Hc N - dipbsf.uninsubria.itdipbsf.uninsubria.it/chimica/File_pdf Analitica/esercizi NMR4.pdf · Gli...
Transcript of Hc N - dipbsf.uninsubria.itdipbsf.uninsubria.it/chimica/File_pdf Analitica/esercizi NMR4.pdf · Gli...
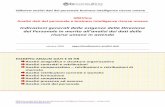
La molecola è la piridina.
N
Hc
Ha
Hb
Ha
HbLo spettro presenta tre segnali dovuti agli H: Ha (2), Hb (2) e Hc (1).
In questa particolare molecola l’effetto elettron attrattore dell’N piridinico è alto nelle posizioni orto e para mentre è basso nella posizione meta che quindi diventa la meno deschermata di conseguenza i segnali vengono assegnati nel seguente modo:
-7.2 ppm Hb
-7.6 ppm Hc (in para sente l’effetto mesomero ma meno quello induttivo.
-8.5 ppm Ha
NH2
COOH
Ha Hb
Hc
La molecola è la fenilalanina.
Lo spettro presenta la zona degli idrogeni aromatici che nel caso di uno spettro allargato potrebbero essere distinguibili fra loro e che in questo caso cadono a 7.3 ppm.
Hc l’idrogeno che è più vicino al gruppo amminoacidico viene notevolmente deschermato e il risultato è un picco a 4.0 ppm e il segnale dovrebbe apparire come un dd.
Ha e Hb sono diastereotopici perché vicini ad un carbonio chirale di conseguenza danno due segnali distinti con J geminale e J vicinale uno cade a 3.3 ppm e l’altro a 3.1 ppm entrambi con un dd.
La molecola è il colesterolo
D H
R
O
E P
Q
Hb
H H
HaHh Hh
Ha = 5.3 ppm è l’idrogeno più deschermato per il doppio legame C=C.
Hb = 3.5 ppm sente l’effetto induttivo dell’ossigeno
Hh = 2.3 ppm spostamento a campi bassi per la vicinanza contemporanea sia dell’ossigeno che del doppio legame C=C.
D = CH3 = 1.0 ppm singoletto del metile
E = CH3 = 0.9 ppm singoletto del metile
P, Q = CH3 = 0.862, 0.867 ppm singoletti dei metili
R = CH3 = 0.7 ppm singoletto del metile
È lo spettro del 13C della piridina
A
BD
B
AN
A, B, C sono carboni
I segnali appaiono tutti nella zona tipica dei doppi legami di tipo aromatico, i segnali appaiono tutti come dei doppietti per l’accoppiamento con il proprio idrogeno, la simmetria della molecola limita il numero dei segnali.
A = 150 ppm sono i due carboni che più di tutti sentono l’influenza deschermante dell’azoto.
D = 136 ppm, come nel caso del protone, il carbonio più deschermato diventa poi quello in posizione para per l’effetto mesomero.
B = 124 ppm C che cadono a campi più alti perché la loro posizione non gli consente di sentire l’influsso dell’azoto né come effetto induttivo che come effetto mesomero.
È lo spettro 13C della fenilalanina
Si osservano i segnali dei tre C fuori dall’anello aromatico e 4 segnali dell’aromatico (2 mancano per simmetria molecolare).
Gli effetti di deschermaggio sono simili al protone solo più intensi, quindi ci si aspetta i segnali a campi alti o bassi come nello spettro del protone:
1 = 174 ppm segnale del C carbossilico.
2 = 136 ppm C dell’anello aromatico sostituito
3, 4 = 130.2 – 130 ppm C orto e meta alla sostituzione
5 = 128 ppm C in para alla sostituzione, il più lontano.
6 = 57 ppm C alchilico ma vicino al carbossile e all’N.
7 = 37 ppm C alchilico
13C del colesterolo
Il riconoscimento della maggior parte dei C alchilici è possibile solo utilizzando tecniche di accoppiamento fra C e H alcuni segnali sono però particolarmente distinguibili 1, 2, 3 gli altri sono complicati da riconoscere e da interpretare.
Consideriamo ora casi di molecole più complesse come le porfirine.
N
Ar
Ar
NH
N
NH
Ar
Ar
Molecole con elevata insaturazione, colorate, con 4 nuclei pirrolici legati fra loro a formare il nucleo tetrapirrolico con doppi legami tutti coniugati, nelle 4 posizioni meso possono trovarsi dei sostituenti come ad esempio gruppi arilici generici, i due H centrali legati agli atomi di N cadono a campi altissimi (ppm negativi) perché al centro nella zona dove il campo magnetico generato dalla coniugazione si sottrae al campo magnetco esterno.
Verranno considerati 4 composti: che permetteranno di evidenziare alcune differenze nei segnali e che possono aiutare a comprendere le elevate potenzailità della tecnica.
N
OMeMeO
MeO
H
NH
N
NH
OMe
OMeMeO
H
N
OMeMeO
MeO
Ar
NH
N
NH
Ar
Ar
Fra questi due composti cambio il livello di sostituzione arilica nelle posizioni meso la prima molecola è altamente simmetrica ma lo è anche la seconda le differenze che si vedranno negli spettri sono significative ai fini della identificazione
Lo spettro è della molecola disostituita.
-3.0 ppm 2 H legati agli N all’interno del nucleo tetrapirrolico
-4.04 ppm sono i due metili in meta, fra loro simmetrici e quindi identici, il chemical shift è tipico di metile su ossigeno.
-4.23 ppm metile in para su ossigeno l’integrazione mette ben evidenza che i due segnali sono in rapporti doppi l’uno con l’altro.
Per quanto riguarda la zona aromatico si osservi lo spettro allargato:
N NH
Ha Hb
Hc
Hb
Hc OMe
OMe
OMe
Hd
Ha = 10.35 ppm singoletto segnale di 2 H identici che non accoppiano con niente e cadono a campi bassi per elevato deschermo della nuvole elettronica.
Hb = 9.435 ppm doppietto segnale di 4 H identici che accoppiano con J vicinale con Hc
Hc = 9.21 ppm doppietto segnale di 4 H identici che accoppiano con J vicinale con Hb
Hd = 7.55 ppm singoletto segnale di 4 H identici che non accoppiano sull’anello aromatico
È lo spettro della tetrasostituita molecola altamente simmetrica in cui scompaiono i segnali dei due idrogeni in meso e i segnali degli idrogeni del pirrolo diventano uno solo.
-2.75 ppm 2 H legati all’N che cadono a campi altissimi (notare che cadono a campi meno alti rispetto ai segnali della disostituita).
3.997 ppm segnale singoletto dei due metili in meta tipico chemical shift di metili su ossigeno.
4.21 ppm segnale singoletto del metile in para, l’intensità è la metà del segnale precedente.
7.50 ppm segnale dei 2 H (x 4) delle posizioni orto dell’anello aromatico.
8.99 ppm segnale unico dei 2 H (x 4) del nucleo pirrolico.
Sin considera quindi i due spettri dei due composti sempre porfirinici di e tetra sostituiti in cui l’anello arilico è costituito da fenili.
N
H
NH
N
NH
H
N
Ph
NH
N
NH
Ph
Ph
L’elevata simmetria della molecola porta ad avere pochi segnali.
-2.73 ppm i 2 H legati all’N interni al nucleo tetrapirrolico altamente schermati.
Nucleo
Ha
HbHb
HcHc
7.8 ppm segnali di Ha e i due Hb (moltiplicati per 4 per i fenili) che danno un multipletto
8.26 ppm dd di Hc che dà due accoppiamenti J orto con Hb e J meta con Ha per la vicinanza col nucleo tetrapirrolico cade a campi più bassi.
8.89 ppm gli idrogeni del pirrolo che danno un unico segnale perché tutti omotopici e quindi non accoppiano fra loro
Spettro della tetrafenile
Spettro della difenile
Anche in questo caso il sistema è simmetrico ma si inseriscono nuovi segnali dovuti alla non sostituzione di tutte le posizioni meso.
-3.08 ppm singoletto dei due H interni al nucleo tetrapirrolico e che cadono a campi più alti dei corrispondenti H della tetrasostituita.
La zona dei fenili e dei pirroli viene allargata:
A 10.35 cadono con un singoletto i due idrogeni in meso a campi molto bassi
Per quanto riguarda l’anello aromatico si ha sempre un multipletto per gli idrogeni in para e meta infatti anche nella integrazione si osserva un segnale intenso dovuto a 3 H (7.84 ppm)
I due H in orto al nucleo tetrapirrolico hanno una integrazione inferiore e cadono a campi più bassi (8.31 ppm per effetto mesomero del nucleo tetrapirrolico.
I 4 H del pirrolo si splittano in due doppietti:
9.11 ppm i due idrogeni più vicini al sostituente aromatico
9.43 ppm i due idrogeni più vicini all’H in posizione meso