Nessun titolo diapositiva · 2017-12-04 · Gli alcoli primari si ossidano ad aldeidi . M nO 4 -...
Transcript of Nessun titolo diapositiva · 2017-12-04 · Gli alcoli primari si ossidano ad aldeidi . M nO 4 -...
Chimica organica Chimica dei composti del carbonio.
Nelle molecole organiche oltre al carbonio sono presenti pochi altri elementi: H, O, N, P, S, alogeni.
Le molecole organiche presentano particolari raggruppamenti di atomi che ne costituiscono il gruppo funzionale, responsabile della reattività della molecola.
Idrocarburi Sono le molecole organiche più semplici,
costituite da C ed H
Alcani e Cicloalcani saturi
Alcheni
Alchini insaturi
Aromatici: Benzene e derivati
Formula bruta
Formula compatta
Formula di struttura
Formula spaziale
C C
C C
C
H
H
H
H
H
H H
H H
H H
H
C C C C C
H H H H H
H H H H H
H H
C H 3 C H 2 C H 2 C H 2 C H 3
C 5 H 1 2
pentano
Nomi di Alcani a catena lineare, Cn H2n+2
1 Metano
2 Etano
3 Propano
4 Butano
5 Pentano
6 Esano
7 Eptano
8 Ottano
9 Nonano
10 Decano
CH4
C2H6
C3H8
C4H10
C5H12
C6H14
C7H16
C8H18
C9H20
C10H22
CH4
CH3CH3
CH3CH2CH3
CH3CH2CH2CH3
CH3(CH2)3CH3
CH3(CH2)4CH3
CH3(CH2)5CH3
CH3(CH2)6CH3
CH3(CH2)7CH3
CH3(CH2)8CH3
Reazioni degli idrocarburi
combustione degli alcani
CH4 + 2 O2 CO2 + 2 H2O
La combustione è una reazione di ossidazione.
Il C passa da numero di ossidazione - 4 a numero
di ossidazione + 4
2CH4 + 3 O2 2CO + 4H2O
In carenza di ossigeno la combustione è
incompleta e porta alla formazione di
monossido di carbonio
Nel CO il carbonio ha numero di ossidazione +2
Gli alcheni danno reazione di addizione
al doppio legame
H 2 +
etene etano
platino C C
H H
H H C H
H
H
C H
H
H
Addizione elettrofila di H2O
C C
H
H H
H
H 2 O C C
H
H
O H
H
H
H
+
etene etanolo
H+
L’addizione di acqua al doppio legame di
un alchene porta alla formazione di
un alcole.
Formula generale di un alcole
R OH
C C O H
H
H
H
H
H
alcole n-propilico
C O H H
H
H
metanolo
alcole metilico
etanolo
alcole etilico
1-propanolo 2-propanolo alcole isopropilico
C C O H
H
H
H
H
C
H
H
H
1 3 2 C C
O H
H
H
H
H
C
H
H
H
1 3 2
C C O H
H
H
H
H
alcole primario
C
H
H
H
C C
O H
H
H
H
H
C
H
H
H
CH3
CH2
CH3 H3C
O H
C
alcole terziario
alcole secondario
disidratazione
intra molecolare
propene propanolo
C H 3 C C H
H O H
H H
C H 3 C C
H
H H
( H + )
H 2 O
di etil etere etanolo
disidratazione
inter molecolare
C H 3 C H 2 O H
C H 3 C H 2 O H
C H 3 C H 2
O C H 3 C H 2
( H + )
H 2 O
Reazioni degli alcoli
O H
H H
C H H
H
C H
H
H
H O C r 2 O 7
2- ( H + )
C r + + +
etanolo etanale
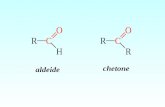
Gli alcoli primari si ossidano ad aldeidi
M n O 4 -
( H + )
M n + +
C H 3
C H 3
H O H O
H 3 C
H 3 C
2-propanolo propanone
Gli alcoli secondari si ossidano a chetoni
CR H
H
H
+1
+1 +1
+1- 4
CR OH
H
H
+1
+1
+1
+1-2
- 2
CR
H
O-2
+1
+10
CR
OH
O+1
-2
-2 +1+2
alcano 1° alcol 1° acido aldeide
CH H
R
R
+1
+1 +1
+1- 4
CH OH
R
R
+1
+1
+1
+1-2
- 2
CR
R
O-2
+1
+10
alcano 2° alcol 2° chetone
CR H
R
R
+1
+1 +1
+1- 4
CR OH
R
R
+1
+1
+1
+1-2
- 2
alcano 3° alcol 3°
ox ox ox
ox ox
ox
Stati di ossidazione del carbonio nei diversi gruppo funzionali
C O
H
H3C
propanale (aldeide propionica)
etanale (aldeide acetica)
C O
H
H
metanale (aldeide formica)
C O
H
H3C C H2 C
O
CH3
H3C
propanone (acetone)
R
H C O
R
H C O
R
H C O d+ d-
L’atomo di ossigeno del gruppo carbonilico
attira su di sé gli elettroni del legame p
a causa della sua maggiore elettronegatività
Il gruppo carbonilico dà reazioni di addizione nucleofila
R
H C O d+ d-
Nu H
R
H C OH
Nu
Il carbonio del gruppo carbonilico è elettrofilo e può
reagire con un nucleofilo, cioè con una specie
chimica in grado di fornire un doppietto elettronico
Reazione con alcoli: formazione di
emiacetali e acetali
La reattività del carbonio carbonilico consente la
formazione di un legame con l’atomo di ossigeno di un
alcole per portare alla formazione degli emiacetali
R C
H
OH
OR’ H+
R C H
O
+ R’OH
emiacetale
Reazione con alcoli: formazione di
emiacetali e acetali
L’ emiacetale reagisce con una seconda molecola
di alcole per formare un acetale
+ R’OH H+
R C
H
OR’
OR’ R C
H
OH
OR’
H2O
chiralità
chirós = mano
immagini speculari non sovrapponibili
2 diversi composti
C
CHO
HO H
CH2OH
C
CHO
H OH
CH2OH
D-gliceraldeide L-gliceraldeide
D-glucosio aldosoesoso
D-fruttosio chetosoesoso
H OH
H OH
H HO
CH2OH
C O
CH2OH
H OH
H OH
H HO
H OH
CH2OH
O C
H
Il gruppo funzionale carbonilico e quello alcolico sono presenti negli zuccheri
D-ribosio D-glucosio D-galattosio D-mannosio D-gliceraldeide
C
CH 2 O H
O H H
C O H
C O H H
C
C
C
O H H
CH 2 O H
O H H
H O C O H H
C
C
C
H HO
C
O H H
CH 2 O H
O H H
H O
C O H H
C
C
C
H HO
C
H HO
CH 2 O H
O H H
H O
C H HO
C
C
C
H HO
C
O H H
CH 2 O H
O H H
H O
1
D-fruttosio
C
C
C
H HO
C
O H H
CH 2 O H
O H H
CH 2 O H
O
1
1 1 1
1
Il glucosio è presente in forme cicliche che originano dalla reazione fra il gruppo alcolico legato al C 5 e la funzione aldeidica. Le forme cicliche sono
forme emiacetaliche
Proiezioni di Haworth
1
2 3
4
5
6
C H
O H
O H
H
H
O
H
CH 2 O H
O H O
H H
b-D-glucosio 1
O O H
H H
O H
O H
H
H
O
H
CH 2 O H
H
a-D-glucosio 1
O H
O H H
O H
O H
H
H
O
H
CH 2 O H
H
forme emiacetaliche del fruttosio
1
2
3 4
5
6 HOH 2
C HO
H
H
O H
C
H
O
CH 2 O H
O H
b-D-fruttosio 2
O O H
CH 2 O H O
H
H
O H
C
H
HOH 2
H
a-D-fruttosio 2
O CH 2 O H
O H O
H
H
O H
C
H
HOH 2
H
b-D-ribosio a-D-ribosio 2-deossi b-D-ribosio
O H
O H H
O H
H
O H
C
H
HOH 2 O O H
H H
O H
H
O H
C
H
HOH 2 O O H
H H
H
H
O H
C
H
HOH 2
1
2
1 1 4 4 4
Il ribosio è un aldopentoso
acido gluconico
forma ciclica (gluconolattone)
acido
glucuronico
forma ciclica
1
C O H H
CO O H
C
C
H HO
C
O H H
CH 2 O H
O H H
6
C O H H
C
C
C
H HO
C
O H H
CO O H
O H H
O H
O
H
O H
O H
H
H
O
H
CH 2 O H
O
H
O H
O H H
O H
O H
H
H
O
H
CO O H
H
forma aperta forma aperta
Prodotti di ossidazione degli zuccheri
1 1 4 4
O H
H
O H
O H
H
H
O
H
CH 2 O H
OH H
O H
O H H
O H
O H
H
H H
CH 2 O H
il MALTOSIO è un disaccaride costituito da due molecole di glucosio
HO
maltosio
1 1 4 4
O H
H
O H
O H
H
H
O
H
CH 2 O H
O H
O H
O H H
O H
O H
H
H H
CH 2 O H
il MALTOSIO è un disaccaride costituito da due molecole di glucosio legate con
legame a-1,4-glicosidico
lattosio
1
1
4
4 O
H H
O H
O H
H
O
H
H
CH 2 O H
O
O H
O H H
O H
O H
H
H H
CH 2 O H
H
il LATTOSIO è un disaccaride costituito da una molecola di galattosio legata a una molecola di glucosio con
legame b-1,4-glicosidico
saccarosio
1
2
O
CH 2 O H O
H
H
O H
C
H
O
HOH 2
H
O H
H
O H
O H
H
H
O
H
CH 2 O H
H
il SACCAROSIO è un disaccaride costituito da una molecola di glucosio legata a
una molecola di fruttosio con
legame 1,2-diglicosidico
Amido e glicogeno sono polimeri costiuiti da molte unità di glucosio legate con
legame a-1,4-glicosidico. Amido e glicogeno presentano
ramificazioni, dovute alla formazione di legami a-1,6-glicosidici.
Nel glicogeno le ramificazioni sono maggiormente frequenti rispetto all’amido.
L’amido è il polisaccaride di riserva dei vegetali, il glicogeno degli animali.
legami a-1,4-glicosidici
legame a-1,6-glicosidico
legami a-1,4-glicosidici
O H
O H
H
C H 2 O H
H
H
H
O H
O O
O H
O H
H
C H 2 O H
H
H
H
O H
O
O H
O H
H H
H
H
O H
O
C H 2
O
O H
O H
H
C H 2 O H
H
H
H
O H
O
O H
O H
H
C H 2 O H
H
H
H
O H
O
O H
O H
H
C H 2 O H
H
H
H
O H
O 1 4 1
6
1 4 1 4 1 4 1 4
4
O
O H
O H
H
C H 2 O H
H
H
H
O H
OH
estremità riducente
O H
O H
H
C H 2 O H
H
H
H
O H
O HO
estremità non riducente
1 4
legami a-1,6-glicosidici
legami a-1,4-glicosidici 1 4
legami b-1,4-glicosidici
O
H O H
H
C H 2 O H
H
H
H
O H
O
O
O
H O H
H
C H 2 O H
H
H
H
O H
O
O
H O H
H H
H
H
O H
C H 2
O
O H
O H
H
C H 2 O H
H
H
H
O H
O
1
1
1
1
4
4
4
4
La cellulosa è una molecola lineare formata da molecole di D-
glucosio (300-3000) legate attraverso legami b-1,4-glicosidici
acido ialuronico
n
-
condroitin 4-solfato
n
-
eparina
n
- -
- -
O
H H
O H
O H
H
H H
CO O
O
O
H
NCO CH 3 H
H
O
H
CH 2 O H
H O
H
H
acido glucuronico
N-acetil glucosammina
O
H H
O H
O H
H
H H
CO O H
CH 2 O H
H
H
H NCO CH 3
H
O
O H
acido glucuronico
N-acetil galattosammina-4-solfato
acido glucuronico-
2-solfato
O
H
O S O 3
O H
H
H H
CO O
H
O
O
H
NS O 3 H
H H
CH 2 O S O 3
O H
H
H
N-solfo
glucosammina-6-
solfato
O -
O3SO
O b1,3
b1,4
O
O O
b1,3
b1,4
a1,4 a1,4
R COOH
gruppo funzionale carbossilico
R OH
O C
sp2
Gli acidi carbossilici sono prodotti di ossidazione delle aldeidi
R H
O C R
OH C
O ox
+2 0
R CH2OH
R
H
O
C
R
O
C
OH
ossidazione
riduzione
riduzione ossidazione
alcol
acido
aldeide
+4
-2
0
+2 CO2
ox
Acidi grassi saturi
CH3(CH2)nC O
OH
ac. palmitico (n=14) 16C
ac. stearico (n=16) 18C
Gli acidi grassi sono acidi
carbossilici a lunga catena
Tab. 13.1 - Formula e denominazione di alcuni fra i più importanti acidi grassi
20:4 (6) CH3(CH2)4CH=CHCH2CH=CHCH2CH=CHCH2CH=CH
(CH2)3COOH
arachidonico
18:3 (3) CH3CH2CH=CHCH2CH=CHCH2CH=CH(CH2)7COOH linolenico
18:2 (6) CH3(CH2)4CH=CHCH2CH=CH(CH2)7COOH linoleico
18:1 (9) CH3(CH2)7CH=CH(CH2)7COOH oleico
18:0 CH3(CH2)16COOH stearico
16:0 CH3(CH2)14COOH palmitico
Sigla Struttura Acido grasso
acido stearico
acido oleico
COOH
C C C C C C C C C C C C C C C C COOHC
H
H
H
H
H
H
H
H
H
H
H
H
H
H
H
H
H
H
H
H
H
H H
H
H
H H
H
H
H
H
H H
H
H
H
CO O H
H
H 3 C C
O
O H H O C H 3
H 3 C C
O
O C H 3
H 2 O
OR’
O
C R esteri
Gli esteri sono derivati degli acidi carbossilici che si ottengono per reazione fra un acido carbossilico e un alcol.
acido acetico alcol metilico
acetato di metile
H 2 O 3 +
+
+ R 2 C
O
O H
H 2 C
HO H C
O H H 2 C
O H
C HO R 1
O
C HO R 3
O 2
O H 2 C C R 1
O
O H C C R
O
H 2 C O C
O
R 3
I glicerolipidi sono esteri del glicerolo
con acidi grassi (acidi carbossilici
saturi o insaturi, a 14-24 atomi di carbonio)
TRIGLICERIDI
fosfatidiletanolammina
O H 2 C C
O
R 1
O H C C
O
R 2
O - H 2 C O P
O
O CH 2 CH 2 NH 2
fosfatidilserina
O H 2 C C
O
R 1
O H C C
O
R 2 +
H -
H 2 C O P
O
O
O CH 2 C
NH3
COO-
fosfatidilcolina
O H 2 C C
O
R 1
+
- H 2 C O P
O
O
O CH 2 CH 2 N( CH 3 ) 3
O H C C
O
R 2
I glicerofosfolipidi presentano acidi grassi esterificati nelle posizioni 1 e 2
del glicerolo mentre nella posizione 3 è esterificata una molecola di acido
ortofosforico che a sua volta esterifica colina o etanolammina o serina….
sfingomielina
sfingosina acido grasso
+
-
CH 2
O
C
C
H NH
C
O H H
C
H
H
C
P
O
O O
O
CH 2 CH 2 N CH 3
CH 3
CH 3
fosfocolina
galattocerebroside
O C
H
H
C
H O H
C
NH H
C
C
CH 2
O O
H H
O H
O H
H
O
H
H
CH 2 O H
H
galattosio Sfingolipidi
Dipalmitoil fosfatidilcolina (lecitina)
Comincia la sintesi dalla 28° settimana
(pmeumociti di tipo II)
COMPONENTE ESSENZIALE E PIU’
ABBONDANTEDEL
SURFATTANTE POLMONARE
-
+ H 2 C
O H C
O H 2 C
O
C
C
O
O (CH2)14CH3
P
O
O
O CH 2 CH 2 N( CH 3 ) 3
CH3(CH2)14
- +
CH 2
O
C
C
H NH
C
O H H
C
H
H
C
P
O
O O
O
CH 2 CH 2 N CH 3
CH 3
CH 3
Sfingomielina
Sintesi fino alla 28° settimana
Respiratory Distress Syndrome (RDS)
Responsabile del 15-20% delle morti neonatali
(bambini nati prematuramente)
Deficit di surfattante polmonare
Immaturità polmonare
Diagnosi
Nel neonato normale a termine il rapporto
Lecitina/Sfingomielina (L/S)=2 (già a 34 settimane)
Valori inferiori nel liquido amniotico sono predittivi di
RDS
testa polare porz
ione idro
fobic
a
I fosfolipidi sono composti amfipatici per la presenza delle due catene idrofobiche degli acidi grassi e di una testa polare corrispondente al fosfato legato con colina, etanolammina, etc… In acqua si organizzano in doppi strati.
testa polare
porz
ione idro
fobic
a
+ HO
colesterolo acido grasso
estere di colesterolo
1 2
3 4
5 6 7
8 9
10
11 13 12
14 15
16 17
19
18 20
21 22
23
24
25
26
27
R C
O
O H
gruppo funzionale amminico
CH3 N H2
metanammina
CH3 CH2 N H2
etanammina
R N H2
R N
H
H R N
R
H R N
R
R
ammina primaria
ammina secondaria
ammina terziaria
Le ammine, come l’ammoniaca, hanno carattere basico ed in soluzione acquosa accettano un protone dall’acqua.
R NH2 + H2O R NH3+ + OH-
Il gruppo funzionale amminico è presente negli amminoacidi.
derivati degli acidi carbossilici: ammidi
NH2
O
C R
N
O
C R R
H
O
C R
N R
R
Il gruppo funzionale ammidico è presente nelle proteine, polimeri degli amminoacidi.
gli amminoacidi che si ottengono dall'idrolisi delle proteine sono tutti a-amminoacidi ed appartengono alla serie sterica L. (Fa eccezione la glicina
he non ha atomi di carbonio asimmetrici).
COO-
C H
R
H3N +
Allo stato cristallino gli amminoacidi si trovano
nella forma zwitterionica (ioni dipolari)
a
Gli amminoacidi delle proteine differiscono per il gruppo R, che può essere apolare polare non dissociabile dissociabile carico negativamente dissociabile carico positivamente aromatico
Gruppi R apolari
glicina (G)
(Gly)
C H H 3 N
CO O
H
- +
alanina (A)
(Ala)
valina (V)
(Val)
isoleucina (I)
(Ile)
leucina (L)
(Leu)
metionina (M)
(Met)
fenilalanina (F)
(Phe)
- +
C H H 3 N
CO O
CH 2
triptofano (W)
(Trp)
- +
C H H 3 N
CO O
CH 2
NH
- +
C H H 3 N
CO O
CH 3
- +
C H H 3 N
CO O
CH H 3 C CH 3
- +
C H H 3 N
CO O
CH 2
CH H 3 C CH 3
3
- +
C H H 3 N
CO O
C
CH 2
H H 3 C
CH
prolina (P)
(Pro)
-
+ CO O
C H 2 N
H 2 C CH 2
CH 2
H
- +
C H H 3 N
CO O
CH 2
CH 2
S
CH 3
serina (S)
(Ser)
treonina (T)
(Thr)
-
cisteina (C)
(Cys)
-
tirosina (Y)
(Tyr)
-
C H H 3 N
CO O
CH 2
O H
+
asparagina (N)
(Asn)
C H H 3 N
CO O
CH 2
C H 2 N O
- +
glutammina (Q)
(Gln)
C H H 3 N
CO O
CH 2
CH 2
C H 2 N O
- +
C H H 3 N
CO O
CH 2
HN
N
+
-
istidina (H)
(His)
C H H 3 N
CO O
CH 2
CH 2
CH 2
NH
C H 2 N NH 2
+
-
arginina (R)
(Arg)
lisina (K)
(Lys)
Gruppi R polari non dissociabili
Gruppi R acidi Gruppi R basici
aspartato (D)
(Asp)
glutammato (E)
(Glu)
- +
C H H 3 N
CO O
CH 2
O H
+ C H H 3 N
CO O
C
CH 3
O H H
+ C H H 3 N
CO O
CH 2
S H
+
-
-
C H H 3 N
CO O
CH 2
CH 2
CO O
+
-
-
C H H 3 N
CO O
CH 2
CO O
+ -
C H H 3 N
CO O
CH 2
CH 2
CH 2
CH 2
NH 3 + +
C H H 3 N
CO O
CH 2
S
S
CH 2
CO O
H NH 3 C
C H H 3 N
CO O
CH 2
S H
C NH 3 H
CO O
CH 2
S H
2H+ + 2e-
2H+ + 2e-
- +
+
+
+
- -
-
cisteina
cisteina
cistina