Cervelletto, nuclei della base, controllo della postura, sistema ventricolare
“Funzioni emotive e benessere psicologico nei pazienti con ... · L’ipotesi del coinvolgimento...
Transcript of “Funzioni emotive e benessere psicologico nei pazienti con ... · L’ipotesi del coinvolgimento...
1
UNIVERSITÀ DI PISA
FACOLTÀ DI MEDICINA E CHIRURGIA
CORSO DI LAUREA MAGISTRALE IN PSICOLOGIA
CLINICA E DELLA SALUTE
“Funzioni emotive e benessere psicologico nei pazienti con danno
cerebellare”
RELATORE
Dott. Francesco Tramonti
CANDIDATO
Chiara Licastro
ANNO ACCADEMICO 2010/2011
2
Sommario Riassunto ............................................................................................................................. 4
Introduzione ........................................................................................................................ 5
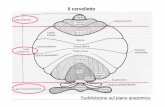
1. IL CERVELLETTO ............................................................................................................... 8
1.1 Descrizione macroscopica e generalità ..................................................................... 8
1.2 Struttura del cervelletto .......................................................................................... 11
1.3 Fisiologia della corteccia cerebellare ...................................................................... 14
1.4 Anatomia funzionale ............................................................................................... 15
1.5 Topografia funzionale del cervelletto ..................................................................... 16
1.6 Connessioni cortico-cerebellari .............................................................................. 23
1.7 Cervelletto e Disturbi Psichiatrici ............................................................................ 31
Cervelletto e Schizofrenia ......................................................................................... 32
Cervelletto e Disturbo Bipolare ................................................................................ 35
Cervelletto e Depressione ......................................................................................... 37
Cervelletto e Disturbi d’ansia .................................................................................... 38
Cervelletto, invecchiamento e patologie degenerative ............................................ 40
Cervelletto e Deficit di Attenzione e Iperattività ...................................................... 44
Cervelletto e Disturbi dello Spettro Autistico ........................................................... 45
Cervelletto e percezione del dolore .......................................................................... 46
Cervelletto e linguaggio ............................................................................................ 47
2. Sindrome Cerebellare Cognitiva Affettiva .................................................................... 48
3. Elaborazione emotiva ................................................................................................... 54
3.1 Modelli neurali delle emozioni ............................................................................... 55
3.2 Contributi cerebellari ai meccanismi neuronali delle emozioni ............................. 59
3.3 Cervelletto e elaborazione emotiva ........................................................................ 62
4. Riconoscimento delle emozioni .................................................................................... 67
4.1 L’empatia ................................................................................................................ 67
L'approccio affettivo ................................................................................................. 68
L'approccio cognitivo ................................................................................................ 69
4.2 Substrati anatomici dell’empatia ............................................................................ 71
4.3 Empatia e cervelletto .............................................................................................. 76
4.5 Espressioni facciali delle emozioni: da Darwin a Ekman ......................................... 79
4.6 Meccanimi neurali delle espressioni facciali delle emozioni ................................. 83
3
5. La ricerca ....................................................................................................................... 87
5.1 Obiettivo dello studio ............................................................................................. 87
5.2 Partecipanti ............................................................................................................. 87
Gruppo sperimentale ................................................................................................ 87
Gruppo di controllo ................................................................................................... 91
5.3 Strumenti ................................................................................................................ 93
Ansia, depressione e benessere psicologico ................................................................. 93
Profile of Mood States .............................................................................................. 93
Psychological Well-Being Scale ................................................................................. 94
Hospital Anxiety and Depression Scale ..................................................................... 95
Empatia e riconoscimento delle emozioni .................................................................... 96
Quoziente di empatia (EQ) ........................................................................................ 96
Faces Test .................................................................................................................. 97
Reading the Mind in the Eyes (RME) ........................................................................ 98
5.4 Analisi statistica....................................................................................................... 99
5.5 Risultati ................................................................................................................... 99
Empatia e riconoscimento emotivo .............................................................................. 99
Ansia, depressione e benessere psicologico ............................................................... 100
5.6 Discussione ............................................................................................................ 101
Limiti dello studio .................................................................................................... 102
5.7 Conclusioni ............................................................................................................ 103
Bibliografia ...................................................................................................................... 104
Ringraziamenti ................................................................................................................ 139
4
Riassunto
I pazienti con danni al cervelletto presentano tipicamente la sindrome
cerebellare motoria caratterizzata da dismetria, disartria e atassia ma, come è
stato recentemente verificato, le lesioni cerebellari possono anche comportare
deficit delle funzioni superiori. Queste osservazioni hanno portato numerosi
studiosi a ipotizzare un ruolo del cervelletto nelle funzioni cognitive ed emotive
in aggiunta a quello tradizionalmente riconosciuto nel controllo motorio.
L’ipotesi del coinvolgimento del cervelletto nelle funzioni superiori è resa
plausibile dall’abbondanza di connessioni cortico-cerebellari ed è confermata da
una mole di studi sempre più ampia. Sulla base di questi presupposti, il presente
lavoro ha l’obiettivo di verificare, tramite l’utilizzo di test psicometrici, se la
presenza di lesioni cerebellari possa influire sulle capacità di riconoscimento ed
elaborazione delle emozioni, sulle sue capacità empatiche, nonché sul suo
benessere psicologico.
La prima parte del lavoro è dedicata alla revisione critica della letteratura sul
coinvolgimento del cervelletto nel riconoscimento e nell’elaborazione delle
emozioni, nelle capacità empatiche e nelle manifestazioni psicopatologiche.
Nella seconda parte, invece, viene descritto un lavoro di ricerca effettuato su un
campione di 8 pazienti con lesioni cerebellari, reclutati presso l’U.O. di
Neuroriabilitazione dell’Azienda Ospedaliero Universitaria Pisana, a cui è stato
appaiato un gruppo di controllo. I soggetti sono stati invitati a compilare tre test
che valutano la sintomatologia ansiosa e depressiva (HADS) gli stati emotivi
(POMS), e il benessere psicologico (PWB) e tre test atti, invece, a valutare le
capacità empatiche e di riconoscimento emotivo (Reading the Mind in the Eyes,
RME; Faces Test e Empathy Quotient, EQ).
Le medie dei punteggi ottenuti dal gruppo sperimentale sono state poi
confrontate con quelle ottenute dal gruppo di controllo per stimare le eventuali
differenze. Dall’analisi statistica sono emerse alcune differenze significative tra i
due gruppi a conferma dell’ipotesi che il cervelletto abbia un ruolo nelle funzioni
emotive. Il danno cerebellare, infatti, sembra associarsi a minore capacità di
riconoscimento delle emozioni altrui e a maggior rischio di sintomatologia
depressiva, nonché a ridotto benessere psicologico.
5
Introduzione
Per molti anni, sono state attribuite al cervelletto esclusivamente le funzioni
relative al movimento, all'andatura, alla postura e all'equilibrio. Tuttavia,
nell’ultimo trentennio, alcuni studi hanno suggerito un possibile coinvolgimento
del cervelletto nelle funzioni cognitive, emotive e nell'elaborazione delle risposte
comportamentali (Andreasen & Pierson, 2008; Grill et al., 2004; Hallet &
Grafman, 2006; Hokkanen et al. 2006; Schmahmann et al., 2007; Timmann et al.,
2003; Schmahmann, 2004; Ribas, 2007). Secondo queste nuove ipotesi, il
cervelletto eserciterebbe una funzione di regolamentazione che sembrerebbe
valorizzare e integrare le altre funzioni cerebrali, mediante circuiti diretti e
indiretti con le altre strutture cerebrali (Andreasen et al., 2008; Ribas et al.,
2007; Schmahmann et al., 2007). Inoltre, diversi contributi clinici e di ricerca
suggeriscono che il cervelletto possa essere alterato in molti disturbi psichiatrici,
tra cui la schizofrenia, il disturbo bipolare, la depressione unipolare, i disturbi
d’ansia e la sindrome da deficit di attenzione e iperattività (Schmahmann et al.
2007; Bugalho et al., 2006). Studi clinici contemporanei suggeriscono una
divisione topografica del cervelletto secondo cui il lobo anteriore del cervelletto
è impegnato principalmente nelle controllo motorio, il verme cerebellare è
coinvolto nell’elaborazione emotiva e il cervelletto posteriore contribuisce alla
operazioni cognitive più complesse (Exner et al., 2004; Levisohn et al., 2000;
Schmahmann, 2004, 2007; Schmahmann & Sherman, 1998; Schoch et al., 2006;
Tavano et al., 2007).
In particolare, Schmahmann e Sherman (1998) hanno dimostranto che esiste un
modello di comportamento anomalo definito “sindrome cerebellare cognitivo
affettiva”, che include deficit delle funzioni esecutive (pianificazione, set-shifting,
ragionamento astratto, fluenza verbale, memoria di lavoro), spesso con
perseverazione, distrazione o disattenzione, disorganizzazione visuo-spaziale e
compromissione della memoria visuo-spaziale; cambiamenti di personalità con
ottundimento affettivo, comportamento disinibito e inappropriato, difficoltà
nella produzione linguistica, compresi disprosodia, agrammatismo e anomia
mite. L'effetto netto di questi disturbi delle funzioni cognitive sembra essere
6
dovuto a un abbassamento generale delle funzioni intellettuali dovuto ai danni
cerebellari.
Qualche anno fa, Damasio et al. (2000), indagando attraverso imaging funzionale
il ruolo che il cervelletto assume nei processi di riconoscimento e elaborazione
emotiva, hanno riportato una marcata attivazione della linea mediana del
cervelletto durante il richiamo mentale emotivo di episodi personali,
concludendo che "anche se il cervelletto non è stato incluso nella ipotesi, le
componenti evolutivamente più antiche del cervelletto probabilmente sono
coinvolte nel coordinamento delle risposte emotive e nella regolazione di quelle
risposte apprese in un contesto sociale".
Inoltre, studi effettuati mediante imaging funzionale hanno evidenziato, durante
compiti di social cognition, non solo l’attivazione delle aree ventrali e dorso
mediali della corteccia prefrontale, dell’amigdala e del solco temporo-parietale
ma anche del cervelletto e in particolare delle regioni neocerebellari (Brune &
Brune-Chors, 2006).
Per chiarire il ruolo del cervelletto in tali funzioni, Gerschovich et al., in uno
studio del 2011, hanno esibito il caso di un paziente con lesioni dovute a infarto
che interessavano il verme posteriore e le regioni mediali e posteriori di
entrambi gli emisferi cerebellari. Poiché questo paziente aveva sviluppato gravi
deficit delle capacità empatiche e nella teoria della mente, gli autori hanno
indagato tali funzioni e hanno evidenziato che il paziente mostrava pronunciate
difficoltà nell’identificazione e nel riconoscimento delle emozioni altrui, oltre che
nella comprensione del linguaggio implicito e nell’interpretazione delle
situazioni sociali. Dunque, sembrerebbe che un danno cerebellare così esteso
possa implicare la compromissione di numerosi circuiti cerebrali e cerebellari,
come quelli che collegano le aree mediali e posteriori del cervelletto alla
corteccia associativa prefrontale, parietale e temporale, alle corteccie
paralimbiche (per esempio, l’insula e il cingolo anteriore), ai nuclei autonomico e
reticolare e alle regioni limbiche (per esempio, l’amigdala, e l’ippocampo). Questi
circuiti sembrerebbero processare le informazioni relative a molte richieste
cognitive, comportamentali ed emotive, inclusi i processi decisionali, l’empatia e
la teoria della mente.
7
La maggior parte delle informazioni ricavate dalla revisione della letteratura
internazionale supportano l’ipotesi che il cervelletto possa avere un ruolo
all’interno dei circuiti neurali implicati nei processi cognitivi ed emotivi. Per
questa ragione è importante indagare gli aspetti psicologici rilevati nei pazienti
cerebellari al fine di chiarire il ruolo che il cervelletto assume nei disturbi
psicopatologici ed emotivi e di migliorare gli interventi neuroriabilitativi tenedo
conto anche di questi aspetti.
8
1. IL CERVELLETTO
1.1 Descrizione macroscopica e generalità
Il cervelletto si trova al di sotto
dell’encefalo. Nonostante esso
appaia molto piccolo se
confrontato con le grandi
dimensioni del cervello, in realtà
contiene tanti neuroni quanti ne
sono contenuti nei due emisferi
cerebrali messi insieme (Bear,
Connors, Paradiso, 2002). Esso
occupa la fossa cranica
posteriore, e si colloca inferiormente ai lobi occipitali degli emisferi cerebrali dai
quali è separato per mezzo del tentorio del cervelletto, dorsalmente al tronco
encefalico al quale è collegato per mezzo dei tre peduncoli cerebellari: quelli
superiori sono due fasci paralleli che dal cervelletto si dirigono in alto e in avanti
verso la lamina quadrigemina del mesencefalo; i peduncoli cerebellari medi sono
due fasci più voluminosi e situati più lateralmente rispetto ai precedenti, che
portandosi avanti, in dentro e in alto, si protraggono con il ponte; i peduncoli
cerebellari inferiori, infine, si incurvano in avanti e raggiungono il midollo
allungato (Castano et Donato, 2006).
Il cervelletto ha forma
ellissoidale, simile a un
cavolfiore, a maggior asse
trasversale e schiacciato sull’asse
verticale nel quale vengono
riconosciute due facce convesse,
quella superiore e quella inferiore,
e una faccia anteriore
corrispondente all’ilo con il quale
ha luogo la connessione del
9
cervelletto con gli altri organi encefalici. Sulla linea mediana della faccia superiore è
presente un rilievo che prende il nome di verme superiore il quale è in continuità
con una modesta sporgenza che prende il nome di verme inferiore presente nel
fondo della scissura mediana che divide la faccia inferiore. Il verme divide le due
masse cerebellari che costituiscono gli emisferi cerebellari (Castano & Donato,
2006; Chiarugi & Bucciante, 1972).
La superficie del cervelletto è solcata da fessure trasversali che sono
progressivamente più lunghe dalla fessura precentrale alla fessura orizzontale,
che è la più lunga, poi sulla faccia inferiore decrescono sino alla fessura
posterolaterale. Per evitare ripetizioni, ciascuna fessura divide sia una porzione
del verme dalla successiva che la corrispondente ala abbinata al verme dalla
successiva: le più profonde lo suddividono in tre lobi, mentre altre, meno
profonde, lo suddividono in lobuli: il lobo anteriore, costituito dal I lobulo fino al
V di Larsell , è separato dal lobo posteriore della fessura primaria, mentre il lobo
posteriore, costituito dal VI lobuli fino al IX di Larsell, è separato dalla parte
posteriore del lobo flocculonodulare (lobulo X di Larsell) da parte della fessura
postero-laterale (Stoonley, Shumamman, 2010); altre fessure più superficiali lo
suddividono in “lamine”, altre, ancora meno profonde ma molto numerose,
creano, sulle superfici delle lamine, delle pieghe che prendono il nome di lamelle
cerebellari, porzioni di corteccia allungata e ripiegata su se stessa sostenuta,
all’interno, da sostanza bianca (Castano & Donato, 2006; Chiarugi & Bucciante,
1972).
La divisione della massa cerebellare in tre soli lobi risale a Larsell (1972). Egli
introdusse un semplice sistema di numeri romani da I a X per i lobuli del verme e
indicava i loro corrispettivi emisferici con il prefisso H. I lobuli del verme sono
10
otto, quattro appartengono al verme inferiore e quattro a quello superiore. In
quest’ultimo si considerano (dall’avanti all’indietro): la lingula, il lobulo centrale,
il monticulus, diviso in culmen e declive, il folium vermis. Nel verme inferiore è
presente il tuber vermis, il pyramis, l’uvula e, infine, il nodulo. I lobuli degli
emisferi sono, nella faccia superiore: il vinculum lingualae cerebelli, l’ala lobuli
centralis, il lobulus quadrangularis, diviso in anteriore e posteriore, il lobulus
semilunaris superior. Nella faccia inferiore si hanno: il lobulus semilunaris
inferior, il lobulus gracidis, il lobulus biventer e la tonsilla cerebelli
(Nieuwenhuys et al. 2009). Larsell divideva il lobo anteriore in: lingula, lobulo
centrale, culmen del monticolo e lobilo quadrangolare anteriore degli emisferi. Il
lobo posteriore invece risultava diviso dalle seguenti parti: il lobulo simplex, il
lobulo mediano e una porzione emisferica da ciascun lato fra il lobulo simplex e
la fessura posterolaterale. Ciascuna porzione emisferica del lobo posteriore
risulta dal lobulo ansiforme, formato da un crus I (lobulo semilunare superiore)
e da un crus II (lobulo semilunare inferiore), del lobulo paramediano, del lobulo
biventre (paraflocculo dorsale), della tonsilla (paraflocculo ventrale) e del
paraflocculo. Il lobulo flocculo-nodulare comprende il flocculo, il nodulo e il velo
midollare interposto (Chiarugi & Bucciante, 1972).
Oggi il cervelletto viene sempre suddiviso i tre lobi: il lobo anteriore a cui
appartengono la Lingula, il Lobulo Centrale e il Culmen, il lobo posteriore a cui
appartengono il lobulo semplice, il Folium Vermis, il Tuber, il Pyramidis e
l’Uvula, e il lobo flocculo-nodulare a cui appartiene il nodulo (Standring, 2008).
Filogeneticamente la corteccia cerebellare è suddivisa in archicerebello, la parte più
antica del cervelletto rappresentato dal lobo flocculonodulare, formato dal nodulo
11
del verme e dal flocculo nell’emisfero di ciascun lato, paleocerebello costituito dal
lobo anteriore (dalla corteccia del verme), delimitato posteriormente della fessura
primaria e contenente la piramide e l’uvula, e, infine, neocerebello formato dagli
emisferi cerebellari e comprendente le tonsille, caratteristiche sporgenze del lobo
posteriore situate sopra del grande foro occipitale. L’archicerebello si collega con le
vie e i nuclei vestibolari, il paleocrebello è collegato con il midollo spinale e il
neocerebello, attraverso il talamo, alla corteccia cerebrale. Mediante tali connessioni
con il cervello e con le altre formazioni nervose il cervelletto regola numerose
attività nervose dell’organismo, dal movimento alle più complesse funzioni
cognitive (Castano & Donato, 2006; Chiarugi & Bucciante, 1972).
1.2 Struttura del cervelletto
La superficie del cervelletto, detta corteccia, è costituita da sostanza grigia
stratificata mentre, internamente, il centro midollare è costituito da sostanza
bianca nel quale sono immersi i nuclei propri del cervelletto (Castano et Donato,
2006).
Questi ultimi sono delle formazioni pari e simmetriche: il nucleo del tetto, in
rapporto con l’archicerebello, il nucleo interposto, formato dal nucleo globoso e
dal nucleo emboliforme, che è in rapporto con il paleocerebello, e, infine, quello
più sviluppato rispetto agli altri, il nucleo dentato in rapporto con il
neocerebello. I nuclei emettono degli impulsi attraverso i loro neuriti che
12
costituiscono le vie di uscita del cervelletto che sono dirette al talamo e da qui
alla corteccia premotoria e motoria costituendo la via cerebello-talamo-corticale.
Attraverso questa via, e mediante la via cerebello-rubro-talamo-cortcale, simile
alla prima ma con una stazione aggiunta al nucleo rosso, il cervelletto manda al
telencefalo tutte le informazioni propricettive utili all’esecuzione di un
determinato movimento. Inoltre, il cervelletto ha anche un ruolo
nell’apprendimento motorio e nella programmazione del movimento grazie ai
collegamenti, per il tramite del complesso olivare inferiore, con la corteccia
cerebrale (via cortico-ponto-cerebellare) (Castano & Donato, 2006; Chiarugi &
Bucciante, 1972).
I neuroni dei nuclei propri del cervelletto, invece, ricevono i neuriti delle cellule
del Purkinjie e collaterali dalle fibre mucoidi e rampicanti.
La corteccia cerebellare è identica in tutte le differenti zone e presenta tre strati
di neuroni. Il più esterno è lo strato molecolare, lo strato intermedio è costituito
dalle cellule di Purkinjie ed è detto strato gangliare, infine lo strato più profondo
è lo strato dei granuli.
Lo strato dei granuli è formato da due tipi di neuroni: i granuli e le cellule di
Golgi. Le cellule del Golgi hanno la funzione di modulare le cellule dei granuli.
Queste ultime proiettano i loro neuriti nello strato molecolare dove, dividendosi
a T, decorrono parallelamente tra loro, parallelamente rispetto alla superficie
della corteccia e, ancora, parallelamente rispetto all’asse della lamella in cui si
trovano, per questa ragione vengono definiti fibre parallele.
Nello strato molecolare sono presenti, oltre alle fibre parallele, anche le cellule
dei canestri e le cellule stellate, neuroni di tipo associativo, che prendono
contatto sinaptico con i dendriti delle cellule del Purkinjie che, dopo aver
raggiunto lo stato molecolare si dispongono in esso a candelabro ebraico, cioè a
spalliera e tutte in un piano, parallelamente tra loro ma perpendicolarmente
rispetto all’asse della lamella in cui si trovano (Castano & Donato, 2006; Chiarugi
& Bucciante, 1972).
Le cellule del Purkinjie possono, grazie a questa disposizione, anche prendere
contatto sinaptico con le fibre parallele e, dunque, afferenze da moltissimi
granuli contemporaneamente. I neuroni più caratteristici del cervelletto sono le
cellule del Purkinjie. Quest’ultime sono le cellule più grandi della corteccia
13
cerebellare, hanno la forma di un fiasco dalla base del quale origina un assone
che, dopo aver attraversato il sottostante strato dei granuli, raggiunge i nuclei
del centro midollare; dal collo del corpo cellulare nascono i dendriti, uno o due al
massimo, che attraversando lo strato molecolare sovrastante raggiungono la
superficie corticale (Castano & Donato, 2006; Chiarugi & Bucciante, 1972).
Le fibre afferenti che raggiungono il cervelletto sono di due tipi: le cellule
rampicanti e le cellule muscoidi. Queste ultime terminano tutte nelle strato dei
granuli dove prendono contatto esclusivamente con i dendriti delle cellule dei
granuli, mentre le prime terminano nello strato molecolare dove si arrampicano
sui dendriti a spalliera delle cellule del Purkinjie, avvolgendo a spirale l’albero
dendritico. Le fibre muscoidi sono più numerose di quelle rampicanti poiché
originano dai nuclei basilari del ponte, dal midollo spinale e dai nuclei
vestibolari, cioè da tutte le altre formazioni del SNC che proiettano al cervelletto.
Le fibre rampicanti, invece, originano dai nuclei olivari inferiori e contraggono
sinapsi con i dendriti delle cellule del Purkinjie attraverso le spine, particolari
sporgenze bottoniformi. Le interconnessioni tra i vari tipi cellulari della
corteccia cerebellare costituiscono un’organizzazione ripetitiva in tutto il
cervelletto, cioè modulare. Nel cervelletto, inoltre, esiste una distribuzione
somatotopica dei circuiti, in cui ad ogni territorio periferico, da cui esso riceve
informazioni, corrisponde una porzione di corteccia cerebellare attraverso cui
esso coordina l’attività motoria del territorio stesso.
14
1.3 Fisiologia della corteccia cerebellare
L’attività del cervelletto risulta dall’integrazione di stimoli eccitatori provenienti
dalle fibre rampicanti e dalle fibre muscoidi e di stimoli inibitori provenienti
dalla corteccia tramite le cellule del Purkinjie convergenti sui nuclei cerebellari
(Castano & Donato, 2006).
I neuriti delle cellule del Purkinjie sono la sola via di uscita degli impulsi di tutta
la corteccia cerebellare, per cui si può affermare che tutti gli altri neuroni
cerebellari hanno la funzione di modulare la scarica di queste cellule. Esse
producono l’acido ɣ-amminobutirrico (GABA), un neurotrasmettitore inibitorio,
che inibisce in maniera abbastanza marcata i nuclei del centro midollare, dai
quali partono le fibre efferenti del cervelletto. Solo i granuli producono un
neurotrasmettitore eccitatorio, il glutammato, ed essi, attraverso le fibre
parallele, eccitano le cellule del Purkinjie. Queste, inoltre, sono eccitate dalle
fibre rampicanti provenienti dall’oliva inferiore che, così come le fibre muscoidi,
contengono glutammato. Sia le fibre muscoidi che quelle rampicanti inviano
collaterali di tipo eccitatorio ai nuclei propri del cervelletto i quali ricevono
inoltre le afferenze inibitorie delle celleule del Purkinjie (Castano & Donato,
2006).
15
1.4 Anatomia funzionale
Dividendo il cervelletto in tre strisce è possibile descrivere insieme filogenesi e
funzione dell’organo. Il vestibulocerebellum (vestibolo cervelletto) è costituito
dalla corteccia del verme insieme al nucleo del fastigio, collocati nella sostanza
bianca vicino al nodulo. Questa porzione mediana dell’organo è collegata in
entrambi i sensi con il nucleo vestibolare di cui controlla le afferenze
relativamente alle afferenze provenienti dal labirinto vestibolare, si occupa
dunque della coordinazione dei movimenti dei muscoli oculari (FitzGerald &
Gruener, 2008).
Il nucleo interposto, costituito dal nucleo globoso e dal nucleo emboli forme,
insieme alla corteccia paravermiania costituisce lo spinocerebellum (spino
cervelletto). Questa porzione paramediana, essendo collegata al midollo spinale,
partecipa principalmente al controllo della andatura e della postura.
Infine, la porzione laterale del cervelletto, il pontocerebellum (pontocervelletto)
comprendente il nucleo dentato, riceve una considerevole quantità di afferenze
dai nuclei pontini controlaterali che, ricevendo informazioni da ampie aree della
neocortex cerebrale, gli forniscono come alternativo appellativo neocerebellum
(FitzGerald & Gruener, 2008).
16
1.5 Topografia funzionale del cervelletto
L'idea dell’esistenza dell’organizzazione somatotopica del cervelletto ha origine
con Lodewijk (Louis) (Bolk, 1906).
Indagini sperimentali sugli animali (Chambers & Sprague, 1955a, b; Snider &
Eldred, 1951), studi di neuroimaging nell’uomo (Snider, 1950; Snider & Eldred,
1951; Snider & Stowell, 1944; Manni & Petrosini, 2004; Bushara et al., 2001;
Grodd et al., 2001, 2005) e relazioni cliniche (ad esempio, Victor et al., 1959;
Schoch et al., 2006) hanno sostenuto l'ipotesi originale di Bolk (1906) che esista
una topografia della funzione motoria all'interno del cervelletto (Manni e
Petrosini 2004).
Studi clinici contemporanei suggeriscono che mentre il lobo anteriore del
cervelletto è impegnato principalmente nelle controllo motorio, il verme
cerebellare è coinvolto nell’elaborazione emotiva e il cervelletto posteriore
contribuisce alla operazioni cognitive più complesse (Exner et al., 2004;
Levisohn et al., 2000; Schmahmann, 2004, 2007; Schmahmann & Sherman, 1998;
Schoch et al., 2006; Tavano et al., 2007). Inoltre, in coerenza con gli intricati
percorsi di fibre cerebro-cerebellari, le disabilità linguistiche possono sorgere in
seguito a lesioni dell'emisfero cerebellare destro, mentre le difficoltà visuo-
spaziali sono causate da lesioni dell'emisfero cerebellare sinistro (Fiez et al.,
1992; Gottwald et al., 2004;Gross-Tsur et al., 2006; Hokkanen et al., 2006; Riva &
Giorgi, 2000; Scott et al., 2001).
Alcuni autori considerano questa topografia funzionale una conseguenza della
organizzazione differenziale delle connessioni del cervelletto con il midollo
spinale, con il tronco encefalico e con gli emisferi cerebrali, che riflettono
l’aggregazione cerebellare nei circuiti neurali che sottendono il movimento, la
cognizione e l’emozione (Stoodley & Schmahmann, 2010).
Tuttavia, altri studi sembrano non rilevare problemi non motori in seguito a
tumore o ictus cerebellari, e altri non trovano affidabile la relazioni struttura-
funzione (Frank et al., 2007).
Una migliore comprensione di questi risultati contraddittori consentirebbe di
chiarire la topografia funzionale del cervelletto in relazione alla posizione del
danno cerebellare.
17
Attraverso uno studio condotto su 39 pazienti con ictus isolato al cervelletto,
Schmahmann et al. (2009) hanno concluso che l’apparente dicotomia tra quei
pazienti con lesioni cerebellari che hanno avuto deficit motori rispetto a coloro
che non li hanno avuti è stata delineata dalla posizione della lesione. Infatti, in
pazienti con conseguenze motorie le lesioni coinvolgevano il lobo anteriore
(lobuli I - V). Nei pazienti con conseguenze motorie minori o assenti, le lesioni
non coinvolgevano il lobo anteriore ma erano confinate nei lobuli VII - X del lobo
posteriore. Nei pazienti in cui l’infarto coinvolgeva il lobulo VI oltre ai lobuli VII -
X, ma in cui il lobo anteriore era risparmiato, il grado di compromissione
motoria era minore.
Il coinvolgimento dei nuclei profondi del cervelletto non sembra essere rilevante
per i deficit motori e, in particolare, per quanto riguarda le alterazioni della
postura e dell'andatura, la disfunzione cinetica delle braccia e delle gambe
(dismetria appendicolare), i disturbi della parola e la compromissione
oculomotoria. Inoltre, la localizzazione della lesione in posizione mediale o
laterale non sembra contribuire in modo differenziato alla presenza delle
suddette alterazioni.
Numerosi studi clinici (Ackermann et al., 1992; Kase et al., 1993; Terao et al.,
1996; Urban et al., 2003), analisi morfometriche di pazienti con ictus (Schoch et
al., 2006) e studi di imaging funzionale (Fox et al., 1985; Nitschke et al., 1996;
Rijntjes et al., 1999; Urban. et al., 2003; Grodd et al., 2005; Stoodley &
Schmahmann, 2009) hanno confermato l’ipotesi che la rappresentazione
motoria sia ubicata nel lobo anteriore del cervelletto, in particolare nei lobuli III,
IV e V, e in misura minore anche nel lobulo VI del lobo posteriore. Al contrario,
l'assenza di impairment motorio in seguito all’ictus, in particolare del lobulo VII
del lobo posteriore, non ha ricevuto l’analoga attenzione. Sembra quindi che ci
sia una doppia dissociazione tra il cervelletto motorio nel lobo anteriore (lobuli I
- V), e il cervelletto cognitivo situato all'interno del lobo posteriore
(prevalentemente lobulo VII). Il lobulo VI sembra occupare un ruolo intermedio
in questa dicotomia motorio- non motorio, forse rappresenta l'equivalente
cerebellare di una regione pre-motoria o motoria supplementare (Schmahmann
et al., 2009).
18
In precedenza, Schoch et al. (2006) hanno supposto che i deficit motori
conseguono lesioni del "cervelletto superiore", e i risultati di Schmahmann et al.
(2009) sono coerenti con le loro conclusioni. Schoch et al. hanno, tuttavia,
notato che le lesioni nel cervelletto posteriore non causano disabilità motoria
significativa perché il lobo posteriore può essere "meramente coinvolto" (cioè
non necessariamente) per il controllo motorio, e perché "le lesioni che
comprendono la rappresentazione somatotopica nel cervelletto posteriore
possono causare disfunzione motoria solo nella fase iniziale della malattia
(ictus)" (Schoch et al., 2006).
Gli autori spiegano questo fenomeno facendo riferimento alla presenza delle
connessioni che il cervelletto ha con determinate aree cerbrali, in particolare, il
lobo anteriore del cervelletto e alcune parti del lobulo VI riceveno afferenze
spinali attraverso le vie spinocerebellari (Oscarsson, 1965), e sono
reciprocamente interconnesse con la corteccia motoria tramite le proiezioni
motorie corticopontine (Brodal, 1978; Hartmann-von Monakow et al., 1981;
Schmahmann et al., 2004) e attraverso il feedback che, dai nuclei cerebellari
attraverso il talamo, raggiunge le regioni motorie (Thach, 1987; Kelly & Strick,
2003). Il lobo anteriore è anche reciprocamente legato ai nuclei accessorio
mediale e dorsale del complesso olivare inferiore, che a sua volta ricevono
afferenze dal midollo spinale (Brodal, 1981; Voogd, 2004). Al contrario, il lobulo
cerebellare VII è essenzialmente privo di collegamenti con la corteccia motoria o
con il midollo spinale (Brodal, 1981; Voogd, 2004). Esso è legato, invece, in
maniera reciproca con feedforward e feedback con le aree associative cerebrali
corticali -corteccia prefrontale, corteccia parietale posteriore, regioni polimodali
superiore e temporale, giro del cingolo e area paraippocampale posteriore
(Schmahmann, 1991, 1996; Schmahmann & Pandya, 1997; Kelly & Strick, 2003).
Inoltre, il lobulo VII è reciprocamente legato al nucleo olivare principale che
riceve input minimi dal midollo spinale (Sugihara & Shinoda, 2004).
Dunque il cervelletto sembra essere coinvolto, oltre che nel controllo motorio, in
una vasta gamma di compiti, tra cui il controllo sensomotorio, il linguaggio, le
funzioni spaziali ed esecutive.
Stoodley & Schmahmann (2009), attraverso una metanalisi di tutti gli studi di
imaging funzionale fino ad allora pubblicati, hanno cercato di stabilire la
19
topografia del cervelletto da cui può essere evidenziato che, per quanto riguarda
i compiti sensomotori, le rappresentazioni motorie e somatosensoriali mostrano
in gran parte dei pattern di attivazione sovrapposti, con cluster principali
concentrati nel lobo anteriore e in particolare nel lobulo V e in alcune zone
dell’adiacente lobulo VI, e un secondo cluster nel lobulo VIII del lobo posteriore
(Blackwood et al., 2004; Frings et al. 2006).
Inoltre, le coordinate motorie e somatosensoriali sembrano essere lateralizzate a
destra, in coerenza con la accertata presenza di una organizzazione
somatotopica cerebellare ipsilaterale.
Per quanto concerne i compiti linguistici, invece, i picchi di attivazione sembrano
essere lateralizzati a destra nel lobulo VI, nei Crus I e II, e lungo la linea mediana
del lobulo VIIAt. È stato rilevato anche un piccolo gruppo di attivazione nel
lobulo VI dell'emisfero laterale sinistro.
Inoltre, gli autori hanno potuto rilevare che c’è una considerevole
sovrapposizione tra le attivazione per i compiti di memoria di lavoro verbale e
quelle per i compiti linguistici. Per i compiti di memoria di lavoro verbale, i
picchi di attivazione più alti sono stati rilevati all'incrocio tra il lobulo VI e il Crus
I nell’emisfero destro, con un analogo cluster nel lobulo VI e Crus I dell’emisfero
sinistro. Oltre a questi cluster più laterali, sono stati rilevati picchi mediali nel
lobulo VI sia dell’emisfero di sinistra che in quello di destra. Infine, c'era un
piccolo cluster di picchi rilevati a destra nel lobulo VIII per i compiti di memoria
di lavoro.
In contrasto con i processi di memoria verbale, la memoria di lavoro era più
lateralizzata a destra, mentre l’elaborazione spaziale mostrava una maggiore
attivazione nell’emisfero sinistro, prevalentemente nel lobulo VI.
L'elaborazione di stimoli emotivi, invece, attiva un cluster che si estende dalla
linea mediana nella regione mediale del lobulo VIIAt dell’emisfero sinistro. Un
cluster di attivazione di grandi dimensioni coinvolge l’emisfero cerebellare
sinistro, in particolare il lobulo VI e il Crus I, ma anche un cluster nel lobulo VI
dell’emisfero destro.
I compiti di funzione esecutiva hanno evidenziato l’attivazione di una serie di
regioni cerebellari, tra cui Crus I bilateralmente, il lobulo VI e il lobulo VIIB
dell’emisfero sinistro.
20
Inoltre, gli autori hanno indicato il verme posteriore come "cervelletto limbico";
tale ipotesi deriva dalle conoscenze sulle connessioni tra questa regione e le
strutture limbiche del cervello (Heath et al., 1979; Schmahmann, 1991,1996,
2004).
I pazienti con la sindrome cognitivo affettiva cerebellare (CCAS), infatti, possono
presentare labilità emotiva, riso o pianto incongrui, (Levisohn et al. 2000; Parvizi
et al., 2007; Parvizi e Schiffer, 2007; Rapoport et al.2000; Schmahmann e
Sherman, 1998; Schmahmann et al., 2007; Steinlin et al., 2003), suggerendo che
queste connessioni cerebello-limbiche sono coinvolte nella modulazione dei
processi emozionali. Inoltre, diversi tipi di intonazione emotiva della voce
attivano una serie di regioni all'interno del cervelletto, tra cui un cluster nel
lobulo VIIAt che si estende lungo la linea mediana. Nell’emisfero mediale sinistro
si verifica una grande lateralizzazione sinistra nel Crus I, e in una parte del
lobulo VI destro. La linea mediana del lobulo VII può essere importante per gli
aspetti affettivi del CCAS e per la sindrome della fossa posteriore (Famularo et
al., 2007; Pollack et al., 1995; Richter et al., 2005), e per le malformazioni del
verme posteriore che sono stati associati a sintomi emotivi (Tavano et al., 2007).
Diversi studi di imaging hanno trovato l'attivazione del cervelletto in risposta
alla visualizzazione di immagini o espressioni facciali emotive (George et al.,
1993; Paradiso et al., 1997, 2003).
Le aree di attivazione del cervelletto che si trovano in contrasto con l'emozione
vs l’attivazione basale corrispondono ad alcune delle regioni riportate nello
studio PET di Imaizumi et al. (1997). In entrambi gli studi, l’attivazione
cerebellare è stata rilevata nella linea mediana del lobulo VII e nella parte
emisferica posteriore laterale (lobulo VI e Crus I).
Questi studi mostrano che l'attivazione del lobulo VII del verme durante processi
emozionali è abbastanza consistente. Probabilmente l'attivazione emisferica è
legata agli aspetti del processo decisionale di queste attività, mentre la
componente del lobulo VII del verme può essere più specificamente legata
all’elaborazione emozionale.
L’ipotesi putativa del cervelletto limbico nel verme posteriore è ulteriormente
suffragata dalla scoperta che i pazienti con ictus cerebellare mostrano differenze
nelle risposte PET nelle regioni prefrontali e limbiche rispetto ai soggetti di
21
controllo (Turner et al., 2007). I pazienti, infatti, hanno mostrato una maggiore
attivazione nelle regioni prefrontali e una diminuita attività nelle strutture
limbiche in risposta a stimoli spiacevoli.
Per quanto concerne le funzioni linguistiche, le attivazioni durante compiti di
linguaggio fonologico, semantico e di generazione di parola sono state
generalmente osservata nel cervelletto postero-laterale destro, con un maggiore
coinvolgimento del lobo anteriore quando l'articolazione è presente (Fiez &
Raichle, 1997; Ackermann et al., 1992). L'attività si è concentrata nelle regioni
posteriori laterali del cervelletto, tra il lobulo VI e i Crus I e II. Questi risultati
sono simili a quelli ottenuti da studi precedenti che mostrano l’attivazione del
cervelletto di destra durante compiti di fluidità verbale in soggetti destrimani
(Le et al., 1998; Petersen et al., 1988; Raichle et al., 1994), e un’attivazione
incrociata cerebro-cerebellare nel corso di un compito di fluidità verbale in
soggetti mancini e in soggetti destrimani (Hubrich-Ungureanu et al., 2002).
Studi di imaging precedenti hanno evidenziato il ruolo del cervelletto nella
memoria di lavoro (Desmond et al., 1997; Fiez et al., 1996). I risultati della meta-
analisi di Stoodley e Schmahmann (2009), rivelano che le regioni coinvolte nei
compiti di memoria di lavoro verbale coincidono con quelli coinvolti nei compiti
di linguaggio, in coerenza con il ruolo proposto per la memoria di lavoro nelle
prove verbali (Baddeley, 1992). Sulla base delle loro scoperte, nel corso di un
lavoro su un esercizio di memoria che utilizza il paradigma di Sternberg, Chen e
Desmond (2005) hanno ipotizzato che il cervelletto ha due ruoli diversi durante
lo svolgimento dei compiti di memoria di lavoro verbale: il primo, comporta
l’attivazione durante le prove di articolazione delle aree del circuito cerebello-
frontale, tra cui il lobulo VI e il Crus I destri del cervelletto e l'area di Broca, la
seconda, comporta l’attivazione delle aree del circuito cerebello-parietale, cioè
dei lobuli VIIB e VIII bis destri del cervelletto e il lobo parietale inferiore, nel
mantenimento/archiviazione delle informazioni.
L’attivazione del lobulo VI nel verme è legata al recupero delle informazioni.
Questi pattern di attività cerebellare durante le varie fasi nei compiti di memoria
di lavoro confermano i risultati ottenuti dalla meta-analisi di Stoodley e
Schmahmann (2009).
22
Infine, studi clinici, studi su animali e dati di imaging forniscono il supporto per
un ruolo del cervelletto nelle funzioni spaziali (Molinari e Leggio, 2007).
Il cervelletto riceve numerosi input da parte del lobo parietale cerebrale
(Glickstein et al., 1985; Schmahmann e Pandya, 1989), infatti danni cerebellari
portano a deficit spaziali (Botez et al., 1985; Levisohn et al., 2000; Molinari et al.,
2004; Nawrot e Rizzo, 1998; Schmahmann e Sherman, 1998; Tavano et al., 2007;
Wallesch e Horn, 1990). La scoperta che le attività spaziali hanno mostrato
pattern di attivazione lateralizzati più a sinistra sono concordanti con i dati di
imaging che mostrano che l'emisfero cerebrale destro è più attivo durante
compiti spaziali, ad esempio, Fink et al. (2000) hanno rilevato che durante il
compito di bisezione della linea è particolarmente coinvolto il cervelletto
sinistro e la corteccia parietale destra. Inoltre, attraverso il compito di memoria
di lavoro di Sternberg, Fink et al., hanno evidenziato che ci sono aree di
sovrapposizione tra le regioni coinvolte nelle prove di memoria di lavoro e
quelle coinvolte nelle funzioni esecutive, ma alcune delle regioni del lobulo VI
destro sono state evidenziate come specifiche per i compiti di memoria di
lavoro; mentre venivano evidenziate due regioni nell'emisfero sinistro del
cervelletto, specifiche per le funzioni esecutive in tutti i confronti (vs
elaborazione emotiva, il linguaggio, la memoria di lavoro e di elaborazione
spaziale): un cluster era localizzato nel lobulo VI e nel Crus I, e un altro nel
lobulo VIIB.
Studi anatomici nelle scimmie mostrano interconnessioni tra le corteccia
prefrontale e il lobulo VII (Crus I, Crus II, e lobulo VIIB; Kelly e Strick, 2003).
Pertanto, questi risultati sono coerenti con il concetto dei circuiti cerebro-
cerebellari che possono essere considerati alla base del coinvolgimento del
cervelletto nelle funzioni esecutive
(Bellebaum e Daum, 2007).
23
1.6 Connessioni cortico-cerebellari
Dalle lesioni cerebellari derivano numerosi deficit quali la dismetria motoria,
l’atassia, i tremori (Holmes, 1939), ma anche la sindrome cognitivo affettiva
(Schmahmann & Sherman, 1998) che include deficit esecutivi, visuo-spaziali,
linguistici ed emotivi, mutismo e psicosi (Botez-Marquard et al., 1994; Grafman
et al., 1992; Heath et al., 1979; Levisohn et al., 2000; Molinari et al., 2004;
Rapoport et al., 2000; Riva & Giorgi, 2000; Schmahmann et al., 2007; Steinlin et
al., 2003).
La supposta base anatomica di questo nuove funzioni non motorie legate a
funzioni cerebellari è dovuta all'esistenza dei circuiti cerebro-cerebellare
(circuito cortico-ponto-cerebellare e circuito cerebello-talamo-corticale) che
collegano il cervelletto con le cortecce motorie e con la corteccia associativa e le
regioni paralimbiche dell'emisfero cerebrale (Botez et al., 1985; Kelly & Strick,
2003; Leiner et al., 1986; Middleton & Strick, 1994; Schmahmann, 1991, 1996;
Schmahmann & Pandya, 1989, 1997; Voogd & Glickstein, 1998).
Inoltre, ci sono evidenze che suggeriscono che informazioni di diverso tipo
vengono elaborate negli emisferi destro e sinistro del cervelletto, e alcuni autori
sostengono la presenza di circuiti parietali-cerebellari vs circuiti prefrontali-
cerebellari. Questa ipotesi è confermata nalla meta-analisi di Stoodley e
Schmahmann (2009).
Salmi e colleghi, in un loro studio del 2010, attraverso l’fMRI e la diffusion-
weighted MRI (DW-MRI), hanno studiato la segregazione delle funzioni cognitive
e motorie nel sistema cerebro-cerebellare umano. Gli autori hanno usato l’fMRI
durante compiti di memoria di lavoro e di controllo sensomotorio per indagare il
ruolo del cervelletto nell’elaborazione cognitiva e motoria, ipotizzando che un
aumento del carico di lavoro per la memoria attiva le aree nei lobuli cerebellari
VII-VIII, mentre un aumento del carico di lavoro per il controllo sensomotorio
attiverebbe i lobuli cerebellari IV-VI; inoltre, hanno messo in correlazione
l'attività cerebrale osservata con le misure ottenute nei compiti di performance
per indagare l'associazione tra l'attività cerebellare e le prestazioni durante
questi compiti. Infine, hanno raccolto i dati DW-MRI per esaminare i feedforward
e i feedback tra le aree attivate del cervelletto e quelle del cervello.
24
Studi precedenti con fMRI in soggetti sani suggeriscono che i compiti motori e
cognitivi attivano diverse aree del cervelletto: compiti motori come il “finger
tapping” attivano i lobuli IV-VI nelle parti superiori del cervelletto anteriore,
mentre le attività cognitive come compito di shifting attentivo o di memoria di
lavoro verbale provocano l’aumento dell’attività negli emisferi cerebellari
posteriori, soprattutto nei lobuli VII (che è diviso per Crus I e II) e VIIB (Allen,
Buxton, Wong e Courchesne, 1997; Desmond, Gabrieli, Wagner, Ginier e Glover,
1997).
Anche se molti studi hanno riportato l'attività cerebellare durante compiti
cognitivi (Ramnani, 2006), il ruolo del cervelletto nella elaborazione cognitiva
non è chiaro. È stato suggerito che l'attività cerebellare in compiti cognitivi può
essere dovuta a processi motori incontrollati, quali per esempio i movimenti
oculari (Glickstein & Doron, 2008).
Le connessioni neurali tra il cervello e il cervelletto sono anche suggestive per il
coinvolgimento del cervelletto nei processi cognitivi. Studi su primati non umani
mostrano che, oltre alla corteccia motoria, anche le cortecce prefrontale e
parietale posteriore (PFC e PPC, rispettivamente) forniscono input di primo
piano al cervelletto (Schmahmann & Pandya, 1989, 1997a, 1997b; Allen, Gilbert
e Yin, 1978; Brodal, 1978). Questi specifici feedforward vengono proiettati al
cervelletto attraverso i nuclei pontini, mentre i segnali di retroazione cerebellare
sono trasmessi tramite il talamo fondamentalmente alle stesse aree cerebrali da
cui originano le proiezioni di feedforward (Clower, West, Lynch e Strick, 2001;
Middleton & Strick, 2001; Hoover & Strick, 1999; Lynch, Hoover e Strick, 1994).
I risultati nei primati non umani suggeriscono anche che il Crus II (nel lobo
posteriore del cervelletto) e l’area 46 di Brodmann (BA) della PFC e dei lobuli IV-
VI (nel lobo cerebellare anteriore) e la corteccia motoria primaria (M1) formano
circuiti chiusi (Kelly & Strick, 2003).
Tuttavia, studi sugli esseri umani non hanno separato il sistema cerebro-
cerebellare "motorio" e quello "cognitivo". Non è neppure chiaro come l'attività
cerebrale adottata nella elaborazione cognitiva e motoria sia legata alla
performance.
25
Tuttavia, i risultati ottenuti nello studio di Selmi e colleghi (2010) suggeriscono
che i processi cognitivi e motori attivano aree segregate del cervelletto umano, e
queste aree hanno tratti di connettività con differenziati pattern nella corteccia
cerebrale. Le regioni Crus I e II del cervelletto che si attivano con l’incremento
del carico cognitivo sono connesse con le aree cerebrali che vengono
simultaneamente attivate. Sulla base dei risultati attuali e di quelli ottenuti in
studi precedenti sulla funzioni del cervelletto (Ito, 2006; Ramnani, 2006), Selmi
e colleghi affermano che i Crus I e II sono probabilmente coinvolti
nell'ottimizzazione della velocità di risposta quando il carico cognitivo aumenta.
In un altro studio, Habas e colleghi, utilizzando una procedura di template-
matching imparziale (Greicius et al., 2004), hanno individuato una serie di reti
intrinseche di connessione (ICNs): la rete in modalità di default (DMN) (Greicius
et al., 2003, 2004), la rete del controllo esecutivo (ECN, divisa nell’emisfero
sinistro LECN e destro RECN) (Seeley et al., 2007), la rete salience (Seeley et al.,
2007), e la rete senso-motoria (Biswal et al., 1995; Xiong et al., 1999).
La rete sensomotoria comprende la corteccia sensomotoria (M1/S1), la
corteccia premotoria (BA 6), l’area motoria supplementare, la corteccia cingolata
anteriore (BA 24), la corteccia occipitale (BA 19/37), la corteccia temporale (BA
21), e l'insula. Questo circuito comprende anche i nuclei lentiforme e caudato, il
talamo ventrale, la parte rostrale del nucleo rosso sinistro; mentre per quanto
riguarda il cervelletto i cluster d’attivazione sono stati localizzati bilateralmente
26
all'interno dei lobuli V e VI e all'interno di ciò che è probabilmente la parte
dorsale dei nuclei dentati (tra il nucleo dentato e la parte laterale del confinante
nucleo interposto).
La rete in modalità di default (DMN) mostra connettività funzionale all'interno
delle seguenti aree corticali: la corteccia prefrontale dorsomediale (BA 9/10), la
corteccia prefrontale mediale (BA 32), la corteccia parietale superiore (BA 7), il
giro angolare (BA 39), la corteccia cingolata posteriore (BA 23/31), la corteccia
retro spleniale (BA 29/30), il lobo temporale mediale e la corteccia temporale
ventrale (BA 20). Cluster di attivazione sottocorticali sono stati trovati anche nel
talamo, nel nucleo rosso sinistro, e nel mesencefalo. Questo circuito diencefalo-
telencefalico comprende anche il cervelletto. I cluster cerebellari sono state
bilateralmente localizzati nell’emisfero caudodorsale del lobulo IX, che può
includere parte del secondo homunculus. Un piccolo gruppo è stato riscontrato
nell'emisfero destro del lobulo VIIB. Sono anche stati osservati cluster all'interno
dei nuclei pontini dorso mediani. La DMN, è principalmente implicata nel
recupero della memoria episodica, nell’auto-riflessione, nell’utilizzo e creazione
di immagini mentali, nel flusso di elaborazione di coscienza (Raichle et al., 2001;
Greicius et al., 2003, 2004; Buckner et al., 2005). Habans e colleghi hanno
scoperto che la DMN include il lobulo IX e un piccolo gruppo nell'emisfero destro
del lobulo VIIB. Tuttavia, il ruolo del lobulo IX rimane poco chiaro; ad oggi,
sappiamo che esso è implicato in vari compiti funzionali quali il senso di sazietà
(Parsons et al., 2000) e la sensazione di sete (Hui et al. 2005), la
sincronizzazione motoria (Jantzen et al., 2004), la memoria di lavoro (Desmond
et al., 1997), e la percezione del cambiamento in stimolo temporali (Liu et al.,
2008). Il lobulo IX, così come è confermato dall’atlante MRI di riferimento del
cervelletto (Schmahmann et al., 2000), è coinvolto nella elaborazione degli
eventi passati e futuri in cooperazione con la corteccia retrospleniale e quella
precuneale (Addis et al., 2007). Essendo il lobulo IX la parte più inferiore del
cervelletto, spesso non è coperto dalle norme dei protocolli fMRI e quindi risulta
più incline rispetto alle altre regioni a produrre falsi negativi. Ciò nonostante, i
risultati di Habans et al., che lo collegano alla rete DMN sono supportati da una
recente studio in fase di riposo che ha anche individuato un cluster di attivazione
della rete DMN nel lobulo IX (Filippini et al. 2009). La DMN, con il suo presunto
27
ruolo nel recupero della memoria episodica e di auto-riflessione, può essere
considerata la rete filogeneticamente più recente delle cinque ICNs considerate
quindi la probabilità di trovare evidenze omologhe a queste negli altri primati è
più bassa. Il ruolo funzionale del lobulo IX caudale nella DMN rimane irrisolto.
Le rete del controllo esecutivo ECNs destra e sinistra, RECN e LECN,
rispettivamente, probabilmente rappresentano due ICNs omologhe che insieme
costituiscono la ECN unitaria (Seeley et al., 2007). L'ECN si attiva principalmente
durante le richiesto di selezione e mantenimento delle informazioni necessarie
nei compiti di memoria di lavoro per la pianificazione dell’azione (Seeley et al.,
2007). I risultati di Habans et al. hanno dimostrato che l'ECN comprende cluster
pontini e nella maggior parte neocerebellari (crus I-II). Questi risultati
concordano con studi anatomici fatti sulle scimmie e rafforzano l’ipotesi
dell’esistenza di una connessione funzionale reciproca tra il Crus I e la corteccia
prefrontale e il Crus II e la corteccia parietale.
In particolare, le afferenze provenienti dalla corteccia prefrontale, attraversando
la parte rostralee mediale dei nuclei pontini, convergono sul I crus, mentre le
afferenze provenienti dalla corteccia parietale convergono sul Crus II attraverso
le vie laterale, dorsale, e mediale degli stessi nuclei pontini (Brodal, 1979). Le
efferenze provenienti dai Crus I e II completano la connessione reciproca con la
corteccia prefrontale e parietale attraverso proiezioni provenienti dal nucleo
dentato (Dum e Strick, 2003).
Negli esseri umani, gli studi di imaging funzionale hanno messo in evidenza il
ruolo dei Crus nelle funzioni esecutive, come il ragionamento astratto (Monti et
al., 2007), la memoria di lavoro (Chen e Desmond, 2005), l’aggiornamento delle
informazioni (Collette et al., 2007), e la selezione della risposta (Desmond et al.,
1998). Lesioni del neocerebellum, infatti, possono comportare alterazioni
nell’esecuzione di compiti di ragionamento astratto, memoria di lavoro, set-
shifting, e nella pianificazione (Schmahmann e Sherman, 1998). Un ampia
lateralizzazione funzionale del cervelletto è stata dimostrato per la presenza
della forte lateralizzazione delle ECNs di destra e sinistra. Infatti, studi di
imaging funzionale (Desmond e Fiez, 1998; Monti et al., 2007) e studi clinici
(Gottwald et al., 2004; Richter et al., 2007) suggeriscono che nei processi verbali
28
è preferibilmente coinvolto il cervelletto destro mantre nei processi spaziali il
cervelletto sinistro.
I cluster corticali della LECN sono stati trovati nella corteccia prefrontale
dorsolaterale, metà dorsolaterale, e dorsomediale (BA 45/46, 9, e 8), la corteccia
orbitofrontale (BA 47), la corteccia parietale superiore (BA 7), e il giro angolare
(BA 39). Inoltre, i cluster sottocorticali sono stati situati all'interno del nucleo
caudato sinistro. La connettività funzionale è stata anche rilevata in diverse
regioni neocerebellari, tra cui il Crus I e il Crus II dell’emisfero destro, con una
predominanza nel Crus I, ed estensioni limitate nei lobuli VI e VII B, nell'emisfero
destro rostrale del lobulo IX e nel Crus I e II dell’emisfero mediale sinistro. Altri
cluster sono stati osservati alla base del ponte dorsale sinistro.
I cluster di attivazione corticale della RECN sono stati trovati nella corteccia
prefrontale dorsolaterale (BA 44/ 45/46), nella corteccia orbitofrontale ventrale
(BA 47), nella corteccia cingolata caudale (BA 23 bilateralmente), nella corteccia
parietale superiore (BA 7), e nel giro angolare e sopramarginale (BA 39 /40).
Infine, i cluster di attivazione sottocorticali, sono stati localizzati all'interno del
nucleo caudato destro e del nucleo rosso sinistro. La connettività funzionale è
stata rilevate anche in diverse regioni neocerebellari, che comprendono cluster
localizzati sul lato sinistro, nei Crus I e II con un'estensione nei lobuli VI e VIIB.
Altri cluster sono stati rilevati anche alla base del ponte dorsale di destra. Gli
studi clinici e di neuroimaging indicano il neocerebellum come un nodo decisivo
per le funzioni esecutive verbali nella RECN e non verbali nella LECN. Infine, il
lobulo IX rostrale destro contribuirebbe anche alla LECN, ma come già detto, la
funzione di lobulo IX rimane poco chiara.
La rete salience presenta connettività funzionali rilevanti con la corteccia
frontale mediale (BA 32), con la corteccia cingolata anteriore dorsale (BA 24),
con la corteccia prefrontale dorsolaterale (BA 46), con la corteccia fronto-
insulare (BA 47/12), con il talamo, ed infine con i nuclei rossi con una
predominanza sinistra. I cluster di attivazione cerebellari si trovano
bilateralmente nella parte laterale e ventrale emisferica del lobulo VI e
nell’adiacente Crus I vicino alla fessura postero-superiore, con una stretta
estensione emisferica del Crus II e del lobulo VIIB. All'interno del lobulo VI, i
cluster della rete salienza si trovano più lateralmente e più vicino alla fessura
29
posterosuperiore più paramediana rispetto all’attivazione trovata nella rete
sensomotoria. Una piccola regione di sovrapposizione tra questi cluster di
attivazione della rete sensomotoria e quella di salience è stata rilevata
posteriormente sul lato sinistro. Altri cluster sono stati rilevati anche nei nuclei
dentati.
All'interno del ponte, i cluster di attivazione sono localizzati nella regione del
nucleo pontino dorsomediano.
La rete salience, è coinvolta nella rilevazione, nell’integrazione e nel filtraggio
delle informazioni interocettive autonomiche ed emotive (Seeley et al., 2007). Lo
studio di Habans et al. dimostra che le funzioni principali di questa rete sono
due, per distinte regioni del cervelletto: la parte laterale dei lobuli VI di destra e
di sinistra e l'adiacente Crus I. I lobuli VI-VII (crus I) sono collegati, attraverso il i
nuclei pontino e dentato, con l’ipotalamo posteriore e i nuclei mammillari
laterali (Haines e Dietrichs, 1984; Haines et al.,. 1997). Mentre, poichè il
neocerebellum laterale è collegato principalmente alle cortecce associative, gli
autori postulano che i cluster frontoinsulari e prefrontali individuati sono
presumibilmente collegati con lobuli VI - Crus I. Dimitrova et al., in uno studio
del 2003, hanno dimostrato che il ruolo del lobulo VI del verme e del lobuli VI –
Crus I emisferici è legato a processi di manifestazione del dolore come smorfie,
paura, e le reazioni di spavento. Ictus cerebellari che colpiscono i lobuli VII e VIII
emisferici causano deficit nell’elaborazione soggettiva di sensazioni piacevoli
(Turner et al., 2007).
Infine, Stoodley e Schmahmann (2009) segnalano l'attivazione cerebellare,
soprattutto nel lobulo VI e crus I, durante processi emotivi, come valutare
l'espressione del viso e l’empatia. Pertanto, il lobulo VI e il I Crus possono
contribuire alla valutazione dell’importanza degli stimoli emotivi e alla selezione
dell'appropriata risposta comportamentale. Contrariamente alle loro aspettative,
gli autori, non hanno trovato nessun cluster di attivazione nel verme posteriore
le cui lesioni causano disturbi affettivi, quali ottundimento delle emozioni
(Schmahmann e Sherman, 1998).
Un piccolo cluster di attivazione mediale/paramediale era presente nel lobulo VI
sinistro. Il lobulo VI del verme riceve afferenze dall'ipotalamo (Azizi et al., 1981)
e proietta di nuovo all'ipotalamo attraverso il nucleo del fastigio (Haines et al.,
30
1997). Lesioni al nucleo del fastigio e a quello interposto possono provocare
alterazioni autonomiche (Haines et al., 1997). La stimolazione del verme ha
provocato miglioramento in alcuni disturbi psichiatrici (Heath, 1977) e un
aumento dell'attività theta legata alle emozioni e alla memoria (Schutter e van
Honk, 2006).
Così, il lobulo VI vermico e paravermico potrebbe svolgere un ruolo di
modulazione sui nodi subcorticali della rete salience e potrebbe rappresentare
un processore cerebellare emotivo filogeneticamente più antico, in
collaborazione con il verme posteriore e il lobo posteriore emisferico. Anche se i
cluster di attivazione del lobulo VI nella rete salience e in quella sensomotoria
erano principalmente distinte, un piccolo cluster di attivazione del lobulo VI è
stato trovato in entrambe le reti, questa sovrapposizione suggerisce una
connessione intracerebellare tra queste due reti.
Coerentemente con i recenti studi task-attivazione che dimostrano replicabili le
risposte cerebellari ad una serie di richieste cognitive (Stoodley e Schmahmann,
2009), i risultati ottenuti da Habas et al. (2009) supportano un importante ruolo
del cervelletto che va oltre il controllo motorio.
In conclusione, lo studio di Habas e colleghi fornisce un ulteriore sostegno
all'opinione che diverse regioni neocerebellari sono coinvolte in funzioni
cognitive distinte. Un limite importante di questo studo è che la presenza di tali
reti è rilevata in assenza di specifiche attività funzionali. Quindi gli autori
inferiscono i ruoli funzionali sopra descritti per i cluster di attivazione
cerebellare in base alla loro appartenenza alle reti ICNs, la cui rilevanza
funzionale è saldamente stabilita nella letteratura. Sembrerebbe, inoltre, che le
regioni cerebrali che tipicamente si attivano insieme durante compiti particolari
rimangono legate ad un certo livello basale, anche in assenza del loro compito
principale. Questa attività di connettività intrinseca basale indipendente è,
secondo alcuni autori, importante per evitare il disuso legato alla potatura
critica delle sinapsi (Luo e O'Leary, 2005). Altri hanno suggerito che questa
attivazione basale mantiene le reti di connettività in uno stato innescato per
migliorare l’efficienza della risposta (Fox e Raichle, 2007).
31
1.7 Cervelletto e Disturbi Psichiatrici
Per molti anni, sono state attribuite al cervelletto esclusivamente le funzioni
relative al movimento, all'andatura, alla postura e all'equilibrio. Tuttavia,
nell’ultimo trentennio, alcuni studi hanno suggerito un possibile coinvolgimento
del cervelletto nelle funzioni cognitive, emotive e nell'elaborazione delle risposte
comportamentali (Andreasen, Pierson, 2008; Grill et al., 2004; Hallet, Grafman,
2006; Hokkanen et al. 2006; Schmahmann et al., 2007; Timmann et al., 2003;
Schmahmann, 2004; Ribas, 2007). Secondo queste nuove ipotesi, il cervelletto
eserciterebbe una funzione di regolamentazione che sembrerebbe valorizzare e
integrare le altre funzioni cerebrali, mediante circuiti diretti e indiretti con le
altre strutture cerebrali (Andreasen et al., 2008; Ribas et al., 2007; Schmahmann
et al., 2007).
Inoltre, diverse fonti hanno suggerito che il cervelletto può essere alterato in
molti disturbi psichiatrici, tra cui la schizofrenia, il disturbo bipolare, la
depressione unipolare, i disturbi d’ansia e la sindrome da deficit di attenzione e
iperattività (Schmahmann et al. 2007; Bugalho et al., 2006).
In alcuni studi, i deficit cerebellari sono stati descritti come risultati isolati, non
rapportabili alla storia clinica. In altri invece ci sono prove che il cervelletto è
una struttura del sistema nervoso probabilmente correlata ad una vasta gamma
di manifestazioni psicopatologiche (Bugalho et al., 2006).
In una rewiew del 2008, Baldaçara e colleghi hanno condotto una revisione della
letteratura su alcuni studi di imaging strutturale e funzionale del cervelletto per
stabilire un possibile ruolo dello stesso nei disturbi psichiatrici e in particolare
rispetto ai meccanismi fisiopatologici che li sottendono.
In particolare, hanno analizzato il ruolo del cervelletto nella schizofrenia, nel
disturbo bipolare, nella depressione, nei disturbi d’ansia e nella sindrome da
deficit di attenzione e iperattività.
32
Cervelletto e Schizofrenia
Negli ultimi tre decenni, gli studi neurofisiologici sulla schizofrenia, utilizzando
diversi modelli, hanno identificato diverse alterazioni del cervelletto. Talvolta si
osserva un deterioramento globale della cognizione con deficit delle funzioni
esecutive (pianificazione, inibizione, flessibilità nel monitoraggio delle azioni,
ragionamento astratto), della memoria (difficoltà nell’organizzazione semantica
del contenuto della memoria e soprattutto nei compiti di memoria verbale e
visuo-spaziale), dell’attenzione (difficoltà nel controllo delle interferenze,
l'attenzione divisa e sostenuta, messa a fuoco) e del linguaggio (scioltezza, ma
senza alterazioni nel vocabolario) (Andreasen et al., 2008; Bugalho et al., 2006;
Konarski et al., 2006).
Ci sono evidenze che i pazienti con schizofrenia presentano alterazioni nella
connettività cortico-cerebellare (Konarski et al., 2006). Andreasen et al. (2008)
hanno proposto che un’interruzione del circuito corticale-talamico- cerebellare-
corticale (CTCC) può essere alla base di almeno una parte della sintomatologia
osservata nel schizofrenia (Konarski et al., 2006).
Questi autori sostengono inoltre che, così come il cervelletto svolge un ruolo
importante nella facilitazione dei compiti motori, e nel miglioramento della loro
esecuzione in termini di velocità e semplicità, il circuito CTCC svolgerebbe un
ruolo simile nel monitoraggio e nella coordinazione dell'esecuzione dell’attività
mentale per un funzionamento cognitivo normale (Andreasen et al., 1996;
Konarski et al., 2006).
Studi neuroanatomici, neuropatologici e di imaging cerebrale hanno rilevato
l'allargamento dei ventricoli cerebrali, la riduzione del volume cerebrale totale,
alterazioni strutturali e funzionali nelle strutture del lobo frontale e temporale,
del sistema limbico, del talamo e dei gangli basali (Bugalho et al., 2006).
Studi neurostrutturali hanno rivelato una riduzione del volume totale del
cervelletto, una riduzione del volume del verme e una riduzione dell’asimmetria
emisferica, mentre gli studi di neuroimaging funzionale, utilizzando paradigmi
cognitivi, hanno fornito prove di ipoattività frontale-talamica-cerebellare in
soggetti con schizofrenia (Andreasen et al., 1996).
33
Studi di risonanza magnetica (MRI), analizzati usando tecniche quantitative
antropometriche, hanno prodotto resoconti più coerenti con l’atrofia cerebellare
nella schizofrenia (Ichimiya et al. 2001; Nopoulos et al. 1999) e alcuni autori
hanno tentato di delineare un sottogruppo di pazienti con riduzione o
atrofizzazione del cervelletto. In alcuni pazienti con schizofrenia la riduzione
globale del cervelletto sembra essere associata a casi di insulti cerebrali
perinatali (Nasrallah et al., 1981), in altri con il sesso maschile (Okugawa et al.,
2002), con esordio infantile (Keller et al., 2003), con esordio tardivo (Barak et
al., 2002), con decorso cronico (DeLisi et al., 1997), e con i sintomi psicotici
positivi (Nopoulos et al., 2001). Altri autori hanno notato una limitata atrofia del
verme (Ichimiya et al., 2001; Okugawa et al., 2002).
In alcune malattie, gli emisferi cerebellari possono essere ridotti in seguito
all’atrofizzazione controlaterale degli emisferi cerebrale. Questo condizione è
chiamata diaschisi. Ci sono studi che suggeriscono che la riduzione del volume
del cervelletto nella schizofrenia non è solo una conseguenza dell’atrofia delle
strutture superiori. Parenti di primo grado non affetti di probandi con
schizofrenia e pazienti con schizofrenia mai trattati con neurolettici hanno
presentato una riduzione del volume cerebellare. Questi dati suggeriscono che
l'atrofia cerebellare può essere un tratto ereditabile piuttosto che un
epifenomeno associato al trattamento (Konarski et al., 2006; Ichimiya et al.,
2001).
Studi sulla schizofrenia, effettuati utilizzando strumenti di imaging funzionale,
hanno trovato un modello relativamente coerente di anomalie distribuite nelle
regioni del cervello che includono il cervelletto (Andreasen et al., 2008; Katsetos
et al., 1997; Crespo-Facorro et al., 2001; Crespo-Facorro et al., 2007). Le
anomalie rilevate in questi studi riguardano il verme e gli emisferi cerebellari. I
pazienti con schizofrenia avrebbero un minor afflusso di sangue nel cervelletto
quando svolgono una vasta gamma di compiti che attingono a sistemi funzionali
diversi del cervello, quali la memoria, l’attenzione, la cognizione sociale e le
emozioni (Katsetos et al., 1997; Crespo-Facorro et al., 2001; Crespo-Facorro et
al., 2007). Le anomalie del verme sono rilevate più frequentemente quando
vengono utilizzati compiti che attingono alle funzioni associate alle regioni
limbiche (ad esempio, studi sull’emozione), mentre le anomalie nelle regioni più
34
laterali neocerebellari sono state rilevate durante l’esecuzione di task che
utilizzano funzioni associate al funzionamento delle regioni neocorticali (ad
esempio, la codifica e il recupero dalla memoria) (Andreasen et al., 2008;
Crespo-Facorro et al., 2001).
Inoltre, sono frequentemente rilevati, nei pazienti con schizofrenia, deboli segni
neurologici che suggeriscono una disfunzione cerebellare, come atassia lieve,
difficoltà di coordinamento, dysdiadochokinesia (impossibilità di assolvere
rapidamente movimenti alternati), tremore intenzionale, dismetria dei
movimenti oculari saccadici (Bugalho et al., 2006). Inoltre, la presenza di
sintomatologia positiva (soprattutto allucinazione), così come la presenza dei
deficit cognitivi (ad esempio, difficoltà di sintesi e del sequenziamento logico e
sintomatologia fluenza verbale) e negativo (affettività appiattita, disturbo del
pensiero, mancanza della motivazione, isolamento sociale, impoverimento del
linguaggio) sono spesso stati segnalati in individui con lesioni cerebellare
(Bugalho et al., 2006; Leroy et al., 2001; Pollak et al., 1996). Non ci sono studi
che supportano l'idea che il cervelletto possa essere coinvolto nei disturbi
motori nei pazienti con schizofrenia trattati con neurolettici. Solo uno studio ha
individuato una riduzione dell’attività metabolica nel cervelletto in pazienti con
acatisia che assumevano olanzapina (Landgrebe et al.,2006). Questa teoria è
difficile da provare soprattutto perché negli studi strutturali i disturbi del
movimento sono utilizzati come criteri di esclusione e negli studi funzionali le
immagini del cervelletto vengono utilizzato come parametro di normalità per
l’analisi.
I risultati convergenti di neuroimaging e di studi cognitivi suggeriscono che le
anomalie cerebellari nella schizofrenia, potrebbero essere la causa di alcuni dei
sintomi positivi, negativi e cognitivi presenti in questa malattia. Fino ad oggi, non
ci sono studi che dimostrano se il trattamento ha un impatto sul funzionamento
del cervelletto o se la anomalie cerebellari sono relative al decorso o alla
prognosi del disturbo. Ci sono anche pochi studi che esplorano i cambiamenti nel
funzionamento cerebrale dopo la riabilitazione neuropsicologica.
35
Cervelletto e Disturbo Bipolare
Nonostante siano stati fatti numerosi studi, la patofisiologia del disturbo
bipolare è ancora poco compresa.
Diversi report hanno evidenziato l'atrofia cerebellare in pazienti con disturbi
dell'umore, ed alcuni in particolare nei pazienti con disturbo bipolare (Hamilton
et al., 1983; Yadalam et al.,1985; Jurjus et al., 1994) inoltre, alcuni studi hanno
trovato anomalie nell’anatomia cerebellare in soggetti con disturbi affettivi
(Soares et al., 1997). Due studi hanno riportato un maggior tasso di atrofia
cerebellare in pazienti maniacali rispetto a pazienti con schizofrenia o controlli
sani (Nasrallah et al., 1981). Inoltre, Yates et al. (1987) hanno trovato un
maggior tasso di atrofia cerebellare in pazienti affetti da disturbo bipolare che
avevano più di 50 anni, ma non nei pazienti bipolari giovani rispetto ai volontari
sani. (Yates et al.,1987).
Lippmann e colleghi hanno evidenziato l’incremento sia dell’atrofia degli
emisferi cerebellare che quella dei vermi cerebellari in pazienti bipolari con
concomitante disturbo di abuso d’alcool rispetto ai volontari sani, suggerendo
che l'abuso d’alcol può contribuire all’anomalia anatomica cerebellare nei
pazienti bipolari (Lippmann et al., 1982).
D'altra parte, uno studio che utilizzava l’analisi di regressione multipla, ha
escluso l'uso di alcol come un potenziale fattore di confondimento per l’atrofia
del volume dell’area vermica nei pazienti con disturbo bipolare (DelBello et al.,
1999).
Il volume della subregione del verme V2 era significativamente minore nei
soggetti con molteplici episodi di disturbo bipolare rispetto pazienti al primo
episodio e a soggetti sani, mentre la subregione vermale V3 era
significativamente più piccola in soggetti che avevano avuto diversi episodi di
disturbo bipolare rispetto ai soggetti sani. Presi insieme, questi risultati
suggeriscono che le anomalie cerebellari del verme postero-inferiore sono
presenti nei pazienti con più episodi di disturbo bipolare (Mills et al., 2005).
Successive indagini MRI del cervelletto, effettuate nei pazienti con il disturbo
bipolare, non hanno rivelato differenze morfologiche tra pazienti e controlli sani.
Tuttavia, quando i pazienti con disturbo bipolare sono stati suddivisi in gruppi di
36
soggetti con primo episodio maniacale e soggetti con più episodi maniacali, è
stata evidenziata una significativa differenza di grandezza della sub-regione V3,
risulta più piccola nel gruppo con più episodi (Mills et al., 2005; Konarski et al.,
2005).
Ulteriori analisi hanno rivelato che, nei pazienti con più episodi, il numero di
episodi depressivi precedenti, ha contribuito alla riduzione di volume V3, mentre
l’abuso di sostanze o la durata dell'assunzione di litio non erano fattori che
influivano sulla riduzione. Loeber e colleghi, impiegando il mezzo di contrasto
nella risonanza magnetica, hanno riportato che i pazienti con disturbo bipolare
avevano un minor flusso ematico cerebrale regionale (rCBF) nel cervelletto
rispetto ai controlli sani e ai pazienti con schizofrenia, anche dopo aver
controllato le differenze per il volume (Loeber et al., 1999).
La regione cerebellare più frequentemente riportata negli studi di neuroimaging
condotti su pazienti bipolari, il verme, ha mostrato la maggiore riduzione
nell’rCBF. Dopo il trattamento con farmaci antipsicotici atipici, tuttavia, questa
relativa diminuzione rCBF era scomparsa (Konarski et al., 2005).
Studi preliminari in vivo hanno comprovato anormalità strutturali e funzionali
nei pazienti bipolari rispetto ai controlli sani. La diminuzione del volume del
cervelletto o la diminuzione del flusso ematico e l’aumento del metabolismo del
glucosio rappresentano il risultato principale in pazienti bipolari. Anche se
controversi, i risultati funzionali possono riflettere l’eterogeneità clinica delle
popolazioni bipolari studiate. Così, è possibile che l’ipermetabolismo cerebellare
sia un reperto limitato ai soggetti bipolare resistenti al trattamento (Konarski et
al., 2005).
Infine, non ci sono ancora prove riguardo al fatto che questi reperti siano la
causa o conseguenza della malattia.
37
Cervelletto e Depressione
Anomalie strutturali e funzionali della corteccia prefrontale, del sistema limbico
e dei gangli della base sono state spesso descritte nei pazienti con depressione
maggiore (Bugalho et al., 2006; Konarski et al., 2006).
Utilizzando un'analisi PET del flusso sanguigno regionale, Reiman e colleghi
hanno indagato i correlati neurofunzionali della emozioni generate da stimoli
esterni (Reiman et al.,1997).
Questi autori hanno valutato le reazioni in volontari sani provocate dalla visione
di film progettati per evocare una varietà di stati emotivi, quali felicità, tristezza
e disgusto. In aggiunta all’attivazione delle aree limbiche e paralimbiche, è stata
osservata anche un'attivazione degli emisferi cerebellari. Utilizzando un
paradigma simile, Lane e colleghi (1997) hanno allargato questi risultati
dimostrando che la tristezza provoca una maggiore attività nelle verme
cerebellare anteriore rispetto alla felicità.
In un'altra indagine PET, l’rCBF è stato comparata in soggetti con depressione
acuta e controlli sani prima e dopo una stato d'animo di sfida transitorio. In
accordo con i risultati ottenuti con fMRI, i pazienti con depressione mostravano
un minore rCBF nel cervelletto e nel talamo (Liotti et al., 2002).
Dolan e colleghi sono stati i primi a segnalare un aumento del flusso sanguigno
cerebrale del verme rispetto a quello basale in un sottoinsieme dei pazienti con
depressione e cognitive impairment (Konarski et al., 2005; Dolan et al., 1998).
Ulteriori dati recenti suggeriscono che questo aumento tonico dell'attività
cerebellare è caratteristico della depressione maggiore, indipendentemente
dallo stato d'animo o dall’assunzione di farmaci (Konarski et al., 2005).
Più recentemente, studi di risonanza magnetica hanno mostrato una riduzione
del volume del cervelletto nei pazienti con depressione unipolare. Ci sono dati
che suggeriscono che l'atrofia cerebellare sia correlata alla gravità e alla
resistenza al trattamento con antidepressivi (Sassi et al. 2001). Una recente
indagine di risonanza magnetica ha rivelato una correlazione negativa tra il
volume totale del tessuto cerebellare e punteggi di depressione baseline. Nello
stesso studio, mediante un’analisi PET, sono stati correlati i deficit cognitivi in
38
pazienti depressi alla minore attività della corteccia cerebellare (Sassi et al.
2001).
Dati emergenti suggeriscono che il cervelletto è coinvolto nella identificazione ed
espressione delle emozioni (Schmahmann et al., 2007; Bugalho et al., 2006),
soprattutto l’espressione della tristezza, sembra essere alterata sia nella
depressione grave che in quella resistente. Alcuni studi ipotizzano che la
riduzione della comprensione dell'espressione emozionale potrebbe essere, in
parte, causata da un danno nel collegamento funzionale tra il cervelletto e il lobo
frontale (Schmahmann et al., 2007; Agid et al., 2003; Beyer et al., 2002).
Tuttavia, non ci sono ancora dati che mostrano se queste alterazioni siano un
fattore di rischio per lo sviluppo di depressione o se sono già presenti prima
dell’inizio della malattia, o, ancora, se siano una conseguenza della malattia.
Cervelletto e Disturbi d’ansia
Il cervelletto potrebbe giocare un ruolo importante nelle manifestazioni d'ansia,
per esempio nei sintomi di ipereccitazione, che sono presenti in diversi disturbi
come il disturbo post-traumatico da stress (PTSD) e il disturbo d’ansia
generalizzata (GAD) (Abadie et al., 1999). Prove recenti suggeriscono che il
cervelletto potrebbe essere coinvolto nella fisiopatologia del PTSD. De Bellis e
Kuchibhatla hanno evidenziato una riduzione del volume di entrambi gli
emisferi del cervelletto nei bambini con PTSD secondario a maltrattamenti (De
Bellis et al., 2006).
Inoltre, in un caso clinico, è stato osservato l’aumento dell'attivazione del
cervelletto, del precuneo e della corteccia motoria supplementare in risposta ai
fleshback del trauma (Fernandez et al., 2001). Questa iperattività è scomparsa
dopo un trattamento di successo con fluoxetina. Inoltre, in soggetti adulti con
recente insorgenza di PTSD è stato trovato un aumento bilaterale della
perfusione nel cervelletto a riposo in rapporto alla SPECT (tomografia
computerizzata) rispetto sia a soggetti che hanno vissuto l’evento traumatico ma
non hanno sviluppato PTSD, sia a soggetti che non che hanno vissuto l’evento
traumatico (Bonne et al., 2003).
39
Ancora, attraverso immagini ottenute tramite risonanza magnetica funzionale
(fMRI), in un sottogruppo di soggetti disturbo borderline di personalità in
comorbidità al PTSD, si è evidenziata un'iperattività nei lobi temporali anteriori,
nelle aree temporali mediali, nell’amigdala, nel cingolo posteriore, nelle aree
occipitali e nel cervelletto in risposta al fleshback del trauma (Driessen et al.,
2004).
Studi che hanno coinvolto soggetti con PTSD legato ad eventi bellici
suggeriscono una maggiore sensibilità del sistema nervoso simpatico che è più
evidente in condizioni sperimentali, di stress o imprese difficili (De Bellis et al.,
2006). Inoltre, l'attività del verme cerebellare è aumentata durante il
rilassamento con biofeedback (Critchley et al., 2001) mentre l’emisfero
cerebellare sinistro è attivato durante risposte simpatiche discrete di
conduttanza cutanea (Critchley et al., 2000). In uno studio PET, la pressione
arteriosa media e la frequenza cardiaca correlavano con l'attività del verme e
degli emisferi cerebellari, quando i soggetti svolgevano un esercizio fisico
isometrico e una prova mentale aritmetica distraente (Critchley et al., 2000),
suggerendo un ruolo del cervelletto nella regolazione simpatica. Un altro studio
suggerisce che l'ansia sociale, indotta da una prova di aritmetica mentale è stata
associata con l'attivazione del cervelletto e di altre strutture come la corteccia
prefrontale, il talamo, l’insula e lo striato ventrale (Kilts et al., 2006). In un altro
studio PET, i pazienti con disturbo d’attacco di panico hanno mostrato un alto
livello d’ansia prima della scansione ed hanno presentato più alti livelli del
metabolismo di glucosio nell'amigdala bilaterale, nell’ippocampo, nel talamo, nel
mesencefalo,nel ponte caudale, nel midollo e nel cervelletto rispetto ai controlli
(Sakai et al., 2005). Il volume del cervelletto sembra essere ridotto, ma più
attivato in alcuni compiti in pazienti con disturbi d'ansia.
40
Cervelletto, invecchiamento e patologie degenerative
Durante l’invecchiamento si rileva un calo dei volumi cerebellari (Fabbro et al.,
2000). Nelle persone anziane sane i sintomi cerebellari diventano più
significativi (Raji et al., 2009). Il cervelletto ha un ruolo nell’apprendimento
cognitivo associativo (Kodama et al., 2002) e nella working memory (Drepper et
al., 1999). In uno studio di 228 di soggetti anziani di Ravizza e colleghi (2006), il
volume della materia grigia nel cervelletto è risultato correlare con le capacità
cognitive generali in persone anziane sane, con un rapporto più forte negli
uomini.
Le demenze costituiscono un gruppo eterogeneo di condizioni neurologiche e
condividono compromissioni cognitive ad eziologia organica. Anche se diverse
cause e diversi meccanismi fisiopatologici sono alla base delle manifestazioni
cliniche di diversi tipi di demenza, studi di neuroimaging hanno confermato
alcuni risultati comuni, come l'atrofia di certe strutture cerebrali o anche atrofia
cerebrale globale e la progressiva compromissione di diversi domini cognitivo
(Tamai, 2002).
Nei pazienti con demenza il volume del cervelletto sembra essere ridotto.
L'ipotesi più frequente è legata alla diaschisi. Un’altra ipotesi è che l'atrofia
cerebellare è dovuta a fattori vascolari, fattori molecolari (i meccanismi
fisiopatologici della demenza interessano direttamente cervelletto) o da tossine
(ad esempio, demenza alcolica) (Landgrebe et al. 2006).
Tuttavia, nella maggior parte degli studi, queste alterazioni sono state rilevate
solo nelle fasi tardive della malattia (Wegiel et al. 1999; Ackermann et al., 1995).
Nelle fasi tardive della malattia d’Alzheimer (AD), le strutture cerebrali
interconnesse con il cervelletto sono colpite da grovigli neurofibrillari e perdite
neuronali. E’ possibile che le variazioni atrofiche nelle strutture cerebrali
potrebbero essere alla base dei cambiamenti atrofici nel cervelletto (Wegiel et
al.,1999). Un classico e vistoso cambiamento neuropatologico nell’AD è
rappresentato dalla presenza di depositi di placche di beta-amiloide e grovigli
neuro-fibrillari nelle regioni neocorticale e subcorticali, ma poichè questi
processi patologici non sono presenti nel cervelletto (Wegiel et al.,1999) esso
41
rappresenta una struttura unica in termini di manifestazioni patologiche dell’
AD.
C'è una forte correlazione tra la perdita di cellule dei granuli e la durata dell’AD.
Inoltre, anche se il cervelletto è virtualmente libero dalla patologia
neurofibrillare, la significatività dell’atrofia cerebellare è strettamente correlata
con la durata e lo stadio della malattia (Wegiel et al.,1999). Nella maggior parte
degli studi, l’atrofia del cervelletto è evidente solo negli stadi tardivi del disturbo
(Ackermann et al.,1995; Aylward et al.,1999; Azzarelli et al., 1985; Rowe et al.,
2008).
Le fibre rampicanti, provenienti dal nucleo olivare inferiore, agiscono come un
potente pathway eccitatorio sulle cellule del Purkinje della corteccia cerebellare
che possono svolgere un ruolo sostanziale nelle prestazioni e
nell’apprendimento di nuove abilità motorie. Nella demenza vascolare, le
alterazioni vascolari presenti possono indurre ipossia o fenomeni ischemici
multipli, per esempio nel sistema olivo-cerebellare, poiché colpiscono le fibre
rampicanti nel loro cammino verso lo strato molecolare della corteccia
cerebellare(Baloyannis et al., 2007).
Di conseguenza, queste alterazioni possono essere correlate almeno in parte ad
alcuni sintomi in questi pazienti.
In casi di autopsia di demenza vascolare, l'applicazione della tecnica di
impregnazione argentica e della microscopia elettronica ha rivelato una
sostanziale diminuzione del numero di fibre rampicanti nella corteccia del
verme, nel flocculo e negli emisferi cerebellari (Baloyannis et al., 2007). La
varicosità presinaptica ed i terminali sinaptici delle fibre rampicanti sui dendriti
delle cellula di Purkinje risultano diminuiti di numero e caratterizzati da una
marcata povertà di vescicole sinaptiche (Baloyannis et al., 2007). La fessura
sinaptica risulta anormale nella maggior parte dei casi e più ampia di 20 nm.
Inoltre, sono state osservate anomalie mitocondriali, come presenza di
mitocondri allungati con rottura del cristallo sia nei rami terminali delle
arborizzazioni delle fibre rampicanti che nelle componenti presinaptiche. I
capillari sanguigni della membrana basale mostrano un notevole ispessimento e
una proliferazione degli astrociti perivascolari, mentre le giunzioni strette tra le
42
cellule endoteliali risultano ultrastrutturalmente intatte (Baloyannis et al.,
2007).
In sintesi, il cervelletto sembra essere implicato nelle manifestazioni
sintomatiche tipiche delle fasi tardive della demenza, probabilmente a causa
dell’atrofia delle strutture superiori e della diffusione della malattia. Baldaçara et
al. (2008), non hanno trovato studi che esaminano la relazione tra il volume del
cervelletto e la prognosi in diversi tipi di demenza. Dal momento che la prognosi
di demenza è fortemente associata a deficit prestazionali delle attività
quotidiane, che, a loro volta, sono legati alle funzioni motorie, si potrebbe
ipotizzare che danni al cervelletto possono correlare negativamente con la
prognosi.
Deficit cognitivi o sintomi psichiatrici sono stati rilevati in circa la metà di tutti i
casi in uno studio di Liszewski e colleghi del 2004, in cui veniva stimato il livello
di impairment cognitivo e la presenza di disturbi psichiatrici in un gruppo di
pazienti con degenerazione cerebellare.
In questo studio la depressione e i sintomi depressivi sono stati i fenomeni
psichiatrici non cognitivi più comunemente osservati, ma sono stati rilevati
anche cambiamenti di personalità, ansia e psicosi. Questi risultati sono coerenti
con l’ipotesi che le malattie che implicano la degenerazione cerebrale, e in
misura minore la degenerazione cerebellare stessa, provocano un alto livello di
fenomeni psichiatrici e cognitivi, e questi fenomeni hanno una gravità e una
rilevanza clinica sufficiente per essere rilevati durante la valutazione
neurologica di routine.
I disturbi psichiatrici associati a degenerazione cerebellare sono stati rilevati
molto meno frequentemente nel corso della valutazione neurologica di routine
rispetto alla sistematica valutazione psicopatologica (Leroi et al., 2002).
Inaspettatamente, però, il numero di deficit cognitivi nei casi di degenerazione
cerebellare senza il coinvolgimento dei gangli della base era più o meno lo
stesso sia nel gruppo di pazienti con degenerazione cerebellare che in quello
con malattia di Huntington, mentre vi sono stati cambiamenti di personalità e
deficit cognitivi sostanzialmente più frequenti accompagnati da una tendenza
verso una maggiore severità della sintomatologia psicopatologica nei casi
malattia di Huntington (Liszewski et al., 2004). Mentre c’è difficoltà
43
nell’affermare che i sintomi depressivi o il disturbo depressivo vero e proprio
rilevati siano dovuti alla degenerazione cerebellare e non alla presenza di una
patologia cronica (Casse net al., 1995; Starkstein et al.,1993), le altre forme di
psicopatologia rilevate nei pazienti valutati nello studio di Liszewski et al., tra cui
i cambiamenti di personalità, i disturbi psicotici e le allucinazioni non sono
facilmente spiegabili come reazioni psicologiche alla malattia cronica, e si sono
verificate con maggiore frequenza rispetto alla popolazione generale (Eaton et
al., 1981). Questi dati supportano ulteriormente l’ipotesi che almeno una parte
dei sintomi psichiatrici nei disturbi dovuti a deterioramento cerebellare sono il
risultato diretto della degenerazione neuronale.
Le evidenze mostrano inoltre che la psicopatologia e il cognitive impairment
sono più frequenti nei pazienti affetti che presentavano anche un coinvolgimento
dei gangli basali. Questo risultato riflette la maggiore gravità delle patologie
neurodegenerative che coinvolgono i gangli della base o una più specifica
correlazione tra la patologia dei gangli basali e le anomalie cognitive e
psichiatriche (Liszewski et al., 2004).
In un altro studio del 2002, Leroi e colleghi hanno ipotizzato che soggetti con
patologia degenerativa cerebellare avrebbero alterazioni psicopatologiche più
frequenti e più gravi rispetto a soggetti neurologicamente sani. Gli autori
avevano anche ipotizzato che queste alterazioni psicopatologiche sarebbero
meno prominenti nei pazienti con malattia cerebellare degenerativa rispetto a
soggetti con corea di Huntington, o con disturbi che causano anche
degenerazione dei gangli basali, con relativo risparmio del cervelletto (Folstein
et al., 1989; Ross et al., 1997). I risultati hanno confermato la loro prima ipotesi,
cioè che le alterazioni psicopatologiche sono più frequenti nei pazienti con
patologia cerebellare degenerativa. Mentre per quanto riguarda la seconda
ipotesi, cioè che le alterazioni psicopatologiche sarebbero meno prominenti nei
pazienti con malattia cerebellare degenerativa rispetto a soggetti con corea di
Huntington, o con degenerazione dei gangli basali, contrariamente alle
aspettative e agli studi precedentemente citati, le alterazioni psicopatologiche
nei due gruppi di pazienti sembrano essere sovrapponibili, anche se nei pazienti
con degenerazione cerebellari le alterazioni erano meno gravi e un po’ diversi
per tipologia (Leroi, O’Hearn, Marsh et al., 2002).
44
Cervelletto e Deficit di Attenzione e Iperattività
La disfunzione dei sistemi di neurotrasmissione noradrenergici e/o
dopaminergici è stata ampiamente considerata implicata nella manifestazione di
ADHD (Arnsten et al., 2006).
D'altronde, alcune teorie sulla suddetta sindrome si sono concentrate sul
disturbo funzionale frontale-sottocorticale, mentre studi strutturali e di
neuroimaging funzionale mostrano alterazioni della corteccia prefrontale, del
cingolo, dei gangli basali, del corpo calloso e del volume cerebrale totale
(Bugalho et al., 2006).
Valera e colleghi (2007) hanno condotto la prima meta-analisi dei risultati di
studi di neuroimaging strutturale in bambini e adolescenti con ADHD. Questa
meta-analisi ha evidenziato una riduzione globale del volume del cervello, con
importanti riduzioni che interessano perlopiù i volumi cerebrali totali e di
destra, le regioni cerebellari, lo splenio del corpo calloso, e il nucleo caudato di
destra.
Tuttavia, si sa relativamente poco su come le anomalie cerebrali nell’ADHD
cambiano nel corso della vita. In uno studio di Castellanos e colleghi (2002),
bambini e adolescenti con ADHD sono stati seguiti nel tempo utilizzando la
risonanza magnetica. Anomalie volumetriche nel cervello e nel cervelletto
persistevano con l'aumentare dell'età, mentre le differenze volumetriche
caratteristiche del nucleo caudato scomparivano. Pochi studi di neuroimaging
strutturale sono stati condotti su adulti con ADHD, ostacolando la nostra
comprensione delle traiettorie di sviluppo (Castellanos et al., 2002). In passato,
Seidman e colleghi (2006), hanno rilevato, in adulti con ADHD, riduzioni
volumetriche della corteccia frontale e cingolata anteriore.
L'associazione di ADHD con alterazioni del cervelletto è stata esplorata negli
ultimi dieci anni. Alcuni studi hanno dimostrato una riduzione del volume
cerebellare in pazienti affetti da ADHD rispetto ai controlli (Berquin et al., 1998;
Giedd et al., 2001). Questi risultati sono più specifici per gli emisferi cerebellari
post-inferiori e per il verme (Casey et al., 2007; Steinlin et al., 2007), inoltre è
stata riportata una correlazione negativa tra il volume cerebellare e le prove
attentive (Bugalho et al., 2006; Mackie et al., 2007) mentre, uno studio
45
funzionale ha dimostrato una riduzione dell’attività del cervelletto e del verme
(Mackie et al., 2007). D'altra parte, ci sono studi che dimostrano alterazioni
cognitive e del comportamento simili a quelle riportate nei pazienti con ADHD in
pazienti con lesioni cerebellari posteriori, ad esempio, difficoltà nella gestione
del tempo, difficoltà nel mantenere l'attenzione, difficoltà nei rapporti con
concetti astratti, impulsività, difficoltà di produzione e organizzazione (Bugalho
et al., 2006; Mackie et al., 2007).
In sintesi, i progressi nella ricerca di neuroimaging hanno aiutato a chiarire la
neurobiologia della ADHD. Ci sono studi che provano come la disregolazione
noradrenergicha e/o dopaminergica, così come le anomalie strutturali cerebrali
e cerebellari possono essere probabilmente legate alla fisiopatologia della ADHD.
Cervelletto e Disturbi dello Spettro Autistico
I pazienti con autismo (adulti e bambini) mostrano una riduzione della densità
delle cellule del Purkinje nella corteccia cerebellare (Catani et al., 2008). Essi
presentano anche inclusioni citoplasmatiche nelle cellule di Purkinje, una
riduzione del numero di cellule, materia grigia ectopica nei nuclei profondi del
cervelletto mentre, nella materia bianca cerebellare, si sviluppa un intenso
processo neuroinfiammatorio (Palmen et al., 2004).
Bauman e Kemper (1985, 1990) e Ritvo et al. (1986) hanno evidenziato che
questi pazienti hanno una riduzione del 50-60 % del numero delle cellule del
verme posteriore e degli emisferi cerebellari. Courchesne e colleghi (1994),
utilizzando planimetria MRI computerizzata, hanno riscontrato valori anormali
per i lobi del verme inferiore (VI e VII).
Nella sindrome di Asperger, si è rilevata una possibile anomalia nello sviluppo
delle reti cerebello-frontali, e vi è il sospetto che tale anomalia possa
compromettere l’attivazione cerebrale durante compiti cognitivi e motori.
Anomalie della materia bianca sono state trovate in specifici circuiti neuronali
del cervelletto, in particolare sono state localizzate nella via principale di
deflusso del cervelletto; ciò potrebbe impedire alla corteccia cerebrale di
ricevere i feedback di retroazione cerebellare necessari per la riuscita di
comportamenti di adattamento sociale (Catani et al., 2008; Palmen et al., 2004).
46
A conferma di ciò, alcuni studi (Palmenet al., 2004; Sivaswamy et al., 2010),
hanno rilevato che i bambini con disturbo dello spettro autistico hanno anomalie
istopatologiche nei peduncoli superiore del cervelletto (alterazioni
microstrutturali dell'integrità di questa via di uscita), hanno anche alterazioni
nell’organizzazione delle fibre afferenti dei peduncoli cerebellari medi e
inferiori, che connettono il cervelletto al lobo frontale. Le fibre sono organizzate
in modo diverso, ma non è ancora chiaro se questa alterazione sia o meno una
conseguenza secondaria, dovuta ai cambiamenti delle strutture corticali o
sottocorticali (Baldaçara et al., 2008).
Queste e altre evidenze, che suggeriscono che la presenza di danni cerebellari
può contribuire all’impairment delle abilità di mentalizzazione, hanno spinto gli
studiosi a indagare sugli aspetti dell’empatia e del riconoscimento emotivo in
gruppi di pazienti con danno cerebellare (Roldan Gerschcovich et al., 2011;
Garrard et al., 2008; Van Harskamp et al., 2005; D’Agata e colleghi, 2011;
Sokolovsky et al., 2010).
Cervelletto e percezione del dolore
Come risulta da studi fMRI effettuati sul dolore, il cervelletto è implicato
nell’elaborazione di stimoli nocivi (Apkarian et al., 2005) poiché esso si attiva sia
in presenza di dolore acuto che in presenza di dolore cronico (Moulton et al.,
2010; Saab et Willis, 2003). Il dolore, descritto come "una esperienza multi-
dimensionale che comprende una componente di discriminazione sensoriale,
una valutazione motivazionale-affettiva e una componente cognitiva" (Melzack
et al., 1968). Giunti al cervelletto, gli stimoli nocicettivi vengono modulati e poi
inviati alla corteccia. Il cervelletto risponde in modo differenziato agli stimoli
innocui e a quelli nocicettivi; infatti, l'elaborazione di tali stimoli avviene in
diverse aree del cervelletto (Helmchen et al. 2003; Helmechen et al., 2004).
47
Cervelletto e linguaggio
Alcuni deficit linguistici sono associati a malattie o danni al cervelletto (De Smet
et al.,2009). La parte destra del cervelletto, di solito, aiuta a modulare i processi
linguistici non motori e le funzioni cognitive in virtù delle connessioni
reciproche che ha con specifiche parti del cervello, quindi il cervelletto
modulerebbe (anziché generare) i processi linguistici e cognitivi e funge da
interfaccia tra la cognizione e l’esecuzione (Murdoch, 2010).
I deficit linguistici che si verificano in seguito a lesioni cerebellari sono, quindi,
diversi da quelli prodotti da lesioni corticali. Le lesioni cerebellari causano una
forma di "incoordinazione linguistica" o grossolanità (Silveri et Misciagna,
2000). Non di rado i pazienti con danno cerebellare hanno problemi con la
sintassi e nell’associare verbi a nomi (Cook et al., 2004; Fiez et al., 1992; Leggio
et al.,2000).
48
2. Sindrome Cerebellare Cognitiva Affettiva
I pazienti con danno cerebellare presentano tipicamente la sindrome cerebellare
motoria caratterizzata da dismetria, disartria e atassia ma, le lesioni cerebellari
possono anche comportare deficit delle funzioni superiori. Queste osservazioni
hanno rilevanza per la teoria della “dismetria del pensiero” (Schmahmann, 1991,
1996), che postula un ruolo del cervelletto nelle funzioni cognitive ed emotive in
aggiunta a quello tradizionalmente riconosciuto nel controllo motorio. La teoria
della dismetria del pensiero è basata sulla caratteristica uniformità della
corteccia cerebellare, sulla ricca eterogeneità di connessioni cerebellari e sulla
sua organizzazione topografica funzionale (Stoodley e Schmahmann 2010).
Il sistema di circuiti neurali che collega la corteccia prefrontale, quella
temporale, quella parietale posteriore e la corteccia limbica con il cervelletto
spiegherebbe l’instaurarsi di tale sintomatologia, ad esempio, i deficit motori
sono il risultato di lesioni che interrompono la comunicazione cerebellare con i
sistemi motori, i deficit cognitivi sono il risultato di lesioni che interrompono la
comunicazione cerebellare con le aree associative della corteccia cerebrale e,
infine, i disturbi psichiatrici risultano da lesioni della linea mediana del verme
cerebellare che interrompono la comunicazione con la neocorteccia e con il
sistema limbico (Stoodley e Schmahmann 2010).
In passato, gli studi che hanno indagato il ruolo del cervelletto nelle funzioni
superiori hanno spesso assunto una forma aneddotica con scarse verifiche
cliniche; per queste ragioni l’ipotesi di un contributo cerebellare alle funzioni
cognitive ed emotive ha impiegato molto tempo per guadagnare l’interesse della
comunità scientifica.
Recentemente, prove del contributo cerebellare alle funzioni superiori sono
state raccolte attraverso l’osservazione di quei pazienti con degenerazione o
ictus cerebellare che presentano vere e proprie disfunzioni cognitive legate alla
malattia cerebellare stessa. Kish e colleghi (1988) e Bracke-Tolkmitt e colleghi
(1989) hanno rilevato, in pazienti con atrofia olivopontocerebellare, difficoltà
nella formazione di concetti, nell'apprendimento di coppie di parole e
deterioramento intellettivo generalizzato. In altri studi i pazienti con atrofia
della corteccia cerebellare hanno mostrato compromissione nelle funzioni
49
esecutive, dimostrate da un aumento di latenza nei tempi di pianificazione
durante l’esecuzione del test della Torre di Hanoi (Grafman et al., 1992) e da
scarse prestazioni ottente nei test di fluidità (difficoltà all'avvio e errori di
perseverazione) e nei subtest della Mattis Dementia Rating Scale (Appollonio et
al., 1993).
I deficit spaziali visivi sono stati invece descritti, in seguito alla rimozione di
tumori nell’emisfero cerebellare sinistro (Wallesch e Horn, 1990), in seguito a
intossicazione cronica da fenitoina (Botez et al., 1985) e dopo un infarto nel
territorio dell'arteria cerebellare superiore sinistra (Botez-Marquard et al.,
1994).
L’elaborazione linguistica è risultata deficitaria nei pazienti con infarto
cerebellare destro, come evidenziato dalla possibile presenza di agrammatismo
(Silveri et al., 1994) e dalla difficoltà nella percezione degli errori nei compiti di
apprendimento associato di un verbo-per-sostantivo (Fiez et al., 1992).
Gravi deficit del linguaggio sono stati rilevati anche in bambini con lesioni
cerebellari. In seguito alla rimozione di tumori cerebellari sono stati riscontrati
mutismo e disartria (Kingma et al., 1994; van Dongen et al., 1994; Pollack et al.,
1995), accompagnati in molti casi da cambiamenti di personalità, labilità
emotiva e dalla difficoltà nella messa in atto di movimenti volontari (Pollack et
al., 1995). Anche Levisohn et al. (1997) hanno rilevato problemi nella
produzione linguistica e nelle funzioni visuo-spaziali nei bambini che hanno
subito l'asportazione di tumori cerebellari. Inoltre, gli autori hanno notato
drammatiche altalene dell'umore e vertigini insolite in otto dei 14 pazienti con
danni al verme, mentre i cambiamenti di personalità non erano presenti quando
il verme rimaneva intatto.
Mediante studi morfometrici e di neuroimaging, è stata evidenziata la presenza
di anomalie del cervelletto in pazienti con autismo infantile precoce (Bauman e
Kemper, 1985; Courchesne et al., 1988). Queste ed altre osservazioni cliniche
preliminari, sostenute da esperimenti di neuroimaging funzionale che mostrano
l'attivazione cerebellare evocata da compiti non-motori (Petersen et al., 1989;
Allen et al., 1997; Fiez e Raichle, 1997; Parsons e Fox, 1997), da reperti
anatomici, da nozioni fisiologiche e da studi comportamentali e teorici,
50
(Schmahmann 1996, 1997b) suggeriscono un ruolo del cervelletto
nell’elaborazione cognitiva ed emozionale.
Tuttavia, un dubbio condiviso da molti clinici e ricercatori, è quello che riguarda
la scarsità di casi clinicamente rilevanti che confermino la possibilità di un
contributo cerebellare ai compiti non-motori. La rilevazione di lievi deficit
ottenuta esclusivamente attraverso test neuropsicologici sembra essere una
ragione insufficiente per giustificare una revisione così drastica del ruolo del
cervelletto.
Proprio allo scopo di delineare un modello valido e clinicamente rilevante di
cambiamenti cognitivi e comportamentali in questi pazienti Schmahmann e
Sherman (1998) hanno eseguito esami neurologici, test di valutazione dello
stato mentale e valutazioni neuropsicologiche su pazienti con isolata patologia al
cervelletto. I loro risultati depongono a favore di un modello di comportamento
anomalo definito “sindrome cerebellare cognitivo affettiva”, che include
disfunzioni nelle funzioni esecutive (pianificazione, set-shifting, ragionamento
astratto, fluenza verbale, memoria di lavoro), spesso con perseverazione,
distrazione o disattenzione, disorganizzazione visuo-spaziale e compromissione
della memoria visuo-spaziale; cambiamenti di personalità con ottundimento
affettivo, comportamento disinibito e inappropriato, difficoltà nella produzione
linguistica, compresi disprosodia, agrammatismo e anomia mite. L'effetto netto
di questi disturbi delle funzioni cognitive sembra essere dovuto a un
peggioramento generale delle funzioni intellettuali. Questi risultati sono stati
rilevati più facilmente nei pazienti con malattia acuta e con danno bilaterale. Le
lesioni del lobo posteriore sono risultate particolarmente importanti
nell’insorgenza della sindrome, mentre il verme è risultato sistematicamente
compromesso in quei pazienti con pronunciate disfunzioni affettive.
Queste implicazioni sulle funzioni esecutive, spaziali, linguistiche ed affettive
definiscono la sindrome cerebellare cognitivo affettiva e la distinguono da stati
confusionali non specifici o da presunti casi di demenza. La vigilanza e
l’attenzione non sono ridotte. La memoria episodica retrograda e quella
semantica sono conservate e le capacità di apprendimento sono soltanto
lievemente interessate. Altri fenomeni “corticali” sono in gran parte assenti,
come l’afasia, l’aprassia e l’agnosia. Inoltre, la sindrome cerebellare cognitivo
51
affettivo è distinguibile da altre sindromi “sottocorticali” in virtù del complesso
sintomatologico costituito dai disturbi esecutivi e spaziali insieme a quelli delle
funzioni linguistiche ed affettive (Schmahmann e Sherman, 1998).
E 'importante notare che questi disturbi sono stati rilevati con test di routine
dello stato mentale esguiti al letto del paziente ma anche con test
neuropsicologici standardizzati delle funzioni cognitive. E 'anche importante
notare che i deficit osservati non possono essere spiegati con le difficoltà nel
controllo motorio. In molti casi, infatti, l’incoordinazione motoria è risultata
assai lieve all’osservazione clinica. L’incapacità motoria non spiegherebbe,
quindi il punteggio anomalo del QI verbale (in cui le risposte sono verbali e non
cronometrate), l’impairment nei compiti di ordinamento e completamento di
figure (dove la richiesta motoria è minima) o lo scarso rendimento al Boston
Naming test. In quei test neuropsicologici in cui c’è una componente motoria
significativa, ad esempio il test di Rey, il Trail Making Test e i Labirinti di
Porteus, e risultato evidente dalle prestazioni dei pazienti che le loro difficoltà
non era dovute alle richieste motorie del compito. Ad esempio, nella copia della
figura di Rey un paziente ha attribuito la sua difficoltà ad un’incapacità
nell’apprezzare la struttura organizzativa della figura e nella pianificazione della
copia della figura. L'esecuzione dei movimenti motori necessari per copiare il
progetto era, al contrario, abbastanza irrilevante. Analogamente, nell’esecuzione
dei Labirinti di Porteus, i pazienti non hanno avuto difficoltà a tracciare il
traggitto, ma piuttosto i loro errori sono stati il risultato di una scarsa capacità di
pianificazione: spesso i pazienti si bloccavano durante il percorso e avevano
bisogno di effettuare diversi tentativi per trovare la giusta soluzione. Questi
risultati suggeriscono che questi pazienti hanno difficoltà con la pianificazione e
l'integrazione delle risposte cognitive. Questi deficit non sono così sottili da
poter essere rilevati solo dai test che indagano funzioni cognitive di livello
elevato. Piuttosto, tali deficit clinicamente rilevanti, venivano anche notati dai
membri della famiglia e dal personale medico e paramedico, oltre ad essere
rilevabili con l'esame dello stato mentale effettuato al letto del pazientie.
Le prestazioni neurocomportamentali deficitarie di questi pazienti sono risultate
più marcate e generalizzate nei pazienti con gravi danni bilaterali o
52
pancerebellari e, in particolare, in quelli con la patologie cerebellari ad
insorgenza acuta.
Le lesioni del lobo posteriore sono risultate particolarmente significative
nell’insorgenza di disturbi comportamentali e cognitivi, mentre il verme è
risultato costantemente interessato nei pazienti con disturbi affettivi. Le lesioni
al lobo anteriore sembravano essere meno importanti nella generazione di
questi deficit cognitivi e comportamentali.
Pur nella sua importanza, questo studio che abbiamo dettagliatamente descritto
non consente di ricavare conclusioni definitive a causa dell'assenza di un gruppo
di controllo e dell'eterogeneità della popolazione di pazienti. Per questo motivo,
Wolf e collaboratori (2009) hanno condotto una revisione sistematica della
letteratura esaminando la componente affettiva della sindrome cerebellare
cognitivo affettivo.
Gli autori si sono concentrati su studi effettuati con adeguati gruppi di controllo.
Nel dettaglio, essi hanno esaminato cinque studi effettuati su popolazioni di
pazienti con atassia spino-cerebellare nei quali sono state utilizzate misure
standardizzate per valutare la sintomatologia affettiva: i pazienti con patologia
cerebellare hanno registrato punteggi più alti per la depressione e l’ansia
ottenuti con una serie di diversi test autosomministrati (Kish et al., 1988; Berent
et al., 1990; Leroi et al., 2002) ma non in tutti gli studi (White et al., 2000). I
cambiamenti di personalità e l'apatia sono stati riportati in un unico studio
(Leroi et al., 2002).
Wolf e colleghi (2009) hanno anche esaminato cinque studi su pazienti con
lesioni cerebellari. Due di questi studi (Gomez et al., 1997; Turner et al., 2007)
non hanno evidenziato differenze per i punteggi di ansia o depressione
(utilizzando le scale di Hamilton per ansia e depressione) tra pazienti con lesioni
cerebellari e un gruppo di controllo sano, al contrario, in un studio su pazienti
ospedalizzati effettuato mediante utilizzo del questionario Profile of Mood States
(POMS) sono stati rilevati sintomi depressivi significativamente più alti rispetto
ai partecipanti sani (Gottwald et al., 2004). Il tasso e il decorso della depressione
erano diversi in un gruppo di pazienti che avevano avuto ictus al tronco
encefalico o al cervelletto rispetto a pazienti con ictus dell'arteria cerebrale
media (Starkstein et al.,1988). I pazienti colpiti da ictus cerebellare differivano
53
nella loro risposta emotiva rispetto al gruppo di controllo (Turner et al., 2007).
La possibilità di mettere in comune il punteggio HAM-D di tre studi disponibili
ha palesato la significatività statistica di questi risultati in cui i punteggi per la
depressione risultavano lievemente più alti nei pazienti con malattie del
cervelletto rispetto ai gruppi di confronto. È stato possibile, inoltre, evidenziare
le prove sperimentali a sostegno del ruolo del cervelletto nella sindrome
affettiva nei pazienti con danno cerebellare. Ciò è coerente con le relazioni
cliniche di molti casi che riferiscono sintomi affettivi nei pazienti con patologia
cerebellare. Questi casi clinici descrivono una vasta gamma di tali sintomi, tra cui
depressione e ansia (Turkel et al., 2004; Richter et al., 2005; Lasek et al., 2006;
Zawacki et al., 2002) mancanza di emozioni (Aarsen et al., 2004) e
disregolazione affettiva (Schmahmann e Sherman, 1998; Levisohn et al., 2000). I
sintomi psicotici e i cambiamenti di personalità descritti in letteratura
comprendono anche deliri (De Michele et al., 2003) ideazioni paranoiche,
allucinazione (Rolfs et al., 2003; Liszewski et al., 2004) apatia (Turkel et al.,
2004), disinibizione, (Schmahmann e Sherman, 1998) irritabilità (Riva et al.,
2000) e "cambio di personalità” (Liszewski et al., 2004).
Vista la variabilità dei risultati e l’eterogeneità delle conseguenze legate a danno
cerebellare, gli studi futuri dovrebbero approfondire la specificità di determinate
lesioni che sembrano maggiormente implicate nell’insorgenza dei sintomi
affettivi. A questo proposito, vi sono evidenze dell’importanza del verme
(Schmahmann e Sherman, 1998) e ciò non è sorprende viste le sue abbondanti
connessioni con il sistema limbico (Schmahmann, 1997).
54
3. Elaborazione emotiva
Secondo una storica definizione di Kleinginna e Kleinginna (1981) le emozioni
corrispondono ad un insieme complesso di interazioni tra fattori soggettivi ed
oggettivi, mediato da sistemi neuronali e ormonali, che possono evocare
esperienze affettive come i sentimenti di piacere/dispiacere, generare processi
cognitivi e percettivi salienti da un punto di vista affettivo, attivare significativi
adattamenti fisiologici e indurre reazioni comportamentali che sono spesso, ma
non sempre, esperienze finalizzate ed adattive. Secondo questi autori, le
emozioni sarebbero, quindi, finalizzate alla produzione di risposte reattive
distinte ed avrebbero una funzione adattiva specifica: permettere all’organismo
di reagire in maniera efficace ed appropriata alle stimolazioni ambientali
(Kleinginna e Kleinginna, 1981).
La maggior parte degli studiosi è d'accordo sul fatto che le emozioni abbiano una
natura complessa e che derivino da una combinazione di fattori fisici e cognitivi.
La componente fisica prevale nelle emozioni fisiche o primarie, mentre
l’elaborazione cognitiva diviene via via più articolata nelle emozioni più complesse
(Rosalind, 1997). Inoltre, le emozioni possono essere analizzate qualitativamente,
ma l'analisi quantitativa è ben più difficile. Le emozioni differiscono anche in termini
di intensità. Secondo una concezione popolare, basata su una chiave interpretativa
di tipo “valenza-eccitazione”, esse sono definite in uno spazio multi-dimensionale. La
valenza definisce se l'emozione è positiva o negativa, e in che misura. L’eccitazione
definisce l'intensità dell'emozione e va dalla calma, considerata il valore minimo,
all’eccitazione, valore massimo (Holzapfel et al., 2002).
Le teorie filogenetiche suddividono le emozioni in "emozioni primarie” o
“universali", quelle cioè che sono più direttamente orientate alla sopravvivenza e
che sono preselezionate a livello della specie (la paura in situazioni pericolose o il
desiderio sessuale), "emozioni di ordine superiore" o “sociali” o, ancora,
“secondarie”, che sono, ovviamente, strettamente legate ad una valenza adattiva e
che sono apprese in un determinato contesto (come ad esempio la vergogna) e
“emozioni background” che hanno come fine il mantenimento dell’omeostasi
dell’organismo e vengono indotte dall’organismo stesso (Stevens & Price, 1996;
Damasio, 1994; 2000).
55
3.1 Modelli neurali delle emozioni
Ormai da diversi anni, le ricerche sulle basi neurali delle emozioni hanno
riscosso un notevole e crescente interesse. Tradizionalmente, i substrati neurali
delle emozioni e dell’elaborazione emotiva sono stati definiti da modelli basati
su studi effettuati sugli animali o sulle lesioni cerebrali (Papez, 1973; MacLean,
1952; LeDoux , 1996), che, in gran parte, coinvolgono il sistema limbico.
Nel 1937 Papez, avanzò una teoria che spiegava l’esperienza soggettiva delle
emozioni in termini di connessioni anatomiche: il Circuito di Papez. Questo
circuito, costituito dai nuclei anteriori del talamo, dalla corteccia cingolata
anteriore, dall’ippocampo, dal fornice, dall’ipotalamo e dai nuclei posteriori del
talamo sarebbe, secondo Papez, fondamentale per la genesi e il mantenimento
delle emozioni e per far sì che uno stimolo sensoriale assuma valenza emotiva
(Papez, 1937).
In seguito, nel 1949, MacLean riprese ed ampliò la teoria di Papez, includendo in
esso la corteccia limbica e le sue regioni subcorticali, l’amigdala, il setto e la
corteccia prefrontale e dandogli il nome si sistema limbico (MacLean, 1952).
Anche se il concetto di sistema limbico continua a permeare,, la sua validità è
stata messa in discussione sia anatomicamente (LeDoux, 1991; Reiner, 1990)
che teoricamente (Calder, Lawrence, & Young, 2001).
Studi recenti nel campo delle neuroscienze affettive, infatti, suggeriscono che il
modello del sistema limbico potrebbe non essere più sufficiente, almeno nella
sua forma più specifica (Damasio, 1998; Panksepp, 2000).
Recentemente, la ricerca è stata aiutata dalla comparsa di tecniche di
neuroimaging funzionale, come la tomografia a emissione di positroni (PET) e la
risonanza magnetica funzionale (fMRI), che possono verificare le ipotesi circa i
substrati neurali delle emozioni in soggetti sani. Grazie a queste nuove tecniche
sono stati avanzati numerosi modelli alternativi a quello del singolo sistema.
Uno dei primi modelli è quello della lateralizzazione dell’emozione: l'ipotesi
dell’emisfero destro (RH) (Mills, 1912; Sackeim & Gur, 1978; Schwartz,
Davidson, e Maer, 1975). Nella sua forma originale, questa ipotesi evidenziava
56
un ruolo critico per l’emisfero destro in tutti gli aspetti del processo emozionale,
sia per le emozioni positive che per quelle negative.
Più recentemente, diverse varianti di questa prima ipotesi hanno cominciato ad
emergere. Per esempio, alcuni studiosi sostengono che l'emisfero destro può
essere più specificamente relativo alla percezione ed espressione delle emozioni,
piuttosto che alla loro esperienza, e che le regioni posteriori possono essere
particolarmente importanti (Adolphs, Damasio, Tranel, e Damasio, 1996; Borod
et al., 1998; Borod et al., 2001; Heller, Nitschke, & Miller, 1998).
Studi precedenti hanno dimostrato che il danno all'emisfero destro può
compromettere l'elaborazione dei volti o scene emotive (DeKosky et al., 1980) e
che la stimolazione elettrica dei lobi temporali legati alla corteccia visiva può
interrompere l'elaborazione di espressioni facciali (Fried et al., 1982).
Recentemente molti studiosi si sono concentrati sul riconoscimento visivo delle
emozioni comunicate da espressioni facciali. L’incapacità selettiva nel
riconoscere le espressioni facciali, risparmiando la capacità di riconoscere
l'identità, può verificarsi dopo lesioni temporo-parietali dell’emisfero destro
(Bowers et al., 1985). Inoltre, è stata segnalata, in seguito a lesioni del giro
temporale medio destro, anomia specifica per le espressioni facciali emotive
(Rapcsak et al., 1989, 1993). L'evidenza che la corteccia temporale destra sia
importante nel processamento emotivo dell’espressioni facciali è corroborata
dai dati di imaging PET (Gur et al., 1994) e la registrazione neuronale (Ojemann
et al., 1992) negli esseri umani.
Teorie alternative di lateralizzazione dell’emozione sono state presentate da
altri ricercatori (per esempio, Buck, 1999; Gainotti, Caltagirone, e Zoccolotti,
1993; Silberman & Weingartner, 1986). Una convergenza di evidenze,
proveniente da studi su pazienti con danno cerebrale (Robinson & Manes, 2000),
da studi comportamentali di pazienti con disturbi emotivi (Heller & Nitschke,
1997), e indagini EEG su neonati, volontari sani e popolazioni cliniche di adulti e
scimmie Rhesus (Davidson, 1984; Fox & Davidson, 1986; Kalin, Larson, Shelton,
e Davidson, 1998), suggerisce che le emozioni positive e negative sono
implementate da sistemi neurali che sono almeno parzialmente separabili.
Alcuni modelli non specificano l'esatta rappresentazione neurale delle emozioni
positive e negative in ogni dettaglio e sono diversi solo per i presunti substrati,
57
mentre altri assumono il coinvolgimento differenziale dell'emisfero sinistro (LH)
e dell’emisfero destro (RH) nella codifica delle diverse dimensioni di
un'emozione (Davidson, 1984; Sackeim et al., 1982).
La teoria più influente e ben illustrata delle teorie dimensionali è il modello della
asimmetria di valenza (Davidson, 1984). Questo modello ipotizza che le regioni
corticali di sinistra e quelle di destra danno contributi diversi all’elaborazione
delle emozioni positive e negative con specifico coinvolgimento, rispettivamente,
delle regioni cerebrali anteriori o frontali.
Eppure, altri teorici dimensionali hanno sostenuto che le emozioni e il
comportamento umano più in generale, sono processi psicologici organizzati
intorno alle tendenze del processo di “avvicinamento” o “ritirata” (Carver,
Sutton, e Scheier, 2000; Davidson, 1998; Lang, Bradley, & Cuthbert, 1997;
Schmidt & Schulkin, 2000). Il sistema di “avvicinamento” facilita i
comportamenti appetitivi o goal-directed e genera alcune forme di emozioni
positive connesse all’avvicinamento (Davidson & Irwin, 1999). Il sistema di
“ritirata”, invece, facilita il ritiro di un individuo da fonti di stimolazione
avversiva e genera alcune forme di emozioni negative che sono legate al ritiro
(Davidson & Irwin, 1999). Diversi clinici e teorici ha proposto distinte basi
neuroanatomiche per la motivazione all’avvicinamento e alla ritirata (Cloninger,
1987 per i sistemi di attivazione e di inibizione comportamentale; Davidson,
1998 per i sistemi di avvicinamento e di ritirata; Gray, 1982 per i sistemi che
sottendono i comportamenti di avvcinamento e inibizione; Lang, Bradley, &
Cuthbert, 1990 per i sistemi di avvicinamento e ritirata).
In diretto contrasto con i modelli tridimensionali delle emozioni, le correnti
categoriche sostengono l'esistenza di un piccolo insieme di emozioni discrete
mediato dai programmi affettivi principali (Darwin, 1872; Ekman, 1992, 1999;
Izard, 1971; Panksepp, 2000; Tomkins, 1982). I programmi affettivi di Ekman
comprendono le emozioni di paura, disgusto, rabbia, felicità, tristezza e sorpresa
(Ekman e Friesen, 1982; Ortony & Turner, 1990).
Il termine “programma affettivo” si riferisce a un meccanismo (neurale), che
memorizza i modelli e innesca risposte emotive complesse che sono spesso
veloci, complesse, organizzate e difficili da controllare. La base per un
programma affettivo limitato a un insieme di emozioni nasce dalla ricerca che
58
designa che esse rimangono invariante da cultura a cultura e sono rappresentate
da particolari espressioni facciali (Ekman, 1992; Izard, 1971).
Ekman (1999) ha sostenuto che un obiettivo importante della ricerca
neuroscientifica dovrebbe essere quello di identificare i modelli unici della
attività dei sistemi neuronali di ciascun programma affettivo delle emozioni.
Negli ultimi anni, sono stati compiuti progressi su questo fronte. A differenza
delle essenziali dimensioni delle emozioni, che sono state collegate ad attività
neurale su base emisferica, le emozioni discrete sono state collegate all’attività di
discrete regioni o sistemi neurali. L'amigdala, per esempio, si ritiene che sia
fondamentale per l'elaborazione della paura (LeDoux, 2000) e che la sua attività
riflette la predisposizione ad uno stile affettivo (Davidson 1999); la corteccia
prefrontale mediale sembrerebbe avere un ruolo specifico per le emozioni legate
al decision making (Damasio, 1994) ed alla autoregolazione emozionale
(Davidson et al., 2000); l'insula sembrerebbe essere la "centrale di allarme" in
quanto integra gli stimoli somatici interni con l'esperienza emotiva (Damasio,
1999) ed è stato collegata specificamente al disgusto (Phillips et al., 1997).
Inoltre, attraverso lo studio di casi neuropsicologici, Calder e colleghi (2001)
hanno osservato che la compromissione nel riconoscimento delle espressioni
facciali delle emozioni discrete e dell'esperienza emotiva può essere collegata a
lesioni cerebrali specifiche. Ciò è stato avvalorato in maniera più efficace per le
emozioni della paura (Adolphs, 1999; Adolphs, Tranel, Damasio, e Damasio,
1994; Adolphs, Tranel, et al., 1999; Bechara et al., 1995; Calder et al., 1996 ;
Schmolck & Squire, 2001; Sprengelmeyer et al., 1999) e del disgusto (Calder,
Keane, Manes, Antoun, & Young, 2000; Gray, Young, Barker, Curtis, e Gibson,
1997). Ad esempio, le lesioni all'amigdala e nelle regioni circostanti producono
deficit nel riconoscimento delle espressioni facciali di paura, così come le
risposte di paura, mentre lesioni a livello dei circuiti che comprendono l'insula
gustativa e i gangli basali portano a deficit nel riconoscerimento dei segnali di
disgusto e nelle risposte di disgusto. Malgrado alcuni lavori preliminari hanno
iniziato a mostrare che anche la rabbia può essere legata all'attività di un sistema
neurale distinto (Lawrence, Calder, Mc-Gowan, e Grasby, 2002), non sono ancora
stati identificate le regioni considerate critica per il riconoscimento della felicità,
della tristezza o della sorpresa.
59
3.2 Contributi cerebellari ai meccanismi neuronali delle
emozioni
Nel 1937, Papez, in una pioneristica pubblicazione, descrisse, con eccezionale
lungimiranza, un circuito nel proencefalo che egli considerava fondamentale per
il benessere emozionale dell’individuo. Egli ipotizzava che “oltre a partecipare
all’espressione emotiva, l’ipotalamo, i nuclei anteriori del talamo, il giro del
cingolo, l’ippocampo e le loro interconnessioni costituissero un armonioso
meccanismo che poteva elaborare le funzioni delle emozioni principali”. Egli
metteva in evidenza il fatto che, queste regioni, filogeneticamente più antiche,
erano interconnesse attraverso fasci di fibre quali il fornice, il tratto mammillo-
talamico, il fascio mediano proencefalico e il cingolo e che tali connessioni
fossero fondamentali alla loro integrità funzionale (Papez, 1973). Nonostante
Papez non parlò mai dell’influenza che il cervelletto può avere su tale circuito,
egli era consapevole che le varie modalità sensoriali, inclusa la propriocezione,
possono toccare queste aree, come dimostra la sua dichiarazione: “si può inferire
che gli impulsi propriocettivi sono così portati all’interno del corpo mammillare
(dal lamnisco mediale)”.
Partendo da tale presupposto Snider e Maiti, in uno studio del 1976, riassumono
alcune ricerche in cui viene supposto che il cervelletto potrebbe influenzare
l’attività o delle regioni intrinseche al cosiddetto Circuito di Papez (PZ) o di
quelle regioni prevalentemente collegate ad esso. Attraverso questa metanalisi, è
possibile osservare come l’influenza del cervelletto sulle varie sottostrutture del
Circuito di Papez è dimostrata attraverso diverse tecniche di indagine (Snider
and Maiti, 1976).
Studi anatomici dimostrano che le principali aree mesencefaliche al quale il PZ
proietta sono: l'area ventrale tegmentale, l’area interpeduncolare e l’area del
grigio periacquedutturale; e queste stesse regioni proiettano, a loro volta, al
sistema limbico (Nauta, 1958; Fink and Heimer, 1967; Papez, 1973; Snider,
1975).
Papez (1973) elencò le principali connessioni discendenti all’area ventral-
tegmentale (VTA) e ai nuclei interpeduncolari (IP). Nauta (1958) aggiunse i
nuclei tegmentali dorsale (DT) e ventrale (VT), l’area del grigio
60
periacquedutturale (PQ), e dimostrò che queste aree proiettano a loro volta e in
maniera significativa al sistema limbico.
Secondo Snider e Maiti il VTA è l’area in cui si trovano la maggior parte delle
connessioni sinaptiche con le fibre discendenti dal Circuito di Papez (PZ) e
suggerisco che in tale area ci sono forti interazioni con le fibre cerebellari
efferenti. La seconda area, per numerosità di connessioni, in cui proiettano le
fibre discendenti provenienti dal PZ è il nucleo interpeduncolare. Perlomeno,
alcune cellule in tutte e tre i nuclei cerebellari sembrano proiettare fibre al IP
con considerevoli sovrapposizioni dei terreni finali. Comunque, la densità
dell’area dei DT varia al variare della suddivisione. Nella parte dorsale c’è una
dominanza di terminazioni fastigiali mentre, nella parte laterale, dove terminano
le fibre del fascicolo retroflesso al quale proiettano NI e ND, c’è una dominanza
di terminazioni NI e ND (Snider e Maiti, 1976).
Studi elettrofisiologici dimostrano che la stimolazione del verme e del nucleo del
fastigo induce risposte evocate nell’amigdala basolaterale, nell’ippocampo, e nel
setto. Attraverso una revisione dalla letteratura sul funzionamento fisiologico di
queste aree si è evidenziato che la stimolazione elettronica del cervelletto,
specialmente del verme, può influenzare un ampio range di risposte che
coinvolgono le attività funzionali sia del sistema nervoso parasimpatico che di
quello simpatico (Whiteside e Snider, 1953; Anand et al., 1959; Iwata e Sniser,
1959; Mutani, 1967; Babb et al., 1974).
Studi sugli afterdischarges (scariche di impulsi nervosi dopo la cessazione dello
stimolo iniziale) effettuati su animali, a cui venivano eseguite induzioni
elettriche nel setto, nell’ippocampo, e nell’amigdala, dimostrano che le
stimolazioni cerebellari possono ridurre gli afterdischarges, e il luogo della
soglia minima è la corteccia mediana. Il raffreddamento focale del verme
promuove il prolungamento degli afterdischerges come pretrattamento degli
animali con 6-OH-dopamina. Lesioni chimiche nel sistema delle catecolamine
indotte dal 6-OH-dopamina riducono l’efficacia delle stimolazioni cerebellari,
così come avviene in seguito alle lesioni del nucleo del fastigio. Questi dati sono
interpretati per dimostrare che il cervelletto può esercitare un’influenza di
soppressoione o inibizione tonica sulle sottostrutture con il circuito di Papez
(Goodfellow e Niemer, 1961; Maiti e Snider, 1975).
61
Studi comportamentali sugli animali dimostrano che la stimolazione elettrica del
cervelletto anteriore può indurre risposte come un arousal, un attacco
predatorio e un’azione finalizzata alla alimentazione che imitano quelli ottenuti
con la stimolazione dell'amigdala. La stimolazione del nucleo del fastigio può
produrre sonnolenza e cambiamenti nel tracciato EEG che assomigliano ai
patterns del sonno derivanti dalla stimolazione dell’amigdala ventrale (Moruzzi,
1940, 1947; Ferrier, 1876; Mussen, 1927; Zanchetti e Zoccolini, 1954; Papez,
1973; Nauta, 1958; Rasheed et al., 1970; Hoffer et al., 1972; Martner, 1975; Rei
set al., 1973; Berntson et al., 1973; Ball et al., 1974; Micco, 1974; Maksburg,
1969; Kaada, 1972; Kriendler e Steriade, 1964; Manzoni et al., 1968).
Moruzzi (1958) ha dimostrato che la stimolazione del verme cerebellare, ma non
degli emisferi, interferisce con le reazioni autonomiche, limitando le oscillazioni
della pressione sanguigna e inducendo iperventilazione. Inoltre, la stessa
stimolazione influisce sulla 'finta rabbia' che si verifica spontaneamente nel
“gatti talamici” e che è caratterizzata da scoppi di forza accumulata che li fa
sembrare animali infuriati. Dopo la stimolazione del verme le risposte
autonomiche che consistono nell’aumento della pressione arteriosa e nella
midriasi e retrazione della palpebra risultano chiaramente inibite. Pertanto,
Moruzzi (1938) ha suggerito che il cervelletto agisce su un insieme di risposte
comportamentali che appartengono a una complessa reazione autonomica.
La dimostrazione di connessioni anatomiche tra il nucleo del fastigio e
l'ipotalamo (Snider 1950) ha suggerito che l'area del verme del cervelletto è
coinvolto nella manifestazione emotiva (Sacchetti et al. 2005). Una crescente
quantità di prove ha confermato che il cervelletto è infatti coinvolto nel
comportamento emotivo e in particolare nei processi paura-correlati (Snider e
Maiti 1976, Bernston Torello e 1982, Supple et al. 1987). Inoltre la sindrome
cerebellare cognitivo affettiva, che si verifica quando le lesioni coinvolgono il
verme e il nucleo del fastigio, implica, in adulti e bambini, una disregolazione
degli affetti (Schmahmann e Sherman 1998). Dopo la grande quantità di
osservazioni che sostengono il ruolo del cervelletto nei processi emozionali è
stata formulata l'ipotesi del "cervelletto limbico" (verme e nucleo del fastigio)
come parte del Circuito di Papez (Bernston Torello 1982).
62
3.3 Cervelletto e elaborazione emotiva
Il campo delle neuroscienze affettive ha, dunque, compiuto progressi nel chiarire
i substrati neurali delle emozioni. Per esempio, Schmahmann (1991) ha
proposto che il verme cerebellare può essere coinvolto nei circuiti delle
emozioni "primitive", mentre gli emisferi cerebellari modulano le "funzioni
cognitive superiori", tra cui pensiero, la pianificazione, l'apprendimento, e il
linguaggio (Schmahmann, 1991).
Recenti studi in vivo su soggetti umani cercano di approfondire il ruolo del
cervelletto nel processo emozionale e cognitivo. Studi di neuroimaging rivelano
un pattern di attivazione in diverse regioni del cervelletto in seguito a
stimolazioni dolorose e durante processi di apprendimento (Ploghaus et al.
1999, 2000, 2003). Stimoli dolorosi, provocati da calore insopportabile, attivano
il cervelletto anteriore intorno al verme; mentre, un segnale sensoriale che
anticipa la stimolazione dolorosa porta all'attivazione del verme cerebellare
posteriore (Ploghaus et al. 1999, 2000). Pertanto, le regioni vicine ma separate
sono impegnate durante l'esperienza di paura e apprendimento associativo, cioè
alcune zone del cervelletto umano si attivano durante i processi associativi
indipendenti dalla regolamentazione diretta dei processi motori/autonomici
(Strata et al., 2011).
Damasio e colleghi (2000) hanno riportato una marcata attivazione della linea
mediana del cervelletto durante il richiamo mentale emotivo di episodi
personali. Gli autori hanno utilizzato l'imaging funzionale per confrontare le
regioni cerebrali attivate da un episodio neutro e quelle attivate da un episodio
di richiamo per le emozioni personali. Essi hanno concluso che "anche se il
cervelletto non è stato incluso nella ipotesi, le componenti evolutivamente più
antiche del cervelletto probabilmente sono coinvolte nel coordinamento delle
risposte emotive e nella regolazione di quelle risposte apprese in un contesto
sociale".
Più recentemente, Singer e colleghi (2004) hanno utilizzato l’imaging funzionale
per valutare l'attività cerebrale mentre soggetti sani venivano sottoposti a
stimolo dolorosi e mentre guardavano il loro partner ricevere uno stimolo
doloroso. Tra le altre strutture, il cervelletto anteriore intorno al verme si
63
attivava nei soggetti trattati con la stimolazione dolorosa, mentre il verme
cerebellare posteriore si attivava negli stessi soggetti quando vedevano il dolore
degli altri. Questi risultati suggeriscono che il cervelletto possa essere coinvolto
anche nell'esperienza empatica legate al dolore.
Tuttavia, il solo utilizzo di studi di imaging consente inferenze di tipo
correlazionale; è perciò importante abbinare a tali studi le valutazioni cliniche
delle conseguenze del danno cerebellare. Il primo studio che combina l'uso di
imaging funzionale e l’osservazione clinica di pazienti con lesioni al cervelletto,
allo scopo di chiarire il ruolo del cervelletto nella modulazione di reti neurali che
servono alla elaborazione di materiale emozionale è quello di Turner e colleghi
(2007). Questo studio rivela un fenomeno interessante: le lesioni del cervelletto
non sembrano influenzare la normale capacità di provare emozioni spiacevoli,
ma sono associati ad una ridotta capacità di provare quelle piacevoli.
I pazienti con lesioni cerebellari che hanno partecipato a questo studio,
percepivano la rilevanza emotiva degli stimoli presentati con successo. Tuttavia,
nonostante la percezione normale, i pazienti con lesioni del cervelletto
mostravano compromissione nella risposta all'esperienza soggettiva di
sensazioni piacevoli in risposta a stimoli che evocano felicità. La loro esperienza
soggettiva emotiva a stimoli spiacevoli non era diversa da quella dei soggetti di
controllo appaiati per età. Tuttavia, la risposta "normale" emozionale a stimoli
spiacevoli nei pazienti con danno cerebellare è stata realizzata in associazione
con un relativo aumento dell’attività nella corteccia prefrontale e insulare, nel
talamo e nei gangli basali, e in associazione con un relativo abbassamento
dell’attività dell'amigdala e di altre regioni limbiche e paralimbiche. Quindi,
mentre i pazienti con lesioni cerebellari potrebbero sperimentare sensazioni
sgradevoli in risposta a stimoli spiacevoli, essi non riescono a reclutare le
strutture cerebrali che normalmente sarebbero ingaggiate per la risposta
emotiva (es. amigdala), e invece reclutano un circuito limbico "alternativo"
costituito dalla corteccia ventromediale prefrontale, dal’insula e dal giro del
cingolo (Turner et al. 2007).
L'ipotesi che i sistemi cerebrali che sottendono all'elaborazione di contenuti
emozionali hanno capacità di adattamento è coerente con le risposte neurali
degli anziani impegnati nella elaborazione visiva di materiale emotivo (Tessitore
64
et al., 2005). Tessitore e colleghi hanno interpretato “la diminuita attività
dell’amigdala ventrale e l’aumento dell'attività della corteccia prefrontale” nei
soggetti anziani come un effetto della "dinamica di adattamento della rete" del
cervello di “fine-vita”.
I risultati dello studio di Turner e colleghi (2007) suggeriscono che il ruolo del
cervelletto nella coordinazione dell'attività mentale (Ito, 1993) si estende a una
rete dinamica per l'elaborazione stimoli con valenza emotiva. Quando il
cervelletto è danneggiato, questa rete tenta di attivare connessioni alternative da
coinvolgere nella risposta adattativa. Quando il cervelletto è danneggiato, questa
rete tenta di impostare, esternamente ad essa, nodi alternativi da coinvolgere
nella risposta adattativa. Quindi, questi risultati, ampliano e chiariscono i dati
crescenti provenienti da studi di neuroimaging funzionale che mostrano un
aumenti del flusso sanguigno cerebrale anche in associazione con la valutazione
di immagini emozionali con valenza spiacevole (Paradiso et al., 1999, 2003b),
ma in associazione con l'apprezzamento di battute umoristiche (Goel e Dolan,
2001), e sono coerenti con un ruolo del cervelletto come regolatore per i sistemi
neurali associati con le risposte agli stimoli gratificanti, comprese le droghe (Sell
et al., 1999; Volkow et al ., 2003), i soldi (Martin-solch et al., 2001), e l'orgasmo
(Holstege et al., 2003).
Non è chiaro perché, in questa popolazione di pazienti, le risposte emotive
positive sono ridotte e quelle negative invece sono conservate. Heath e colleghi
(Heath, Franklin, Walker, & Keating, 1982) postularono che l'atrofia del
cervelletto può ridurre la sua influenza inibitoria sulle regioni prefrontali e la
sua influenza “facilitatrice” sui sistemi di ricompensa (per esempio, il nucleo
accumbens). Infatti le lesioni del cervelletto hanno dimostrato di provocare
diminuzione della dopamina, un modulatore implicato nelle risposte
dell'amigdala agli stimoli potenzialmente attivanti (Rosenkranz & Grace, 2002;
Tessitore et al., 2002), dei livelli di noradrenalina nel proencefalo e nel talamo e
un aumento dei livelli di serotonina nel talamo (Albert, Dempesy, & Sorenson,
1985; Cano, Garcia-Uria, Machado, e Reinoso-Suarez, 1980). Una eccitazione
ridotta dei sistemi di ricompensa in risposta agli stimoli dell'appetito potrebbe
spiegare il fallimento, nelle persone con ictus cerebellare, nel provare sensazioni
piacevoli attraverso stimoli che evocano, lasciando inalterata la loro capacità di
65
provare stimoli paurosi. Questa interpretazione, tuttavia, non spiega la bassa
attività dell'amigdala osservata in questi pazienti in associazione con la risposta
conservata e congruente agli stimoli spiacevoli. Una spiegazione di questo
fenomeno può essere legata all'evoluzione differenziale dei sistemi emozionali
all'interno del sistema nervoso. I dati di Turner e collaborarori sono coerenti con
l’ipotesi di Schmahmann (1991) che attribuirebbe al cervelletto il ruolo di
regolatore nella rete che sottende l'elaborazione di contenuti emozionali sia di
valenza positiva che negativa, anche se con conseguenze "comportamentale"
solo per gli stimoli piacevoli. La scoperta interessante è che "l'unica" anomalia
associata alla risposta degli stimoli negativi emerge a livello neurale.
Coerentemente con quanto confermato dal lavoro di Joseph LeDoux (1996), è
stato postulato da più studi (Ohman & Mineka, 2001; Paradiso et al., 1999) che la
capacita di elaborare stimoli potenzialmente pericoloso è una funzione
evolutivamente più vecchia e quindi più resistente. L’immediata consapevolezza
di pericolo (ad esempio, l'esperienza di paura improvvisa) promuove non solo la
sopravvivenza dell'individuo, ma, soprattutto, la sopravvivenza delle specie.
Quindi, un circuito di ridondanza o circuiti neurali di compensazione per paura
possono essersi sviluppati durante l’evoluzione di gran lunga prima rispetto a
strutture neurali necessarie per sperimentare la felicità. Diverse linee di ricerca
con le presentazioni di stimoli subliminali che inducono paura hanno suggerito
che i circuiti di compensazione potrebbero sfruttare i collegamenti diretti tra il
collicolo superiore, il pulvinar, ed il complesso amigdaleo (LeDoux, 1996;
LeDoux, 2000; Liddell et al. , 2005; Ohman, 2005; Ohman & Soares, 1994).
Stimoli subliminali che inducono paura ed espressioni di paura a bassa
frequenza spaziale hanno dimostrato di aggirare inizialmente la corteccia visiva
coinvolgendo una rete che comprende il collicolo superiore, il pulvinar,
l’amigdala e la corteccia prefrontale (Liddell et al., 2005; Morris, Ohman, &
Dolan, 1999; Vuilleumier, Armony, Autista, e Dolan, 2003).
Questi risultati inoltre supportano l'ipotesi che, nei pazienti con danno
crebellare rispondono a stimoli spiacevoli con una maggiore attività in
determinate aree (ad esempio, la parte ventrale della corteccia mediale
prefrontale e del pulvinar) che possono essere reclutate come meccanismo di
66
compensazione neurale responsabile della conservazione di risposte adeguate in
presenza di un potenziale pericolo.
Infine, è importante sottolineare che il modello complessivo di risposte affettive e
visive agli stimoli ad alta valenza emotiva nei pazienti con lesioni cerebellari era
simile a quello dei pazienti con schizofrenia (Crespo-Facorro et al., 2001; Paradiso et
al., 2003a) quando veniva loro chiesto di valutare gli stimoli piacevoli e spiacevoli.
Anche se indirettamente, i risultati di questo studio supportano l’ipotesi del ruolo
del cervelletto nella schizofrenia in termini di "dismetria cognitiva" (Andreasen et
al., 1999a; Andreasen et al., 1996a; Andreasen et al., 1998.) o "dismetria del
pensiero" (Schmahmann, 2004).
In conclusione, mentre il ruolo del cervelletto nella coordinazione motoria è
ampiamente accettato, l'idea che sia coinvolto in un'esperienza emotiva solo di
recente ha acquisito interesse. Il cervelletto, come distretto implicato nelle memorie
emotive, sembrerebbe quindi rivestire un ruolo importante nella complessa rete
neurale alla base del comportamento emotivo (Strata et al., 2011).
67
4. Riconoscimento delle emozioni
4.1 L’empatia
“L’empatia permette di sintonizzarsi in maniera naturale e spontanea con
qualsiasi pensiero o sentimento altrui. Essere empatici significa […] leggere il
clima emotivo che si stabilisce tra le persone, mettersi facilmente nei panni degli
altri, essere così sensibili da comprendere a fondo il loro stato d’animo e
interagire con loro senza ferirli ne offenderli”(Baron-Cohen, 2004).
L'empatia è senza dubbio una capacità importante sul piano adattivo. Ci
permette di entrare in sintonia con l’altro consentendoci di capire quello che
qualcun’altro sente, o quello che potrebbe pensare. L'empatia ci permette di
capire le intenzioni degli altri, di prevedere il loro comportamento e di vivere
un'emozione stimolata dalla loro emozione. In breve, l'empatia ci permette di
interagire in modo efficace nel mondo sociale. Essa è addirittura considerata il
"collante" del mondo sociale, fornendoci la possibilità di aiutare gli altri e la
capacità di fermarci prima di ferirli (Baron-Cohen and Wheelwright, 2004).
Considerando che il termine "simpatia" ha una lunga tradizione, il termine
"empatia" sorprendentemente è nato solo alla fine del secolo scorso.
Sorprendentemente, perché si pensa che questa capacità sia tanto antica quanto
lo stesso Homo sapiens (Baron-Cohen and Wheelwright, 2004). Tuttavia, la
parola "empatia" è stata “brevettata” da Titchener come traduzione della parola
tedesca "Einfuhlung," termine che deriva dall'estetica e significa "proiettare se
stessi in ciò che si osserva" (Titchener, 1909). Nonostante l'ovvia importanza,
l’empatia è un concetto difficile da definire. Esistono diverse definizioni di
empatia che riflettno la sua natura multidimensionale. Gli psicologi sociali hanno
concettualizzato l'empatia dividendola in due componenti principali, la prima
delle quali è quella cognitiva, che consente di comprendere i sentimenti degli
altri e di mettersi nei loro panni. Lo studioso Piaget (1937) definì questo aspetto
dell’empatia “decentramento” e “risposta non egocentrica”. Più di recente gli
psicologi dell’età evolutiva hanno spiegato che chi è dotato di empatia cognitiva
accede ad una “teoria della mente” ovvero è capace di “leggere la mente” altrui.
68
La letteratura sulla “teoria della mente” (o la capacità di considerare il contenuto
mentale delgi altri) si sovrappone con l'empatia cognitiva e, spesso, i termini
sono usati in modo intercambiabile. Possedere la componente cognitiva
dell’empatia significa attribuire all’altro uno stato mentale (atteggiamento) e, in
base all’esperienza personale, dedurre il probabile contenuto di quello stato
mentale. Inoltre, tale componente consente di prevedere il comportamento o lo
stato mentale degli altri (Davis, 1994; Wellman, 1990).
La seconda componente dell’empatia è quella affettiva, che consiste nel reagire
in maniera emotivamente appropriata allo stato psichico dell’altro. Risposte
emotive agli stati mentali degli altri possono essere classificate come: in
parallelo, quando la risposta corrisponde a quella del bersaglio (per esempio, la
sensazione di paura di un altro provaca spavento) e reattiva, che prevede di
andare oltre una semplice corrispondenza di affetti, come la simpatia o la
compassione (Davis, 1994). Ad esempio, la solidarietà è una delle possibili
risposte empatiche poiché comporta la partecipazione al dolore dell’altro e, al
tempo stesso, il desiderio di alleviare la sua sofferenza. Tuttavia, alcune risposte
emotive non sono considerate veramente empatiche, cioè la felicità per la
sfrotuna di un altro o, meno ovviamente, l’angoscia personale (Davis, 1980;
Eisenberg et al 1987). Quest'ultimo caso si verifica quando qualcuno ha uno
stato auto-orientato di 'disagio personale' in risposta allo stato negativo di altro
(Batson et al. 1987). Ciò che distingue questa da una risposta empatica è che è
“auto-orientata” piuttosto che “altro-orientata”. L’empatia è, quindi, una
caratteristica fondante dei rapporti umani perché impedisce di fare cose che
feriscano i sentimenti altrui.
L'approccio affettivo
L'approccio affettivo definisce l'empatia come la risposta emotiva di un
osservatore allo stato affettivo di un altro. Questa visione dell’empatia nasce
dagli scritti sulla simpatia (Smith, 1759). All’interno dell'approccio affettivo, le
diverse definizioni di empatia variano in base a quanto deve essere ampia o
stretta la risposta emotiva dell'osservatore rispetto all’emozione di un altro. Per
quanto possiamo vedere, ci sono quattro varietà di empatia: 1) la sensazione
69
nell'osservatore deve corrispondere a quello della persona osservata (ad
esempio, si sente paura quando si vede qualcun altro avere timore; Eisenberg &
Miller, 1987; Hoffman, 1984 ), 2) la sensazione nell'osservatore è semplicemente
adeguata allo stato emozionale di un'altra persona in qualche altro modo, anche
se non esattamente corrispondente (ad esempio, si può avere pietà di qualcuno
che è triste; Stotland, 1969), 3) La sensazione nell'osservatore deve essere uno
stato di preoccupazione o compassione per la sofferenza di un altro (Batson,
1991). 4) la emozione nell'osservatore può essere qualsiasi reazione emotiva
alle emozioni di un altro (ad esempio, l'osservatore sente piacere nel vedere il
dolore di un altro). Quest’’ultima viene definita come "empatia contrasto"
(Stotland, Sherman, & Shaver, 1971). Una definizione utile di empatia deve
comprendere tutto questo. Tuttavia, l’ultima definizione sembra discutibile. Gli
autori sostengono che l'empatia dovrebbe escludere le emozioni inappropriate
innescate dallo stato emotivo di qualcun altro (ad esempio, provare piacere nel
dolore di un altro). Piuttosto, la definizione di empatia affettiva sottolinea
l'adeguatezza della risposta emotiva dello spettatore. Naturalmente, definire ciò
che può essere considerato “una risposta emotiva adeguata” non è semplice. Ad
esempio, venire a conoscenza della morte di un giovane amico che era stato
colpito da una dolorosa malattia terminale potrebbe produrre sollievo (perché il
suo dolore è finito) e tristezza (perché la sua vita è stata stroncata). Entrambe le
emozioni sono risposte emotive adeguate e possono quindi essere classificate
come risposte empatiche (Baron-Cohen and Wheelwright, 2004).
L'approccio cognitivo
Le teorie cognitive sottolineano che l'empatia implica la comprensione sociale
dei sentimenti (Kohler, 1929). Queste teorie fanno riferimento anche ai processi
cognitivi, quali il role-taking, la capacità di prestare attenzione al punto di vista
dell’altro durante una conversazione (Mead, 1934), o "decentramento", cioè, la
capacità di rispondere non egocentricamente (Piaget, 1932). Durante gli anni
quaranta e cinquanta il termine "acuità sociale" è stato usato anche per riferirsi
all’empatia (Chapin, 1942; Dymond, 1950; Kerr & Speroff, 1954). Nella
terminologia recente, la componente cognitiva si riferisce all’utilizzo della
70
"teoria della mente" (Astington, Harris, e Olson, 1988; Wellman, 1990) o "lettura
della mente" (Baron-Cohen, 1995; Whiten, 1991). In sostanza, si tratta della
capacità di affrancarsi parzialmente dal proprio punto di vista attuale,
concentrandosi e facendo proprio uno stato mentale (o "atteggiamento")
dell'altra persona (Leslie, 1987), e quindi dedurre il probabile contenuto del suo
stato mentale, attraverso le conoscenze su quella persona. Per alcune correnti
questo processo appare puramente cognitivo in quanto non vi sarebbe alcun
riferimento a qualsiasi stato affettivo. Per esempio, una persona potrebbe
dedurre che, poiché John era assente durante un evento importante, non saprà
nulla di ciò che è avvenuto durante quell’evento. In aggiunta a questo processo di
comprensione e quello inferenziale, l'elemento cognitivo comporta anche la
capacità di prevedere il comportamento o lo stato mentale di un altro (Dennett,
1987). Così, tenendo conto dell’ignoranza di John a proposito del fatto che il
luogo di un appuntamento venga modificato, si può prevedere che John andrà al
posto sbagliato. Tuttavia, è chiaro che l'empatia è costituita da entrambe le
componenti affettive e cognitive (Davis, 1994). I modelli psicologici dell’empatia,
infatti, suggeriscono che essa è costituita sia da componenti cognitive che
emotive (Davis, 1994;. Rankin et al, 2005). L'empatia cognitiva è
concettualmente molto simile alla teoria della mente (ToM). In effetti, l'empatia
cognitiva può essere visto come la capacità specifica di mentalizzazione
dell'emozione (ToM). Recenti teorie hanno suggerito che la ToM è costituita da
due componenti: decodifica dello stato mentale (socio-percettivo) e deduzione
dello stato mentale (socio-cognitivo) (Tager-Flusberg e Sullivan, 2000; Sabbagh,
2004). Queste stesse componenti possono essere applicate anche all'empatia
cognitiva. La capacità socio-percettiva è importante per l’interpretazione delle
emozioni degli altri sulla base delle informazioni osservabili, come le espressioni
facciali o i gesti. La capacità socio-cognitiva richiede l'integrazione delle
informazioni contestuali e storiche sulla persona per capire i suoi sentimenti.
Per l'empatia cognitiva anche altre abilità cognitive come la memoria di lavoro e
l'attenzione possono essere considerate necessarie. L’empatia emozionale è un
altro costrutto, è la reazione emotiva e la preoccupazione emotiva sperimentata
all’idea di qualcuno in difficoltà. Dunque, secondo questo modello, mentre il
primo passo per avere una reazione empatica con i sentimenti di un'altra
71
persona è quello di percepire o dedurre le altrui emozioni (empatia cognitiva),
per una vera e propria risposta empatica, è essenziale una risposta fisiologica e
autonoma.
4.2 Substrati anatomici dell’empatia
L’applicazione delle acquisizioni e delle metodologie delle neuroscienze allo
studio della cognizione sociale ha permesso di rileggere costrutti psicologici
quali l’empatia sulla base di prove neuroscientifiche.
In una importante revisione della letteratura, Decety e Jackson (2004)
esaminano le linee convergenti di dati provenienti da studi di neuroimaging
funzionale e di lesione che suggeriscono che l'empatia deriva da tre principali
processi cognitivi. Nella prima fase, l'emozione dell’altro viene 'condivisa',
mediante l'attivazione di aree cerebrali coinvolte nell’esperienza emozionale
soggettiva come la corteccia frontale inferiore, la corteccia temporale superiore,
l’amigdala, la corteccia somatosensoriale destra, il polo temporale destro e
l’insula destra (Reiman et al. 1997, Carr et al., 2003). In secondo luogo, il
soggetto riconosce che l'agente di partenza dell'esperienza emotiva è un altro,
non lui stesso. Questa capacità di determinare che la fonte dell’emozione
internamente rappresentate o che l’ obiettivo previsto si trova all’esterno
rispetto a se stessi richiede la prospettiva di assunzione (PT), che sembra essere
mediata da un circuito cerebrale che comprende la corteccia prefrontale mediale
(Gallagher e Frith, 2003). Questo processo richiede anche la capacità di
attribuire la rappresentanza, capacità che è probabilmente mediata dalla area
associativa eteromodale a livello della giunzione temporale, dei lobi parietali e
occipitali (Farrer et al., 2003, Ruby e Decety, 2003, 2004, Saxe e Wexler, 2005).
Infine, la capacità di dedurre con precisione la prospettiva dell'altro richiede la
soppressione intenzionale della propria visione (Keysar et al., 2003; Royzman et
al., 2003, Van Boven e Loewenstein, 2003, Bernstein et al., 2004). Studi di lesione
sia funzionale e che di sviluppo negli esseri umani indicano che il polo frontale,
corrispondente all'incirca all’area 10 di Brodmann (BA 10), potrebbe eseguire
questa funzione di regolamentazione, cioè di inibire attivamente l’auto-
prospettiva per consentire di considerare la prospettiva dell'altro (Anderson et
72
al ., 1999, Moll et al., 2001, Ruby e Decety, 2003, 2004, Shamay-Tsoory et al.,
2003, 2005a).
Le attuali evidenze evolutive suggeriscono che ci sono diversi sistemi che
mediano l'empatia: il primo, filogeneticamente più antico, quello del contagio
emotivo e il secondo, quello cognitivo e più evoluto dell’ assunzione di
prospettiva (De Waal, 2007).
Il sistema essenziale di contagio emotivo è pensato per supportare la capacità di
immedesimarsi emotivamente ('sento ciò che senti'). Secondo l’ipotesi
percezione-azione di Preston e De Waal (2002), la percezione del
comportamento di un altro, attiva automaticamente le rappresentazioni per il
proprio comportamento, e l'output di questa rappresentazione condivisa viene
automaticamente processato nelle aree motorie del cervello dove si preparano le
risposte e la loro esecuzione. Questo stato di somiglianza di reazione è stata
legata alla teoria della simulazione e del sistema dei neuroni specchio (MNS)
(Gallese, 2007). La scoperta del MNS nella regione di F5 della scimmia e nel giro
frontale inferiore (IFG) nell'uomo dimostra che un meccanismo per la
traduzione viene automaticamente stimolato durante la visualizzazione delle
azioni degli altri. Mentre alcuni modelli per l'empatia non attribuiscono alcun
ruolo ai neuroni specchio motori, è stato dimostrato di recente che l’attivazione
del MNS motorio che coinvolge l'IFG si verifica non solo rispetto alle azioni
motorie, ma anche per la valutazione o il riconoscimento delle emozioni (Carr et
al., 2003; Seitz et al., 2008) e per l'empatia emozionale (Jabbi et al., 2007;
Schulte-Ruther et al., 2007). Mentre gli ultimi studi e altri studi (Wicker et al.,
2003; Singer et al., 2004) si sono anche concentrati sul ruolo dell'insula nella
simulazione di esperienze emotive degli altri, un recente studio ha sottolineato il
ruolo specifico dell’IFG nell’empatia emozionale (Schulte-Ruther et al., 2007).
Dati di neuroimaging funzionale che dimostrano l'attivazione del IFG sia durante
l'imitazione e la visione passiva di volti emotivi, sono in linea con questa visione
(Dapretto et al., 2006). Inoltre, Gazzola et al. (2006) hanno dimostrato che gli
individui che ottengono punteggi più alti in una scala che valuta l’empatia
cognitiva attivano maggiormente il MNS, mentre Kaplan e Iacoboni (2006)
riportano una correlazione tra alti punteggi nella misura dell’empatia
emozionale e l'attività del IFG durante la visione di sequenze d'azione. Così,
73
sembrerebbe che la struttura di base dell’empatia emozionale sia la IFG che
sembra essere coinvolto principalmente nel contagio emotivo e nel
riconoscimento delle emozioni.
Tuttavia, la risposta empatica umana è molto più che un puro contagio emotivo
(Stotland e Dunn, 1963) e coinvolge anche l'assunzione di prospettiva, funzione
più cognitiva. Così, il secondo sistema dell’empatia richiede le funzioni cognitive
più complesse, tra cui l'assunzione di prospettiva empatica e la mentalizzazione
(De Waal, 2007). Questo processo di comprensione della prospettiva di un'altra
persona, denominata 'empatia cognitiva' ('Capisco quello che senti') sembra
dipendere dalle funzioni cognitive superiori quali la flessibilità cognitiva (Decety
e Jackson, 2004). Gli studi di neuroimaging hanno coinvolto i lobi frontali mediali
negli esseri umani per lo svolgimento di un ruolo critico nella rete della 'teoria
della mente' (ToM) o 'mentalizzzione' (Gallagher e Frith, 2003). Tuttavia, altri
hanno messo in dubbio il ruolo di queste cortecce (Bird et al., 2004.).
Suggerendo che la giunzione temporoparietale (TPJ), (Saxe e Kanwisher, 2003;
Samson et al., 2004), così come il solco temporale superiore (STS); (Frith e Frith,
2003) sono coinvolti nella ToM. Tuttavia, è stato ripetutamente segnalato che
l'empatia cognitiva è legata alla Tom, o mentalizzazione, e che queste abilità
sono alterate nei pazienti con lesioni prefrontali ventromediali (VM) (Eslinger,
1998; Shamay-Tsoory et al., 2003).
In accordo con ciò, un aumento dell’attivazione dell’area VM durante un compito
di mentalizzazione, segnalato negli studi fMRI (Mitchell et al., 2006), supporta
ulteriormente il ruolo di questa regione nell’empatia cognitiva e nella Tom.
Danni all’area VM sono stati correlati alla compromissione del decision-making
(Bechara et al., 1998; Fellows e Farah, 2007; Koenigs e Tranel, 2007) e nella
messa in atto di giudizi morali di convenienza (Koenigs et al., 2007), funzioni
cognitive relative alla metacognizione.
Collettivamente, le evidenze neuroanatomiche indicano due possibili sistemi per
l’empatia: un sistema emozionale, che coinvolge l'IFG, e un sistema più cognitivo
che coinvolge la VM. Inoltre, la distinzione tra l’empatia emotiva e cognitiva è
coerente con i dati di sviluppo e di sotto-processo filogenetico. Considerando che
il contagio emotivo, minimo comune denominatore di tutte le risposte
empatiche, è riportato negli uccelli e nei roditori, mentre la capacità
74
dell’assunzione di prospettiva si manifesta solo nei mammiferi filogeneticamente
più evoluti, come le grandi scimmie (De Waal, 2007). Inoltre, evolutivamente, i
bambini mostrano contagio emotivo in risposta alla sofferenza di un altro
individuo senza essere in grado di separare il proprio e l'altrui disagio (Singer,
2006). Solo più tardi, durante l'infanzia e l'adolescenza gli individui diventano
sempre più capace di cogliere il punto di vista individuale dell'altro (Hoffman,
1977; Preston e de Waal, 2002; Gallese, 2003; Decety e Jackson, 2004).
Diversi modelli teorici hanno affrontato la questione dei distinti aspetti
emozionali e cognitivi del trattamento dell’empatia (Adams, 2001; Preston e de
Waal, 2002; Decety e Jackson, 2004; Leiberg e Anders, 2006). La maggior parte
dei modelli sostiene un quadro teorico in cui il processo empatico implica un
incrociato di componenti emotive e cognitive che si intrecciano funzionalmente
per per consentire le funzioni empatiche. Tuttavia, nessuno di questi modelli
affronta direttamente il rapporto tra gli aspetti cognitivi ed emotivi dell’empatia.
Due modelli potenziali possono descrivere la possibile relazione tra empatia
emotiva e cognitiva. Il primo rapporto possibile tra l'empatia emotiva e cognitiva
è quello di 'dipendenza'. Dall’idea che l’empatia emotiva è anteriore, più
automatica e fondamentale sia evolutivamente che fisiologicamente rispetto
all’empatia cognitiva, può essere proposto che l'empatia cognitiva si basa,
oppure può seguire, il contagio emotivo di base e quindi l'elaborazione emotiva
empatica è una pre-condizione per l'empatia cognitiva. Secondo questa
formulazione, i deficit nell’empatia emozionale necessariamente si traducono in
disturbi dell’empatia cognitiva. Un secondo, altrettanto plausibile modello
teorico è quello di 'esclusività'. Questo modello suggerisce che l'empatia emotiva
e cognitiva hanno differenti origini neurali. L'implicazione di questo modello
sarebbe che le lesioni che possano compromettere l'empatia emotiva, non
avranno effetto sulle abilità cognitive empatiche e viceversa (Simone et al.,
2008).
Mentre gli studi di neuroimaging fino ad oggi sono sempre più in grado di
caratterizzare le reti neurali coinvolte nell’empatia emozionale e cognitiva
(Hynes et al., 2006; Vollm et al., 2006; Schulte-Ruther et al., 2007), solo studi di
lesione possono verificare direttamente se l'empatia emotiva è 'necessaria' per
l'empatia cognitiva o se esiste una doppia dissociazione, neuroanatomica e
75
comportamentale, tra queste due componenti. Molti disturbi neuropsichiatrici
sono associati al deficit empatico, inclusa la schizofrenia, la sindrome di
Asperger, la sociopatia, le lesioni cerebrali post-traumatiche e gli ictus. Tuttavia,
solo pochi studi di hanno valutato la correlazione cervello-empatia nei gruppi di
pazienti (Shamay-Tsoory et al., 2003, 2005a), e la maggior parte di essi non
misurano l'empatia in soggetti tipici o l’impegno nel comportamento empatico
nella vita reale.
Nonostante la perdita di empatia sia un sintomo diffuso in seguito a danno
cerebrale, solo pochi studi descrittivi hanno esaminato direttamente le strutture
cerebrali che mediano la perdita di empatia. Per esempio, nella degenerazione
lobare frontotemporale (FTLD), una malattia neurodegenerativa focale che
interessa principalmente i lobi frontali e temporali, la perdita di empatia è un
sintomo precoce e centrale. I pazienti con danno soprattutto FTLD mostrano un
drammatico aumento del “distacco interpersonale” (Rankin et al., 2003) e hanno
livelli cognitivi ed emotivi patologicamente bassi di empatia, mentre i pazienti
con atrofia frontale FTLD sembrano perdere principalmente la capacità empatica
di PT, ma non diventare significativamente più distaccati. In uno studio di
quattro casi di pazienti FTLD, Perry e colleghi (2001) hanno trovato che i
pazienti con danni alla corteccia temporale dell'emisfero non-linguistico
dominante mostrano significativi deficit di empatia (Perry et al., 2001).
Così, sia i dati ottenuti attraverso lo studio di pazienti che quelli ottenuti
attraverso neuroimaging funzionale suggeriscono che un circuito presente nelle
regioni cerebrali dei lobi temporale, parietale e frontale, il giro fronatle inferiore,
sia implicate nelle funzioni empatiche; tuttavia, rimane comunque necessario lo
studio di ulteriori dati provenienti da studi di pazienti con lesioni.
76
4.3 Empatia e cervelletto
I disordini di diversi aspetti della teoria della mente e dell’empatia sono stati
descritti in pazienti affetti da lesioni a livello della corteccia prefrontale ventrale
(VPF) e mediodorsale (DMPF), delle regioni temporo parietali e di strutture
cerebrali inclusa l’amigdala (Brune & Brune-Chors, 2006; Saxe & Kanwisher,
2003; Saxe, Carey & Kanwisher, 2004). Inoltre, studi effettuati mediante imaging
funzionale hanno evidenziato, durante compinti di social cognition, l’attivazione
delle aree VPF, DMPF, dell’amigdala e del solco temporo-parietale ma anche del
cervelletto e in particolare delle regioni neocerebellari (Brune & Brune-Chors,
2006). Queste distinte regioni cerebrali sembrano essere implicate in diversi
aspetti del social cognition (Saxe, 2006).
In uno studio del 2011, Roldan Gerschcovich et al., hanno esibito il caso di un
paziente con lesioni dovute a infarto che interessavano il verme posteriore e le
regioni mediali e posteriori di entrambi gli emisferi cerebellari. Poiché questo
paziente aveva sviluppato la sindrome cognitiva affettiva con gravi deficit delle
capacità empatiche e nella teoria della mente, gli autori hanno indagato tali
funzioni e hanno evidenziato che il paziente mostrava pronunciate difficoltà
nell’identificazione e riconoscimento delle emozioni altrui, oltre che nella
comprensione del linguaggio implicito e nell’interpretazione delle situazioni
sociali. Grazie a tali evidenze, Roldan Gerschcovich e colleghi (2011), hanno
concluso che un danno cerebellare così esteso causa la distruzione di numerosi
circuiti cerebrali e cerebellari come quelli che collegano le aree mediali e
posteriori del cervelletto alla corteccia associativa prefrontale, parietale e
temporale, alle corteccie paralimbiche (per esempio, l’insula e il cingolo
anteriore), ai nuclei autonomico e reticolare e alle regioni limbiche (per
esempio, l’amigdala, e l’ippocampo). Questi circuiti sembrerebbero processare le
informazioni relative a molte richieste cognitive, comportamentali ed emotive,
incluse il descision-making, l’empatia e la teoria della mente (ToM). Queste
evidenze cliniche supportano quindi l’ipotesi che il cervelletto abbia un ruolo
all’interno dei circuiti neurali associati ai succitati processi cognitivi ed emotivi.
Garrard e colleghi (2008) analizzarono un gruppo di pazienti con atassia
spinocerebellare (SCA). Per SCA si intende un insieme di malattie genetiche
77
autosomiche dominanti caratterizzate da degenerazione delle cellule che
compongono il cervelletto. Esistono diverse forme di atassie spino cerebellari:
dal punto di vista clinico le diverse forme sono piuttosto simili. Ognuna di esse è
causata dall'alterazione di un diverso gene. Le ricerche di questi ultimi anni
hanno portato alla scoperta dei geni responsabili di 9 forme di SCA. I pazienti che
costituivano il campione analizzato da Gerrard e colleghi presentavano la SCA3 e
SCA6. Gli studiosi, indagando le funzioni mnemoniche, esecutive, di cognizione
sociale (elaborazione emotiva e ToM), attentive, linguistiche, hanno concluso che
i deficit delle funzioni esecutive e della cognizione sociale documentate in
entrambe le patologie possono dipendere, in una certa misura, dall’integrità del
sistema cerebellare.
Prima di loro, nel 2005 Van Harskamp et al., analizzando un gruppo di pazienti
con siderosi (accumulo di ferro) superficiale a livello cerebellare, fornirono
elementi ancora più sistematici e numerosi: in aggiunta ai deficit alle funzioni
esecutive, alla memoria visiva e alla produzione linguistica, questi pazienti
presentavano anche una debilitazione della Teoria della Mente (ToM),
nonostante avessero performance normali nelle prove che richiedevano
l’attribuzione di emozioni o di valutazione di un comportamento sociale
appropriato. La debilitazione della ToM coinvolge l’abilità di attribuire i corretti
stati mentali agli altri ed è la caratteristica peculiare dello sviluppo neurologico
della sindrome dell’autismo. È interessante notare che i pazienti con autismo
presentano anomalie cerebellari, sia all’autopsia che con MRI strutturale. Per
esempio, Bauman e Kemper (1985, 1990) e Ritvo et al. (1986), hanno
evidenziato che questi pazienti hanno una riduzione del 50-60 % del numero
delle cellule del verme posteriore e degli emisferi cerebellari. Courchesne e
colleghi (1994), utilizzando planimetria MRI computerizzata, hanno riscontrato
valori anormali per i lobi del verme inferiore (VI e VII). Tutte queste evidenze
suggeriscono che la presenza di danni cerebellari può contribuire all’impairment
delle abilità di mentalizzazione.
Inoltre, D’Agata e colleghi, in uno studio del 2011, hanno indagato l’abilità di
riconoscere le emozioni attraverso le espressioni facciali, capacità essenziale per
il funzionamento delle interazioni umane, in pazienti con atassia spino
cerebellare (SCA). Le evidenze ottenute mediante questo studio ampliano il
78
ruolo del cervelletto nel processo emozionale; l’evidente impairment nelle
emozioni sociali comprova un importante contributo delle reti corticocerebellari
nel riconoscimento di molte emozioni complesse o sociali. Secondo gli autori, nei
pazieni con SCA, potrebbero essere presenti danni diffusi ai circuiti
corticocerebellari, che possono essere facilmente compensati, nel caso delle
emozioni di base, grazie alla robustezza delle connessioni, fisiologicamente più
vecchie, rudimentali e ridondanti, mentre, nel caso delle emozioni sociali,
potrebbe presentarsi una sfumata difficoltà dovuta a un maggior sovraccaricato
dei circuiti.
In un recentissimo studio di Sokolovsky e colleghi (2010) è stata effettuata una
preliminare descrizione della gravità dei deficit cognitivi e sociali nei pazienti
con SCA2, SCA1 e SCA7 effettuata facendo un confronto con pazienti affetti da
SCA6 e SCA3 utilizzando una batteria che indaga le funzioni mnemoniche,
esecutive, di cognizione sociale (elaborazione emotiva e ToM), attentive e
linguistiche. Dallo studio è risultato che i profili cognitivi dei pazienti affetti da
SCA1 e SCA7 sono risultati paragonabili a quelli dei pazienti con SCA6, i pazienti
affetti da SCA1 avevano profili sostanzialmente identici, mentre in alcuni
pazienti con SCA7 veniveno rilevati solo deficit selettivi. Al contrario, i pazienti
con SCA2 mostravano maggiori deficit rispetto ai pazienti con SCA3. Nei test di
cognizione sociale, nei pazienti con SCA2 e SCA7 risultava compromessa la
capacità di attribuire le emozioni degli altri, mentre un paziente affetto da SCA1
presentava un deficit a livello della teoria della mente, che è stato anche
documentato in pazienti con SCA3 e SCA6. Sokolovsky e colleghi, attraverso
questo studio, hanno potuto fornire le prove preliminari che i profili
neuropsicologici dei pazienti affetti da SCA ben corrispondono con la gravità
delle caratteristiche patologiche e cliniche. Inoltre, questi pazienti possono
anche presentare difficoltà nelle attività di cognizione sociale. In sintesi, questi
dati suggeriscono che vi sia un certo grado di eterogeneità nel tipo di deficit
cognitivo e di cognizione sociale nei pazienti affetti da SCA.
Poiché l’ipotesi del coinvolgimento del cervelletto nelle capacità empatiche è
abbastanza recente, ancora molto dobbiamo scoprire sulle specificità di tali
deficit.
79
4.5 Espressioni facciali delle emozioni: da Darwin a Ekman
L’esperienza emotiva è un processo manifestato all’esterno attraverso specifiche
espressioni: facciali, posturali, vocali e motorie. Gran parte degli studi, da Charles
Darwin in poi, si sono concentrati sull’area del volto e delle espressioni facciali in
quanto canali privilegiati per la comunicazione e la comprensione delle
emozioni.
Riguardo all’ontogenesi del riconoscimento delle espressioni facciali, infatti,
l’analisi della letteratura sperimentale (Klinnert, Campos e altri, 1983) evidenzia
che dai primi mesi dopo la nascita il bambino comincia a discriminare le
espressioni facciali e dal settimo mese risponde alle espressioni emozionali
altrui con espressioni appropriate.
Secondo Darwin, le emozioni e le espressioni facciali sono adattative, frutto
dell’evoluzione delle specie, biologicamente innate e universali, patrimonio di
tutti gli esseri umani, i quali esprimono attraverso il volto le emozioni nella
stessa maniera, senza distinzioni di razza o cultura (Matsumoto e Cortini, 2001).
In particolare, Darwin notò che le espressioni facciali sono identiche perfino
nelle persone affette da cecità dalla nascita, che quindi non hanno potuto vedere
altri individui né imparare da loro i movimenti muscolari, e nei neonati, che
ancora non hanno avuto la possibilità di apprenderli attraverso l’imitazione
(Mula et al.,2011).
Nel 1872, Darwin, in “L’espressione delle emozioni nell’uomo e negli animali”,
adattò la sua teoria evoluzionistica non solo alle caratteristiche fisiche delle
specie animali e della specie umana, ma anche alla mente e alle espressioni
emotive.
Egli raccolse esempi di svariate espressioni fisiche che sono simili in specie
diverse, come il fenomeno dell’orripilazione, che, seppur blandamente, è
presente anche negli esseri umani e sarebbe una traccia residuale delle
manifestazioni presenti negli altri mammiferi (LeDoux, 2001). Utilizzando il
principio dell’antitesi, Darwin postulò che a opposte emozioni corrispondono
opposte espressioni facciali e del corpo. Ad esempio, l’atteggiamento aggressivo
di un cane, con il corpo appoggiato sulle zampe posteriori mentre digrigna i
denti, e l’atteggiamento dello stesso cane vicino al padrone con tutto il corpo a
80
terra e l’aspetto compassionevole, sarebbero simili a ciò che si osserva
nell’espressione facciale e del corpo di un uomo in atteggiamento aggressivo o
sottomesso (Ekman, 2003). Nell’ipotesi darwiniana, le espressioni del volto e del
corpo costituiscono i primi mezzi di comunicazione nel rapporto materno-
infantile.
Fino alla metà degli anni sessanta del Novecento gli studi sulle espressioni
facciali delle emozioni hanno attraversato una lunga parentesi di silenzio, prima
che Sylvan Tomkins e i suoi allievi Paul Ekman e Carroll Izard cominciassero a
condurre una serie di studi (universality studies) che miravano a replicare i
risultati di Darwin. A soggetti appartenenti a ventuno diverse culture
alfabetizzate (in Africa, Argentina, Brasile, Cile, Cina, Inghilterra, Estonia, Etiopia,
Francia, Grecia, Germania, Italia, Giappone, Kirghizistan, Malesia, Scozia, Svezia,
Sumatra, Svizzera, Turchia, Stati Uniti) e a due culture pre-letterate di Papua
Nuova Guinea venivano mostrate fotografie di espressioni facciali e veniva
richiesto di descrivere l’emozione rappresentata.
Gli studi di Ekman, inizialmente con Izard e in seguito con Friesen, oltre a fornire
dati a conferma dell’universalità delle espressioni facciali delle emozioni,
condussero alla definizione di sei emozioni universali: rabbia, disgusto, paura,
gioia, tristezza e sorpresa.
Secondo Ekman, l’utilità evolutiva primaria delle espressioni facciali delle
emozioni consiste nell’informare gli individui della stessa specie, senza scelta né
giudizio, rispetto al significato degli stimoli esterni e alle loro potenziali
conseguenze. Ad esempio, provare paura di fronte a un animale feroce ci
permetterebbe di comprendere che quello stimolo è nocivo per la nostra specie e
ci porterebbe ad allontanarcene, così come la sensazione di disgusto di fronte a
un animale in decomposizione ci porterebbe ad astenerci dal mangiare le sue
carni. In seguito, Ekman (Ekman e Davidson, 1994) sostenne l’esistenza di
“famiglie” di emozioni. Ogni emozione fondamentale costituisce un cluster di
stati affettivi correlati, caratterizzati da simili modalità espressive, attività
fisiologica e stimoli che possono elicitarli. Queste caratteristiche comuni
permettono di distinguere una famiglia di emozioni da un’altra. Le
caratteristiche comuni ai membri di una famiglia di emozioni ne costituiscono il
“tema”, il nucleo filogeneticamente più antico. I diversi membri della famiglia
81
costituiscono le variazioni su quel tema, influenzate dalla società e
dall’educazione. Un grave limite degli universality studies sta nel passaggio
dall’accordo transculturale del riconoscimento delle emozioni alla dimensione
panculturale dell’espressione delle emozioni. Lo stesso Ekman sostenne infatti
che non sappiamo praticamente nulla sul tipo di informazione che arriva a un
individuo quando vede l’espressione facciale di un’emozione accompagnata da
parole e da atteggiamenti posturali, né sappiamo se l’individuo abbia un insieme
abituale di aspettative su ciò che dovrebbe accadere in quella situazione (Mula et
al., 2011).
L’interrogativo fondamentale era quindi se vi fosse una concordanza dei
messaggi nelle diverse culture. Gli studiosi delle emozioni universali spostarono
l’attenzione dal riconoscimento delle emozioni all’espressione delle emozioni.
Ekman e i suoi colleghi notarono che le espressioni facciali delle emozioni non
sono sistematicamente associate a specifici eventi o a specifiche esperienze
soggettive (ad esempio, un soggetto può sorridere anche vedendo la
decapitazione di un ratto o ricevendo la notizia di un evento luttuoso), ma
queste esperienze possono essere considerate come “marcatori” dell’esperienza
emotiva, correlati, ad esempio, a specifiche attivazioni autonomiche
universalmente presenti, che possono coordinare le interazioni sociali tra
individui (Mula et al., 2011).
Il primo di tali studi fu condotto da Ekman e Friesen (1975), che lavorando su
due diversi gruppi culturali della Nuova Guinea verificarono se e in quale misura
i risultati ottenuti a sostegno dell’universalità delle espressioni facciali fossero
ascrivibili all’esposizione ai media. Attraveso questo studio Ekman e Friesen
stabilirono l’esistenza di una base universale e innata per l’espressione delle
emozioni. A suffragio della teoria panculturale delle emozioni, Ekman sostenne
inoltre che se in una particolare società o cultura manca il termine esatto per una
data emozione, l’espressione di quell’emozione è presente e concorde con
l’esperienza emotiva.
Secondo la teoria neuroculturale proposta da Ekman, al di là della base
universale dell’espressione delle emozioni esiste tuttavia una serie di display
rules, regole sociali di esibizione delle emozioni, culturalmente apprese, che
prescrivono il controllo e la modificazione delle espressioni emozionali a
82
seconda delle circostanze sociali. Si può dunque ritenere che esistano anche
programmi di regolazione delle espressioni facciali appresi e finalizzati alla
manipolazione delle espressioni emozionali soggettive in funzione del contesto
relazionale (Mula et al., 2011).
Ekman e Friesen hanno inoltre osservato la differenza tra le espressioni facciali
spontanee e quelle non autentiche (manipolate in funzione del contesto sociale),
o meglio non indotte da un’emozione specifica, caratterizzate molto spesso da
“microespressioni”. Le espressioni facciali autentiche sono contraddistinte da
breve durata, simmetria, concordanza con ciò che viene detto nello stesso
momento, compresenza di altri movimenti o posture, comparsa e scomparsa
piuttosto repentina dell’apice espressivo (Ekman, 1999).
In conclusione, Ekman sosteneva l’esistenza di una connessione universale tra
espressione facciale ed emozione, anche se ciò non significa che ogni volta che
viene esperita un’emozione si rende visibile una particolare espressione facciale,
perché siamo capaci di inibirne la manifestazione; e neppure, ogni volta che vi è
una data espressione facciale, a questa corrisponde l’esperienza di una data
emozione, perché siamo capaci di esibire delle espressioni facciali anche solo in
base alla nostra volontà (Mula et al., 2011).
83
4.6 Meccanimi neurali delle espressioni facciali delle emozioni
Dato il ruolo cruciale nella funzione sociale svolto dall’elaborazione dei volti
umani emozionali, nel corso degli ultimi due decenni le neuroscienze affettive
hanno dimostrato un forte interesse per la comprensione dei meccanismi neurali
che supportano la percezione dei volti (Peelen & Downing, 2007).
La maggior parte delle nostre interazioni sociali, infatti, comporta il
riconoscimento dell'identità dell’altro, delle sua azioni, emozioni e intenzioni.
Molte di queste informazioni sono ricavabili tramite le espressioni facciali, che
rappresentano una potente forma di comunicazione non verbale delle emozioni
poichè forniscono informazioni di vitale importanza nel complesso mondo
sociale (Phillips et al. 1995).
Riconoscere le espressioni facciali ci permette, infatti, di individuare lo stato
emotivo di un'altra persona e ci fornisce spunti su come interagire con essa
(Frank & Stennett, 2001; Grossmann et al., 2007). Alcune emozioni di base
possono essere più facilmente riconosciute dalle espressioni facciali (per
esempio, paura, disgusto, rabbia, felicità, tristezza) e sono considerate universali
nella loro esibizione e percezione (Adolphs, 2002).
In definitiva, la percezione del viso è definita come “un’elaborazione visiva dei
volti di alto livello" (Kanwisher et al., 1997), che riguarda sia l'elaborazione
percettiva – intesa come la capacità di individuare la configurazione geometrica
del viso e di discriminare le caratteristiche facciali tra i diversi stimoli sulla base
del loro aspetto - e il riconoscimento del significato emozionale di uno stimulo
(Adolphs, 2002). Così, la percezione delle emozioni facciali mette insieme la
corrente sensoriale di ingresso visivo con il recupero dalla memoria ed è una
capacità importante in quanto ereditata poiché evidente fin dalle fasi neonatali
(Grossmann et al., 2007).
Recentemente, le tecniche di imaging funzionale cerebrali come la risonanza
magnetica funzionale (fMRI), che consente l'indagine in vivo del cervello umano,
sono state impiegate per chiarire i substrati neurofisiologici dell’elaborazione
emotiva. Nonostante il numero crescente di studi fMRI effettuati in questo
campo, se presi separatamente, questi studi di imaging indicano scoperte
contrastanti (Neumann et al., 2008) e non sono in grado di caratterizzare in via
84
definitiva quali regioni del cervello sono associate ad ogni specifica condizione
emotiva. Inoltre, anche se i fattori metodologici quali i disegni sperimentali, i
metodi di imaging e di analisi diversi possono essere una fonte di eterogeneità
tra gli studi, i limiti principali della letteratura corrente per la maggior parte
degli studi fMRI sono i campioni di piccole dimensioni e la potenza statistica
relativamente bassa. Per di più, è anche difficile discriminare l'effetto modulante
di altri fattori di confondimento come l'età Deeley et al., 2008; Iidaka et al.,2002;
Pine et al., 2001; Guyer et al., 2008) e il sesso (Schulte-Rüther et al., 2008;
McClure et al., 2004; Kranz & Ishai, 2006; Lee et al., 2002) e tipo di elaborazione
emotiva (ad esempio, esplicita o implicita; Habel et al., 2007; Gorno-Tempini et
al., 2001; Whalen et al., 1998; Chen et al., 2006; Critchley et al.,2000).
Tuttavia, Fusar-Poli et al., in uno studio del 2009, hanno trovato che il
processamento emozionale dei volti è associato all’aumentato dell’attività in un
certo numero di aree visive (giro fusiforme, giro occipitale inferiore e medio,
giro linguale), limbiche (amigdala e giro paraippocampale, cingolo posteriore),
temporali (giro temporale medio/superiore), temporoparietali (lobulo parietale,
giro temporale mediale, insula), prefrontali (giro frontale mediale),
sottocorticali (putamen) e nel cervelletto (declive). Questa rete neurale è quella
più frequentemente attivata durante l'elaborazione di un volto umano esprime
un’emozione. Questi risultati confermano che il riconoscimento delle emozioni
dalle espressioni facciali di elaborazione si basa su diversi processi psicologici
attuati in una vasta gamma di strutture neurali (Vuilleumier &Pourtois, 2007).
Anche se l'interazione funzionale precisa tra queste aree non è chiara, alcuni
autori suggeriscono che all'inizio dell'elaborazione percettiva dei volti si basa
sulle cortecce occipitali e nei lobi temporali che costruiscono le rappresentazioni
dettagliate dalla configurazione dei lineamenti del viso (Adolphs, 2002).
Successivamente il riconoscimento richiede un insieme di strutture, tra cui
l'amigdala e la corteccia orbitofrontale, che collegano le rappresentazioni
percettive del viso al riconoscimento dell’emozione segnalato (Adolphs, 2002).
Inoltre, i dati ottenuti da Fusar-Poli et al. indicano che le condizioni emotive sono
eseguite da sistemi neurali che sono almeno in parte separabili, sebbene non
sono completamente distinti.
85
Dunque, è possibile concludere, per esempio, che il coinvolgimento dell'amigdala
durante l'elaborazione dei volti impauriti è un risultato solido e confermato da
un’ampia letteratura. Tale risultato è coerente con le prove che suggeriscono che
l'amigdala è specificamente sensibile al processamento emotivo della paura
(Adolphs, 2008). Tuttavia, l'amigdala si attiva anche durante l'elaborazione di
facce neutre (Fitzgerald et al., 2006). Inoltre, durante l'elaborazione dei volti
disgustati e arrabbiati è particolarmente frequente l'attivazione insulare. In più,
un certo numero di correnti comportamentali e neurobiologiche hanno suggerito
che questa regione del cervello è importante per i modelli neurobiologici del
disgusto (Calder et al., 2000). Alcuni autori hanno ipotizzato che, mentre il
sistema limbico (amigdala e regioni ippocampali) è particolarmente coinvolto
nella risposta emozionale agli stimoli sensoriali esterocettivi, la corteccia
insulare è preferibilmente coinvolta nella risposta emotiva agli stimoli sensoriali
interocettivi e alle sensazioni corpree potenzialmente dolorose. Infatti, l'insula è
parte della corteccia gustativa ed è collegata al nucleo ventro-mediale-
posteriore(Husted et al., 2006). Gli autori hanno anche evidenziato un’ulteriore
attivazione talamica in risposta alle facce disgustate, indicando che la via
insulare-talamico può rappresentare il relè principale di questa rete neurale. La
corteccia frontale mediale, d'altro canto, partecipa alla esperienza cosciente delle
emozioni, l'inibizione delle emozioni eccessive, o il monitoraggio del proprio
stato emotivo nel prendere decisioni pertinenti. Questa regione è stata attivata
da volti paurosi, mentre le facce felici attivano la corteccia cingolata anteriore,
una regione che è specificamente coinvolta nella eccitazione emotiva di uno
stimolo visivo (Husted et al., 2006).
Infine, non è stata evidenziata nessuna differenza per le diverse emozioni
nell’attivazione del cervelletto. Questa area è di particolare interesse nel campo
delle neuroscienze affettive in quanto è strettamente connessa con il sistema
reticolare (arousal), con le aree corticali di associazione (elaborazione cognitiva
delle emozioni) e con le strutture limbiche (esperienza emozionale ed
espressione), come l'amigdala, l'ippocampo e i nuclei settali (Baillieux et al.,
2008). Studi precedenti hanno indicato che lesioni cerebellari provocano
appiattimento o ottundimento emotivo (Schmahmann, 2000) e che l’attivazione
cerebellare è stata osservata in risposta a differenti emozioni (Reiman et al.,
86
1997; Sacchetti et al., 2002). Tuttavia, come già detto in precedenza, la
mancanza di attivazione differenziale in questo settore è in linea con le evidenza
che indicano che il cervelletto gioca nel processamento emotivo un ruolo
generale (Turner & Paradiso, 2007).
Alcuni studi ipotizzano che la riduzione della comprensione dell'espressione
emozionale potrebbe essere, in parte, causata da un danno nel collegamento
funzionale tra il cervelletto e il lobo frontale (Schmahmann et al., 2007; Agid et
al., 2003; Beyer et al., 2002). Altre recenti evidenze supportano l’ipotesi che il
cervelletto abbia un ruolo all’interno dei circuiti neurali associati ai processi
cognitivi ed emotivi. In uno studio, già citato, di Roldan Gerschcovich et al.
(2011), in cui venivano esaminate le capacità sociali di un paziente con estese
lesioni al cervelletto, gli autori hanno rilevato che il paziente mostrava anche
pronunciate difficoltà nell’identificazione e nel riconoscimento delle emozioni
altrui, e hanno concluso che un danno cerebellare così esteso causa la
distruzione di numerosi circuiti cerebrali e cerebellari che sembrerebbero
processare le informazioni relative all’identificazione e al riconoscimento
dell’emozioni altrui.
Come precedentemente detto, D’Agata e colleghi, in uno studio del 2011, hanno
indagato l’abilità di riconoscere le emozioni attraverso le espressioni facciali in
pazienti con atassia spino cerebellare (SCA). Le evidenze ottenute mediante
questo studio comprovano l’importante contributo delle reti corticocerebellari
nel riconoscimento di molte emozioni complesse o sociali. Secondo questi autori,
tuttavia, nonostante nei pazieni con SCA potrebbero essere presenti danni diffusi
ai circuiti corticocerebellari, nel caso delle emozioni di base, questi danni
possono essere facilmente compensati, grazie alla robustezza delle connessioni,
fisiologicamente più vecchie e ridondanti (D’Agata et al., 2011).
87
5. La ricerca
5.1 Obiettivo dello studio
L’obiettivo del presente lavoro è quello di valutare le funzioni emotive e il
benessere psicologico in un gruppo di pazienti con danno cerebellare, nonché di
valutare le eventuali differenze con un gruppo di controllo costituito da volontari
sani.
5.2 Partecipanti
Il campione preso in esame è costituito da 24 soggetti: 8 di loro sono pazienti,
mentre i restanti 16 sono soggetti volontari sani appaiati ai pazienti per sesso e
per età.
Gruppo sperimentale
Il gruppo dei pazienti è costituito da 8 soggetti reclutati presso l’U.O. di
Neuroriabilitazione del Dipartimento di Neuroscienze dell’Azienda Ospedaliero
Universitaria Pisana.
Degli otto pazienti, tre hanno riportato il danno cerebellare in seguito all’exeresi
chirurgica effettuata per rimuovere una neoplasia; due di loro hanno subito
un’evacuazione chirurgica in seguito ad un ematoma spontaneo; due pazienti,
invece, hanno riportato il danno in seguito ad un trauma e un solo paziente
presenta una lesione ischemica focale.
Di seguito è presentata una tabella riassuntiva, dettagliata, in cui i pazienti
vengono descritti singolarmente. Viene specificata l’area interessata dal danno,
la prevalenza laterale del danno (Destra, Dx; Sinistra, Sx;, Bilaterale, Dx=Sx; e
Mediana) e l’eziologia.
88
Tabella 1Descrizione neurologica
PAZIENTE DIAGNOSI SEDE LESIONELATO >
AFFETTOEZIOLOGIA
M.Q.
Exeresi
chirurgica
neoplasia
Verme e paraverme posteriore MEDIANA Neoplasia
M.A.
ischemia della
arteria
cerebellare
superiore sx
Emiverme sup x Emisfero sx
Peduncolo c. sup e med. Sx III
post mesencefalico
SxIschemica/
Embolica
P.L.
Exeresi
chirurgica
neoplasia e
terapia radiante
emisferi mesiali dx e sx sx>dx
verme sofferenza ponte-
mesencefalo-bulbo
Dx>sxmedullo-
blastoma
O.G.
Exeresi
chirurgica
neoplasia/
meningocele
Emisfero c. dx Meningocele
retrospinale/ suboccipitaleDX Meningioma
B.R.
Ematoma c.
spontaneo/
evacuazione
chirurgica
emisfero/verme Dx Dx Emorragica
A.J. focolai contusivipeduncoli cerebellari superiore e
medio SxSx Trauma
P.L. focolai contusivi Verme superiore Sx Trauma
S.V.
Ematoma c.
spontaneo/
evacuazione
chirurgica
Emisfero Dx, verme e paraverme
sup. Dx Emorragica
Degli 8 pazienti, 5 sono di sesso femminile (62, 5 %) e 3 sono di sesso maschile
(37,5 %).
Tabella 2Distribuzione sesso- pazienti
Sesso Frequenza Percentuale
F 5 62, 5 %
M 3 37,5 %
Totale 8 100 %
89
L’età media dei pazienti è di 47,13 anni (DS 18,187; mediana 44,5).
Il livello d’istruzione medio misurato per anni di scolarità è 12, 38 (DS 4,897; mediana 13).
Tabella 3 Livello d'istruzione
Scolarità Frequenza Percentuale
5 anni 2 25 %
13 anni 3 37,5 %
16 anni 2 25 %
18 anni 1 12,5%
Totale 8 100 %
90
I test, autosomministrati sono stati compilati dai pazienti in presenza dello
sperimentatore. Nella stessa occasione è stato richiesto il consenso per il
trattamento dei dati.
91
Gruppo di controllo
Il gruppo di controllo è stato appaiato al gruppo di pazienti per sesso e per età.
Esso è costituito da 16 volontari sani. Anche in questo caso i test sono stati
compilati in presenza dello sperimentatore e nella stessa occasione è stato
richiesto il consenso informato.
Dei 16 soggetti 10 sono si sesso femminile (62,5 %) e 6 di sesso maschile
(37,5%).
Tabella 4 Distribuzione sesso-controlli
Sesso Frequenza Percentuale
F 10 62,5 %
M 6 37,5 %
Totale 16 100 %
L’età media dei soggetti è di 53,50 anni (DS 16,256; mediana 57).
92
Il livello d’istruzione medio misurato per anni di scolarità è 14,19 (DS 4,490;
mediana 16).
Tabella 5Livello d'istruzione
Scolarità Frequenza Percentuale
5 anni 1 6,3 %
8 anni 3 18,8 %
13 anni 2 12,5 %
16 anni 4 25 %
18 anni 6 37,5 %
Totale 16 100 %
93
5.3 Strumenti
Tutti i soggetti sono stati invitati a compilare tre test che valutano le dimensioni
dell’ansia e della depressione, dell’espressione emotiva e del benessere
psicologico (l’Hospital Anxiety and Depression Scale, HADS; il Profile of Mood
States, POMS; la Psychological Well-being, PWB) e tre test atti, invece, a valutare
le capacità empatiche e di riconoscimento emotivo (il test Reading the Mind in
the Eyes, RME; il Faces Test e l’Empathy Quotient, EQ).
Ansia, depressione e benessere psicologico
Profile of Mood States
Il Profile of Mood States (POMS) è uno degli strumenti più utilizzati in psicologia
per la misurazione di sentimenti, emozioni e stati d'animo (Avila e de la Pena
Gimenez, 1991).
Si tratta di un elenco di aggettivi multidimensionali originariamente sviluppate
da McNair, Loor e Droppleman nel 1971, per le popolazioni psichiatriche e non
psichiatriche.
Le proprietà psicometriche della scala risultano adeguate, il coefficienti di
affidabilità (alpha di Cronbach) oscilla tra 0,80 e 0,90 (McNair et al., 1971,
Norcross, Guadagnoli, e Prochaska, 1984, Weckowicz, 1978). Ha una buona
coerenza interna ed una struttura fattoriale relativamente stabile. Infatti,
attraverso numerose analisi fattoriali, è stato possibile rilevare sei fattori che
appaiono in modo coerente: Tensione-Ansia (T); Depressione-Avvilimento (D),
Aggressività- Rabbia (A), Vigore-Attività (V), Stanchezza-Indolenza (S) e
Confusione-Sconcerto (C), (McNair, Loor, 1992).
La POMS fornisce un punteggio totale e un punteggio per ciascuna sottoscale e
tutti gli elementi hanno una coerenza interna di ≥ .90.34 . Un punteggio totale
più elevato indica una maggiore intensità di espressione in quella categoria.
Ogni aggettivo che compone il test è valutato su una scala Likert a cinque punti
che va da "mai (punteggio 0)" a "molto spesso (punteggio 4)". Il punteggio per
ciascun fattore è ottenuto dalla somma delle risposte di tutti gli aggettivi che lo
definiscono.
94
Si può ottenere un punteggio totale sommando i punteggi dei fattori,
considerando che “Vigore”, a differenza degli altri si sottrae. Per evitare i numeri
negativi, si aggiunge una costante 100 al punteggio totale (Balaguer, Fuentes,
1993).
Il fattore D (Depressione) è composto da aggettivi come infelice, triste, senza
speranza e sembra rappresentare un umore depresso accompagnato da un
sentimento d’inadeguatezza personale.
Il fattore definito T (Tensione) è costituito da aggettivi che descrivono un
aumento della tensione muscolare scheletrica: teso, nervoso, rilassato.
Il fattore A (Aggressività) è uno stato d'animo di rabbia e antipatia verso gli
altri. Alcuni aggettivi sono: arrabbiato, amareggiato, ribelle, deluso.
Il fattore V (Vigore) rappresenta uno stato di ebollizione, vigore, energia elevata.
Questo è composto dai seguenti aggettivi: attivo, pieno di energie, di buon
umore, pieno di vita, libero da preoccupazioni, pronto in gamba, pieno
d’iniziativa, forte.
Il fattore S (Stanchezza) è uno stato d'animo di stanchezza, d'inerzia e basso
consumo energetico. Formato da aggettivi come: esaurito, stanco.
Il fattore C (confusione) si caratterizza per la confusione e il disordine. Gli
aggettivi che lo compongono sono: con le idee confuse, incapace di concentrarsi,
smemorato (McNair, Loor, 1992).
Psychological Well-Being Scale
La Psychological Well-Being Scale (PWB; Ryff, 1989) è un questionario
autovalutativo che nasce dal modello di Carol Ryff (1989) secondo cui il
benessere psicologico è inteso come un processo multidimensionale e dinamico
che comprende vari e molteplici aspetti.
La scala è in grado di misurare le sei dimensioni del benessere proposte dalla
Ryff: autoaccettazione, relazioni interpersonali positive, autonomia, controllo
ambientale, crescita personale e scopo nella vita (Ryff, 1989).
È stato ampiamente dimostrato che le sei dimensioni del benessere della Ryff
possiedono correlazioni differenti riguardo alle diverse età (Ryff, 1991), ai
diversi profili culturali (Ryff et al., 1996) e al sesso di appartenenza (Ryff,
1989b).
95
Il test ha delle buone proprietà psicomentriche e recenti studi condotti in
America hanno dimostrato la superiorità del modello multidimensionale del
benessere rispetto a quello ad un singolo fattore (Ryff & Keyes, 1995) e han- no
analizzato il rapporto tra benessere psicologico e soddisfazione nella vita (Keyes
et al., 2002). In seguito la PWB è stata utilizzata in numerose ricerche (Ryff,
1989; Ryff, 1995; Ryff & Essex,1992; Ryff & Keyes, 1995; Ryff & Singer, 1996).
Versioni più sintetiche del questionario sono state costruite e validate; nel
presente studio è stata utilizzata la versione costituita da 18 items (3 items per
ciascuna dimensione del benessere; Ryff & Keyes, 1995).
Hospital Anxiety and Depression Scale
La Hospital Anxiety and Depression Scale (HADS) è uno strumento composto da
14 item sviluppato da Zigmond e Snaith (Zigmond & Snaith, 1983) e comprende
domande relative alla presenza di sintomatologia ansioso depressiva con
particolare riferimento ai sintomi che meno si confondono gli esiti di condizioni
mediche (Undavia & Goldstein, 2008).
Si compone, nel dettaglio, di sette item relativi all'ansia (HADS-A) e sette inerenti
sintomi depressivi (HADS-D). Gli item sono valutati su una scala likert con
quattro possibilità di risposta in cui zero corrisonde all’assenza del sintomo e tre
alla presenza del sintomo in modo considerevole, (Olsson I, Mykletun A, 2005).
La scala HADS è stata validata in diversi contesti clinici inclusi i pazienti della
popolazione generale, quelli con malattie somatiche, malattie psichiatriche e
cardiache, e ha dimostrato di essere uno strumento valido e affidabile con un’alfa
di Cronbach che va dal 0,67-0,93 per le due sottoscale (Zigmond AS, Snaith RP,
1983).
Sulla base di una recente revisione, un punteggio pari a ≥ 8 é considerato
positivo per entrambe le sottoscale (Bjelland I, Dahl AA, 2002). Gli autori del test
raccomandano che, in ogni sottoscala, i punteggi grezzi tra l'8 e il 10 identificano
i casi lievi, tra l’11-15 i casi moderati, mentre punteggi uguali o superiori a 16 , i
casi gravi (Snaith RP, Zigmond AS, 1994).
La validità concorrente della scala HADS rispetto ad altri questionari per ansia e
depressione è descritta tra 0,60 e 0,80 per entrambe le sotto-scale (Bjelland I,
Dahl AA, 2002).
96
Empatia e riconoscimento delle emozioni
Per valutare l’empatia e le capacità di riconoscimento emotivo sono stati
utilizzati tre test: il Quoziente di empatia (EQ), il test Reading the Mind in the
Eyes (RME) e il Faces Test.
Quoziente di empatia (EQ)
L'EQ (Baron-Cohen & Wheelwright, 2003) è la più recente scala costruita per
valutare l’empatia, e, a differenza delle scale precedenti è stata esplicitamente
progettata per avere una applicazione clinica ed essere sensibile alla mancanza
di empatia, intesa come caratteristica psicopatologia. Diversi gruppi clinici infatti
presentano deficit in questa capacità. I più evidenti, sono i disturbi dello spettro
autistico e le persone che mostrano segni di psicosi (Blair, 1995).
Il test è un questionario originariamente costituito da 60 items, con 40 domande
che valutano realmente il costrutto e 20 items di controllo. Nel nostro studio è
stata utilizzata una versione validata dallo stesso Baron-Cohen (2003). Tale
versione è raccomandata da Baron-Choen. Le risposte sono date su una scala
Likert che va da 0 a 4 dove 0 corrisponde a “Assolutamente in disaccordo” e 4 a
“Assolutamente d’accordo”. Il punteggio può essere compreso in un range che va
da 0 a 80. Il cut-off corrisponde a un punteggio di 30, che si è dimostrato il più
utile nel differenziare adulti con sindrome di autismo dai controlli. Il punteggio
che oscilla tra 53 e 63 viene considerato al di sopra della media (Baron-Cohen et
al. 2003).
97
Faces Test
Il Faces Test (Baron-Cohen et al., 1996) nasce dall’ipotesi che, al di là delle
"emozioni di base", una ampia gamma di stati mentali complessi possono essere
riconosciuti attraverso le espressioni facciali.
La sua validazione è stata effettuata su un campione di 50 soggetti (25 maschi e
25 femmine), studenti presso l'Università di Cambridge con un’età compresa tra
i 18-21 anni. Le differenze tra i sessi erano tutte non-significative (p> 0,05). La
validazione italiana è stata effettuata da Anna Gasparre dall’Università di Bari.
Il Faces Test è costituito da 20 fotografie in bianco-nero. Ogni foto ritrae l’intero
volto di un’attrice inglese e misura 10x8 cm e sono tutte riportate in Baron-
Cohen (1997). Sotto ciascuna immagine vi sono due aggettivi o termini relativi
alle espressioni emotive. Per ogni stato mentale i soggetti dovevano scegliere
una risposta tra due alternative. Queste parole sono state scelte da una giuria di
quattro giudici indipendenti (due maschi, due femmine), e sono stati usati solo
quei termini che hanno prodotto un accordo unanime. Il termine alternativo, è
stato selezionato sulla base del fatto che esso apparteneva alla stessa categoria
semantica rispetto al termine di destinazione. Cioè, se il bersaglio è una
emozione di base, allora l’alternativa lo è anche. Se il bersaglio è uno stato
mentale complesso, allora lo è anche l’alternativa. Analogamente, il bersaglio e
l’alternativa hanno la stessa valenza (negativa o positiva). Il test risulta valido e
attendibile e gode di un ampio utilizzo (Baron-Cohen et al., 1996).
Figura 1. Eempio di emozione complessa. Figura 2. Esempio di emozione di base
98
Reading the Mind in the Eyes (RME)
Il test Reading the Mind in the Eyes (RME) è un compito atto a valutare alcuni
aspetti complessi dell’intelligenza sociale, in particolare permette di esaminare
la capacità di inferire stati mentali complessi per mezzo di informazioni che
provengono dal volto (Serafin & Surian, 2004). Vari studi indicano l’utilità
del’RME nell’indagare l’integrità della teoria della mente in soggetti con autismo,
sindrome d’Asperger o schizofrenia (Baron-Cohen et al., 1997; Baron-Cohen et
al., 2001; Kington et al., 2000). È stato anche utile a rilevare differenze
significative fra genitori di bambini con sindrome di Asperger e genitori di
bambini senza disturbi mentali (Baron-Cohen e Hammer, 1997).
La versione italiana del RME, validata su un campione di 195 adulti senza
disturbi mentali suddivisi in tre fasce d’età, è costituita da 36 fotografie in
bianco-nero. Ogni foto ritrae la regione oculare di adulti, giovani e anziani di
entrambi i sessi. Le foto provengono da giornali e riviste inglesi, misurano 4,8
x12,2 cm e sono tutte riportate in Baron-Cohen (2003). Sotto ciascuna immagine
vi sono quattro aggettivi o termini relativi ad espressioni emotive. Nella versione
inglese del test, i termini erano posti ai quattro angoli della foto, mentre in quella
italiana, per rendere il test più adatto all’esame di pazienti con eventuali disturbi
dell’attenzione spaziale e per evitare effetti dovuti alla direzione degli occhi, si è
preferito porre tutte le parole sotto la foto (Serafin & Surian, 2004).
Figura 3 e 4. Esempi di
sguardo che esprimono
emozioni sociali.
99
5.4 Analisi statistica
I dati sono stati analizzati utilizzando il software statistico SPSS versione 17.0.
Dopo avere verificato che non ci sono significative differenze socio-demografiche tra
i due gruppi, è stato eseguito un T test per confrontare le medie dei punteggi dei
pazienti e quelle del gruppo di controllo considerando la significatività per p<0,01 e
p<0,05. Inoltre, è stata effettuata un’analisi di correlazione di Pearson tra le variabili
prese in esame considerando la significatività per p<0,01 e p<0,05.
5.5 Risultati
Empatia e riconoscimento emotivo
Per quanto riguarda l’empatia così come misurata dal test EQ, non si è
riscontrata alcuna differenza significativa tra i due gruppi.
Invece, per quanto concerne il riconoscimento delle emozioni tramite il FACES
TEST è emersa una differenza significativa nel riconoscimento delle emozioni in
generale (p<0,05) e in particolare nel riconoscimento delle emozioni di base
(p<0,05); al contrario, non si è riscontrata nessuna differenza significativa per il
riconoscimento delle emozioni secondarie (FACES-SECONDARIE).
Per quanto riguarda l’intelligenza sociale e in particolare il riconoscimento delle
emozioni sociali o secondarie e la capacità di inferire stati mentali complessi per
mezzo di informazioni che provengono dal volto valutato attraverso Il test
Reading the Mind in the Eyes, si è riscontrata una differenza significativa tra i
due gruppi (p<0,05).
Tabella 6 Risultati t-test dei test che indagano l'empatia e il riconoscimento emotivo
TEST T P
EQ 0,746 0,464
FACES BASE 2,518 0,020
FACES SECONDARIE 0,961 0,347
FACES TOTALE 2,143 0,043
RME 2,204 0,038
100
Ansia, depressione e benessere psicologico
Per quanto riguarda il benessere psicologico generale valutato attraverso la
Psychological Well-Being Scale (PWB; Ryff, 1989) e definito attraverso le
variabili autoaccettazione, relazioni interpersonali positive, autonomia, controllo
ambientale, crescita personale e scopo nella vita, è risultato che il gruppo di
pazienti ha ottenuto un punteggio significativamente più basso nelle sottoscale
scopo nella vita (p<0,05) e controllo ambientale (p<0,01).
Per quanto riguarda la presenza di sintomatologia depressiva e ansiosa è stata
rilevata una differenza significativa per la sintomatologia depressiva (p<0,05),
risultata più elevata nel gruppo sperimentale.
Al contrario, nessuna differenza significativa è stata rilevata nell’espressione di
emozioni, stati d’animo e sentimenti misurati attraverso il Profile of Mood States.
Tabella 7 Risultati t-test HADS
TEST T P
HADS-D -2,709 0,013
HADS-A -1,974 0,061
Tabella 8 Risultati t-test PWB
PWB-AUTONOMIA -0,468 0,644
PWB-RELAZIONE POS. ALTRI -1,429 0,167
PWB-AUTOACCETTAZIONE 1,778 0,089
PWB-COMP. AMBIENTALI 3,184 0,004
PWB-SCOPO VITA 2,295 0,032
PWB-CRESCITA PERSONALE 1,318 0,201
PWB-TOTALE 1,941 0,065
Dall’analisi di correlazione di Pearson è risultato che la variabile “scopo nella
vita” della scala PWB correla positivamente con il riconoscimento delle emozioni
attraverso i volti (Faces Test-Totale; p<0,01) e con il riconoscimento delle
emozioni di base (Faces Test-Base; p<0,01).
101
5.6 Discussione
I risultati emersi da questo studio sembrano confermare l’ipotesi che il
cervelletto abbia un ruolo nelle funzioni emotive. Inoltre, il danno cerebellare
sembra associarsi a maggior rischio di sintomatologia depressiva e ridotto
benessere psicologico in alcune aree particolari tra cui il controllo ambientale e
lo scopo nella vita.
Per quanto concerne le funzioni emotive, i pazienti con lesioni al cervelletto
sembrano avere maggiori difficoltà rispetto al gruppo di controllo nel
riconoscimento delle emozioni altrui, attraverso le espressioni facciali. Tale
difficoltà sembra estendersi alle emozioni di base e non essere confinata al
riconoscimento delle emozioni sociali come riportato da precedenti studi
(D’Agata et al., 2011).
D’Agata e colleghi, infatti, ipotizzavano un ruolo compensatorio dei meccanismi
di plasticità per i danni ai circuiti corticocerebellari causati dalla SCA che
potrebbero, secondo questi autori, essere facilmente compensati, nel caso delle
emozioni di base, dalla robustezza di connessioni ridondanti e più
profondamente radicate. Ciò detto, i dati ottenuti in questo studio confermano,
invece, l’ipotesi di D’Agata e colleghi (2011) sul riconoscimento delle emozioni
sociali, secondo cui i pazienti con lesioni al cerevelletto presenterebbero una
sfumata difficoltà in quest’ambito.
Il presente studio conferma anche i risultati ottenuti nello studio di Sokolovsky e
colleghi (2010), in cui, nei pazienti con danno cerebellare risultava
compromessa la capacità di decodificare le emozioni degli altri.
In più, in accordo con Gerschcovich e colleghi (2011), i risultati qui presentati
supportano l’ipotesi che il cervelletto possa avere un ruolo all’interno dei circuiti
neurali associati ai processi emotivi e all’empatia.
Il fatto che non sono state evidenziate differenze significative nel confronto dei
punteggi ottenuti nella valutazione del quoziente di empatia può essere dovuto a
questioni metodologiche, ovvero alla possibile maggiore influenza della
desiderabilità sociale, oppure a meccanismi di compensazione cognitiva che, pur
in presenza di una ridotta capacità di decodifica delle emozioni, consentono di
mantenere sufficienti capacità di comprensione ed immedesimazione nelle
102
situazioni sociali emotivamente connotate. In altre parole, se i test di
riconoscimento basati su espressioni facciali indagano aspetti di decodifica più
immediati, il quoziente di empatia ricavabile dal test EQ può risultare da
variabili più complesse e meno direttamente legate al riconoscimento di
specifiche espressioni emotive.
Per quanto riguarda la sintomatologia depressiva, essa sembra essere
significativamente presente in questo gruppo di pazienti, confermando i dati di
numerosi studi precedentemente citati (Dolan et al., 1998; Liotti et al., 2002;
Konarski et al., 2005;Sassi et al. 2001).
Anche il benessere psicologico generale sembra interessato, in particolare negli
aspetti che riguardano il controllo ambientale e il proposito nella vita. Questi
dati presentano non pochi motivi di interesse poiché, se da una parte è vero che i
problemi motori tipici dei pazienti con danno cerebellare possono spiegare
queste difficoltà, è altrettanto plausibile che anche le disfunzioni sul piano
emotivo possano contribuire significativamente a questi esiti.
Limiti dello studio
Lo studio presenta dati interessanti ed incoraggianti verso un approfondimento
di questi temi. E’ altresì innegabile che la scarsa numerosità del campione
impone cautela nell’interpretazione dei dati. Una popolazione più vasta, magari
arruolata attraverso studi multicentrici vista la relativa esiguità della
popolazione clinica in esame, consentirebbe non solo di ottenere risultati più
solidi, ma anche di identificare sottogruppi sufficientemente ampi attraverso i
quali approfondire le differenze legate alle sedi delle lesioni.
103
5.7 Conclusioni
In conclusione, i dati di questo studio confermano l’ipotesi di un coinvolgimento
del cervelletto nei processi emozionali. Le valutazioni psicometriche utilizzate
sottolineano la presenza di alcuni deficit, in particolare nel riconoscimento delle
emozioni di base e di quelle secondarie e nella sintomatologia depressiva, a
fronte di altri aspetti e prestazioni che risultano invece paragonabili a quelli del
gruppo di controllo. E’ presumibile che il danno cerebellare causi danni specifici
e che meccanismi di compensazione intervengano in alcune funzioni più
complesse, quali ad esempio l’autovalutazione delle proprie capacità empatiche.
Ciononostante, implicazioni generali sull’umore e sul benessere psicologico
emergono da questa analisi, in particolare su dimensioni, quali il controllo
ambientale, che possono risentire di deficit nel riconoscimento delle emozioni
altrui, così come delle limitazioni sul piano motorio che abitualmente si
associano a danno cerebellare.
104
Bibliografia
Aarsen FK, Van Dongen HR, Paquier PF, et al: Long-term sequelae in children after cerebellar astrocytoma surgery. Neurology 2004; 62:1311–1316.
Abadie P, Boulenger JP, Benali K, Barré L, Zarifian E, Baron JC. Relationships between trait and state anxiety and the central benzodiazepine receptor: a PET study. Eur J Neurosci. 1999;11(4):1470-8.
Ackermann H, Daum I. [The cerebellum and cognition--psychopathological, neuropsychological and neuroradiological findings]. Fortschr Neurol Psychiatr. 1995;63(1):30-7.
Ackermann, H., Vogel, M., Petersen, D., Poremba, M., 1992. Speech deficits in ischaemic cerebellar lesions. J. Neurol. 239, 223–227.
Adams F. Empathy: neural imaging and theory versus simulation debate. Mind Lang 2001;16:368-392.
Addis DR, Wong AT, Schacter DL (2007) Remembering the past and imagining the future: common and distinct neural substrates during event construction and elaboration. Neuropsychologia 45:1363–1377.
Adolphs R, Tranel D, Damasio H, Damasio AR (1994) Impaired recognition of emotion in facial expressions following bilateral damage to the human amygdala. Nature 372:669–672.
Adolphs R, Tranel D, Damasio H, Damasio AR (1995) Fear and the human amygdala. J Neurosci 15:5879 –5892.
Adolphs R. Fear, faces, and the human amygdala. Curr Opin Neurobiol 2008;18:166 -72.
Adolphs R. Neural systems for recognizing emotion. Curr Opin Neurobiol 2002;12:169-77.
Adolphs, R., Damasio, H., Tranel, D., & Damasio, A. R. (1996). Cortical systems for the recognition of emotion in facial expressions. Journal of Neuroscience, 16, 7678-7687.
Adolphs, R., Russell, J. A., & Tranel, D. (1999). A role for the human amygdala in recognizing emotional arousal from unpleasant stimuli. Psychological Science, 10, 167-171.
Agid R, Levin T, Gomori JM, Lerer B, Bonne O. T2-weighted image hyperintensities in major depression: focus on the basal ganglia. Int J Neuropsychopharmacol. 2003;6(3):215-24.
Albert TJ, Dempesy CW, Sorenson CA. Anterior cerebellar vermal stimulat ion: effect on behavior and basal forebrain neurochemistry in rat. Biological Psychiatry 1985;20(12):1267–1276.
Allen, G. I., Gilbert, P. F., & Yin, T. C. (1978). Convergence of cerebral inputs onto dentate neurons in monkey. Experimental Brain Research, 32, 151–170.
105
Allen, G., Buxton, R., Wong, E., Courchesne, E., 1997. Attentional activation of the cerebellum independent of motor involvement. Science 275, 1940–1943.
Anand, V.K. 1976. A preliminary list of Cyanophyceaoef Saruinsarl akc (Janrmu). Geobiot 3:132-133.
Anderson SW, Bechara A, Damasio H, Tranel D, Damasio AR. Impairment of social and moral behavior related to early damage in human prefrontal cortex. Nat Neurosci 1999;2:1032-7.
Andreasen NC, Nopoulos P, O’Leary DS, Miller DD, Wassink T, Flaum M. Defining the phenotype of schizophrenia: cognitive dysmetria and its neural mechanisms. Biological Psychiatry 1999a;46(7):908–920.
Andreasen NC, O’Leary DS, Cizadlo T, Arndt S, Rezai K, Ponto LL, Watkins GL, Hichwa RD. Schizophrenia and cognitive dysmetria: a positron-emission tomography study of dysfunctional prefrontal–thalamic–cerebellar circuitry. Proc Natl Acad Sci U S A. 1996;93(18):9985-90.
Andreasen NC, Paradiso S, O’Leary DS. “Cognitive dysmetria” as an integrative theory of schizophrenia: a dysfunction in cortical-subcortical-cerebellar circuitry? Schizophrenia Bulletin 1998;24(2):203–218.
Andreasen NC, Pierson R. The Role of the Cerebellum in Schizophrenia. Biol Psychiatry. 2008.
Apkarian AV, Bushnell MC, Treede RD, Zubieta JK. Human brain mechanisms of pain perception and regulation in health and disease. Eur J Pain. 2005;9:463–484.
Appollonio IM, Grafman J, Schwartz V, Massaquoi S, Hallett M. Memory in patients with cerebellar degeneration. Neurology 1993; 43: 1536–44.
Arnsten AF. Fundamentals of attention-deficit/hyperactivity disorder: circuits and pathways. J Clin Psychiatry. 2006;67 Suppl 8:7-12.
Astington, J., Harris, P., & Olson, D. (1988). Developing theories of mind. New York: Cambridge University Press.
Avila, A., y Gimenez de la Peña, A. (1991). Los adjetivos en tareas de evaluación psicológica: propiedades y valor estimular. Revista de PsicoLogía GeneraLy ApLicada, 44, 465-475.
Aylward EH, Reiss A. Area and volume measurement of posterior fossa structures in MRI. J Psychiatr Res. 1991;25(4):159-68.
Azizi SA, Mihailoff GA, Burne RA, Woodward DJ (1981) The pontocerebellar system in the rat: an HRP study. I. Posterior vermis. J Comp Neurol 197:543–548.
Azzarelli B, Muller J, Ghetti B, Dyken M, Conneally PM. Cerebellar plaques in familial Alzheimer’s disease (Gerstmann-Straussler-Scheinker variant?). Acta Neuropathol. 1985;65(3-4):235-46.
Baddeley, A., 1992. Working memory. Science 255, 556–559.
Baillieux H, De Smet HJ, Paquier PF, et al. Cerebellar neurocognition: insights into the bottom of the brain. Clin Neurol Neurosurg 2008;110:763-73.
106
Balaguer, Fuentes, Meliá L., Garcia-Merita, Perez M.L, Recio, G. 1993 “El profil de los Estados de Animo (POMS): baremo para estudiantes valencianos y su aplicacion en el contexto deportivo”
Baloyannis S. Pathological alterations of the climbing fibres of the cerebellum in vascular dementia: a Golgi and electron microscope study. J Neurol Sci. 2007;257(1-2):56-61.
Barak Y, Aizenberg D, Mirecki I, Mazeh D, Achiron A. Very late onset schizophrenia -like psychosis: clinical and imaging characteristics in comparison with elderly patients with schizophrenia. J Nerv Ment Dis. 2002;190(11):733-6.
Baron-Cohen S. and Wheelwright S. The Empathy Quotient: An Investigation of Adults with Asperger Syndrome or High Functioning Autism, and Normal Sex Differences. April 2004, Journal of Autism and Developmental Disorders, Vol. 34, No. 2
Baron-Cohen, S. Mindblindness: An Essay on autism and theory of mind, Cambrige, Mass., MIT Press/Bradford Books; 1995.
Baron-Cohen, S. The Essential Difference: the male and female brain. 2004, Cambridge University Press.
Baron-Cohen, S., & Hammer, J. (1997). Is autism an extreme form of the male brain? Advances in Infancy Research, 11, 193–217.
Baron-Cohen, S., Cox, A., Baird, G., Swettenham, J., Drew, A., Morgan, K., Nightingale, N., & Charman, T. (1996). Psychological markers in the detection of autism in infancy in a large population. British Journal of Psychology, 168, 158–163.
Baron-Cohen, S., Jolliffe, T., Mortimore, C., & Robertson, M. (1997). Another advanced test of theory of mind: Evidence from very high functioning adults with autism or Asperger Syndrome. Journal of Child Psychology and Psychiatry, 38, 813–822.
Baron-Cohen, S., Richler, J., Bisarya, D., Gurunathan, N., & Wheelwright, S. (2003). The Systemising Quotient (SQ): An investigation of adults with Asperger syndrome or high functioning autism and normal sex differences. Philosophical Transactions of the Royal Society, Series B, Special issue on “Autism: Mind and Brain,” 358, 361–374.
Baron-Cohen, S., Wheelwright, S., Skinner, R., Martin, J., & Clubley, E. (2001). The Autism Spectrum Quotient (AQ): Evidence from Asperger syndrome/high functioning autism, males and females, scientists and mathematicians. Journal of Autism and Developmental Disorders, 31, 5–17.
Batson, C. D. (1991). The altruism question: Toward a socialpsychological answer. Hillsdale, NJ: Lawrence Erlbaum Associates.
Bauman ML, Kemper TL. Histoanatomic observations of the brain in early infantile autism. Neurology 1985; 35: 866–74.
Bauman ML, Kemper TL. Limbic and cerebellar abnormalities are also present in an autistic child of normal intelligence. Neurology 1990; 40 (Suppl 1): 307.
Bear M.F., Connors B.W., Paradiso M.A., 2002. Neuroscenze. Esplorando il cervello. II edizione. Masson.
107
Bechara A, Damasio H, Tranel D, Anderson SW. Dissociation of working memory from decision making within the human prefrontal cortex. J Neurosci 1998;18:428-37.
Bechara,A., Tranel,D.,Damasio,H.,Adolphs,R., Rockland,C.,& Damasio,A. R. (1995).Double dissociation of conditioning and declarative knowledge relative to the amygdala and hippocampus in humans. Science, 269, 1115-1118.
Bellebaum,C., Daum, I., 2007. Cerebellar involvement in executive control. Cerebellum 6, 184–192.
Berent S, Giordani B, Gilman S, et al: Neuropsychological changes in olivopontocerebellar atrophy. Arch Neurol 1990; 47:997–1001.
Bernstein DM, Attence C, Loftus G, Meltzoff AN. We saw it all along: visual hindsight bias in children and adults. Psychol Sci 2004;15:264-7.
BERNTSON GG, TORELLO MW: The paleocerebellum and the integration of behavioural function. Physiol Psychol 10: 2-12, 1982.
Berquin PC, Giedd JN, Jacobsen LK, Hamburger SD, Krain AL, Rapoport JL, Castellanos FX. Cerebellum in attention-deficit hyperactivity disorder: a morphometric MRI study. Neurology. 1998;50(4):1087-93.
Beyer JL, Krishnan KR. Volumetric brain imaging findings in mood disorders. Bipolar Disord. 2002;4(2):89-104.
Bird CM, Castelli F, Malik O, Frith U, Husain M. The impact of extensive medial frontal lobe damage on ‘Theory of Mind’ and cognition. Brain 2004;127:914-28.
Biswal B, Yetkin FZ, Haughton VM, Hyde JS (1995) Functional connectivity in the motor cortex of resting human brain using echo-planar MRI. Magn Reson Med 34:537–541.
Bjelland I, Dahl AA, Haug TT, Neckelmann D. “The validity of the Hospital Anxiety and Depression Scale. An updated literature review” J Psychosom Res 2002.
Blair, R. J. (1995). A cognitive developmental approach to mortality: Investigating the psychopath. Cognition, 57, 1–29.
Blonder LX, Bowers D, Heilman K (1991) The role of the right hemisphere in emotional communication. Brain 114:1115–1127.
Bolk, L., 1906. Das Cerebellum der Saugetiere. Fischer, Jena.
Bonne O, Gilboa A, Louzoun Y, Brandes D, Yona I, Lester H, Barkai G, Freedman N, Chisin R, Shalev AY. Resting regional cerebral perfusion in recent posttraumatic stress disorder. Biol Psychiatry. 2003;54(10):1077-86.
Borod JC (1993) Cerebral mechanisms underlying facial, prosodic, and lexical emotional expression: a review of neuropsychological studies and methodological issues. Neuropsychology 7:445– 463.
Borod JC, Andelman F, Obler LK, Tweedy JR, Welkowitz J (1992) Right hemisphere specializations for the identification of emotional words and sentences: evidence from stroke patients. Neuropsychologia 30:827– 844.
108
Borod, J. C., Cicero, B. A., Obler, L. K., Welkowitz, J., Erhan, H.M., Santschi,C.,Grunwald, I. S.,Agosti,R.M., & Whalen, J. R. (1998). Right hemisphere emotional perception: Evidence across multiple channels. Neuropsychology, 12, 446-458.
Borod, J. C., Zgaljardic, D., Tabert, M. H., & Koff, E. (2001). Asymmetries of emotional perception and expression in normal adults. In G. Gainotti (Ed.),Handbookof neuropsychology(2nd ed., Vol. 5, pp. 181-205). Amsterdam: Elsevier.
Botez MI, Gravel J, Attig E, Vezina J-L. Reversible chronic cerebellar ataxia after phenytoin intoxication: Possible role of cerebellum in cognitive thought. Neurology 1985; 35: 1152–7.
Botez, M.I., Gravel, J., Attig, E., Vezina, J.L.,1985. Reversible chronic cerebellar ataxia after phenytoin intoxication: possible role of cerebellum in cognitive thought. Neurology 35, 1152–1157.
Botez-Marquard T, Botez MI: Cognitive behavior in heredodegenerative ataxias. Eur Neurol 1993; 33:351–357.
Botez-Marquard, T., Leveille, J., Botez, M., 1994. Neuropsychological functioning in unilateral cerebellar damage. Can. J. Neurol. Sci. 21, 353–357.
Bowers D, Bauer RM, Coslett HB, Heilman KM (1985) Processing of faces by patients with unilateral hemisphere lesions. Brain Cognit 4:258 –272.
Bowers D, Coslett HB, Bauer RM, Speedie LJ, Heilman KH (1987) Comprehension of emotional prosody following unilateral hemispheric lesions: processing defect versus distraction defect. Neuropsychologia 25:317–328.
Boyle, G. (1987). Quantitative and qualitative intersections between the eight state questionnaire and the Profile of Mood States. Educational and PsychoLogieaL Measurement, 47, 437-443.
Bracke-Tolkmitt R, Linden A, Canavan AGM, et al: The cerebellum contributes to mental skills. Behav Neurosci 1989; 103:442– 446.
Brodal, A. Vol. 3rd edition. New York: Oxford University Press; 1981. Neurological anatomy in relation to clinical medicine; Voogd, 2004
Brodal, P. (1978). The corticopontine projection in the rhesus monkey. Origin and principles of organization. Brain, 101,251–283.
Brodal, P., 1979. The pontocerebellar projection in the rhesus monkey: an experimental study with retrograde axonal transport of horseradish peroxidase. Neuroscience 4, 193–208.
Brüne M, Brüne-Cohrs U. Theory of mind--evolution, ontogeny, brain mechanisms and psychopathology. Neurosci Biobehav Rev. 2006;30(4):437-55.
Buck, R. (2002). The genetics and biology of true love: Prosocial biological affects and the left hemisphere. PsychologicalReview, 109, 739-744.
Buckner RL, Snyder AZ, Shannon BJ, LaRossa G, Sachs R, Fotenos AF, Sheline YI, Klunk WE, Mathis CA, Morris JC, Mintun MA (2005) Molecular, structural, and functional characterization of Alzheimer’s disease: evidence for a relationship between default activity, amyloid, and memory. J Neurosci 25:7709 –7717.
109
Bugalho P, Correa B, Viana-Baptista M. Papel do cerebelo nas funções cognitivas e comportamentais. Bases Científicas e Modelos de Estudo. Acta Med Port. 2006;19(3):257-68.
Bush G, Luu P, Posner MI. Cognitive and emotional influences in anterior cingulate cortex. Trends Cogn Sci. 2000;4:215-222.
Bushara, K., Wheat, J., Khan, A., Mock, B., Turski, P., Sorenson, J., Brooks, B.R., 2001. Multiple tactile maps in the human cerebellum. Neuroreport 12, 2483–2486.
Cacioppo, John T.;Gardner, Wendi L.;Berntson, Gary G. The affect system has parallel and integrative processing components: Form follows function. Journal of Personality and Social Psychology, Vol 76(5), May 1999, 839-855.
Calder AJ, Keane J, Manes F, et al. Impaired recognition and experience of disgust following brain injury. Nat Neurosci 2000;3:1077-8.
Calder AJ, Lawrence AD, Young AW. Neuropsychology of fear and loathing. Nat Rev Neurosci. 2001 May;2(5):352-63.
Calder,A. J., Keane, J., Manes, F., Antoun, N., & Young, A. W. (2000). Impaired recognition and experience of disgust following brain injury. Nature Neuroscience, 3, 1077-1078.
Calder,A. J., Young,A.W.,Rowland,D., Perrett,D. I.,Hodges, J. R., & Etcoff, N. L. (1996). Facial emotion recognition after bilateral amygdala damage: Differentially severe impairment of fear. Cognitive Neuropsychology, 13, 699-745.
Cano J, Garcia-Uria J, Machado A, Reinoso-Suarez F. Effect of cerebellar lesions on monoamine levels in various brain areas of the cat. Journal of Neurochemistry 1980;35(6):1446–1448.
Carr L, Iacoboni M, Dubeau M, Mazziotta JC, Lenzi GL. Neural mechanisms of empathy in humans: a relay from neural systems for imitation to limbic areas. Proc Natl Acad Sci USA 2003;100:5497-502.
Carver,C. S., Sutton, S.K., & Scheier,M. F. (2000).Action, emotion, and personality: Emerging conceptual integration.Personality & Social Psychology Bulletin, 26, 741-751.
Casey BJ, Nigg JT, Durston S. New potential leads in the biology and treatment of attention deficit-hyperactivity disorder. Curr Opin Neurol. 2007;20(2):119-24.
Cassen E H. Depressive disorders inthe medically ill: an overview. Psychosomatics 1995; 36:S2–S10.
Castano P., Donato R. F., Anatomia dell'uomo, Edi. Erms 2, 2006.
Castellanos FX, Lee PP, Sharp W, Jeffries NO, Greenstein DK, Clasen LS, Blumenthal JD, James RS, Ebens CL, Walter JM, Zijdenbos A, Evans AC, Giedd JN, Rapoport JL. Developmental trajectories of brain volume abnormalities in children and adolescents with attention-deficit/hyperactivity disorder. JAMA. 2002;288(14):1740-8.
Catani M, Jones DK, Daly E, et al. Altered cerebellar feedback projections in Asperger syndrome. Neuroimage. 2008;41(4):1184–1191.
110
Chambers, W.W., Sprague, J.M., 1955a. Functional localization in the cerebellum. I. Organization in longitudinal cortico-nuclear zones and their contribution to the control of posture, both extrapyramidal and pyramidal. J. Comp. Neurol.103,105–129.
Chambers, W.W., Sprague, J.M., 1955b. Functional localization in the cerebellum. II. Somatotopic organization in cortex and nuclei. AMA Arch. Neurol. Psychiatry 74, 653–680.
Chapin, F. S. (1942). Preliminary standardization of a social insight scale. American Sociological Review, 7, 214–225.
Chen CH, Lennox B, Jacob R, et al. Explicit and implicit facial affect recognition in manic and depressed states of bipolar disorder: a functional magnetic resonance imaging study. Biol Psychiatry 2006;59:31-9.
Chiarugi G., Bucciante L. Istituzioni di anatomia dell'uomo : testo-atlante Ristampa 1978
Cloninger, C. (1987). A systematic method for clinical description and classif ication of personality variants. Archives of General Psychiatry, 44, 573-588.
Clower, D. M., West, R. A., Lynch, J. C., & Strick, P. L. (2001). The inferior parietal lobule is the target of output from the superior colliculus, hippocampus, and cerebellum. Journal of Neuroscience, 21, 6283–6291
Collette F, Van der Linden M, Laureys S, Arigoni F, Delfiore G, Degueldre C, Luxen A, Salmon E (2007) Mapping the updating process: common and specific brain activations across different versions of the running span task. Cortex 43:146-158
Cook M, Murdoch BE, Cahill L. Whelan B-M: Higher-level language deficits resulting from left primary cerebellar lesions. Aphasiology. 2004;18:771–784.
Courchesne E, Saitoh O, Townsend JP, Yeung-Courchesne R, Press GA, Lincoln AJ, et al. Cerebellar hypoplasia and hyperplasia in infantile-autism. Lancet 1994; 343: 63–4.
Courchesne E, Yeung-Courchesne R, Press GA, Hesselink JR,Jernigan TL. Hypoplasia of cerebellar vermal lobules VI and VII in autism. N Engl J Med 1988; 318: 1349–54.
Crespo-Facorro B, Barbadillo L, Pelayo-Terán JM, Rodriguez-Sánchez JM. Neuropsychological functioning and brain structure in schizophrenia. Int Rev Psychiatry. 2007;19(4):325-36.
Crespo-Facorro B, Paradiso S, Andreasen NC, O’Leary DS, Watkins GL, Ponto LL, et al. Neural mechanisms of anhedonia in schizophrenia: a PET study of response to unpleasant and pleasant odors. Journal of the American Medical Association 2001;286(4):427–435.
Crespo-Facorro B, Wiser AK, Andreasen NC, O’Leary DS, Watkins GL, Boles Ponto LL, Hichwa RD. Neural basis of novel and well-learned recognition memory in schizophrenia: a positron emission tomography study. Hum Brain Mapp. 2001;12(4):219-31.
111
Critchley H, Daly E, Phillips M, et al. Explicit and implicit neural mechanisms for processing of social information from facial expressions: a functional magnetic resonance imaging study. Hum Brain Mapp 2000;9:93-105.
Critchley H. Emotion and its disorders. Br Med Bull. 2003;65:35-47.
Critchley HD, Corfield DR, Chandler MP, Mathias CJ, Dolan RJ. Cerebral correlates of autonomic cardiovascular arousal: a functional neuroimaging investigation in humans. J Physiol. 2000;523(Pt 1):259-70.
Critchley HD, Elliott R, Mathias CJ, Dolan RJ. Neural activity relating to generation and representation of galvanic skin conductance responses: a functional magnetic resonance imaging study. J Neurosci. 2000;20(8):3033-40.
Critchley HD, Melmed RN, Mathias CJ, Dolan RJ. Brain activity during biofeedback relaxation: a functional neuroimaging investigation. Brain. 2001;124(Pt 5):1003 -12.
D'Agata F, Caroppo P, Baudino B, Caglio M, Croce M, Bergui M, Tamietto M, Mortara P, Orsi L. The recognition of facial emotions in spinocerebellar ataxia patients. Cerebellum. 2011 Sep;10(3):600-10.
Damasio Antonio. The Feeling of What Happens. Body and Emotion in the Making of Consciousness. Harcourt Brace, New York 2000.
DAMASIO AR, GRABOWSKI TJ, BECHARA A, DAMASIO H, PONTO LL, PARVIZI J, HICHWA RD. Subcortical and cortical brain activity during the feeling of self-generated emotions. Nat Neurosci 3: 1049-1056, 2000.
Damasio AR. Descartes’ Error. New York, NY: Avon Books, Inc; 1994.
Damasio AR. The Feeling of What Happens: Body and Emotion in the Making of Consciousness. New York, NY: Hardcourt Brace; 1999.
Damasio, A. R. (1998). Emotion in the perspective of an integrated nervous system. Brain Research Reviews, 26, 83-86.
Dapretto M, Davies MS, Pfeifer JH, Scott AA, Sigman M, Bookheimer SY, et al. Understanding emotions in others: mirror neuron dysfunction in children with autism spectrum disorders. Nat Neurosci 2006;9:28-30.
Darby DG (1993) Sensory aprosodia: a clinical clue to lesions of the inferior division of the right middle cerebral artery. Neurology 43:567–572.
Darwin, C. (1872). The expression of the emotions in man and animals. London: John Murray.
Davidson RJ, Irwin W. The functional neuroanatomy of emotion and affective style. Trends Cogn Sci. 1999;3:11-21.
Davidson RJ, Jackson DC, Kalin NH. Emotion, plasticity, context, and regulation: perspectives from affective neuroscience. Psychol Bull. 2000;126(spec. issue):890-909.
Davidson, R. J. (1984). Affect, cognition and hemispheric specialization. In C. E. Izard, J. Kagan, & R. Zajonc (Eds.), Emotion, cognition and behavior (pp. 320-365).New York: Cambridge University Press.
112
Davidson, R. J. (1998). Affective style and affective disorders: Perspectives from affective neuroscience. Cognition & Emotion, 12, 307-330.
Davidson, R. J., & Sutton, S. K. (1995). Affective neuroscience: The emergence of a discipline. Current Opinion in Neurobiology, 5, 217-224.
Davidson, R.J., Putnam, K.M. & Larson, C.L. (2000). Dysfunction in the neural circuitry of emotion regulation-A possible prelude to violence. Science, 289 591-594.
Davidson,R. J., & Irwin,W. (1999).The functional neuroanatomy of emotion and affective style. Trends in Cognitive Sciences, 3, 11-21.
Davidson,R. J., Ekman, P., Saron,C. D., Senulis, J. A., & Friesen, W. V. (1990).Approach–withdrawal and cerebral asymmetry: Emotional expression and brain physiology I. Journal of Personality & Social Psychology, 58, 330-341.
Davis M, Whalen PJ. The amygdala: vigilance and emotion. Mol Psychiatry. 2001;6:13-34.
Davis, M. H. (1980). A multidimensional approach to individual differences in empathy. JSAS Catalog of Selected Documents in Psychology, 10, 85.
Davis, M. H. (1994). Empathy: A social psychological approach. CO:Westview Press
Davis, M.H.Empathy: A Social Psychological Approach. Social Psychologial Series, Colorado, Westview Press, 1994.
De Bellis MD, Kuchibhatla M. Cerebellar volumes in pediatric maltreatment-related posttraumatic stress disorder. Biol Psychiatry. 2006;60(7):697-703.
De Michele G, Maltecca F, Carella M, et al: Dementia, ataxia, extrapyramidal features, and epilepsy: phenotype spectrum in two Italian families with spinocerebellar ataxia type 17. Neurol Sci 2003; 24:166–167.
De Smet HJ, Baillieux H, Wackenier P, et al. Long-term cognitive deficits following posterior fossa tumor resection: a neuropsychological and functional neuroimaging follow-up study. Neuropsychology. 2009;23(6):694–704.
De Waal FB. Putting the altruism back into altruism: the evolution of emapthy. Annu Rev Psychol 2007;59:1-22.
Decety J, Jackson PL. The functional architecture of human empathy. Behav Cogn Neurosci Rev 2004;3:71-100.
Deeley Q, Daly EM, Azuma R, et al. Changes in male brain responses to emotional faces from adolescence to middle age. Neuroimage 2008;40:389-97.
DeKosky ST, Heilman KM, Bowers D, Valenstein E (1980) Recognition and discrimination of emotional faces and pictures. Brain Language 9:206 –214.
Del Bello MP, Strakowski SM, Zimmerman ME, Hawkins JM, Sax KW. MRI analysis of the cerebellum in bipolar disorder: a pilot study. Neuropsychopharmacology. 1999;21(1):63-8.
113
DeLisi LE, Sakuma M, Tew W, Kushner M, Hoff AL, Grimson R. Schizophrenia as a chronic active brain process: a study of progressive brain structural change subsequent to the onset of schizophrenia. Psychiatry Res. 1997;74(3):129-40.
Dennett, D. (1987). The intentional stance. Cambridge, MA: MIT Press/Bradford Books.
Desmond JE, Fiez JA (1998) Neuroimaging studies of the cerebellum: language, learning, memory. Trends Neurosci 2:355–362.
Desmond JE, Gabrieli JD, Glover GH (1998) Dissociation of frontal and cerebellar activity in a cognitive task: evidence for a distinction between selection and search. Neuroimage 7:368 –376.
Desmond, J., Gabrieli, J., Wagner, A., Ginier, B., Glover, G., 1997. Lobular patterns of cerebellar activation in verbal working-memory and finger-tapping tasks as revealed by functional MRI. J. Neurosci. 17, 9675–9685.
Diener,E. (1999). Introduction to the special section on the structure of emotion. Journal of Personality&SocialPsychology, 76, 803-804.
Dimitrova A, Kolb FP, Elles HG, Maschke M, Forsting M, Diener HC, Timmann D (2003) Cerebellar responses evoked by nociceptive leg withdrawal reflex as revealed by event-related FMRI. J Neurophysiol 90:1877–1886.
Dolan RJ. A cognitive affective role for the cerebellum. Brain. 1998;121(Pt 4):545-6.
DOW RS, MORUZZI G: The Physiology and Pathology of the Cerebellum. University of Minnesota Press, Minneapolis, 1958.
Drepper J, Timmann D, Kolb FP, Diener HC. Non-motor associative learning in patients with isolated degenerative cerebellar disease. Brain. 1999;122:87–97.
Driessen M, Beblo T, Mertens M, Piefke M, Rullkoetter N, Silva-Saavedra A, Reddemann L, Rau H, Markowitsch HJ, Wulff H, Lange W, Woermann FG. Posttraumatic stress disorder and fMRI activation patterns of traumatic memory in patients with borderline personality disorder. Biol Psychiatry. 2004;55(6):603-11.
Dum RP, Strick PL (2003) An unfolded map of the cerebellar dentate nucleus and its projection to the cerebral cortex. J Neurophysiol 89:634–639.
Dymond, R. F. (1950). Personality and empathy. Journal of Consulting Psychology, 14, 343–350.
EatonWW, Regier DA, Locke BZ, Taube CA. The Epidemiologic Catchment Area Program of the National Institutes of Mental Health. Public Health Rep 1981; 96:319–325
Eisenberg, N., & Miller, P. A. (1987). Empathy and prosocial behavior. Psychological Bulletin, 101, 91–119.
Ekman P. e Davidson R. J., Afterword: Are there Basic Emotions? The Nature of Emotion: Fundamental Questions, Oxford University Press, New York 1994.
Ekman P. e Friesen W. V., Unmasking the Face, a Guide to Recognizing Emotions from Facial Expressions, Prentice Hall, Englewood Cliffs 1975.
114
Ekman P. Darwin, Deception, and Facial Expression, “Annals of the New York Academy of Sciences”, N. 1000, pp. 205-21 (2003).
Ekman P. Handbook of Cognition and Emotion, 1, Basic Emotions; 2, Facial Expressions, Wiley, New York 1999.
Ekman, P. (1999). Basic emotions. In T. Dalgleish & M. J. Power (Eds.),Handbookof cognitionand emotion (pp. 45-60).Chichester, U.K.: Wiley.
Ekman, P., & Friesen,W.V. (1982).Measuring facial movement with the Facial Action Coding System. In P. Ekman (Ed.), Emotion in the human face (pp. 178-211). Cambridge: Cambridge University Press.
Ekman,P. (1992).An argument for basic emotions. Cognition& Emotion, 6, 169-200.
Elkis H. A evolução do conceito de esquizofrenia neste século. Rev Bras Psiquiatr. 2000;22(Suppl 1):23-6.
Eslinger PJ. Neurological and neuropsychological bases of empathy. Eur Neurol 1998;39:193-9.
Exner, C., Weniger, G., Irle, E., 2004. Cerebellar lesions in the PICA but not SCA territory impair cognition. Neurology 63, 2125–2132.
Fabbro F, Moretti R, Bava A. Language impairments in patients with cerebellar lesions. J Neurolinguistics. 2000;13:173–188.
Famularo, G., Corsi, F., Minisola, G., Simone, C.D., Nicotra, G., 2007 . Cerebellar tumour presenting with pathological laughter and gelastic syncope. Eur. J. Neurosci. 14, 940–943.
Farrer C, Franck N, Georgieff N, Frith CD, Decety J, Jeannerod M. Modulating the experience of agency: a positron emission tomography study. Neuroimage 2003;18:324-33.
Fava GA, Rafanelli C, Cazzaro M, Conti S, Grandi S:Well-being therapy. Psychological Medicine, 1998, 28, 475-480
Fava GA, Rafanelli C, Grandi S, Conti S, Belluardo P: Prevention of recurrent depression with cognitive behavioral therapy. Archives of General Psychiatry, 1998, 155, 816-820.
Fava GA, Rafanelli C, Ottolini F, Ruini C, Cazzaro M, Grandi S: Psychological well -being and residual symptoms in remitted patients with panic disorder and agoraphobia. Journal of Affective Disorders, 2001, 65, 185-190.
Fava GA, Ruini C: Sequential treatment of unipolar depression. World Psychiatry 2002, 1, 10-15.
Fellows LK, Farah MJ. The role of ventromedial prefrontal cortex in decision making: judgment under uncertainty or judgment per se? Cereb Cortex 2007;17:2669-74.
Fernandez M, Pissiota A, Frans O, von Knorring L, Fischer H, Fredrikson M. Brain function in a patient with torture related post-traumatic stress disorder before and after fluoxetine treatment: a positron emission tomography provocation study. Neurosci Lett. 2001;297(2):101-4.
115
Ferrier, D. (1876). The Functions of the Brain. London.
Fiez JA, Petersen SE, Cheney MK, et al: Impaired non-motor learning and error detection associated with cerebellar damage. Brain 1992; 115:155–178.
Fiez JA, Raichle ME. Linguistic processing. In: Schmahmann JD, editor. The cerebellum and cognition. International Review of Neurobiology, Vol. 41. San Diego: Academic Press; 1997. p. 233–54.
Fiez, J., Raife, E., Balota, D., Schwarz, J., Raichle, M., Petersen, S. ,1996. A positron emission tomography study of the short-term maintenance of verbal information. J. Neurosci. 16, 808–822.
Filippini N, MacIntosh BJ, Hough MG, Goodwin GM, Frisoni GB, Smith SM, Matthews PM, Beckmann CF, Mackay CE (2009) Distinct patterns of brain activity in young carriers of the APOE-epsilon4 allele. Proc Natl Acad Sci U S A 106:7209 –7214.
Fink, G.R., Marshall, J.C., Shah, N.J., Weiss, P.H., Halligan, P.W., Grosse -Ruyken, M., Ziemons, K., Zilles, K., Freund, H.J., 2000. Line bisection judgments implicate right parietal cortex and cerebellum as assessed by fMRI. Neurology 54, 1324–1331.
FINK, R. P. & HEIMER, L. (1967). Two methods for selective silver impregnation of degenerating axons and their synaptic endings in the central nervous system. Brain Research 4, 369-374.
Fischer H, Sandblom J, Gavazzeni J, et al. Age-differential patterns of brain activation during perception of angry faces. Neurosci Lett 2005;386:99-104.
Fitzgerald DA, Angstadt M, Jelsone LM, et al. Beyond threat: amygdala reactivity across multiple expressions of facial affect. Neuroimage 2006;30:1441-8.
FitzGerald T. M. J., Gruener G., Neuroanatomia con riferimenti funzionali e clinici, 2008.
Folstein SE: Huntington’s Disease: A Disorder of Families. Baltimore, Johns Hopkins University Press, 1989
Fox MD, Raichle ME (2007) Spontaneous fluctuations in brain activity observed with functional magnetic resonance imaging. Nat Rev Neurosci 8:700 –711.
Fox PT, Raichle ME, Thach WT. Functional mapping of the human cerebellum with positron emission tomography. Proc Natl Acad Sci USA 1985;82:7462–7466.
Fox, N. A., & Davidson, R. J. (1986). Smiles to the stranger, joy to the mother: EEG asymmetry discriminates between felt and unfelt smiles in human infants [Abstract]. Psychophysiology, 23, 436.
Frank MG, Stennett J. The forced-choice paradigm and the perception of facial expressions of emotion. J Pers Soc Psychol 2001;80:75-85.
Frank, B., Schoch, B., Richter, S., Frings, M., Karnath, H.-O., Timmann, D., 2007. Cerebellar lesion studies of cognitive function in children and adolescents — limitations and negative findings. Cerebellum 6, 242–253.
Fried I, Mateer C, Ojemann G, Wohns R, Fedio P (1982) Organization of visuospatial functions in human cortex. Brain 105:349 –371.
116
Frith U, Frith CD. Development and neurophysiology of mentalizing. Philos Trans R Soc Lond B Biol Sci 2003;358:459-73.
Fusar-Poli P; Placentino, A; Carletti, F; Landi, P; Allen, P; Surguladze, S; Benedetti, F; Abbamonte, M; Gasparotti, R; Barale, F; Perez, J; McGuire, P; Politi, P. Functional atlas of emotional faces processing: a voxel-based meta-analysis of 105 functional magnetic resonance imaging studies. J Psychiatry Neurosci 2009;34(6):418-32.
Gainotti,G., Caltagirone,C., & Zoccolotti,P. (1993). Left /right and cortical/subcortical dichotomies in the neuropsychological study of human emotions. Cognition& Emotion, 7, 71-93.
Gallagher HL, Frith CD. Functional imaging of ‘theory of mind’. Trends Cogn Sci 2003;7:77-83.
Gallese V. Before and below ‘theory of mind’: embodied simulation and the neural correlates of social cognition. Philos Trans R Soc Lond B Biol Sci 2007;362:659-69.
Gallese V. The roots of empathy: the shared manifold hypothesis and the neural basis of intersubjectivity. Psychopathology 2003;36:171-80
Garrard P, Martin NH, Giunti P, Cipolotti L. Cognitive and social cognitive functioning in spinocerebellar ataxia : a preliminary characterization. J Neurol. 2008 Mar;255(3):398-405. Epub 2008 Mar 20.
Gazzola V, Aziz-Zadeh L, Keysers C. Empathy and the somatotopic auditory mirror system in humans. Curr Biol 2006;16:1824-9.
George, M.S., Ketter, T.A., Gill, D.S., Haxby, J.V., Ungerleider, L.G., Herscovitch, P., Post, R.M., 1993. Brain regions involved in recognizing facial emotion or identity: an oxygen-15 PET study. J. Neuropsychiatry Clin. Neurosci. 5, 384–394.
Giedd JN, Blumenthal J, Molloy E, Castellanos FX. Brain imaging of attention deficit/hyperactivity disorder. Ann N Y Acad Sci. 2001;931:33-49.
Glickstein, M., & Doron, K. (2008). Cerebellum: Connections and functions. Cerebellum, 7, 589–594.
Glickstein, M., May 3rd, J.G., Mercier, B.E., 1985. Corticopontine projection in the macaque: the distribution of labelled cortical cells after large injections of horseradish peroxidase in the pontine nuclei. J. Comp. Neurol. 235, 343–359.
Goel V, Dolan RJ. The functional anatomy of humor: segregating cognitive and affective components. Nature Neuroscience 2001;4(3):237–238.
Gomez Beldarrain M, Garcia-Monco JC, Quintana JM, et al: Diaschisis and neuropsychological performance after cerebellar stroke. Eur Neurol 1997; 37:82–89.
GOODFELLOW, E. F. and NIEMER, W. T. 1961. The spread of after-discharge from stimulation of the rhinencephalon in the cat. Electroenceph. Clin. Neurophysiol. 13: 710-721.
Gorno-Tempini ML, Pradelli S, Serafini M, et al. Explicit and incidental facial expression processing: an fMRI study. Neuroimage 2001;14:465-73.
117
Gottwald B, Wilde B, Mihajlovic Z, et al: Evidence for distinct cognitive deficits after focal cerebellar lesions. J Neurol, Neurosurgery Psychiatry 2004; 75:1524–1531.
Grafman J, Litvan I, Massaquoi S, et al: Cognitive planning deficit in patients with cerebellar atrophy. Neurology 1992; 42:1493–1496.
Gray, J. (1982). The neuropsychology of anxiety. New York: Oxford University Press.
Gray, J.M.,Young,A.W., Barker,W.A., Curtis,A., & Gibson,D. (1997). Impaired recognition of disgust in Huntington’s disease gene carriers. Brain, 120, 2029 -2038.
Green, D. P., & Salovey, P. (1999). In what sense are positive and negative affect independent? A reply to Tellegen, Watson, and Clark. Psychological Science, 10, 304-306.
Greicius MD, Krasnow B, Reiss AL, Menon V (2003) Functional connectivity in the resting brain: a network analysis of the default mode hypothesis. Proc Natl Acad Sci U S A 100:253–258.
Greicius MD, Srivastava G, Reiss AL, Menon V (2004) Default-mode network activity distinguishes Alzheimer’s disease from healthy aging: evidence from functional MRI. Proc Natl Acad Sci U S A 101:4637– 4642.
Greicius MD. Dissociable intrinsic connectivity networks for salience processing and executive control. J Neurosci (2007) 27:2349 –2356.
Grill J, Viguier D, Kieffer V, Bulteau C, Sainte-Rose C, Hartmann O, Kalifa C, Dellatolas G. Critical risk factors for intellectual impairment in children with posterior fossa tumors: the role of cerebellar damage. J Neurosurg. 2004;101(Suppl 2):152-8.
Grodd W, Hülsmann E, Ackermann H. Functional MRI localizing in the cerebellum. Neurosurg Clin N Am 2005;16:77–99.
Grodd,W., Hulsmann, E., Lotze, M., Wildgruber, D., Erb, M., 2001. Sensorimotor mapping of the human cerebellum: fMRI evidence of somatotopic organization. Hum. Brain Mapp. 13, 55–73.
Grossmann T, Johnson MH. The development of the social brain in human infancy. Eur J Neurosci 2007;25:909-19.
Gross-Tsur, V., Ben-Bashat, D., Shalev, R.S., Levav, M., Sira, L.B., 2006. Evidence of a developmental cerebello-cerebral disorder. Neuropsychologia 44, 2569–2572.
Gur RC, Skolnick BE, Gur RE (1994) Effects of emotional discrimination tasks on cerebral blood flow: regional activation and its relation to performance. Brain Cognit 25:271–286.
Guyer AE, Monk CS, McClure-Tone EB, et al. A developmental examination of amygdala response to facial expressions. J Cogn Neurosci 2008;20:1565-82.
Habas C., Kamdar N., Nguyen D., Prater K., Beckmann C., Menon V., Greicius M. D., 2009. Distinct Cerebellar Contributions to Intrinsic Connectivity Networks. J. Neurosci., 29(26):8586–8594.
118
Habel U, Windischberger C, Derntl B, et al. Amygdala activation and facial expressions: explicit emotion discrimination versus implicit emotion processing. Neuropsychologia 2007;45:2369-77.
Haines DE, Dietrichs E (1984) An HRP study of hypothalamocerebellar and cerebello-hypothalamic connections in squirrel monkey (Saimiri sciureus). J Comp Neurol 229:559 –575.
Haines DE, Dietrichs E, Mihailoff GA, McDonald EF (1997) Cerebellarhypothalamic axis: basis circuits and clinical observations. Int Rev Neurobiol 41:83–107.
Hallet M, Grafman J. Executive function and motor skill learning. In: Schmahmann JD, editor. The cerebellum and cognition. Academic Press; 2006. p. 297-319.
Hamilton NG, Frick RB, Takahashi T, Hopping MW. Psychiatric symptoms and cerebellar pathology. Am J Psychiatry. 1983;140(10):1322-6.
Hammerlid E, Ahlner-Elmqvist M, Bjordal K, et al “A prospective multicentre study in Sweden and Norway of mental distress and psychiatric morbidity in head and neck cancer patients”. British Journal of Cancer, 1999
Hartmann-von Monakow K, Akert K, Künzle H. Projection of precentral, premotor and prefrontal cortex to the basilar pontine grey and to nucleus reticularis tegmenti pontis in the monkey (Macaca fascicularis). Schweiz Arch Neurol Neurochir Psychiatr 1981;129(2):189–208.
Hartwig Holzapfel, Matthias Denecke,Christain Fuegen, Alex Waibel “Integrating Emotional Cues into a Framework for Dialogue Management” Fourth IEEE International Conference on Multimodal Interfaces (ICMI'02) October 14 - 16, 2002.
Heath RG, Franklin DE, Walker CF, Keating JW Jr. Cerebellar vermal atrophy in psychiatric patients. Biological Psychiatry 1982;17(5):569–583.
Heath, R., Franklin, D., Shraberg, D., 1979. Gross pathology of the cerebellum in patients diagnosed and treated as functional psychiatric disorders. J. Nerv. Ment. Dis. 167, 585–592.
Heller,W., & Nitschke, J. B. (1997). Regional brain activity in emotion: A framework for understanding cognition in depression. Cognition& Emotion, 11, 637-661.
Heller,W., Nitschke, J. B., & Miller,G. A. (1998). Lateralization in emotion and emotional disorders. Current Directions in Psychological Science, 7, 26-32.
Helmchen C, Mohr C, Erdmann C, et al. Cerebellar neural responses related to actively and passively applied noxious thermal stimulation in human subjects: a parametric fMRI study. Neurosci Lett. 2004;361:237–240.
Helmchen C, Mohr C, Erdmann C, et al. Differential cerebellar activation related to perceived pain intensity during noxious thermal stimulation in humans: a functional magnetic resonance imaging study. Neurosci Lett. 2003;335:202–206.
HERRICK THE C. J.FUNCTIONS OF THE OLFACTORY PARTS OF THE CEREBRAL CORTEX.1933 The Journal of Comparative Neurology, 58( 1): 1–288.
Hoffman ML. Empathy, its development and prosocial implications. Nebr Symp Motiv 1977;25:169-217.
119
Hoffman, M. L. (1984). Interaction of affect and cognition in empathy. In C. E. Izard & R. B. Kagan (Eds.), Emotions, cognition, and behavior (pp. 103–131). Cambridge: Cambridge University Press.
Hokkanen, L.S., Kauranen, V., Roine, R.O., Salonen, O., Kotila, M., 2006. Subtle cognitive deficits after cerebellar infarcts. Eur. J. Neurol. 13, 161–170.
Holmes, G., 1939. The cerebellum of man. Brain 62, 1–30.
Holstege G, Georgiadis JR, Paans AM, Meiners LC, van der Graaf FH, Reinders AA. Brain activation during human male ejaculation. Journal of Neuroscience 2003;23(27):9185–9193.
Holzapfel Hartwig, Fuegen Christian. Integrating Emotional Cues into a Framework for Dialogue Management. Interactive Systems Laboratories University of Karlsruhe. IEEE Computer Society Washington, DC, USA 2002.
Hoover, J. E., & Strick, P. L. (1999). The organization of cerebellar and basal ganglia outputs to primary motor cortex as revealed by retrograde transneuronal transport of herpes simplex virus type 1. Journal of Neuroscience, 19, 1446–1463.
Hubrich-Ungureanu, P., Kaemmerer, N., Henn, F., Braus, D., 2002. Lateralized organization of the cerebellum in a silent verbal fluency task: a functional magnetic resonance imaging study in healthy volunteers. Neurosci. Lett. 319, 91–94.
Hui KK, Liu J, Marina O, Napadow V, Haselgrove C, Kwong KK, Kennedy DN, Makris N (2005) The integrated response of the human cerebrocerebellar and limbic systems to acupuncture stimulation at ST 36 as evidenced by fMRI. Neuroimage 27:479–496.
Husted DS, Shapira NA, Goodman WK. The neurocircuitry of obsessive-compulsive disorder and disgust. Prog Neuropsychopharmacol Biol Psychiatry 2006;30:389-99.
Hynes CA, Baird AA, Grafton ST. Differential role of the orbital frontal lobe in emotional versus cognitive perspective-taking. Neuropsychologia 2006;44:374-83.
Ichimiya T, Okubo Y, Suhara T, Sudo Y. Reduced volume of the cerebellar vermis in neuroleptic-naive schizophrenia. Biol Psychiatry. 2001;49(1):20-7.
Iidaka T, Okada T, Murata T, et al. Age-related differences in the medial temporal lobe responses to emotional faces as revealed by fMRI. Hippocampus 2002;12:352-62.
Imaizumi, S., Mori, K., Kiritani, S., Kawashima, R., Sugiura, M., Fukuda, H., Itoh, K., Kato, T., Nakamura, A., Hatano, K., Kojima, S., Nakamura, K., 1997. Vocal identification of speaker and emotion activates different brain regions. Neuroreport 8, 2809–2812.
Isaacson RL. 1982. The Limbic System. New York: Plenum.
Ito M. Movement and thought: identical control mechanisms by the cerebellum. Trends in Neuroscience 1993;16(11):448–450. 453–444.
120
Ito, M. (2006). Cerebellar circuitry as a neuronal machine. Progress in Neurobiology, 78, 272–303.
Izard,C.E. (1971). The face of emotion. New York: Appleton-Century-Crofts.
Jabbi M, Swart M, Keysers C. Empathy for positive and negative emotions in the gustatory cortex. Neuroimage 2007;34:1744-53.
Jantzen KJ, Steinberg FL, Kelso JA (2004) Brain networks underlying human timing behavior are influenced by prior context. Proc Natl Acad Sci U S A 101:6815– 6820.
Jurjus GJ, Weiss KM, Jaskiw GE. Schizophrenia-like psychosis and cerebellar degeneration. Schizophr Res. 1994;12(2):183-4.
Kaada BR. 1960. Cingulate, posterior orbital,anterior insular and temporal pole cortex. In Handbook of Physiology: Neurophysiology II, ed. J Field, HJ Magoun, VE Hall, pp. 1345–72. Washington, DC: Am. Physiol.Soc. Livingston KE, Escobar A. 1971. Anatomical bias of the limbic system concept. Arch. Neurol. 24:17–21.
Kalin,N.H., Larson, C., Shelton, S. E., & Davidson, R. J. (1998). Asymmetric frontal brain activity, cortisol, and behavior associated with fearful temperament in rhesus monkeys. Behavioral Neuroscience, 112, 286-292.
Kanwisher N, McDermott J, Chun MM. The fusiform face area: a module in human extrastriate cortex specialized for face perception. J Neurosci 1997;17:4302-11.
Kaplan JT, Iacoboni M. Getting a grip on other minds: mirror neurons, intention understanding, and cognitive empathy. Soc Neurosci 2006;1:175-83.
Kase CS, Norrving B, Levine SR, Babikian VL, Chodosh EH, Wolf PA, Welch KM. Cerebellar infarction Clinical and anatomic observations in 66 cases. Stroke 1993;24:76–83.
Katsetos CD, Hyde TM, Herman MM. Neuropathology of the cerebellum in schizophrenia--an update: 1996 and future directions. Biol Psychiatry. 1997;42(3):213-24.
Keller A, Castellanos FX, Vaituzis AC, Jeffries NO, Giedd JN, Rapoport JL. Progressive loss of cerebellar volume in childhood onset schizophrenia. Am J Psychiatry. 2003;160(1):128-33.
Kelly RM, Strick PL. Cerebellar loops with motor cortex and prefrontal cortex of a nonhuman primate. J Neurosci 2003;23:8432–8444.
Kerr, W. A., & Speroff, B. G. (1954). Validation and evaluation of the empathy test. Journal of General Psychology, 50, 369–376.
Keyes CLM, Shmotkin D, Ryff CD: Optimizing well-being: the empirical encounter of two traditions. Journal of Personality and Social Psychology, 2002, 82, 1007-1022.
Keysar B, Lin S, Barr DJ. Limits on theory of mind in adults. Cognition 2003;89:25 -41.
Kilts CD, Kelsey JE, Knight B, Ely TD, Bowman FD, Gross RE, Selvig A, Gordon A, Newport DJ, Nemeroff CB. The neural correlates of social anxiety disorder and
121
response to pharmacotherapy. Neuropsychopharmacology. 2006;31(10):2243-53.
Kingma A, Mooij JJA, Metemaekers JDM, et al: Transient mutism and speech disorders after posterior fossa surgery in children with brain tumors. Acta Neurochir 1994; 131:74–79.
Kingsley, J. Mind Reading: the interactive guide to emotions, London, 2003. www.human-emotions.com
Kington J.M., Jones L. A., Watt A.A., Hopkin E.J., William J. (2000). Impaired eye expression recognition in schizophrenia. Journal of Psychiatric Research, 34, 341-347.
Kinsbourne,M. (1978). Biological determinants of functional bisymmetry and asymmetry. In M. Kinsbourne (Ed.), Asymmetrical function of the brain (pp. 3-13).
Kish SJ, el-Awar M, Schut L, et al: Cognitive deficits in olivopontocerebellar atrophy: implications for the cholinergic hypothesis of Alzheimer’s dementia. Ann Neurol 1988; 24:200–206.
Kleinginna Paul R. Jr. and Kleinginna Anne M. A Categorized List of Emotion Definitions, with Suggestions for a Consensual Definition. 1981 Motivation and Emotion 5(4):345-349.
Klinnert M., Campos J., Sorce J. e altri, Emotions as Behavior Regulators in Infancy: Social Referencing in Infancy, in R. Plutchik e H. Kellerman (a cura di), Emotion: Theory, Research and Experience, vol. 2, Emotion in Early Development, Academic Press, New York 1983.
Kodama T, Nakagawa M, Arimura K, et al. Cross-sectional analysis of neurological findings among healthy elderly: study in a remote island in Kagoshima, Japan. Neuroepidemiology. 2002;21:36–43.
Koenigs M, Tranel D. Irrational economic decision-making after ventromedial prefrontal damage: evidence from the Ultimatum Game. J Neurosci 2007;27:951-6.
Koenigs M, Young L, Adolphs R, Tranel D, Cushman F, Hauser M, et al. Damage to the prefrontal cortex increases utilitarian moral judgements. Nature 2007;446:908-11.
Kohler, W. (1929). Gestalt psychology. New York: Liveright.
Konarski JZ, McIntyre RS, Grupp LA, Kennedy SH. Is the cerebellum relevant in the circuitry of neuropsychiatric disorders? J Psychiatry Neurosci. 2006;30(3):178-86.
Kotter R, Meyer N. 1992. The limbic system: a review of its empirical foundation. Behav. Brain Res. 52:105–27.
Kranz F, Ishai A. Face perception is modulated by sexual preference. Curr Biol 2006;16:63-8.
122
Landgrebe M, Marienhagen J, Langguth B, Sand P, Eichhammer P, Hajak G. Cerebellar and thalamic metabolic changes visualized by [18]-FDG-PET in olanzapine-induced acute akathisia. Neuro Endocrinol Lett. 2006;27(6):737-9.
Lane RD, Reiman EM, Ahern GL, Schwartz GE, Davidson RJ. Neuroanatomical correlates of happiness, sadness, and disgust. Am J Psychiatry. 1997;154(7):926-33
Lang, P. J., Bradley, M. M., & Cuthbert, B. N. (1997).Motivated attention: Affect, activation, and action. In P. J. Lang, R. F. Simons, & M. T. Balaban (Eds.), Attention and orienting: Sensory and motivational processes (pp. 97-135).
Lantieri F, Glessner JT, Hakonarson H, et al. Analysis of GWAS top hits in ADHD suggests association to two polymorphisms located in genes expressed in the cerebellum. Am J Med Genet B Neuropsychiatr Genet. 2010 Sep;153B(6):1127–33.
Lasek K, Lencer R, Gaser C, et al: Morphological basis for the spectrum of clinical deficits in spinocerebellar ataxia 17 (SCA17). Brain 2006; 129:2341–2352.
Lawrence,A. D., Calder,A. J., McGowan, S. V., & Grasby, P.M. (2002).Selective disruption of the recognition of facial expressions of anger. NeuroReport, 13, 881-884.
Le, T.H., Pardo, J.V., Hu, X.P., 1998. 4 T-fMRI study of nonspatial shifting of selective attention: cerebellar and parietal contributions. J. Neurophysiol. 79, 1535–1548.
LeDoux J., Il cervello emotivo. Alle origini delle emozioni (2001), Baldini Castoldi Dalai, Milano 2002-04.
LeDoux JE, Farb CR. Neurons of the acoustic thalamus that project to the amygdala contain glutamate. Neurosci Lett. 1991 Dec 16;134(1):145-9.
LeDoux JE. Emotion circuits in the brain. Annual Review of Neuroscience 2000;23:155–184.
LeDoux JE. The Emotional Brain. New York, NY: Touchstone; 1996.
LeDoux, J.E., 1996. The Emotional Brain. Simon & Schuster, New York.
LeDoux, JE. The Emotional Brain: The mysterious underpinnings of emotional life. New York: Simon and Schuster; 1996.
Lee TM, Liu HL, Hoosain R, et al. Gender differences in neural correlates of recognition of happy and sad faces in humans assessed by functional magnetic resonance imaging. Neurosci Lett 2002;333:13-6.
Leggio MG, Silveri MC, Petrosini L, Molinari M. Phonological grouping is specifically affected in cerebellar patients: A verbal fluency study. J Neurol Neurosurg Psychiatry. 2000;69:102–106.
Leiberg S, Anders S. The multiple facets of empathy: a survey of theory and evidence. Prog Brain Res 2006;156:419-40.
Leiner, H., Leiner, A., Dow, R., 1986. Does the cerebellum contribute to mental skills? Behav. Neurosci. 100, 443–454.
123
Leroi I, O’Hearn E, Marsh L, et al: Psychopathology in patients with degenerative cerebellar diseases: a comparison to Huntington’s disease. Am J Psychiatry 2002; 159:1306–1314.
Leroy I, O’hearn E, Margolis R. Psychiatric syndromes in cerebellar degeneration. Int Rev Psychiatry (Abingdon, England). 2001;13:323-9.
Leslie, A. Pretence and representation: the origins of theory of mind. Psychological Review, 1987;99:412-26.
Levisohn L, Cronin-Golomb A, Schmahmann JD. Neuropsychological sequelae of cerebellar tumors in children. Soc Neurosci Abstr 1997; 23: 496.
Levisohn L, Cronin-Golomb A, Schmahmann JD: Neuropsychological consequences of cerebellar tumor resection in children: cerebellar cognitive affective syndrome in a pediatric population. Brain 2000; 123:1041–1050.
Ley, R., & Bryden, M. (1979). Hemispheric differences in recognizing faces and emotions. Brain and Language, 7, 127-138.
Liddell BJ, Brown KJ, Kemp AH, Barton MJ, Das P, Peduto A, et al. A direct brainstem-amygdalacortical ‘alarm’ system for subliminal signals of fear. Neuroimage 2005;24(1):235–243.
Liotti M, Mayberg HS, McGinnis S, Brannan SL, Jerabek P. Unmasking disease-specific cerebral blood flow abnormalities: mood challenge in patients with remitted unipolar depression. Am J Psychiatry. 2002;159(11):1830-40.
Lippmann S, Manshadi M, Baldwin H, Drasin G, Rice J, Alrajeh S. Cerebellar vermis dimensions on computerized tomographic scans of schizophrenic and bipolar patients. Am J Psychiatry. 1982;139(5):667-8.
Lisspers J, Nygren A & Soderman E. “Hospital Anxiety and Depression Scale (HAD): some psychometric data for a Swedish sample”. Acta Psychiatrica Scandinavica, 1997
Liszewski CM, O’Hearn E, Leroi I, et al: Cognitive impairment and psychiatric symptoms in 133 patients with diseases associated with cerebellar degeneration. J Neuropsychiatry Clin Neurosci 2004; 16:109–112.
Liu T, Xu D, Ashe J, Bushara K (2008) The specificity of inferior olive response to stimulus timing. J Neurophysiol 100:1557–1561.
Loeber RT, Sherwood AR, Renshaw PF, Cohen BM, Yurgelun-Todd DA. Differences in cerebellar blood volume in schizophrenia and bipolar disorder. Schizophr Res. 1999;37(1):81-9.
Luo L, O’Leary DD (2005) Axon retraction and degeneration in development and disease. Annu Rev Neurosci 28:127–156.
Lynch, J. C., Hoover, J. E., & Strick, P. L. (1994). Input to the primate frontal eye field from the substantia nigra, superior colliculus, and dentate nucleus demonstrated by transneuronal transport. Experimental Brain Research, 100, 181–186.
Mackie S, Shaw P, Lenroot R, Pierson R, Greenstein DK, Nugent TF 3rd, Sharp WS, Giedd JN, Rapoport JL. Cerebellar development and clinical outcome in attention deficit hyperactivity disorder. Am JPsychiatry. 2007;164(4):647-55.
124
MacLEAN PD. Psychosomatic disease and the visceral brain; recent developments bearing on the Papez theory of emotion. Psychosom Med. 1949 Nov-Dec;11(6):338-53.
MacLean PD. Some psychiatric implications of physiological studies on the frontotemporal portion of the limbic system. Electroencephalogr Clin Neurophysiol. 1952;4:407-418.
MacLean, P. D. (1993). Cerebral evolution of emotion. In M. Lewis & J. M. Haviland (Eds.), Handbook of emotions (pp. 67-83). New York: Guilford.
MacLean, P. D. (2001). Ongoing discussion of book reviews of Jaak Panksepp (1998), Affective neuroscience. NeuroPsychoanalysis, 3, 81-85.
Mandal, M. K., Asthana, H. S., Tandon, S. C., & Asthana, S. (1992). Role of cerebral hemispheres and regions in processing hemifacial expression of emotion: Evidence from brain-damage. International Journal of Neuroscience, 63, 187-195.
Mandal,M. K., Mohanty,A., Pandey,R., & Mohanty, S. (1996). Emotion-specific processing deficit in focal brain-damaged patients. International Journal of Neuroscience, 84, 87-95.
Manni, E., Petrosini, L., 2004. A century of cerebellar somatotopy: a debated representation. Nat. Rev. Neurosci. 4, 240–249.
Martin-Solch C, Magyar S, Kunig G, Missimer J, Schultz W, Leenders KL. Changes in brain activation associated with reward processing in smokers and nonsmokers. A positron emission tomography study. Experimental Brain Research 2001;139(3):278–286.
Matsumoto D. e Cortini M., Studio cross-culturale delle emozioni, “Editoria Scientifica Elettronica”, pp. 1-22 (2001).
McClure EB, Monk CS, Nelson EE, et al. A developmental examination of gender differences in brain engagement during evaluation of threat. Biol Psychiatry 2004;55:1047-55.
McNair, D.M., Lorr, M., y Droppleman, L.F. (1971). Manualflr the Profile ofMood States. San Diego, California: EdITS/Educational and Industrial Testing Service.
Mead, G. H. (1934). Mind, self, and society. Chicago: University of Chicago Press.
Melzack R, Casey KL. Sensory, motivational and central control determinants of chronic pain: a new conceptual model. In: Kenshalo DDR, editor. The Skin Senses. Charles C. Thomas; Springfield: 1968. pp. 423–443.
Mendoza, S. P., & Ruys, J. D. (2001). The beginning of an alternative view of the neurobiology of emotion. Social Science Information, 40, 39-60.
Middleton, F. A., & Strick, P. L. (2001). Cerebellar projections to the prefrontal cortex of the primate. Journal of Neuroscience, 15, 700–712.
Middleton, F.A., Strick, P.L., 1994. Anatomical evidence for cerebellar and basal ganglia involvement in higher cognitive function. Science 266, 458–461.
125
Mills NP, Delbello MP, Adler CM, Strakowski SM. MRI analysis of cerebellar vermal abnormalities in bipolar disorder. Am J Psychiatry. 2005;162(8):1530-2.
Mills, C. K. (1912). The cortical representation of emotion, with a discussion of some points in the general nervous system mechanism of expression in its relation to organic nervous disease and insanity. Proceedings of the American Medico-Psychological Association, 19, 297-300.
Mitchell JP, Macrae CN, Banaji MR. Dissociable medial prefrontal contributions to judgments of similar and dissimilar others. Neuron 2006;50:655-63.
Molinari, M., Leggio, M., 2007. Cerebellar information processing and visuospatial functions. Cerebellum 6, 214–220.
Molinari, M., Petrosini, L., Misciagna, S., Leggio, M., 2004. Visuospatial abilities in cerebellar disorders. J. Neurol. Neurosurg. Psychiatry 75, 235–240.
Moll J, Eslinger PJ, Oliveira-Souza R. Frontopolar and anterior temporal cortex activation in a moral judgment task: preliminary functional MRI results in normal subjects. Arq Neuropsiquiatr 2001;59:657-64.
Monti MM, Osherson DN, Martinez MJ, Parsons LM (2007) Functional neuroanatomy of deductive inference: a language-independent distributed network. Neuroimage 37:1005–1016.
Moorey S, Greer S, Watson M, et al “The factor structure and factor stability of the Hospital Anxiety and Depression Scale in patients with cancer”. British Journal of Psychiatry, 1991
Morris JS, Ohman A, Dolan RJ. A subcortical pathway to the right amygdala mediating “unseen” fear. Proceedings of the National Academy of Sciences of the United States of America 1999;96(4):1680–1685.
MORUZZI G: Sur les rapports entre le paléocervelet et le réflexes vasomoteurs. Ann Physiol 14: 605-612, 1938.
Moulton EA, Schmahmann JD, Becerra L, Borsook D. The cerebellum and pain: Passive integrator or active participator? Brain Res Rev. 2010 Oct 5;65(1):14–27. Epub 2010 May 27.
Mula M, Marotta A.E, Chiodo Martinetto R., Monaco F. Riconoscimento delle espressioni facciali delle emozioni e demenze: dall’antropologia alla clinica. Psicologi a confronto 2011,5(2)
Murdoch BE. The cerebellum and language: historical perspective and review. Cortex. 2010;46(7):858–868.
Murphy FC, Nimmo-Smith I, Lawrence AD. Functional neuroanatomy of emotions: a meta-analysis. Cogn Affect Behav Neurosci. 2003 Sep;3(3):207-33.
MUSSEN, A. T. (1927). Experimental investigations on the cerebellum. Brain, 50, 313-349.
Nasrallah HA, Jacoby CG, McCalley-Whitters M. Cerebellar atrophy in schizophrenia and mania. Lancet. 1981;1(8229):1102.
126
Nauta WJH, Karten HJ. 1970. A general profile of the vertebrate brain, with sidelights on the ancestry of cerebral cortex. See Schmitt 1970, pp. 7–26
Nauta WJH. 1979. Expanding borders of the limbic system concept. In Functional Neurosurgery, ed. T Rasmussen, R Marino, pp. 7–23. New York: Raven
Nawrot, M., Rizzo, M., 1998. Chronic motion perception deficits from midline cerebellar lesions in human. Vision Res. 38, 2219–2224.
Neumann J, von Cramon DY, Lohmann G. Model-based clustering of meta-analytic functional imaging data. Hum Brain Mapp 2008;29:177-92.
Nitschke MF, Kleinschmidt A, Wessel K, Frahm J. Somatotopic motor representation in the human anterior cerebellum. A high-resolution functional MRI study. Brain 1996;119:1023–1029.
Nopoulos PC, Ceilley JW, Gailis EA, Andreasen NC. An MRI study of cerebellar vermis morphology in patients with schizophrenia: evidence in support of the cognitive dysmetria concept. Biol Psychiatry. 1999;46(5):703-11.
Nopoulos PC, Ceilley JW, Gailis EA, Andreasen NC. An MRI study of midbrain morphology in patients with schizophrenia: relationship to psychosis, neuroleptics, and cerebellar neural circuitry. Biol Psychiatry. 2001;49(1):13-9.
Norcross John C., Guadagnoli E., Prochaska J. O. Factor structure of the Profile of Mood States (POMS): Two partial replications. 2006
Norcross, J. , Guadagnoli, E., y Prochaska, J. (1984). Factor Structure of the Profile of Mood States (POMS): Two partial replications. Journal ofClinical Psychology,
Ohman A, Soares JJ. “Unconscious anxiety”: phobic responses to masked stimuli. Journal of Abnormal Psychology 1994;103(2):231–240.
Ohman A. The role of the amygdala in human fear: automatic detection of threat. Psychoneuroendocrinology 2005;30(10):953–958.
Ojemann JG, Ojemann GA, Lettich E (1992) Neuronal activity related to faces and matching in human right nondominant temporal cortex. Brain 115:1–13.
Okugawa G, Sedvall G, Nordstrom M, Andreasen N, Pierson R, Magnotta V, Agartz I. Selective reduction of the posterior superior vermis in men with chronic schizophrenia. Schizophr Res. 2002;55(1-2):61-7.
Ortony, A., & Turner, T. J. (1990). What’s basic about basic emotions? Psychological Review, 97, 315-331.
Oscarsson O. Functional organzation of the spino- and cuneocerebellar tracts. Physiol Rev 1965;45:495-522.
Palmen SJ, van Engeland H, Hof PR, Schmitz C. Neuropathological findings in autism. Brain. 2004;127(12):2572–2583.
Panksepp J. 1998. Affective Neuroscience: The Foundations of Human and Animal Emotions. New York: Oxford Univ. Press
127
Panksepp, J. (2000).Emotions as natural kinds within the mammalian brain. In M. Lewis & J. M. Haviland-Jones (Eds.), Handbook of emotions (2nd ed., pp. 137-156).New York: Guilford.
Papez J. W. A proposed mechanism of emotion. Arch. Neurol. Psych. 1973; 28:725-743.
Paradiso S, Andreasen NC, Crespo-Facorro B, O’Leary DS, Watkins GL, Boles Ponto LL, et al. Emotions in unmedicated patients with schizophrenia during evaluation with positron emission tomography. American Journal of Psychiatry 2003a;160(10):1775–1783.
Paradiso, S., Johnson, D.L., Andreasen, N.C., O'Leary, D.S., Watkins, G .L., Ponto, L.L., Hichwa, R.D., 1999. Cerebral blood flow changes associated with attribution of emotional valence to pleasant, unpleasant, and neutral visual stimuli in a PET study of normal subjects. Am. J. Psychiatry 156, 1618–1629.
Paradiso, S., Robinson, R.G., Boles Ponto, L.L.,Watkins, G.L., Hichwa, R.D., 2003. Regional cerebral blood flow changes during visually induced subjective sadness in healthy elderly persons. J. Neuropsychiatry Clin. Neurosci. 15, 35–44.
Parsons LM, Denton D, Egan G, McKinley M, Shade R, Lancaster J, Fox PT (2000) Neuroimaging evidence implicating cerebellum in support of sensory/cognitive processes associated with thirst. Proc Natl Acad Sci U S A 97:2332–2336.
Parsons LM, Fox PT. Sensory and cognitive functions. In: Schmahmann JD, editor. The cerebellum and cognition. International Review of Neurobiology, Vol. 41. San Diego: Academic Press; 1997. p. 255–71.
Parsons, L.M., Fox, P.T., Downs, J.H., Glass, T., Hirsch, T.B., Martin, C.C., Jerabek, P.A., Lancaster, J.L., 1995. Use of implicit motor imagery for visual shape discrimination as revealed by PET. Nature 375, 54–58.
Parvizi, J., Joseph, J., Press, D.Z., Schmahmann, J.D., 2007. Pathological laughter and crying in patients with multiple system atrophy-cerebellar type. Mov. Disord. 22, 798–803.
Parvizi, J., Schiffer, R., 2007. Exaggerated crying and tremor with a cerebellar cyst. J. Neuropsychiatry Clin. Neurosci. 19, 187–190.
Peelen MV, Downing PE. The neural basis of visual body perception. Nat Rev Neurosci 2007;8:636-48.
Perry RJ, Rosen HR, Kramer JH, Beer JS, Levenson RL, Miller BL. Hemispheric dominance for emotions, empathy and social behaviour: evidence from right and left handers with frontotemporal dementia. Neurocase 2001;7:145-60.
Petersen SE, Fox PT, Posner MI, Mintum MA, Raichle ME. Positron emission tomographic studies of the processing of single words. J Cogn Neurosci 1989; 1: 153–70.
Petersen, S.E., Fox, P.T., Posner, M.I., Mintun, M., Raichle, M.E., 1988. Positron emission tomographic studies of the cortical anatomy of single-word processing. Nature 331, 585–589.
Petrides M, Cadoret G, Mackey S. Orofacial somatomotor responses in the macaque monkey homologue of Broca's area. Nature 2005;435:1235-8.
128
Phan KL, Wager TD, Taylor SF, Liberzon I. Functional neuroimaging studies of human emotions. CNS Spectr. 2004 Apr;9(4):258-66.
Phillips ML, David AS. Facial processing in schizophrenia and delusional misidentification: cognitive neuropsychiatric approaches. Schizophr Res 1995;17:109-14.
Phillips ML, Drevets WC, Rauch SL, Lane R. The neurobiology of emotion perception I: the neural basis of normal emotion perception. Biol Psychiatry. 2003;54:504-514.
Phillips ML, Young AW, Senior C, et al. A specific neural substrate for perceiving facial expressions of disgust. Nature. 1997;389:495-498.
Phillips,M. L., Marks, I. M., Senior, C., Lythgoe, D., O’Dwyer, A.M.,Meehan,O.,Williams, S.C.R.,Brammer,M. J.,Bullmore, E. T., & McGuire, P. K. (2000). A differential neural response in obsessive-compulsive disorder patients with washing compared with checking symptoms to disgust. Psychological Medicine, 30, 1037-1050.
Piaget, J. (1932). The moral judgment of the child. London: Kegan Paul, Trench, Trubner.
Piaget, J. La construction du réel chez l'enfant. / The construction of the real in th e child. Oxford, England: Delachaux & Niestle. (1937). 398 pp.
Pine DS, Grun J, Zarahn E, et al. Cortical brain regions engaged by masked emotional faces in adolescents and adults: an fMRI study. Emotion 2001;1:137-47.
PLOGHAUS A, BECERRA L, BORRAS C, BORSOOK D: Neural circuitry underlying pain modulation: expectation,hypnosis, placebo. Trends Cogn Sci 7: 197-200, 2003.
PLOGHAUS A, TRACEY I, CLARE S, GATI JS, RAWLINS JN, MATTHEWS PM: Learning about pain: the neural substrate of the prediction error for aversive events. Proc Natl Acad Sci USA 97: 9281-9286, 2000.
PLOGHAUS A, TRACEY I, GATI JS, CLARE S, MENON RS, MATTHEWS PM, RAWLINS JN: Dissociating painfrom its anticipation in the human brain. Science 284: 1979 -1981, 1999.
Pollack IF, Polinko P, Albright AL, Towbin R, Fitz C. Mutism and pseudobulbar symptoms after resection of posterior fossa tumors in children: incidence and pathophysiology. [Review]. Neurosurgery 1995; 37: 885–93.
Pollak L, Klein C, Rabey J, Schiffer J. Posterior fossa lesions associated with neuropsychiatric symptomatology. Int J Neurosci. 1996;87(3-4):119-26.
Preston SD, De Waal FB. Empathy: Its ultimate and proximate bases. Behav Brain Sci 2002;25:1-20. discussion 20–71.
Rafanelli C, Park SK, Ruini C, Ottolini F, Fava GA: Rating wellbeing and distress. Stress Medicine, 2000, 16, 55-61
Raichle ME, MacLeod AM, Snyder AZ, Powers WJ, Gusnard DA, Shulman GL (2001) A default mode of brain function. Proc Natl Acad Sci U S A 98:676–682.
129
Raichle, M., Fiez, J., Videen, T., MacLeod, A., Pardo, J., Fox, P., Petersen, S., 1994. Practicerelated changes in human functional anatomy during nonmotor learning. Cereb. Cortex 4, 8–26.
Raji CA, Lopez OL, Kuller LH, et al. Age, Alzheimer disease, and brain structure. Neurology. 2009;73:1899–1905.
Ramnani, N., Behrens, T., Johansen-Berg, H., Richter, M., Pinsk, M., Andersson, J., Rudebeck, P., Ciccarelli, O., Richter,W., Thompson, A., Gross, C., Robson, M., Kastner, S., Matthews, P., 2006. The evolution of prefrontal inputs to the cortico-pontine system: diffusion imaging evidence from Macaque monkeys and humans. Cereb. Cortex 16.
Rankin KP, Kramer JH, Mychack P, Miller BL. Double dissociation of social functioning in frontotemporal dementia. Neurology 2003;60:266-71.
Rapcsak SZ, Comer JF, Rubens AB (1993) Anomia for facial expressions: neuropsychological mechanisms and anatomical correlates. Brain Language 45:233–252.
Rapcsak SZ, Kaszniak AW, Rubens AB (1989) Anomia for facial expressions: evidence for a category specific visual-verbal disconnection syndrome. Neuropsychologia 27:1031–1041.
Rapoport, M., Reekum, R.V., Mayberg, H., 2000. The role of the cerebellum in cognition and behaviour: a selective review. J. Neuropsychiatry Clin. Neurosci. 12, 193–198.
Ravizza SM, McCormick CA, Schlerf JE, et al. Cerebellar damage produces selective deficits in verbal working memory. Brain. 2006;129:306–320.
Razzouk D, Mari JJ, Shirakawa I, Wainer J, Sigulem D. How do experts recognize schizophrenia: the role of disorganization symptom. Rev Bras Psiquiatr. 2006;28(1):5-9.
Reiman EM, Lane RD, Ahern GL, Schwartz GE, Davidson RJ, Friston KJ. Neuroanatomical correlates of externally and internally generated human emotion. Am J Psychiatry. 1997;154(7):918-25.
Reiner A. The Triune Brain in Evolution. Role in Paleocerebral Functions. Paul D. MacLean. Plenum, New York, Science. 1990 Oct 12;250(4978):303-5.
Ribas GC. As bases neuroanatômicas do comportamento: histórico e contribuições recentes. Rev Bras Psiquiatr. 2007;29(1):63-71.
Richter S, Gerwig M, Aslan B, Wilhelm H, Schoch B, Dimitrova A, Gizewski ER, Ziegler W, Karnath HO, Timmann D (2007) Cognitive functions in patients with MR-defined chronic focal cerebellar lesions. J Neurol 254:1193–1203.
Richter S, Schoch B, Kaiser O, et al: Behavioral and affective changes in children and adolescents with chronic cerebellar lesions. Neurosci Lett 2005; 381:102–107.
Rijntjes M, Buechel C, Kiebel S, Weiller C. Multiple somatotopic representations in the human cerebellum. Neuroreport 1999;10:3653–3658.
Ritvo ER, Freeman BJ, Scheibel AB, Duong T, Robinson H, Guthrie D, Ritvo A. Lower Purkinje cell counts in the cerebella of four autistic subjects: initial findings of
130
the UCLA-NSAC Autopsy Research Report. Am J Psychiatry. 1986 Jul;143(7):862-6.
Riva D, Giorgi C: The cerebellum contributes to higher functions during development: evidence from a series of children surgically treated for posterior fossa tumors. Brain 2000; 123:1051–1061.
Robinson,R. G., & Manes, F. (2000). Elation,mania, and mood disorders: Evidence from neurological disease. In J. C. Borod (Ed.), The neuropsychology of emotion (pp. 239-268). Oxford: Oxford University Press.
Roldan Gerschcovich E, Cerquetti D, Tenca E, Leiguarda R. The impact of bilateral cerebellar damage on theory of mind, empathy and decision making. Neurocase. 2011Jun;17(3):270-5.
Rolfs A, Koeppen AH, Bauer I, et al: Clinical features and neuropathology of autosomal dominant spinocerebellar ataxia (SCA17). Ann Neurol 2003; 54:367–375.
Rolls ET. Precis of The brain and emotion. Behav Brain Sci. 2000;23:177-191.
Rosalind W. Picard. Affective Computing. The MIT Press, 1997.
Rosenkranz JA, Grace AA. Dopamine-mediated modulation of odour-evoked amygdala potentials during pavlovian conditioning. Nature 2002; 417(6886): 282–287.
Ross CA, Margolis RL, Rosenblatt A, Ranen NG, Becher MW, Aylward E: Reviews in molecular medicine: Huntington disease and the related disorder, dentatorubral -pallidoluysian atrophy (DRPLA). Medicine 1997; 76:305–338
Ross ED (1985) Modulation of affect and nonverbal communication by the right hemisphere. In: Principles of behavioral neurology (Mesulam M-M, ed), pp 239–258.
Rowe CC, Ackerman U, Browne W, Mulligan R, Pike KL, O’Keefe G, Tochon-Danguy H, Chan G, Berlangieri SU, Jones G, Dickinson-Rowe KL, Kung HP, Zhang W, Kung MP, Skovronsky D, Dyrks T, Holl G, Krause S, Friebe M, Lehman L, Lindemann S, Dinkelborg LM, Masters CL, Villemagne VL. Imaging of amyloid beta in Alzheimer’s disease with 18F-BAY94-9172, a novel PET tracer: proof of mechanism. Lancet Neurol. 2008;7(2):129-35.
Royzman EB, Cassidy KW, Baron J. ‘I know, you know’: Epistemic egocentricism in children and adults. Rev Gen Psychol 2003;7:38-65
Ruby P, Decety J. How would you feel versus how do you think she would feel? A neuroimaging study of perspective-taking with social emotions. J Cogn Neurosci 2004;16:988-99.
Ruby P, Decety J. What you believe versus what you think they believe: a neuroimaging study of conceptual perspective-taking. Eur J Neurosci 2003;17:2475-80.
Ruini C, Ottolini F, Rafanelli C, Conti S, Fava GA: Il concetto di guarigione nei disturbi affettivi. Bollettino di Psicologia Applicata, 2000, 230, 27-36.
131
Russell, J. A. (1980).A circumplex model of affect. Journal of Personality& Social Psychology, 39, 1161-1178.
Russell, J. A., & Barrett, L. F. (1999). Core affect, prototypical emotional episodes, and other things called emotion: Dissecting the
Russell, J. A., & Bullock,M. (1985).Multidimensional-scaling of emotional facial expressions: Similarity from preschoolers to adults. Journal of Personality&Social Psychology, 48, 1290-1298.
Ryff CD, Essex MJ: The interpretation of life experience and well-being: the sample case of relocation. Psychology and Aging, 1992, 4, 507-517.
Ryff CD, Keyes CL: The structure of psychological well-being revisited. Journal of Personality and Social Psychology, 1995, 69 (4), 719-727.
Ryff CD, Lee Y, Keyes C: Through The Lens Of Culture: Psychological Well-Being At Midlife. Madison, University of Wisconsin, 1996.
Ryff CD, Singer B. Psychological well-being: meaning, measurement and implication for psychotherapy research. Psychotherapy and Psychosomatics, 1996, 65, 14-23.
Ryff CD. Happiness is everything, or is it? Explorations on the meaning of psychological well-being. Journal of Personality and Social Psychology, 1989, 57, 1069-1081.
Ryff CD: Beyond Ponce De Leon and life satisfaction: new directions in quest of successful aging. International Journal of Behavioural Development, 1989b, 12(1), 35-55
Ryff CD: Possible selves in adulthood and old age: a tale of shifting horizons. Psychology and Aging, 1991, 6; 286-295.
Ryff CD: Psychological well-being in adult life. Psychological Science,1995,4, 99-104.
Saab CY, Willis WD. The cerebellum: organization, functions and its role in nociception. Brain Res Brain Res Rev. 2003;42(1):85–95.
Sacchetti B, Baldi E, Lorenzini CA, et al. Cerebellar role in fearconditioning consolidation. Proc Natl Acad Sci U S A 2002;99:8406-11.
SACCHETTI B, SCELFO B, STRATA P: Cerebellum and emotional behavior. Neuroscience 162: 756-762, 2009.
SACCHETTI B, SCELFO B, STRATA P: The cerebellum: synaptic changes and fear conditioning. Neuroscientist 11:217-227, 2005.
Sackeim, H. A., Greenberg,M. S., Weiman, A. L., Gur, R. C., Hungerbuhler, J. P., & Geschwind, N. (1982). Hemispheric asymmetry in the expression of positive and negative emotions:Neurologic evidence. Archives of Neurology, 39, 210-218.
Sackeim,H. A., & Gur, R. E. (1978). Emotions are expressed more intensely on the left side of the face. Science, 202, 434-436.
132
Sakai Y, Kumano H, Nishikawa M, Sakano Y, Kaiya H, Imabayashi E,Ohnishi T, Matsuda H, Yasuda A, Sato A, Diksic M, Kuboki T. Cerebral glucose metabolism associated with a fear network in panic disorder. Neuroreport. 2005;16(9):927-31.
Salmi J., Pallesen K. J., Neuvonen T., Brattico E., Korvenoja A., Salonen O., Carlson S., 2010. Cognitive and Motor Loops of the Human Cerebro-cerebellar System. Journal of Cognitive Neuroscience 22:11, 2663–2676
Salvatore P. Insana, Ph.D. and Hawley E. Montgomery-Downs, Ph.D.* 2010 Maternal Postpartum Sleepiness and Fatigue: Associations with Objectively Measured Sleep Variables. West Virginia University
Samson D, Apperly IA, Chiavarino C, Humphreys GW. Left temporoparietal junction is necessary for representing someone else's belief. Nat Neurosci 2004;7:499-500.
Sassi RB, Soares JC. Ressonância magnética estrutural nos transtornos afetivos. Rev Bras Psiquiatr. 2001;23(Suppl 1):11-4.
Savard J, Laberge B, Gauthier J G, et al “Evaluating anxiety and depression in HIV -infected patients”. Journal of Personality Assessment, 1998
Saxe R, Carey S, Kanwisher N. Understanding other minds: linking developmental psychology and functional neuroimaging. Annu Rev Psychol. 2004;55:87-124.
Saxe R, Kanwisher N. People thinking about thinking people. The role of the temporo-parietal junction in “theory of mind”. Neuroimage 2003;19:1835-42.
Saxe R, Wexler A. Making sense of another mind: the role of the right temporo -parietal junction. Neuropsychologia 2005;43:1391-9.
Saxe R. and Kanwishera N. People thinking about thinking people The role of the temporo-parietal junction in “theory of mind”. NeuroImage 19 (2003) 1835–1842
Saxe R. Uniquely human social cognition. Curr Opin Neurobiol. 2006 Apr;16(2):235 -9.
Schmahmann JD, Macmore J, Vangel M. Cerebellar stroke without motor deficit: clinical evidence for motor and non-motor domains within the human cerebellum. Neuroscience. 2009 Sep 1;162(3):852-61.
Schmahmann, J. D., & Pandya, D. N. (1997a). Anatomic organization of the basilar pontine projections from prefrontal cortices in rhesus monkey. Journal of Neuroscience, 17, 438–458.
Schmahmann, J. D., & Pandya, D. N. (1997b). The cerebrocerebellar system. International Reviews in Neurobiology, 41, 31–60.
Schmahmann, J.D., 1991. An emerging concept: the cerebellar contribution to higher function. Arch. Neurol. 48, 1178–1187.
Schmahmann, J.D., 1996. From movement to thought: anatomic substrates of the cerebellar contribution to cognitive processing. Hum. Brain Mapp. 4, 174–198.
133
Schmahmann, J.D., 2000. The role of the cerebellum in affect and psychosis. J.Neurolinguist. 13, 189–214.
Schmahmann, J.D., 2004. Disorders of the cerebellum: ataxia, dysmetria of thought, and the cerebellar cognitive affective syndrome. J. Neuropsychiatry Clin. Neurosci. 16, 367–378.
Schmahmann, J.D., 2007. The primary motor cerebellum is in the anterior lobe but not the posterior lobe. Evidence from stroke patients. Neurology 68, A357.
Schmahmann, J.D., Doyon, J., Toga, A.W., Petrides, M., Evans, A.C., 2000. MRI Atlas of the Human Cerebellum. Academic Press, San Diego. Neuroimage. 1999 (10)233-60.
Schmahmann, J.D., Pandya, D.N., 1989. Anatomical investigation of projections to the basis pontis from posterior parietal association cortices in rhesus monkey. J. Comp. Neurol. 289, 53–73.
Schmahmann, J.D., Pandya, D.N., 1997. The cerebrocerebellar system. In: Schmahmann,, J. (Ed.), The Cerebellum and Cognition. Academic Press, San Diego, pp. 31–60.
Schmahmann, J.D., Sherman, J.C., 1998. The cerebellar cognitive affective syndrome. Brain 121, 561–579.
Schmahmann, J.D., Weilburg, J., Sherman, J.C., 2007. The neuropsychiatry of the cerebellum — insights from the clinic. Cerebellum 6, 254–267.
Schmidt, L. A., & Schulkin, J. (2000). Toward a computational affective neuroscience. Brain & Cognition, 42, 95-98.
Schmolck, H., & Squire, L. (2001). Impaired perception of facial emotions following bilateral damage to the anterior temporal lobe. Neuropsychology, 15, 30-38.
Schneirla,T. (1959). An evolutionary and developmental theory of biphasic processes underlying approach and withdrawal. In M. Jones (Ed.), Nebraska Symposium on Motivation (pp. 1-42).
Schoch B, Dimitrova A, Gizewski ER, Timmann D. Functional localization in the human cerebellum based on voxelwise statistical analysis: a study of 90 patients. Neuroimage 2006;30:36–51.
Schulte-Ruther M, Markowitsch HJ, Fink GR, Piefke M. Mirror neuron and theory of mind mechanisms involved in face-to-face interactions: a functional magnetic resonance imaging approach to empathy. J Cogn Neurosci 2007;19:1354-72.
Schulte-Rüther M, Markowitsch HJ, Shah NJ, et al. Gender differences in brain networks supporting empathy. Neuroimage 2008; 42:393-403.
Schutter DJ, van Honk J (2006) An electrophysiological link between the cerebellum cognition and emotion: frontal theta EEG activity to singlepulse cerebellar TMS. Neuroimage 33:1227–1231.
Schwartz, G. E., Davidson, R. J., & Maer, F. (1975). Right hemisphere lateralization for emotion in the human brain: Interactions with cognition. Science, 190, 286-288.
134
Scott, R., Stoodley, C., Anslow, P., Paul, C., Stein, J., Sugden, E., Mitchell, C., 2001. Lateralized cognitive deficits in children following cerebellar lesions. Dev. Med. Child. Neurol. 43, 685–691.
Scoville WB, Milner B. 1957. Loss of recent memory after bilateral hippocampal lesions. J. Neurol. Psychol. 20:11–21.
Seeley WW, Menon V, Schatzberg AF, Keller J, Glover GH, Kenna H, Reiss Singer, T., Seymour, B., O'Doherty, J., Kaube, H., Dolan, R., Frith, C., 2004. Empathy for pain involves the affective but not sensory components of pain. Science 303, 1157–1162.
Seidman LJ, Valera EM, Makris N, Monuteaux MC, Boriel DL, Kelkar K, Kennedy DN, Caviness VS, Bush G, Aleardi M, Faraone SV, Biederman J. Dorsolateral prefrontal and anterior cingulate cortex volumetric abnormalities in adults with attention-deficit/hyperactivity disorder identified by magnetic resonance imaging. Biol Psychiatry. 2006;60(10):1071-80.
Seitz RJ, Schafer R, Scherfeld D, Friederichs S, Popp K, Wittsack HJ, et al. Valuating other people's emotional face expression: a combined functional magnetic resonance imaging and electroencephalography study. Neuroscience 2008;152:713-22.
Sell LA, Morris J, Bearn J, Frackowiak RS, Friston KJ, Dolan RJ. Activation of reward circuitry in human opiate addicts. European Journal of Neuroscience 1999;11(3):1042–1048.
Serafin M., Surian L. Il test degli occhi: uno strumento per valutare la “teoria della mente”. Giornale italiano di psicologia/a. XXXI, n.4, dicembre 2004.
Shamay-Tsoory SG, Tomer R, Berger BD, Aharon-Peretz J. Characterization of empathy deficits following prefrontal brain damage: the role of the right ventromedial prefrontal cortex. J Cogn Neurosci 2003;15:324-37.
Shamay-Tsoory SG, Tomer R, Berger BD, Goldsher D, Aharon-Peretz J. Impaired ‘affective theory of mind’ is associated with right ventromedial prefrontal damage. Cogn Behav Neurol 2005a;18:55-67.
Sigurdardottir V, Bolund C, Brandberg Y, et al. “The impact of generalized malignant melanoma on quality of life evaluated by the EORTC questionnaire technique”. Quality of Life Research, 1993
Silberman EK, Weingartner H (1986) Hemispheric lateralization of functions related to emotion. Brain Cognit 5:322–353.
Silveri MC, Leggio MG, Molinari M: The cerebellum contributes to linguistic production: a case of agrammatic speech following a right cerebellar lesion. Neurology 1994; 44:2047–2050.
Silveri MC, Misciagna S. Language, memory and cerebellum. J Neurolinguistics. 2000;13:129–143.
Simone G. Shamay-Tsoory, Judith Aharon-Peretz and Daniella Perry. Two systems for empathy: a double dissociation between emotional and cognitive empathy in inferior frontal gyrus versus ventromedial prefrontal lesions. Brain (2009) 132 (3): 617-627
135
Singer T,Seymour B, O’Doherty J, Kaube H, Dolan RJ, Frith CD. Empathy for pain involves the affective but not sensory components of pain. Science 2004;303:1157-62.
Singer T. The neuronal basis and ontogeny of empathy and mind reading: review of literature and implications for future research. Neurosci Biobehav Rev 2006;30:855-63.
Sivaswamy L, Kumar A, Rajan D, et al. A diffusion tensor imaging study of the cerebellar pathways in children with autism spectrum disorder. J Child Neurol. 2010 Feb 22.
Snaith, R. P., & Zigmond, A. S. “HADS: Hospital Anxiety and Depression Scale. Windsor: NFER Nelson. 1994
Snider R.S. and Maiti A. Cerebellar contributions to the Papez Circuit. J Neurosci Res. 1976;2(2):133-46.
SNIDER RS: Recent contribution to the anatomy and physiology of the cerebellum. Arch Neurol Psychiatry 64: 196-219, 1950.
Snider, R., Eldred, E.,1951. Electro-anatomical studies on cerebro-cerebellar connections in the cat. J. Comp. Neurol. 95, 1-16.
Snider, R., Stowell, A., 1944. Electro-anatomical studies on a tactile system in the cerebellum of monkey (Macaca mulatta). Anat. Rec. 88, 457.
Snider, R.S., 1950. Recent contributions to the anatomy and physiology of the cerebellum. Arch. Neurol. Psychiatry 64, 196–219.
Soares JC, Mann JJ. The anatomy of mood disorders--review of structural neuroimaging studies. Biol Psychiatry. 1997;41(1):86-106.
Sokolovsky N, Cook A, Hunt H, Giunti P, Cipolotti L. A preliminary characterisation of cognition and social cognition in spinocerebellar ataxia types 2, 1, and 7. Behav Neurol. 2010;23(1-2):17-29.
Sprengelmeyer,R.,Young,A.W.,Schroeder,U.,Grossenbacher, P.G., Federlein,J., Büttner, T., & Przuntek,H. (1999).Knowing no fear. Proceedings of the Royal Society of London: Series B, 266, 2451-2456.
Starkstein SE and Robinson RG, eds. Depression in Neurological Disease. Baltimore: Johns Hopkins University Press, 1993.
Starkstein SE, Robinson RG, Berthier ML, et al: Depressive disorders following posterior circulation as compared with middle cerebral artery infarcts. Brain 1988; 111:375–387.
Steinlin M. The cerebellum in cognitive processes: supporting studies in children. Cerebellum (London, England). 2007;6(3):237-41.
Steinlin, M., Imfeld, S., Zulauf, P., Boltshauser, E., Lovblad, K.-O., Luthy, A.R., Perrig, W., Kaufman, F., 2003. Neuropsychological long-term sequelae after posterior fossa tumour resection during childhood. Brain 126, 1998–2008.
Stevens A, Price J. EVOLUTIONARY PSYCHIATRY: A NEW BEGINNING (1996). Routledge, London: first edition (1996); second edition (2000).
136
Stoodley C.J., Schmahmann J.D., 2009. Functional topography in the human cerebellum: A meta-analysis of neuroimaging studies. NeuroImage 44, 489–501.
Stotland E, Dunn RE. Empathy, self-esteem, and birth order. J Abnorm Soc Psychol 1963;66:532-40.
Stotland, E. (1969). Exploratory investigations of empathy. In L. Berkowitz (Ed.), Advances in experimental social psychology (Vol. 4, pp. 271–314). New York: Academic Press.
Stotland, E., Sherman, S., & Shaver, K. (1971). Empathy and birth order: Some experimental explorations. Lincoln: University of Nebraska Press.
STRATA P., SCELFO B., SACCHETTI B. Involvement of Cerebellum in Emotional Behavior. 2011, Physiol. Res. 60 (Suppl. 1): S39-S48,
Sugihara I, Shinoda Y. Molecular, topographic, and functional organization of the cerebellar cortex: a study with combined aldolase C and olivocerebellar labeling. J Neurosci 2004;24(40):8771–8785.
SUPPLE WF Jr, LEATON RN, FANSELOW MS: Effects of cerebellar vermal lesions on species-specific fear responses, neophobia, and taste-aversion learning in rats. Physiol Behav 39: 579-586, 1987.
Swanson LW. 1983. The hippocampus and the concept of the limbic system. In Neurobiology of the Hippocampus, ed. W Seifert, pp. 3–19. London: Academic.
Tamai S. Tratamento dos transtornos do comportamento de paziente com demência. Rev Bras Psiquiatr. 2002;24(Supl I):15-21.
Tavano, A., Grasso, R., Gagliardi, C., Triulzi, F., Bresolin, N., Fabbro, F., Borgatti, R., 2007. Disorders of cognitive and affective development in cerebellar malformations. Brain 130, 2646–2660.
Terao S, Sobue G, Izumi M, Miura N, Takeda A, Mitsuma T. Infarction of superior cerebellar artery resenting as cerebellar symptoms. Stroke 1996;27:1679–1681.
Tessitore A, Hariri AR, Fera F, Smith WG, Das S, Weinberger DR, et al. Functional changes in the activity of brain regions underlying emotion processing in the elderly. Psychiatry Research 2005;139 (1):9–18.
Thach WT. Cerebellar inputs to motor cortex. Ciba Found Symp 1987;132:201–220.
Thorndike, E.L. y Lorge, 1. (1944). The teachers word book of30.000 words. NV: Teachers College, Columbia University. Bureau of Publications.
Timmann D, Dimitrova A, Hein-Kropp C, Wilhelm H, Dorfler A. Cerebellar agenesis: clinical, Neuropsychological and MR findings. Neurocase. 2003;9(5):402-13.
Titchener, E. (1909). Elementary psychology of the thought processes. New York: Macmillan.
Tomkins, S. (1982). Affect theory. In K. R. Scherer&P. Ekman (Eds.), Approaches to emotion (pp. 163-195).Hillsdale, NJ: Erlbaum.
137
Turkel SB, Lan SC, Nelson MD, et al: Case series: acute mood symptoms associated with posterior fossa lesions in children. J Neuropsychiatry Clin Neurosci 2004; 16:443–445.
Turner, B., Paradiso, S., Marvel, C., Pierson, R., Ponto, L.B., Hichwa, R., Robinson, R., 2007. The cerebellum and emotional experience. Neuropsychologia 45, 1331–1341.
Undavia M, Goldstein NE, Cohen P, Sinthawanarong K, Singson M, Bhutani D, Munson T, et al. “Impact of implantable cardioverter defibrillator recalls on patients’ anxiety, depression, and quality of life” Pacing Clin Electrophysiol, 2008
Urban PP, Marx J, Hunsche S, Gawehn J, Vucurevic G, Wicht S, Massinger C, Stoeter P, Hopf HC. Cerebellar speech representation: lesion topography in dysarthria as derived from cerebellar ischemia and functional magnetic resonance imaging. Arch Neurol 2003;60:965–972;
Valera EM, Faraone SV, Murray KE, Seidman LJ. Meta-analysis of structural imaging findings in attention-deficit/hyperactivity disorder. Biol Psychiatry. 2007;61(12):1361-9.
Van Boven L, Loewenstein G. Social projection of transient drive states. Pers Soc Psychol Bull 2003;29:1159-68.
Van Dongen HR, Catsman-Berrevoets CE, van Mourik M. The syndrome of ‘cerebellar’ mutism and subsequent dysarthria. Neurology 1994; 44: 2040–6. Comment in: Neurology 1994; 44: 2001–5.
Van Harskamp NJ, Rudge P, Cipolotti L. Cognitive and social impairments in patients with superficial siderosis. Brain. 2005 May;128(Pt 5):1082-92.
Van Strien JW, Morpurgo M (1992) Opposite hemispheric activations as a result of emotionally threatening and non-threatening words. Neuropsych. 30:845-848.
Victor, M., Adams, R., Mancall, E., 1959. A restricted form of cerebellar cortical degeneration occurring in alcoholic patients. Arch. Neurol. 1, 579–688.
Volkow ND, Wang GJ, Ma Y, Fowler JS, Zhu W, Maynard L, et al. Expectation enhances the regional brain metabolic and the reinforcing effects of stimulants in cocaine abusers. Journal of Neuroscience 2003;23(36):11461–11468.
Vollm BA, Taylor AN, Richardson P, Corcoran R, Stirling J,McKie S, et al. Neuronal correlates of theory of mind and empathy: a functional magnetic resonance imaging study in a nonverbal task. Neuroimage 2006;29:90-8.
Voogd, J. Cerebellum and precerebellar nuclei. In: Paxinos, G.; Mai, JK., editors. The Human Nervous System. Vol. Second edition. Amsterdam: Elsevier Academic Press; 2004. p. 321-392
Voogd, J., Glickstein, M., 1998. The anatomy of the cerebellum. Trends. Cogn. Sci. 2, 307–313.
Vuilleumier P, Armony JL, Driver J, Dolan RJ. Distinct spatial frequency sensitivities for processing faces and emotional expressions. Nature Neuroscience 2003;6(6):624–631.
138
Vuilleumier P, Pourtois G. Distributed and interactive brain mechanisms du ring emotion face perception: evidence from functional neuroimaging. Neuropsychologia 2007;45:174-94.
Wallesch C-W, Horn A. Long-term effects of cerebellar pathologyon cognitive functions. Brain Cogn 1990; 14: 19–25.
Watson, D.,Wiese, D., Vaidya, J., & Tellegen,A. (1999). The two general activation systems of affect: Structural findings, evolutionary considerations, and psychobiological evidence. JournalofPersonality&SocialPsychology, 76, 820-838.
Weckowicz, T. (1978). Review of the profile of Mood States. En O.K. Buros (Ed.). The eighth mental measurements yearbook, Vol. 1(pp. 1018-1O19). Highland Park, NJ: Gryphon Press.
Wegiel J, Wisniewski HM, Dziewiatkowski J, Badmajew E, Tarnawski M, Reisberg B, Mlodzik B, De Leon MJ, Miller DC. Cerebellar atrophy in A lzheimer’s disease-clinicopathological correlations. Brain Res. 1999;818(1):41-50.
Wellman, H. Children’s Theories of Mind, Oxford University Press, 1990.
Whalen PJ, Rauch SL, Etcoff NL, et al. Masked presentations of emotional facial expressions modulate amygdala activity without explicit knowledge. J Neurosci 1998;18:411-8.
White M, Lalonde R, Botez-Marquard T: Neuropsychologic and neuropsychiatric characteristics of patients with Friedreich’s ataxia. Acta Neurol Scand 2000; 102:222–226.
Whiten, A. (1991). Natural theories of mind. Oxford: Basil Blackwell.
WHITESIDE, J. A. & SNIDER, R. S. (1953). Relation of cerebellum to the upper brainstem. J. Neurophysiol. 16, 397-413.
Wicker B, Keysers C, Plailly J, Royet JP, Gallese V, Rizzolatti G. Both of us disgusted in My insula: the common neural basis of seeing and feeling disgust. Neuron 2003;40:655-64
Xiong J, Parsons LM, Gao JH, Fox PT (1999) Interregional connectivity to primary motor cortex revealed using MRI resting state images. HumBrainMapp 8:151–56.
Yadalam KG, Jain AK, Simpson GM. Mania in two sisters with similar cerebellar disturbance. Am J Psychiatry. 1985;142(9):1067-9.
Yates WR, Jacoby CG, Andreasen NC. Cerebellar atrophy in schizophrenia and affective disorder. Am J Psychiatry. 1987;144(4):465-7.
Zald DH. The human amygdala and the emotional evaluation of sensory stimuli. Brain Res Brain Res Rev. 2003;41:88-123.
ZANCHETTI, A. & ZOCCOLINI, A. (1954). Autonomic hypothalamic outbursts elicited by cerebellar stimulation. J. Neurophysiol. 17, 475-483.
Zawacki TM, Grace J, Friedman JH, et al: Executive and emotional dysfunction in Machado-Joseph disease. Move Disord 2002; 17:1004–1010.
Zigmond AS, Snaith RP. “The hospital anxiety and depression scale”. Acta Psychiatr Scand 1983.
139
Ringraziamenti
Se state leggendo questa pagina vuol dire che mi sono laureata, e se mi sono
laureata vuol dire che durante questo percorso ho incontrato persone speciali
che meritano si essere ringraziate.
In primo luogo, ringrazio il Dott. Francesco Tramonti per avermi dato la
possibilità di realizzare questa ricerca e per avermi guidato, con pazienza e
professionalità, in questo percorso finale. Lo ringrazio, inoltre, per essere stato
più di un semplice relatore, sempre attento e disponibile.
Inoltre, ringrazio la Dott.ssa Pieranna Arrighi, per la disponibilità, l’aiuto e il
sostegno pratico e morale.
Ringrazio Chiara Ulivi per l’aiuto pratico e per avermi sostenuto fin dall’inizio in
questo lavoro di tesi. Con lei ringrazio Samantha per avermi fornito la geniale
idea dell’ARCI e anche tutti i tirocinanti. le fisioterapiste e gli operatori del
reparto di neuroscienza e neuroriabilitazione che, in un modo o nell’altro, hanno
contribuito alla riuscita di questo lavoro.
Un grosso grazie va naturalmente al mio “orsacchiotto di cioccolato”, Roberta,
insostituibile compagna di studi e amica, per la sua pazienza, disponibilità, per
l’aiuto pratico e il sostegno morale. Come dice Saverio, se non fosse peri
Giuseppe (che naturalmente ringrazio) scapperemmo in Spagna.
Un ringraziemento particolare va anche ad Antonella che mi ha “accudito” come
solo “mamma chioccia” sa fare, e ad Alice che ha curato il mio style.
Ringrazio anche Eleonora, Saverio e i miei “compaesani” per aver allietato le
serate pisane e per avermi fatto sentire a casa anche a chilometri di distanza.
Grazie anche ad Andrea, Checca, Daniela e alla mia comunità che mi ha sempre
incoraggiato e sorretto.
Grazie anche a tutti i miei amici lontani e alle persone che ho incontrato durante
questo percorso universitario.
Un infinito grazie va alla mia famiglia per avermi sopportato, supportato,
incoraggiato, consolato, stimolato, rassicurato, sostenuto, aiutato… per essere
stata la mia base sicura. A mia mamma e mio papà per avermi permesso di
diventare quello che sono, a Giuseppe, Bananetta e Paoletta, fratelli insostituibili,
per avermi accompagnato, fin dai primi passi, nel cammino della vita.