Analisi Quantitativa I Metodi Analitici (B J Kakos)
-
Upload
vassily-kakos -
Category
Documents
-
view
14 -
download
2
description
Transcript of Analisi Quantitativa I Metodi Analitici (B J Kakos)

METODI ANALITICI E SEPARAZIONI QUANTITATIVEASPETTI GENERALI
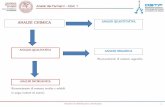
I principali metodi analitici sono tre: chimici, fisici e chimicofisici.Occore considerare quattro aspetti generali nella scelta del metodo analitico più adatto:a) selettività, b) sensibilità, c)accuratezza, d) riproducibilità.a). la selettività, riguarda la capacità di un metodo di non consentire delle interferenze, dovute alla presenza di altre sostanze.b) la sensibilità riguarda la capacità di consentire determinazioni di quantità di sostanze molto piccole.c) l’accuratezza dipende dall’errore che si commette nella misura di una grandezzad) la riproducibilità è la capacità di un metodo di fornire dei valori confrontanti quando si ripete più volte la stessa determinazione.II metodi fisico e chimico-fisico sono anche detti metodo strumentale, perchè richiedono l’uso di apparecchiature particolari diverse dalla bilancia e dalla purezza. Tra questi metodi possiamo citare quelli basati sull’assorbimento o emissione di radiazioni (colorimetria, spettrofotometria). Altri metodi sono le operazioni del piano di diffrazione della luce polarizzata e le proprietà magnetiche (NMR). La potenziometria basata sulle proprietà elettriche e la calorimetria. Esistono pure metodi radio-chimici molto usati nei dossaggi biologici. L’analisi quantitativa si divide in due grandi categorie: a) analisi gravimetrica (o ponderale) e b) analisi volumetrica.Nell’analisi gravimetrica il prodotto viene determinato attraverso pesata. Nell’analisi volumetrica si determina il reagente richiesto, ricavato di solito dalla misura del volume di una soluzione standard.Soluzione standard è la soluzione che contiene una quantità di reagente chimicamente equivalente al costituente di cui si cerca la percentuale. Titolazione è il metodo di analisi basato sulla quantità del reagente necessaria per reagire col componente stesso.Inoltre i metodi fisici si basano largamente sull’energia mentre i metodi chimici sulla massa.Separazione è il processo mediante il quale i costituenti di un campione vengono separati gli uni dagli altri. Una separazione richiede la formazione di una nuova fase. La separazionedi uno dei costituenti, cioè la formazione di una nuova fase, si chiama estrazione. L’estrazione si divide in due stadi: a) il processo fisico in cui da una fase omogenea si forma una nuova fase Esempio: precipitazione di un costituente per aggiunta di un solvente miscibile con l’acqua e poi la distillazione nella quale la sostanza separata (volatile) si separa da quella non volatile, variando la temperatura o la pressione del sistema, b) l’allontanamento delle due fasi del sistema oramai eterogeneo.I pricipali metodi di separazione sono i seguenti:a). precipitazione e/o coprecipitazione, b)cromatografia e scambio ionico, c) estrazione liquido-liquido, d) volatilizzazione.Le separazioni richieste nell’analisi di un dato campione si dividono in quelle inorganiche e quelle organiche.
Separazioni inorganiche per precipitazioneEsse dipendono dalla composizione del campione, dagli elementi da determinare, dal tipo della determinazione finale, cioè gravimetrica o volumetrica, e.t.c.I metalli si possono precipitare con quattro metodia) precipitazione come idrossidi: In questo caso viene sfruttata la solubilità in ambiente acquoso di essi entro ampi limiti al variare del pH.b) precipitazione con ammoniaca: si considera una delle operazioni più comuni nell’analisi classica. Si basa sulla precipitazione dei metalli con NH4OH. Questo si spiega dal fatto che si crea un tampone NH3/NH4
+ che permette di regolare a piacere il pH di una soluzione tra la neutralità ed una reazione debolmente o moderatamente basica. Un grande vantaggio dell’ammoniaca come precipitante nel caso degli idrossidi è che dopo calcinazione come ossidi i loro sali volatilizzano a basse temperature.c) precipitazione dei metalli come solfuri: si basa sulla diversità dei valori dei prodotti di solubilità dei vari solfuri che così si separano attraverso un’acidità regolata.d) separazioni elettrolitiche: presentano il vantaggio che non si aggiunge nessun materiale alla soluzione dei reagenti. Avviene cioè semplicemente la rimozione dell’elettrodo
Aspetti generali 1

Precipitanti organiciLe sostanze organiche trovano impiego come: a) precipitanti nell’analisi gravimetrica e nelle separazioni, b)come solventi imiscibili in soluzioni acquose per estrarre dalla soluzione cationi o anioni inorganici, c) come resine scambiatrici di ioni, d) come titolanti nelle determinazioni volumetriche a causa del fatto che si formano dei complessi solubili (chelati con cariche libere). Esempio: ottimo titolante è l’EDTA, agente riducente, e) indicatori, f) standard nella volumetria.1
Esistono due condizioni necessarie per la formazione di un prodotto insolubile nella reazione tra un reagente organico ed uno ione inorganico, che: a) la solubilità intrinseca del prodotto dev’essere molto bassa, b) la costante di dissociazione del prodotto non dev’essere molto grande.I composti organici formano spesso composti chelati (complessi) con vari metalli di tipo HL o H2L (H rappresenta un idrogeno acido che può essere sostituito da un equivalente di un metallo. Un esempio di chelante molto utilizzato è l-8idrossichinolina) che funge da legante formando con il metallo anelli penta o esatomici. Nella formula a destra appaiono 4 dalle 6 coordinazioni che il magnesio è capace di effettuare Le due posizioni restanti
sono occupate da due molecole di acqua. La presenza dell’acqua è molto importante nell’analisi gravimetrica e per le separazioni per estrazione.Altri precipitanti organici importanti sono le ossime: -C=NOH (fig. a sinistra) che danno precipitati insolubili con Pd, Ni, e Bi.Un esempio è la dimetigliossima che è un reagente selettivo per il Ni. Altri precipitanti organici sono la rodamina B che precipita alogeno complessi
anionici, la benzidina che in soluzione acida precipita i solfati e.t.c.
Legge delle azioni di massa-Guldberg e WaageLa velocità di reazione è proporzionale alle concentrazioni attive delle sostanze reagenti ciascuna elevata ad un esponente uguale al coefficiente con cui compare nell’equazione stecchiometrica.Ammettiamo di avere un’equazione: A+BC+D, sarà v1=k1[A][B], la velocità della reazione tra A e Be v2=k2[C][D], la velocità della reazione tra C e D, dove k1 e k2 sono le costanti di velocità. All’equilibrio sarà: v1=v2 quindi k1[A][B] =k2[C][D]⇒ [C][D]/ [A][B]=k1/k2=K a T=cost. K rappresenta la costante di equilibrio o costante stecchiometrica o costante di concentrazione. Quindi per una reazione generica si può scrivere:
aA+bBcC+dD; [ ] [ ][ ] [ ]ba
dc
BA
DCK = . Per soluzioni diluite al posto di concentrazioni si usano le
attività e così K prende il nome di costante termodinamica.Stato standard è lo stato di una specie chimica che ha attività unitaria. Convenzionalmente tutti i solidi si trovano allo stato standard a 25°C. In questo modo le costanti di equilibrio in cui partecipano i solidi si chiamano prodotti di solubilità. Quando siamo di fronte ad una reazione acido debole o base debole con un’altra specie, la K si chiama costante di dissociazione o di ionizzazione.Esempio: CH3COOH+H2OCH3COO-+H3O+; K=[CH3COO-][H3O+]/[CH3COOH]2
Le costanti di equilibrio per la formazione di ioni complessi si chiamano costanti di stabilità o di formazione. Il suo reciproco viene chiamato costante di instabilità. I cambiamenti che influenzano la posizione di equilibrio vengono controllati dal teorema di Le Châtelier, il quale afferma che ogni alterazione nei fattori che condizionano un equilibrio chimico fa sì che l’equilibrio si sposti in modo tale da minimizzare l’alterazione stessa.I fattori che influenzano l’equilibrio sono la temperatura e la pressione. P.es. un aumento di temperatura sposta l’equilibrio verso la parte in cui avviene assorbimento di calore. La pressione influisce sopratutto alle reazioni gassose e ciò perchè una variazione provoca
1 I precipitanti organici per la determinazione gravimetrica di costituenti inorganici specialmente dei metalli sono molto numerosi.2 L’acqua non partecipa nella costante di dissociazione perchè nelle soluzioni diluite ha attività unitaria.
Aspetti generali 2
N
O
N
OMg
N
OH
N OH
CH3
CH3
dimetigliossima

anche variazione di volume. Per le reazioni che avvengono allo stato liquido tali variazioni sono trascurabili.Quando un composto si scioglie in acqua si producono ioni positivi e negativi. La reazione tra ioni positivi e negativi è data dalla regola dell’elettroneutralità, la quale afferma che: la concentrazione totale delle cariche positive dev’essere uguale alla concentrazione totale delle cariche negative.Esempio: soluzione di un sale in acqua:MmXx mMm++nXn-, vale: n[Mn+]=m[Xm-]
Trattamento degli errori sistematiciUno dei sistemi per individuare la causa di un errore sistematico quando dipende dalla presenza delle impurezze dei reattivi è quello della prova in bianco, cioè in assenza della sostanza da determinare.3
Trattamento degli errori accidentaliGli errori accidentali sono più difficili da individuare e da corregere; si possono trattare soltanto statisticamente, cioè eseguendo il maggior numero possibile di misure e rilevando il valore medio o più probabile. Quando possibile è megio tracciare la curva di Gauss. La curva si basa su un numero elevato, quasi infinito di misure. Nel linguaggio della statistica rappresenta l’universo, cioè la popolazione infinita dei dati. Con µ si denota la media dell’intera popolazione che divide la curva in due parti uguali (simmetriche), il che significa che le deviazioni positive e negative sono ugualmente probabili. Xv rappresenta il valore
vero mentre x è la media di un numero finito N di misure e sarà: ∑= Nxx e non è
identica a µ che è un numero infinito di misure.x si può dire che è una stima di µ e quando maggiore sarà il numero di misure tanto migliore sarà la stima. In ultima analisi µ non coincide con Xv neccessariamente, dato che possono aversi errori sistematici. Ed è appunto la differenza tra µ e Xv che rappresenta l’errore sistematico (o la somma degli errori sistematici). Pertanto in assenza di errori sistematici, la media oggettiva µ coincide con il valore vero.Precisione di una misura singolaIn una serie di misure l’entità della dispersione dei singoli valori rispetto alla loro media aritmetica è un indice inverso della precisione. La precisione viene espressa numericamente mediante gli indici. Se indichiamo con x ciascun risultato analitico (x1,x2,...) si definisce: a) deviazione assoluta (Das), la differenza X-µ , cioè Das=X-µ , b) deviazione relativa(Drel) è data dal rapporto Drel=x-µ /µ c) deviazione media(δ ) è la media dei valori assoluti delle differenze tra i valori misurati e la media aritmetica δ =ΣX-µ /N, d) deviazione standard(σ ) è la radice quadrata della media delle differenze tra i valori
misurati e la media aritmetica ( ) 2
12
−
= ∑N
X µσ .Il quadrato Σ (X-µ )2 è noto anche come
varianza. Per un numero molto limitato di misure si ha:2
XX−Σ=σ che rappresenta il
numero di varianza o grado di libertà degli N risultati disponibili per il calcolo di σ . Si
può dimostrare che la media aritmetica dei risultati di N misure è 21
N volte più ottenibile
che una misura singola. Si ha quindi:
• Deviazione media stimata della media:2
1N
ddX
=
3 Sfuggono da questa prova le cause dovute da coprecipitazione dato che manca la sostanza da precipitare. Si può allora proseguire la prova di controllo con una quantità nota della sostanza da determinare su un campione di composizione analoga a quella in esame. Se non è nota la composizione del campione si ricorre alla prova di controllo con aggiunte tarate aggiungendo allo stesso campione quantità crescenti della sostanza da determinare e osservando se i valori aumentano in proporzione alle quantità aggiunte.
Aspetti generali 3

• Deviazione standard stimata della media:2
1N
SdX
=
(La deviazione probabile è raramente usata)
La bilancia classicaLa bilancia è una leva di 1° genere perchè il fulcro si trova tra i punti di applicazione delle forze. La bilancia misura la massa e non il peso del corpo, il peso si misura con il dinamometro. La massa si misura dalla forza che occorre per imprimere ad un corpo una
determinata accelerazione: a
FmamF
=⇒= , invece il peso dipende da P=mg, dove la
massa è una proprietà invariabile e il peso una proprietà variabile.La sensibilità di una bilancia è misurata dallo spostamento che essa subisce dalla posizione di equilibrio per aggiunta di un peso molto piccolo. La bilancia è costituita da un gioco cui sono attaccati due piatti che oscillano su coltelli di agata. Se indichiamo con l1,l2,l3 le lunghezze dei bracci, con F1,F2 le forze che agiscono sui piatelli, si ha l’equilibrio: F1l1=F2l2. Con g invece si indica il baricentro mobile, l:lunghezza dei bracci, F:fulcro, d:distanza dal centro del fulcro, P1eP2:i pesi. Se poniamo un peso P1>P2 in modo da provocare la rotazione del giogo di un angolo
α , la nuova posizione di equilibrio è data dalla formula: P1l1cosα +P2α sinα =P2l2cosα⇒Pdsinα =cosα (P2l-P1l)⇒sinα /cosα =l(P2-P1/Pα⇒ )tgα =l(P2-P1)/Pα (per un angolo molto piccolo si può porre tgα ≈ α ).La bilancia modernaLe bilance moderne ad un piatto sono a carico costante e la pesata si ottiene scaricando i pesi che gravano sul gioco. L’errata di pesata dipende dalla sensibilità della bilancia e dalla quantità della sostanza pesata. Se abbiamo p.es. per una bilancia una sensibilità di 0,2mg. ed una pesata di 200mgr., l’errore si dà dall’espressione: E=2± 0,2mgr/200mgr x 100=± 0,2%. Il numeratore va moltiplicato per 2, perchè otteniamo sempre la differenza tra due pesate. Questo è anche importante perchè ci permette di non eseguire la riduzione della pesata nel vuoto. A prescindere dalla sensibilità, gli errori di pesata possono essere di due tipi: a) sistematici, b) accidentali (o ambientali).I sistematici sono inerenti alla bilancia ed ai pesi, mentre quelli accidentali dipendono da vari fattori (variazione del tempo, vibrazioni, presenza di polvere, adsorbimento di umidità dalla parte della sostanza che si pesa, elettrizzazione del recipiente di vetro, etc.).Le bilance per macroanalisi hanno una sensibilità di 0,2mgr. Quelle per le analisi semimicro di 0,01mgr e quelle usate per microanalisi di 0,001mgr.Cifre significative e regole di arrotondamentoLe cifre significative sono il numero di cifre neccessariamente utili per esprimere il risultato di una misura coerentemente al grado di precisione con cui essa è stata eseguita. Ad esempio se si fa una pesata sensibile al decimo di gr. il risultato dev’essere scritto con una cifra decimale p.es.14.6. Se si pesa con una bilancia sensibile al decimo di mgr. Il risultato è espresso in quattro cifre decimali (anche se la quarta cifra è uno zero), p.es. 14,6230. Per quanto riguarda l’arottondamento, le cifre eccedenti vengono eliminate seguendo le regole sottoposte: a) se la prima cifra eccedente è inferiore a 5 va eliminata da quelle che la seguono, b) se è superiore a cinque si elimina aumentando di uno l’ultima cifra significativa, c) se il gruppo di cifre è cinque (5 significa anche 50,500) si elimina lasciando inalterata l’ultima cifra sul risultato finale.Metodi e regole di pesata
1. Tutte le bilance moderne sono dotate di un livello regolabile che serve a livellare la bilancia. Quindi come prima operazione occorre controllare il livello della bilancia.
2. Osservare se il piatto è pulito, quindi liberare il giogo e controllare l’azzeramento della bilancia.
3. Eseguire le varie operazioni di carico-scarico a giogo bloccato
Aspetti generali 4
a
l1 l2
F1
F2
P1 g
P2
dl

4. Prima di pesare il corpo accertarsi che non vi siano differenze di temperatura5. Bloccare il giogo alla fine di una pesata6. Ruotare lentamente le manopole dei pesi per evitare che saltino dalla loro posizione7. Evitare di lasciare sostanze sul piatto o all’interno della bilancia. Lasciare la bilancia
pulita e chiusa8. Le bilance di cui disponiamo sono dotate di un sistema (dispositivo) di prepesata che
ci fornisce approssimativamente il peso del corpo da pesare.
Aspetti generali 5