IDROCARBURI - ALCANI
-
Upload
provezacademy -
Category
Education
-
view
72 -
download
1
Transcript of IDROCARBURI - ALCANI
SONO COMPOSTI BINARI, FORMATI
DA CARBONIO ED IDROGENO.
Si tratta di un vasto gruppo di sostanze che presentano caratteristiche diverse, sia nei legami tra gli atomi di carbonio sia nella struttura delle molecole.
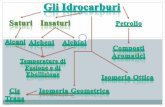
IDROCARBURI
LEGAMI STRUTTURA
SEMPLICI
DOPPI
TRIPLI
CATENA APERTA LINEARE
CATENA APERTA RAMIFICATA
CATENA CHIUSA AD ANELLO
(CICLICA)
UNO O PIU’ ANELLI AROMATICI
(BENZENICI)
IDROCARBURI SATURI
IBRIDIZZAZIONE sp3
LEGAMI SEMPLICI TRA ATOMI DI CARBONIO
Cn H2n+2
FORMULA GENERALE
DAL QUINTO COMPOSTO SI SEGUE LA NOMENCLATURA IUPAC CHE ASSEGNA IL PREFISSO GRECO CHE INDICA IL NUMERO DI ATOMI DI CARBONIO PRESENTI NELLA MOLECOLA, SEGUITO DAL SUFFISSO - ANO
Prefisso
Met - 1 C
Et - 2 C
Prop - 3 C
But - 4 C
Pent - 5 C
Es - 6 C
Ept - 7 C
Ott- 8 C
Non- 9 C
Dec - 10 C
1 Metano2 Etano3 Propano4 Butano5 Pentano6 Esano7 Eptano8 Ottano9 Nonano10 Decano11 Undecano12 Dodecano13 Tridecano14 Tetradecano
CH4
C2H6
C3H8
C4H10
C5H12
C6H14
C7H16
C8H18
C9H20
C10H22
C11H24
C12H26
C13H28
C14H30
CH4
CH3CH3
CH3CH2CH3
CH3CH2CH2CH3
CH3(CH2)3CH3
CH3(CH2)4CH3
CH3(CH2)5CH3
CH3(CH2)6CH3
CH3(CH2)7CH3
CH3(CH2)8CH3
CH3(CH2)9CH3
CH3(CH2)10CH3
CH3(CH2)11CH3
CH3(CH2)12CH3
Formulabruta
Formularazionale
Gli idrocarburi con più di tre atomi di carbonio possono dare origine a ISOMERI, composti formati dallo stesso numero di atomi di carbonio e idrogeno ma con struttura diversa.
CATENA LINEARE
n - butano
CATENA
RAMIFICATA
Gli isomeri possibili aumentano all’aumentare degli atomi di carbonio nel composto.
Il pentano ha 3 isomeri, l’ottano 18 e così via, fino ad arrivare a miliardi di isomeri!
Per questo motivo si adotta la nomenclatura IUPAC che attribuisce il nome a QUALSIASI ALCANO, INDIPENDENTEMENTE DALLA SUA COMPLESSITA’.
Se ad un idrocarburo viene tolto un H si ottengono i
RADICALI ALCHILICI
Il suffisso … ano viene sostituito da … ile
CH3- metile
CH3-CH2- etile
CH3-CH2-CH2- propile
REGOLE DA SEGUIRE PER ATTRIBUIRE IL NOME AD UN ALCANO:
Si individua la catena con il maggior numero di atomi di Carbonio
La numerazione della catena deve essere assegnata in modo che il numero di posizione della prima ramificazione sia il più piccolo possibile.
Tra il numero e il nome si inserisce un trattino.
Se un gruppo sostituente si ripete due, tre … volte, si usano i prefissi di, tri, tetra… prima del nome del radicale.
I numeri corrispondenti alle posizioni dei gruppi si antepongono al nome.
Tali numeri vengono separati tra loro da una virgola.
I gruppi sostituenti diversi si elencano secondo un ordine alfabetico, prefissi esclusi.
In presenza di più catene “principali” con lo stesso numero d’atomi di carbonio, la priorità appartiene a quella con il maggior numero di ramificazioni.
La numerazione di radicali alchilici complessi parte dall’atomo di carbonio attaccato alla catena principale; quindi si procede secondo le regole precedenti.I numeri e i sostituenti dei radicali alchilici complessi vanno posti tra parentesi
prima del nome della catena radicalica principale.
5-(1-etilpropil) nonano
PROPRIETÀ FISICHE DEGLI ALCANI
Tempo fa gli alcani venivano chiamati composti alifatici, termine che deriva dal greco aleifar cioè unguento. Questo perché molti grassi contengono lunghe catene carboniose.
Gli alcani sono composti apolari in quanto contengono solo legami covalenti pressoché omopolari, disposti in modo del tutto
simmetrico.
Poiché le attrazioni intermolecolari sono dovute unicamente a deboli forze di van der Waals, tanto più forti quanto più grande è la molecola, i loro punti di fusione e di ebollizione sono piuttosto bassi ed aumentano con le dimensioni della molecola.
I PRIMI QUATTRO TERMINI DELLA SERIE SONO TUTTI GASSOSI
DAL C 5 AL C 16 SONO LIQUIDI
DAL C 17 SONO SOLIDI
A TEMPERATURA AMBIENTE:
I punti di fusione e di ebollizione degli idrocarburi liquidi aumentano all’aumentare del numero degli atomi di carbonio in misura di 20-30 °C per ogni atomo di carbonio che viene aggiunto alla catena, mentre, a parità di massa molecolare, la catena più corta comporta un punto di fusione e di ebollizione più bassi.
Le temperature di fusione, di ebollizione e la densità degli alcani dipendono dalla lunghezza e dalle ramificazioni della catena di atomi di carbonio.
I diversi isomeri di uno stesso alcano hanno differente punto di ebollizione: esso è tanto più basso quanto più ramificate sono le molecole. Infatti le molecole di questo tipo sono a contatto solo per una modesta porzione della loro superficie e quindi sono legate in modo notevolmente più blando
Il pentano normale bolle a 36,1 °C, l’isopentano a 27,9 °C ed ilneopentano (dimetilpropano), 9,5 °C; i primi due sono liquidi molto volatili (bollono sul palmo della mano); il terzo, alla temperatura ambiente, è gassoso.
Non potendo formare legami a idrogeno, gli alcani non sono solubili in acqua, mentre lo sono nei solventi apolari, quali benzene, etere etc.
Per quanto le proprietà chimiche possiamo dire che gli alcani sono composti molto stabili e, per queste loro proprietà, sono anche detti paraffine (dal latino = poco affini, poco reattivi). La loro grande stabilità è dovuta ai legami covalenti puri della catena di carbonio, nei quali la coppia di elettroni che costituisce il legame σ è rigidamente localizzata e condivisa tra due atomi.
PROPRIETÀ CHIMICHE DEGLI ALCANI
I legami C—H sono solo leggermente polarizzati, in quanto la differenza di elettronegatività tra C—H è molto bassa (circa 0,24); inoltre, la disposizione simmetrica degli atomi di idrogeno intorno a ogni atomo di carbonio, ne annulla gli effetti e la molecola risulta essere stabile.
Tuttavia, in particolari condizioni o in presenza di catalizzatori, gli alcani possono dare tre tipi di reazioni: la sostituzione radicalica, la combustione e il cracking.
In condizioni standard gli alcani non danno alcuna reazione né con gli acidi, né con le basi, né con gli agenti ossidanti; reagiscono solo a temperatura molto elevata o sotto l’azione di raggi ultravioletti che forniscono energia sufficiente per rompere i legami.
LA REAZIONE AVVIENE CON DIFFICOLTA’
SI DEVE FORNIRE ENERGIA O RISCALDANDO A 250-400°CO IRRADIANDO CON LUCE ULTRAVIOLETTA
NELLA REAZIONE -X INDICA GLI ALOGENI Cl2 E Br2 ,MENTRE -R UN GRUPPO ALCHILICO
R-H + X2 R-X + H-X
LA REAZIONE CON GLI ALOGENI SEGUE UN MECCANISMO A CATENA
CH4 + Cl2 → CH3Cl + HCl
INIZIAZIONECl2 → 2Cl°
PROPAGAZIONECl° + CH4 → CH3° + HCl
CH3° + Cl2 → CH3Cl + Cl°
TERMINAZIONE
CH3° + Cl° → CH3ClCH3° + CH3° → CH3CH3
SONO LE REAZIONI DEGLI ALCANI CON L’OSSIGENO
AVVENGONO FACILMENTE CON GLI ALCANI CHE SITROVANO ALLO STATO GASSOSO
POSSONO AVVENIRE IN DUE MODI :
IN ECCESSO DI OSSIGENOIN CARENZA DI OSSIGENO
LA REAZIONE IN ECCESSO DI OSSIGENO
CON OSSIGENO ABBONDANTE LA REAZIONE DI COMBUSTIONE E’ COMPLETA
I PRODOTTI DI REAZIONE SONO ACQUA E ANIDRIDE CARBONICA (DIOSSIDO DI CARBONIO)
LA REAZIONE E’ FORTEMENTE ESOTERMICA
LA REAZIONE IN CARENZA DI OSSIGENO
CON OSSIGENO CARENTE LA REAZIONE DI COMBUSTIONERISULTA INCOMPLETA
I PRODOTTI DI REAZIONE SONO ACQUA E OSSIDO DICARBONIO (MONOSSIDO DI CARBONIO).
SONO REAZIONI CHE AVVENGONO GRAZIE AL CALORE (CRACKING TERMICO) O CALORE E CATALIZZATORI (CRACKING CATALITICO).
CONSISTONO NELLA ROTTURA DI LUNGHE CATENE DI ALCANI CON MOLTI ATOMI DI CARBONIO, IN MOLECOLE PIU’ CORTE DI ALCANI E ALCHENI.
L’IMPIEGO DEI CATALIZZATORI ( A BASE DI SILICE E ALLUMINA ) CONSENTE DI INDIRIZZARE LE REAZIONI SELETTIVAMENTE VERSO ALCUNI DEI PRODOTTI).