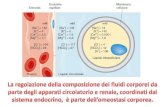
CLORO E HIDROXIDO de Sodio Expo Industria
-
Upload
loayza-totty-rodriguez -
Category
Documents
-
view
55 -
download
3
Transcript of CLORO E HIDROXIDO de Sodio Expo Industria

CLORO E HIDROXIDO DE SODIO
ALUMNO: LOAYZA RODRIGUEZ JORGE ANTONIO
CURSO. QUIMICA INDUSTRIAL

QUÍMICA DEL CLORO

Descubridor: Carl William Scheele.Lugar de descubrimiento: Suecia.Año de descubrimiento: 1774.Origen del nombre: De la palabra griega "chloros",
que significa "verde pálido", reflejando el color del gas.
Obtención: Scheele hizo reaccionar al mineral pirolusita (dióxido de manganeso, MnO2) con ácido clorhídrico.
HISTORIA
MnO2 + 4 HCl → MnCl2 + Cl2 + 2 H2O

El cloro se encuentra en la naturaleza combinado con otros elementos formando principalmente sales iónicas; como es el caso del cloruro sódico y cálcico; también con la mayoría de metales; desde el cloruro de hafnio hasta el cloruro de plata. Podría decirse que el cloro combina de forma natural bastante bien con la mayoría de elementos, quitando los de su grupo, halógenos y gases nobles, aunque en las últimas décadas de manera sintética forma parte de los mismo en compuestos conocidos como son los fluorocloruros y cloruros de xenón. Finalmente cabe destacar que la gran mayoría de estos compuestos suelen encontrarse con impurezas formando parte de minerales como la carnalita, KMgCl3·6H2O.
INTRODUCCIÓN

El cloro comercial se obtiene por electrólisis en el proceso de preparación de los álcalis y se expende en forma líquida, no es puro; y por lo tanto, ha de purificarse. Si se trata el dióxido de manganeso hidratado con ácido clorhídrico concentrado se produce un gas exento en gran parte de impurezas tales como el oxígeno gas (O2(g)) y óxidos de cloro.
4HCl + MnO2xH2O MnCl2 + (x+2)H2O + Cl2

CARACTERÍSTICAS GENERALES
Nombre: Cloro Símbolo: Cl
Número atómico: 17 Masa atómica (uma): 35,4527
Período: 3 Grupo: VIIA (halógenos)
Bloque: p (representativo) Valencias: -1, +1, +3, +5, +7
PROPIEDADES PERIÓDICAS
Configuración electrónica: [Ne] 3s2 3p5 Radio atómico (Å): -
Radio iónico (Å): 1,81 (-1) Radio covalente (Å): 0,99
Energía de ionización (kJ/mol):1251 Electronegatividad: 3,16
Afinidad electrónica (kJ/mol): 349
PROPIEDADES FÍSICAS
Densidad (g/cm3): 0,003214 (0 ºC) Color: Amarillo-verdoso
Punto de fusión (ºC): -102 P. de ebullición (ºC): -34
Volumen atómico (cm3/mol): 17,39
PROPIEDADES FÍSICAS Y QUIMICAS DEL CLORO

El cloro se fabrica de tres formas distintas. Del proceso de producción se obtienen, además, varios productos secundarios muy útiles. 1.-El cloro se produce mediante la electrolisis del cloruro de sodio (sal común). Además del cloro en estado gaseoso,2.-se obtiene hidrogeno y una solución de hidróxido sódico (llamada comúnmente sosa)3.-(Soda caustica). La reacción que se produce en este proceso es la siguiente:
2NaCl (aq) + 2 H2O 2 NaOH (aq) + Cl2 + H2
QUIMICA DEL PROCESO DE PRODUCCIÓN DE CLORO

El proceso de electrolisis consiste en aplicar una corriente eléctrica a una determinada sustancia iónica, lo que permite separar sus iones. La electrolisis se produce en una celda donde se distinguen dos compartimentos o electrodos: elpolo positivo (o ánodo) y el polo negativo (o cátodo), de forma que al aplicar la corriente, los iones positivos se sienten atraídos hacia el polo de signo contrario (es decir, hacia el cátodo) y los iones negativos se sienten atraídos hacia el ánodo
ELECTROLISIS

Actualmente se aplican tres tipos diferentes de tecnologías de electrolisis en la fabricación del cloro:
a) Electrolisis con celda de mercuriob)Electrolisis con celda de diafragmac)Electrolisis con celda de membrana

Fue la primera técnica de producción de cloro y sosa cáustica utilizada a escala industrial. Se trata, además, de un procedimiento desarrollado principalmente en Europa, ya que se utiliza en un 64% de las empresas europeas. El mercurio actúa como cátodo, "amalgamando" el sodio elemental (lo atrapa en su seno). Esta amalgama, cuando se pone en contacto con agua libera el sodio, desprendiendo hidrogeno y formando hidróxido de sodio en solución. El mercurio "des amalgamado" se recircula para ser reutilizado nuevamente. Con este proceso se consiguen unos productos muy puros, pero por el hecho de utilizar mercurio requiere de unos controles y unas medidas de seguridad específicas para la protección de los trabajadores y del medio ambiente. En todas las empresas que utilizan esta tecnología las emisiones de mercurio son controladas rigurosamente, en cumplimiento de la normativa ambiental mas exigente
ELECTROLISIS CON CELDA DE MERCURIO


Fue la primera técnica que se desarrollo. en laboratorio. Este procedimiento se implanta. principalmente en los Estados Unidos. Necesita menos energía que el proceso con celda de mercurio. Sin embargo, para obtener una sosa cáustica comercial es preciso otro procedimiento adicional. Esto supone un encarecimiento del proceso. Una membrana especial actúa como medio de separación entre las dos soluciones presentes (la salmuera de NaCl en contacto con el ánodo y la solución de hidróxido de sodio en contacto con el catodo).
ELECTROLISIS CON CELDA DE DIAFRAGMA

Este proceso se empezó. A desarrollar en los años 70. La celda esta. dividida en dos compartimentos por medio de una membrana que permite el paso de iones a través de ella. El consumo de energía es parecido al de las celdas con diafragma y la sosa caustica que se produce es de gran pureza. Sin embargo, los costes de fabricación son muy elevados.
ELECTROLISIS CON CELDA DE MEMBRANA

Potabilizar y depurar el agua para consumo humano.Producción de papel, colorantes ,textiles, productos
derivados del petróleo, antisépticos, insecticidas, medicamentos, disolventes, pinturas, plásticos, etc.
En grandes cantidades, el cloro es consumido, para: productos sanitarios, blanqueantes, desinfectantes y productos textiles.
Producción de ácido clorhídrico, cloratos (usados como oxidantes, fuentes de oxígeno en fósforos en explosivos), cloroformo y tetracloruro de carbono (estas dos últimas sustancias se emplean para obtener refrigerantes, propulsores y plásticos).
En la extracción de bromo.
APLICACIONES

a) Producción de compuestos orgánicos clorados como cloro metano, cloro etano, etc., y sobre todo el cloruro de vinilo, monómero del PVC. El 70% de la producción del Cl 2 se emplea con este fin
CH2=CH2 + Cl2 Fe c l 3 CH2ClCH2Cl
CH2ClCH 2Cl 4 5 0 - 5 0 0 ° C CH2=CH2Cl +HCl
b) Como blanqueante en las industrias del papel y textil; para la desinfección sanitaria de aguas, piscinas y en el tratamiento de aguas residuales. El 20% de la producción del Cl2 se emplea para este uso.
c) En la fabricación con compuestos inorgánicos como el HCl, Cl2O, HClO, NaClO3,PCl3, PCl5, etc. El 10% de la producción del Cl2 se emplea en esta síntesis de productos inorgánicos.

El cloro se emplea principalmente en la purificación de aguas, como blanqueante en la producción de papel y en la preparación de distintos compuestos clorados.
Un proceso de purificación de aguas ampliamente utilizado es la cloración. Se emplea ácido hipocloroso, HClO, que se produce disolviendo cloro en agua y regulando el pH
En la producción de papel se emplea cloro en el blanqueo de la pulpa, aunque tiende a ser sustituido por dióxido de cloro, ClO2.

Una gran parte del cloro se emplea en la producción de cloruro de vinilo, compuesto orgánico que se emplea principalmente en la síntesis del poli(cloruro de vinilo), conocido como PVC.
Se usa en la síntesis de numerosos compuestos orgánicos e inorgánicos, por ejemplo tetracloruro de carbono, CCl4, o cloroformo, CHCl3, y distintos halogenuros metálicos. También se emplea como agente oxidante.
Preparación de cloruro de hidrógeno puro; se puede llevar a cabo por síntesis directa: H2 + Cl2 → 2HCl

Ácido clorhídrico , HCl. Se emplea en la industria alimentaria, metalúrgica, productos de limpieza, abrillantador de pisos, destapador de caños y tuberías.
Ácido hipocloroso , HClO. Se emplea en la depuración de aguas y alguna de sus sales como agente blanqueante.
Ácido cloroso , HClO2. La sal de sodio correspondiente, NaClO2, se emplea para producir dióxido de cloro, ClO 2, el cual se usa como desinfectante.
Ácido clórico (HClO3). El clorato de sodio, NaClO 3, también se puede emplear para producir dióxido de cloro, empleado en el blanqueo de papel, así como para obtener clorato.
Ácido perclórico (HClO4). Es un ácido oxidante y se emplea en la industria de explosivos. El perclorato de sodio, NaClO4, se emplea como oxidante y en la industria textil y papelera
DERIVADOS DEL CLORO CON INTERES INDUSTRIAL

Estado físico: Liquido viscoso Peso molecular: 39.9971 g/mol Color: blanquecino Inodoro Punto de Ebullición: 145ºC (al 50% peso) Punto de Fusión: 10ºC (al 50% peso) Densidad Relativa: 1530 (15,6ºC y 50% peso) Densidad del Liquido: 1530 g/ml (15,6ºC y 50% peso) Solubilidad en Agua: 100% soluble Presión de Vapor: 6,3 mm de Hg (40º y 50% peso) PH: 13- Viscosidad: a 20ºC50 OP Peso especifico: a 25ºC1,53 Otras solubilidades: Metanol, etanol, glicerina Insoluble en acetonas y éter
PROPIEDADES FÍSICAS DEL HIDROXIDO DE SODIO

El hidróxido de sodio es un producto muy higroscópico que atrapa la humedad del aire. Igualmente absorbe albióxido de carbono.
El Hidróxido de Sodio es una base fuerte, se disuelve con facilidad en agua generando gran cantidad de calor y disociándose por completo en sus iones, es también muy soluble en Etanol y Metanol. Reacciona con ácidos
Es una sustancia muy reactiva, que puede reaccionar violentamente con numerosos compuestos como: aldehído acético, acroleína, acrilonitrilo, anhídrido maleico.
PROPIEDADES QUÍMICAS DEL HIDRÓXIDO DE SODIO

El Hidróxido de Sodio es corrosivo para muchos metales. Reacciona con sales de amonio generando peligro de producción de fuego, ataca algunas formas de plástico, caucho y recubrimientos.
En presencia de agua, el hidróxido de sodio, reacciona con las nitroparafinas, nitrometano y otros nitro
compuestos similares, formando sales, que una vez secas son explosivas (reaccionan a los impactos)
Ciertos metales, como el zinc, aluminio, estaño, cobre, plomo, bronce y latón, son atacados por las soluciones acuosas de hidróxido de sodio, con desprendimiento de hidrógeno, altamente inflamable.

PROCESO DE CLORO SODA

Los iones Ca++ SO4= y Mg++ son removidos por reacciones de precipitación de la solución de NaCl alimentada:
Reacción global del proceso cloro soda:

Dos tipos importantes de celdas son utilizadas, la celda de diafragma (75% de toda la producción) y la de mercurio (17%). Las celdas de membrana comprenden un 5% de la producción, otras celdas 13%.
El diafragma previene la difusión de hidróxido de sodio hacia el ánodo. Esta pared permite el paso lento de solución y el paso libre de iones de sodio. Es hecha de fibras de asbesto soportada sobre una pantalla de hierro. El nivel del anolito se mantiene más alto que el catolito para retardar la migración opuesta.
Si el hidróxido de sodio se acumula cerca del ánodo reaccionará con cloro para dar hipoclorito de sodio como un subproducto:
CELDAS UTILIZADAS EN EL PROCESO DE CLOROSODA

Los ánodos eran hechos anteriormente de grafito pero tenian que ser reemplazados en aproximadamente 250 días. Nuevos átomos dimensionalmente estables son hechos de titanio con recubrimiento de platino, rutenio, o iridio. CELDA DE DIAFRAGMA

CELDA DE MERCURIO

CELDA DE MEMBRANAEn la celda de membrana se utlizan membranas perfluoradas o polisulfonas. Los grupos aniónicos inhiben casi completamente el transporte de iones hidróxido desde el cátodo, y al mismo tiempo permiten el flujo de iones de sodio. El cáustico resultante es más puro y concentrado mientrasque se evita la contaminación potencial de las celdas de mercurio.

Proceso del Mercurio Proceso de Diafragma Proceso de Membrana
Ventajas -NaOH 50%-Cl2 puro -utiliza sales menos puras-Utiliza menos energía que el proceso de mercurio.
-NaOH puro (20-25 %)-Consume sólo el 77% de la energía que se consume en el proceso de Hg-No utiliza Hg o asbestos
Desventajas -Hg tóxico-Más energía consumida (más del 10-15% que el proceso de diafragma)
-NaOH de pureza media-El Cl2
contiene O2-Los asbestos son
tóxicos
-el Cl2 contiene O2 -Se necesita
sal de alta pureza.-Alto coste de las Membranas
DIFERENCIAS EN LAS CELDAS

El hidróxido de sodio se produce por electrólisis de soluciones acuosas de cloruro de sodio o por la reacción de carbonato de sodio con hidróxido de calcio.
2NaCl + 2H 2O <=> 2NaOH + Cl 2 + H2
Otro tipo de proceso de producción de hidróxido de sodio consiste en la combinación del proceso de electrólisis con celdas de diálisis. Se usa en el tratamiento de aguas residuales que contienen sales de sodio para minimizar las concentraciones de estas sustancias en los vertimientos. La materia prima consiste en sales inorgánicas de sodio que por acción del conjunto de operaciones se transforman en hidróxido de sodio y en el ácido correspondiente al anión de la sal sódica como se muestra en la reacción:
NaSO4+ 2H2O => 2NaOH + H 2SO4
PRODUCCIÓN DE HIDROXIDO DE SODIO

ELECTRÓLISIS CLORO-ÁLCALI
MÉTODO DE OBTENCIÓN

MÉTODO LE BLANC:
1.- A part ir de Cloruro de Sodio y Ácido Sulfúr ico se obtienen Sulfato de Sodio y Cloruro de Hidrógeno. 2 NaCl + H 2SO 4 Na2SO4 + 2 HCl
2- El Sulfato de Sodio se reduce con coque y se calc ina con cal iza, así se obtiene Carbonato de Sodio, Sulfuro de Calc io y Dióxido de Carbono.
Na2SO4 + CaCO 3 + 2 C Na2CO3 + CaS + 2 CO 2
3- Por extracción con agua pueden separarse el Carbonato de Sodio (soluble) y el Sulfuro de Calc io( insoluble).
4- El Carbonato de Sodio puede tratarse con cal apagada para obtener una solución de Hidróxido de Sodio.
Na 2CO 3 + Ca(OH) 2 CaCO3 ¯ + 2 NaOH

MÉTODO SOLVAY:1.-Haciendo pasar Amoníaco y Dióx ido de Carbono (gaseosos) por una so luc ión saturada de C loruro de Sodio se forma Carbonato ác ido de Sodio y C loruro de Amonio (ambos inso lubles) .
NaCl + NH 3 + CO 2 + H 2O NaHCO 3 + NH 4Cl
2- E l Carbonato ácido de Sodio se separa de la so luc ión por f i l t rac ión y se t ransforma en Carbonato de Sodio por ca lc inación:
2 NaHCO 3 Na 2CO 3 + H 2O + CO 2
3- E l C loruro de Amonio obtenido se hace reaccionar con Hidróx ido de Calc io y se recupera Amoníaco.
2 NH 4Cl + Ca(OH) 2 2 NH 3 + 2 H 2O + CaCl 2
4- E l Hidróx ido de Calc io se produce en la misma fábr ica por ca lc inación de Carbonato de Calc io (p iedra ca l iza) y as í se produce e l Dióx ido de Carbona necesar io en la ecuación CaCO 3 CaO + CO 2

Química Orgánica e Inorgánica: Fabricación de compuestos de sodio que pueden, a su vez, ser intermedios (como el Fenolato Sódico) en la preparación de aspirina o producto final como el hipoclorito de sodio, importante blanqueador y desinfectante base de lejías.
Industria Textil: Operaciones de acabado y apresto como el mercerizado, en el que mejore el brillo y la absorción de tintes, la limpieza removiendo ceras y pectinas, y el blanqueado con un agente oxidante.
Aplicación

Detergentes y Tensioactivos : La sosa interviene en la hidrólisis de grasas y aceites vegetales y animales, para producir los detergentes. En la fabricación de los polvos, intervienen además otros compuestos de sodio en el que también esta presente la sosa.
Producción de Gas y Petróleo : La sosa se emplea en
perforación para controlar el PH de los barros y lodos, y también como bactericida. En el refino del petróleo, se emplea para extraer azufre, compuestos de azufre y ácidos.
Producción de Aluminio : Extracción de la alúmina de la bauxita, mineral base.
Industria de la Celulosa y el Papel : La sosa actúa sobre la pulpa para producir celulosa. En la industria papelera, blanquea la materia prima reciclada.

Industria del Rayón : Disolución de la lignina de la pulpa.
Industria Alimenticia : Refino de aceites animales y vegetales, limpieza de botellas y equipos de fabricación de cervezas y pelado de papas, frutas y vegetales.
Tratamiento de Agua : Control del PH y regeneración de resinas iónicas.
Industria Agrícola : Tratamiento de la paja para mejorar su valor nutritivo y digestibilidad. Limpieza de equipos lácteos.
Otros Usos: Decapado de pinturas, agente extractor

Carbonato de sodio es una sal muy soluble en agua y las soluciones presentan reacción alcalina por un proceso de hidrólisis:
Na2CO3 + H2O NaHCO3 + NaOH
Tiene múltiples aplicaciones : en la industria jabonera, en la fabricación del vidrio y de la cerámica, en el lavado de lanas y fibras textiles, en la industria del papel, en la refinación de derivados del petróleo.
SALES DE HIDROXIDO DE SODIO

El cloruro de sodio Nacl (sal común); se emplea en la industria para la obtención de cloro, hidróxido de sodio y acido clorhidrico;en la fabricación de vidrio y de jabón, para la conservación de alimentos y como condimento