CAPITOLO 4 DEFINIZIONE DEL PROGRAMMA...
Transcript of CAPITOLO 4 DEFINIZIONE DEL PROGRAMMA...

Capitolo 4 – Definizione del programma sperimentale
110
CAPITOLO 4 DEFINIZIONE DEL PROGRAMMA
SPERIMENTALE
4.1 Il processo produttivo ipotizzato I processi per la produzione di bioetanolo, biodiesel e metano ricavato dal biogas sono da
tempo noti, mentre, solo nel corso degli ultimi anni, sono state sperimentate vie di produzione
fermentativa di idrogeno da biomasse (Turn et al., 1998, Hallenbeck & Benemann, 2002;
Levin et al., 2002). Tra queste, quella che sfrutta le capacità di batteri fermentativi
acidogenici di trasformare idrati di carbonio in idrogeno ed acidi grassi volatili appare
particolarmente promettente (Levin et al., 2002).
L’interesse deriva anche dalla possibilità di impiego come materia prima di rifiuti e scarti
lignocellulosici “umidi” come ad esempio la frazione organica dei rifiuti solidi urbani. Tali
rifiuti sono largamente disponibili in tutti i paesi industrializzati a costi negativi stimabili, in
prima approssimazione, pari a quelli necessari per un loro corretto smaltimento.
La cellulosa e l’emicellulosa, che costituiscono le principali componenti dei rifiuti in
questione, non sono però facilmente utilizzabili dai batteri acidogenici; si rendono quindi
necessari pretrattamenti termo-chimici di idrolisi (Kim et al., 2005). Nei naturali processi di
degradazione anaerobica della sostanza organica la fase acidogenica/idrogenogenica precede
quella metanogenica in una successione perfettamente integrata di trasformazioni
biocatalizzate che possono essere sfruttate per convertire rifiuti lignocellulosici in metano o in
idrogeno e metano (Gavala et al., 2005) (Figura 4.1).

Capitolo 4 – Definizione del programma sperimentale
111
Figura 4.1 Schema concettuale per la produzione biologica di idrogeno e metano da biomassa.
Nel primo stadio del processo, tramite la fermentazione della biomassa si forma l’idrogeno
principalmente mediante degradazione della componente glucidica del substrato organico, e
altri prodotti intermedi (residui fermentescibili non zuccherini) che passano al secondo stadio
metanogenico e rappresentano il substrato utilizzabile dai metanobatteri. L’idrogeno, separato
dalla CO2, può essere usato direttamente nelle fuel cell o in motori a combustione interna, solo
o combinato con il metano prodotto nel secondo step; inoltre quest’ultimo può essere
teoricamente sottoposto a steam reforming e utilizzato anch’esso in fuel cells.
Sulla base delle considerazioni esposte uno schema concettuale di un processo per la
produzione di biocarburanti gassosi (rappresentato in Figura 4.1) può essere il seguente:
1) Pretrattamenti meccanici: un modo di migliorare i rendimenti di conversione è quello di
ridurre la dimensione delle particelle solide attraverso trattamenti meccanici che aumentano la
superficie specifica delle particelle (Hills e Nakano, 1984). I pretrattamenti meccanici
vengono effettuati su un substrato da cui sono stati eliminati inerti e plastiche (cioè le frazioni
non biodegradabili).
IDROLISI
rifiuti lignocellulosici umidi
calore catalisi acida/basica
neutralizzazione lavaggio
fermentazione anaerobica/idrogenionica purificazione
fermentazione anaerobica/metanogenica purificazione
residui solidi allo
smaltimento
H2O
trattamento aerobico
corpi idrici superficiali metano idrogeno
CO2
CO2
prettamenti meccanici

Capitolo 4 – Definizione del programma sperimentale
112
2) Idrolisi: i materiali di partenza contenuti nei residui organici sono polimeri complessi come
la cellulosa, l’amido, i grassi e le proteine non assimilabili direttamente dai batteri. Quindi
questo processo serve a degradare i polimeri dell’amido, della cellulosa, dei grassi, delle
proteine, in acidi organici, alcoli, acqua e anidride carbonica. Sono state effettuate idrolisi
acide e basiche a diverse temperature e diverse concentrazioni di solidi totali.
3) Preparazione del substrato: consiste nell’assicurare la presenza di nutrienti essenziali a
diverse concentrazioni e rapporti. Questi rappresentano unità strutturali e sorgenti di energia
utilizzate dai microrganismi per costruire e mantenere la loro struttura ed organizzazione. La
maggior parte delle matrici organiche contiene in gran quantità i principali nutrienti (C,N,P e
K) richiesti dai microrganismi coinvolti nel processo. Ove i giusti rapporti tra i nutrienti non
sono rispettati nella materia prima utilizzata dal processo, questi devono essere aggiunti
mediante l’uso di chemical che li contengono.
4) Fermentazione idrogenogenica: durante la fase acidogenica si ha la trasformazione dei
monomeri in H2O, CO2, NH3, etanolo ed acidi grassi volatili. Durante la fase acetogenica
invece si ha la trasformazione degli alcoli, degli acidi grassi volatili in acetati (acido acetico e
acido formico), H2, CO2.
5) Fermentazione metanogenica: i batteri metanigeni trasformano acetati, H2, CO2, CH4
mediante le seguenti reazioni:
a. Riduzione della CO2: O2HCHO4HCO 2422 +→+ (4.1) ca. 30%
b. Decarbossilazione dell’acido acetico: 32423 COHCHOHCOOHCH +→+ (4.2)
c.a. 70% -
6) Trattamento aerobico degli effluenti: si può ipotizzare un trattamento tradizionale a fanghi
attivi con il compito di portare a norma (vedi punto 10) gli effluenti generati dal processo che
potrebbero in parte essere riciclati all’inizio per la preparazione del substrato ed in parte
smaltiti in un corpo idrico recettore. I fanghi di supero potrebbero essere inviati alla
fermentazione metanogenica.
7) Disidratazione dei fanghi: i fanghi dalla digestione anaerobica devono essere sottoposti a
trattamenti che normalmente ne aumentano il contenuto di sostanza secca fino ad un tenore ≥
25% per essere inviati allo smaltimento in discarica.

Capitolo 4 – Definizione del programma sperimentale
113
Figura 4.2 Schema qualitativo dei diversi cammini metabolici del processo di digestione anaerobica.
8) Residuo solido alla smaltimento: in accordo con i vincoli posti dal D. M. 2003 n° 36.
9) Trattamento terziario: costituisce un’ulteriore sezione dell’impianto, presente quando è
necessario ridurre le concentrazioni di composti azotati e fosforati.
10) Residuo liquido allo smaltimento: in accordo con i vincoli posti dal D.Lgs. 2000 n°258.
52%
24% 28%
72% 20 %
4%
76% SOSTANZA ORGANICA
COMPLESSA
ACIDI ORGANICI
H2
CH4
ACIDO ACETICO
ACETOGENESI IDROLISI
FERMENTAZIONE
METANOGENESI

Capitolo 4 – Definizione del programma sperimentale
114
Figura 4.3 Fasi della digestione anaerobica1.
1Per digestione anaerobica si intende il processo biologico di trasformazione di un substrato organico in assenza di ossigeno, attraverso idrolisi, acidogenesi e metanogenesi (conversione del carbonio in metano ed anidride carbonica) della frazione biodegradabile del substrato. Nel caso in esame le fasi di idrolisi e di acidogenesi del substrato sono in larga misura già avvenute nello stadio di fermentazione idrogenogenica.
FASI DELLA DIGESTIONE
ANAEROBICA
H2, CO2 ACETATO
ACIDI ORGANICI,
ALCOLI
MONOMERI SOLUBILI
CEPPI BATTERICI
MACRO MOLECOLE ORGANICHE
CH4 CH4, CO2 METANOGENESI
ACETOGENESI
IDROLISI
Clostridium Ruminococcus Butyrivibrio Bacillus
Clostridium Ruminococcus Selonomomas ACIDOGENESI
Eubacterium Clostridium Acerogenium
Metanobacter
Batteri fermentativi 76%
20% 4 %
Batteri acetogeni
Batteri acetoclasti 72% Batteri idrogenofili 28%

Capitolo 4 – Definizione del programma sperimentale
115
Figura 4.4 Degradazione di substrati organici complessi particolati o solubili.
4.2 Il substrato modello di riferimento e quello reale
Ciascuna delle materie prime rinnovabili potenzialmente utilizzabili per la bioproduzione di
idrogeno ipotizzata renderebbe disponibile un substrato per la “dark fermentation” diverso per
struttura e composizione.
Così ad esempio si avrebbe come fonte di carbonio:
Saccarosio: da melasso di barbabietola o di canna (sottoprodotti dell’agroindustria); da sorgo
zuccherino (pianta energetica per eccellenza);
Fruttosio: dall’idrolisi dell’inulina prodotta dal topinambur (altra pianta proposta per scopi
energetici);
Oligosaccaridi del glucosio: dall’idrolisi di materiali amidacei di scarto;
Lattosio: da siero di latte (sottoprodotto dell’industria casearia);
Glicerina: da liscivi (sottoprodotti dell’industria del sapone e/o della produzione del
biodiesel);
Oligosaccaridi di glucosio e xilosio: dall’idrolisi di scarti lignocellulosici e/o della FORSU.
PROTEINE GRASSI CARBOIDRATI
AMMINOACIDI ACIDI GRASSI MONOSACCARIDI
NH3 ALCOLI, CHETONI
ACIDI GRASSI VOLATILI
H2, CO2
ACIDO ACETICO
CH4
ACIDO FORMICO
CH4 CO2

Capitolo 4 – Definizione del programma sperimentale
116
È noto dai dati di letteratura che i batteri produttori di idrogeno oggetto del presente lavoro
utilizzano come substrato di elezione il glucosio, il saccarosio o il fruttosio.
Si è quindi programmato di utilizzare come fonte di carbonio e di energia tre tipi di substrati:
• una miscela 1:1 di amido pre-idrolizzato e xilosio in modo da simulare una miscela di
glucidi simile a quella che si otterrebbe idrolizzando materiali lignocellulosici (substrato
di riferimento);
• FORSU selezionata meccanicamente (substrato reale 1);
• FORSU proveniente da RD (Raccolta Differenziata) (substrato reale 2).
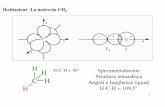
4.2.1 Il substrato modello di riferimento L'amido e la cellulosa (Figura 4.5) sono due polimeri molto simili. Infatti entrambi sono
sintetizzati dallo stesso monomero, il glucosio (Figura 4.6), ed hanno le stesse unità ripetitive
di base. Figura 4.5 Struttura dell’amido.
C'è solo una differenza: nell'amido, tutte le molecole di glucosio sono orientate nella stessa
direzione. Nella cellulosa, invece, ogni unità di glucosio successiva è ruotata di 180 gradi
attorno all'asse della catena principale del polimero rispetto all'unità monomerica che lo
precede.

Capitolo 4 – Definizione del programma sperimentale
117
Figura 4.6 Struttura del glucosio.
La formula di struttura dello xilosio (pentoso) è rappresentata, invece, nella Figura 4.7. Figura 4.7 Struttura dello xilosio.
La cellulosa è costituita da catene lineari di β-D glucosio uniti con 14 legami, e l’unità
ripetuta è il cellobiosio (Figura 4.8).

Capitolo 4 – Definizione del programma sperimentale
118
Figura 4.8 Struttura del cellobiosio.
La composizione del medium utilizzato è riportata nella Tabella 4.1. Tabella 4.1 Composizione terreno nutritizio per brodocolture.
g/l
Amido solubile 5,0
Xilosio 5,0
Nitrato d’ammonio 0,34 C/N ~ 40
Sodio tioglicollato 0,5
KH2PO2 0,25
Soluzioni secondo Owen2 ml/l
A 0,5
B 2,0
C 0,2
D 1,2
pH 7,0 prima della sterilizzazione
(121°C per 30 min.)
2 Owen. et al., 1979

Capitolo 4 – Definizione del programma sperimentale
119
Il rapporto C/N è stato impostato su un valore di 40, intermedio tra quello teorico ottimale per
la crescita (20) e quello sperimentalmente osservato da alcuni autori in corrispondenza di una
massimizzazione delle rese in H2 (47) (Lin C.Y., & Lay C.H., 2004). Il medium di
alimentazione del reattore è stato sterilizzato alla temperatura di 121°C per 30 min., mentre il
serbatoio che lo conteneva è stato stabilmente sottoposto ad un’atmosfera di gas inerte (azoto)
esercitata tramite una camera d’aria a pressione relativa di 3 bar iniziali per mantenerlo
incontaminato.
Le composizioni dei costituenti della Soluzione di Owen utilizzate sono riportate in
Appendice II.
4.2.2 Il substrato reale (1) Nel presente studio è stata utilizzata la F.O.R.S.U. (Frazione Organica dei Rifiuti Solidi
Urbani) proveniente dall’impianto di selezione di rifiuti solidi urbani di Albano, dopo una
prima vagliatura e prima ancora di una completa digestione aerobica.
Tale impianto di preselezione, recupero e riduzione volumetrica degli RSU e trattamento
aerobico della componente organica, è stato progettato in attuazione del D.L. numero 22 del
5/2/97 (Decreto Ronchi) che, nell’articolo 5 al punto 6, specifica come sia necessario avviare
in discarica solamente i residui di lavorazione che derivano dalle operazioni di riciclaggio e
recupero degli RSU.
Il prelievo della FORSU è avvenuto periodicamente con scadenza mensile, per mantenere le
caratteristiche della materia inalterate durante il trasporto è stato previsto l’utilizzo di appositi
contenitori termici, in modo da bloccare ogni possibilità di digestione della sostanza organica
in corso.
Per lo stesso motivo la conservazione della FORSU, per tutto il periodo di analisi in
laboratorio, è avvenuta in camere frigorifero alla temperatura di 4°C.
Le caratteristiche chimico-fisiche di tale materiale sono riportate nella Tabella 4.2 e in Figura
4.9. Tabella 4.2 Sintesi dell'analisi di caratterizzazione della FORSU nel mese di luglio 2006.
Umidità totale (%)
Solidi totali (%)
Solidi volatili (%ST)
Ceneri (%)
Proteine (%ST)
Lipidi (%ST)
Fibra grezza (%ST)
46 54 52 25.7 15.2 4.2 26.2

Capitolo 4 – Definizione del programma sperimentale
120
Figura 4.9 Analisi della caratterizzazione della FORSU nel mese di luglio 2005.
SV28%
Umidità46%
Ceneri26%
Le caratteristiche appena mostrate sono relative alla FORSU prelevata dall’impianto di
selezione di Albano nel mese di Luglio. Utilizzando tale frazione sono state effettuate la
maggior parte delle prove sperimentali, sia nei microreattori batch che nel reattore CSTR.
La Figura 4.10 e la Figura 4.11 rappresentano l’andamento della % di ST e SV nella FORSU
durante l’anno, da aprile 2005 a dicembre 2005.
Figura 4.10 Andamento della percentuale di SV calcolata sugli ST contenuti nella FORSU nei vari mesi della
sperimentazione.
5350 52
48
58
0
10
20
30
40
50
60
%
Aprile Giugno Luglio Ottobre Dicembre
Dall’analisi di tali grafici si mette in evidenza la variazione stagionale delle caratteristiche del
substrato. Notiamo un contenuto maggiore di umidità nell’approssimarsi dei mesi invernali e
una sensibile variazione del contenuto di materia organica. Ma data l’estrema eterogeneità
della FORSU si ritiene opportuno specificare che si tratta solo di risultati “locali”, relativi cioè
ad una piccola parte del campione esaminato.

Capitolo 4 – Definizione del programma sperimentale
121
Figura 4.11 Andamento della % di ST contenuti nella FORSU durante i vari prelievi all’impianto di selezione.
62
53 54 52 49
0
10
20
30
40
50
60
70
%
Aprile Giugno Luglio Ottobre Dicembre
4.2.3 Il substrato reale (2) In una seconda fase di sperimentazione su substrato reale è stato deciso di utilizzare la
FORSU proveniente dall’impianto di compostaggio di Maccarese. Nell'impianto vengono
conferiti i rifiuti della raccolta dei mercati gestita da AMA, oltre a residui organici raccolti in
modo differenziato e a rifiuti lignocellulosici, che vengono trasformati in compost.
Nella sperimentazione presente sono stati impiegati solamente i rifiuti mercatali giunti
all’impianto e sottoposti ad una prima triturazione con mulino a coltelli.
Nella Figura 4.12 sono riportate le caratteristiche medie di tali rifiuti (riferite al mese di
maggio 2006) in termini di umidità, ceneri e solidi volatili.
Figura 4.12 Caratterizzazione della FORSU nel mese di maggio 2006.
Umidità83%
Ceneri2%
SV15%

Capitolo 4 – Definizione del programma sperimentale
122
4.3 I pretrattamenti meccanici ed idrolitici
I pretrattamenti sono una serie di processi a cui viene sottoposta la FORSU per migliorare le
sue caratteristiche in funzione della capacità di fungere da substrato per la produzione di
idrogeno. Uno dei primi obiettivi di questi trattamenti è stato incrementare la concentrazione
di sostanza organica, poiché essa rappresenta il substrato per i microrganismi idrogeno
produttori, e in particolare sono gli zuccheri a svolgere un ruolo fondamentale in questo
processo.
Questi trattamenti mirano a solubilizzare tali sostanze e renderle di immediato utilizzo per i
microrganismi.
Sono state effettuate numerose prove sperimentali in scala di laboratorio al fine di individuare
le condizioni ottimali di pretrattamento; precedentemente, è stato necessario omogeneizzare al
meglio il materiale utilizzato tramite un mulino a sfere o un mulino a coltelli per rendere
significativi i risultati di tali prove.
4.3.1 Pretrattamenti meccanici L’efficienza del processo di digestione anaerobica di rifiuti solidi dipende dalle dimensioni
delle particelle che costituiscono il substrato. Hills e Nakano (1984), lavorando su rifiuti di
pomodoro ridotti a particelle di dimensioni da 1,3 a 20 mm, hanno dimostrato che il tasso di
produzione di biogas ed il consumo di solidi sono inversamente proporzionali al diametro
medio delle particelle del substrato. Risultati simili sono stati ottenuti da Sharma et al. (1988)
con residui forestali ed agroindustriali. Quindi, la riduzione dimensionale delle particelle, e
l’aumento conseguente della superficie specifica disponibile, rappresenta un metodo per
incrementare i rendimenti di degradazione e accelerare il processo di digestione.
Una vasta gamma di processi di riduzione dimensionale, dalla comminuzione alla
disintegrazione della cellula, sono stati sperimentati come pretrattamenti per aumentare la
biodegradazione dei materiali solidi.
L’effetto della comminuzione di materiali organici, utilizzando diversi macchinari, sulla
biodegradabilità anaerobica è stato esaminato da Palmowsky e Müller (1999).
I risultati dimostrano che sia la produzione di biogas che la riduzione del tempo tecnico di
digestione vengono incrementati dalla comminuzione, per tutti i substrati, in particolare per
quelli a bassa biodegradabilità come foglie, semi e gambi di fieno.
La riduzione meccanica delle particelle si è dimostrata efficace anche per l’aumento della
produzione potenziale di biogas da rifiuti ricchi di fibre come il concime. Hartmann et al.

Capitolo 4 – Definizione del programma sperimentale
123
(1999) hanno comparato l’effetto sulla produzione di biogas, della macerazione delle fibre del
concime in cinque differenti impianti di digestione anaerobica. I maceratori installati tra il
serbatoio di stoccaggio e il digestore avevano le stesse caratteristiche. E’ stato dimostrato che
la macerazione dell’intera alimentazione ha l’effetto di incrementare il rendimento del biogas
dell’ordine del 5-25%. Secondo gli autori, i bassi costi della macerazione (l’energia richiesta è
di 0,1-1,3 kWh/m3 di concime) rendono questo metodo conveniente per incrementare la
produzione di biogas da concime e probabilmente anche da altri tipi di rifiuto con un alto
contenuto di materiale particolato.
La disintegrazione meccanica della cellula è un processo ben noto usato in molte applicazioni
biotecnologiche per ottenere prodotti intracellulari, come proteine o enzimi (Schwedes e
Bunge, 1992). Alcuni autori hanno proposto di applicare tale trattamento meccanico come
pretrattamento a monte del processo biologico anaerobico del fango (Kopp et al., 1997, Müller
et al., 1998, Müller e Pelletier, 1998). L’obbiettivo di tale pretrattamento è di accelerare la
digestione del fango e incrementare il grado di degradazione al fine di minimizzare la quantità
finale da smaltire. La frazione principale del fango è costituita da materiali cellulari che spesso
limitano direttamente la degradazione anaerobica perché agiscono come barriere fisiche per i
microrganismi idrolitici. La disponibilità di tale materiale organico intracellulare potrebbe
essere incrementato attraverso i processi di distruzione meccanica della cellula. Inoltre,
l’obbiettivo di un processo di questo tipo è di distruggere la struttura compatta e di
frammentarla in piccole particelle che risultano più facilmente biodegradabili.
Numerosi processi di distruzione della cellula sono stati testati su acque reflue per migliorarne
la biodegradabilità anaerobica (Müller et al., 1998, Müller e Pelletier, 1998; Baier e
Schmidheiny, 1997; Engelhart et al., 1999). In questo campo, risultati comparativi sono
riportati da Müller et al. (1998) che hanno sperimentato in scala di laboratorio quattro metodi
di disintegrazione meccanica della cellula usando fanghi di acque reflue con una
concentrazione di SS pari a 1-4% e di SSV pari al 70% dei SS. I processi meccanici analizzati
sono stati:
• macinazione tramite un mulino a sfere. In questo processo la distruzione delle cellule
avviene attraverso forze di taglio e carichi di compressione tra gli agenti macinanti. Il
mulino testato operava in continuo con una portata di 10 l/h ed una velocità di agitazione
tangenziale da 2 a 10 m/s.
• trattamento tramite un omogeneizzatore ad alta pressione nel quale il componente chiave è
la valvola omogeneizzante attraverso cui la sospensione di cellule è forzata ad alta

Capitolo 4 – Definizione del programma sperimentale
124
pressione (400-900 bar). In questo processo la distruzione delle cellule ha luogo attraverso
meccanismi di cavitazione e turbolenza indotti dal decremento di pressione.
• Trattamento tramite un omogeneizzatore ultrasonico dove l’energia necessaria per la
distruzione è trasferita dentro la sospensione di cellule da un sistema oscillante sotto forma
di onde acustiche. L’elevata energia dei vortici proviene dai meccanismi di cavitazione
creati da forze di taglio che distruggono la struttura di cellule.
• Trattamento tramite un omogeneizzatore “shear gap” nel quale un rotore cilindrico gira con
un alta velocità di rotazione (nel campo da 5000-24000 rpm) concentricamente ad uno
statore. Le forze di taglio risultanti conducono alla distruzione delle cellule.
Usando il tasso di domanda di ossigeno e il COD solubilizzato come parametri per misurare il
grado di distruzione delle cellule, è stato mostrato come un tasso di disintegrazione vicino al
90% è stato ottenuto in condizioni operative ottimali con tutti i metodi testati eccetto con
l’omogeneizzatore “shear gap”. Considerando il consumo di energia specifica,
l’omogeneizzatore ad alta pressione e il mulino a sfere rappresentano i processi più economici.
Inoltre, il grado di digestione del fango disintegrato è risultato superiore a quello di un fango
non trattato per una percentuale compresa tra il 10 e il 20% (Müller et al., 1998).
Gli effetti positivi della disintegrazione meccanica delle cellule sulla digestione anaerobica dei
fanghi è stata illustrata anche da altri autori. Thiem et al. (1997) hanno studiato l’effetto del
pretrattamento ad ultrasuoni sulla biodegradabilità del fango usando ultrasuoni ad una
frequenza di 31 kHz ed alte intensità acustiche. Gli autori hanno mostrato, in digestori operanti
con un identico tempo di residenza di 22 giorni, che la riduzione di solidi volatili era del
45,8% per un fango non trattato e del 50,3% per un fango disintegrato. Inoltre, la riduzione di
solidi volatili era del 44,3% in un digestore operante con un fango disintegrato ed un tempo di
residenza di 8 giorni. Engelhart et al. (1999) hanno mostrato che il pretrattamento meccanico
del fango usando un omogeneizzatore ad alta pressione conduce ad un accelerazione nella
riduzione di solidi volatili nei digestori a film fissato. La riduzione di solidi volatili di circa il
40% è stata raggiunta con tempi di residenza idraulici più bassi di 5 giorni senza processi
falliti.
Chiu et al. (1997) hanno studiato l’effetto di un trattamento ad ultrasuoni ed alcalino del fango
prima della fermentazione anaerobica con produzione di acidi grassi volatili. E’ stato mostrato
che la combinazione del trattamento alcalino con quello ad ultrasuoni consente una massima
solubilizzazione del COD totale pari all’89% contro il 36% ottenuto con il solo trattamento
alcalino. Inoltre, il pretrattamento combinato alcalino - ultrasuoni aumenta la produzione di

Capitolo 4 – Definizione del programma sperimentale
125
acidi grassi volatili: valori del rapporto VFA:COD compresi tra il 66% e l’84% sono stati
ottenuti in queste condizioni laddove tali rapporti risultavano pari al 10% e al 30%
rispettivamente con il fango grezzo e con il fango pretrattato col solo metodo alcalino.
Rivard e Nagle (1996) hanno testato una combinazione di pretrattamento termico e meccanico
basato sulla sinergia tra l’azione meccanica e quella termica, per distruggere la macrostruttura
del fango disidratato e successivamente per incrementare la sua biodegradabilità. Le
condizioni ottimali di pretrattamento (rilascio di COD solubile dell’ordine dell’80-83%) sono
state ottenute con un contenuto di solidi dell’1%, tempi di trattamento tra 4 e 8 minuti, e una
temperatura di 55°C. In secondo luogo, gli autori hanno proposto una combinazione di
pretrattamento termico e di taglio usando un Ultra-Turrax; il pretrattamento di taglio ottimale
(rilascio di COD solubile dell’ordine dell’88-90%) è avvenuto con un contenuto di solidi
dell’1-2%, tempi di trattamento di 6-10 minuti e una temperatura di 87°C.
Dohanyos et al. (1997) hanno proposto la distruzione meccanica delle cellule contenute nei
fanghi attivi tramite una speciale centrifuga adatta per l’ispessimento. Lo scopo di questo
metodo è la parziale distruzione delle cellule durante l’ispessimento con la centrifuga,
sfruttando l’energia cinetica generata dalla centrifuga stessa. Di conseguenza, non è richiesta
alcuna energia aggiuntiva. Uno speciale ingranaggio impattante è stato incorporato nella
centrifuga e posizionato nel punto in cui il fango ispessito esce. Gli autori riportano che
l’incremento del rendimento della produzione di metano da fanghi attivati ispessiti è stato
dell’84,6%.
4.3.2 Idrolisi L’idrolisi consente la degradazione di substrati organici complessi particolati o solubili, quali
proteine, grassi e carboidrati, con la formazione di composti semplici, quali aminoacidi, acidi
grassi e monosaccaridi in forma solubile.
Il fenomeno dell’idrolisi è un caso particolare del fenomeno generale della solvòlisi, nome
con il quale si indica la reazione di un soluto con il solvente in cui è disciolto; se il solvente è
l’acqua si parla di idrolisi.
L’idrolisi salina è a sua volta il caso di idrolisi in cui si ha reazione tra il solvente acqua ed un
sale in essa disciolto, ma il fenomeno dell’idrolisi non è limitato soltanto ai sali: qualsiasi
reazione in cui una specie chimica che in soluzione acquosa reagisce con H2O formando
nuove specie chimiche rappresenta una reazione di idrolisi, così ad esempio può formarsi
perossido di idrogeno (acqua ossigenata) per idrolisi dell’acido perossidisolforico:
22422822 OHSO2HO2HOSH +→+ (4.3)

Capitolo 4 – Definizione del programma sperimentale
126
Anche in chimica organica si incontrano frequentemente reazioni di idrolisi: ad esempio il
formiato di metile (H-COOCH3) si idrolizza e forma alcool metilico (CH3OH) ed acido
formico (HCOOH):
OHCHHCOOHOHCOOCHH 323 −+→+− (4.4)
Nel caso della FORSU che è composta da residui organici di varia natura, si verifica l’idrolisi
contemporanea dei suoi vari costituenti: lipidi, carboidrati, fibre, proteine
Trattamenti di idrolisi
L’idrolisi può essere di tipo:
• chimico (alcalina o acida)
• termico
• termo-chimico (utilizzata nel nostro studio)
I trattamenti con agenti chimici sono stati ampiamente utilizzati per la produzione di
biocombustibili da substrati lignocellulosici (Millet et al., 1975; Datta 1981; Pavlostathis &
Gosset, 1985). Sono stati investigati pretrattamenti chimici a temperatura ambiente a base di
acidi o basi.
Il trattamento alcalino generalmente è più compatibile con i processi fermentativi anaerobici
che sono più efficaci a pH basici (Pavlostathis & Gosset, 1985) perché provoca una
saponificazione di esteri di acido ironico associata a catene di xilano (Datta, 1981) che ha
come effetto un incremento marcato nella capacità di rigonfiamento e nelle dimensione dei
pori. Ciò non solo consente una diffusività maggiore per gli enzimi idrolitici ma facilita anche
le interazioni tra il substrato e gli enzimi. Per questi motivi i batteri acidogenici possono
fermentare la lignocellulosa pretrattata anche senza che sia avvenuta una delignificazione o
l’idrolisi della cellulosa durante il pretrattamento.
L’agente alcalino più comunemente utilizzato è l’idrossido di sodio. Impiegando tale reagente
a temperatura ambiente si riporta un miglioramento della biodegradabilità di paglia di grano.
La più alta efficienza di conversione anaerobica riportata è stata dell’80% per il substrato
pretrattato a 7.5% di ST, con 50 g NaOH/100 g ST per 24 ore; mentre per il substrato non
trattato l’efficienza di conversione è stata del 34.3%. Il pretrattamento alcalino basato
sull’aggiunta di NaOH può essere applicato ad altri substrati organici più complessi, come i
fanghi civili (Rajan et al,1989); infatti studiando la solubilizzazione a bassi livelli alcalini di
fanghi di depurazione a temperatura ambiente e si trova una solubilizzazione di circa il 45%
del COD particolato. Anche la concentrazione di NaOH e dei solidi nei fanghi influenzano

Capitolo 4 – Definizione del programma sperimentale
127
significativamente il tasso di idrolisi. Con fanghi di alimentazione con l’1% ST, l’idrolisi del
particolato solido dopo 12 ore a 20°C è stata incrementata dal 13 al 45% quando la
concentrazione di NaOH passa da 10 a 40 meq/l. con un livello costante di 4 g NaOH/100 g
ST, il tasso di idrolisi si incrementava dal 13 al 31% quando la concentrazione dei solidi di
alimentazione passa da 0.5 al 3%.
In ogni caso nei pretrattamenti chimici di rifiuti devono essere tenuti in considerazione i
problemi di potenziale tossicità dei substrati, in particolare l’inibizione o la tossicità dovuta
all’alta concentrazione di ioni. Il catione sodio infatti ha un’attività inibente nei confronti
della flora metanogenica (Kugelman & McCarty, 1965; Feijoo et al., 1995). La soglia di
tossicità dello ione Na è considerata 0.3 M che raramente si raggiunge con pretrattamenti a
modesti livelli alcalini. La scarsa biodegradabilità di substrati pretrattati a pH basici sembra
essere quindi dovuta alla formazione di composti refrattari sotto condizioni di alto pH, come
ad esempio le sostanze aromatiche che derivano dalla degradazione della lignina che
costituisce i substrati lignocellulosici.
Il trattamento termico viene impiegato solitamente per migliorare la disidratabilità di fanghi
di depurazione grezzi o digeriti. Naturalmente, l’incremento di biodegradabilità deriva sia
dalla frazione solubile che da quella insolubile. Infatti il trattamento ad alta temperatura altera
la struttura della frazione insolubile e la rende più facilmente biodegradabile.
I principali svantaggi dei pretrattamenti termici sono: produzione di odori molesti, corrosione
e contaminazione organica dei tubi di scambio termico, l’elevata richiesta energetica,
l’esigenza frequente di alcune forme di trattamento prima di riciclare la sostanza liquida
all’impianto di trattamento.
I potenziali vantaggi sono invece una migliore disidratabilità, un incremento della
biodegradabilità, una riduzione nella forza dei flussi liquidi, una riduzione degli odori durante
la fase di digestione, la sterilizzazione del substrato ed un migliore bilancio energetico. Alcuni
studi (Haug et al. 1978) hanno verificato che il pretrattamento termico di fanghi primari a
175°C non ha effetti significativi sulla produzione di biogas. Al contrario, il trattamento di
fanghi attivi comporta un incremento del 60% nel tasso di metano con una riduzione del 36%
di VSS nell’effluente della digestione anaerobica. Gli stessi autori hanno valutato i bilanci
energetici dei sistemi convenzionali di digestione anaerobica dove il trattamento termico
segue la fase di digestione e di quelli dove il trattamento termico si esegue prima, e hanno
concluso che questi ultimi presentano un incremento dell’energia netta prodotta in relazione

Capitolo 4 – Definizione del programma sperimentale
128
alla maggiore biodegradabilità del substrato e alle ridotte richieste energetiche per riscaldare il
digestore.
Il tempo di ritenzione per la digestione anaerobica di fanghi attivi pretrattati a 170°C per
un’ora può essere ridotto a 5 giorni (Li & Noike, 1992). In queste condizioni il tasso di
rimozione del COD era del 60%, con una produzione di biogas di 223 ml/g COD, circa
doppia di quella registrata con il controllo. Secondo questi autori l’effetto positivo del
pretrattamento termico sulla biodegradabilità anaerobica dei fanghi attivi è dovuta all’idrolisi
della maggior parte della frazione particolata dei fanghi attivi, alla produzione di acidi grassi
volatili che sono più facilmente convertibili in biogas durante la successiva fase di digestione,
al fatto che la rimanente frazione particolata contenuta nel fango attivo pretrattato
termicamente risulta più facilmente idrolizzabile dal consortium anaerobico. La fluidità del
rifiuto dipende dalle condizioni di trattamento (temperatura, tempo operativo).
Il fango di acque reflue può essere liquidizzato (Dote et al., 1993) a temperature comprese tra
150 e 175°C. La viscosità del fango diminuisce con l’incremento della temperatura e del
tempo di trattamento. Naturalmente, condizioni troppo severe sembrano avere un effetto
negativo sulla successiva fase di digestione. Si è osservato (Pinnekamp, 1989) un effetto
contrario sopra la temperatura di 180°C. A dispetto dell’incremento della dissoluzione
termica, la produzione di gas ottenuta da un fango trattato termicamente decresce nettamente,
in alcuni casi a valori più bassi del fango non trattato. Allo stesso modo, si è osservato
(Stuckey & McCarty, 1978) che incrementando la temperatura di trattamento veniva
incrementata la solubilizzazione fino ad un massimo del 51% a 225°C. A temperature
maggiori la quantità di materia organica solubile diminuisce suggerendo la formazione di
molecole più grandi attraverso la polimerizzazione. Tale fenomeno è stato associato alle
reazioni di zuccheri semplici contenuti nel fango con aminoacidi che provocano la formazione
di composti difficili da degradare. A temperature superiori a 175°C, essi osservarono una
diminuzione della biodegradabilità anaerobica che potrebbe essere dovuta o alla formazione
di composti refrattari durante il trattamento termico o all’inibizione dei microrganismi
anaerobici dal fango trattato. L’acclimatazione biologica sia a 225 che a 250°C di trattamento
si registra solo dopo 8 giorni di incubazione, questo suggerisce che i materiali refrattari siano
la principale causa della più bassa biodegradabilità alle temperature più alte. Allo stesso
modo, la temperatura alla quale il pretrattamento termico viene condotto ha un effetto
pronunciato sulla biodegradabilità. Con il fango attivo, la biodegradabilità è stata
incrementata con la temperatura con un ottimo vicino a 175°C, oltre tale temperatura la
produzione di gas diminuisce.

Capitolo 4 – Definizione del programma sperimentale
129
L’idrolisi termo-chimica della sostanza organica solida è comunemente effettuata con agenti
alcalini, sebbene sono riportati in letteratura dati sulla idrolisi termo-acida di rifiuti (Bouthilet
& Dean, 1970; Barlindhaug & Odegaard, 1996; Rocher et al., 1999). In questo campo
l’effetto del pretrattamento combinato termico ed alcalino sulla biodegradabilità anaerobica di
fanghi attivi è stato studiato da Stuckey & McCarty (1978) e da Haug et al. (1978). Stuckey &
McCarty, lavorando con fanghi attivi, hanno riportato che, sotto un pretrattamento termo-
chimico, il fango attivo è soggetto alle seguenti reazioni: i lipidi sono idrolizzati in condizioni
acide o alcaline a glicerolo e acidi grassi; i carboidrati, e più in particolare i polisaccaridi
batterici, sono idrolizzati a polisaccaridi più semplici o zuccheri; le proteine sono idrolizzate
da soluzioni acide in monomeri di aminoacidi (alcuni legami peptidici – quelli di valina,
isoleucina e leucina per esempio – sono più stabili degli altri e richiedono tempi di idrolisi
maggiori e acidi più forti. La rottura del legame peptidico è notoriamente più veloce con acido
cloridrico che con acido solforico). Gli aminoacidi possono essere inoltre degradati ad
ammoniaca e acidi organici, le proteine possono anche essere idrolizzate in condizioni
alcaline; naturalmente la velocità e il grado sono generalmente minori rispetto alle condizioni
acide. Gli acidi nucleici RNA e DNA sono idrolizzati per produrre costituenti basici, zuccheri
e ortofosfati. Possono avvenire varie reazioni intermolecolari come le reazioni che
coinvolgono la polimerizzazione di gruppi carbossili con gruppi amminici per formare
polimeri marroni a base di azoto e co-polimeri chiamati melanoidi. Temperature elevate e
valori estremi di pH aumentano la velocità di questa polimerizzazione. Tali composti
notoriamente sono difficili da degradare. Molti autori (Stuckey & McCarty, 1978; Tanaka et
al., 1997; Penaud et al., 1998) hanno confrontato l’efficienza dei pretrattamenti termici,
chimici o termo-chimici e hanno osservato che le migliori performance in termini di
solubilizzazione di COD e biodegradabilità anaerobica erano ottenuti con i pretrattamenti
termo-chimici. Le condizioni ottimali definite dipendono ovviamente dal tipo di substrato
impiegato (Tabella 4.3).
Tanaka et al. (1997) hanno utilizzato fanghi attivi di reflui civili e una combinazione di fanghi
civili e industriali. Impiegando i primi il rapporto di solubilizzazione dei VSS è stato del 70-
80% con un incremento della produzione di CH4 di circa il 30%. Con la combinazione di
fanghi il rapporto di solubilizzazione dei VSS è stato del 40-50% e la produzione di CH4
superiore al 200% rispetto al controllo. Patel et al. (1993), utilizzando giacinti d’acqua,
associarono l’effetto del pretrattamento alcalino alla solubilizzazione della lignina. Ciò
costituisce un vantaggio nel senso che viene liberata la parte solida rimanente di carboidrati
ed incrementa la porosità.

Capitolo 4 – Definizione del programma sperimentale
130
Tabella 4.3 Effetto dei pretrattamenti termo-chimici sulla solubilizzazione e la biodegradabilità anaerobica di vari tipi di rifiuti (Mata-Alvarez, 2003).
Riferimento
Substrato
Condizioni
ottimali definite
Efficienza di solubilizzazione
Effetto sulla biodegradabilità
Stuckey & McCarty, 1978 Fango attivo
175°C, 30 meq NaOH/l,
1 ora 55% COD
78% conversione COD
in CH4
Haug et al. (1978) Fango organico 175°C, pH 12,
30 min 68% COD
Aumento del 57% nella
produzione di CH4
Patel et al. (1993) Giacinto d’acqua 121°C, pH 11, 1 ora 58,5% COD
Aumento della
produzione di CH4
Tanaka et al. (1997)
Combinazione di fanghi
130°C, 0.3 g
NaOH/g VSS, 5 min
45% VSS
Aumento del 220% nella produzione di
CH4
Penaud et al. (1998) Fango industriale
140°C, pH 12,
30 minuti 75% COD
40% biodegradabilità
Penaud et al. (1998) hanno osservato che il pretrattamento alcalino di un fango industriale
conduce ad un incremento della solubilizzazione del COD pari al 75-80% utilizzando 5 g
NaOH/l a 140°C per 30 minuti invece del 65% a temperatura ambiente. Mentre aumentando
la concentrazione di idrossido di sodio non si registravano incrementi significativi del COD
solubile.
I pretrattamenti termo-chimici consentono di incrementare significativamente la
solubilizzazione della sostanza organica ma presentano alcuni inconvenienti come:
• possibilità di formazione di molecole inibenti;
• solubilizzazione di molecole che formano polimeri difficili da degradare;
• utilizzo di reagenti chimici che possono indurre problemi di tossicità.
Per quanto riguarda la formazione di composti inibenti, Haug et al. (1978), trattando fanghi
organici a 175°C a pH 12, osservarono la produzione di tali composti che compromettevano
le prestazioni della digestione anaerobica subito dopo la loro alimentazione al reattore.
Nessuna acclimatazione si registrava dopo 43 giorni dall’alimentazione. In un altro studio,
Patel et al. (1993) sottolinearono i derivati della lignina solubile ottenuti da un trattamento
termo-alcalino esercitano effetti tossici (principalmente come conseguenza delle sostanze
aromatiche prodotte dalla degradazione della lignina). Allo stesso modo Penaud et al. (1998)

Capitolo 4 – Definizione del programma sperimentale
131
non osservarono alcuna acclimatazione dei batteri anaerobici alla biomassa industriale
pretrattata termo-chimicamente, indicando la possibile presenza di materiali inibenti.
Stuckey & McCarty (1978) hanno riportato che la minore biodegradabilità era dovuta
principalmente alla formazione di composti refrattari, sia solubili che insolubili. Come ipotesi
per spiegare la natura refrattaria delle molecole formate è stata avanzata quella della
formazione di reazioni intramolecolari tra i composti solubili che portano alla produzione di
sostanze complesse. Tali reazioni, comunemente definite reazioni di Maillard, si osservano
frequentemente nell’industria alimentare. I composti colorati che si formano sono complessi e
molto difficili da degradare, perfino da i batteri del rumine (Marounek et al., 1995). Penaud et
al. (2000) hanno caratterizzato le molecole solubili generate durante il pretrattamento termo-
chimico di un fango industriale (aggiunta di NaOH fino ad un pH 12, 140°C). Essi
dimostrarono che i composti ad elevato peso molecolare erano responsabili della scarsa
biodegradabilità anaerobica e della biotossicità registrata.
Per quanto riguarda infine la possibile tossicità degli agenti alcalini, nessun autore ha
dimostrato tale ipotesi. Pavlostathis & Gosset (1985) che trattarono paglia di grano con 10 g
NaOH/100 g TS con sistema a flusso continuo, dimostrarono che per una concentrazione del
5% di solidi influente al digestore, la concentrazione di sodio nel digestore allo stato
stazionario dovrebbe essere approssimativamente 0.125 M, che è più basso di 0.3 M
considerata la soglia di tossicità dello ione sodio (Kugelman & McCarty, 1965; McCarty &
McKinney, 1971). In un altro studio, Penaud et al. (1998) non rilevarono alcuna sostanziale
differenza nelle caratteristiche di biodegradabilità ottenute con pretrattamento alcalino a
140°C utilizzando diversi reagenti (NaOH, KOH, Mg(OH)2 e Ca(OH)2). Ciò indica che la
bassa biodegradabilità non è legata alla concentrazione dello ione sodio. Questo è stato
confermato dai test di biodegradabilità condotti a concentrazioni crescenti di sodio.

Capitolo 4 – Definizione del programma sperimentale
132
Figura 4.13 Idrolisi chimica di esosi, pentosi e lignina.
4.4 I meccanismi e le rese dell’Idrogenogenesi
Molte specie di batteri anaerobi sviluppati al buio possono degradare substrati ricchi di
carboidrati producendo un biogas misto costituito principalmente da idrogeno ed anidride
carbonica, ma anche piccole quantità di metano, monossido di carbonio e/o acido solfidrico.
Le reazioni di fermentazione possono avvenire a temperature mesofiliche (25-40°C),
termofiliche (40-65°C), estremamente termofiliche (65-80°C) o ipertermofiliche (> 80°C). I
principali ceppi batterici produttori di idrogeno includono specie di Enterobacter, Bacillus e
Clostridium. I microrganismi appartenenti ai ceppi Clostridium e Bacillus sono caratterizzati
dalla capacità di formare le spore in condizioni ambientali sfavorevoli (stress metabolico),
come scarsità di nutrienti o temperature non elettive, etc. I Clostridi possono essere selezionati
da consorzi naturali come fanghi anaerobici o fanghi attivi utilizzando trattamenti termici.
I Clostridi garantiscono maggiori rese di produzione di idrogeno rispetto ai microrganismi del
ceppo Enterobacter; Clostridium pasteurianum, C. butyricum e C. beijerinkii sono alti
produttori di idrogeno, mentre C. propionicum è un modesto produttore di idrogeno (Levin et
al., 2002).
Il glucosio, i suoi isomeri, o i polimeri (amido o cellulosa), vengono convertiti in quantità
differenti di idrogeno a seconda del percorso di fermentazione e dei prodotti finali. È possibile
ottenere una quantità teorica massima di 4 moli di H2 per mole di glucosio (pari a circa 0,5
l/g) quando il prodotto finale è rappresentato da acido acetico:
IDROLISI CHIMICA
esosi
pentosi
lignina
Fermentazione
Deidrogenazione Idrolisi Idrogenazione Cristallizzazione
Fermentazione Disidratazione Idrogenazione Cristallizzazione
Idrogenazione Idrolisi Ossidazione
Glucosio Acido levulinico Polioli Idrossimetilfurfuroli
Xilosio Lievito Furfurolo Polioli
Derivati del fenolo Idrocarburi Vanillina
Alcoli Polioli, Chetoni Acidi Amidi

Capitolo 4 – Definizione del programma sperimentale
133
22326126 2CO4HCOOH2CHO2HOHC ++→+ (4.5)
Se invece il prodotto finale è l’acido butirrico si possono ottenere al massimo 2 moli di H2
(pari a circa 0,25 l/g) per mole di glucosio:
2222326126 2CO2HCOOHCHCHCHO2HOHC ++→+ (4.6)
Pertanto la massima produzione si realizza quando il prodotto finale di fermentazione è
rappresentato dall’acido acetico. In pratica alte produzioni di H2 sono associate a prodotti di
fermentazione misti di acetato e butirato, e basse rese di H2 sono associate a propionato e
prodotti finali ridotti (alcoli, acido lattico). Pertanto, nel caso di netta preminenza di butirrato
sull’acetato, è lecito attendersi una resa specifica in idrogeno molto inferiore a 0,5 lH2/g e, nel
caso di una degradazione di carboidrati che generi una miscela di acidi grassi volatili (es.
acetico, propionico, butirrico, etc.), si assiste ad una drastica riduzione dei rendimenti in
idrogeno.
La relazione tra la conversione in idrogeno e le concentrazioni di acido acetico e butirrico può
ritenersi valida anche nel nostro caso particolare, ove, avendo adottato come substrato di
riferimento amido:xilosio 1:1, può supporsi anche per lo xilosio una degradazione microbica
teorica quale:
22325105 4CO8HCOOH3CHO4HOH2C ++→+ (4.7)
222235105 CO01H01COOHCHCHCH5OH6C ++→ (4.8)
Sulla base di tali equazioni, la massima resa teorica di idrogeno da xilosio è stimabile pari a
circa 0,6 l/g.
In conclusione, utilizzando una miscela amido:xilosio 1:1, la massima resa teorica ottenibile,
via “dark fermentation”, è pari a 0,55 litri di H2 per grammo di substrato consumato.
4.4.1 Parametri di processo La produzione di idrogeno per via anaerobica e in assenza di luce è fortemente dipendente
dalle condizioni di processo determinate dai parametri come il pH, la pressione parziale
dell’idrogeno, la temperatura ed altri.
Il pH rappresenta uno dei principali parametri nei processi biologici di produzione
dell’idrogeno. Un valore di pH minore di 5 consente di ottenere l’inibizione dei batteri
metanigeni che consumano idrogeno. Kim et al. (2004) hanno ottenuto un tasso di produzione
compreso tra 28 e 40 ml H2/(g glucosio⋅d) con un reattore semi continuo operante ad un pH di
circa 4.5 e un valore di HRT pari a 9 giorni.

Capitolo 4 – Definizione del programma sperimentale
134
Khanal et al.(2004) hanno condotto dei test in batch per investigare l’effetto del pH sulla
produzione di bioidrogeno. Il massimo tasso di produzione (10 mlH2/(gVSS⋅h)) è stato
ottenuto dalla fermentazione di saccarosio con un pH iniziale compreso tra 5.5 e 5.7. Hwang
et al. (2004) utilizzando un reattore CSTR semi continuo hanno determinato un valore di pH
pari a 4 come limite operativo per la produzione di idrogeno dalla fermentazione di glucosio.
La pressione parziale dell’idrogeno è un fattore estremamente importante poiché quando
aumenta la concentrazione di H2, la sua sintesi diminuisce e il pathway metabolico si modifica
verso la produzione di substrati ridotti, come l’etanolo, l’acetone e il butanolo.
La produzione di idrogeno in continuo richiede pH2 < 50 kPa a 60 °C; < 20 kPa a 70°C; < 2
kPa a 98 °C.
È necessario pertanto controllare tale parametro durante il processo di fermentazione al buio
per garantire elevati tassi di produzione di idrogeno. Mizuno et al.(2000) hanno sperimentato
un incremento nel tasso di idrogeno prodotto effettuando lo spargimento di N2 in un reattore
CSTR inoculato con farina integrale di soia per la produzione di idrogeno da glucosio.
Lin & Lay (2004) hanno dimostrato, inoltre, una dipendenza dell’attività dei microrganismi
che convertono saccarosio in idrogeno dal rapporto C/N, determinandone, in particolare, il
valore ottimo (47) in corrispondenza di una produzione massima di idrogeno pari a 4.8
molH2/mol saccarosio. In un altro studio gli stessi autori hanno investigato l’effetto della
concentrazione di carbonati e fosfati sulla produzione di idrogeno da saccarosio utilizzando
fanghi di depurazione pretrattati. Nel caso di limitazione di fosfati, infatti, i prodotti di
fermentazione più abbondanti sono costituiti dall’etanolo e dal butanolo la cui presenza incide
negativamente sulle rese di conversione. Dai risultati è emersa la possibilità di ridurre la fase
di acclimatazione dei microrganismi adottando una giusta concentrazione di fosfati (600
mg/l). Da esperimenti in batch utilizzando come substrato il glucosio è stato dimostrato che
concentrazioni di ferro minori di 0.56 ml/l sono anch’essi limitanti la crescita dei
microrganismi idrogeno produttori e causano la produzione di acido lattico. Il ferro è infatti
un componente dell’enzima Idrogenasi e la sua limitazione ne riduce l’attività. Lin & Lay
(2005) hanno condotto uno studio sull’influenza della concentrazione dei nutrienti sulla
produzione di bioidrogeno dalla microflora dei fanghi di depurazione di reflui civili. Tale
sperimentazione ha evidenziato la possibilità di incrementare i tassi di produzione di idrogeno
fino al 60% circa controllando e ottimizzando la concentrazione di magnesio, sodio, zinco e
ferro.
Un altro parametro importante è la temperatura. La maggior parte degli studi effettuati sulla
produzione di idrogeno attraverso la fermentazione anaerobica al buio sono stati condotti a

Capitolo 4 – Definizione del programma sperimentale
135
temperatura mesofilica (35°C); la produzione di H2 da batteri termofili come il Thermotoga è
attualmente sotto investigazione, ma la sua massima resa ottenuta dal glucosio è di 2,7- 4,5
mmoli H2/(l⋅h).
Cohen (1982) ha dimostrato infine la relazione lineare tra potenziale redox e la formazione di
butirrato nel range -300 mV (max butirrato) e -120 mV (zero butirrato), attribuendo il
fenomeno all’arricchimento selettivo delle specie producenti propionato quando il potenziale
redox cresceva. È quindi importante che il potenziale redox sia minore o uguale ai -300 mV,
per garantire le condizioni ottimali per la formazione di acido butirrico.
4.4.2 Substrati e tipologie di reattori utilizzati La microflora idrogenogenica è capace di degradare una varietà di substrati costituiti da
carboidrati più ampia rispetto ai lieviti che operano la conversione in etanolo, consentendo,
potenzialmente, un abbattimento dei costi di approvvigionamento delle materie prime. Un
tipico esempio in tal senso è la capacità di utilizzare lo xilosio derivato dall’idrolisi di
lignocellulosici (Taguchi et al., 1995).
È stato dimostrato come alcune colture di Clostridium siano capaci di degradare amido
insolubile, senza pretrattamento, mentre alcune colture di Enterobacter possono degradare
solo l’amido solubile. Specie di Clostridium generalmente garantiscono alte concentrazioni e
rese di H2 usando xilosio come substrato. La conversione di rifiuti come substrati in
idrogeno, attraverso il metabolismo anaerobico dei microrganismi, è stata recentemente
oggetto di studio da parte di diversi ricercatori. La ricerca è stata indirizzata verso
l’individuazione di substrati a basso costo e facilmente reperibili.
È stata investigata la possibilità di impiegare con successo substrati come reflui industriali
organici e reflui di un impianto di raffinazione del riso (Yu et al, 2002), reflui di uno
zuccherificio (Ueno. et al., 1996) ed anche rifiuti solidi organici urbani (FORSU) (Lay et al,
1999), letame (Fan et al., 2004) e rifiuti domestici (Han & Shin, 2004).
Sono stati impiegati diverse tipologie di reattori, tra cui reattori UASB, a letto fisso e reattori
a completa miscelazione (CSTR).
Chang et al. (2002) hanno sperimentato l’utilizzo di un reattore UASB per la produzione di
idrogeno inoculato con fango di un impianto di depurazione di reflui civili pretrattato a 100°C
per 45 minuti per inibire l’attività dei batteri metanigeni. Il substrato impiegato è stato il
saccarosio con una concentrazione di 20 g di COD/l. Una produzione costante di 1,5 mmol
H2/mol saccarosio è stata ottenuta con un HRT compreso tra 8 e 20 ore. Il tasso di produzione

Capitolo 4 – Definizione del programma sperimentale
136
di idrogeno invece è risultato massimo in corrispondenza di un HRT di 8 ore e pari a 11,275
mmol H2/(l⋅ h) con una percentuale di H2 nel gas prodotto pari a 42,4%. Il tasso specifico di
produzione di idrogeno ha raggiunto il massimo valore di 2,23 mmol H2/(gVSS ⋅h) con un
HRT di 8 ore. Confrontandolo con gli altri reattori utilizzati, il valore del tasso specifico di
produzione di H2 ottenuto con questo sistema (UASB) è stato più basso mentre la conversione
del substrato in idrogeno è risultata dello stesso livello.
In un altro studio è stato confrontato l’utilizzo di matrici di supporto per i microrganismi
come argilla espansa o carboni attivi in bioreattori a letto fisso. Il substrato impiegato è stato il
saccarosio in concentrazione pari a 20 g COD/l mentre l’inoculo proveniva dal fango di un
impianto di depurazione di reflui civili.
Il tempo di residenza idraulica (HRT) è stato fatto variare tra 0,5 e 5 ore. Con un HRT di 1 ora
la matrice a carboni attivi ha prodotto 1,3 l di H2/(l⋅h). L’impiego di una membrana per la
microfiltrazione a fibre cave ha consentito di incrementare il tasso di produzione di idrogeno
fino a 3 l di H2/(l⋅h). La produzione di H2 è iniziata 2-3 giorni dopo l’aggiunta di inoculo ed è
stata continua per un periodo di 2 settimane. Questo corrisponde ad un tasso di circa 121
mmol di H2/(l ⋅h).
Yu et al. (2002) hanno sperimentato la produzione di idrogeno attraverso l’impiego di un
reattore upflow alimentato con il refluo di un impianto di raffinazione del riso. Il tasso di
produzione specifico di H2 è stato dimostrato che aumenta con la concentrazione del substrato
e con la temperatura, ma con un decremento del tempo di residenza idraulica (HRT). Con un
HRT pari a 2 h è stato raggiunto un ottimo tasso specifico di 15,67 mmol H2/(gVSS⋅ h). La
produzione di idrogeno si è attestata in un range compreso tra 1,37 e 2,14 mol H2/mol esoso.
Lay et al.(1999) hanno riportato un tasso specifico massimo di 1,81 mmol H2/(gVSS⋅ h) con
un alto carico (elevato rapporto F/M) utilizzando un reattore CSTR e come substrato la
FORSU. Tale studio ha dimostrato la possibilità di impiegare la frazione organica dei rifiuti
solidi urbani come substrato per la produzione di bioidrogeno
Nella Tabella 4.4 è riportato uno schema riassuntivo dei principali tipi di substrati e reattori
utilizzati nei diversi studi sulla produzione di idrogeno attraverso la fermentazione anaerobica
al buio.
Dagli studi emerge una certa facilità di produrre idrogeno nei reattori a biomassa adesa come
nei reattori UASB, sebbene non manchino esempi di reattori a biomassa dispersa come
reattori CSTR .

Tabella 4.4 Principali tipi di substrati impiegati nella produzione di idrogeno attraverso la fermentazione al buio.
Substrato Reattore Inoculo Temperatura pH mol H2/mol esoso l H2/(gVSS⋅d) lH2/(l⋅d)
Refluo impianto di raffinazione del riso UASB Fango secondario acclimatato a
glucosio 55°C 5.5 2.14 9.33 3.81
FORSU Batch Fango di depurazione pretrattato a 100°C per 15 minuti 37°C 5.5 0.86
Refluo di uno zuccherificio Batch Fango attivo aerato 60°C 6.8 2.59 4.91
Saccarosio (20 g COD/l) UASB Fango secondario pretrattato a 100°C per 45 minuti 35 °C 6.7-
6.9
3 1.33 6.72
Saccarosio (20 g COD/l) Reattore a letto fisso
Fango di depurazione pretrattato con HCl 0.1 N per 24 h 35°C 6.7
2.32 (bioreattore ad argilla espansa)
2.07 (bioreattore a carboni attivi)
31.68 (bioreattore a carboni
attivi) Glucosio CSTR Farina integrale di soia 35°C 6 0.85 2.08
Glucosio CSTR
con spargimento di N2
Farina integrale di soia 35°C 6 1.43 4.5
Glucosio CSTR Fango di depurazione 35°C 5 1.3 1.01

Capitolo 4 – Definizione del programma sperimentale
138
In particolare si possono osservare elevati livelli di produzione di H2 (6.72 lH2/(l⋅d)) con i
reattori UASB e reattori a letto fisso (31.68 lH2/(l⋅d)) alimentati entrambi con fanghi di
depurazione. Tali tipologie di reattore rappresentano pertanto un sistema di produzione di
bioidrogeno molto promettente soprattutto per l’impiego di substrati ad alto carico organico.
Infatti, in molti studi effettuati sull’utilizzo di reattori CSTR per la produzione di bioidrogeno
da reflui organici, si è evidenziata l’incapacità di tali reattori di mantenere alti livelli di
biomassa produttrice di idrogeno e di garantire elevati tassi specifici di produzione.
4.4.3 Vantaggi e prospettive future della dark fermentation Pur avendo rese più modeste, l’evoluzione di idrogeno da fermentazione al buio presenta
notevoli vantaggi potenziali rispetto a quella fotobiologica per la produzione industriale:
• gli investimenti sono prevedibilmente più contenuti;
• l’H2 può essere prodotto da substrati organici a basso costo;
• la produzione di idrogeno è svincolata dalla presenza della luce;
In conclusione nonostante le rese della “dark fermentation” non siano le più elevate questa via
di produzione del bioidrogeno sembra offrire la massima potenzialità nel ricorrere all’uso di
sostanze di scarto come materia prima e di minimizzare i costi di investimento per la
realizzazione degli impianti.
Vantaggi sostanziali possono essere ottenuti attraverso la rimozione rapida e la separazione
del gas, il design del bioreattore ed eventualmente via modifica genetica dei microrganismi.
Miglioramenti nelle tecniche di separazione del gas possono contribuire ad incrementare la
produzione di H2, essendo la sua pressione parziale, come già detto, estremamente importante
per la sua produzione in continuo (come la concentrazione di idrogeno aumenta, infatti, la
resa diminuisce e l’attività metabolica vira verso pathway che sintetizzano più substrati
ridotti). Anche la concentrazione di CO2 influenza le rese di H2; le cellule infatti sintetizzano
succinato e formiato usando CO2, piruvato e NADH (nicotinamide adenin dinucleotide).
Questo pathway comprende la reazione in cui l’H2 è sintetizzato dall’idrogenasi dipendente da
NADH (che ossida NADH a NAD+). Un’efficiente rimozione di CO2 diminuirebbe la
competizione per l’NADH favorendo la sintesi di idrogeno.
Infine modifiche genetiche dei ceppi potrebbero essere mirate ad eliminare le idrogenasi che
consumano H2 .

Capitolo 4 – Definizione del programma sperimentale
139
4.5 I meccanismi e le rese della metanogenesi
I batteri metanigeni rappresentano un gruppo specifico di microrganismi che costituiscono
l’anello finale della catena trofica di degradazione anaerobica della sostanza organica; essi
sono in grado di convertire solo un ristretto gruppo di substrati (acetati, formiati, miscele di
idrogeno e anidride carbonica) in metano. I principali generi conosciuti sono: Methanococcus,
Methanosarcina, Methanobacterium, Methanobacillus, Methanospirillium.
Questi batteri sono presenti nel rumine dei bovini, nelle concimaie, sul fondo delle paludi,
ecc. Dal punto di vista nutrizionale sono chemiolitoeterotrofi, cioè ricavano l'energia
necessaria per il loro metabolismo degradando sostanze chimiche (chemiotrofi) e possono
utilizzare, per costruire le proprie strutture carboniose, sia la CO2, sia molecole organiche
(litoeterotrofi), infine sono anaerobi obbligati, cioè la presenza dell'ossigeno elementare per
loro è tossica e la loro crescita è totalmente inibita anche solo da tracce di O2.
Esamineremo ora in particolare la respirazione anaerobica compiuta dai metano batteri.
Questi utilizzano come molecola ossidante inorganica l'anidride carbonica (CO2) che viene
ridotta a metano (CH4), come molecole riducenti utilizzano H2, etanolo, acido formico. La
biochimica della metanogenesi è abbastanza complessa e non è stata ancora del tutto chiarita
anche se studi compiuti negli ultimi anni hanno permesso di comprenderne i tratti principali.
In particolare si è chiarito che i metanobatteri:
a) non hanno la glicolisi, dato che non possono degradare il glucosio
b) non hanno il ciclo di Krebs, dato che non degradano l'acido acetico a CO2
c) non hanno la catena respiratoria e la fosforilazione ossidativa, dato che non possiedono nè
il coenzima Q nè i citocromi;
d) sono molto ricchi, invece, di vitamina B12 e di acido folico.
Da tutto questo si deduce che il metabolismo degradativo o catabolismo dei metanobatteri è
del tutto diverso da quello proprio degli organismi aerobi. Studi compiuti utilizzando
molecole marcate con carbonio radioattivo 14C hanno dimostrato che le reazioni principali
sono quelle riportate nella Figura 4.14.
Lo schema riassuntivo per le reazioni compiute dai metanobatteri è dunque quello
rappresentato in Figura 4.15.

Capitolo 4 – Definizione del programma sperimentale
140
Figura 4.14 Reazioni principali del catabolismo dei metanobatteri.
Figura 4.15 Schema riassuntivo del catabolismo dei metanobatteri.
Questa è la sola reazione dalla quale i metanobatteri ricavano l’energia che usano per il loro
metabolismo, ma per ogni molecola di CO2 ridotta a metano si ha la produzione di una sola
molecola di ATP. Una quantità così bassa di energia consente ai metanobatteri una crescita
molto lenta, quindi il tempo necessario perchè la loro popolazione raddoppi è di alcuni giorni,
mentre per i batteri aerobi è di alcune ore.
La CO2 è l'accettore finale di elettroni nella respirazione anaerobica dei metanobatteri. La sua
riduzione a metano permette di smaltire tutto il NADH, cioè tutti gli equivalenti riducenti che
si sono accumulati nel digestore anaerobico per l'ossidazione delle molecole organiche.
Queste ossidazioni sono operate non solo dai metanobatteri, ma anche dai batteri idrolitici e
da quelli acetogenici che hanno trasferito i loro equivalenti riducenti fino ai metanobatteri
sotto forma di etanolo, H2 e acido formico. Il fatto che per ridurre una molecola di CO2 a CH4
siano necessari ben 8 elettroni, cioè 4 NADH, fa sì che non tutta la CO2 generata possa venire
ridotta a CH4, per cui il biogas ottenuto contiene, in media, circa il 65% di metano, il 30% di
CO2 e il 5% di altri gas (H2, H2S, N2). La composizione del biogas è determinata dal tipo di
biomolecole che costituiscono il substrato.
Un parametro di fondamentale importanza ai fini dell’efficienza del processo è il tempo di
ritenzione, definito come il tempo di permanenza della massa organica nel digestore.

Capitolo 4 – Definizione del programma sperimentale
141
La produzione di gas aumenta con il tempo di ritenzione e presenta un andamento a campana:
inizialmente nulla, nel giro di pochi giorni raggiunge il massimo per poi diminuire più
lentamente (Figura 4.16) (Lagrange, 1981). Figura 4.16 Produzione di biogas in funzione del tempo di ritenzione.
Il tempo di ritenzione ottimale è funzione della temperatura all’interno del digestore e
diminuisce all’aumentare della stessa (Tabella 4.5). Tabella 4.5 Tempi di ritenzione in funzione della temperatura all’interno del digestore.
Temperatura (°C) Tempo (giorni) min max
20
25
30
35
40
11
8
6
4
4
28
20
14
10
10
Si deve distinguere un tempo di ritenzione dei solidi (SRT), tempo durante il quale i
microrganismi permangono nella massa in fermentazione, che può essere calcolato dal
rapporto tra la massa di solidi volatili presenti nel sistema e la massa dei solidi volatili
effluenti giornalmente, e un tempo di ritenzione idraulico (HRT), tempo di permanenza
dell’intera massa, calcolato come rapporto tra il volume del digestore e la portata quotidiana
media di influente. Ovviamente SRT e HRT coincidono in digestori nei quali non c’è
ricircolo.

Capitolo 4 – Definizione del programma sperimentale
142
Il tempo di ritenzione, calcolato sperimentalmente in funzione della temperatura nel digestore,
condiziona il volume del digestore, influenzando così anche i costi di produzione (Simonini,
1990; Scarpini, 1980).
L’efficacia del processo di digestione anaerobica dipende anche dal carico organico della
sostanza sottoposta a fermentazione, espresso sia in COD che in percentuale di solidi volatili
presenti nella massa. Infatti i batteri metanogeni non si sviluppano in maniera adeguata al di
sotto di una certa concentrazione nel substrato. In genere la soglia viene definita (per ogni
specie batterica e per un determinato valore di pH) in riferimento all’acido acetico
indissociato che costituisce l’effettivo substrato per i batteri metanogeni (Mergaert et al.,
1991).
La produzione di gas dipende principalmente dalla percentuale di solidi volatili presenti nel
sistema (cioè dalla concentrazione della massa) e da quanto gas (in particolare metano) è
possibile estrarre per ogni chilogrammo di sostanza organica decomponibile (Lagrange, 1981;
Simonini, 1990).
Occorre inoltre considerare un fattore cinetico, legato alla velocità di crescita dei
microrganismi ed alla temperatura di digestione, in quanto la velocità di degradazione
aumenta proporzionalmente alla concentrazione dei reagenti (Rozzi et al., 1988).
Perchè la reazione di metanizzazione avvenga correttamente è necessario che il pH si
mantenga entro determinati limiti. In un ambiente acido l’attività dei batteri è bloccata, mentre
in un ambiente alcalino si ha una eccessiva produzione di idrogeno (H2) ed idrogeno solforato
(H2S). Si ha allora che il pH deve essere compreso da un minimo di 6.6 ÷ 7.6 ad un massimo
di 7.5 ÷ 8.5.
Normalmente la diminuzione del pH per effetto della produzione di acidi organici è
controbilanciata dalla distruzione degli stessi durante lo stadio successivo (simbiosi batterica
tra i batteri acidogeni e i batteri metanigeni). Ma già per valori di pH = 6.2 le condizioni sono
tossiche per i batteri metanigeni ed il tutto è aggravato dal fatto che i batteri acidogeni
possono ancora produrre acidi fino a pH = 4.5 ÷ 5.
In queste condizioni la produzione dei batteri acidogeni è più veloce di quella dei metanigeni,
per cui aumenta la concentrazione degli acidi che la capacità tamponante del sistema non
riesce più a bilanciare, facendo ulteriormente diminuire il pH.
L’inibizione dei batteri metanigeni comporta una riduzione, anche drastica, della produzione
di gas. La produttività del sistema può quindi essere controllata monitorando il pH cioè la
quantità di acidi organici presenti nel sistema stesso.

Capitolo 4 – Definizione del programma sperimentale
143
Il pH della massa in fermentazione dipende dalla concentrazione degli ioni bicarbonato a sua
volta funzione della concentrazione del biossido di carbonio; infatti la concentrazione dello
ione bicarbonato è approssimativamente equivalente all’acidità della maggior parte dei rifiuti
(Lagrange, 1981).
Risulta pertanto:
[ ] [ ]332 HCO/COHKpH −= (4.9)
in cui K è la costante di ionizzazione dell’acido carbonico.
Quando la concentrazione degli acidi aumenta, essi sono neutralizzati dal bicarbonato che ha
pertanto un effetto tampone. Se però la concentrazione degli acidi è notevole si ha che il
bicarbonato presente non è in grado di mantenere l’equilibrio. Con il procedere della
fermentazione si verifica però la produzione di ammoniaca (NH3) che, essendo solubile in
acqua, forma l’idrato d’ammonio (NH4OH) che, essendo una base, neutralizza gli acidi
presenti; l’eccesso di acido viene allora riassorbito con il procedere della fermentazione.
Affinché il processo di fermentazione avvenga correttamente è necessario che all’interno del
digestore siano presenti gli elementi necessari al nutrimento dei batteri, in particolare
carbonio, azoto, fosforo e zolfo.
La presenza di carbonio è garantita dal fatto che è l’elemento principale delle sostanze
organiche che costituiscono il substrato.
L’azoto è indispensabile per la produzione delle proteine; se non ve ne è in sufficienza i
batteri non potranno utilizzare tutto il carbonio e la resa in metano sarà bassa. Il rapporto tra le
concentrazioni di carbonio ed azoto, indicato con C/N, non deve mai superare il valore di 35,
con un ottimo di 30.
Per la crescita dei batteri sono indispensabili anche il fosforo e, in misura molto ridotta, lo
zolfo; tuttavia, mentre un eccesso di fosforo non genera problemi, un eccesso di zolfo è
nocivo perché porta alla produzione di idrogeno solforato (H2S). Il rapporto ottimale tra le
concentrazioni di carbonio e fosforo (C/P) è di 150, quello tra carbonio e zolfo dovrà essere
molto più elevato.
Gli ioni minerali (Na+, K+, Ca2+, Mg2
+, NH4+, S2
-) sono indispensabili per la costruzione della
membrana delle cellule e devono essere presenti nella massa organica.
Un loro eccesso è però dannoso: infatti, per la loro proprietà di passare da una soluzione più
concentrata ad una meno concentrata, essi tendono ad attraversare la membrana delle cellule
arrestando, a causa della loro tossicità, l’attività dei batteri.
Valori di concentrazione degli ioni minerali stimolanti e dannose per il processo di
bioconversione sono riportati nella Tabella 4.6.

Capitolo 4 – Definizione del programma sperimentale
144
Tabella 4.6 Concentrazioni ammesse o tossiche di alcuni ioni. Concentrazione (mg/l)
Ioni stimolante inibente
debolmente fortemente
Sodio Na+ 100-200 3500-5500 8000
Potassio K+ 200-400 2500-4500 12000
Calcio Ca++ 100-200 2500-4500 8000
Magnesio Mg++ 75-150 1000-1500 3000
Ammonio NH4+ 50-200 1500-2000 3000 tossico
Zolfo S-- - <200 200
Anche gli ioni dei metalli pesanti (Cu2+, Ni2+, Cr6+, Zn2+, Pb2+) sono necessari al metabolismo
delle cellule, ma un loro eccesso oltre 1 mg/l risulta dannoso.
Tra gli elementi tossici bisogna annoverare i composti chimici di sintesi. Tra questi bisogna
prestare attenzione ai detergenti che in concentrazioni superiori a 15 mg/l possono bloccare la
fermentazione.
Come già accennato in precedenza, il substrato stesso può costituire un fattore di inibizione in
quanto la sua concentrazione può regolare e/o rallentare la velocità di reazione degli stadi
successivi.
Anche alcuni intermedi metabolici che si formano durante il processo di digestione
anaerobica possono limitare lo sviluppo degli stadi successivi, portando, quindi, ad un effetto
globale negativo. Ad esempio, il propionato è un intermedio quantitativamente importante nei
digestori anaerobici, in genere secondo solo all’acido acetico. Sebbene la concentrazione di
propionato sia di solito abbastanza bassa, il suo turnover è piuttosto elevato (circa 1 ora):
l’inibizione del meccanismo di degradazione del propionato, pertanto, può portare ad un
repentino aumento della sua concentrazione che può risultare tossica (Boone & Xun, 1987). Il
limite di tossicità per il propionato sembra attestarsi intorno a 3 g/l (Gourdon & Vermande,
1987). La degradazione del propionato è influenzata anche dall’idrogeno che, a sua volta, può
inibire la degradazione microbica dell’etanolo e, reversibilmente, la crescita di molti batteri
anaerobici (Kaspar & Wuhrmann, 1978).
Più in generale, è stato riportato in letteratura come alte concentrazioni di acidi grassi volatili
(VFA) possano avere effetti tossici, principalmente a causa della risultante diminuzione del
pH. Tra i composti che possono in qualche modo inibire il normale decorso del processo di
metanizzazione si possono annoverare l’acido solfidrico, l’azoto ammoniacale, la salinità, il
cloroformio ed altri clorurati, i disinfettanti quali formaldeide e fenoli, oltre a varie specie
metalliche.

Capitolo 4 – Definizione del programma sperimentale
145
La formazione di acido solfidrico nei reattori anaerobici è il risultato della riduzione dei
composti ossidati dello zolfo e della dissimilazione degli aminoacidi a base di zolfo (es.
cisteina). I batteri metanigeni possono tollerare concentrazioni di acido solfidrico fino a 1000
mg/kgTS anche se l’effettiva capacità di produrre metano è seriamente compromessa anche a
200 mg/kgTS. La letteratura suggerisce che i solfato-riduttori competano con i metanigeni per
il substrato e che, quindi, un’elevata concentrazione di zolfo ridotto sia un allarme di
sbilanciamento del sistema. In generale le condizioni ottimali per i batteri metanigeni si hanno
per concentrazioni di solfuri tra 8 e 22 mg/kgTS (Hilton & Oleszkiewicz, 1988).
Secondo quanto suggerito da van Velsen (1979) concentrazioni tra 200 e 1500 mg/l di
ammoniaca non dovrebbero avere effetti avversi sulla formazione di metano mentre,
superando i 1500 mg/l, il comportamento del sistema può essere differente a seconda della
capacità di adattamento della biomassa; in generale è stato osservato che concentrazioni di
azoto ammoniacale tra 1500 e 3000 mg/l sono inibenti a pH inferiore a 7.4 mentre
concentrazioni superiori a 3000 mg/l risultano tossiche a qualsiasi valore di pH.
L’instaurarsi di un ambiente di reazione ad elevata salinità può influenzare negativamente il
processo di digestione anaerobica. In letteratura è stata constatata una diminuzione della
velocità di crescita dei batteri metanigeni fino al 50% nel caso di concentrazioni di NaCl da
250 a 500 mM, identificando con quest’ultimo il limite di tollerabilità (Cecchi & Pavan,
1993). L’eccessiva salinità può portare ad un progressivo squilibrio del processo con
accumulo di acidi grassi volatili e blocco parziale ed, eventualmente, totale della
metanogenesi.
Nel caso di batteri metanigeni esposti ad una concentrazione di 2.5 mg/l di cloroformio si è
osservata la completa ripresa della produzione di metano dopo circa due settimane; è
interessante notare, inoltre, che la ripetizione dell’esposizione non ha mostrato nessun effetto
di inibizione dimostrandola capacità di risposta del consorzio batterico allo stimolo negativo
(Speece, 1983).
In alcuni casi la variazione di concentrazione di una sostanza tossica può renderla
biodegradabile: è il caso della formaldeide e del fenolo (utilizzati come disinfettanti) che al di
sotto di 400 e 2000 mg/l rispettivamente vengono velocemente convertire a metano per via
anaerobica.
In generale la tossicità degli ioni metallici è dovuta al fatto che essi inattivano un grande
numero di enzimi interagendo con i loro gruppi sulfidrilici; inoltre la correlazione tra la
presenza di zolfo e la presenza di metalli pesanti è direttamente in relazione con il prodotto di

Capitolo 4 – Definizione del programma sperimentale
146
solubilità dei rispettivi solfuri: ciò indica che la quantità di zolfo in soluzione influenza in
maniera più o meno sensibile l’effetto tossico degli ioni in soluzione.
Studi eseguiti su digestori anaerobici di RU indicano che vi è una sensibile riduzione di acidi
grassi volatili (da 4000 a 400 mg/l) allorché la concentrazione di ferro viene aumentata
all’interno del digestore stesso. Simili effetti di riduzione della resa in metano possono essere
attribuiti anche ad altri metalli quali zinco (limite tossicità = 160 mg/l), rame (limite tossicità
= 170 mg/l), cromo e cadmio (limite tossicità = 180 mg/l).
Obiettivo fondamentale di qualsiasi strategia di controllo di processo è il mantenimento di
condizioni operative ottimali e stabili.
Nel caso specifico della digestione anaerobica questo concetto diviene particolarmente
significativo dal momento che la fase controllante l’intero processo, cioè la metanogenesi,
risulta particolarmente sensibile alle variazioni ambientali del mezzo di reazione.
Di particolare importanza risultano parametri quali il pH, la concentrazione di acidi grassi
volatili, l’alcalinità, il rapporto tra acidi grassi volatili ed alcalinità, la produzione e
composizione percentuale del biogas, la temperatura .
Occorre comunque rilevare che l’analisi di questi parametri deve essere globale: la variazione
di un singolo parametro, se non accompagnata da un monitoraggio complessivo di tutti gli
altri parametri, risulta difficilmente interpretabile.
Il monitoraggio della quantità e della composizione (almeno in termini di metano e biossido
di carbonio) del biogas è di fondamentale importanza per il controllo della stabilità del
processo di digestione anaerobica (Stafford et al., 1980).
Se il reattore sta operando in condizioni di regime stazionario la produzione e la
composizione del biogas risultano costanti.
Una diminuzione nella produzione complessiva di biogas ed un aumento nella percentuale di
CO2 possono indicare fenomeni di inibizione a danno della componente metanigena dovuti,
ad esempio, all’eccessiva presenza di acidi grassi volatili ed inibizione del processo. Ne
consegue che l’analisi della produzione e della composizione percentuale del biogas dovrebbe
sempre essere associata al controllo di parametri quali la concentrazione degli acidi grassi
volatili e l’alcalinità del mezzo.
Si potrà osservare che in presenza di eccessivi carichi di substrato la percentuale di CO2 tende
a crescere, a scapito della presenza di metano. Tutto ciò in stretta relazione con le variazioni
di concentrazione degli acidi grassi volatili nel mezzo. In particolare si potranno osservare tre
diverse situazioni (IRSA-CNR, 1985):

Capitolo 4 – Definizione del programma sperimentale
147
1. una bassa concentrazione di VFA, unitamente ad una elevata produzione di biogas, in
cui la CO2 si attesti su valori bassi compresi tra il 25-33%, indica che il processo è
stabile e si ha una buona capacità di trasferimento dai batteri acidificanti a quelli
metanigeni;
2. concentrazioni crescenti nel tempo dei VFA, unite ad una produzione di biogas in cui
la presenza relativa della CO2 cresca nel tempo (valori superiori ai 2/3 del biogas
prodotto) indicano che le popolazioni acidificanti stanno prendendo il sopravvento sui
batteri metanigeni e si ha quindi un progressivo accumulo di VFA nel mezzo di
reazione;
3. concentrazioni crescenti di VFA unite a produzioni di biogas progressivamente
decrescenti possono indicare problemi di inibizione o tossicità.
Alcuni autori suggeriscono il monitoraggio dell’idrogeno nel gas ma, data la sua bassa
concentrazione, è una procedura poco utilizzata a livello industriale mentre è maggiormente
diffusa nell’ambito della ricerca scientifica.
Il pH fornisce un’indicazione della stabilità del mezzo di reazione, in quanto una sua
variazione è associata sia alla capacità tamponante del sistema da parte del mezzo di reazione
che a variazioni dell’equilibrio tra le specie che partecipano alla catena trofica dei
microrganismi coinvolti nel processo.
Per valori di pH compresi tra 6.5 e 7.5 il processo di digestione è generalmente considerato
stabile. Il valore del pH in un digestore è determinato essenzialmente dalla presenza di CO2
nel mezzo liquido, e quindi dalla sua pressione parziale nel biogas e dai valori di
concentrazioni degli acidi grassi volatili e dell’ammoniaca. Occorre rilevare che questo
parametro è in grado di indicare condizioni di squilibrio del sistema, ma solo con un certo
ritardo rispetto all’evoluzione dell’effetto tampone del mezzo.
Infatti la variazione di pH appare evidente quando ormai il bicarbonato ha terminato la sua
attività tamponante.
Problemi possono sorgere anche nel caso di innalzamenti eccessivi del pH nel reattore: in
queste condizioni infatti l’equilibrio tra l’ammoniaca e la sua specie protonata, l’ammonio, si
sposta a favore della prima
L’alcalinità rappresenta la capacità di un sistema di neutralizzare protoni ed è generalmente
espressa in termini di concentrazione di carbonato di calcio. Questa viene determinata,
analiticamente, sulla fase liquida presente nel reattore, per titolazione con acido cloridrico.
Valori di alcalinità dell’ordine di 3000-5000 mg CaCO3 per litro sono tipici per i digestori
anaerobici operanti in condizioni stabili.

Capitolo 4 – Definizione del programma sperimentale
148
Durante la titolazione, dapprima fino a pH 6, si satura il sistema tampone imputabile alla
presenza del bicarbonato del sistema e successivamente, proseguendo la titolazione sino a pH
4, vengono titolate tutte le rimanenti basi coniugate, quali gli acidi grassi volatili ed altri
anioni (fosfati, solfuri, silicati ecc.).
La differenza tra le alcalinità determinate a pH 6 e a pH 4 fornisce quindi, in prima
approssimazione, la concentrazione di acidi grassi volatili presenti nel mezzo (IRSA-CNR,
1985). Questo parametro è di fondamentale importanza nei processi anaerobici. Tenendo
infatti presente che i tassi di crescita della biomassa metanigena sono estremamente ridotti
può capitare che, in occasione di un incremento del carico organico, le aumentate capacità
idrolitiche ed acidificanti del sistema determinino uno sbilanciamento della popolazione
batterica a favore della componente acidogenica e, quindi, a sfavore della componente
metanigena. Si avrà, pertanto, una fase transitoria in cui si osserverà un incremento di
concentrazione degli acidi grassi volatili. In questi casi risulta fondamentale la capacità
tamponante del sistema, che deve essere in grado di neutralizzare l’abbassamento di pH
determinato dall’accumulo degli acidi organici.
L’alcalinità di un digestore anaerobico è determinata essenzialmente dalla presenza di un
sistema tampone dovuto alla coesistenza di ammoniaca, originata dalla degradazione di
proteine, e di bicarbonato, derivante dalla dissoluzione del biossido di carbonio nel mezzo.
L’interazione del biossido di carbonio con la fase liquida e la conseguente formazione del
sistema tampone determinato dalla contemporanea presenza di acido carbonico ed ammonio
prende il nome di sistema calco-acetico.
Si ha, in generale, la formazione di NH4HCO3:
HHCOOHCO 322+− +→+ (4.10)
3443 HCONHNaHCO →+ +− (4.11)
La presenza di questo sale disciolto in soluzione porta ad una elevata alcalinità del mezzo con
conseguente controllo del processo anche nel caso di un accumulo di acidi grassi volatili. Gli
acidi grassi volatili vengono rappresentati dalla formula generale R-COOH dove R è un
gruppo alchilico del tipo CH3(CH2)n.
In generale i batteri idrolitici ed acidificanti producono, nel corso del processo di digestione
anaerobica, acidi grassi volatili in cui R contiene tra 0 e 3 atomi di carbonio (acidi grassi a
catena corta).
Il livello di concentrazione degli acidi volatili, generalmente espresso in termini di acido
acetico o di COD, dipende dal tipo di substrato trattato, e varia da circa 200 fino a 2000 mg/l
come acido acetico.

Capitolo 4 – Definizione del programma sperimentale
149
Di norma non è la concentrazione assoluta ad essere assunta come parametro di stabilità ma
piuttosto la variazione di concentrazione: variazioni repentine con incremento della
concentrazione indicano che il processo sta scivolando verso processi acidogenici piuttosto
che metanigenici.
In generale si può osservare che un incremento degli acidi volatili è conseguente ad un
aumento di carico di substrato da trattare che determina l’accelerazione dei fenomeni idrolitici
ed acidogenici con conseguente sbilanciamento della catena trofica e variazione del sistema
verso condizioni di basso pH a seguito dell’esaurimento della capacità tamponante del mezzo.
Il valore di concentrazione degli acidi grassi volatili non va disgiunto dal dato della
produzione del biogas e dalla sua composizione, oltre che dai dati relativi a pH ed alcalinità.
La concentrazione degli acidi grassi volatili e l’alcalinità sono i due parametri che mostrano
una più rapida variazione quando il sistema tende ad allontanarsi da condizioni di stabilità.
Dal momento che, in caso di problemi, la concentrazione degli acidi grassi tende ad
aumentare mentre l’alcalinità tende a diminuire, un utile parametro da considerare è il
rapporto tra queste due grandezze. Valori del rapporto intorno a 0.3 indicano una operatività
stabile del digestore, mentre valori superiori possono indicare l’insorgere di problemi di
stabilità.
Dato che i processi di degradazione anaerobica sono determinati dall’attività di popolazioni
microbiche eterogenee l’effetto delle variazioni di temperatura è particolarmente importante.
Ciò è imputabile al fatto che, al variare della temperatura, non si avrà un semplice
rallentamento o accelerazione dei processi metabolici ma la vera e propria sostituzione di
popolazioni batteriche, che risultano presenti solo in alcuni ristretti intervalli di temperatura.
Variazioni di soli 2-3°C possono influire sulle prestazioni generali del processo, specialmente
in prossimità dei limiti dell’intervallo operativo. Ne deriva la necessità di controllare con
particolare accuratezza i sistemi di controllo per il funzionamento dei dispositivi di
riscaldamento. E’ stato riscontrato che i processi di digestione anaerobica in regime mesofilo
mostrano le migliori produzioni di biogas in intervalli di temperatura compresi tra i 30 ed i
35°C, mentre nel caso di processi termofili l’intervallo si allarga e varia tra i 40 ed i 60°C. In
generale si può osservare che, all’interno dell’intervallo ottimale, la produzione di biogas e la
rimozione di substrato incrementano al crescere della temperatura.
Un tipico esempio di degradazione anaerobica di un substrato organico puro è rappresentato
dalla digestione anaerobica del glucosio. In questo caso si ha un primo passaggio in cui il
glucosio viene convertito ad acido acetico ed un successivo in cui l’acido acetico viene
ulteriormente degradato a metano e biossido di carbonio:

Capitolo 4 – Definizione del programma sperimentale
150
COOH3CHOHC 36126 → (4.12)
243 COCHCOOHCH +→ (4.13)
La reazione globale è:
246126 3CO 3CHOHC +→ (4.14)
Nel caso di proteine, come ad esempio la cisteina, si avrà:
COOHCHSHNH6CO4CHOHNSOH4C 323242273 ++++→+ (4.15)
Mentre l’equazione complessiva di degradazione di un acido grasso è data da:
242zyx z/4)COy/8-(x/2z/4)CH-y/8(x/2OH)2/4/(OHC +++→−−+ zyx (4.16)
Per quanto concerne invece la formazione del metano si hanno due possibili meccanismi
alternativi. In un caso il CH4 si forma in seguito alla riduzione del carbonio della CO2 secondo
la seguente reazione complessiva:
O2HCH4HCO 2422 +→+ (4.17)
Nell’altro meccanismo si ha formazione di metano a spese del gruppo metilico presente in
substrati organici a basso peso molecolare (acido acetico) attraverso una reazione di
transmetilazione:
233 CO2HCHRHRCOOHCH ++−→−+ (4.18)
HRCH2HCHR 43 −+→+− (4.19)
Globalmente:
243 COCHCOOHCH +→ (4.20)
Nella Tabella 4.7 è rappresentata la quantità di biogas ottenibile dai vari costituenti dei rifiuti
lignocellulosici: Tabella 4.7 Rendimenti in biogas di carboidrati, proteine, grassi.
CH4 (l/kg)
CH4 (%)
Carboidrati 790 50
Proteine 705 71
Grassi 1250 68
A temperatura e pressione standard, 0°C e 1 atm, ad ogni Kg di COD corrispondono 0.35 m3
di metano.