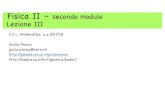
Unità SI usate in elettrochimica Ampère A = quantità di corrente che deposita 0,00118 g di Ag per...
-
Upload
sabino-roberti -
Category
Documents
-
view
215 -
download
1
Transcript of Unità SI usate in elettrochimica Ampère A = quantità di corrente che deposita 0,00118 g di Ag per...

Unità SI usate in elettrochimica
C
J
A
mNewtonVddpvolt
sec
Ampère A = quantità di corrente che deposita 0,00118 g di Ag per secondoCoulomb C = A.s = carica elettrica
AVs
mNJouleWpotenzawatt
sec
Faraday = carica di una mole di elettroni = FF = N(Avogadro) . q(elettrone) = 6,023 .1023 (molecole.mol-1) . 1,6023.1019C (carica e-) = 96500 C.mol-1

)(96500
)()(1
eqC
stAI
PE
g
Pesi equivalenti
• Ag+ + e- Ag PE = PA = 107,8
• Cu++ + 2e- Cu PE = PA/2 = 63,5/2 = 31,7
• Fe+++ + 3e- Fe PE = PA/3 = 55,8/3 = 18,6
• Fe+++ + e- Fe2+ PE = PA = 55,8
• 2Cl- Cl2 + 2e- PE = PM/2 = 71/2 = 35,5

Una corrente che deposita 2,185 g di Ag, deposita anche 1,314 g di Au, quale è il PE di Au e quale il suo numero di ossidazione ?
)(020,0)(8,107
185,21
eqAgeqg
g
PE
g
38,64
197
Au
Au
PE
PA
Au+++ + 3e- Au
)(8,64020,0
314,1 1 Aueqgeq
g

Chromium plating is applied by electrolysis to objects suspended in a dichromate solution, according to the following half- reaction:
Cr2O72-(aq) + 12e- + 14H+(aq) -> 2Cr(s) + 7H2O(l)
How many hours would it take to apply a chromium plating of thickness 2.0 x 10-2 mm to a car bumper of surface area 0.25 m2 in an electrolysis cell carrying a current of 75.0A? [The density of chromium is 7.19 g/cm3] 2.2 h 1.5 h 3.0 h 0.25 h 2.5 h
gcmgcmmmm 9,3519,75;1050,025,0102333525
)(50,1sec3600
(sec)5329;
96500
(sec)0,75
6
529,35
96500
(sec))(1
hh
ttAtAi
PE
g

Calcolare il volume di cloro gassoso misurato a 25°C e 1,2 atmosfere ed i grammi di sodio metallico ottenibili elettrolizzando NaCl fuso, per 8 ore con una corrente di 15 A.
litriP
nRTVCl 6,45
2,1
298082,0238,22
gNaeqgeq 81,1022347,4 1
Catodo(-) Na+ + e- Na
Anodo(+) Cl- 1/2Cl2 + e-
eq47,496500
3600815
)(96500
)()(1
eqC
stAI
PE
g
nCl2 = ½ eq Cl2

Calcolare i KWh teorici necessari per preparare 1 Kg di alluminio con una ddp di 4,5 volt.
)(96500
)()(1
eqC
stAI
PE
g
)(96500
)()(
9
100011
eqC
stAI
eqg
g
Ahhs
sA4,2978
3600
22207211
AstI 2220721
hWvolthA 7,402135,44,2978
KgAl
KWh402,13
Al+++ + 3 e- → Al ; PEAl = 27/3 = 9

Calcolare il volume di cloro gassoso, misurato a c.n. ed i g di Mg, si producono per elettrolisi del MgCl2 fuso, con una corrente di 10000 A per 24 ore.
Mg++ + 2e- → Mg ; 2Cl- → Cl2 + 2e-
eqeqC
sA
eqC
stAI
PE
g8953
96500
8640010000
)(96500
)()(11
)(1002732
41,228953
)(1087832
31,248953
21
1
1
ClLmoleq
molleq
Mggeqgeq

Calcolare il pH di una soluzione acquosa di NaCl, del volume di 50 cc elettrolizzata per 16,6 minuti con una corrente di 0,0965 A.
(anodo) 2Cl- Cl2 + 2e- ; (catodo) 2H2O + 2e- H2 + 2OH-
)(001,096500
9960965,0
)(96500
)()(11
OHeq
eqC
sA
eqC
stAI
PE
g
3,127,11414
7,102,0log
)(02,0)(050,0
)(001,0 1
pOHpH
pOH
lmoll
molOH

Una soluzione 0,1M di CuSO4 a pH=1 viene elettrolizzata fra elettrodi inerti. Calcolare ilpotenziale di decomposizione della reazione.
Reazione anodica:
3H2O ½O2 +2 H3O+ + 2e-
17,1)10log(2
059,023,1 21
anodoE
Reazione catodica:Cu++ + 2e- Cu
31,010log2
059,034,0 1
catodoE
VE 86,031,017,1

Una soluzione 0,1M di AgNO3 a pH=3 viene elettrolizzata con una ddp di 0,60 V. Dire sesi ha deposito di Ag al catodo.
Reazione anodica:
3H2O ½O2 +2 H3O+ + 2e-
05,1)10log(2
059,023,1 23
anodoE
Reazione catodica:Ag+ + e- Ag
74,010log059,080,0 1 catodoE
VE 31,074,005,1

Una soluzione acquosa di Na2SO4 viene elettrolizzata per 50’ con una ddp di 2 volt, siottengono complessivamente 4,8 litri di gas a c.n.. Calcolare l’intensità di corrente e l’energia consumata in Wh.
Reazione anodica:
3H2O ½O2 +2 H3O+ + 2e-
litriVH 2,38,43
22
Reazione catodica:2H2O + 2e- H2 + 2OH-
litriVO 6,18,43
12
eqeql
idrogenol28,0
2,11
)(2,31
WhhVA
Ai
Ceq
Ai
Ceq
tAieq
PE
g
1583,029
9
96500
)min(sec60(min)50)(28,0
96500
(sec))(
1
1
1