RADIOATTIVITÀ E RADIAZIONI IONIZZANTI - uniroma2.ite0_e... · h = costante di Plank . ... Esistono...
-
Upload
trinhquynh -
Category
Documents
-
view
223 -
download
0
Transcript of RADIOATTIVITÀ E RADIAZIONI IONIZZANTI - uniroma2.ite0_e... · h = costante di Plank . ... Esistono...
PRIMA PARTE - CONCETTI INTRODUTTIVI
Onde elettromagnetiche
Dualismo onda-particella
I fotoni
Struttura dell’atomo
2
ONDE ELETTROMAGNETICHE
Sperimentalmente si riscontra che il campo elettromagnetico si propaga sotto forma di
onde che viaggiano senza necessità di supporto materiale.
Nel vuoto la velocità di propagazione delle onde elettromagnetiche è una costante ed è
indipendente dalla frequenza
c = 299.792.458 m/s
Le onde elettromagnetiche sono una modificazione dello spazio in cui è presente un
campo elettrico e magnetico
Le onde elettromagnetiche trasportano energia
Definiamo intensità di un onda l’energia l’energia che all’istante t fluisce attraverso una
superficie posta ortogonalmente alla direzione di propagazione dell’onda.
3
Lunghezza
d’onda l
Frequenza n
Nel vuoto
l = c/n
22, HEtrI
ONDE ELETTROMAGNETICHE
Onde radio, microonde, infrarossi, luce, raggi X e raggi gamma sono tutte onde
elettromagnetiche caratterizzate da frequenza diverse
4
Una grande varietà di fenomeni possono essere correttamente
interpretati ipotizzando che l’energia elettromagnetica (energia
associata ad un campo elettrico e magnetico variabili) si propaghi
nello spazio in forma di onde
Riflessione, rifrazione, fenomeni di interferenza, polarizzazione…
fenomeni macroscopici: la lunghezza d’onda è molto più grande degli
oggetti con cui interagisce
In altri casi, soprattutto quando si ha a che fare con fenomeni di
tipo microscopico (quelli che vogliamo affrontare oggi, in cui le
onde em interagiscono con strutture atomiche), è necessario
interpretare l’onda elettromagnetica come un insieme di particelle
5
EFFETTO FOTOELETTRICO
Fenomeno che si manifesta con l'emissione di particelle elettricamente cariche da parte di un corpo esposto a onde luminose o a radiazioni elettromagnetiche di varia frequenza
L’onda elettromagnetica colpisce gli elettroni del metallo trasferendo ad essi energia
Se l’onda em incide sull’anodo di un circuito, gli elettroni emessi per effetto fotoelettrico, e attratti dal catodo determinano un passaggio di corrente nel circuito
6
La teoria ondulatoria classica prevedeva però che, all'aumentare
dell'intensità (energia legata al campo elettrico e magnetico) della
luce incidente, aumentasse l'energia degli elettroni emessi
Sperimentalmente si osserva che
L’energia posseduta dai fotoelettroni non dipendeva dall’intensità
di illuminazione, ma unicamente dalla frequenza della radiazione
incidente.
L’intensità della radiazione, al contrario, determinava l’intensità
della corrente, ovvero il numero di elettroni strappati alla superficie
metallica.
L’effetto fotoelettrico non è spiegabile ammettendo la sola natura
ondulatoria delle luce
Gli elettroni vengono
acquistano energia
sufficiente a lasciare
il metallo solo dopo
una certa soglia
DOPPIA NATURA
CORPUSCOLARE/ONDULATORIA DELLA LUCE
Albert Einstein spiegò l'effetto fotoelettrico con
l'ipotesi che i raggi luminosi trasportassero particelle,
chiamate fotoni, o quanti di luce; pacchetti di
energia, la cui energia è direttamente proporzionale
alla frequenza dell’onda corrispondente.
Secondo la teoria formulata da Einstein, incidendo
sulla superficie di un corpo metallico, i fotoni cedono
in un “urto” l’energia agli elettroni liberi del
conduttore, provocandone l'emissione.
In questa ipotesi, l'energia dell'elettrone liberato
dipende solo dall'energia del fotone mentre
l’intensità della radiazione è direttamente correlata al
numero di fotoni trasportati dall’onda
Un aumento dell’intensità della radiazione
determina un aumento degli elettroni emessi e
quindi della corrente che circola nel cicuito
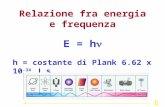
E = hv = h(1/l
I = N c hv
7
h = costante di Plank
STRUTTURA ATOMO
Esperimenti di Rutherford (1911) Materia è organizzata in atomi e il numero di atomi(o molecole in una mole di
sostanza è NA )
La carica è unitaria e non infinitamente divisibile
Il portatore di carica elementare (negativa) è l’elettrone me = 9.11x10-31 kg (~1/1840 mH ) e = 1,60x 10-19 C
8
STRUTTURA ATOMO
Particelle alfa (nuclei di elio)particelle massive (x8000 massa e-), cariche positivamente ed ad alto potere penetrante
Spessore lamina ~
10-6 m
• fissata un energia la maggior parte delle particelle alfa (proiettili )
vengono deviate ad angoli <1°
•1/8000 viene deflessa ad angoli maggiori di 90°
•Particelle vengono deflesse anche ad angoli intermedi
9
STRUTTA ATOMO
Gran parte del volume
atomico è costituito da spazio
vuoto o compatibilmente da
elettroni
Le deviazioni a bassa
probabilità a grandi angoli
sono compatibili con la
presenza di zone concentrate
ad alta densità
“impenetrabili” a carica
positiva10
STRUTTURA ATOMO (RUTHERFORD 1911)
L’atomo è costituito da un nucleo centrale e da una nuvola elettronica esterna
I nuclei, carichi positivamente, concentrano praticamente tutta la massa dell’atomo
Gli elettroni occupano la periferia dell’atomo in numero pari da eguagliare in modulo la carica nucleare in un atomo neutro
(Modello di Rutherford) Gli elettroni (carichi) orbitano attorno al nucleo per azione della forza di Coulumb come in un sistema gravitazionale F~qQ/r2
Particelle cariche su orbite
circolari perderebbero energia
in modo continuo sotto forma
di onde em11
STRUTTURA ATOMO (BHOR)
Atomi sono stabili
Gas se riscaldati emettono spettri discreti emettono fotoni con energie
fissate e caratteristiche dell’atomo
un elettrone può muoversi soltanto su alcuni determinati livelli stabili (riferimento ad un modello classico orbite), detti stati stazionari
L'atomo irraggia energia solamente quando, per un qualche motivo, un elettrone effettua una transizione da uno stato stazionario ad un altro. La frequenza della radiazione è legata all'energia del livello di partenza e di quello di arrivo 12
STRUTTURA ATOMO (BOHR)
Energia elettrone En = -2,18 x 10-18 / n2 joule
E1 – E2 = hv
v = (E1 – E2 )/hh = costante di Plank
Raggi ammessi
13
LE RADIAZIONI
Con il termine radiazione si indica genericamente un insieme di
fenomeni caratterizzati dal trasporto di energia nello spazio
La radiazione può essere di tipo elettromagnetico (fotoni) o sotto
forma di particelle atomiche/subatomiche dotate di energia cinetica
(elettroni, protoni, neutroni, ioni…)
Se la radiazione interagisce con la materia può trasferire tutta o
parte della sua energia agli atomi costituenti il mezzo
I fenomeni di interazione della radiazione con un mezzo dipendo
principalmente dall’energia della radiazione incidente
Distinguiamo le radiazioni ionizzanti dalle non ionizzanti sulla base
di questi fenomeni di interazione.
14
RADIAZIONI IONIZZANTI
Vengono definite radiazioni ionizzanti quelle radiazioni in grado di
ionizzare (strappare e mettere in moto gli elettroni) degli atomi del
mezzo con cui interagiscono
15
Radiazioni
ionizzanti
Onde elettromagnetiche ad alta
energia: raggi X e raggi gamma
Particelle
Devono avere un energia maggiore dell’energia di
legame degli elettroni al nucleo
ENERGIA DELLE RADIAZIONI IONIZZANTI
L’energia delle radiazioni ionizzanti è in genere misurata in elettronVolt
16
Un elettronVolt (simbolo eV) è l'energia acquistata da un
elettrone libero quando passa attraverso una differenza di
potenziale elettrico di 1 volt nel vuoto
Sono molto usati i suoi multipli keV (kilo-eV, ossia 1000
elettronvolt), MeV (mega-eV, cioè un milione di elettronvolt) e
GeV (giga-eV, cioè un miliardo di elettronvolt)
L’energia minima di ionizzazione (ordine di grandezza delle energie di
legame degli elettroni atomici più esterni) è dell’ordine di qualche decina di
eV
Le radiazioni per essere definite ionizzanti devono avere energia maggiore
di questa soglia
Di fatto le energie tipiche delle radiazioni ionizzanti partono da qualche
decina/centinaio di keV
SORGENTI DI RADIAZIONI IONIZZANTI
Decadimento sorgenti radioattive naturali
Radioattività gamma
Radioattività beta
Radioattività alfa
Tubi a raggi X
Raggi X con energie caratteristiche ~ 10/100 kV
Macchine acceleratrici
Raggi X con energie caratteristiche ~ 10 MV
Elettroni ~ 10 MeV
Particelle subatomiche/ioni pesanti < 10 MeV17
ESEMPIO: TUBO A RAGGI X
Un tubo a raggi X è costituito da un'ampolla di vetro, all'interno della quale viene fatto il
vuoto, posta dentro un involucro metallico rivestito di piombo. L'emissione dei raggi X
avviene solo da una piccola zona non schermata detta finestra
All'interno dell'ampolla vi sono anodo e catodo. Il catodo è costituito da un filamento,
tipicamente di tungsteno. Il filamento viene attraversato da una corrente intensa che
riscalda il catodo e determina la fuoriuscita degli elettroni di conduzione per emissione
termoionica. Tali elettroni vengono poi accelerati verso l'anodo grazie all'alta differenza di
potenziale che viene applicata tra il catodo e l'anodo.
Le macchine acceleratrici per radioterapia funzionano in modo simile; gli elettroni sono
però accelerati da un acceleratore lineare e non da una differenza di potenziale elettrico.
Si raggiungono energie 1000 volte maggiori
18
elettroni
Fotoni –
raggi x
RADIOATTIVITÀ
Definiamo Radioattività la trasformazione
spontanea o artificiale (isotopi instabili prodotti per
mezzo di reazioni nucleari in lab.) di nuclei in altri
nuclei per mezzo di emissione di radiazione
Corpuscolare (particelle)
Elettromagnetica
19
Esistono 3 tipi distinti di emissioni
radioattive: alfa, beta e gamma
R=mv/qB
Non tutti i
nuclei sono
stabili !!!
Fenomeni riguardanti il
nucleo atomico
IL NUCLEO
In nucleo è composto da protoni e neutroni
Il numero di protoni e neutroni determina le proprietà fisiche dell’atomo
Rnucleo 10-15 m = 1 fm
Ratomo 10-10 m = 1 Å
il nucleo è 100000 volte più piccolo dell’atomo
protoni Z
mp = 1.67 • 10-27 kg
q = +e = 1.6 • 10-19 C
neutroni N
mn = 1.67 • 10-27 kg
q = 0
Gli elettroni determinano le
proprietà chimiche
elettroni (se neutro Z)
me = 9.07 • 10-31 kg
q = -e = -1.6 • 10-19 C
Neutroni e protoni genericamente nucleoni
20
TAVOLA PERIODICA
DI MENDELEEV
Elementi: atomi con diverso Z naturali: da idrogeno (Z=1) a uranio (Z=92)
artificiali: tecnezio (Z=43) e transuranici (Z>92)
21
Un particolare elemento è definito da Z
Il numero di neutroni in un dato atomo di un elemento
è variabile
Si indica con A il numero dei nucleoni
I diversi nuclei, intesi come combinazione di N e Z
sono detti nuclidi
Z numero atomico
A numero di massa
Il numero di neutroni N=A-Z
Un nuclide è completamente identificato da A e Z
22
Un nuclide si indica con la dicitura
XA
Z
23
I nuclei contenenti lo stesso numero di protoni Z, ma differente numero di
neutroni sono detti ISOTOPI
Gli isotopi hanno stesse proprietà chimiche ma diversa massa
Gli isotopi possono essere naturali o sintetici, stabili o instabili
Gli isotopi per un certo elemento non si presentano con la stessa
abbondanza
C11
6C12
6 C13
6 C14
6
1.1% 98.9%
Come fanno i protoni a rimanere “vicini” nei nuclei?
24
Nel nucleo ci sono Z protoni molto vicini tra loro (d 10-15 m).
Essi risentono delle forze di:
attrazione
gravitazionale
repulsione
elettrostatica
N102)10(
)1067.1(1067.6
r
mmGF 34
215
22711
2
ppG
N230)10(
)106.1(109
r
4
1F
215
2199
2
pp
0E
In base alle forze gravitazionale (attrattiva ma molto debole) ed
elettromagnetica (repulsiva e 36 ordini di grandezza più intensa
della gravitazionale)
i protoni dovrebbero respingersi violentemente
LA FORZA NUCLEARE FORTE
All’interno dei nuclei atomici si manifesta una ulteriore
nuova forza di attrazione, capace di “incollare” tra loro i
protoni vincendo la loro repulsione coulombiana
25
Caratteristiche della forza nucleare:
• E’ sempre attrattiva
• Si manifesta solo a distanze d 10-15 m
• Vale tra protoni, tra neutroni, tra protoni e neutroni
La sola forza forte è uguale per tutti I nucleoni. In realtà
non basta a spiegare da sola la stabilità dei nuclei in
quanto esiste una relazione tra numero di massa A,
numero atomico Z e stabilita del nuclide Forza debole
Considerando per semplicità nuclei leggeri come l’Idrogeno o l’Elio si vede
che un numero troppo piccolo o troppo grande di neutroni rispetto a quello
di protoni determina una instabilità dell’atomo
26
Idrogeno Z=1 Elio Z=2
H11
H21
H31
Deuterio
Trizio
instabile
He22
He32
He42
Non
esiste
He52 instabile
In natura non sono possibili tutte le combinazioni di protoni e neutroni. L’atomo
tenderà a portarsi ad uno stato energeticamente più stabile modificando il
numero dei suoi nucleoni. I nuclei tenderanno a decadere in tempi più o meno
brevi (da frazioni di secondo ad anni) frantumandosi, emettendo particelle e
radiazione em
RadioattivitàAtomo perde l’energia in
eccesso
DECADIMENTO ALFA
X nucleo padre
Y nucleo figlio
Il decadimento a avviene per nuclei molto grandi dove la forza nucleare forte a corto raggio non riesce a mantenere il nucleo unito a fronte di una forza elettrostatica crescente
Il decadimento avviene solo se la massa (o energia) del nucleo padre è maggiore della massa (o energia) del nucleo figlio e della particella a
La differenza in energia va in energia cinetica della particella a e di rinculo del nucleo figlio
La probabilità che questo decadimento avvenga varia da atomo ad atomo
27
2
4
22
4
2 HeYX N
A
ZN
A
Z
+a
Nuclei pesanti
DECADIMENTO BETA
E’ bene tenere presente che l’elettrone nel decadimento beta negativo non è un elettrone orbitale
L’elettrone positivo è l’antiparticella dell’elettrone ed è detto positrone
Il neutrino e la sua antiparticella, l’antineutrino sono particelle a massa piccolissima e difficilissimi da rilevare (altissima penetrazione); inizialmente fu introdotto per “far tornare il bilancio energetico” 28
n eYX N
AZN
AZ 11- + +
n eYX N
AZN
AZ 11+ + +
DECADIMENTO GAMMA
Il decadimento gamma è la modalità
di decadimento di nuclei in stato
eccitato.
Un atomo un nucleo in uno stato
eccitato torna allo stato fondamentale
emettendo fotoni dell’ordine dei keV
fino a qualche MeV
Un nucleo può trovarsi in uno stato
eccitato in seguito ad un urto od ad
un’altra forma di decadimento
Il decadimento gamma accompagna
spesso il decadimento alfa o beta 29
nhXX N
A
ZN
A
Z * + fotoni
LEGGI DECADIMENTO
L’Attività radioattiva o il tasso di decadimento di un
nuclide è dato dal numero di decadimenti per unità di
tempo
30
Unità di misura SI:
becquerel 1 Bq = 1/s
dimensionalmenteuguale all’hertz
frequenza
1 Bq essendo uguale ad un decadimento
(disintegrazione) al secondo è un unità in genere piccola
Si usa più spesso l’unità pratica Cu (Curie)
curie: attività di 1g di radio
(decadimento a: 234Ra 230Rn, t=1620 anni)
1 Cu = 3.7 1010 Bq
Il numero di decadimenti DN che avviene in un breve intervallo Dt è
proporzionale a Dt e al numero di nuclei presenti N
31
-DN/Dt = l•N l = costante di decadimento
N(t) = N0 e-lt
N(t) = N0 e-t/t1/l = t = vita media
A=DN/Dt =- l•N A(t) = A0 e-lt
Il momento esatto in cui un atomo instabile decadrà in uno più stabile è
assolutamente casuale. Ciò che si può fare, dato un campione di un
particolare isotopo, è notare che il numero di decadimenti rispetta una
precisa legge statistica.
Il decadimento radioattivo è un processo statistico a probabilità
costante (= indipendente dal tempo)
La vita media è la costante caratteristica del fenomeno e
rappresenta il tempo dopo cui i nuclei si riducono del 37%
(1/e)
Il tempo di dimezzamento T1/2 è il tempo dopo il numero
dei nuclei si riduce del 50%
32T1/2
n(t)
t
t0
0.50 n0
0.37 n0
n0
n(T1/2) = n0/2 = n0 e-T1/2/t
e-T1/2/t = ½
-T1/2/t = ln ½ = -ln2 = -0.693
RADIAZIONI IONIZZANTI
INTERAZIONE CON IL MEZZO ATTRAVERSATO
Le radiazioni ionizzanti attraversando un mezzo
interagiscono per lo più con gli elettroni del mezzo
ionizzando gli atomi che lo compongono
Il tipo di interazioni dipende principalmente dalla
carica delle particelle
Le particelle cariche interagiranno con gli elettroni del
mezzo attraverso forze di natura coloumbiana
Le particelle neutre mettono in moto particelle cariche che
a loro volta interagiscono con gli elettroni del mezzo
Il tipo di interazioni dipende, inoltre, dalla massa e
dall’energia delle particelle incidenti
33
ELETTRONI
Come vengono prodotti?
Radioattività beta positiva e beta negativa, acceleratori lineari
Quali sono le caratteristiche?
Hanno una carica e possiedono una massa molto piccola (particelle leggere)
Come si comportano nel mezzo?
A causa della sua piccolissima massa e della carica elettrica negativa unitaria (1-) ogni
volta che un elettrone si avvicina ad elettroni orbitali subisce una deviazione dal suo
percorso; quest’ultimo viene deviato anche dai nuclei atomici positivi. Gli elettroni orbitali
possono essere eccitati o espulsi dall’atomo e determinare ionizzazione a distanza
Per queste ragioni il percorso dell’elettrone, sebbene lungo, è tortuoso e difficile da definire. La
profondità di penetrazione è inferiore alla reale lunghezza di percorso.
La maggiore densità di ionizzazione si produce alla fine del suo percorso Diminuendo
l’energia diminuisce la velocità e aumentano le probabilità di interazione con gli atomi del
mezzo attraversato.
Alternativamente elettroni più energetici possono perdere energia frenando nel campo elettrico
dei nuclei ed emettendo fotoni a tutte le energie (radiazione di frenamento o bremsstrahlung)
Che capacità di penetrazione hanno?
La penetrazione dipende dall’energia, ma in media per energie caratteristiche (ordine MeV), è di
qualche cm in acqua 34
percorso
PARTICELLE ALFA E IONI
35
Come vengono prodotti?
Radioattività, acceleratori
Quali sono le caratteristiche?
Hanno una carica e possiedono una massa confrontabile con quella degli atomi del
mezzo
Come si comportano nel mezzo?
Le particelle pesanti interagiscono principalmente con gli elettroni del mezzo.
A causa della massa molto grande procedono in linea praticamente retta o con deviazioni
minime
A causa della massa molto grande sono relativamente lente e tendono ad ionizzare un
maggior numero di atomi per unità di percorso
Hanno notevole densità di ionizzazione
Perdono l’80% di energia a fine percorso come conseguenza di una diminuzione drastica
della velocità
Che capacità di penetrazione hanno?
La penetrazione è dell’orine del millimetro (foglio di carta per le particelle alfa)
FOTONI
Come vengono prodotti?
Radioattività gamma
Emissione di fotoni in seguito a diseccitamento dei nuclei
Raggi X
Radiazione di frenamento
Emissioni di fotoni per salti elettronici verso livelli energetici più interni
Quali sono le caratteristiche?
Non hanno massa e sono elettricamente neutri. Interazioni peculiari, non producono
ionizzazione diretta, ma mettono in moto elettroni che ionizzano gli atomi del
mezzo.
Comportamento nel mezzo e capacità di penetrazione
I fotoni interagiscono con il mezzo mediante effetto fotoelettrico, effetto Compton o
produzione di coppie di elettroni con prevalenza a basse, medie o alte energie
In ciascuno di questi eventi il fotone originario viene completamente assorbito e
quindi rimosso dal fascio
Alternativamente il fotone può essere deviato senza perdere energia
La probabilità che il fotone venga assorbito è casuale e di conseguenza l’intensità di
fascio di fotoni si riduce in modo esponenziale
Hanno altissima capacità di penetrazione (1MeV dimezzato da 8mm di piombo)
36
DOSE, EQUIVALENTE DI DOSE E DOSE
EFFICACE
Radiazioni ionizzanti cedono energia al mezzo
In dosimetria la quantità di interesse è l’energia
assorbita in un mezzo come conseguenza del
passaggio di un fascio di radiazioni ionizzanti
Tale energia si misura in dose
La dose è l’energia assorbita per unità di massa
D = dE/dm (J/kg)
Per la dose si utilizza l’unità di misura speciale Gray
1 Gy = 1J/kg
38
Quando le radiazioni ionizzanti attraversano un mezzo generico la dose dipende solo
dall’energia assorbita dal mezzo.
La dose è indipendente dal tipo di particella che rilascia l’energia nel mezzo
Nel tessuto biologico il passaggio della radiazione può danneggiare strutture vitali per
il corretto funzionamento cellulare quali le catene di DNA
39 Nel tessuto biologico l’entità del danno dipende dal tipo di radiazione considerata
40
Il LET misura la densità di
ionizzazione indotta,
espressa come quantità di
energia ceduta (in KeV) da
una radiazione per di
percorso.
LET (trasferimento lineare di energia)
Unità di misura della DENSITÀ DI IONIZZAZIONE indotta dall’energia radiante
(quantità di energia ceduta in keV)/ di percorso della radiazione.
Radiazione a LET
molto elevato (200
keV/m)
Radiazione a LET
elevato (20-100
keV/m)
Radiazione a LET
ridotto (10 keV/m)
Particelle a
neutroni
protoni
Elettroni veloci
Raggi
Raggi X
Alto LET
Basso
LET
LA DOSE, e quindi la semplice
energia ceduta al mezzo NON
BASTA A DENTIFICARE IL
DANNO BIOLOGICO
41
20
10
1
0.1 1 10 100 1000
Induzione di letalità: Relazione tra EBR
di una radiazione ed il suo LET
EBR
LET
Introducendo un fattore che tiene conto dell’efficacia biologica delle diverse
radiazioni ionizzanti, detto EBR, definiamo l’equivalente di dose, H
H = D (Gy) EBR
L’equivalente di dose è misurato in un unità speciale, il Sv (Sievert), e
rappresenta una stima diretta del danno subito a livello biologico
Fotoni ed elettroni
Ioni pesanti Per fini radioprotezionistici si tiene
conto spesso anche della sensibilità
alle radiazioni dei diversi organi.
Si introduce quindi la dose efficace, E
E = Σ wt H (Sv)
Gonadi 0.20
Midollo osseo (rosso) 0.12
Colon 0.12
Polmone (vie respiratorie) 0.12
Stomaco 0.12
Vescica 0.05
Mammelle 0.05
Fegato 0.05
Esofago 0.05
Tiroide 0.05
Pelle 0.01
Superficie ossea 0.01
Rimanenti organi e tessuti 0.05
Esposizioni annue
popolazione comune
sono < mSv