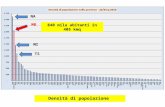
Principi della centrifugazione Materiali differenti per forma, densità e dimensioni, sedimentano a...
-
Upload
anunciata-tortora -
Category
Documents
-
view
216 -
download
1
Transcript of Principi della centrifugazione Materiali differenti per forma, densità e dimensioni, sedimentano a...

Principi della centrifugazionePrincipi della centrifugazione
Materiali differenti per forma densitagrave e dimensioni sedimentano a diverse
velocitagrave se posti in un campo di forza centrifuga
Sospensione
Campo gravitazionale indotto con la centrifugazione
Precipitato (pellet)
Sopranatante
Separazione completata
Principi della centrifugazionePrincipi della centrifugazione
Le particelle in soluzione se lasciate in condizioni di quiete tenderanno a
sedimentare per effetto della gravitagrave
Una centrifuga egrave uno strumento progettato per produrre una forza
centrifuga superiore alla forza di gravitagrave terrestre
Obiettivo esercitare una forza maggiore del campo gravitazionale
terrestre aumentando la velocitagrave di sedimentazione delle macromolecole
col fine di separare macromolecole che differiscono per densitagrave forma e
dimensioni
In una centrifuga su una particella di massa m ruotante ad una velocitagrave
angolare ω a distanza r dallrsquoasse di rotazione agisce una forza verso lrsquoesterno
e perpendicolare allrsquoasse di rotazione
FFcc= m ω= m ω2 2 rr
Fc= forza centrifuga
ω2 r= velocitagrave angolare che definisce il campo centrifugo G= ω2 rSolitamente perograve la velocitagrave angolare del rotore viene espressa in rpm
(rivoluzioni per min) dove una rivoluzione del rotore egrave pari a 2 radianti e
la forza centrifuga come forza centrifuga relativa RCF cioegrave multiplo della
forza di gravitagrave agente sulla particella
Considerando la forza di gravitagrave Fg pari al prodotto della massa m per
lrsquoaccelerazione di gravitagrave g cioegrave
Fg = mg
si puograve esprimere la forza centrifuga come RCF (forza centrifuga relativa) pari ad un multiplo della forza di gravitagrave cioegrave
RCF = Fc Fg = m 2r mg =2r g
La forza centrifuga relativa egrave il rapporto tra il peso di una massa nel campo centrifugo ed il peso della stessa massa sottoposta alla sola azione del campo gravitazionale
Esprimendo la velocitagrave angolare come rpm (= 2 RPM60) ed inglobando i termini noti in unrsquounica costante avremo alla fine la seguente equazione
RCF = 1119 x 10-5 (rpm)2 r
Quindi risulta che la RCF agente su una qualsiasi particella egrave funzione solo della velocitagrave di rotazione e della distanza della particella dallrsquoasse di rotazionePertanto particelle sottopose alla stessa RCF sedimenteranno con una velocitagrave che dipenderagrave essenzialmente dalla loro densitagrave
Centrifughe
bull Centrifuga da banco bull Ultracentrifuga
Centrifughe
RPM g
Da banco 4000-6000 3000-7000Micro max 16000 max 22000Super ~ 25000 ~ 60000Ultra ~ 80000 ~ 600000
Coperchio del rotore (a tenuta drsquoaria)
Coperchio del tubo da centrifuga
Asse di rotazione
Rotori ad angolo fisso - hanno gli alloggiamenti per i tubi disposti circolarmente attorno allrsquoasse di rotazione ad un certo angolo prefissato che varia in genere tra 20deg e 40deg Quando le particelle sono proiettate contro le pareti scivolano verso il fondo con la formazione del pellet
Rotori oscillanti o ad angolo mobile - A riposo i tubi rimangono in
posizione orizzontale ma quando il rotore inizia a girare per effetto della
accelerazione centrifuga i tubi ruotano sui perni verso lrsquoesterno
disponendosi orizzontalmente I rotori oscillanti consentono una formazione
di bande di sedimento ben differenziate e di pellets piugrave uniformi ma hanno
una maggiore delicatezza rispetto ai rotori ad angolo fisso
Le tecniche centrifugative si possono suddividere in
generale in preparative e analitiche
Preparativa permette di separare e purificare cellule
intere organuli subcellulari e macromolecole biologiche
come acidi nucleici o proteine
Analitica permette invece di studiare le caratteristiche
di sedimentazione del campione e di determinarne il
grado di purezza o la massa molecolare
La centrifugazione differenziale egrave la tecnica piugrave usata per il
frazionamento cellulare cioegrave per lrsquoottenimento di preparazioni di
organelli da sottoporre poi a studio Ad esempio centrifugando un
omogenato cellulare per tempi relativamente brevi ed a velocitagrave
modeste saragrave possibile ottenere la sedimentazione dei nuclei ma non
degli altri organelli che hanno densitagrave eo dimensioni minori e che
rimarranno nel sovranatante Il sovranatante puograve essere
ulteriormente processato per ottenere altri tipi di particelle Mediante
lrsquoapplicazione ripetuta di questo procedimento con lrsquoaumento della
velocitagrave e del tempo di centrifugazione si puograve ottenere la successiva
sedimentazione di particelle sempre piugrave piccole
Centrifugazione differenziale
Separazione su gradiente di densitarsquo
GRADIETE
Campocentrifugo
campione
Il campione viene fatto stratificare su un gradiente pre-formato in una provetta mediante il mescolamento in proporzioni diverse di soluzioni a diversa densitagrave La densitarsquo massima non deve superare quella delle particelle piursquo dense da separare
Particelle a bassa densitarsquo
Particelle ad alta densitarsquo
Tecnica analitica e separativa basata sul movimento di particelle
elettricamente cariche immerse in un fluido per effetto di un campo elettrico
applicato mediante una coppia di elettrodi al fluido stesso
verso il catodo (particelle cariche positive= cationi)
verso lrsquoanodo (particelle cariche negative= anioni)
- +
+ + - +
- + - -
ElettroforesiElettroforesi
I fattori che influenzano la mobilitagrave di una molecola in un campo
elettrico comprendono la carica della molecola (q) il gradiente di
voltaggio del campo elettrico (E) la resistenza di attrito del mezzo
di supporto (f)
Mobilitagrave elettroforeticaMobilitagrave elettroforetica
La velocitagrave (v) di una molecola carica che si sposta in un campo
elettrico egrave data dunque dalla seguente equazione
v = Eq f
Comunemente egrave adoperato il termine mobilitagrave elettroforetica (μ)
dello ione che equivale alla velocitagrave dello ione diviso lrsquointensitagrave
del campo elettrico (vE)
Quando si applica una differenza di potenziale molecole con
carica elettrica totale differente inizieranno a separarsi in funzione
della loro mobilitagrave elettroforetica
Anche molecole con carica elettrica uguale ma con
dimensioni molecolari differenti si separeranno per effetto di
forze frizionali diverse
Apparecchiatura per elettroforesi
bullAlimentatore
elettrico
bullCella elettroforetica
bullsupporto
Per la maggior parte delle tecniche elettroforetiche si adoperano gel di
poliacrilammide o di agarosio
AcrilammideAcrilammide Bis-acrilammideBis-acrilammide
Materiali di supporto
I gel di poliacrilammide sono preparati facendo copolimerizzare monomeri
di acrilammide in presenza di piccole quantitagrave di NNrsquo-metilene
bisacrilammide (bis-acrilamide)
La bis-acrilammide composta da due molecole di acrilammide legate da
un gruppo metilene egrave utilizzata come agente in grado di formare legami
crociati (cross-linking agent)
Acrilammide
Il processo di polimerizzazione dellrsquoacrilammide egrave un tipico esempio di catalisi radicalica ed inizia con lrsquoaggiunta di ammonio persolfato e della base NNNrsquoNrsquo-tetrametilendiammina (TEMED) Il TEMED catalizza la decomposizione dello ione persolfato con la produzione del corrispondente radicale libero (cioegrave una molecola con un elettrone spaiato) nel modo seguente
TEMED (iniziatore)TEMED (iniziatore)
Lrsquoammonio persolfato egrave lrsquoestere disolfato
dellrsquoacqua ossigenata e omolisa rapidamente a
radicali instabili (radicali solforici)
Il TEMED egrave unrsquoammina terziaria che reagisce con questi radicali a
formare radicali liberi TEMED che a loro volta
reagiscono con lrsquoacrilammide inducendone
la polimerizzazione
Se rappresentiamo il radicale libero con R ed il monomero di acrilammide con M possiamo schematizzare la polimerizzazione nel modo seguente
R + M rarr RMRM + M rarr RMMRMM + M rarr RMMM ecc
In questo modo si formano lunghe catene di acrilammide tenute insieme
tra loro da legami crociati derivanti dallrsquoinserzione occasionale
allrsquointerno della catena di molecole di bis-acrilammide
AcrilammideAcrilammide bis-acrilammidebis-acrilammide
GEL DI POLIACRILAMMIDEGEL DI POLIACRILAMMIDE(molto idrofilico =gt(molto idrofilico =gt
trattiene grosse quantitagrave di acqua)trattiene grosse quantitagrave di acqua)
TEMED (iniziatore)TEMED (iniziatore)
(catalizzatore)(catalizzatore)
ElettroforesiElettroforesiDenaturante
nativa
Elettroforesi denaturante o SDS PAGEElettroforesi denaturante o SDS PAGE
Per semplificare lrsquoanalisi di miscele di proteine egrave possibile fare in modo che la separazione elettroforetica si basi solo sulle dimensioni delle catene polipeptidiche
Ciograve si ottiene denaturando le proteine con il detergente Sodio Dodecil Solfato (SDS) Tale detergente si lega con forza alle proteine le quali si ripiegano a formare delle bacchette estese rivestite di SDS
La separazione delle catene polipeptidiche denaturate e rivestite di detergente si baseragrave quasi esclusivamente sulle dimensioni delle molecole proteiche per cui proteine piugrave piccole si muovono piugrave rapidamente attraverso il gel mentre quelle con dimensioni maggiori sono piugrave rallentate e migrano piugrave lentamente
proteinaproteina
Sodio Dodecil SolfatoSodio Dodecil SolfatoCH3(CH2)10CH2OSO3
- Na+
ElettroforesiElettroforesi
Elettroforesi in condizioni native
Separazione di proteine preservando la loro attivitagrave biologica
Le proteine conservano la loro carica nativa si separano mediante
le loro differenti mobilitagrave elettroforetiche e gli effetti setaccio del gel
Esempio separazione dei complessi della catena respiratoria in un
gradiente lineare o esponenziale
SDS PAGE
I V III IV
Elettroforesi in condizioni native
I
V
III
II
IV
IsoelettrofocalizzazioneIsoelettrofocalizzazione
Separazione delle proteine in base al loro punto isoelettrico
In un gel viene creato un gradiente di pH mediante lrsquoaggiunta di
appropriati anfoliti
La miscela di proteine viene posta in un pozzetto sul gel e viene
applicato un campo elettrico Le proteine entrano nel gel e
migrano fino a che non raggiungono un pH equivalente al punto
isoelettrico
Le proteine con punti isoelettrici diversi si distribuiscono in punti
diversi nel gel
Analisi quantitativa delle proteine presenti nel campione di interesse
Determinazione del peso molecolare di proteine sconosciute
Analisi qualitativa delle proteine presenti nel campione di interesse (colorazione con Coomassie o nitrato drsquoargento o western-blotting)
Applicazioni dellrsquoSDS-PAGEApplicazioni dellrsquoSDS-PAGE
Tecniche di rivelazioneTecniche di rivelazione
Il gel egrave immerso in una soluzione che contiene Coomassie Brilliant Blue R-250 sciolto in acido acetico diluito e metanolo Rivela 01 g di proteina
Coomassie Brilliant BlueIl gel si colora con una miscela di sali drsquoargento e formaldeideGli ioni drsquoargento reagiscono con i gruppi basici e tiolici delle proteine 100 volte piugrave sensibile
Silver
Al termine della corsa elettroforetica le proteine sono trasferita su un
filtro di nitrocellulosa mediante una procedura definita elettroblotting Il gel e la nitrocellulosa sono posti in un apposito cestello a forma
di sandwich immerso in un tampone nel quale ci sono due elettrodi
paralleli La corrente in direzione perpendicolare al gel trasferisce le proteine
sul foglio di nitrocellulosa
St C1 C2 C3 C4 C5 C6
Elettroforesi delle sieroproteineElettroforesi delle sieroproteine
Il termine cromatografia indica un insieme di tecniche che hanno lo
scopo di separare una miscela nei suoi componenti per permetterne il
riconoscimento qualitativo e quantitativo
Queste tecniche sono basate sulla distribuzione differenziale dei vari
componenti fra due fasi una chiamata fase fissa o fase stazionaria e
lrsquoaltra chiamata fase mobile o eluente che fluisce in continuo attraverso
la fase fissa
Cromatografia
Le fasi essenziali di un processo cromatografico sono 3
Caricamento del campione o della miscela da analizzare in una zona
ristretta della fase stazionaria
Eluizione della miscela dalla fase stazionaria per effettuare la
separazione nei singoli componenti
Rivelazione dei composti separati
In base alla forma del letto cromatograficondashCromatografia su colonna (impaccata open-tubular)
ndashCromatografia planare (su carta su strato sottile)
In base allo stato fisico della fase mobilendashCromatografia Liquida (LC)ndashGascromatografia (GC)
In base al meccanismo di separazionendashScambio ionicondashEsclusionendashAffinitagrave
Forma del letto cromatografico
Cromatografia su colonna la fase
stazionaria egrave contenuta allrsquointerno
di una colonna cilindrica che puograve
riempire completamente (colonna
impaccata) oppure rivestirne la
superficie interna (colonna
tubulare)
Cromatografia planare la fase
stazionaria egrave distribuita su una
superficie piana che puograve essere un
supporto cartaceo (cromatografia su
carta PC) o una lastrina in vetro o
altri materiali (cromatografia su
strato sottile TLC)
Gel filtrazione o esclusione molecolare
Separa le proteine in base alle dimensioni la matrice presente
nella colonna egrave un polimero con molti legami crociati che
generano pori con un diametro specifico Le proteine piugrave grandi
potranno migrare nella colonna piugrave velocemente in quanto non
possono entrare nei pori dei granuli della matrice il loro
percorso saragrave quindi diretto verso il fondo della colonna Le
proteine piugrave piccole potranno invece entrare nei pori
allungando il percorso che devono compiere per arrivare al
fondo della colonna
La matrice solida della colonna egrave un polimero sintetico contenente
gruppi carichi (quelli con gruppi anionici sono detti scambiatori di
cationi mentre quelli con gruppi cationici sono detti scambiatori di
anioni)
Lrsquo affinitagrave delle singole proteine del campione per i gruppi carichi
sulla colonna dipende dal pH della soluzione (che determina lo
stato di ionizzazione delle proteine) e dalla concentrazione di sali
(in grado di competere con le cariche delle proteine)
La separazione puograve essere ottimizzata variando gradualmente il
pH o la concentrazione salina in modo da creare un gradiente di
pH o un gradiente salino
Scambio ionico
Cromatografia per affinitagrave
Separa le proteine in base alla loro specificitagrave di legame
Le proteine sono trattenute sulla colonna solo se sono in
grado di legarsi a uno specifico ligando ancorato alla matrice
solida
Dopo aver allontanato dalla colonna le proteine che non si
possono legare la proteina viene eluita usando una soluzione
contenente ligando libero
- Slide 1
- Slide 2
- Slide 3
- Slide 4
- Slide 5
- Slide 6
- Slide 7
- Slide 8
- Slide 9
- Slide 10
- Slide 11
- Slide 12
- Slide 13
- Slide 14
- Slide 15
- Slide 16
- Slide 17
- Slide 18
- Slide 19
- Slide 20
- Slide 21
- Slide 22
- Slide 23
- Slide 24
- Slide 25
- Slide 26
- Slide 27
- Slide 28
- Slide 29
- Slide 30
- Slide 31
- Slide 32
- Slide 33
- Slide 34
- Slide 35
- Slide 36
- Slide 37
- Slide 38
- Slide 39
- Slide 40
- Slide 41
- Slide 42
- Slide 43
- Slide 44
- Slide 45
- Slide 46
- Slide 47
- Slide 48
-

Principi della centrifugazionePrincipi della centrifugazione
Le particelle in soluzione se lasciate in condizioni di quiete tenderanno a
sedimentare per effetto della gravitagrave
Una centrifuga egrave uno strumento progettato per produrre una forza
centrifuga superiore alla forza di gravitagrave terrestre
Obiettivo esercitare una forza maggiore del campo gravitazionale
terrestre aumentando la velocitagrave di sedimentazione delle macromolecole
col fine di separare macromolecole che differiscono per densitagrave forma e
dimensioni
In una centrifuga su una particella di massa m ruotante ad una velocitagrave
angolare ω a distanza r dallrsquoasse di rotazione agisce una forza verso lrsquoesterno
e perpendicolare allrsquoasse di rotazione
FFcc= m ω= m ω2 2 rr
Fc= forza centrifuga
ω2 r= velocitagrave angolare che definisce il campo centrifugo G= ω2 rSolitamente perograve la velocitagrave angolare del rotore viene espressa in rpm
(rivoluzioni per min) dove una rivoluzione del rotore egrave pari a 2 radianti e
la forza centrifuga come forza centrifuga relativa RCF cioegrave multiplo della
forza di gravitagrave agente sulla particella
Considerando la forza di gravitagrave Fg pari al prodotto della massa m per
lrsquoaccelerazione di gravitagrave g cioegrave
Fg = mg
si puograve esprimere la forza centrifuga come RCF (forza centrifuga relativa) pari ad un multiplo della forza di gravitagrave cioegrave
RCF = Fc Fg = m 2r mg =2r g
La forza centrifuga relativa egrave il rapporto tra il peso di una massa nel campo centrifugo ed il peso della stessa massa sottoposta alla sola azione del campo gravitazionale
Esprimendo la velocitagrave angolare come rpm (= 2 RPM60) ed inglobando i termini noti in unrsquounica costante avremo alla fine la seguente equazione
RCF = 1119 x 10-5 (rpm)2 r
Quindi risulta che la RCF agente su una qualsiasi particella egrave funzione solo della velocitagrave di rotazione e della distanza della particella dallrsquoasse di rotazionePertanto particelle sottopose alla stessa RCF sedimenteranno con una velocitagrave che dipenderagrave essenzialmente dalla loro densitagrave
Centrifughe
bull Centrifuga da banco bull Ultracentrifuga
Centrifughe
RPM g
Da banco 4000-6000 3000-7000Micro max 16000 max 22000Super ~ 25000 ~ 60000Ultra ~ 80000 ~ 600000
Coperchio del rotore (a tenuta drsquoaria)
Coperchio del tubo da centrifuga
Asse di rotazione
Rotori ad angolo fisso - hanno gli alloggiamenti per i tubi disposti circolarmente attorno allrsquoasse di rotazione ad un certo angolo prefissato che varia in genere tra 20deg e 40deg Quando le particelle sono proiettate contro le pareti scivolano verso il fondo con la formazione del pellet
Rotori oscillanti o ad angolo mobile - A riposo i tubi rimangono in
posizione orizzontale ma quando il rotore inizia a girare per effetto della
accelerazione centrifuga i tubi ruotano sui perni verso lrsquoesterno
disponendosi orizzontalmente I rotori oscillanti consentono una formazione
di bande di sedimento ben differenziate e di pellets piugrave uniformi ma hanno
una maggiore delicatezza rispetto ai rotori ad angolo fisso
Le tecniche centrifugative si possono suddividere in
generale in preparative e analitiche
Preparativa permette di separare e purificare cellule
intere organuli subcellulari e macromolecole biologiche
come acidi nucleici o proteine
Analitica permette invece di studiare le caratteristiche
di sedimentazione del campione e di determinarne il
grado di purezza o la massa molecolare
La centrifugazione differenziale egrave la tecnica piugrave usata per il
frazionamento cellulare cioegrave per lrsquoottenimento di preparazioni di
organelli da sottoporre poi a studio Ad esempio centrifugando un
omogenato cellulare per tempi relativamente brevi ed a velocitagrave
modeste saragrave possibile ottenere la sedimentazione dei nuclei ma non
degli altri organelli che hanno densitagrave eo dimensioni minori e che
rimarranno nel sovranatante Il sovranatante puograve essere
ulteriormente processato per ottenere altri tipi di particelle Mediante
lrsquoapplicazione ripetuta di questo procedimento con lrsquoaumento della
velocitagrave e del tempo di centrifugazione si puograve ottenere la successiva
sedimentazione di particelle sempre piugrave piccole
Centrifugazione differenziale
Separazione su gradiente di densitarsquo
GRADIETE
Campocentrifugo
campione
Il campione viene fatto stratificare su un gradiente pre-formato in una provetta mediante il mescolamento in proporzioni diverse di soluzioni a diversa densitagrave La densitarsquo massima non deve superare quella delle particelle piursquo dense da separare
Particelle a bassa densitarsquo
Particelle ad alta densitarsquo
Tecnica analitica e separativa basata sul movimento di particelle
elettricamente cariche immerse in un fluido per effetto di un campo elettrico
applicato mediante una coppia di elettrodi al fluido stesso
verso il catodo (particelle cariche positive= cationi)
verso lrsquoanodo (particelle cariche negative= anioni)
- +
+ + - +
- + - -
ElettroforesiElettroforesi
I fattori che influenzano la mobilitagrave di una molecola in un campo
elettrico comprendono la carica della molecola (q) il gradiente di
voltaggio del campo elettrico (E) la resistenza di attrito del mezzo
di supporto (f)
Mobilitagrave elettroforeticaMobilitagrave elettroforetica
La velocitagrave (v) di una molecola carica che si sposta in un campo
elettrico egrave data dunque dalla seguente equazione
v = Eq f
Comunemente egrave adoperato il termine mobilitagrave elettroforetica (μ)
dello ione che equivale alla velocitagrave dello ione diviso lrsquointensitagrave
del campo elettrico (vE)
Quando si applica una differenza di potenziale molecole con
carica elettrica totale differente inizieranno a separarsi in funzione
della loro mobilitagrave elettroforetica
Anche molecole con carica elettrica uguale ma con
dimensioni molecolari differenti si separeranno per effetto di
forze frizionali diverse
Apparecchiatura per elettroforesi
bullAlimentatore
elettrico
bullCella elettroforetica
bullsupporto
Per la maggior parte delle tecniche elettroforetiche si adoperano gel di
poliacrilammide o di agarosio
AcrilammideAcrilammide Bis-acrilammideBis-acrilammide
Materiali di supporto
I gel di poliacrilammide sono preparati facendo copolimerizzare monomeri
di acrilammide in presenza di piccole quantitagrave di NNrsquo-metilene
bisacrilammide (bis-acrilamide)
La bis-acrilammide composta da due molecole di acrilammide legate da
un gruppo metilene egrave utilizzata come agente in grado di formare legami
crociati (cross-linking agent)
Acrilammide
Il processo di polimerizzazione dellrsquoacrilammide egrave un tipico esempio di catalisi radicalica ed inizia con lrsquoaggiunta di ammonio persolfato e della base NNNrsquoNrsquo-tetrametilendiammina (TEMED) Il TEMED catalizza la decomposizione dello ione persolfato con la produzione del corrispondente radicale libero (cioegrave una molecola con un elettrone spaiato) nel modo seguente
TEMED (iniziatore)TEMED (iniziatore)
Lrsquoammonio persolfato egrave lrsquoestere disolfato
dellrsquoacqua ossigenata e omolisa rapidamente a
radicali instabili (radicali solforici)
Il TEMED egrave unrsquoammina terziaria che reagisce con questi radicali a
formare radicali liberi TEMED che a loro volta
reagiscono con lrsquoacrilammide inducendone
la polimerizzazione
Se rappresentiamo il radicale libero con R ed il monomero di acrilammide con M possiamo schematizzare la polimerizzazione nel modo seguente
R + M rarr RMRM + M rarr RMMRMM + M rarr RMMM ecc
In questo modo si formano lunghe catene di acrilammide tenute insieme
tra loro da legami crociati derivanti dallrsquoinserzione occasionale
allrsquointerno della catena di molecole di bis-acrilammide
AcrilammideAcrilammide bis-acrilammidebis-acrilammide
GEL DI POLIACRILAMMIDEGEL DI POLIACRILAMMIDE(molto idrofilico =gt(molto idrofilico =gt
trattiene grosse quantitagrave di acqua)trattiene grosse quantitagrave di acqua)
TEMED (iniziatore)TEMED (iniziatore)
(catalizzatore)(catalizzatore)
ElettroforesiElettroforesiDenaturante
nativa
Elettroforesi denaturante o SDS PAGEElettroforesi denaturante o SDS PAGE
Per semplificare lrsquoanalisi di miscele di proteine egrave possibile fare in modo che la separazione elettroforetica si basi solo sulle dimensioni delle catene polipeptidiche
Ciograve si ottiene denaturando le proteine con il detergente Sodio Dodecil Solfato (SDS) Tale detergente si lega con forza alle proteine le quali si ripiegano a formare delle bacchette estese rivestite di SDS
La separazione delle catene polipeptidiche denaturate e rivestite di detergente si baseragrave quasi esclusivamente sulle dimensioni delle molecole proteiche per cui proteine piugrave piccole si muovono piugrave rapidamente attraverso il gel mentre quelle con dimensioni maggiori sono piugrave rallentate e migrano piugrave lentamente
proteinaproteina
Sodio Dodecil SolfatoSodio Dodecil SolfatoCH3(CH2)10CH2OSO3
- Na+
ElettroforesiElettroforesi
Elettroforesi in condizioni native
Separazione di proteine preservando la loro attivitagrave biologica
Le proteine conservano la loro carica nativa si separano mediante
le loro differenti mobilitagrave elettroforetiche e gli effetti setaccio del gel
Esempio separazione dei complessi della catena respiratoria in un
gradiente lineare o esponenziale
SDS PAGE
I V III IV
Elettroforesi in condizioni native
I
V
III
II
IV
IsoelettrofocalizzazioneIsoelettrofocalizzazione
Separazione delle proteine in base al loro punto isoelettrico
In un gel viene creato un gradiente di pH mediante lrsquoaggiunta di
appropriati anfoliti
La miscela di proteine viene posta in un pozzetto sul gel e viene
applicato un campo elettrico Le proteine entrano nel gel e
migrano fino a che non raggiungono un pH equivalente al punto
isoelettrico
Le proteine con punti isoelettrici diversi si distribuiscono in punti
diversi nel gel
Analisi quantitativa delle proteine presenti nel campione di interesse
Determinazione del peso molecolare di proteine sconosciute
Analisi qualitativa delle proteine presenti nel campione di interesse (colorazione con Coomassie o nitrato drsquoargento o western-blotting)
Applicazioni dellrsquoSDS-PAGEApplicazioni dellrsquoSDS-PAGE
Tecniche di rivelazioneTecniche di rivelazione
Il gel egrave immerso in una soluzione che contiene Coomassie Brilliant Blue R-250 sciolto in acido acetico diluito e metanolo Rivela 01 g di proteina
Coomassie Brilliant BlueIl gel si colora con una miscela di sali drsquoargento e formaldeideGli ioni drsquoargento reagiscono con i gruppi basici e tiolici delle proteine 100 volte piugrave sensibile
Silver
Al termine della corsa elettroforetica le proteine sono trasferita su un
filtro di nitrocellulosa mediante una procedura definita elettroblotting Il gel e la nitrocellulosa sono posti in un apposito cestello a forma
di sandwich immerso in un tampone nel quale ci sono due elettrodi
paralleli La corrente in direzione perpendicolare al gel trasferisce le proteine
sul foglio di nitrocellulosa
St C1 C2 C3 C4 C5 C6
Elettroforesi delle sieroproteineElettroforesi delle sieroproteine
Il termine cromatografia indica un insieme di tecniche che hanno lo
scopo di separare una miscela nei suoi componenti per permetterne il
riconoscimento qualitativo e quantitativo
Queste tecniche sono basate sulla distribuzione differenziale dei vari
componenti fra due fasi una chiamata fase fissa o fase stazionaria e
lrsquoaltra chiamata fase mobile o eluente che fluisce in continuo attraverso
la fase fissa
Cromatografia
Le fasi essenziali di un processo cromatografico sono 3
Caricamento del campione o della miscela da analizzare in una zona
ristretta della fase stazionaria
Eluizione della miscela dalla fase stazionaria per effettuare la
separazione nei singoli componenti
Rivelazione dei composti separati
In base alla forma del letto cromatograficondashCromatografia su colonna (impaccata open-tubular)
ndashCromatografia planare (su carta su strato sottile)
In base allo stato fisico della fase mobilendashCromatografia Liquida (LC)ndashGascromatografia (GC)
In base al meccanismo di separazionendashScambio ionicondashEsclusionendashAffinitagrave
Forma del letto cromatografico
Cromatografia su colonna la fase
stazionaria egrave contenuta allrsquointerno
di una colonna cilindrica che puograve
riempire completamente (colonna
impaccata) oppure rivestirne la
superficie interna (colonna
tubulare)
Cromatografia planare la fase
stazionaria egrave distribuita su una
superficie piana che puograve essere un
supporto cartaceo (cromatografia su
carta PC) o una lastrina in vetro o
altri materiali (cromatografia su
strato sottile TLC)
Gel filtrazione o esclusione molecolare
Separa le proteine in base alle dimensioni la matrice presente
nella colonna egrave un polimero con molti legami crociati che
generano pori con un diametro specifico Le proteine piugrave grandi
potranno migrare nella colonna piugrave velocemente in quanto non
possono entrare nei pori dei granuli della matrice il loro
percorso saragrave quindi diretto verso il fondo della colonna Le
proteine piugrave piccole potranno invece entrare nei pori
allungando il percorso che devono compiere per arrivare al
fondo della colonna
La matrice solida della colonna egrave un polimero sintetico contenente
gruppi carichi (quelli con gruppi anionici sono detti scambiatori di
cationi mentre quelli con gruppi cationici sono detti scambiatori di
anioni)
Lrsquo affinitagrave delle singole proteine del campione per i gruppi carichi
sulla colonna dipende dal pH della soluzione (che determina lo
stato di ionizzazione delle proteine) e dalla concentrazione di sali
(in grado di competere con le cariche delle proteine)
La separazione puograve essere ottimizzata variando gradualmente il
pH o la concentrazione salina in modo da creare un gradiente di
pH o un gradiente salino
Scambio ionico
Cromatografia per affinitagrave
Separa le proteine in base alla loro specificitagrave di legame
Le proteine sono trattenute sulla colonna solo se sono in
grado di legarsi a uno specifico ligando ancorato alla matrice
solida
Dopo aver allontanato dalla colonna le proteine che non si
possono legare la proteina viene eluita usando una soluzione
contenente ligando libero
- Slide 1
- Slide 2
- Slide 3
- Slide 4
- Slide 5
- Slide 6
- Slide 7
- Slide 8
- Slide 9
- Slide 10
- Slide 11
- Slide 12
- Slide 13
- Slide 14
- Slide 15
- Slide 16
- Slide 17
- Slide 18
- Slide 19
- Slide 20
- Slide 21
- Slide 22
- Slide 23
- Slide 24
- Slide 25
- Slide 26
- Slide 27
- Slide 28
- Slide 29
- Slide 30
- Slide 31
- Slide 32
- Slide 33
- Slide 34
- Slide 35
- Slide 36
- Slide 37
- Slide 38
- Slide 39
- Slide 40
- Slide 41
- Slide 42
- Slide 43
- Slide 44
- Slide 45
- Slide 46
- Slide 47
- Slide 48
-

In una centrifuga su una particella di massa m ruotante ad una velocitagrave
angolare ω a distanza r dallrsquoasse di rotazione agisce una forza verso lrsquoesterno
e perpendicolare allrsquoasse di rotazione
FFcc= m ω= m ω2 2 rr
Fc= forza centrifuga
ω2 r= velocitagrave angolare che definisce il campo centrifugo G= ω2 rSolitamente perograve la velocitagrave angolare del rotore viene espressa in rpm
(rivoluzioni per min) dove una rivoluzione del rotore egrave pari a 2 radianti e
la forza centrifuga come forza centrifuga relativa RCF cioegrave multiplo della
forza di gravitagrave agente sulla particella
Considerando la forza di gravitagrave Fg pari al prodotto della massa m per
lrsquoaccelerazione di gravitagrave g cioegrave
Fg = mg
si puograve esprimere la forza centrifuga come RCF (forza centrifuga relativa) pari ad un multiplo della forza di gravitagrave cioegrave
RCF = Fc Fg = m 2r mg =2r g
La forza centrifuga relativa egrave il rapporto tra il peso di una massa nel campo centrifugo ed il peso della stessa massa sottoposta alla sola azione del campo gravitazionale
Esprimendo la velocitagrave angolare come rpm (= 2 RPM60) ed inglobando i termini noti in unrsquounica costante avremo alla fine la seguente equazione
RCF = 1119 x 10-5 (rpm)2 r
Quindi risulta che la RCF agente su una qualsiasi particella egrave funzione solo della velocitagrave di rotazione e della distanza della particella dallrsquoasse di rotazionePertanto particelle sottopose alla stessa RCF sedimenteranno con una velocitagrave che dipenderagrave essenzialmente dalla loro densitagrave
Centrifughe
bull Centrifuga da banco bull Ultracentrifuga
Centrifughe
RPM g
Da banco 4000-6000 3000-7000Micro max 16000 max 22000Super ~ 25000 ~ 60000Ultra ~ 80000 ~ 600000
Coperchio del rotore (a tenuta drsquoaria)
Coperchio del tubo da centrifuga
Asse di rotazione
Rotori ad angolo fisso - hanno gli alloggiamenti per i tubi disposti circolarmente attorno allrsquoasse di rotazione ad un certo angolo prefissato che varia in genere tra 20deg e 40deg Quando le particelle sono proiettate contro le pareti scivolano verso il fondo con la formazione del pellet
Rotori oscillanti o ad angolo mobile - A riposo i tubi rimangono in
posizione orizzontale ma quando il rotore inizia a girare per effetto della
accelerazione centrifuga i tubi ruotano sui perni verso lrsquoesterno
disponendosi orizzontalmente I rotori oscillanti consentono una formazione
di bande di sedimento ben differenziate e di pellets piugrave uniformi ma hanno
una maggiore delicatezza rispetto ai rotori ad angolo fisso
Le tecniche centrifugative si possono suddividere in
generale in preparative e analitiche
Preparativa permette di separare e purificare cellule
intere organuli subcellulari e macromolecole biologiche
come acidi nucleici o proteine
Analitica permette invece di studiare le caratteristiche
di sedimentazione del campione e di determinarne il
grado di purezza o la massa molecolare
La centrifugazione differenziale egrave la tecnica piugrave usata per il
frazionamento cellulare cioegrave per lrsquoottenimento di preparazioni di
organelli da sottoporre poi a studio Ad esempio centrifugando un
omogenato cellulare per tempi relativamente brevi ed a velocitagrave
modeste saragrave possibile ottenere la sedimentazione dei nuclei ma non
degli altri organelli che hanno densitagrave eo dimensioni minori e che
rimarranno nel sovranatante Il sovranatante puograve essere
ulteriormente processato per ottenere altri tipi di particelle Mediante
lrsquoapplicazione ripetuta di questo procedimento con lrsquoaumento della
velocitagrave e del tempo di centrifugazione si puograve ottenere la successiva
sedimentazione di particelle sempre piugrave piccole
Centrifugazione differenziale
Separazione su gradiente di densitarsquo
GRADIETE
Campocentrifugo
campione
Il campione viene fatto stratificare su un gradiente pre-formato in una provetta mediante il mescolamento in proporzioni diverse di soluzioni a diversa densitagrave La densitarsquo massima non deve superare quella delle particelle piursquo dense da separare
Particelle a bassa densitarsquo
Particelle ad alta densitarsquo
Tecnica analitica e separativa basata sul movimento di particelle
elettricamente cariche immerse in un fluido per effetto di un campo elettrico
applicato mediante una coppia di elettrodi al fluido stesso
verso il catodo (particelle cariche positive= cationi)
verso lrsquoanodo (particelle cariche negative= anioni)
- +
+ + - +
- + - -
ElettroforesiElettroforesi
I fattori che influenzano la mobilitagrave di una molecola in un campo
elettrico comprendono la carica della molecola (q) il gradiente di
voltaggio del campo elettrico (E) la resistenza di attrito del mezzo
di supporto (f)
Mobilitagrave elettroforeticaMobilitagrave elettroforetica
La velocitagrave (v) di una molecola carica che si sposta in un campo
elettrico egrave data dunque dalla seguente equazione
v = Eq f
Comunemente egrave adoperato il termine mobilitagrave elettroforetica (μ)
dello ione che equivale alla velocitagrave dello ione diviso lrsquointensitagrave
del campo elettrico (vE)
Quando si applica una differenza di potenziale molecole con
carica elettrica totale differente inizieranno a separarsi in funzione
della loro mobilitagrave elettroforetica
Anche molecole con carica elettrica uguale ma con
dimensioni molecolari differenti si separeranno per effetto di
forze frizionali diverse
Apparecchiatura per elettroforesi
bullAlimentatore
elettrico
bullCella elettroforetica
bullsupporto
Per la maggior parte delle tecniche elettroforetiche si adoperano gel di
poliacrilammide o di agarosio
AcrilammideAcrilammide Bis-acrilammideBis-acrilammide
Materiali di supporto
I gel di poliacrilammide sono preparati facendo copolimerizzare monomeri
di acrilammide in presenza di piccole quantitagrave di NNrsquo-metilene
bisacrilammide (bis-acrilamide)
La bis-acrilammide composta da due molecole di acrilammide legate da
un gruppo metilene egrave utilizzata come agente in grado di formare legami
crociati (cross-linking agent)
Acrilammide
Il processo di polimerizzazione dellrsquoacrilammide egrave un tipico esempio di catalisi radicalica ed inizia con lrsquoaggiunta di ammonio persolfato e della base NNNrsquoNrsquo-tetrametilendiammina (TEMED) Il TEMED catalizza la decomposizione dello ione persolfato con la produzione del corrispondente radicale libero (cioegrave una molecola con un elettrone spaiato) nel modo seguente
TEMED (iniziatore)TEMED (iniziatore)
Lrsquoammonio persolfato egrave lrsquoestere disolfato
dellrsquoacqua ossigenata e omolisa rapidamente a
radicali instabili (radicali solforici)
Il TEMED egrave unrsquoammina terziaria che reagisce con questi radicali a
formare radicali liberi TEMED che a loro volta
reagiscono con lrsquoacrilammide inducendone
la polimerizzazione
Se rappresentiamo il radicale libero con R ed il monomero di acrilammide con M possiamo schematizzare la polimerizzazione nel modo seguente
R + M rarr RMRM + M rarr RMMRMM + M rarr RMMM ecc
In questo modo si formano lunghe catene di acrilammide tenute insieme
tra loro da legami crociati derivanti dallrsquoinserzione occasionale
allrsquointerno della catena di molecole di bis-acrilammide
AcrilammideAcrilammide bis-acrilammidebis-acrilammide
GEL DI POLIACRILAMMIDEGEL DI POLIACRILAMMIDE(molto idrofilico =gt(molto idrofilico =gt
trattiene grosse quantitagrave di acqua)trattiene grosse quantitagrave di acqua)
TEMED (iniziatore)TEMED (iniziatore)
(catalizzatore)(catalizzatore)
ElettroforesiElettroforesiDenaturante
nativa
Elettroforesi denaturante o SDS PAGEElettroforesi denaturante o SDS PAGE
Per semplificare lrsquoanalisi di miscele di proteine egrave possibile fare in modo che la separazione elettroforetica si basi solo sulle dimensioni delle catene polipeptidiche
Ciograve si ottiene denaturando le proteine con il detergente Sodio Dodecil Solfato (SDS) Tale detergente si lega con forza alle proteine le quali si ripiegano a formare delle bacchette estese rivestite di SDS
La separazione delle catene polipeptidiche denaturate e rivestite di detergente si baseragrave quasi esclusivamente sulle dimensioni delle molecole proteiche per cui proteine piugrave piccole si muovono piugrave rapidamente attraverso il gel mentre quelle con dimensioni maggiori sono piugrave rallentate e migrano piugrave lentamente
proteinaproteina
Sodio Dodecil SolfatoSodio Dodecil SolfatoCH3(CH2)10CH2OSO3
- Na+
ElettroforesiElettroforesi
Elettroforesi in condizioni native
Separazione di proteine preservando la loro attivitagrave biologica
Le proteine conservano la loro carica nativa si separano mediante
le loro differenti mobilitagrave elettroforetiche e gli effetti setaccio del gel
Esempio separazione dei complessi della catena respiratoria in un
gradiente lineare o esponenziale
SDS PAGE
I V III IV
Elettroforesi in condizioni native
I
V
III
II
IV
IsoelettrofocalizzazioneIsoelettrofocalizzazione
Separazione delle proteine in base al loro punto isoelettrico
In un gel viene creato un gradiente di pH mediante lrsquoaggiunta di
appropriati anfoliti
La miscela di proteine viene posta in un pozzetto sul gel e viene
applicato un campo elettrico Le proteine entrano nel gel e
migrano fino a che non raggiungono un pH equivalente al punto
isoelettrico
Le proteine con punti isoelettrici diversi si distribuiscono in punti
diversi nel gel
Analisi quantitativa delle proteine presenti nel campione di interesse
Determinazione del peso molecolare di proteine sconosciute
Analisi qualitativa delle proteine presenti nel campione di interesse (colorazione con Coomassie o nitrato drsquoargento o western-blotting)
Applicazioni dellrsquoSDS-PAGEApplicazioni dellrsquoSDS-PAGE
Tecniche di rivelazioneTecniche di rivelazione
Il gel egrave immerso in una soluzione che contiene Coomassie Brilliant Blue R-250 sciolto in acido acetico diluito e metanolo Rivela 01 g di proteina
Coomassie Brilliant BlueIl gel si colora con una miscela di sali drsquoargento e formaldeideGli ioni drsquoargento reagiscono con i gruppi basici e tiolici delle proteine 100 volte piugrave sensibile
Silver
Al termine della corsa elettroforetica le proteine sono trasferita su un
filtro di nitrocellulosa mediante una procedura definita elettroblotting Il gel e la nitrocellulosa sono posti in un apposito cestello a forma
di sandwich immerso in un tampone nel quale ci sono due elettrodi
paralleli La corrente in direzione perpendicolare al gel trasferisce le proteine
sul foglio di nitrocellulosa
St C1 C2 C3 C4 C5 C6
Elettroforesi delle sieroproteineElettroforesi delle sieroproteine
Il termine cromatografia indica un insieme di tecniche che hanno lo
scopo di separare una miscela nei suoi componenti per permetterne il
riconoscimento qualitativo e quantitativo
Queste tecniche sono basate sulla distribuzione differenziale dei vari
componenti fra due fasi una chiamata fase fissa o fase stazionaria e
lrsquoaltra chiamata fase mobile o eluente che fluisce in continuo attraverso
la fase fissa
Cromatografia
Le fasi essenziali di un processo cromatografico sono 3
Caricamento del campione o della miscela da analizzare in una zona
ristretta della fase stazionaria
Eluizione della miscela dalla fase stazionaria per effettuare la
separazione nei singoli componenti
Rivelazione dei composti separati
In base alla forma del letto cromatograficondashCromatografia su colonna (impaccata open-tubular)
ndashCromatografia planare (su carta su strato sottile)
In base allo stato fisico della fase mobilendashCromatografia Liquida (LC)ndashGascromatografia (GC)
In base al meccanismo di separazionendashScambio ionicondashEsclusionendashAffinitagrave
Forma del letto cromatografico
Cromatografia su colonna la fase
stazionaria egrave contenuta allrsquointerno
di una colonna cilindrica che puograve
riempire completamente (colonna
impaccata) oppure rivestirne la
superficie interna (colonna
tubulare)
Cromatografia planare la fase
stazionaria egrave distribuita su una
superficie piana che puograve essere un
supporto cartaceo (cromatografia su
carta PC) o una lastrina in vetro o
altri materiali (cromatografia su
strato sottile TLC)
Gel filtrazione o esclusione molecolare
Separa le proteine in base alle dimensioni la matrice presente
nella colonna egrave un polimero con molti legami crociati che
generano pori con un diametro specifico Le proteine piugrave grandi
potranno migrare nella colonna piugrave velocemente in quanto non
possono entrare nei pori dei granuli della matrice il loro
percorso saragrave quindi diretto verso il fondo della colonna Le
proteine piugrave piccole potranno invece entrare nei pori
allungando il percorso che devono compiere per arrivare al
fondo della colonna
La matrice solida della colonna egrave un polimero sintetico contenente
gruppi carichi (quelli con gruppi anionici sono detti scambiatori di
cationi mentre quelli con gruppi cationici sono detti scambiatori di
anioni)
Lrsquo affinitagrave delle singole proteine del campione per i gruppi carichi
sulla colonna dipende dal pH della soluzione (che determina lo
stato di ionizzazione delle proteine) e dalla concentrazione di sali
(in grado di competere con le cariche delle proteine)
La separazione puograve essere ottimizzata variando gradualmente il
pH o la concentrazione salina in modo da creare un gradiente di
pH o un gradiente salino
Scambio ionico
Cromatografia per affinitagrave
Separa le proteine in base alla loro specificitagrave di legame
Le proteine sono trattenute sulla colonna solo se sono in
grado di legarsi a uno specifico ligando ancorato alla matrice
solida
Dopo aver allontanato dalla colonna le proteine che non si
possono legare la proteina viene eluita usando una soluzione
contenente ligando libero
- Slide 1
- Slide 2
- Slide 3
- Slide 4
- Slide 5
- Slide 6
- Slide 7
- Slide 8
- Slide 9
- Slide 10
- Slide 11
- Slide 12
- Slide 13
- Slide 14
- Slide 15
- Slide 16
- Slide 17
- Slide 18
- Slide 19
- Slide 20
- Slide 21
- Slide 22
- Slide 23
- Slide 24
- Slide 25
- Slide 26
- Slide 27
- Slide 28
- Slide 29
- Slide 30
- Slide 31
- Slide 32
- Slide 33
- Slide 34
- Slide 35
- Slide 36
- Slide 37
- Slide 38
- Slide 39
- Slide 40
- Slide 41
- Slide 42
- Slide 43
- Slide 44
- Slide 45
- Slide 46
- Slide 47
- Slide 48
-

Considerando la forza di gravitagrave Fg pari al prodotto della massa m per
lrsquoaccelerazione di gravitagrave g cioegrave
Fg = mg
si puograve esprimere la forza centrifuga come RCF (forza centrifuga relativa) pari ad un multiplo della forza di gravitagrave cioegrave
RCF = Fc Fg = m 2r mg =2r g
La forza centrifuga relativa egrave il rapporto tra il peso di una massa nel campo centrifugo ed il peso della stessa massa sottoposta alla sola azione del campo gravitazionale
Esprimendo la velocitagrave angolare come rpm (= 2 RPM60) ed inglobando i termini noti in unrsquounica costante avremo alla fine la seguente equazione
RCF = 1119 x 10-5 (rpm)2 r
Quindi risulta che la RCF agente su una qualsiasi particella egrave funzione solo della velocitagrave di rotazione e della distanza della particella dallrsquoasse di rotazionePertanto particelle sottopose alla stessa RCF sedimenteranno con una velocitagrave che dipenderagrave essenzialmente dalla loro densitagrave
Centrifughe
bull Centrifuga da banco bull Ultracentrifuga
Centrifughe
RPM g
Da banco 4000-6000 3000-7000Micro max 16000 max 22000Super ~ 25000 ~ 60000Ultra ~ 80000 ~ 600000
Coperchio del rotore (a tenuta drsquoaria)
Coperchio del tubo da centrifuga
Asse di rotazione
Rotori ad angolo fisso - hanno gli alloggiamenti per i tubi disposti circolarmente attorno allrsquoasse di rotazione ad un certo angolo prefissato che varia in genere tra 20deg e 40deg Quando le particelle sono proiettate contro le pareti scivolano verso il fondo con la formazione del pellet
Rotori oscillanti o ad angolo mobile - A riposo i tubi rimangono in
posizione orizzontale ma quando il rotore inizia a girare per effetto della
accelerazione centrifuga i tubi ruotano sui perni verso lrsquoesterno
disponendosi orizzontalmente I rotori oscillanti consentono una formazione
di bande di sedimento ben differenziate e di pellets piugrave uniformi ma hanno
una maggiore delicatezza rispetto ai rotori ad angolo fisso
Le tecniche centrifugative si possono suddividere in
generale in preparative e analitiche
Preparativa permette di separare e purificare cellule
intere organuli subcellulari e macromolecole biologiche
come acidi nucleici o proteine
Analitica permette invece di studiare le caratteristiche
di sedimentazione del campione e di determinarne il
grado di purezza o la massa molecolare
La centrifugazione differenziale egrave la tecnica piugrave usata per il
frazionamento cellulare cioegrave per lrsquoottenimento di preparazioni di
organelli da sottoporre poi a studio Ad esempio centrifugando un
omogenato cellulare per tempi relativamente brevi ed a velocitagrave
modeste saragrave possibile ottenere la sedimentazione dei nuclei ma non
degli altri organelli che hanno densitagrave eo dimensioni minori e che
rimarranno nel sovranatante Il sovranatante puograve essere
ulteriormente processato per ottenere altri tipi di particelle Mediante
lrsquoapplicazione ripetuta di questo procedimento con lrsquoaumento della
velocitagrave e del tempo di centrifugazione si puograve ottenere la successiva
sedimentazione di particelle sempre piugrave piccole
Centrifugazione differenziale
Separazione su gradiente di densitarsquo
GRADIETE
Campocentrifugo
campione
Il campione viene fatto stratificare su un gradiente pre-formato in una provetta mediante il mescolamento in proporzioni diverse di soluzioni a diversa densitagrave La densitarsquo massima non deve superare quella delle particelle piursquo dense da separare
Particelle a bassa densitarsquo
Particelle ad alta densitarsquo
Tecnica analitica e separativa basata sul movimento di particelle
elettricamente cariche immerse in un fluido per effetto di un campo elettrico
applicato mediante una coppia di elettrodi al fluido stesso
verso il catodo (particelle cariche positive= cationi)
verso lrsquoanodo (particelle cariche negative= anioni)
- +
+ + - +
- + - -
ElettroforesiElettroforesi
I fattori che influenzano la mobilitagrave di una molecola in un campo
elettrico comprendono la carica della molecola (q) il gradiente di
voltaggio del campo elettrico (E) la resistenza di attrito del mezzo
di supporto (f)
Mobilitagrave elettroforeticaMobilitagrave elettroforetica
La velocitagrave (v) di una molecola carica che si sposta in un campo
elettrico egrave data dunque dalla seguente equazione
v = Eq f
Comunemente egrave adoperato il termine mobilitagrave elettroforetica (μ)
dello ione che equivale alla velocitagrave dello ione diviso lrsquointensitagrave
del campo elettrico (vE)
Quando si applica una differenza di potenziale molecole con
carica elettrica totale differente inizieranno a separarsi in funzione
della loro mobilitagrave elettroforetica
Anche molecole con carica elettrica uguale ma con
dimensioni molecolari differenti si separeranno per effetto di
forze frizionali diverse
Apparecchiatura per elettroforesi
bullAlimentatore
elettrico
bullCella elettroforetica
bullsupporto
Per la maggior parte delle tecniche elettroforetiche si adoperano gel di
poliacrilammide o di agarosio
AcrilammideAcrilammide Bis-acrilammideBis-acrilammide
Materiali di supporto
I gel di poliacrilammide sono preparati facendo copolimerizzare monomeri
di acrilammide in presenza di piccole quantitagrave di NNrsquo-metilene
bisacrilammide (bis-acrilamide)
La bis-acrilammide composta da due molecole di acrilammide legate da
un gruppo metilene egrave utilizzata come agente in grado di formare legami
crociati (cross-linking agent)
Acrilammide
Il processo di polimerizzazione dellrsquoacrilammide egrave un tipico esempio di catalisi radicalica ed inizia con lrsquoaggiunta di ammonio persolfato e della base NNNrsquoNrsquo-tetrametilendiammina (TEMED) Il TEMED catalizza la decomposizione dello ione persolfato con la produzione del corrispondente radicale libero (cioegrave una molecola con un elettrone spaiato) nel modo seguente
TEMED (iniziatore)TEMED (iniziatore)
Lrsquoammonio persolfato egrave lrsquoestere disolfato
dellrsquoacqua ossigenata e omolisa rapidamente a
radicali instabili (radicali solforici)
Il TEMED egrave unrsquoammina terziaria che reagisce con questi radicali a
formare radicali liberi TEMED che a loro volta
reagiscono con lrsquoacrilammide inducendone
la polimerizzazione
Se rappresentiamo il radicale libero con R ed il monomero di acrilammide con M possiamo schematizzare la polimerizzazione nel modo seguente
R + M rarr RMRM + M rarr RMMRMM + M rarr RMMM ecc
In questo modo si formano lunghe catene di acrilammide tenute insieme
tra loro da legami crociati derivanti dallrsquoinserzione occasionale
allrsquointerno della catena di molecole di bis-acrilammide
AcrilammideAcrilammide bis-acrilammidebis-acrilammide
GEL DI POLIACRILAMMIDEGEL DI POLIACRILAMMIDE(molto idrofilico =gt(molto idrofilico =gt
trattiene grosse quantitagrave di acqua)trattiene grosse quantitagrave di acqua)
TEMED (iniziatore)TEMED (iniziatore)
(catalizzatore)(catalizzatore)
ElettroforesiElettroforesiDenaturante
nativa
Elettroforesi denaturante o SDS PAGEElettroforesi denaturante o SDS PAGE
Per semplificare lrsquoanalisi di miscele di proteine egrave possibile fare in modo che la separazione elettroforetica si basi solo sulle dimensioni delle catene polipeptidiche
Ciograve si ottiene denaturando le proteine con il detergente Sodio Dodecil Solfato (SDS) Tale detergente si lega con forza alle proteine le quali si ripiegano a formare delle bacchette estese rivestite di SDS
La separazione delle catene polipeptidiche denaturate e rivestite di detergente si baseragrave quasi esclusivamente sulle dimensioni delle molecole proteiche per cui proteine piugrave piccole si muovono piugrave rapidamente attraverso il gel mentre quelle con dimensioni maggiori sono piugrave rallentate e migrano piugrave lentamente
proteinaproteina
Sodio Dodecil SolfatoSodio Dodecil SolfatoCH3(CH2)10CH2OSO3
- Na+
ElettroforesiElettroforesi
Elettroforesi in condizioni native
Separazione di proteine preservando la loro attivitagrave biologica
Le proteine conservano la loro carica nativa si separano mediante
le loro differenti mobilitagrave elettroforetiche e gli effetti setaccio del gel
Esempio separazione dei complessi della catena respiratoria in un
gradiente lineare o esponenziale
SDS PAGE
I V III IV
Elettroforesi in condizioni native
I
V
III
II
IV
IsoelettrofocalizzazioneIsoelettrofocalizzazione
Separazione delle proteine in base al loro punto isoelettrico
In un gel viene creato un gradiente di pH mediante lrsquoaggiunta di
appropriati anfoliti
La miscela di proteine viene posta in un pozzetto sul gel e viene
applicato un campo elettrico Le proteine entrano nel gel e
migrano fino a che non raggiungono un pH equivalente al punto
isoelettrico
Le proteine con punti isoelettrici diversi si distribuiscono in punti
diversi nel gel
Analisi quantitativa delle proteine presenti nel campione di interesse
Determinazione del peso molecolare di proteine sconosciute
Analisi qualitativa delle proteine presenti nel campione di interesse (colorazione con Coomassie o nitrato drsquoargento o western-blotting)
Applicazioni dellrsquoSDS-PAGEApplicazioni dellrsquoSDS-PAGE
Tecniche di rivelazioneTecniche di rivelazione
Il gel egrave immerso in una soluzione che contiene Coomassie Brilliant Blue R-250 sciolto in acido acetico diluito e metanolo Rivela 01 g di proteina
Coomassie Brilliant BlueIl gel si colora con una miscela di sali drsquoargento e formaldeideGli ioni drsquoargento reagiscono con i gruppi basici e tiolici delle proteine 100 volte piugrave sensibile
Silver
Al termine della corsa elettroforetica le proteine sono trasferita su un
filtro di nitrocellulosa mediante una procedura definita elettroblotting Il gel e la nitrocellulosa sono posti in un apposito cestello a forma
di sandwich immerso in un tampone nel quale ci sono due elettrodi
paralleli La corrente in direzione perpendicolare al gel trasferisce le proteine
sul foglio di nitrocellulosa
St C1 C2 C3 C4 C5 C6
Elettroforesi delle sieroproteineElettroforesi delle sieroproteine
Il termine cromatografia indica un insieme di tecniche che hanno lo
scopo di separare una miscela nei suoi componenti per permetterne il
riconoscimento qualitativo e quantitativo
Queste tecniche sono basate sulla distribuzione differenziale dei vari
componenti fra due fasi una chiamata fase fissa o fase stazionaria e
lrsquoaltra chiamata fase mobile o eluente che fluisce in continuo attraverso
la fase fissa
Cromatografia
Le fasi essenziali di un processo cromatografico sono 3
Caricamento del campione o della miscela da analizzare in una zona
ristretta della fase stazionaria
Eluizione della miscela dalla fase stazionaria per effettuare la
separazione nei singoli componenti
Rivelazione dei composti separati
In base alla forma del letto cromatograficondashCromatografia su colonna (impaccata open-tubular)
ndashCromatografia planare (su carta su strato sottile)
In base allo stato fisico della fase mobilendashCromatografia Liquida (LC)ndashGascromatografia (GC)
In base al meccanismo di separazionendashScambio ionicondashEsclusionendashAffinitagrave
Forma del letto cromatografico
Cromatografia su colonna la fase
stazionaria egrave contenuta allrsquointerno
di una colonna cilindrica che puograve
riempire completamente (colonna
impaccata) oppure rivestirne la
superficie interna (colonna
tubulare)
Cromatografia planare la fase
stazionaria egrave distribuita su una
superficie piana che puograve essere un
supporto cartaceo (cromatografia su
carta PC) o una lastrina in vetro o
altri materiali (cromatografia su
strato sottile TLC)
Gel filtrazione o esclusione molecolare
Separa le proteine in base alle dimensioni la matrice presente
nella colonna egrave un polimero con molti legami crociati che
generano pori con un diametro specifico Le proteine piugrave grandi
potranno migrare nella colonna piugrave velocemente in quanto non
possono entrare nei pori dei granuli della matrice il loro
percorso saragrave quindi diretto verso il fondo della colonna Le
proteine piugrave piccole potranno invece entrare nei pori
allungando il percorso che devono compiere per arrivare al
fondo della colonna
La matrice solida della colonna egrave un polimero sintetico contenente
gruppi carichi (quelli con gruppi anionici sono detti scambiatori di
cationi mentre quelli con gruppi cationici sono detti scambiatori di
anioni)
Lrsquo affinitagrave delle singole proteine del campione per i gruppi carichi
sulla colonna dipende dal pH della soluzione (che determina lo
stato di ionizzazione delle proteine) e dalla concentrazione di sali
(in grado di competere con le cariche delle proteine)
La separazione puograve essere ottimizzata variando gradualmente il
pH o la concentrazione salina in modo da creare un gradiente di
pH o un gradiente salino
Scambio ionico
Cromatografia per affinitagrave
Separa le proteine in base alla loro specificitagrave di legame
Le proteine sono trattenute sulla colonna solo se sono in
grado di legarsi a uno specifico ligando ancorato alla matrice
solida
Dopo aver allontanato dalla colonna le proteine che non si
possono legare la proteina viene eluita usando una soluzione
contenente ligando libero
- Slide 1
- Slide 2
- Slide 3
- Slide 4
- Slide 5
- Slide 6
- Slide 7
- Slide 8
- Slide 9
- Slide 10
- Slide 11
- Slide 12
- Slide 13
- Slide 14
- Slide 15
- Slide 16
- Slide 17
- Slide 18
- Slide 19
- Slide 20
- Slide 21
- Slide 22
- Slide 23
- Slide 24
- Slide 25
- Slide 26
- Slide 27
- Slide 28
- Slide 29
- Slide 30
- Slide 31
- Slide 32
- Slide 33
- Slide 34
- Slide 35
- Slide 36
- Slide 37
- Slide 38
- Slide 39
- Slide 40
- Slide 41
- Slide 42
- Slide 43
- Slide 44
- Slide 45
- Slide 46
- Slide 47
- Slide 48
-

Esprimendo la velocitagrave angolare come rpm (= 2 RPM60) ed inglobando i termini noti in unrsquounica costante avremo alla fine la seguente equazione
RCF = 1119 x 10-5 (rpm)2 r
Quindi risulta che la RCF agente su una qualsiasi particella egrave funzione solo della velocitagrave di rotazione e della distanza della particella dallrsquoasse di rotazionePertanto particelle sottopose alla stessa RCF sedimenteranno con una velocitagrave che dipenderagrave essenzialmente dalla loro densitagrave
Centrifughe
bull Centrifuga da banco bull Ultracentrifuga
Centrifughe
RPM g
Da banco 4000-6000 3000-7000Micro max 16000 max 22000Super ~ 25000 ~ 60000Ultra ~ 80000 ~ 600000
Coperchio del rotore (a tenuta drsquoaria)
Coperchio del tubo da centrifuga
Asse di rotazione
Rotori ad angolo fisso - hanno gli alloggiamenti per i tubi disposti circolarmente attorno allrsquoasse di rotazione ad un certo angolo prefissato che varia in genere tra 20deg e 40deg Quando le particelle sono proiettate contro le pareti scivolano verso il fondo con la formazione del pellet
Rotori oscillanti o ad angolo mobile - A riposo i tubi rimangono in
posizione orizzontale ma quando il rotore inizia a girare per effetto della
accelerazione centrifuga i tubi ruotano sui perni verso lrsquoesterno
disponendosi orizzontalmente I rotori oscillanti consentono una formazione
di bande di sedimento ben differenziate e di pellets piugrave uniformi ma hanno
una maggiore delicatezza rispetto ai rotori ad angolo fisso
Le tecniche centrifugative si possono suddividere in
generale in preparative e analitiche
Preparativa permette di separare e purificare cellule
intere organuli subcellulari e macromolecole biologiche
come acidi nucleici o proteine
Analitica permette invece di studiare le caratteristiche
di sedimentazione del campione e di determinarne il
grado di purezza o la massa molecolare
La centrifugazione differenziale egrave la tecnica piugrave usata per il
frazionamento cellulare cioegrave per lrsquoottenimento di preparazioni di
organelli da sottoporre poi a studio Ad esempio centrifugando un
omogenato cellulare per tempi relativamente brevi ed a velocitagrave
modeste saragrave possibile ottenere la sedimentazione dei nuclei ma non
degli altri organelli che hanno densitagrave eo dimensioni minori e che
rimarranno nel sovranatante Il sovranatante puograve essere
ulteriormente processato per ottenere altri tipi di particelle Mediante
lrsquoapplicazione ripetuta di questo procedimento con lrsquoaumento della
velocitagrave e del tempo di centrifugazione si puograve ottenere la successiva
sedimentazione di particelle sempre piugrave piccole
Centrifugazione differenziale
Separazione su gradiente di densitarsquo
GRADIETE
Campocentrifugo
campione
Il campione viene fatto stratificare su un gradiente pre-formato in una provetta mediante il mescolamento in proporzioni diverse di soluzioni a diversa densitagrave La densitarsquo massima non deve superare quella delle particelle piursquo dense da separare
Particelle a bassa densitarsquo
Particelle ad alta densitarsquo
Tecnica analitica e separativa basata sul movimento di particelle
elettricamente cariche immerse in un fluido per effetto di un campo elettrico
applicato mediante una coppia di elettrodi al fluido stesso
verso il catodo (particelle cariche positive= cationi)
verso lrsquoanodo (particelle cariche negative= anioni)
- +
+ + - +
- + - -
ElettroforesiElettroforesi
I fattori che influenzano la mobilitagrave di una molecola in un campo
elettrico comprendono la carica della molecola (q) il gradiente di
voltaggio del campo elettrico (E) la resistenza di attrito del mezzo
di supporto (f)
Mobilitagrave elettroforeticaMobilitagrave elettroforetica
La velocitagrave (v) di una molecola carica che si sposta in un campo
elettrico egrave data dunque dalla seguente equazione
v = Eq f
Comunemente egrave adoperato il termine mobilitagrave elettroforetica (μ)
dello ione che equivale alla velocitagrave dello ione diviso lrsquointensitagrave
del campo elettrico (vE)
Quando si applica una differenza di potenziale molecole con
carica elettrica totale differente inizieranno a separarsi in funzione
della loro mobilitagrave elettroforetica
Anche molecole con carica elettrica uguale ma con
dimensioni molecolari differenti si separeranno per effetto di
forze frizionali diverse
Apparecchiatura per elettroforesi
bullAlimentatore
elettrico
bullCella elettroforetica
bullsupporto
Per la maggior parte delle tecniche elettroforetiche si adoperano gel di
poliacrilammide o di agarosio
AcrilammideAcrilammide Bis-acrilammideBis-acrilammide
Materiali di supporto
I gel di poliacrilammide sono preparati facendo copolimerizzare monomeri
di acrilammide in presenza di piccole quantitagrave di NNrsquo-metilene
bisacrilammide (bis-acrilamide)
La bis-acrilammide composta da due molecole di acrilammide legate da
un gruppo metilene egrave utilizzata come agente in grado di formare legami
crociati (cross-linking agent)
Acrilammide
Il processo di polimerizzazione dellrsquoacrilammide egrave un tipico esempio di catalisi radicalica ed inizia con lrsquoaggiunta di ammonio persolfato e della base NNNrsquoNrsquo-tetrametilendiammina (TEMED) Il TEMED catalizza la decomposizione dello ione persolfato con la produzione del corrispondente radicale libero (cioegrave una molecola con un elettrone spaiato) nel modo seguente
TEMED (iniziatore)TEMED (iniziatore)
Lrsquoammonio persolfato egrave lrsquoestere disolfato
dellrsquoacqua ossigenata e omolisa rapidamente a
radicali instabili (radicali solforici)
Il TEMED egrave unrsquoammina terziaria che reagisce con questi radicali a
formare radicali liberi TEMED che a loro volta
reagiscono con lrsquoacrilammide inducendone
la polimerizzazione
Se rappresentiamo il radicale libero con R ed il monomero di acrilammide con M possiamo schematizzare la polimerizzazione nel modo seguente
R + M rarr RMRM + M rarr RMMRMM + M rarr RMMM ecc
In questo modo si formano lunghe catene di acrilammide tenute insieme
tra loro da legami crociati derivanti dallrsquoinserzione occasionale
allrsquointerno della catena di molecole di bis-acrilammide
AcrilammideAcrilammide bis-acrilammidebis-acrilammide
GEL DI POLIACRILAMMIDEGEL DI POLIACRILAMMIDE(molto idrofilico =gt(molto idrofilico =gt
trattiene grosse quantitagrave di acqua)trattiene grosse quantitagrave di acqua)
TEMED (iniziatore)TEMED (iniziatore)
(catalizzatore)(catalizzatore)
ElettroforesiElettroforesiDenaturante
nativa
Elettroforesi denaturante o SDS PAGEElettroforesi denaturante o SDS PAGE
Per semplificare lrsquoanalisi di miscele di proteine egrave possibile fare in modo che la separazione elettroforetica si basi solo sulle dimensioni delle catene polipeptidiche
Ciograve si ottiene denaturando le proteine con il detergente Sodio Dodecil Solfato (SDS) Tale detergente si lega con forza alle proteine le quali si ripiegano a formare delle bacchette estese rivestite di SDS
La separazione delle catene polipeptidiche denaturate e rivestite di detergente si baseragrave quasi esclusivamente sulle dimensioni delle molecole proteiche per cui proteine piugrave piccole si muovono piugrave rapidamente attraverso il gel mentre quelle con dimensioni maggiori sono piugrave rallentate e migrano piugrave lentamente
proteinaproteina
Sodio Dodecil SolfatoSodio Dodecil SolfatoCH3(CH2)10CH2OSO3
- Na+
ElettroforesiElettroforesi
Elettroforesi in condizioni native
Separazione di proteine preservando la loro attivitagrave biologica
Le proteine conservano la loro carica nativa si separano mediante
le loro differenti mobilitagrave elettroforetiche e gli effetti setaccio del gel
Esempio separazione dei complessi della catena respiratoria in un
gradiente lineare o esponenziale
SDS PAGE
I V III IV
Elettroforesi in condizioni native
I
V
III
II
IV
IsoelettrofocalizzazioneIsoelettrofocalizzazione
Separazione delle proteine in base al loro punto isoelettrico
In un gel viene creato un gradiente di pH mediante lrsquoaggiunta di
appropriati anfoliti
La miscela di proteine viene posta in un pozzetto sul gel e viene
applicato un campo elettrico Le proteine entrano nel gel e
migrano fino a che non raggiungono un pH equivalente al punto
isoelettrico
Le proteine con punti isoelettrici diversi si distribuiscono in punti
diversi nel gel
Analisi quantitativa delle proteine presenti nel campione di interesse
Determinazione del peso molecolare di proteine sconosciute
Analisi qualitativa delle proteine presenti nel campione di interesse (colorazione con Coomassie o nitrato drsquoargento o western-blotting)
Applicazioni dellrsquoSDS-PAGEApplicazioni dellrsquoSDS-PAGE
Tecniche di rivelazioneTecniche di rivelazione
Il gel egrave immerso in una soluzione che contiene Coomassie Brilliant Blue R-250 sciolto in acido acetico diluito e metanolo Rivela 01 g di proteina
Coomassie Brilliant BlueIl gel si colora con una miscela di sali drsquoargento e formaldeideGli ioni drsquoargento reagiscono con i gruppi basici e tiolici delle proteine 100 volte piugrave sensibile
Silver
Al termine della corsa elettroforetica le proteine sono trasferita su un
filtro di nitrocellulosa mediante una procedura definita elettroblotting Il gel e la nitrocellulosa sono posti in un apposito cestello a forma
di sandwich immerso in un tampone nel quale ci sono due elettrodi
paralleli La corrente in direzione perpendicolare al gel trasferisce le proteine
sul foglio di nitrocellulosa
St C1 C2 C3 C4 C5 C6
Elettroforesi delle sieroproteineElettroforesi delle sieroproteine
Il termine cromatografia indica un insieme di tecniche che hanno lo
scopo di separare una miscela nei suoi componenti per permetterne il
riconoscimento qualitativo e quantitativo
Queste tecniche sono basate sulla distribuzione differenziale dei vari
componenti fra due fasi una chiamata fase fissa o fase stazionaria e
lrsquoaltra chiamata fase mobile o eluente che fluisce in continuo attraverso
la fase fissa
Cromatografia
Le fasi essenziali di un processo cromatografico sono 3
Caricamento del campione o della miscela da analizzare in una zona
ristretta della fase stazionaria
Eluizione della miscela dalla fase stazionaria per effettuare la
separazione nei singoli componenti
Rivelazione dei composti separati
In base alla forma del letto cromatograficondashCromatografia su colonna (impaccata open-tubular)
ndashCromatografia planare (su carta su strato sottile)
In base allo stato fisico della fase mobilendashCromatografia Liquida (LC)ndashGascromatografia (GC)
In base al meccanismo di separazionendashScambio ionicondashEsclusionendashAffinitagrave
Forma del letto cromatografico
Cromatografia su colonna la fase
stazionaria egrave contenuta allrsquointerno
di una colonna cilindrica che puograve
riempire completamente (colonna
impaccata) oppure rivestirne la
superficie interna (colonna
tubulare)
Cromatografia planare la fase
stazionaria egrave distribuita su una
superficie piana che puograve essere un
supporto cartaceo (cromatografia su
carta PC) o una lastrina in vetro o
altri materiali (cromatografia su
strato sottile TLC)
Gel filtrazione o esclusione molecolare
Separa le proteine in base alle dimensioni la matrice presente
nella colonna egrave un polimero con molti legami crociati che
generano pori con un diametro specifico Le proteine piugrave grandi
potranno migrare nella colonna piugrave velocemente in quanto non
possono entrare nei pori dei granuli della matrice il loro
percorso saragrave quindi diretto verso il fondo della colonna Le
proteine piugrave piccole potranno invece entrare nei pori
allungando il percorso che devono compiere per arrivare al
fondo della colonna
La matrice solida della colonna egrave un polimero sintetico contenente
gruppi carichi (quelli con gruppi anionici sono detti scambiatori di
cationi mentre quelli con gruppi cationici sono detti scambiatori di
anioni)
Lrsquo affinitagrave delle singole proteine del campione per i gruppi carichi
sulla colonna dipende dal pH della soluzione (che determina lo
stato di ionizzazione delle proteine) e dalla concentrazione di sali
(in grado di competere con le cariche delle proteine)
La separazione puograve essere ottimizzata variando gradualmente il
pH o la concentrazione salina in modo da creare un gradiente di
pH o un gradiente salino
Scambio ionico
Cromatografia per affinitagrave
Separa le proteine in base alla loro specificitagrave di legame
Le proteine sono trattenute sulla colonna solo se sono in
grado di legarsi a uno specifico ligando ancorato alla matrice
solida
Dopo aver allontanato dalla colonna le proteine che non si
possono legare la proteina viene eluita usando una soluzione
contenente ligando libero
- Slide 1
- Slide 2
- Slide 3
- Slide 4
- Slide 5
- Slide 6
- Slide 7
- Slide 8
- Slide 9
- Slide 10
- Slide 11
- Slide 12
- Slide 13
- Slide 14
- Slide 15
- Slide 16
- Slide 17
- Slide 18
- Slide 19
- Slide 20
- Slide 21
- Slide 22
- Slide 23
- Slide 24
- Slide 25
- Slide 26
- Slide 27
- Slide 28
- Slide 29
- Slide 30
- Slide 31
- Slide 32
- Slide 33
- Slide 34
- Slide 35
- Slide 36
- Slide 37
- Slide 38
- Slide 39
- Slide 40
- Slide 41
- Slide 42
- Slide 43
- Slide 44
- Slide 45
- Slide 46
- Slide 47
- Slide 48
-

Centrifughe
bull Centrifuga da banco bull Ultracentrifuga
Centrifughe
RPM g
Da banco 4000-6000 3000-7000Micro max 16000 max 22000Super ~ 25000 ~ 60000Ultra ~ 80000 ~ 600000
Coperchio del rotore (a tenuta drsquoaria)
Coperchio del tubo da centrifuga
Asse di rotazione
Rotori ad angolo fisso - hanno gli alloggiamenti per i tubi disposti circolarmente attorno allrsquoasse di rotazione ad un certo angolo prefissato che varia in genere tra 20deg e 40deg Quando le particelle sono proiettate contro le pareti scivolano verso il fondo con la formazione del pellet
Rotori oscillanti o ad angolo mobile - A riposo i tubi rimangono in
posizione orizzontale ma quando il rotore inizia a girare per effetto della
accelerazione centrifuga i tubi ruotano sui perni verso lrsquoesterno
disponendosi orizzontalmente I rotori oscillanti consentono una formazione
di bande di sedimento ben differenziate e di pellets piugrave uniformi ma hanno
una maggiore delicatezza rispetto ai rotori ad angolo fisso
Le tecniche centrifugative si possono suddividere in
generale in preparative e analitiche
Preparativa permette di separare e purificare cellule
intere organuli subcellulari e macromolecole biologiche
come acidi nucleici o proteine
Analitica permette invece di studiare le caratteristiche
di sedimentazione del campione e di determinarne il
grado di purezza o la massa molecolare
La centrifugazione differenziale egrave la tecnica piugrave usata per il
frazionamento cellulare cioegrave per lrsquoottenimento di preparazioni di
organelli da sottoporre poi a studio Ad esempio centrifugando un
omogenato cellulare per tempi relativamente brevi ed a velocitagrave
modeste saragrave possibile ottenere la sedimentazione dei nuclei ma non
degli altri organelli che hanno densitagrave eo dimensioni minori e che
rimarranno nel sovranatante Il sovranatante puograve essere
ulteriormente processato per ottenere altri tipi di particelle Mediante
lrsquoapplicazione ripetuta di questo procedimento con lrsquoaumento della
velocitagrave e del tempo di centrifugazione si puograve ottenere la successiva
sedimentazione di particelle sempre piugrave piccole
Centrifugazione differenziale
Separazione su gradiente di densitarsquo
GRADIETE
Campocentrifugo
campione
Il campione viene fatto stratificare su un gradiente pre-formato in una provetta mediante il mescolamento in proporzioni diverse di soluzioni a diversa densitagrave La densitarsquo massima non deve superare quella delle particelle piursquo dense da separare
Particelle a bassa densitarsquo
Particelle ad alta densitarsquo
Tecnica analitica e separativa basata sul movimento di particelle
elettricamente cariche immerse in un fluido per effetto di un campo elettrico
applicato mediante una coppia di elettrodi al fluido stesso
verso il catodo (particelle cariche positive= cationi)
verso lrsquoanodo (particelle cariche negative= anioni)
- +
+ + - +
- + - -
ElettroforesiElettroforesi
I fattori che influenzano la mobilitagrave di una molecola in un campo
elettrico comprendono la carica della molecola (q) il gradiente di
voltaggio del campo elettrico (E) la resistenza di attrito del mezzo
di supporto (f)
Mobilitagrave elettroforeticaMobilitagrave elettroforetica
La velocitagrave (v) di una molecola carica che si sposta in un campo
elettrico egrave data dunque dalla seguente equazione
v = Eq f
Comunemente egrave adoperato il termine mobilitagrave elettroforetica (μ)
dello ione che equivale alla velocitagrave dello ione diviso lrsquointensitagrave
del campo elettrico (vE)
Quando si applica una differenza di potenziale molecole con
carica elettrica totale differente inizieranno a separarsi in funzione
della loro mobilitagrave elettroforetica
Anche molecole con carica elettrica uguale ma con
dimensioni molecolari differenti si separeranno per effetto di
forze frizionali diverse
Apparecchiatura per elettroforesi
bullAlimentatore
elettrico
bullCella elettroforetica
bullsupporto
Per la maggior parte delle tecniche elettroforetiche si adoperano gel di
poliacrilammide o di agarosio
AcrilammideAcrilammide Bis-acrilammideBis-acrilammide
Materiali di supporto
I gel di poliacrilammide sono preparati facendo copolimerizzare monomeri
di acrilammide in presenza di piccole quantitagrave di NNrsquo-metilene
bisacrilammide (bis-acrilamide)
La bis-acrilammide composta da due molecole di acrilammide legate da
un gruppo metilene egrave utilizzata come agente in grado di formare legami
crociati (cross-linking agent)
Acrilammide
Il processo di polimerizzazione dellrsquoacrilammide egrave un tipico esempio di catalisi radicalica ed inizia con lrsquoaggiunta di ammonio persolfato e della base NNNrsquoNrsquo-tetrametilendiammina (TEMED) Il TEMED catalizza la decomposizione dello ione persolfato con la produzione del corrispondente radicale libero (cioegrave una molecola con un elettrone spaiato) nel modo seguente
TEMED (iniziatore)TEMED (iniziatore)
Lrsquoammonio persolfato egrave lrsquoestere disolfato
dellrsquoacqua ossigenata e omolisa rapidamente a
radicali instabili (radicali solforici)
Il TEMED egrave unrsquoammina terziaria che reagisce con questi radicali a
formare radicali liberi TEMED che a loro volta
reagiscono con lrsquoacrilammide inducendone
la polimerizzazione
Se rappresentiamo il radicale libero con R ed il monomero di acrilammide con M possiamo schematizzare la polimerizzazione nel modo seguente
R + M rarr RMRM + M rarr RMMRMM + M rarr RMMM ecc
In questo modo si formano lunghe catene di acrilammide tenute insieme
tra loro da legami crociati derivanti dallrsquoinserzione occasionale
allrsquointerno della catena di molecole di bis-acrilammide
AcrilammideAcrilammide bis-acrilammidebis-acrilammide
GEL DI POLIACRILAMMIDEGEL DI POLIACRILAMMIDE(molto idrofilico =gt(molto idrofilico =gt
trattiene grosse quantitagrave di acqua)trattiene grosse quantitagrave di acqua)
TEMED (iniziatore)TEMED (iniziatore)
(catalizzatore)(catalizzatore)
ElettroforesiElettroforesiDenaturante
nativa
Elettroforesi denaturante o SDS PAGEElettroforesi denaturante o SDS PAGE
Per semplificare lrsquoanalisi di miscele di proteine egrave possibile fare in modo che la separazione elettroforetica si basi solo sulle dimensioni delle catene polipeptidiche
Ciograve si ottiene denaturando le proteine con il detergente Sodio Dodecil Solfato (SDS) Tale detergente si lega con forza alle proteine le quali si ripiegano a formare delle bacchette estese rivestite di SDS
La separazione delle catene polipeptidiche denaturate e rivestite di detergente si baseragrave quasi esclusivamente sulle dimensioni delle molecole proteiche per cui proteine piugrave piccole si muovono piugrave rapidamente attraverso il gel mentre quelle con dimensioni maggiori sono piugrave rallentate e migrano piugrave lentamente
proteinaproteina
Sodio Dodecil SolfatoSodio Dodecil SolfatoCH3(CH2)10CH2OSO3
- Na+
ElettroforesiElettroforesi
Elettroforesi in condizioni native
Separazione di proteine preservando la loro attivitagrave biologica
Le proteine conservano la loro carica nativa si separano mediante
le loro differenti mobilitagrave elettroforetiche e gli effetti setaccio del gel
Esempio separazione dei complessi della catena respiratoria in un
gradiente lineare o esponenziale
SDS PAGE
I V III IV
Elettroforesi in condizioni native
I
V
III
II
IV
IsoelettrofocalizzazioneIsoelettrofocalizzazione
Separazione delle proteine in base al loro punto isoelettrico
In un gel viene creato un gradiente di pH mediante lrsquoaggiunta di
appropriati anfoliti
La miscela di proteine viene posta in un pozzetto sul gel e viene
applicato un campo elettrico Le proteine entrano nel gel e
migrano fino a che non raggiungono un pH equivalente al punto
isoelettrico
Le proteine con punti isoelettrici diversi si distribuiscono in punti
diversi nel gel
Analisi quantitativa delle proteine presenti nel campione di interesse
Determinazione del peso molecolare di proteine sconosciute
Analisi qualitativa delle proteine presenti nel campione di interesse (colorazione con Coomassie o nitrato drsquoargento o western-blotting)
Applicazioni dellrsquoSDS-PAGEApplicazioni dellrsquoSDS-PAGE
Tecniche di rivelazioneTecniche di rivelazione
Il gel egrave immerso in una soluzione che contiene Coomassie Brilliant Blue R-250 sciolto in acido acetico diluito e metanolo Rivela 01 g di proteina
Coomassie Brilliant BlueIl gel si colora con una miscela di sali drsquoargento e formaldeideGli ioni drsquoargento reagiscono con i gruppi basici e tiolici delle proteine 100 volte piugrave sensibile
Silver
Al termine della corsa elettroforetica le proteine sono trasferita su un
filtro di nitrocellulosa mediante una procedura definita elettroblotting Il gel e la nitrocellulosa sono posti in un apposito cestello a forma
di sandwich immerso in un tampone nel quale ci sono due elettrodi
paralleli La corrente in direzione perpendicolare al gel trasferisce le proteine
sul foglio di nitrocellulosa
St C1 C2 C3 C4 C5 C6
Elettroforesi delle sieroproteineElettroforesi delle sieroproteine
Il termine cromatografia indica un insieme di tecniche che hanno lo
scopo di separare una miscela nei suoi componenti per permetterne il
riconoscimento qualitativo e quantitativo
Queste tecniche sono basate sulla distribuzione differenziale dei vari
componenti fra due fasi una chiamata fase fissa o fase stazionaria e
lrsquoaltra chiamata fase mobile o eluente che fluisce in continuo attraverso
la fase fissa
Cromatografia
Le fasi essenziali di un processo cromatografico sono 3
Caricamento del campione o della miscela da analizzare in una zona
ristretta della fase stazionaria
Eluizione della miscela dalla fase stazionaria per effettuare la
separazione nei singoli componenti
Rivelazione dei composti separati
In base alla forma del letto cromatograficondashCromatografia su colonna (impaccata open-tubular)
ndashCromatografia planare (su carta su strato sottile)
In base allo stato fisico della fase mobilendashCromatografia Liquida (LC)ndashGascromatografia (GC)
In base al meccanismo di separazionendashScambio ionicondashEsclusionendashAffinitagrave
Forma del letto cromatografico
Cromatografia su colonna la fase
stazionaria egrave contenuta allrsquointerno
di una colonna cilindrica che puograve
riempire completamente (colonna
impaccata) oppure rivestirne la
superficie interna (colonna
tubulare)
Cromatografia planare la fase
stazionaria egrave distribuita su una
superficie piana che puograve essere un
supporto cartaceo (cromatografia su
carta PC) o una lastrina in vetro o
altri materiali (cromatografia su
strato sottile TLC)
Gel filtrazione o esclusione molecolare
Separa le proteine in base alle dimensioni la matrice presente
nella colonna egrave un polimero con molti legami crociati che
generano pori con un diametro specifico Le proteine piugrave grandi
potranno migrare nella colonna piugrave velocemente in quanto non
possono entrare nei pori dei granuli della matrice il loro
percorso saragrave quindi diretto verso il fondo della colonna Le
proteine piugrave piccole potranno invece entrare nei pori
allungando il percorso che devono compiere per arrivare al
fondo della colonna
La matrice solida della colonna egrave un polimero sintetico contenente
gruppi carichi (quelli con gruppi anionici sono detti scambiatori di
cationi mentre quelli con gruppi cationici sono detti scambiatori di
anioni)
Lrsquo affinitagrave delle singole proteine del campione per i gruppi carichi
sulla colonna dipende dal pH della soluzione (che determina lo
stato di ionizzazione delle proteine) e dalla concentrazione di sali
(in grado di competere con le cariche delle proteine)
La separazione puograve essere ottimizzata variando gradualmente il
pH o la concentrazione salina in modo da creare un gradiente di
pH o un gradiente salino
Scambio ionico
Cromatografia per affinitagrave
Separa le proteine in base alla loro specificitagrave di legame
Le proteine sono trattenute sulla colonna solo se sono in
grado di legarsi a uno specifico ligando ancorato alla matrice
solida
Dopo aver allontanato dalla colonna le proteine che non si
possono legare la proteina viene eluita usando una soluzione
contenente ligando libero
- Slide 1
- Slide 2
- Slide 3
- Slide 4
- Slide 5
- Slide 6
- Slide 7
- Slide 8
- Slide 9
- Slide 10
- Slide 11
- Slide 12
- Slide 13
- Slide 14
- Slide 15
- Slide 16
- Slide 17
- Slide 18
- Slide 19
- Slide 20
- Slide 21
- Slide 22
- Slide 23
- Slide 24
- Slide 25
- Slide 26
- Slide 27
- Slide 28
- Slide 29
- Slide 30
- Slide 31
- Slide 32
- Slide 33
- Slide 34
- Slide 35
- Slide 36
- Slide 37
- Slide 38
- Slide 39
- Slide 40
- Slide 41
- Slide 42
- Slide 43
- Slide 44
- Slide 45
- Slide 46
- Slide 47
- Slide 48
-

Centrifughe
RPM g
Da banco 4000-6000 3000-7000Micro max 16000 max 22000Super ~ 25000 ~ 60000Ultra ~ 80000 ~ 600000
Coperchio del rotore (a tenuta drsquoaria)
Coperchio del tubo da centrifuga
Asse di rotazione
Rotori ad angolo fisso - hanno gli alloggiamenti per i tubi disposti circolarmente attorno allrsquoasse di rotazione ad un certo angolo prefissato che varia in genere tra 20deg e 40deg Quando le particelle sono proiettate contro le pareti scivolano verso il fondo con la formazione del pellet
Rotori oscillanti o ad angolo mobile - A riposo i tubi rimangono in
posizione orizzontale ma quando il rotore inizia a girare per effetto della
accelerazione centrifuga i tubi ruotano sui perni verso lrsquoesterno
disponendosi orizzontalmente I rotori oscillanti consentono una formazione
di bande di sedimento ben differenziate e di pellets piugrave uniformi ma hanno
una maggiore delicatezza rispetto ai rotori ad angolo fisso
Le tecniche centrifugative si possono suddividere in
generale in preparative e analitiche
Preparativa permette di separare e purificare cellule
intere organuli subcellulari e macromolecole biologiche
come acidi nucleici o proteine
Analitica permette invece di studiare le caratteristiche
di sedimentazione del campione e di determinarne il
grado di purezza o la massa molecolare
La centrifugazione differenziale egrave la tecnica piugrave usata per il
frazionamento cellulare cioegrave per lrsquoottenimento di preparazioni di
organelli da sottoporre poi a studio Ad esempio centrifugando un
omogenato cellulare per tempi relativamente brevi ed a velocitagrave
modeste saragrave possibile ottenere la sedimentazione dei nuclei ma non
degli altri organelli che hanno densitagrave eo dimensioni minori e che
rimarranno nel sovranatante Il sovranatante puograve essere
ulteriormente processato per ottenere altri tipi di particelle Mediante
lrsquoapplicazione ripetuta di questo procedimento con lrsquoaumento della
velocitagrave e del tempo di centrifugazione si puograve ottenere la successiva
sedimentazione di particelle sempre piugrave piccole
Centrifugazione differenziale
Separazione su gradiente di densitarsquo
GRADIETE
Campocentrifugo
campione
Il campione viene fatto stratificare su un gradiente pre-formato in una provetta mediante il mescolamento in proporzioni diverse di soluzioni a diversa densitagrave La densitarsquo massima non deve superare quella delle particelle piursquo dense da separare
Particelle a bassa densitarsquo
Particelle ad alta densitarsquo
Tecnica analitica e separativa basata sul movimento di particelle
elettricamente cariche immerse in un fluido per effetto di un campo elettrico
applicato mediante una coppia di elettrodi al fluido stesso
verso il catodo (particelle cariche positive= cationi)
verso lrsquoanodo (particelle cariche negative= anioni)
- +
+ + - +
- + - -
ElettroforesiElettroforesi
I fattori che influenzano la mobilitagrave di una molecola in un campo
elettrico comprendono la carica della molecola (q) il gradiente di
voltaggio del campo elettrico (E) la resistenza di attrito del mezzo
di supporto (f)
Mobilitagrave elettroforeticaMobilitagrave elettroforetica
La velocitagrave (v) di una molecola carica che si sposta in un campo
elettrico egrave data dunque dalla seguente equazione
v = Eq f
Comunemente egrave adoperato il termine mobilitagrave elettroforetica (μ)
dello ione che equivale alla velocitagrave dello ione diviso lrsquointensitagrave
del campo elettrico (vE)
Quando si applica una differenza di potenziale molecole con
carica elettrica totale differente inizieranno a separarsi in funzione
della loro mobilitagrave elettroforetica
Anche molecole con carica elettrica uguale ma con
dimensioni molecolari differenti si separeranno per effetto di
forze frizionali diverse
Apparecchiatura per elettroforesi
bullAlimentatore
elettrico
bullCella elettroforetica
bullsupporto
Per la maggior parte delle tecniche elettroforetiche si adoperano gel di
poliacrilammide o di agarosio
AcrilammideAcrilammide Bis-acrilammideBis-acrilammide
Materiali di supporto
I gel di poliacrilammide sono preparati facendo copolimerizzare monomeri
di acrilammide in presenza di piccole quantitagrave di NNrsquo-metilene
bisacrilammide (bis-acrilamide)
La bis-acrilammide composta da due molecole di acrilammide legate da
un gruppo metilene egrave utilizzata come agente in grado di formare legami
crociati (cross-linking agent)
Acrilammide
Il processo di polimerizzazione dellrsquoacrilammide egrave un tipico esempio di catalisi radicalica ed inizia con lrsquoaggiunta di ammonio persolfato e della base NNNrsquoNrsquo-tetrametilendiammina (TEMED) Il TEMED catalizza la decomposizione dello ione persolfato con la produzione del corrispondente radicale libero (cioegrave una molecola con un elettrone spaiato) nel modo seguente
TEMED (iniziatore)TEMED (iniziatore)
Lrsquoammonio persolfato egrave lrsquoestere disolfato
dellrsquoacqua ossigenata e omolisa rapidamente a
radicali instabili (radicali solforici)
Il TEMED egrave unrsquoammina terziaria che reagisce con questi radicali a
formare radicali liberi TEMED che a loro volta
reagiscono con lrsquoacrilammide inducendone
la polimerizzazione
Se rappresentiamo il radicale libero con R ed il monomero di acrilammide con M possiamo schematizzare la polimerizzazione nel modo seguente
R + M rarr RMRM + M rarr RMMRMM + M rarr RMMM ecc
In questo modo si formano lunghe catene di acrilammide tenute insieme
tra loro da legami crociati derivanti dallrsquoinserzione occasionale
allrsquointerno della catena di molecole di bis-acrilammide
AcrilammideAcrilammide bis-acrilammidebis-acrilammide
GEL DI POLIACRILAMMIDEGEL DI POLIACRILAMMIDE(molto idrofilico =gt(molto idrofilico =gt
trattiene grosse quantitagrave di acqua)trattiene grosse quantitagrave di acqua)
TEMED (iniziatore)TEMED (iniziatore)
(catalizzatore)(catalizzatore)
ElettroforesiElettroforesiDenaturante
nativa
Elettroforesi denaturante o SDS PAGEElettroforesi denaturante o SDS PAGE
Per semplificare lrsquoanalisi di miscele di proteine egrave possibile fare in modo che la separazione elettroforetica si basi solo sulle dimensioni delle catene polipeptidiche
Ciograve si ottiene denaturando le proteine con il detergente Sodio Dodecil Solfato (SDS) Tale detergente si lega con forza alle proteine le quali si ripiegano a formare delle bacchette estese rivestite di SDS
La separazione delle catene polipeptidiche denaturate e rivestite di detergente si baseragrave quasi esclusivamente sulle dimensioni delle molecole proteiche per cui proteine piugrave piccole si muovono piugrave rapidamente attraverso il gel mentre quelle con dimensioni maggiori sono piugrave rallentate e migrano piugrave lentamente
proteinaproteina
Sodio Dodecil SolfatoSodio Dodecil SolfatoCH3(CH2)10CH2OSO3
- Na+
ElettroforesiElettroforesi
Elettroforesi in condizioni native
Separazione di proteine preservando la loro attivitagrave biologica
Le proteine conservano la loro carica nativa si separano mediante
le loro differenti mobilitagrave elettroforetiche e gli effetti setaccio del gel
Esempio separazione dei complessi della catena respiratoria in un
gradiente lineare o esponenziale
SDS PAGE
I V III IV
Elettroforesi in condizioni native
I
V
III
II
IV
IsoelettrofocalizzazioneIsoelettrofocalizzazione
Separazione delle proteine in base al loro punto isoelettrico
In un gel viene creato un gradiente di pH mediante lrsquoaggiunta di
appropriati anfoliti
La miscela di proteine viene posta in un pozzetto sul gel e viene
applicato un campo elettrico Le proteine entrano nel gel e
migrano fino a che non raggiungono un pH equivalente al punto
isoelettrico
Le proteine con punti isoelettrici diversi si distribuiscono in punti
diversi nel gel
Analisi quantitativa delle proteine presenti nel campione di interesse
Determinazione del peso molecolare di proteine sconosciute
Analisi qualitativa delle proteine presenti nel campione di interesse (colorazione con Coomassie o nitrato drsquoargento o western-blotting)
Applicazioni dellrsquoSDS-PAGEApplicazioni dellrsquoSDS-PAGE
Tecniche di rivelazioneTecniche di rivelazione
Il gel egrave immerso in una soluzione che contiene Coomassie Brilliant Blue R-250 sciolto in acido acetico diluito e metanolo Rivela 01 g di proteina
Coomassie Brilliant BlueIl gel si colora con una miscela di sali drsquoargento e formaldeideGli ioni drsquoargento reagiscono con i gruppi basici e tiolici delle proteine 100 volte piugrave sensibile
Silver
Al termine della corsa elettroforetica le proteine sono trasferita su un
filtro di nitrocellulosa mediante una procedura definita elettroblotting Il gel e la nitrocellulosa sono posti in un apposito cestello a forma
di sandwich immerso in un tampone nel quale ci sono due elettrodi
paralleli La corrente in direzione perpendicolare al gel trasferisce le proteine
sul foglio di nitrocellulosa
St C1 C2 C3 C4 C5 C6
Elettroforesi delle sieroproteineElettroforesi delle sieroproteine
Il termine cromatografia indica un insieme di tecniche che hanno lo
scopo di separare una miscela nei suoi componenti per permetterne il
riconoscimento qualitativo e quantitativo
Queste tecniche sono basate sulla distribuzione differenziale dei vari
componenti fra due fasi una chiamata fase fissa o fase stazionaria e
lrsquoaltra chiamata fase mobile o eluente che fluisce in continuo attraverso
la fase fissa
Cromatografia
Le fasi essenziali di un processo cromatografico sono 3
Caricamento del campione o della miscela da analizzare in una zona
ristretta della fase stazionaria
Eluizione della miscela dalla fase stazionaria per effettuare la
separazione nei singoli componenti
Rivelazione dei composti separati
In base alla forma del letto cromatograficondashCromatografia su colonna (impaccata open-tubular)
ndashCromatografia planare (su carta su strato sottile)
In base allo stato fisico della fase mobilendashCromatografia Liquida (LC)ndashGascromatografia (GC)
In base al meccanismo di separazionendashScambio ionicondashEsclusionendashAffinitagrave
Forma del letto cromatografico
Cromatografia su colonna la fase
stazionaria egrave contenuta allrsquointerno
di una colonna cilindrica che puograve
riempire completamente (colonna
impaccata) oppure rivestirne la
superficie interna (colonna
tubulare)
Cromatografia planare la fase
stazionaria egrave distribuita su una
superficie piana che puograve essere un
supporto cartaceo (cromatografia su
carta PC) o una lastrina in vetro o
altri materiali (cromatografia su
strato sottile TLC)
Gel filtrazione o esclusione molecolare
Separa le proteine in base alle dimensioni la matrice presente
nella colonna egrave un polimero con molti legami crociati che
generano pori con un diametro specifico Le proteine piugrave grandi
potranno migrare nella colonna piugrave velocemente in quanto non
possono entrare nei pori dei granuli della matrice il loro
percorso saragrave quindi diretto verso il fondo della colonna Le
proteine piugrave piccole potranno invece entrare nei pori
allungando il percorso che devono compiere per arrivare al
fondo della colonna
La matrice solida della colonna egrave un polimero sintetico contenente
gruppi carichi (quelli con gruppi anionici sono detti scambiatori di
cationi mentre quelli con gruppi cationici sono detti scambiatori di
anioni)
Lrsquo affinitagrave delle singole proteine del campione per i gruppi carichi
sulla colonna dipende dal pH della soluzione (che determina lo
stato di ionizzazione delle proteine) e dalla concentrazione di sali
(in grado di competere con le cariche delle proteine)
La separazione puograve essere ottimizzata variando gradualmente il
pH o la concentrazione salina in modo da creare un gradiente di
pH o un gradiente salino
Scambio ionico
Cromatografia per affinitagrave
Separa le proteine in base alla loro specificitagrave di legame
Le proteine sono trattenute sulla colonna solo se sono in
grado di legarsi a uno specifico ligando ancorato alla matrice
solida
Dopo aver allontanato dalla colonna le proteine che non si
possono legare la proteina viene eluita usando una soluzione
contenente ligando libero
- Slide 1
- Slide 2
- Slide 3
- Slide 4
- Slide 5
- Slide 6
- Slide 7
- Slide 8
- Slide 9
- Slide 10
- Slide 11
- Slide 12
- Slide 13
- Slide 14
- Slide 15
- Slide 16
- Slide 17
- Slide 18
- Slide 19
- Slide 20
- Slide 21
- Slide 22
- Slide 23
- Slide 24
- Slide 25
- Slide 26
- Slide 27
- Slide 28
- Slide 29
- Slide 30
- Slide 31
- Slide 32
- Slide 33
- Slide 34
- Slide 35
- Slide 36
- Slide 37
- Slide 38
- Slide 39
- Slide 40
- Slide 41
- Slide 42
- Slide 43
- Slide 44
- Slide 45
- Slide 46
- Slide 47
- Slide 48
-

Coperchio del rotore (a tenuta drsquoaria)
Coperchio del tubo da centrifuga
Asse di rotazione
Rotori ad angolo fisso - hanno gli alloggiamenti per i tubi disposti circolarmente attorno allrsquoasse di rotazione ad un certo angolo prefissato che varia in genere tra 20deg e 40deg Quando le particelle sono proiettate contro le pareti scivolano verso il fondo con la formazione del pellet
Rotori oscillanti o ad angolo mobile - A riposo i tubi rimangono in
posizione orizzontale ma quando il rotore inizia a girare per effetto della
accelerazione centrifuga i tubi ruotano sui perni verso lrsquoesterno
disponendosi orizzontalmente I rotori oscillanti consentono una formazione
di bande di sedimento ben differenziate e di pellets piugrave uniformi ma hanno
una maggiore delicatezza rispetto ai rotori ad angolo fisso
Le tecniche centrifugative si possono suddividere in
generale in preparative e analitiche
Preparativa permette di separare e purificare cellule
intere organuli subcellulari e macromolecole biologiche
come acidi nucleici o proteine
Analitica permette invece di studiare le caratteristiche
di sedimentazione del campione e di determinarne il
grado di purezza o la massa molecolare
La centrifugazione differenziale egrave la tecnica piugrave usata per il
frazionamento cellulare cioegrave per lrsquoottenimento di preparazioni di
organelli da sottoporre poi a studio Ad esempio centrifugando un
omogenato cellulare per tempi relativamente brevi ed a velocitagrave
modeste saragrave possibile ottenere la sedimentazione dei nuclei ma non
degli altri organelli che hanno densitagrave eo dimensioni minori e che
rimarranno nel sovranatante Il sovranatante puograve essere
ulteriormente processato per ottenere altri tipi di particelle Mediante
lrsquoapplicazione ripetuta di questo procedimento con lrsquoaumento della
velocitagrave e del tempo di centrifugazione si puograve ottenere la successiva
sedimentazione di particelle sempre piugrave piccole
Centrifugazione differenziale
Separazione su gradiente di densitarsquo
GRADIETE
Campocentrifugo
campione
Il campione viene fatto stratificare su un gradiente pre-formato in una provetta mediante il mescolamento in proporzioni diverse di soluzioni a diversa densitagrave La densitarsquo massima non deve superare quella delle particelle piursquo dense da separare
Particelle a bassa densitarsquo
Particelle ad alta densitarsquo
Tecnica analitica e separativa basata sul movimento di particelle
elettricamente cariche immerse in un fluido per effetto di un campo elettrico
applicato mediante una coppia di elettrodi al fluido stesso
verso il catodo (particelle cariche positive= cationi)
verso lrsquoanodo (particelle cariche negative= anioni)
- +
+ + - +
- + - -
ElettroforesiElettroforesi
I fattori che influenzano la mobilitagrave di una molecola in un campo
elettrico comprendono la carica della molecola (q) il gradiente di
voltaggio del campo elettrico (E) la resistenza di attrito del mezzo
di supporto (f)
Mobilitagrave elettroforeticaMobilitagrave elettroforetica
La velocitagrave (v) di una molecola carica che si sposta in un campo
elettrico egrave data dunque dalla seguente equazione
v = Eq f
Comunemente egrave adoperato il termine mobilitagrave elettroforetica (μ)
dello ione che equivale alla velocitagrave dello ione diviso lrsquointensitagrave
del campo elettrico (vE)
Quando si applica una differenza di potenziale molecole con
carica elettrica totale differente inizieranno a separarsi in funzione
della loro mobilitagrave elettroforetica
Anche molecole con carica elettrica uguale ma con
dimensioni molecolari differenti si separeranno per effetto di
forze frizionali diverse
Apparecchiatura per elettroforesi
bullAlimentatore
elettrico
bullCella elettroforetica
bullsupporto
Per la maggior parte delle tecniche elettroforetiche si adoperano gel di
poliacrilammide o di agarosio
AcrilammideAcrilammide Bis-acrilammideBis-acrilammide
Materiali di supporto
I gel di poliacrilammide sono preparati facendo copolimerizzare monomeri
di acrilammide in presenza di piccole quantitagrave di NNrsquo-metilene
bisacrilammide (bis-acrilamide)
La bis-acrilammide composta da due molecole di acrilammide legate da
un gruppo metilene egrave utilizzata come agente in grado di formare legami
crociati (cross-linking agent)
Acrilammide
Il processo di polimerizzazione dellrsquoacrilammide egrave un tipico esempio di catalisi radicalica ed inizia con lrsquoaggiunta di ammonio persolfato e della base NNNrsquoNrsquo-tetrametilendiammina (TEMED) Il TEMED catalizza la decomposizione dello ione persolfato con la produzione del corrispondente radicale libero (cioegrave una molecola con un elettrone spaiato) nel modo seguente
TEMED (iniziatore)TEMED (iniziatore)
Lrsquoammonio persolfato egrave lrsquoestere disolfato
dellrsquoacqua ossigenata e omolisa rapidamente a
radicali instabili (radicali solforici)
Il TEMED egrave unrsquoammina terziaria che reagisce con questi radicali a
formare radicali liberi TEMED che a loro volta
reagiscono con lrsquoacrilammide inducendone
la polimerizzazione
Se rappresentiamo il radicale libero con R ed il monomero di acrilammide con M possiamo schematizzare la polimerizzazione nel modo seguente
R + M rarr RMRM + M rarr RMMRMM + M rarr RMMM ecc
In questo modo si formano lunghe catene di acrilammide tenute insieme
tra loro da legami crociati derivanti dallrsquoinserzione occasionale
allrsquointerno della catena di molecole di bis-acrilammide
AcrilammideAcrilammide bis-acrilammidebis-acrilammide
GEL DI POLIACRILAMMIDEGEL DI POLIACRILAMMIDE(molto idrofilico =gt(molto idrofilico =gt
trattiene grosse quantitagrave di acqua)trattiene grosse quantitagrave di acqua)
TEMED (iniziatore)TEMED (iniziatore)
(catalizzatore)(catalizzatore)
ElettroforesiElettroforesiDenaturante
nativa
Elettroforesi denaturante o SDS PAGEElettroforesi denaturante o SDS PAGE
Per semplificare lrsquoanalisi di miscele di proteine egrave possibile fare in modo che la separazione elettroforetica si basi solo sulle dimensioni delle catene polipeptidiche
Ciograve si ottiene denaturando le proteine con il detergente Sodio Dodecil Solfato (SDS) Tale detergente si lega con forza alle proteine le quali si ripiegano a formare delle bacchette estese rivestite di SDS
La separazione delle catene polipeptidiche denaturate e rivestite di detergente si baseragrave quasi esclusivamente sulle dimensioni delle molecole proteiche per cui proteine piugrave piccole si muovono piugrave rapidamente attraverso il gel mentre quelle con dimensioni maggiori sono piugrave rallentate e migrano piugrave lentamente
proteinaproteina
Sodio Dodecil SolfatoSodio Dodecil SolfatoCH3(CH2)10CH2OSO3
- Na+
ElettroforesiElettroforesi
Elettroforesi in condizioni native
Separazione di proteine preservando la loro attivitagrave biologica
Le proteine conservano la loro carica nativa si separano mediante
le loro differenti mobilitagrave elettroforetiche e gli effetti setaccio del gel
Esempio separazione dei complessi della catena respiratoria in un
gradiente lineare o esponenziale
SDS PAGE
I V III IV
Elettroforesi in condizioni native
I
V
III
II
IV
IsoelettrofocalizzazioneIsoelettrofocalizzazione
Separazione delle proteine in base al loro punto isoelettrico
In un gel viene creato un gradiente di pH mediante lrsquoaggiunta di
appropriati anfoliti
La miscela di proteine viene posta in un pozzetto sul gel e viene
applicato un campo elettrico Le proteine entrano nel gel e
migrano fino a che non raggiungono un pH equivalente al punto
isoelettrico
Le proteine con punti isoelettrici diversi si distribuiscono in punti
diversi nel gel
Analisi quantitativa delle proteine presenti nel campione di interesse
Determinazione del peso molecolare di proteine sconosciute
Analisi qualitativa delle proteine presenti nel campione di interesse (colorazione con Coomassie o nitrato drsquoargento o western-blotting)
Applicazioni dellrsquoSDS-PAGEApplicazioni dellrsquoSDS-PAGE
Tecniche di rivelazioneTecniche di rivelazione
Il gel egrave immerso in una soluzione che contiene Coomassie Brilliant Blue R-250 sciolto in acido acetico diluito e metanolo Rivela 01 g di proteina
Coomassie Brilliant BlueIl gel si colora con una miscela di sali drsquoargento e formaldeideGli ioni drsquoargento reagiscono con i gruppi basici e tiolici delle proteine 100 volte piugrave sensibile
Silver
Al termine della corsa elettroforetica le proteine sono trasferita su un
filtro di nitrocellulosa mediante una procedura definita elettroblotting Il gel e la nitrocellulosa sono posti in un apposito cestello a forma
di sandwich immerso in un tampone nel quale ci sono due elettrodi
paralleli La corrente in direzione perpendicolare al gel trasferisce le proteine
sul foglio di nitrocellulosa
St C1 C2 C3 C4 C5 C6
Elettroforesi delle sieroproteineElettroforesi delle sieroproteine
Il termine cromatografia indica un insieme di tecniche che hanno lo
scopo di separare una miscela nei suoi componenti per permetterne il
riconoscimento qualitativo e quantitativo
Queste tecniche sono basate sulla distribuzione differenziale dei vari
componenti fra due fasi una chiamata fase fissa o fase stazionaria e
lrsquoaltra chiamata fase mobile o eluente che fluisce in continuo attraverso
la fase fissa
Cromatografia
Le fasi essenziali di un processo cromatografico sono 3
Caricamento del campione o della miscela da analizzare in una zona
ristretta della fase stazionaria
Eluizione della miscela dalla fase stazionaria per effettuare la
separazione nei singoli componenti
Rivelazione dei composti separati
In base alla forma del letto cromatograficondashCromatografia su colonna (impaccata open-tubular)
ndashCromatografia planare (su carta su strato sottile)
In base allo stato fisico della fase mobilendashCromatografia Liquida (LC)ndashGascromatografia (GC)
In base al meccanismo di separazionendashScambio ionicondashEsclusionendashAffinitagrave
Forma del letto cromatografico
Cromatografia su colonna la fase
stazionaria egrave contenuta allrsquointerno
di una colonna cilindrica che puograve
riempire completamente (colonna
impaccata) oppure rivestirne la
superficie interna (colonna
tubulare)
Cromatografia planare la fase
stazionaria egrave distribuita su una
superficie piana che puograve essere un
supporto cartaceo (cromatografia su
carta PC) o una lastrina in vetro o
altri materiali (cromatografia su
strato sottile TLC)
Gel filtrazione o esclusione molecolare
Separa le proteine in base alle dimensioni la matrice presente
nella colonna egrave un polimero con molti legami crociati che
generano pori con un diametro specifico Le proteine piugrave grandi
potranno migrare nella colonna piugrave velocemente in quanto non
possono entrare nei pori dei granuli della matrice il loro
percorso saragrave quindi diretto verso il fondo della colonna Le
proteine piugrave piccole potranno invece entrare nei pori
allungando il percorso che devono compiere per arrivare al
fondo della colonna
La matrice solida della colonna egrave un polimero sintetico contenente
gruppi carichi (quelli con gruppi anionici sono detti scambiatori di
cationi mentre quelli con gruppi cationici sono detti scambiatori di
anioni)
Lrsquo affinitagrave delle singole proteine del campione per i gruppi carichi
sulla colonna dipende dal pH della soluzione (che determina lo
stato di ionizzazione delle proteine) e dalla concentrazione di sali
(in grado di competere con le cariche delle proteine)
La separazione puograve essere ottimizzata variando gradualmente il
pH o la concentrazione salina in modo da creare un gradiente di
pH o un gradiente salino
Scambio ionico
Cromatografia per affinitagrave
Separa le proteine in base alla loro specificitagrave di legame
Le proteine sono trattenute sulla colonna solo se sono in
grado di legarsi a uno specifico ligando ancorato alla matrice
solida
Dopo aver allontanato dalla colonna le proteine che non si
possono legare la proteina viene eluita usando una soluzione
contenente ligando libero
- Slide 1
- Slide 2
- Slide 3
- Slide 4
- Slide 5
- Slide 6
- Slide 7
- Slide 8
- Slide 9
- Slide 10
- Slide 11
- Slide 12
- Slide 13
- Slide 14
- Slide 15
- Slide 16
- Slide 17
- Slide 18
- Slide 19
- Slide 20
- Slide 21
- Slide 22
- Slide 23
- Slide 24
- Slide 25
- Slide 26
- Slide 27
- Slide 28
- Slide 29
- Slide 30
- Slide 31
- Slide 32
- Slide 33
- Slide 34
- Slide 35
- Slide 36
- Slide 37
- Slide 38
- Slide 39
- Slide 40
- Slide 41
- Slide 42
- Slide 43
- Slide 44
- Slide 45
- Slide 46
- Slide 47
- Slide 48
-

Rotori oscillanti o ad angolo mobile - A riposo i tubi rimangono in
posizione orizzontale ma quando il rotore inizia a girare per effetto della
accelerazione centrifuga i tubi ruotano sui perni verso lrsquoesterno
disponendosi orizzontalmente I rotori oscillanti consentono una formazione
di bande di sedimento ben differenziate e di pellets piugrave uniformi ma hanno
una maggiore delicatezza rispetto ai rotori ad angolo fisso
Le tecniche centrifugative si possono suddividere in
generale in preparative e analitiche
Preparativa permette di separare e purificare cellule
intere organuli subcellulari e macromolecole biologiche
come acidi nucleici o proteine
Analitica permette invece di studiare le caratteristiche
di sedimentazione del campione e di determinarne il
grado di purezza o la massa molecolare
La centrifugazione differenziale egrave la tecnica piugrave usata per il
frazionamento cellulare cioegrave per lrsquoottenimento di preparazioni di
organelli da sottoporre poi a studio Ad esempio centrifugando un
omogenato cellulare per tempi relativamente brevi ed a velocitagrave
modeste saragrave possibile ottenere la sedimentazione dei nuclei ma non
degli altri organelli che hanno densitagrave eo dimensioni minori e che
rimarranno nel sovranatante Il sovranatante puograve essere
ulteriormente processato per ottenere altri tipi di particelle Mediante
lrsquoapplicazione ripetuta di questo procedimento con lrsquoaumento della
velocitagrave e del tempo di centrifugazione si puograve ottenere la successiva
sedimentazione di particelle sempre piugrave piccole
Centrifugazione differenziale
Separazione su gradiente di densitarsquo
GRADIETE
Campocentrifugo
campione
Il campione viene fatto stratificare su un gradiente pre-formato in una provetta mediante il mescolamento in proporzioni diverse di soluzioni a diversa densitagrave La densitarsquo massima non deve superare quella delle particelle piursquo dense da separare
Particelle a bassa densitarsquo
Particelle ad alta densitarsquo
Tecnica analitica e separativa basata sul movimento di particelle
elettricamente cariche immerse in un fluido per effetto di un campo elettrico
applicato mediante una coppia di elettrodi al fluido stesso
verso il catodo (particelle cariche positive= cationi)
verso lrsquoanodo (particelle cariche negative= anioni)
- +
+ + - +
- + - -
ElettroforesiElettroforesi
I fattori che influenzano la mobilitagrave di una molecola in un campo
elettrico comprendono la carica della molecola (q) il gradiente di
voltaggio del campo elettrico (E) la resistenza di attrito del mezzo
di supporto (f)
Mobilitagrave elettroforeticaMobilitagrave elettroforetica
La velocitagrave (v) di una molecola carica che si sposta in un campo
elettrico egrave data dunque dalla seguente equazione
v = Eq f
Comunemente egrave adoperato il termine mobilitagrave elettroforetica (μ)
dello ione che equivale alla velocitagrave dello ione diviso lrsquointensitagrave
del campo elettrico (vE)
Quando si applica una differenza di potenziale molecole con
carica elettrica totale differente inizieranno a separarsi in funzione
della loro mobilitagrave elettroforetica
Anche molecole con carica elettrica uguale ma con
dimensioni molecolari differenti si separeranno per effetto di
forze frizionali diverse
Apparecchiatura per elettroforesi
bullAlimentatore
elettrico
bullCella elettroforetica
bullsupporto
Per la maggior parte delle tecniche elettroforetiche si adoperano gel di
poliacrilammide o di agarosio
AcrilammideAcrilammide Bis-acrilammideBis-acrilammide
Materiali di supporto
I gel di poliacrilammide sono preparati facendo copolimerizzare monomeri
di acrilammide in presenza di piccole quantitagrave di NNrsquo-metilene
bisacrilammide (bis-acrilamide)
La bis-acrilammide composta da due molecole di acrilammide legate da
un gruppo metilene egrave utilizzata come agente in grado di formare legami
crociati (cross-linking agent)
Acrilammide
Il processo di polimerizzazione dellrsquoacrilammide egrave un tipico esempio di catalisi radicalica ed inizia con lrsquoaggiunta di ammonio persolfato e della base NNNrsquoNrsquo-tetrametilendiammina (TEMED) Il TEMED catalizza la decomposizione dello ione persolfato con la produzione del corrispondente radicale libero (cioegrave una molecola con un elettrone spaiato) nel modo seguente
TEMED (iniziatore)TEMED (iniziatore)
Lrsquoammonio persolfato egrave lrsquoestere disolfato
dellrsquoacqua ossigenata e omolisa rapidamente a
radicali instabili (radicali solforici)
Il TEMED egrave unrsquoammina terziaria che reagisce con questi radicali a
formare radicali liberi TEMED che a loro volta
reagiscono con lrsquoacrilammide inducendone
la polimerizzazione
Se rappresentiamo il radicale libero con R ed il monomero di acrilammide con M possiamo schematizzare la polimerizzazione nel modo seguente
R + M rarr RMRM + M rarr RMMRMM + M rarr RMMM ecc
In questo modo si formano lunghe catene di acrilammide tenute insieme
tra loro da legami crociati derivanti dallrsquoinserzione occasionale
allrsquointerno della catena di molecole di bis-acrilammide
AcrilammideAcrilammide bis-acrilammidebis-acrilammide
GEL DI POLIACRILAMMIDEGEL DI POLIACRILAMMIDE(molto idrofilico =gt(molto idrofilico =gt
trattiene grosse quantitagrave di acqua)trattiene grosse quantitagrave di acqua)
TEMED (iniziatore)TEMED (iniziatore)
(catalizzatore)(catalizzatore)
ElettroforesiElettroforesiDenaturante
nativa
Elettroforesi denaturante o SDS PAGEElettroforesi denaturante o SDS PAGE
Per semplificare lrsquoanalisi di miscele di proteine egrave possibile fare in modo che la separazione elettroforetica si basi solo sulle dimensioni delle catene polipeptidiche
Ciograve si ottiene denaturando le proteine con il detergente Sodio Dodecil Solfato (SDS) Tale detergente si lega con forza alle proteine le quali si ripiegano a formare delle bacchette estese rivestite di SDS
La separazione delle catene polipeptidiche denaturate e rivestite di detergente si baseragrave quasi esclusivamente sulle dimensioni delle molecole proteiche per cui proteine piugrave piccole si muovono piugrave rapidamente attraverso il gel mentre quelle con dimensioni maggiori sono piugrave rallentate e migrano piugrave lentamente
proteinaproteina
Sodio Dodecil SolfatoSodio Dodecil SolfatoCH3(CH2)10CH2OSO3
- Na+
ElettroforesiElettroforesi
Elettroforesi in condizioni native
Separazione di proteine preservando la loro attivitagrave biologica
Le proteine conservano la loro carica nativa si separano mediante
le loro differenti mobilitagrave elettroforetiche e gli effetti setaccio del gel
Esempio separazione dei complessi della catena respiratoria in un
gradiente lineare o esponenziale
SDS PAGE
I V III IV
Elettroforesi in condizioni native
I
V
III
II
IV
IsoelettrofocalizzazioneIsoelettrofocalizzazione
Separazione delle proteine in base al loro punto isoelettrico
In un gel viene creato un gradiente di pH mediante lrsquoaggiunta di
appropriati anfoliti
La miscela di proteine viene posta in un pozzetto sul gel e viene
applicato un campo elettrico Le proteine entrano nel gel e
migrano fino a che non raggiungono un pH equivalente al punto
isoelettrico
Le proteine con punti isoelettrici diversi si distribuiscono in punti
diversi nel gel
Analisi quantitativa delle proteine presenti nel campione di interesse
Determinazione del peso molecolare di proteine sconosciute
Analisi qualitativa delle proteine presenti nel campione di interesse (colorazione con Coomassie o nitrato drsquoargento o western-blotting)
Applicazioni dellrsquoSDS-PAGEApplicazioni dellrsquoSDS-PAGE
Tecniche di rivelazioneTecniche di rivelazione
Il gel egrave immerso in una soluzione che contiene Coomassie Brilliant Blue R-250 sciolto in acido acetico diluito e metanolo Rivela 01 g di proteina
Coomassie Brilliant BlueIl gel si colora con una miscela di sali drsquoargento e formaldeideGli ioni drsquoargento reagiscono con i gruppi basici e tiolici delle proteine 100 volte piugrave sensibile
Silver
Al termine della corsa elettroforetica le proteine sono trasferita su un
filtro di nitrocellulosa mediante una procedura definita elettroblotting Il gel e la nitrocellulosa sono posti in un apposito cestello a forma
di sandwich immerso in un tampone nel quale ci sono due elettrodi
paralleli La corrente in direzione perpendicolare al gel trasferisce le proteine
sul foglio di nitrocellulosa
St C1 C2 C3 C4 C5 C6
Elettroforesi delle sieroproteineElettroforesi delle sieroproteine
Il termine cromatografia indica un insieme di tecniche che hanno lo
scopo di separare una miscela nei suoi componenti per permetterne il
riconoscimento qualitativo e quantitativo
Queste tecniche sono basate sulla distribuzione differenziale dei vari
componenti fra due fasi una chiamata fase fissa o fase stazionaria e
lrsquoaltra chiamata fase mobile o eluente che fluisce in continuo attraverso
la fase fissa
Cromatografia
Le fasi essenziali di un processo cromatografico sono 3
Caricamento del campione o della miscela da analizzare in una zona
ristretta della fase stazionaria
Eluizione della miscela dalla fase stazionaria per effettuare la
separazione nei singoli componenti
Rivelazione dei composti separati
In base alla forma del letto cromatograficondashCromatografia su colonna (impaccata open-tubular)
ndashCromatografia planare (su carta su strato sottile)
In base allo stato fisico della fase mobilendashCromatografia Liquida (LC)ndashGascromatografia (GC)
In base al meccanismo di separazionendashScambio ionicondashEsclusionendashAffinitagrave
Forma del letto cromatografico
Cromatografia su colonna la fase
stazionaria egrave contenuta allrsquointerno
di una colonna cilindrica che puograve
riempire completamente (colonna
impaccata) oppure rivestirne la
superficie interna (colonna
tubulare)
Cromatografia planare la fase
stazionaria egrave distribuita su una
superficie piana che puograve essere un
supporto cartaceo (cromatografia su
carta PC) o una lastrina in vetro o
altri materiali (cromatografia su
strato sottile TLC)
Gel filtrazione o esclusione molecolare
Separa le proteine in base alle dimensioni la matrice presente
nella colonna egrave un polimero con molti legami crociati che
generano pori con un diametro specifico Le proteine piugrave grandi
potranno migrare nella colonna piugrave velocemente in quanto non
possono entrare nei pori dei granuli della matrice il loro
percorso saragrave quindi diretto verso il fondo della colonna Le
proteine piugrave piccole potranno invece entrare nei pori
allungando il percorso che devono compiere per arrivare al
fondo della colonna
La matrice solida della colonna egrave un polimero sintetico contenente
gruppi carichi (quelli con gruppi anionici sono detti scambiatori di
cationi mentre quelli con gruppi cationici sono detti scambiatori di
anioni)
Lrsquo affinitagrave delle singole proteine del campione per i gruppi carichi
sulla colonna dipende dal pH della soluzione (che determina lo
stato di ionizzazione delle proteine) e dalla concentrazione di sali
(in grado di competere con le cariche delle proteine)
La separazione puograve essere ottimizzata variando gradualmente il
pH o la concentrazione salina in modo da creare un gradiente di
pH o un gradiente salino
Scambio ionico
Cromatografia per affinitagrave
Separa le proteine in base alla loro specificitagrave di legame
Le proteine sono trattenute sulla colonna solo se sono in
grado di legarsi a uno specifico ligando ancorato alla matrice
solida
Dopo aver allontanato dalla colonna le proteine che non si
possono legare la proteina viene eluita usando una soluzione
contenente ligando libero
- Slide 1
- Slide 2
- Slide 3
- Slide 4
- Slide 5
- Slide 6
- Slide 7
- Slide 8
- Slide 9
- Slide 10
- Slide 11
- Slide 12
- Slide 13
- Slide 14
- Slide 15
- Slide 16
- Slide 17
- Slide 18
- Slide 19
- Slide 20
- Slide 21
- Slide 22
- Slide 23
- Slide 24
- Slide 25
- Slide 26
- Slide 27
- Slide 28
- Slide 29
- Slide 30
- Slide 31
- Slide 32
- Slide 33
- Slide 34
- Slide 35
- Slide 36
- Slide 37
- Slide 38
- Slide 39
- Slide 40
- Slide 41
- Slide 42
- Slide 43
- Slide 44
- Slide 45
- Slide 46
- Slide 47
- Slide 48
-

Le tecniche centrifugative si possono suddividere in
generale in preparative e analitiche
Preparativa permette di separare e purificare cellule
intere organuli subcellulari e macromolecole biologiche
come acidi nucleici o proteine
Analitica permette invece di studiare le caratteristiche
di sedimentazione del campione e di determinarne il
grado di purezza o la massa molecolare
La centrifugazione differenziale egrave la tecnica piugrave usata per il
frazionamento cellulare cioegrave per lrsquoottenimento di preparazioni di
organelli da sottoporre poi a studio Ad esempio centrifugando un
omogenato cellulare per tempi relativamente brevi ed a velocitagrave
modeste saragrave possibile ottenere la sedimentazione dei nuclei ma non
degli altri organelli che hanno densitagrave eo dimensioni minori e che
rimarranno nel sovranatante Il sovranatante puograve essere
ulteriormente processato per ottenere altri tipi di particelle Mediante
lrsquoapplicazione ripetuta di questo procedimento con lrsquoaumento della
velocitagrave e del tempo di centrifugazione si puograve ottenere la successiva
sedimentazione di particelle sempre piugrave piccole
Centrifugazione differenziale
Separazione su gradiente di densitarsquo
GRADIETE
Campocentrifugo
campione
Il campione viene fatto stratificare su un gradiente pre-formato in una provetta mediante il mescolamento in proporzioni diverse di soluzioni a diversa densitagrave La densitarsquo massima non deve superare quella delle particelle piursquo dense da separare
Particelle a bassa densitarsquo
Particelle ad alta densitarsquo
Tecnica analitica e separativa basata sul movimento di particelle
elettricamente cariche immerse in un fluido per effetto di un campo elettrico
applicato mediante una coppia di elettrodi al fluido stesso
verso il catodo (particelle cariche positive= cationi)
verso lrsquoanodo (particelle cariche negative= anioni)
- +
+ + - +
- + - -
ElettroforesiElettroforesi
I fattori che influenzano la mobilitagrave di una molecola in un campo
elettrico comprendono la carica della molecola (q) il gradiente di
voltaggio del campo elettrico (E) la resistenza di attrito del mezzo
di supporto (f)
Mobilitagrave elettroforeticaMobilitagrave elettroforetica
La velocitagrave (v) di una molecola carica che si sposta in un campo
elettrico egrave data dunque dalla seguente equazione
v = Eq f
Comunemente egrave adoperato il termine mobilitagrave elettroforetica (μ)
dello ione che equivale alla velocitagrave dello ione diviso lrsquointensitagrave
del campo elettrico (vE)
Quando si applica una differenza di potenziale molecole con
carica elettrica totale differente inizieranno a separarsi in funzione
della loro mobilitagrave elettroforetica
Anche molecole con carica elettrica uguale ma con
dimensioni molecolari differenti si separeranno per effetto di
forze frizionali diverse
Apparecchiatura per elettroforesi
bullAlimentatore
elettrico
bullCella elettroforetica
bullsupporto
Per la maggior parte delle tecniche elettroforetiche si adoperano gel di
poliacrilammide o di agarosio
AcrilammideAcrilammide Bis-acrilammideBis-acrilammide
Materiali di supporto
I gel di poliacrilammide sono preparati facendo copolimerizzare monomeri
di acrilammide in presenza di piccole quantitagrave di NNrsquo-metilene
bisacrilammide (bis-acrilamide)
La bis-acrilammide composta da due molecole di acrilammide legate da
un gruppo metilene egrave utilizzata come agente in grado di formare legami
crociati (cross-linking agent)
Acrilammide
Il processo di polimerizzazione dellrsquoacrilammide egrave un tipico esempio di catalisi radicalica ed inizia con lrsquoaggiunta di ammonio persolfato e della base NNNrsquoNrsquo-tetrametilendiammina (TEMED) Il TEMED catalizza la decomposizione dello ione persolfato con la produzione del corrispondente radicale libero (cioegrave una molecola con un elettrone spaiato) nel modo seguente
TEMED (iniziatore)TEMED (iniziatore)
Lrsquoammonio persolfato egrave lrsquoestere disolfato
dellrsquoacqua ossigenata e omolisa rapidamente a
radicali instabili (radicali solforici)
Il TEMED egrave unrsquoammina terziaria che reagisce con questi radicali a
formare radicali liberi TEMED che a loro volta
reagiscono con lrsquoacrilammide inducendone
la polimerizzazione
Se rappresentiamo il radicale libero con R ed il monomero di acrilammide con M possiamo schematizzare la polimerizzazione nel modo seguente
R + M rarr RMRM + M rarr RMMRMM + M rarr RMMM ecc
In questo modo si formano lunghe catene di acrilammide tenute insieme
tra loro da legami crociati derivanti dallrsquoinserzione occasionale
allrsquointerno della catena di molecole di bis-acrilammide
AcrilammideAcrilammide bis-acrilammidebis-acrilammide
GEL DI POLIACRILAMMIDEGEL DI POLIACRILAMMIDE(molto idrofilico =gt(molto idrofilico =gt
trattiene grosse quantitagrave di acqua)trattiene grosse quantitagrave di acqua)
TEMED (iniziatore)TEMED (iniziatore)
(catalizzatore)(catalizzatore)
ElettroforesiElettroforesiDenaturante
nativa
Elettroforesi denaturante o SDS PAGEElettroforesi denaturante o SDS PAGE
Per semplificare lrsquoanalisi di miscele di proteine egrave possibile fare in modo che la separazione elettroforetica si basi solo sulle dimensioni delle catene polipeptidiche
Ciograve si ottiene denaturando le proteine con il detergente Sodio Dodecil Solfato (SDS) Tale detergente si lega con forza alle proteine le quali si ripiegano a formare delle bacchette estese rivestite di SDS
La separazione delle catene polipeptidiche denaturate e rivestite di detergente si baseragrave quasi esclusivamente sulle dimensioni delle molecole proteiche per cui proteine piugrave piccole si muovono piugrave rapidamente attraverso il gel mentre quelle con dimensioni maggiori sono piugrave rallentate e migrano piugrave lentamente
proteinaproteina
Sodio Dodecil SolfatoSodio Dodecil SolfatoCH3(CH2)10CH2OSO3
- Na+
ElettroforesiElettroforesi
Elettroforesi in condizioni native
Separazione di proteine preservando la loro attivitagrave biologica
Le proteine conservano la loro carica nativa si separano mediante
le loro differenti mobilitagrave elettroforetiche e gli effetti setaccio del gel
Esempio separazione dei complessi della catena respiratoria in un
gradiente lineare o esponenziale
SDS PAGE
I V III IV
Elettroforesi in condizioni native
I
V
III
II
IV
IsoelettrofocalizzazioneIsoelettrofocalizzazione
Separazione delle proteine in base al loro punto isoelettrico
In un gel viene creato un gradiente di pH mediante lrsquoaggiunta di
appropriati anfoliti
La miscela di proteine viene posta in un pozzetto sul gel e viene
applicato un campo elettrico Le proteine entrano nel gel e
migrano fino a che non raggiungono un pH equivalente al punto
isoelettrico
Le proteine con punti isoelettrici diversi si distribuiscono in punti
diversi nel gel
Analisi quantitativa delle proteine presenti nel campione di interesse
Determinazione del peso molecolare di proteine sconosciute
Analisi qualitativa delle proteine presenti nel campione di interesse (colorazione con Coomassie o nitrato drsquoargento o western-blotting)
Applicazioni dellrsquoSDS-PAGEApplicazioni dellrsquoSDS-PAGE
Tecniche di rivelazioneTecniche di rivelazione
Il gel egrave immerso in una soluzione che contiene Coomassie Brilliant Blue R-250 sciolto in acido acetico diluito e metanolo Rivela 01 g di proteina
Coomassie Brilliant BlueIl gel si colora con una miscela di sali drsquoargento e formaldeideGli ioni drsquoargento reagiscono con i gruppi basici e tiolici delle proteine 100 volte piugrave sensibile
Silver
Al termine della corsa elettroforetica le proteine sono trasferita su un
filtro di nitrocellulosa mediante una procedura definita elettroblotting Il gel e la nitrocellulosa sono posti in un apposito cestello a forma
di sandwich immerso in un tampone nel quale ci sono due elettrodi
paralleli La corrente in direzione perpendicolare al gel trasferisce le proteine
sul foglio di nitrocellulosa
St C1 C2 C3 C4 C5 C6
Elettroforesi delle sieroproteineElettroforesi delle sieroproteine
Il termine cromatografia indica un insieme di tecniche che hanno lo
scopo di separare una miscela nei suoi componenti per permetterne il
riconoscimento qualitativo e quantitativo
Queste tecniche sono basate sulla distribuzione differenziale dei vari
componenti fra due fasi una chiamata fase fissa o fase stazionaria e
lrsquoaltra chiamata fase mobile o eluente che fluisce in continuo attraverso
la fase fissa
Cromatografia
Le fasi essenziali di un processo cromatografico sono 3
Caricamento del campione o della miscela da analizzare in una zona
ristretta della fase stazionaria
Eluizione della miscela dalla fase stazionaria per effettuare la
separazione nei singoli componenti
Rivelazione dei composti separati
In base alla forma del letto cromatograficondashCromatografia su colonna (impaccata open-tubular)
ndashCromatografia planare (su carta su strato sottile)
In base allo stato fisico della fase mobilendashCromatografia Liquida (LC)ndashGascromatografia (GC)
In base al meccanismo di separazionendashScambio ionicondashEsclusionendashAffinitagrave
Forma del letto cromatografico
Cromatografia su colonna la fase
stazionaria egrave contenuta allrsquointerno
di una colonna cilindrica che puograve
riempire completamente (colonna
impaccata) oppure rivestirne la
superficie interna (colonna
tubulare)
Cromatografia planare la fase
stazionaria egrave distribuita su una
superficie piana che puograve essere un
supporto cartaceo (cromatografia su
carta PC) o una lastrina in vetro o
altri materiali (cromatografia su
strato sottile TLC)
Gel filtrazione o esclusione molecolare
Separa le proteine in base alle dimensioni la matrice presente
nella colonna egrave un polimero con molti legami crociati che
generano pori con un diametro specifico Le proteine piugrave grandi
potranno migrare nella colonna piugrave velocemente in quanto non
possono entrare nei pori dei granuli della matrice il loro
percorso saragrave quindi diretto verso il fondo della colonna Le
proteine piugrave piccole potranno invece entrare nei pori
allungando il percorso che devono compiere per arrivare al
fondo della colonna
La matrice solida della colonna egrave un polimero sintetico contenente
gruppi carichi (quelli con gruppi anionici sono detti scambiatori di
cationi mentre quelli con gruppi cationici sono detti scambiatori di
anioni)
Lrsquo affinitagrave delle singole proteine del campione per i gruppi carichi
sulla colonna dipende dal pH della soluzione (che determina lo
stato di ionizzazione delle proteine) e dalla concentrazione di sali
(in grado di competere con le cariche delle proteine)
La separazione puograve essere ottimizzata variando gradualmente il
pH o la concentrazione salina in modo da creare un gradiente di
pH o un gradiente salino
Scambio ionico
Cromatografia per affinitagrave
Separa le proteine in base alla loro specificitagrave di legame
Le proteine sono trattenute sulla colonna solo se sono in
grado di legarsi a uno specifico ligando ancorato alla matrice
solida
Dopo aver allontanato dalla colonna le proteine che non si
possono legare la proteina viene eluita usando una soluzione
contenente ligando libero
- Slide 1
- Slide 2
- Slide 3
- Slide 4
- Slide 5
- Slide 6
- Slide 7
- Slide 8
- Slide 9
- Slide 10
- Slide 11
- Slide 12
- Slide 13
- Slide 14
- Slide 15
- Slide 16
- Slide 17
- Slide 18
- Slide 19
- Slide 20
- Slide 21
- Slide 22
- Slide 23
- Slide 24
- Slide 25
- Slide 26
- Slide 27
- Slide 28
- Slide 29
- Slide 30
- Slide 31
- Slide 32
- Slide 33
- Slide 34
- Slide 35
- Slide 36
- Slide 37
- Slide 38
- Slide 39
- Slide 40
- Slide 41
- Slide 42
- Slide 43
- Slide 44
- Slide 45
- Slide 46
- Slide 47
- Slide 48
-

La centrifugazione differenziale egrave la tecnica piugrave usata per il
frazionamento cellulare cioegrave per lrsquoottenimento di preparazioni di
organelli da sottoporre poi a studio Ad esempio centrifugando un
omogenato cellulare per tempi relativamente brevi ed a velocitagrave
modeste saragrave possibile ottenere la sedimentazione dei nuclei ma non
degli altri organelli che hanno densitagrave eo dimensioni minori e che
rimarranno nel sovranatante Il sovranatante puograve essere
ulteriormente processato per ottenere altri tipi di particelle Mediante
lrsquoapplicazione ripetuta di questo procedimento con lrsquoaumento della
velocitagrave e del tempo di centrifugazione si puograve ottenere la successiva
sedimentazione di particelle sempre piugrave piccole
Centrifugazione differenziale
Separazione su gradiente di densitarsquo
GRADIETE
Campocentrifugo
campione
Il campione viene fatto stratificare su un gradiente pre-formato in una provetta mediante il mescolamento in proporzioni diverse di soluzioni a diversa densitagrave La densitarsquo massima non deve superare quella delle particelle piursquo dense da separare
Particelle a bassa densitarsquo
Particelle ad alta densitarsquo
Tecnica analitica e separativa basata sul movimento di particelle
elettricamente cariche immerse in un fluido per effetto di un campo elettrico
applicato mediante una coppia di elettrodi al fluido stesso
verso il catodo (particelle cariche positive= cationi)
verso lrsquoanodo (particelle cariche negative= anioni)
- +
+ + - +
- + - -
ElettroforesiElettroforesi
I fattori che influenzano la mobilitagrave di una molecola in un campo
elettrico comprendono la carica della molecola (q) il gradiente di
voltaggio del campo elettrico (E) la resistenza di attrito del mezzo
di supporto (f)
Mobilitagrave elettroforeticaMobilitagrave elettroforetica
La velocitagrave (v) di una molecola carica che si sposta in un campo
elettrico egrave data dunque dalla seguente equazione
v = Eq f
Comunemente egrave adoperato il termine mobilitagrave elettroforetica (μ)
dello ione che equivale alla velocitagrave dello ione diviso lrsquointensitagrave
del campo elettrico (vE)
Quando si applica una differenza di potenziale molecole con
carica elettrica totale differente inizieranno a separarsi in funzione
della loro mobilitagrave elettroforetica
Anche molecole con carica elettrica uguale ma con
dimensioni molecolari differenti si separeranno per effetto di
forze frizionali diverse
Apparecchiatura per elettroforesi
bullAlimentatore
elettrico
bullCella elettroforetica
bullsupporto
Per la maggior parte delle tecniche elettroforetiche si adoperano gel di
poliacrilammide o di agarosio
AcrilammideAcrilammide Bis-acrilammideBis-acrilammide
Materiali di supporto
I gel di poliacrilammide sono preparati facendo copolimerizzare monomeri
di acrilammide in presenza di piccole quantitagrave di NNrsquo-metilene
bisacrilammide (bis-acrilamide)
La bis-acrilammide composta da due molecole di acrilammide legate da
un gruppo metilene egrave utilizzata come agente in grado di formare legami
crociati (cross-linking agent)
Acrilammide
Il processo di polimerizzazione dellrsquoacrilammide egrave un tipico esempio di catalisi radicalica ed inizia con lrsquoaggiunta di ammonio persolfato e della base NNNrsquoNrsquo-tetrametilendiammina (TEMED) Il TEMED catalizza la decomposizione dello ione persolfato con la produzione del corrispondente radicale libero (cioegrave una molecola con un elettrone spaiato) nel modo seguente
TEMED (iniziatore)TEMED (iniziatore)
Lrsquoammonio persolfato egrave lrsquoestere disolfato
dellrsquoacqua ossigenata e omolisa rapidamente a
radicali instabili (radicali solforici)
Il TEMED egrave unrsquoammina terziaria che reagisce con questi radicali a
formare radicali liberi TEMED che a loro volta
reagiscono con lrsquoacrilammide inducendone
la polimerizzazione
Se rappresentiamo il radicale libero con R ed il monomero di acrilammide con M possiamo schematizzare la polimerizzazione nel modo seguente
R + M rarr RMRM + M rarr RMMRMM + M rarr RMMM ecc
In questo modo si formano lunghe catene di acrilammide tenute insieme
tra loro da legami crociati derivanti dallrsquoinserzione occasionale
allrsquointerno della catena di molecole di bis-acrilammide
AcrilammideAcrilammide bis-acrilammidebis-acrilammide
GEL DI POLIACRILAMMIDEGEL DI POLIACRILAMMIDE(molto idrofilico =gt(molto idrofilico =gt
trattiene grosse quantitagrave di acqua)trattiene grosse quantitagrave di acqua)
TEMED (iniziatore)TEMED (iniziatore)
(catalizzatore)(catalizzatore)
ElettroforesiElettroforesiDenaturante
nativa
Elettroforesi denaturante o SDS PAGEElettroforesi denaturante o SDS PAGE
Per semplificare lrsquoanalisi di miscele di proteine egrave possibile fare in modo che la separazione elettroforetica si basi solo sulle dimensioni delle catene polipeptidiche
Ciograve si ottiene denaturando le proteine con il detergente Sodio Dodecil Solfato (SDS) Tale detergente si lega con forza alle proteine le quali si ripiegano a formare delle bacchette estese rivestite di SDS
La separazione delle catene polipeptidiche denaturate e rivestite di detergente si baseragrave quasi esclusivamente sulle dimensioni delle molecole proteiche per cui proteine piugrave piccole si muovono piugrave rapidamente attraverso il gel mentre quelle con dimensioni maggiori sono piugrave rallentate e migrano piugrave lentamente
proteinaproteina
Sodio Dodecil SolfatoSodio Dodecil SolfatoCH3(CH2)10CH2OSO3
- Na+
ElettroforesiElettroforesi
Elettroforesi in condizioni native
Separazione di proteine preservando la loro attivitagrave biologica
Le proteine conservano la loro carica nativa si separano mediante
le loro differenti mobilitagrave elettroforetiche e gli effetti setaccio del gel
Esempio separazione dei complessi della catena respiratoria in un
gradiente lineare o esponenziale
SDS PAGE
I V III IV
Elettroforesi in condizioni native
I
V
III
II
IV
IsoelettrofocalizzazioneIsoelettrofocalizzazione
Separazione delle proteine in base al loro punto isoelettrico
In un gel viene creato un gradiente di pH mediante lrsquoaggiunta di
appropriati anfoliti
La miscela di proteine viene posta in un pozzetto sul gel e viene
applicato un campo elettrico Le proteine entrano nel gel e
migrano fino a che non raggiungono un pH equivalente al punto
isoelettrico
Le proteine con punti isoelettrici diversi si distribuiscono in punti
diversi nel gel
Analisi quantitativa delle proteine presenti nel campione di interesse
Determinazione del peso molecolare di proteine sconosciute
Analisi qualitativa delle proteine presenti nel campione di interesse (colorazione con Coomassie o nitrato drsquoargento o western-blotting)
Applicazioni dellrsquoSDS-PAGEApplicazioni dellrsquoSDS-PAGE
Tecniche di rivelazioneTecniche di rivelazione
Il gel egrave immerso in una soluzione che contiene Coomassie Brilliant Blue R-250 sciolto in acido acetico diluito e metanolo Rivela 01 g di proteina
Coomassie Brilliant BlueIl gel si colora con una miscela di sali drsquoargento e formaldeideGli ioni drsquoargento reagiscono con i gruppi basici e tiolici delle proteine 100 volte piugrave sensibile
Silver
Al termine della corsa elettroforetica le proteine sono trasferita su un
filtro di nitrocellulosa mediante una procedura definita elettroblotting Il gel e la nitrocellulosa sono posti in un apposito cestello a forma
di sandwich immerso in un tampone nel quale ci sono due elettrodi
paralleli La corrente in direzione perpendicolare al gel trasferisce le proteine
sul foglio di nitrocellulosa
St C1 C2 C3 C4 C5 C6
Elettroforesi delle sieroproteineElettroforesi delle sieroproteine
Il termine cromatografia indica un insieme di tecniche che hanno lo
scopo di separare una miscela nei suoi componenti per permetterne il
riconoscimento qualitativo e quantitativo
Queste tecniche sono basate sulla distribuzione differenziale dei vari
componenti fra due fasi una chiamata fase fissa o fase stazionaria e
lrsquoaltra chiamata fase mobile o eluente che fluisce in continuo attraverso
la fase fissa
Cromatografia
Le fasi essenziali di un processo cromatografico sono 3
Caricamento del campione o della miscela da analizzare in una zona
ristretta della fase stazionaria
Eluizione della miscela dalla fase stazionaria per effettuare la
separazione nei singoli componenti
Rivelazione dei composti separati
In base alla forma del letto cromatograficondashCromatografia su colonna (impaccata open-tubular)
ndashCromatografia planare (su carta su strato sottile)
In base allo stato fisico della fase mobilendashCromatografia Liquida (LC)ndashGascromatografia (GC)
In base al meccanismo di separazionendashScambio ionicondashEsclusionendashAffinitagrave
Forma del letto cromatografico
Cromatografia su colonna la fase
stazionaria egrave contenuta allrsquointerno
di una colonna cilindrica che puograve
riempire completamente (colonna
impaccata) oppure rivestirne la
superficie interna (colonna
tubulare)
Cromatografia planare la fase
stazionaria egrave distribuita su una
superficie piana che puograve essere un
supporto cartaceo (cromatografia su
carta PC) o una lastrina in vetro o
altri materiali (cromatografia su
strato sottile TLC)
Gel filtrazione o esclusione molecolare
Separa le proteine in base alle dimensioni la matrice presente
nella colonna egrave un polimero con molti legami crociati che
generano pori con un diametro specifico Le proteine piugrave grandi
potranno migrare nella colonna piugrave velocemente in quanto non
possono entrare nei pori dei granuli della matrice il loro
percorso saragrave quindi diretto verso il fondo della colonna Le
proteine piugrave piccole potranno invece entrare nei pori
allungando il percorso che devono compiere per arrivare al
fondo della colonna
La matrice solida della colonna egrave un polimero sintetico contenente
gruppi carichi (quelli con gruppi anionici sono detti scambiatori di
cationi mentre quelli con gruppi cationici sono detti scambiatori di
anioni)
Lrsquo affinitagrave delle singole proteine del campione per i gruppi carichi
sulla colonna dipende dal pH della soluzione (che determina lo
stato di ionizzazione delle proteine) e dalla concentrazione di sali
(in grado di competere con le cariche delle proteine)
La separazione puograve essere ottimizzata variando gradualmente il
pH o la concentrazione salina in modo da creare un gradiente di
pH o un gradiente salino
Scambio ionico
Cromatografia per affinitagrave
Separa le proteine in base alla loro specificitagrave di legame
Le proteine sono trattenute sulla colonna solo se sono in
grado di legarsi a uno specifico ligando ancorato alla matrice
solida
Dopo aver allontanato dalla colonna le proteine che non si
possono legare la proteina viene eluita usando una soluzione
contenente ligando libero
- Slide 1
- Slide 2
- Slide 3
- Slide 4
- Slide 5
- Slide 6
- Slide 7
- Slide 8
- Slide 9
- Slide 10
- Slide 11
- Slide 12
- Slide 13
- Slide 14
- Slide 15
- Slide 16
- Slide 17
- Slide 18
- Slide 19
- Slide 20
- Slide 21
- Slide 22
- Slide 23
- Slide 24
- Slide 25
- Slide 26
- Slide 27
- Slide 28
- Slide 29
- Slide 30
- Slide 31
- Slide 32
- Slide 33
- Slide 34
- Slide 35
- Slide 36
- Slide 37
- Slide 38
- Slide 39
- Slide 40
- Slide 41
- Slide 42
- Slide 43
- Slide 44
- Slide 45
- Slide 46
- Slide 47
- Slide 48
-

Separazione su gradiente di densitarsquo
GRADIETE
Campocentrifugo
campione
Il campione viene fatto stratificare su un gradiente pre-formato in una provetta mediante il mescolamento in proporzioni diverse di soluzioni a diversa densitagrave La densitarsquo massima non deve superare quella delle particelle piursquo dense da separare
Particelle a bassa densitarsquo
Particelle ad alta densitarsquo
Tecnica analitica e separativa basata sul movimento di particelle
elettricamente cariche immerse in un fluido per effetto di un campo elettrico
applicato mediante una coppia di elettrodi al fluido stesso
verso il catodo (particelle cariche positive= cationi)
verso lrsquoanodo (particelle cariche negative= anioni)
- +
+ + - +
- + - -
ElettroforesiElettroforesi
I fattori che influenzano la mobilitagrave di una molecola in un campo
elettrico comprendono la carica della molecola (q) il gradiente di
voltaggio del campo elettrico (E) la resistenza di attrito del mezzo
di supporto (f)
Mobilitagrave elettroforeticaMobilitagrave elettroforetica
La velocitagrave (v) di una molecola carica che si sposta in un campo
elettrico egrave data dunque dalla seguente equazione
v = Eq f
Comunemente egrave adoperato il termine mobilitagrave elettroforetica (μ)
dello ione che equivale alla velocitagrave dello ione diviso lrsquointensitagrave
del campo elettrico (vE)
Quando si applica una differenza di potenziale molecole con
carica elettrica totale differente inizieranno a separarsi in funzione
della loro mobilitagrave elettroforetica
Anche molecole con carica elettrica uguale ma con
dimensioni molecolari differenti si separeranno per effetto di
forze frizionali diverse
Apparecchiatura per elettroforesi
bullAlimentatore
elettrico
bullCella elettroforetica
bullsupporto
Per la maggior parte delle tecniche elettroforetiche si adoperano gel di
poliacrilammide o di agarosio
AcrilammideAcrilammide Bis-acrilammideBis-acrilammide
Materiali di supporto
I gel di poliacrilammide sono preparati facendo copolimerizzare monomeri
di acrilammide in presenza di piccole quantitagrave di NNrsquo-metilene
bisacrilammide (bis-acrilamide)
La bis-acrilammide composta da due molecole di acrilammide legate da
un gruppo metilene egrave utilizzata come agente in grado di formare legami
crociati (cross-linking agent)
Acrilammide
Il processo di polimerizzazione dellrsquoacrilammide egrave un tipico esempio di catalisi radicalica ed inizia con lrsquoaggiunta di ammonio persolfato e della base NNNrsquoNrsquo-tetrametilendiammina (TEMED) Il TEMED catalizza la decomposizione dello ione persolfato con la produzione del corrispondente radicale libero (cioegrave una molecola con un elettrone spaiato) nel modo seguente
TEMED (iniziatore)TEMED (iniziatore)
Lrsquoammonio persolfato egrave lrsquoestere disolfato
dellrsquoacqua ossigenata e omolisa rapidamente a
radicali instabili (radicali solforici)
Il TEMED egrave unrsquoammina terziaria che reagisce con questi radicali a
formare radicali liberi TEMED che a loro volta
reagiscono con lrsquoacrilammide inducendone
la polimerizzazione
Se rappresentiamo il radicale libero con R ed il monomero di acrilammide con M possiamo schematizzare la polimerizzazione nel modo seguente
R + M rarr RMRM + M rarr RMMRMM + M rarr RMMM ecc
In questo modo si formano lunghe catene di acrilammide tenute insieme
tra loro da legami crociati derivanti dallrsquoinserzione occasionale
allrsquointerno della catena di molecole di bis-acrilammide
AcrilammideAcrilammide bis-acrilammidebis-acrilammide
GEL DI POLIACRILAMMIDEGEL DI POLIACRILAMMIDE(molto idrofilico =gt(molto idrofilico =gt
trattiene grosse quantitagrave di acqua)trattiene grosse quantitagrave di acqua)
TEMED (iniziatore)TEMED (iniziatore)
(catalizzatore)(catalizzatore)
ElettroforesiElettroforesiDenaturante
nativa
Elettroforesi denaturante o SDS PAGEElettroforesi denaturante o SDS PAGE
Per semplificare lrsquoanalisi di miscele di proteine egrave possibile fare in modo che la separazione elettroforetica si basi solo sulle dimensioni delle catene polipeptidiche
Ciograve si ottiene denaturando le proteine con il detergente Sodio Dodecil Solfato (SDS) Tale detergente si lega con forza alle proteine le quali si ripiegano a formare delle bacchette estese rivestite di SDS
La separazione delle catene polipeptidiche denaturate e rivestite di detergente si baseragrave quasi esclusivamente sulle dimensioni delle molecole proteiche per cui proteine piugrave piccole si muovono piugrave rapidamente attraverso il gel mentre quelle con dimensioni maggiori sono piugrave rallentate e migrano piugrave lentamente
proteinaproteina
Sodio Dodecil SolfatoSodio Dodecil SolfatoCH3(CH2)10CH2OSO3
- Na+
ElettroforesiElettroforesi
Elettroforesi in condizioni native
Separazione di proteine preservando la loro attivitagrave biologica
Le proteine conservano la loro carica nativa si separano mediante
le loro differenti mobilitagrave elettroforetiche e gli effetti setaccio del gel
Esempio separazione dei complessi della catena respiratoria in un
gradiente lineare o esponenziale
SDS PAGE
I V III IV
Elettroforesi in condizioni native
I
V
III
II
IV
IsoelettrofocalizzazioneIsoelettrofocalizzazione
Separazione delle proteine in base al loro punto isoelettrico
In un gel viene creato un gradiente di pH mediante lrsquoaggiunta di
appropriati anfoliti
La miscela di proteine viene posta in un pozzetto sul gel e viene
applicato un campo elettrico Le proteine entrano nel gel e
migrano fino a che non raggiungono un pH equivalente al punto
isoelettrico
Le proteine con punti isoelettrici diversi si distribuiscono in punti
diversi nel gel
Analisi quantitativa delle proteine presenti nel campione di interesse
Determinazione del peso molecolare di proteine sconosciute
Analisi qualitativa delle proteine presenti nel campione di interesse (colorazione con Coomassie o nitrato drsquoargento o western-blotting)
Applicazioni dellrsquoSDS-PAGEApplicazioni dellrsquoSDS-PAGE
Tecniche di rivelazioneTecniche di rivelazione
Il gel egrave immerso in una soluzione che contiene Coomassie Brilliant Blue R-250 sciolto in acido acetico diluito e metanolo Rivela 01 g di proteina
Coomassie Brilliant BlueIl gel si colora con una miscela di sali drsquoargento e formaldeideGli ioni drsquoargento reagiscono con i gruppi basici e tiolici delle proteine 100 volte piugrave sensibile
Silver
Al termine della corsa elettroforetica le proteine sono trasferita su un
filtro di nitrocellulosa mediante una procedura definita elettroblotting Il gel e la nitrocellulosa sono posti in un apposito cestello a forma
di sandwich immerso in un tampone nel quale ci sono due elettrodi
paralleli La corrente in direzione perpendicolare al gel trasferisce le proteine
sul foglio di nitrocellulosa
St C1 C2 C3 C4 C5 C6
Elettroforesi delle sieroproteineElettroforesi delle sieroproteine
Il termine cromatografia indica un insieme di tecniche che hanno lo
scopo di separare una miscela nei suoi componenti per permetterne il
riconoscimento qualitativo e quantitativo
Queste tecniche sono basate sulla distribuzione differenziale dei vari
componenti fra due fasi una chiamata fase fissa o fase stazionaria e
lrsquoaltra chiamata fase mobile o eluente che fluisce in continuo attraverso
la fase fissa
Cromatografia
Le fasi essenziali di un processo cromatografico sono 3
Caricamento del campione o della miscela da analizzare in una zona
ristretta della fase stazionaria
Eluizione della miscela dalla fase stazionaria per effettuare la
separazione nei singoli componenti
Rivelazione dei composti separati
In base alla forma del letto cromatograficondashCromatografia su colonna (impaccata open-tubular)
ndashCromatografia planare (su carta su strato sottile)
In base allo stato fisico della fase mobilendashCromatografia Liquida (LC)ndashGascromatografia (GC)
In base al meccanismo di separazionendashScambio ionicondashEsclusionendashAffinitagrave
Forma del letto cromatografico
Cromatografia su colonna la fase
stazionaria egrave contenuta allrsquointerno
di una colonna cilindrica che puograve
riempire completamente (colonna
impaccata) oppure rivestirne la
superficie interna (colonna
tubulare)
Cromatografia planare la fase
stazionaria egrave distribuita su una
superficie piana che puograve essere un
supporto cartaceo (cromatografia su
carta PC) o una lastrina in vetro o
altri materiali (cromatografia su
strato sottile TLC)
Gel filtrazione o esclusione molecolare
Separa le proteine in base alle dimensioni la matrice presente
nella colonna egrave un polimero con molti legami crociati che
generano pori con un diametro specifico Le proteine piugrave grandi
potranno migrare nella colonna piugrave velocemente in quanto non
possono entrare nei pori dei granuli della matrice il loro
percorso saragrave quindi diretto verso il fondo della colonna Le
proteine piugrave piccole potranno invece entrare nei pori
allungando il percorso che devono compiere per arrivare al
fondo della colonna
La matrice solida della colonna egrave un polimero sintetico contenente
gruppi carichi (quelli con gruppi anionici sono detti scambiatori di
cationi mentre quelli con gruppi cationici sono detti scambiatori di
anioni)
Lrsquo affinitagrave delle singole proteine del campione per i gruppi carichi
sulla colonna dipende dal pH della soluzione (che determina lo
stato di ionizzazione delle proteine) e dalla concentrazione di sali
(in grado di competere con le cariche delle proteine)
La separazione puograve essere ottimizzata variando gradualmente il
pH o la concentrazione salina in modo da creare un gradiente di
pH o un gradiente salino
Scambio ionico
Cromatografia per affinitagrave
Separa le proteine in base alla loro specificitagrave di legame
Le proteine sono trattenute sulla colonna solo se sono in
grado di legarsi a uno specifico ligando ancorato alla matrice
solida
Dopo aver allontanato dalla colonna le proteine che non si
possono legare la proteina viene eluita usando una soluzione
contenente ligando libero
- Slide 1
- Slide 2
- Slide 3
- Slide 4
- Slide 5
- Slide 6
- Slide 7
- Slide 8
- Slide 9
- Slide 10
- Slide 11
- Slide 12
- Slide 13
- Slide 14
- Slide 15
- Slide 16
- Slide 17
- Slide 18
- Slide 19
- Slide 20
- Slide 21
- Slide 22
- Slide 23
- Slide 24
- Slide 25
- Slide 26
- Slide 27
- Slide 28
- Slide 29
- Slide 30
- Slide 31
- Slide 32
- Slide 33
- Slide 34
- Slide 35
- Slide 36
- Slide 37
- Slide 38
- Slide 39
- Slide 40
- Slide 41
- Slide 42
- Slide 43
- Slide 44
- Slide 45
- Slide 46
- Slide 47
- Slide 48
-

Tecnica analitica e separativa basata sul movimento di particelle
elettricamente cariche immerse in un fluido per effetto di un campo elettrico
applicato mediante una coppia di elettrodi al fluido stesso
verso il catodo (particelle cariche positive= cationi)
verso lrsquoanodo (particelle cariche negative= anioni)
- +
+ + - +
- + - -
ElettroforesiElettroforesi
I fattori che influenzano la mobilitagrave di una molecola in un campo
elettrico comprendono la carica della molecola (q) il gradiente di
voltaggio del campo elettrico (E) la resistenza di attrito del mezzo
di supporto (f)
Mobilitagrave elettroforeticaMobilitagrave elettroforetica
La velocitagrave (v) di una molecola carica che si sposta in un campo
elettrico egrave data dunque dalla seguente equazione
v = Eq f
Comunemente egrave adoperato il termine mobilitagrave elettroforetica (μ)
dello ione che equivale alla velocitagrave dello ione diviso lrsquointensitagrave
del campo elettrico (vE)
Quando si applica una differenza di potenziale molecole con
carica elettrica totale differente inizieranno a separarsi in funzione
della loro mobilitagrave elettroforetica
Anche molecole con carica elettrica uguale ma con
dimensioni molecolari differenti si separeranno per effetto di
forze frizionali diverse
Apparecchiatura per elettroforesi
bullAlimentatore
elettrico
bullCella elettroforetica
bullsupporto
Per la maggior parte delle tecniche elettroforetiche si adoperano gel di
poliacrilammide o di agarosio
AcrilammideAcrilammide Bis-acrilammideBis-acrilammide
Materiali di supporto
I gel di poliacrilammide sono preparati facendo copolimerizzare monomeri
di acrilammide in presenza di piccole quantitagrave di NNrsquo-metilene
bisacrilammide (bis-acrilamide)
La bis-acrilammide composta da due molecole di acrilammide legate da
un gruppo metilene egrave utilizzata come agente in grado di formare legami
crociati (cross-linking agent)
Acrilammide
Il processo di polimerizzazione dellrsquoacrilammide egrave un tipico esempio di catalisi radicalica ed inizia con lrsquoaggiunta di ammonio persolfato e della base NNNrsquoNrsquo-tetrametilendiammina (TEMED) Il TEMED catalizza la decomposizione dello ione persolfato con la produzione del corrispondente radicale libero (cioegrave una molecola con un elettrone spaiato) nel modo seguente
TEMED (iniziatore)TEMED (iniziatore)
Lrsquoammonio persolfato egrave lrsquoestere disolfato
dellrsquoacqua ossigenata e omolisa rapidamente a
radicali instabili (radicali solforici)
Il TEMED egrave unrsquoammina terziaria che reagisce con questi radicali a
formare radicali liberi TEMED che a loro volta
reagiscono con lrsquoacrilammide inducendone
la polimerizzazione
Se rappresentiamo il radicale libero con R ed il monomero di acrilammide con M possiamo schematizzare la polimerizzazione nel modo seguente
R + M rarr RMRM + M rarr RMMRMM + M rarr RMMM ecc
In questo modo si formano lunghe catene di acrilammide tenute insieme
tra loro da legami crociati derivanti dallrsquoinserzione occasionale
allrsquointerno della catena di molecole di bis-acrilammide
AcrilammideAcrilammide bis-acrilammidebis-acrilammide
GEL DI POLIACRILAMMIDEGEL DI POLIACRILAMMIDE(molto idrofilico =gt(molto idrofilico =gt
trattiene grosse quantitagrave di acqua)trattiene grosse quantitagrave di acqua)
TEMED (iniziatore)TEMED (iniziatore)
(catalizzatore)(catalizzatore)
ElettroforesiElettroforesiDenaturante
nativa
Elettroforesi denaturante o SDS PAGEElettroforesi denaturante o SDS PAGE
Per semplificare lrsquoanalisi di miscele di proteine egrave possibile fare in modo che la separazione elettroforetica si basi solo sulle dimensioni delle catene polipeptidiche
Ciograve si ottiene denaturando le proteine con il detergente Sodio Dodecil Solfato (SDS) Tale detergente si lega con forza alle proteine le quali si ripiegano a formare delle bacchette estese rivestite di SDS
La separazione delle catene polipeptidiche denaturate e rivestite di detergente si baseragrave quasi esclusivamente sulle dimensioni delle molecole proteiche per cui proteine piugrave piccole si muovono piugrave rapidamente attraverso il gel mentre quelle con dimensioni maggiori sono piugrave rallentate e migrano piugrave lentamente
proteinaproteina
Sodio Dodecil SolfatoSodio Dodecil SolfatoCH3(CH2)10CH2OSO3
- Na+
ElettroforesiElettroforesi
Elettroforesi in condizioni native
Separazione di proteine preservando la loro attivitagrave biologica
Le proteine conservano la loro carica nativa si separano mediante
le loro differenti mobilitagrave elettroforetiche e gli effetti setaccio del gel
Esempio separazione dei complessi della catena respiratoria in un
gradiente lineare o esponenziale
SDS PAGE
I V III IV
Elettroforesi in condizioni native
I
V
III
II
IV
IsoelettrofocalizzazioneIsoelettrofocalizzazione
Separazione delle proteine in base al loro punto isoelettrico
In un gel viene creato un gradiente di pH mediante lrsquoaggiunta di
appropriati anfoliti
La miscela di proteine viene posta in un pozzetto sul gel e viene
applicato un campo elettrico Le proteine entrano nel gel e
migrano fino a che non raggiungono un pH equivalente al punto
isoelettrico
Le proteine con punti isoelettrici diversi si distribuiscono in punti
diversi nel gel
Analisi quantitativa delle proteine presenti nel campione di interesse
Determinazione del peso molecolare di proteine sconosciute
Analisi qualitativa delle proteine presenti nel campione di interesse (colorazione con Coomassie o nitrato drsquoargento o western-blotting)
Applicazioni dellrsquoSDS-PAGEApplicazioni dellrsquoSDS-PAGE
Tecniche di rivelazioneTecniche di rivelazione
Il gel egrave immerso in una soluzione che contiene Coomassie Brilliant Blue R-250 sciolto in acido acetico diluito e metanolo Rivela 01 g di proteina
Coomassie Brilliant BlueIl gel si colora con una miscela di sali drsquoargento e formaldeideGli ioni drsquoargento reagiscono con i gruppi basici e tiolici delle proteine 100 volte piugrave sensibile
Silver
Al termine della corsa elettroforetica le proteine sono trasferita su un
filtro di nitrocellulosa mediante una procedura definita elettroblotting Il gel e la nitrocellulosa sono posti in un apposito cestello a forma
di sandwich immerso in un tampone nel quale ci sono due elettrodi
paralleli La corrente in direzione perpendicolare al gel trasferisce le proteine
sul foglio di nitrocellulosa
St C1 C2 C3 C4 C5 C6
Elettroforesi delle sieroproteineElettroforesi delle sieroproteine
Il termine cromatografia indica un insieme di tecniche che hanno lo
scopo di separare una miscela nei suoi componenti per permetterne il
riconoscimento qualitativo e quantitativo
Queste tecniche sono basate sulla distribuzione differenziale dei vari
componenti fra due fasi una chiamata fase fissa o fase stazionaria e
lrsquoaltra chiamata fase mobile o eluente che fluisce in continuo attraverso
la fase fissa
Cromatografia
Le fasi essenziali di un processo cromatografico sono 3
Caricamento del campione o della miscela da analizzare in una zona
ristretta della fase stazionaria
Eluizione della miscela dalla fase stazionaria per effettuare la
separazione nei singoli componenti
Rivelazione dei composti separati
In base alla forma del letto cromatograficondashCromatografia su colonna (impaccata open-tubular)
ndashCromatografia planare (su carta su strato sottile)
In base allo stato fisico della fase mobilendashCromatografia Liquida (LC)ndashGascromatografia (GC)
In base al meccanismo di separazionendashScambio ionicondashEsclusionendashAffinitagrave
Forma del letto cromatografico
Cromatografia su colonna la fase
stazionaria egrave contenuta allrsquointerno
di una colonna cilindrica che puograve
riempire completamente (colonna
impaccata) oppure rivestirne la
superficie interna (colonna
tubulare)
Cromatografia planare la fase
stazionaria egrave distribuita su una
superficie piana che puograve essere un
supporto cartaceo (cromatografia su
carta PC) o una lastrina in vetro o
altri materiali (cromatografia su
strato sottile TLC)
Gel filtrazione o esclusione molecolare
Separa le proteine in base alle dimensioni la matrice presente
nella colonna egrave un polimero con molti legami crociati che
generano pori con un diametro specifico Le proteine piugrave grandi
potranno migrare nella colonna piugrave velocemente in quanto non
possono entrare nei pori dei granuli della matrice il loro
percorso saragrave quindi diretto verso il fondo della colonna Le
proteine piugrave piccole potranno invece entrare nei pori
allungando il percorso che devono compiere per arrivare al
fondo della colonna
La matrice solida della colonna egrave un polimero sintetico contenente
gruppi carichi (quelli con gruppi anionici sono detti scambiatori di
cationi mentre quelli con gruppi cationici sono detti scambiatori di
anioni)
Lrsquo affinitagrave delle singole proteine del campione per i gruppi carichi
sulla colonna dipende dal pH della soluzione (che determina lo
stato di ionizzazione delle proteine) e dalla concentrazione di sali
(in grado di competere con le cariche delle proteine)
La separazione puograve essere ottimizzata variando gradualmente il
pH o la concentrazione salina in modo da creare un gradiente di
pH o un gradiente salino
Scambio ionico
Cromatografia per affinitagrave
Separa le proteine in base alla loro specificitagrave di legame
Le proteine sono trattenute sulla colonna solo se sono in
grado di legarsi a uno specifico ligando ancorato alla matrice
solida
Dopo aver allontanato dalla colonna le proteine che non si
possono legare la proteina viene eluita usando una soluzione
contenente ligando libero
- Slide 1
- Slide 2
- Slide 3
- Slide 4
- Slide 5
- Slide 6
- Slide 7
- Slide 8
- Slide 9
- Slide 10
- Slide 11
- Slide 12
- Slide 13
- Slide 14
- Slide 15
- Slide 16
- Slide 17
- Slide 18
- Slide 19
- Slide 20
- Slide 21
- Slide 22
- Slide 23
- Slide 24
- Slide 25
- Slide 26
- Slide 27
- Slide 28
- Slide 29
- Slide 30
- Slide 31
- Slide 32
- Slide 33
- Slide 34
- Slide 35
- Slide 36
- Slide 37
- Slide 38
- Slide 39
- Slide 40
- Slide 41
- Slide 42
- Slide 43
- Slide 44
- Slide 45
- Slide 46
- Slide 47
- Slide 48
-

I fattori che influenzano la mobilitagrave di una molecola in un campo
elettrico comprendono la carica della molecola (q) il gradiente di
voltaggio del campo elettrico (E) la resistenza di attrito del mezzo
di supporto (f)
Mobilitagrave elettroforeticaMobilitagrave elettroforetica
La velocitagrave (v) di una molecola carica che si sposta in un campo
elettrico egrave data dunque dalla seguente equazione
v = Eq f
Comunemente egrave adoperato il termine mobilitagrave elettroforetica (μ)
dello ione che equivale alla velocitagrave dello ione diviso lrsquointensitagrave
del campo elettrico (vE)
Quando si applica una differenza di potenziale molecole con
carica elettrica totale differente inizieranno a separarsi in funzione
della loro mobilitagrave elettroforetica
Anche molecole con carica elettrica uguale ma con
dimensioni molecolari differenti si separeranno per effetto di
forze frizionali diverse
Apparecchiatura per elettroforesi
bullAlimentatore
elettrico
bullCella elettroforetica
bullsupporto
Per la maggior parte delle tecniche elettroforetiche si adoperano gel di
poliacrilammide o di agarosio
AcrilammideAcrilammide Bis-acrilammideBis-acrilammide
Materiali di supporto
I gel di poliacrilammide sono preparati facendo copolimerizzare monomeri
di acrilammide in presenza di piccole quantitagrave di NNrsquo-metilene
bisacrilammide (bis-acrilamide)
La bis-acrilammide composta da due molecole di acrilammide legate da
un gruppo metilene egrave utilizzata come agente in grado di formare legami
crociati (cross-linking agent)
Acrilammide
Il processo di polimerizzazione dellrsquoacrilammide egrave un tipico esempio di catalisi radicalica ed inizia con lrsquoaggiunta di ammonio persolfato e della base NNNrsquoNrsquo-tetrametilendiammina (TEMED) Il TEMED catalizza la decomposizione dello ione persolfato con la produzione del corrispondente radicale libero (cioegrave una molecola con un elettrone spaiato) nel modo seguente
TEMED (iniziatore)TEMED (iniziatore)
Lrsquoammonio persolfato egrave lrsquoestere disolfato
dellrsquoacqua ossigenata e omolisa rapidamente a
radicali instabili (radicali solforici)
Il TEMED egrave unrsquoammina terziaria che reagisce con questi radicali a
formare radicali liberi TEMED che a loro volta
reagiscono con lrsquoacrilammide inducendone
la polimerizzazione
Se rappresentiamo il radicale libero con R ed il monomero di acrilammide con M possiamo schematizzare la polimerizzazione nel modo seguente
R + M rarr RMRM + M rarr RMMRMM + M rarr RMMM ecc
In questo modo si formano lunghe catene di acrilammide tenute insieme
tra loro da legami crociati derivanti dallrsquoinserzione occasionale
allrsquointerno della catena di molecole di bis-acrilammide
AcrilammideAcrilammide bis-acrilammidebis-acrilammide
GEL DI POLIACRILAMMIDEGEL DI POLIACRILAMMIDE(molto idrofilico =gt(molto idrofilico =gt
trattiene grosse quantitagrave di acqua)trattiene grosse quantitagrave di acqua)
TEMED (iniziatore)TEMED (iniziatore)
(catalizzatore)(catalizzatore)
ElettroforesiElettroforesiDenaturante
nativa
Elettroforesi denaturante o SDS PAGEElettroforesi denaturante o SDS PAGE
Per semplificare lrsquoanalisi di miscele di proteine egrave possibile fare in modo che la separazione elettroforetica si basi solo sulle dimensioni delle catene polipeptidiche
Ciograve si ottiene denaturando le proteine con il detergente Sodio Dodecil Solfato (SDS) Tale detergente si lega con forza alle proteine le quali si ripiegano a formare delle bacchette estese rivestite di SDS
La separazione delle catene polipeptidiche denaturate e rivestite di detergente si baseragrave quasi esclusivamente sulle dimensioni delle molecole proteiche per cui proteine piugrave piccole si muovono piugrave rapidamente attraverso il gel mentre quelle con dimensioni maggiori sono piugrave rallentate e migrano piugrave lentamente
proteinaproteina
Sodio Dodecil SolfatoSodio Dodecil SolfatoCH3(CH2)10CH2OSO3
- Na+
ElettroforesiElettroforesi
Elettroforesi in condizioni native
Separazione di proteine preservando la loro attivitagrave biologica
Le proteine conservano la loro carica nativa si separano mediante
le loro differenti mobilitagrave elettroforetiche e gli effetti setaccio del gel
Esempio separazione dei complessi della catena respiratoria in un
gradiente lineare o esponenziale
SDS PAGE
I V III IV
Elettroforesi in condizioni native
I
V
III
II
IV
IsoelettrofocalizzazioneIsoelettrofocalizzazione
Separazione delle proteine in base al loro punto isoelettrico
In un gel viene creato un gradiente di pH mediante lrsquoaggiunta di
appropriati anfoliti
La miscela di proteine viene posta in un pozzetto sul gel e viene
applicato un campo elettrico Le proteine entrano nel gel e
migrano fino a che non raggiungono un pH equivalente al punto
isoelettrico
Le proteine con punti isoelettrici diversi si distribuiscono in punti
diversi nel gel
Analisi quantitativa delle proteine presenti nel campione di interesse
Determinazione del peso molecolare di proteine sconosciute
Analisi qualitativa delle proteine presenti nel campione di interesse (colorazione con Coomassie o nitrato drsquoargento o western-blotting)
Applicazioni dellrsquoSDS-PAGEApplicazioni dellrsquoSDS-PAGE
Tecniche di rivelazioneTecniche di rivelazione
Il gel egrave immerso in una soluzione che contiene Coomassie Brilliant Blue R-250 sciolto in acido acetico diluito e metanolo Rivela 01 g di proteina
Coomassie Brilliant BlueIl gel si colora con una miscela di sali drsquoargento e formaldeideGli ioni drsquoargento reagiscono con i gruppi basici e tiolici delle proteine 100 volte piugrave sensibile
Silver
Al termine della corsa elettroforetica le proteine sono trasferita su un
filtro di nitrocellulosa mediante una procedura definita elettroblotting Il gel e la nitrocellulosa sono posti in un apposito cestello a forma
di sandwich immerso in un tampone nel quale ci sono due elettrodi
paralleli La corrente in direzione perpendicolare al gel trasferisce le proteine
sul foglio di nitrocellulosa
St C1 C2 C3 C4 C5 C6
Elettroforesi delle sieroproteineElettroforesi delle sieroproteine
Il termine cromatografia indica un insieme di tecniche che hanno lo
scopo di separare una miscela nei suoi componenti per permetterne il
riconoscimento qualitativo e quantitativo
Queste tecniche sono basate sulla distribuzione differenziale dei vari
componenti fra due fasi una chiamata fase fissa o fase stazionaria e
lrsquoaltra chiamata fase mobile o eluente che fluisce in continuo attraverso
la fase fissa
Cromatografia
Le fasi essenziali di un processo cromatografico sono 3
Caricamento del campione o della miscela da analizzare in una zona
ristretta della fase stazionaria
Eluizione della miscela dalla fase stazionaria per effettuare la
separazione nei singoli componenti
Rivelazione dei composti separati
In base alla forma del letto cromatograficondashCromatografia su colonna (impaccata open-tubular)
ndashCromatografia planare (su carta su strato sottile)
In base allo stato fisico della fase mobilendashCromatografia Liquida (LC)ndashGascromatografia (GC)
In base al meccanismo di separazionendashScambio ionicondashEsclusionendashAffinitagrave
Forma del letto cromatografico
Cromatografia su colonna la fase
stazionaria egrave contenuta allrsquointerno
di una colonna cilindrica che puograve
riempire completamente (colonna
impaccata) oppure rivestirne la
superficie interna (colonna
tubulare)
Cromatografia planare la fase
stazionaria egrave distribuita su una
superficie piana che puograve essere un
supporto cartaceo (cromatografia su
carta PC) o una lastrina in vetro o
altri materiali (cromatografia su
strato sottile TLC)
Gel filtrazione o esclusione molecolare
Separa le proteine in base alle dimensioni la matrice presente
nella colonna egrave un polimero con molti legami crociati che
generano pori con un diametro specifico Le proteine piugrave grandi
potranno migrare nella colonna piugrave velocemente in quanto non
possono entrare nei pori dei granuli della matrice il loro
percorso saragrave quindi diretto verso il fondo della colonna Le
proteine piugrave piccole potranno invece entrare nei pori
allungando il percorso che devono compiere per arrivare al
fondo della colonna
La matrice solida della colonna egrave un polimero sintetico contenente
gruppi carichi (quelli con gruppi anionici sono detti scambiatori di
cationi mentre quelli con gruppi cationici sono detti scambiatori di
anioni)
Lrsquo affinitagrave delle singole proteine del campione per i gruppi carichi
sulla colonna dipende dal pH della soluzione (che determina lo
stato di ionizzazione delle proteine) e dalla concentrazione di sali
(in grado di competere con le cariche delle proteine)
La separazione puograve essere ottimizzata variando gradualmente il
pH o la concentrazione salina in modo da creare un gradiente di
pH o un gradiente salino
Scambio ionico
Cromatografia per affinitagrave
Separa le proteine in base alla loro specificitagrave di legame
Le proteine sono trattenute sulla colonna solo se sono in
grado di legarsi a uno specifico ligando ancorato alla matrice
solida
Dopo aver allontanato dalla colonna le proteine che non si
possono legare la proteina viene eluita usando una soluzione
contenente ligando libero
- Slide 1
- Slide 2
- Slide 3
- Slide 4
- Slide 5
- Slide 6
- Slide 7
- Slide 8
- Slide 9
- Slide 10
- Slide 11
- Slide 12
- Slide 13
- Slide 14
- Slide 15
- Slide 16
- Slide 17
- Slide 18
- Slide 19
- Slide 20
- Slide 21
- Slide 22
- Slide 23
- Slide 24
- Slide 25
- Slide 26
- Slide 27
- Slide 28
- Slide 29
- Slide 30
- Slide 31
- Slide 32
- Slide 33
- Slide 34
- Slide 35
- Slide 36
- Slide 37
- Slide 38
- Slide 39
- Slide 40
- Slide 41
- Slide 42
- Slide 43
- Slide 44
- Slide 45
- Slide 46
- Slide 47
- Slide 48
-

Comunemente egrave adoperato il termine mobilitagrave elettroforetica (μ)
dello ione che equivale alla velocitagrave dello ione diviso lrsquointensitagrave
del campo elettrico (vE)
Quando si applica una differenza di potenziale molecole con
carica elettrica totale differente inizieranno a separarsi in funzione
della loro mobilitagrave elettroforetica
Anche molecole con carica elettrica uguale ma con
dimensioni molecolari differenti si separeranno per effetto di
forze frizionali diverse
Apparecchiatura per elettroforesi
bullAlimentatore
elettrico
bullCella elettroforetica
bullsupporto
Per la maggior parte delle tecniche elettroforetiche si adoperano gel di
poliacrilammide o di agarosio
AcrilammideAcrilammide Bis-acrilammideBis-acrilammide
Materiali di supporto
I gel di poliacrilammide sono preparati facendo copolimerizzare monomeri
di acrilammide in presenza di piccole quantitagrave di NNrsquo-metilene
bisacrilammide (bis-acrilamide)
La bis-acrilammide composta da due molecole di acrilammide legate da
un gruppo metilene egrave utilizzata come agente in grado di formare legami
crociati (cross-linking agent)
Acrilammide
Il processo di polimerizzazione dellrsquoacrilammide egrave un tipico esempio di catalisi radicalica ed inizia con lrsquoaggiunta di ammonio persolfato e della base NNNrsquoNrsquo-tetrametilendiammina (TEMED) Il TEMED catalizza la decomposizione dello ione persolfato con la produzione del corrispondente radicale libero (cioegrave una molecola con un elettrone spaiato) nel modo seguente
TEMED (iniziatore)TEMED (iniziatore)
Lrsquoammonio persolfato egrave lrsquoestere disolfato
dellrsquoacqua ossigenata e omolisa rapidamente a
radicali instabili (radicali solforici)
Il TEMED egrave unrsquoammina terziaria che reagisce con questi radicali a
formare radicali liberi TEMED che a loro volta
reagiscono con lrsquoacrilammide inducendone
la polimerizzazione
Se rappresentiamo il radicale libero con R ed il monomero di acrilammide con M possiamo schematizzare la polimerizzazione nel modo seguente
R + M rarr RMRM + M rarr RMMRMM + M rarr RMMM ecc
In questo modo si formano lunghe catene di acrilammide tenute insieme
tra loro da legami crociati derivanti dallrsquoinserzione occasionale
allrsquointerno della catena di molecole di bis-acrilammide
AcrilammideAcrilammide bis-acrilammidebis-acrilammide
GEL DI POLIACRILAMMIDEGEL DI POLIACRILAMMIDE(molto idrofilico =gt(molto idrofilico =gt
trattiene grosse quantitagrave di acqua)trattiene grosse quantitagrave di acqua)
TEMED (iniziatore)TEMED (iniziatore)
(catalizzatore)(catalizzatore)
ElettroforesiElettroforesiDenaturante
nativa
Elettroforesi denaturante o SDS PAGEElettroforesi denaturante o SDS PAGE
Per semplificare lrsquoanalisi di miscele di proteine egrave possibile fare in modo che la separazione elettroforetica si basi solo sulle dimensioni delle catene polipeptidiche
Ciograve si ottiene denaturando le proteine con il detergente Sodio Dodecil Solfato (SDS) Tale detergente si lega con forza alle proteine le quali si ripiegano a formare delle bacchette estese rivestite di SDS
La separazione delle catene polipeptidiche denaturate e rivestite di detergente si baseragrave quasi esclusivamente sulle dimensioni delle molecole proteiche per cui proteine piugrave piccole si muovono piugrave rapidamente attraverso il gel mentre quelle con dimensioni maggiori sono piugrave rallentate e migrano piugrave lentamente
proteinaproteina
Sodio Dodecil SolfatoSodio Dodecil SolfatoCH3(CH2)10CH2OSO3
- Na+
ElettroforesiElettroforesi
Elettroforesi in condizioni native
Separazione di proteine preservando la loro attivitagrave biologica
Le proteine conservano la loro carica nativa si separano mediante
le loro differenti mobilitagrave elettroforetiche e gli effetti setaccio del gel
Esempio separazione dei complessi della catena respiratoria in un
gradiente lineare o esponenziale
SDS PAGE
I V III IV
Elettroforesi in condizioni native
I
V
III
II
IV
IsoelettrofocalizzazioneIsoelettrofocalizzazione
Separazione delle proteine in base al loro punto isoelettrico
In un gel viene creato un gradiente di pH mediante lrsquoaggiunta di
appropriati anfoliti
La miscela di proteine viene posta in un pozzetto sul gel e viene
applicato un campo elettrico Le proteine entrano nel gel e
migrano fino a che non raggiungono un pH equivalente al punto
isoelettrico
Le proteine con punti isoelettrici diversi si distribuiscono in punti
diversi nel gel
Analisi quantitativa delle proteine presenti nel campione di interesse
Determinazione del peso molecolare di proteine sconosciute
Analisi qualitativa delle proteine presenti nel campione di interesse (colorazione con Coomassie o nitrato drsquoargento o western-blotting)
Applicazioni dellrsquoSDS-PAGEApplicazioni dellrsquoSDS-PAGE
Tecniche di rivelazioneTecniche di rivelazione
Il gel egrave immerso in una soluzione che contiene Coomassie Brilliant Blue R-250 sciolto in acido acetico diluito e metanolo Rivela 01 g di proteina
Coomassie Brilliant BlueIl gel si colora con una miscela di sali drsquoargento e formaldeideGli ioni drsquoargento reagiscono con i gruppi basici e tiolici delle proteine 100 volte piugrave sensibile
Silver
Al termine della corsa elettroforetica le proteine sono trasferita su un
filtro di nitrocellulosa mediante una procedura definita elettroblotting Il gel e la nitrocellulosa sono posti in un apposito cestello a forma
di sandwich immerso in un tampone nel quale ci sono due elettrodi
paralleli La corrente in direzione perpendicolare al gel trasferisce le proteine
sul foglio di nitrocellulosa
St C1 C2 C3 C4 C5 C6
Elettroforesi delle sieroproteineElettroforesi delle sieroproteine
Il termine cromatografia indica un insieme di tecniche che hanno lo
scopo di separare una miscela nei suoi componenti per permetterne il
riconoscimento qualitativo e quantitativo
Queste tecniche sono basate sulla distribuzione differenziale dei vari
componenti fra due fasi una chiamata fase fissa o fase stazionaria e
lrsquoaltra chiamata fase mobile o eluente che fluisce in continuo attraverso
la fase fissa
Cromatografia
Le fasi essenziali di un processo cromatografico sono 3
Caricamento del campione o della miscela da analizzare in una zona
ristretta della fase stazionaria
Eluizione della miscela dalla fase stazionaria per effettuare la
separazione nei singoli componenti
Rivelazione dei composti separati
In base alla forma del letto cromatograficondashCromatografia su colonna (impaccata open-tubular)
ndashCromatografia planare (su carta su strato sottile)
In base allo stato fisico della fase mobilendashCromatografia Liquida (LC)ndashGascromatografia (GC)
In base al meccanismo di separazionendashScambio ionicondashEsclusionendashAffinitagrave
Forma del letto cromatografico
Cromatografia su colonna la fase
stazionaria egrave contenuta allrsquointerno
di una colonna cilindrica che puograve
riempire completamente (colonna
impaccata) oppure rivestirne la
superficie interna (colonna
tubulare)
Cromatografia planare la fase
stazionaria egrave distribuita su una
superficie piana che puograve essere un
supporto cartaceo (cromatografia su
carta PC) o una lastrina in vetro o
altri materiali (cromatografia su
strato sottile TLC)
Gel filtrazione o esclusione molecolare
Separa le proteine in base alle dimensioni la matrice presente
nella colonna egrave un polimero con molti legami crociati che
generano pori con un diametro specifico Le proteine piugrave grandi
potranno migrare nella colonna piugrave velocemente in quanto non
possono entrare nei pori dei granuli della matrice il loro
percorso saragrave quindi diretto verso il fondo della colonna Le
proteine piugrave piccole potranno invece entrare nei pori
allungando il percorso che devono compiere per arrivare al
fondo della colonna
La matrice solida della colonna egrave un polimero sintetico contenente
gruppi carichi (quelli con gruppi anionici sono detti scambiatori di
cationi mentre quelli con gruppi cationici sono detti scambiatori di
anioni)
Lrsquo affinitagrave delle singole proteine del campione per i gruppi carichi
sulla colonna dipende dal pH della soluzione (che determina lo
stato di ionizzazione delle proteine) e dalla concentrazione di sali
(in grado di competere con le cariche delle proteine)
La separazione puograve essere ottimizzata variando gradualmente il
pH o la concentrazione salina in modo da creare un gradiente di
pH o un gradiente salino
Scambio ionico
Cromatografia per affinitagrave
Separa le proteine in base alla loro specificitagrave di legame
Le proteine sono trattenute sulla colonna solo se sono in
grado di legarsi a uno specifico ligando ancorato alla matrice
solida
Dopo aver allontanato dalla colonna le proteine che non si
possono legare la proteina viene eluita usando una soluzione
contenente ligando libero
- Slide 1
- Slide 2
- Slide 3
- Slide 4
- Slide 5
- Slide 6
- Slide 7
- Slide 8
- Slide 9
- Slide 10
- Slide 11
- Slide 12
- Slide 13
- Slide 14
- Slide 15
- Slide 16
- Slide 17
- Slide 18
- Slide 19
- Slide 20
- Slide 21
- Slide 22
- Slide 23
- Slide 24
- Slide 25
- Slide 26
- Slide 27
- Slide 28
- Slide 29
- Slide 30
- Slide 31
- Slide 32
- Slide 33
- Slide 34
- Slide 35
- Slide 36
- Slide 37
- Slide 38
- Slide 39
- Slide 40
- Slide 41
- Slide 42
- Slide 43
- Slide 44
- Slide 45
- Slide 46
- Slide 47
- Slide 48
-

Apparecchiatura per elettroforesi
bullAlimentatore
elettrico
bullCella elettroforetica
bullsupporto
Per la maggior parte delle tecniche elettroforetiche si adoperano gel di
poliacrilammide o di agarosio
AcrilammideAcrilammide Bis-acrilammideBis-acrilammide
Materiali di supporto
I gel di poliacrilammide sono preparati facendo copolimerizzare monomeri
di acrilammide in presenza di piccole quantitagrave di NNrsquo-metilene
bisacrilammide (bis-acrilamide)
La bis-acrilammide composta da due molecole di acrilammide legate da
un gruppo metilene egrave utilizzata come agente in grado di formare legami
crociati (cross-linking agent)
Acrilammide
Il processo di polimerizzazione dellrsquoacrilammide egrave un tipico esempio di catalisi radicalica ed inizia con lrsquoaggiunta di ammonio persolfato e della base NNNrsquoNrsquo-tetrametilendiammina (TEMED) Il TEMED catalizza la decomposizione dello ione persolfato con la produzione del corrispondente radicale libero (cioegrave una molecola con un elettrone spaiato) nel modo seguente
TEMED (iniziatore)TEMED (iniziatore)
Lrsquoammonio persolfato egrave lrsquoestere disolfato
dellrsquoacqua ossigenata e omolisa rapidamente a
radicali instabili (radicali solforici)
Il TEMED egrave unrsquoammina terziaria che reagisce con questi radicali a
formare radicali liberi TEMED che a loro volta
reagiscono con lrsquoacrilammide inducendone
la polimerizzazione
Se rappresentiamo il radicale libero con R ed il monomero di acrilammide con M possiamo schematizzare la polimerizzazione nel modo seguente
R + M rarr RMRM + M rarr RMMRMM + M rarr RMMM ecc
In questo modo si formano lunghe catene di acrilammide tenute insieme
tra loro da legami crociati derivanti dallrsquoinserzione occasionale
allrsquointerno della catena di molecole di bis-acrilammide
AcrilammideAcrilammide bis-acrilammidebis-acrilammide
GEL DI POLIACRILAMMIDEGEL DI POLIACRILAMMIDE(molto idrofilico =gt(molto idrofilico =gt
trattiene grosse quantitagrave di acqua)trattiene grosse quantitagrave di acqua)
TEMED (iniziatore)TEMED (iniziatore)
(catalizzatore)(catalizzatore)
ElettroforesiElettroforesiDenaturante
nativa
Elettroforesi denaturante o SDS PAGEElettroforesi denaturante o SDS PAGE
Per semplificare lrsquoanalisi di miscele di proteine egrave possibile fare in modo che la separazione elettroforetica si basi solo sulle dimensioni delle catene polipeptidiche
Ciograve si ottiene denaturando le proteine con il detergente Sodio Dodecil Solfato (SDS) Tale detergente si lega con forza alle proteine le quali si ripiegano a formare delle bacchette estese rivestite di SDS
La separazione delle catene polipeptidiche denaturate e rivestite di detergente si baseragrave quasi esclusivamente sulle dimensioni delle molecole proteiche per cui proteine piugrave piccole si muovono piugrave rapidamente attraverso il gel mentre quelle con dimensioni maggiori sono piugrave rallentate e migrano piugrave lentamente
proteinaproteina
Sodio Dodecil SolfatoSodio Dodecil SolfatoCH3(CH2)10CH2OSO3
- Na+
ElettroforesiElettroforesi
Elettroforesi in condizioni native
Separazione di proteine preservando la loro attivitagrave biologica
Le proteine conservano la loro carica nativa si separano mediante
le loro differenti mobilitagrave elettroforetiche e gli effetti setaccio del gel
Esempio separazione dei complessi della catena respiratoria in un
gradiente lineare o esponenziale
SDS PAGE
I V III IV
Elettroforesi in condizioni native
I
V
III
II
IV
IsoelettrofocalizzazioneIsoelettrofocalizzazione
Separazione delle proteine in base al loro punto isoelettrico
In un gel viene creato un gradiente di pH mediante lrsquoaggiunta di
appropriati anfoliti
La miscela di proteine viene posta in un pozzetto sul gel e viene
applicato un campo elettrico Le proteine entrano nel gel e
migrano fino a che non raggiungono un pH equivalente al punto
isoelettrico
Le proteine con punti isoelettrici diversi si distribuiscono in punti
diversi nel gel
Analisi quantitativa delle proteine presenti nel campione di interesse
Determinazione del peso molecolare di proteine sconosciute
Analisi qualitativa delle proteine presenti nel campione di interesse (colorazione con Coomassie o nitrato drsquoargento o western-blotting)
Applicazioni dellrsquoSDS-PAGEApplicazioni dellrsquoSDS-PAGE
Tecniche di rivelazioneTecniche di rivelazione
Il gel egrave immerso in una soluzione che contiene Coomassie Brilliant Blue R-250 sciolto in acido acetico diluito e metanolo Rivela 01 g di proteina
Coomassie Brilliant BlueIl gel si colora con una miscela di sali drsquoargento e formaldeideGli ioni drsquoargento reagiscono con i gruppi basici e tiolici delle proteine 100 volte piugrave sensibile
Silver
Al termine della corsa elettroforetica le proteine sono trasferita su un
filtro di nitrocellulosa mediante una procedura definita elettroblotting Il gel e la nitrocellulosa sono posti in un apposito cestello a forma
di sandwich immerso in un tampone nel quale ci sono due elettrodi
paralleli La corrente in direzione perpendicolare al gel trasferisce le proteine
sul foglio di nitrocellulosa
St C1 C2 C3 C4 C5 C6
Elettroforesi delle sieroproteineElettroforesi delle sieroproteine
Il termine cromatografia indica un insieme di tecniche che hanno lo
scopo di separare una miscela nei suoi componenti per permetterne il
riconoscimento qualitativo e quantitativo
Queste tecniche sono basate sulla distribuzione differenziale dei vari
componenti fra due fasi una chiamata fase fissa o fase stazionaria e
lrsquoaltra chiamata fase mobile o eluente che fluisce in continuo attraverso
la fase fissa
Cromatografia
Le fasi essenziali di un processo cromatografico sono 3
Caricamento del campione o della miscela da analizzare in una zona
ristretta della fase stazionaria
Eluizione della miscela dalla fase stazionaria per effettuare la
separazione nei singoli componenti
Rivelazione dei composti separati
In base alla forma del letto cromatograficondashCromatografia su colonna (impaccata open-tubular)
ndashCromatografia planare (su carta su strato sottile)
In base allo stato fisico della fase mobilendashCromatografia Liquida (LC)ndashGascromatografia (GC)
In base al meccanismo di separazionendashScambio ionicondashEsclusionendashAffinitagrave
Forma del letto cromatografico
Cromatografia su colonna la fase
stazionaria egrave contenuta allrsquointerno
di una colonna cilindrica che puograve
riempire completamente (colonna
impaccata) oppure rivestirne la
superficie interna (colonna
tubulare)
Cromatografia planare la fase
stazionaria egrave distribuita su una
superficie piana che puograve essere un
supporto cartaceo (cromatografia su
carta PC) o una lastrina in vetro o
altri materiali (cromatografia su
strato sottile TLC)
Gel filtrazione o esclusione molecolare
Separa le proteine in base alle dimensioni la matrice presente
nella colonna egrave un polimero con molti legami crociati che
generano pori con un diametro specifico Le proteine piugrave grandi
potranno migrare nella colonna piugrave velocemente in quanto non
possono entrare nei pori dei granuli della matrice il loro
percorso saragrave quindi diretto verso il fondo della colonna Le
proteine piugrave piccole potranno invece entrare nei pori
allungando il percorso che devono compiere per arrivare al
fondo della colonna
La matrice solida della colonna egrave un polimero sintetico contenente
gruppi carichi (quelli con gruppi anionici sono detti scambiatori di
cationi mentre quelli con gruppi cationici sono detti scambiatori di
anioni)
Lrsquo affinitagrave delle singole proteine del campione per i gruppi carichi
sulla colonna dipende dal pH della soluzione (che determina lo
stato di ionizzazione delle proteine) e dalla concentrazione di sali
(in grado di competere con le cariche delle proteine)
La separazione puograve essere ottimizzata variando gradualmente il
pH o la concentrazione salina in modo da creare un gradiente di
pH o un gradiente salino
Scambio ionico
Cromatografia per affinitagrave
Separa le proteine in base alla loro specificitagrave di legame
Le proteine sono trattenute sulla colonna solo se sono in
grado di legarsi a uno specifico ligando ancorato alla matrice
solida
Dopo aver allontanato dalla colonna le proteine che non si
possono legare la proteina viene eluita usando una soluzione
contenente ligando libero
- Slide 1
- Slide 2
- Slide 3
- Slide 4
- Slide 5
- Slide 6
- Slide 7
- Slide 8
- Slide 9
- Slide 10
- Slide 11
- Slide 12
- Slide 13
- Slide 14
- Slide 15
- Slide 16
- Slide 17
- Slide 18
- Slide 19
- Slide 20
- Slide 21
- Slide 22
- Slide 23
- Slide 24
- Slide 25
- Slide 26
- Slide 27
- Slide 28
- Slide 29
- Slide 30
- Slide 31
- Slide 32
- Slide 33
- Slide 34
- Slide 35
- Slide 36
- Slide 37
- Slide 38
- Slide 39
- Slide 40
- Slide 41
- Slide 42
- Slide 43
- Slide 44
- Slide 45
- Slide 46
- Slide 47
- Slide 48
-

Per la maggior parte delle tecniche elettroforetiche si adoperano gel di
poliacrilammide o di agarosio
AcrilammideAcrilammide Bis-acrilammideBis-acrilammide
Materiali di supporto
I gel di poliacrilammide sono preparati facendo copolimerizzare monomeri
di acrilammide in presenza di piccole quantitagrave di NNrsquo-metilene
bisacrilammide (bis-acrilamide)
La bis-acrilammide composta da due molecole di acrilammide legate da
un gruppo metilene egrave utilizzata come agente in grado di formare legami
crociati (cross-linking agent)
Acrilammide
Il processo di polimerizzazione dellrsquoacrilammide egrave un tipico esempio di catalisi radicalica ed inizia con lrsquoaggiunta di ammonio persolfato e della base NNNrsquoNrsquo-tetrametilendiammina (TEMED) Il TEMED catalizza la decomposizione dello ione persolfato con la produzione del corrispondente radicale libero (cioegrave una molecola con un elettrone spaiato) nel modo seguente
TEMED (iniziatore)TEMED (iniziatore)
Lrsquoammonio persolfato egrave lrsquoestere disolfato
dellrsquoacqua ossigenata e omolisa rapidamente a
radicali instabili (radicali solforici)
Il TEMED egrave unrsquoammina terziaria che reagisce con questi radicali a
formare radicali liberi TEMED che a loro volta
reagiscono con lrsquoacrilammide inducendone
la polimerizzazione
Se rappresentiamo il radicale libero con R ed il monomero di acrilammide con M possiamo schematizzare la polimerizzazione nel modo seguente
R + M rarr RMRM + M rarr RMMRMM + M rarr RMMM ecc
In questo modo si formano lunghe catene di acrilammide tenute insieme
tra loro da legami crociati derivanti dallrsquoinserzione occasionale
allrsquointerno della catena di molecole di bis-acrilammide
AcrilammideAcrilammide bis-acrilammidebis-acrilammide
GEL DI POLIACRILAMMIDEGEL DI POLIACRILAMMIDE(molto idrofilico =gt(molto idrofilico =gt
trattiene grosse quantitagrave di acqua)trattiene grosse quantitagrave di acqua)
TEMED (iniziatore)TEMED (iniziatore)
(catalizzatore)(catalizzatore)
ElettroforesiElettroforesiDenaturante
nativa
Elettroforesi denaturante o SDS PAGEElettroforesi denaturante o SDS PAGE
Per semplificare lrsquoanalisi di miscele di proteine egrave possibile fare in modo che la separazione elettroforetica si basi solo sulle dimensioni delle catene polipeptidiche
Ciograve si ottiene denaturando le proteine con il detergente Sodio Dodecil Solfato (SDS) Tale detergente si lega con forza alle proteine le quali si ripiegano a formare delle bacchette estese rivestite di SDS
La separazione delle catene polipeptidiche denaturate e rivestite di detergente si baseragrave quasi esclusivamente sulle dimensioni delle molecole proteiche per cui proteine piugrave piccole si muovono piugrave rapidamente attraverso il gel mentre quelle con dimensioni maggiori sono piugrave rallentate e migrano piugrave lentamente
proteinaproteina
Sodio Dodecil SolfatoSodio Dodecil SolfatoCH3(CH2)10CH2OSO3
- Na+
ElettroforesiElettroforesi
Elettroforesi in condizioni native
Separazione di proteine preservando la loro attivitagrave biologica
Le proteine conservano la loro carica nativa si separano mediante
le loro differenti mobilitagrave elettroforetiche e gli effetti setaccio del gel
Esempio separazione dei complessi della catena respiratoria in un
gradiente lineare o esponenziale
SDS PAGE
I V III IV
Elettroforesi in condizioni native
I
V
III
II
IV
IsoelettrofocalizzazioneIsoelettrofocalizzazione
Separazione delle proteine in base al loro punto isoelettrico
In un gel viene creato un gradiente di pH mediante lrsquoaggiunta di
appropriati anfoliti
La miscela di proteine viene posta in un pozzetto sul gel e viene
applicato un campo elettrico Le proteine entrano nel gel e
migrano fino a che non raggiungono un pH equivalente al punto
isoelettrico
Le proteine con punti isoelettrici diversi si distribuiscono in punti
diversi nel gel
Analisi quantitativa delle proteine presenti nel campione di interesse
Determinazione del peso molecolare di proteine sconosciute
Analisi qualitativa delle proteine presenti nel campione di interesse (colorazione con Coomassie o nitrato drsquoargento o western-blotting)
Applicazioni dellrsquoSDS-PAGEApplicazioni dellrsquoSDS-PAGE
Tecniche di rivelazioneTecniche di rivelazione
Il gel egrave immerso in una soluzione che contiene Coomassie Brilliant Blue R-250 sciolto in acido acetico diluito e metanolo Rivela 01 g di proteina
Coomassie Brilliant BlueIl gel si colora con una miscela di sali drsquoargento e formaldeideGli ioni drsquoargento reagiscono con i gruppi basici e tiolici delle proteine 100 volte piugrave sensibile
Silver
Al termine della corsa elettroforetica le proteine sono trasferita su un
filtro di nitrocellulosa mediante una procedura definita elettroblotting Il gel e la nitrocellulosa sono posti in un apposito cestello a forma
di sandwich immerso in un tampone nel quale ci sono due elettrodi
paralleli La corrente in direzione perpendicolare al gel trasferisce le proteine
sul foglio di nitrocellulosa
St C1 C2 C3 C4 C5 C6
Elettroforesi delle sieroproteineElettroforesi delle sieroproteine
Il termine cromatografia indica un insieme di tecniche che hanno lo
scopo di separare una miscela nei suoi componenti per permetterne il
riconoscimento qualitativo e quantitativo
Queste tecniche sono basate sulla distribuzione differenziale dei vari
componenti fra due fasi una chiamata fase fissa o fase stazionaria e
lrsquoaltra chiamata fase mobile o eluente che fluisce in continuo attraverso
la fase fissa
Cromatografia
Le fasi essenziali di un processo cromatografico sono 3
Caricamento del campione o della miscela da analizzare in una zona
ristretta della fase stazionaria
Eluizione della miscela dalla fase stazionaria per effettuare la
separazione nei singoli componenti
Rivelazione dei composti separati
In base alla forma del letto cromatograficondashCromatografia su colonna (impaccata open-tubular)
ndashCromatografia planare (su carta su strato sottile)
In base allo stato fisico della fase mobilendashCromatografia Liquida (LC)ndashGascromatografia (GC)
In base al meccanismo di separazionendashScambio ionicondashEsclusionendashAffinitagrave
Forma del letto cromatografico
Cromatografia su colonna la fase
stazionaria egrave contenuta allrsquointerno
di una colonna cilindrica che puograve
riempire completamente (colonna
impaccata) oppure rivestirne la
superficie interna (colonna
tubulare)
Cromatografia planare la fase
stazionaria egrave distribuita su una
superficie piana che puograve essere un
supporto cartaceo (cromatografia su
carta PC) o una lastrina in vetro o
altri materiali (cromatografia su
strato sottile TLC)
Gel filtrazione o esclusione molecolare
Separa le proteine in base alle dimensioni la matrice presente
nella colonna egrave un polimero con molti legami crociati che
generano pori con un diametro specifico Le proteine piugrave grandi
potranno migrare nella colonna piugrave velocemente in quanto non
possono entrare nei pori dei granuli della matrice il loro
percorso saragrave quindi diretto verso il fondo della colonna Le
proteine piugrave piccole potranno invece entrare nei pori
allungando il percorso che devono compiere per arrivare al
fondo della colonna
La matrice solida della colonna egrave un polimero sintetico contenente
gruppi carichi (quelli con gruppi anionici sono detti scambiatori di
cationi mentre quelli con gruppi cationici sono detti scambiatori di
anioni)
Lrsquo affinitagrave delle singole proteine del campione per i gruppi carichi
sulla colonna dipende dal pH della soluzione (che determina lo
stato di ionizzazione delle proteine) e dalla concentrazione di sali
(in grado di competere con le cariche delle proteine)
La separazione puograve essere ottimizzata variando gradualmente il
pH o la concentrazione salina in modo da creare un gradiente di
pH o un gradiente salino
Scambio ionico
Cromatografia per affinitagrave
Separa le proteine in base alla loro specificitagrave di legame
Le proteine sono trattenute sulla colonna solo se sono in
grado di legarsi a uno specifico ligando ancorato alla matrice
solida
Dopo aver allontanato dalla colonna le proteine che non si
possono legare la proteina viene eluita usando una soluzione
contenente ligando libero
- Slide 1
- Slide 2
- Slide 3
- Slide 4
- Slide 5
- Slide 6
- Slide 7
- Slide 8
- Slide 9
- Slide 10
- Slide 11
- Slide 12
- Slide 13
- Slide 14
- Slide 15
- Slide 16
- Slide 17
- Slide 18
- Slide 19
- Slide 20
- Slide 21
- Slide 22
- Slide 23
- Slide 24
- Slide 25
- Slide 26
- Slide 27
- Slide 28
- Slide 29
- Slide 30
- Slide 31
- Slide 32
- Slide 33
- Slide 34
- Slide 35
- Slide 36
- Slide 37
- Slide 38
- Slide 39
- Slide 40
- Slide 41
- Slide 42
- Slide 43
- Slide 44
- Slide 45
- Slide 46
- Slide 47
- Slide 48
-

Il processo di polimerizzazione dellrsquoacrilammide egrave un tipico esempio di catalisi radicalica ed inizia con lrsquoaggiunta di ammonio persolfato e della base NNNrsquoNrsquo-tetrametilendiammina (TEMED) Il TEMED catalizza la decomposizione dello ione persolfato con la produzione del corrispondente radicale libero (cioegrave una molecola con un elettrone spaiato) nel modo seguente
TEMED (iniziatore)TEMED (iniziatore)
Lrsquoammonio persolfato egrave lrsquoestere disolfato
dellrsquoacqua ossigenata e omolisa rapidamente a
radicali instabili (radicali solforici)
Il TEMED egrave unrsquoammina terziaria che reagisce con questi radicali a
formare radicali liberi TEMED che a loro volta
reagiscono con lrsquoacrilammide inducendone
la polimerizzazione
Se rappresentiamo il radicale libero con R ed il monomero di acrilammide con M possiamo schematizzare la polimerizzazione nel modo seguente
R + M rarr RMRM + M rarr RMMRMM + M rarr RMMM ecc
In questo modo si formano lunghe catene di acrilammide tenute insieme
tra loro da legami crociati derivanti dallrsquoinserzione occasionale
allrsquointerno della catena di molecole di bis-acrilammide
AcrilammideAcrilammide bis-acrilammidebis-acrilammide
GEL DI POLIACRILAMMIDEGEL DI POLIACRILAMMIDE(molto idrofilico =gt(molto idrofilico =gt
trattiene grosse quantitagrave di acqua)trattiene grosse quantitagrave di acqua)
TEMED (iniziatore)TEMED (iniziatore)
(catalizzatore)(catalizzatore)
ElettroforesiElettroforesiDenaturante
nativa
Elettroforesi denaturante o SDS PAGEElettroforesi denaturante o SDS PAGE
Per semplificare lrsquoanalisi di miscele di proteine egrave possibile fare in modo che la separazione elettroforetica si basi solo sulle dimensioni delle catene polipeptidiche
Ciograve si ottiene denaturando le proteine con il detergente Sodio Dodecil Solfato (SDS) Tale detergente si lega con forza alle proteine le quali si ripiegano a formare delle bacchette estese rivestite di SDS
La separazione delle catene polipeptidiche denaturate e rivestite di detergente si baseragrave quasi esclusivamente sulle dimensioni delle molecole proteiche per cui proteine piugrave piccole si muovono piugrave rapidamente attraverso il gel mentre quelle con dimensioni maggiori sono piugrave rallentate e migrano piugrave lentamente
proteinaproteina
Sodio Dodecil SolfatoSodio Dodecil SolfatoCH3(CH2)10CH2OSO3
- Na+
ElettroforesiElettroforesi
Elettroforesi in condizioni native
Separazione di proteine preservando la loro attivitagrave biologica
Le proteine conservano la loro carica nativa si separano mediante
le loro differenti mobilitagrave elettroforetiche e gli effetti setaccio del gel
Esempio separazione dei complessi della catena respiratoria in un
gradiente lineare o esponenziale
SDS PAGE
I V III IV
Elettroforesi in condizioni native
I
V
III
II
IV
IsoelettrofocalizzazioneIsoelettrofocalizzazione
Separazione delle proteine in base al loro punto isoelettrico
In un gel viene creato un gradiente di pH mediante lrsquoaggiunta di
appropriati anfoliti
La miscela di proteine viene posta in un pozzetto sul gel e viene
applicato un campo elettrico Le proteine entrano nel gel e
migrano fino a che non raggiungono un pH equivalente al punto
isoelettrico
Le proteine con punti isoelettrici diversi si distribuiscono in punti
diversi nel gel
Analisi quantitativa delle proteine presenti nel campione di interesse
Determinazione del peso molecolare di proteine sconosciute
Analisi qualitativa delle proteine presenti nel campione di interesse (colorazione con Coomassie o nitrato drsquoargento o western-blotting)
Applicazioni dellrsquoSDS-PAGEApplicazioni dellrsquoSDS-PAGE
Tecniche di rivelazioneTecniche di rivelazione
Il gel egrave immerso in una soluzione che contiene Coomassie Brilliant Blue R-250 sciolto in acido acetico diluito e metanolo Rivela 01 g di proteina
Coomassie Brilliant BlueIl gel si colora con una miscela di sali drsquoargento e formaldeideGli ioni drsquoargento reagiscono con i gruppi basici e tiolici delle proteine 100 volte piugrave sensibile
Silver
Al termine della corsa elettroforetica le proteine sono trasferita su un
filtro di nitrocellulosa mediante una procedura definita elettroblotting Il gel e la nitrocellulosa sono posti in un apposito cestello a forma
di sandwich immerso in un tampone nel quale ci sono due elettrodi
paralleli La corrente in direzione perpendicolare al gel trasferisce le proteine
sul foglio di nitrocellulosa
St C1 C2 C3 C4 C5 C6
Elettroforesi delle sieroproteineElettroforesi delle sieroproteine
Il termine cromatografia indica un insieme di tecniche che hanno lo
scopo di separare una miscela nei suoi componenti per permetterne il
riconoscimento qualitativo e quantitativo
Queste tecniche sono basate sulla distribuzione differenziale dei vari
componenti fra due fasi una chiamata fase fissa o fase stazionaria e
lrsquoaltra chiamata fase mobile o eluente che fluisce in continuo attraverso
la fase fissa
Cromatografia
Le fasi essenziali di un processo cromatografico sono 3
Caricamento del campione o della miscela da analizzare in una zona
ristretta della fase stazionaria
Eluizione della miscela dalla fase stazionaria per effettuare la
separazione nei singoli componenti
Rivelazione dei composti separati
In base alla forma del letto cromatograficondashCromatografia su colonna (impaccata open-tubular)
ndashCromatografia planare (su carta su strato sottile)
In base allo stato fisico della fase mobilendashCromatografia Liquida (LC)ndashGascromatografia (GC)
In base al meccanismo di separazionendashScambio ionicondashEsclusionendashAffinitagrave
Forma del letto cromatografico
Cromatografia su colonna la fase
stazionaria egrave contenuta allrsquointerno
di una colonna cilindrica che puograve
riempire completamente (colonna
impaccata) oppure rivestirne la
superficie interna (colonna
tubulare)
Cromatografia planare la fase
stazionaria egrave distribuita su una
superficie piana che puograve essere un
supporto cartaceo (cromatografia su
carta PC) o una lastrina in vetro o
altri materiali (cromatografia su
strato sottile TLC)
Gel filtrazione o esclusione molecolare
Separa le proteine in base alle dimensioni la matrice presente
nella colonna egrave un polimero con molti legami crociati che
generano pori con un diametro specifico Le proteine piugrave grandi
potranno migrare nella colonna piugrave velocemente in quanto non
possono entrare nei pori dei granuli della matrice il loro
percorso saragrave quindi diretto verso il fondo della colonna Le
proteine piugrave piccole potranno invece entrare nei pori
allungando il percorso che devono compiere per arrivare al
fondo della colonna
La matrice solida della colonna egrave un polimero sintetico contenente
gruppi carichi (quelli con gruppi anionici sono detti scambiatori di
cationi mentre quelli con gruppi cationici sono detti scambiatori di
anioni)
Lrsquo affinitagrave delle singole proteine del campione per i gruppi carichi
sulla colonna dipende dal pH della soluzione (che determina lo
stato di ionizzazione delle proteine) e dalla concentrazione di sali
(in grado di competere con le cariche delle proteine)
La separazione puograve essere ottimizzata variando gradualmente il
pH o la concentrazione salina in modo da creare un gradiente di
pH o un gradiente salino
Scambio ionico
Cromatografia per affinitagrave
Separa le proteine in base alla loro specificitagrave di legame
Le proteine sono trattenute sulla colonna solo se sono in
grado di legarsi a uno specifico ligando ancorato alla matrice
solida
Dopo aver allontanato dalla colonna le proteine che non si
possono legare la proteina viene eluita usando una soluzione
contenente ligando libero
- Slide 1
- Slide 2
- Slide 3
- Slide 4
- Slide 5
- Slide 6
- Slide 7
- Slide 8
- Slide 9
- Slide 10
- Slide 11
- Slide 12
- Slide 13
- Slide 14
- Slide 15
- Slide 16
- Slide 17
- Slide 18
- Slide 19
- Slide 20
- Slide 21
- Slide 22
- Slide 23
- Slide 24
- Slide 25
- Slide 26
- Slide 27
- Slide 28
- Slide 29
- Slide 30
- Slide 31
- Slide 32
- Slide 33
- Slide 34
- Slide 35
- Slide 36
- Slide 37
- Slide 38
- Slide 39
- Slide 40
- Slide 41
- Slide 42
- Slide 43
- Slide 44
- Slide 45
- Slide 46
- Slide 47
- Slide 48
-

In questo modo si formano lunghe catene di acrilammide tenute insieme
tra loro da legami crociati derivanti dallrsquoinserzione occasionale
allrsquointerno della catena di molecole di bis-acrilammide
AcrilammideAcrilammide bis-acrilammidebis-acrilammide
GEL DI POLIACRILAMMIDEGEL DI POLIACRILAMMIDE(molto idrofilico =gt(molto idrofilico =gt
trattiene grosse quantitagrave di acqua)trattiene grosse quantitagrave di acqua)
TEMED (iniziatore)TEMED (iniziatore)
(catalizzatore)(catalizzatore)
ElettroforesiElettroforesiDenaturante
nativa
Elettroforesi denaturante o SDS PAGEElettroforesi denaturante o SDS PAGE
Per semplificare lrsquoanalisi di miscele di proteine egrave possibile fare in modo che la separazione elettroforetica si basi solo sulle dimensioni delle catene polipeptidiche
Ciograve si ottiene denaturando le proteine con il detergente Sodio Dodecil Solfato (SDS) Tale detergente si lega con forza alle proteine le quali si ripiegano a formare delle bacchette estese rivestite di SDS
La separazione delle catene polipeptidiche denaturate e rivestite di detergente si baseragrave quasi esclusivamente sulle dimensioni delle molecole proteiche per cui proteine piugrave piccole si muovono piugrave rapidamente attraverso il gel mentre quelle con dimensioni maggiori sono piugrave rallentate e migrano piugrave lentamente
proteinaproteina
Sodio Dodecil SolfatoSodio Dodecil SolfatoCH3(CH2)10CH2OSO3
- Na+
ElettroforesiElettroforesi
Elettroforesi in condizioni native
Separazione di proteine preservando la loro attivitagrave biologica
Le proteine conservano la loro carica nativa si separano mediante
le loro differenti mobilitagrave elettroforetiche e gli effetti setaccio del gel
Esempio separazione dei complessi della catena respiratoria in un
gradiente lineare o esponenziale
SDS PAGE
I V III IV
Elettroforesi in condizioni native
I
V
III
II
IV
IsoelettrofocalizzazioneIsoelettrofocalizzazione
Separazione delle proteine in base al loro punto isoelettrico
In un gel viene creato un gradiente di pH mediante lrsquoaggiunta di
appropriati anfoliti
La miscela di proteine viene posta in un pozzetto sul gel e viene
applicato un campo elettrico Le proteine entrano nel gel e
migrano fino a che non raggiungono un pH equivalente al punto
isoelettrico
Le proteine con punti isoelettrici diversi si distribuiscono in punti
diversi nel gel
Analisi quantitativa delle proteine presenti nel campione di interesse
Determinazione del peso molecolare di proteine sconosciute
Analisi qualitativa delle proteine presenti nel campione di interesse (colorazione con Coomassie o nitrato drsquoargento o western-blotting)
Applicazioni dellrsquoSDS-PAGEApplicazioni dellrsquoSDS-PAGE
Tecniche di rivelazioneTecniche di rivelazione
Il gel egrave immerso in una soluzione che contiene Coomassie Brilliant Blue R-250 sciolto in acido acetico diluito e metanolo Rivela 01 g di proteina
Coomassie Brilliant BlueIl gel si colora con una miscela di sali drsquoargento e formaldeideGli ioni drsquoargento reagiscono con i gruppi basici e tiolici delle proteine 100 volte piugrave sensibile
Silver
Al termine della corsa elettroforetica le proteine sono trasferita su un
filtro di nitrocellulosa mediante una procedura definita elettroblotting Il gel e la nitrocellulosa sono posti in un apposito cestello a forma
di sandwich immerso in un tampone nel quale ci sono due elettrodi
paralleli La corrente in direzione perpendicolare al gel trasferisce le proteine
sul foglio di nitrocellulosa
St C1 C2 C3 C4 C5 C6
Elettroforesi delle sieroproteineElettroforesi delle sieroproteine
Il termine cromatografia indica un insieme di tecniche che hanno lo
scopo di separare una miscela nei suoi componenti per permetterne il
riconoscimento qualitativo e quantitativo
Queste tecniche sono basate sulla distribuzione differenziale dei vari
componenti fra due fasi una chiamata fase fissa o fase stazionaria e
lrsquoaltra chiamata fase mobile o eluente che fluisce in continuo attraverso
la fase fissa
Cromatografia
Le fasi essenziali di un processo cromatografico sono 3
Caricamento del campione o della miscela da analizzare in una zona
ristretta della fase stazionaria
Eluizione della miscela dalla fase stazionaria per effettuare la
separazione nei singoli componenti
Rivelazione dei composti separati
In base alla forma del letto cromatograficondashCromatografia su colonna (impaccata open-tubular)
ndashCromatografia planare (su carta su strato sottile)
In base allo stato fisico della fase mobilendashCromatografia Liquida (LC)ndashGascromatografia (GC)
In base al meccanismo di separazionendashScambio ionicondashEsclusionendashAffinitagrave
Forma del letto cromatografico
Cromatografia su colonna la fase
stazionaria egrave contenuta allrsquointerno
di una colonna cilindrica che puograve
riempire completamente (colonna
impaccata) oppure rivestirne la
superficie interna (colonna
tubulare)
Cromatografia planare la fase
stazionaria egrave distribuita su una
superficie piana che puograve essere un
supporto cartaceo (cromatografia su
carta PC) o una lastrina in vetro o
altri materiali (cromatografia su
strato sottile TLC)
Gel filtrazione o esclusione molecolare
Separa le proteine in base alle dimensioni la matrice presente
nella colonna egrave un polimero con molti legami crociati che
generano pori con un diametro specifico Le proteine piugrave grandi
potranno migrare nella colonna piugrave velocemente in quanto non
possono entrare nei pori dei granuli della matrice il loro
percorso saragrave quindi diretto verso il fondo della colonna Le
proteine piugrave piccole potranno invece entrare nei pori
allungando il percorso che devono compiere per arrivare al
fondo della colonna
La matrice solida della colonna egrave un polimero sintetico contenente
gruppi carichi (quelli con gruppi anionici sono detti scambiatori di
cationi mentre quelli con gruppi cationici sono detti scambiatori di
anioni)
Lrsquo affinitagrave delle singole proteine del campione per i gruppi carichi
sulla colonna dipende dal pH della soluzione (che determina lo
stato di ionizzazione delle proteine) e dalla concentrazione di sali
(in grado di competere con le cariche delle proteine)
La separazione puograve essere ottimizzata variando gradualmente il
pH o la concentrazione salina in modo da creare un gradiente di
pH o un gradiente salino
Scambio ionico
Cromatografia per affinitagrave
Separa le proteine in base alla loro specificitagrave di legame
Le proteine sono trattenute sulla colonna solo se sono in
grado di legarsi a uno specifico ligando ancorato alla matrice
solida
Dopo aver allontanato dalla colonna le proteine che non si
possono legare la proteina viene eluita usando una soluzione
contenente ligando libero
- Slide 1
- Slide 2
- Slide 3
- Slide 4
- Slide 5
- Slide 6
- Slide 7
- Slide 8
- Slide 9
- Slide 10
- Slide 11
- Slide 12
- Slide 13
- Slide 14
- Slide 15
- Slide 16
- Slide 17
- Slide 18
- Slide 19
- Slide 20
- Slide 21
- Slide 22
- Slide 23
- Slide 24
- Slide 25
- Slide 26
- Slide 27
- Slide 28
- Slide 29
- Slide 30
- Slide 31
- Slide 32
- Slide 33
- Slide 34
- Slide 35
- Slide 36
- Slide 37
- Slide 38
- Slide 39
- Slide 40
- Slide 41
- Slide 42
- Slide 43
- Slide 44
- Slide 45
- Slide 46
- Slide 47
- Slide 48
-

ElettroforesiElettroforesiDenaturante
nativa
Elettroforesi denaturante o SDS PAGEElettroforesi denaturante o SDS PAGE
Per semplificare lrsquoanalisi di miscele di proteine egrave possibile fare in modo che la separazione elettroforetica si basi solo sulle dimensioni delle catene polipeptidiche
Ciograve si ottiene denaturando le proteine con il detergente Sodio Dodecil Solfato (SDS) Tale detergente si lega con forza alle proteine le quali si ripiegano a formare delle bacchette estese rivestite di SDS
La separazione delle catene polipeptidiche denaturate e rivestite di detergente si baseragrave quasi esclusivamente sulle dimensioni delle molecole proteiche per cui proteine piugrave piccole si muovono piugrave rapidamente attraverso il gel mentre quelle con dimensioni maggiori sono piugrave rallentate e migrano piugrave lentamente
proteinaproteina
Sodio Dodecil SolfatoSodio Dodecil SolfatoCH3(CH2)10CH2OSO3
- Na+
ElettroforesiElettroforesi
Elettroforesi in condizioni native
Separazione di proteine preservando la loro attivitagrave biologica
Le proteine conservano la loro carica nativa si separano mediante
le loro differenti mobilitagrave elettroforetiche e gli effetti setaccio del gel
Esempio separazione dei complessi della catena respiratoria in un
gradiente lineare o esponenziale
SDS PAGE
I V III IV
Elettroforesi in condizioni native
I
V
III
II
IV
IsoelettrofocalizzazioneIsoelettrofocalizzazione
Separazione delle proteine in base al loro punto isoelettrico
In un gel viene creato un gradiente di pH mediante lrsquoaggiunta di
appropriati anfoliti
La miscela di proteine viene posta in un pozzetto sul gel e viene
applicato un campo elettrico Le proteine entrano nel gel e
migrano fino a che non raggiungono un pH equivalente al punto
isoelettrico
Le proteine con punti isoelettrici diversi si distribuiscono in punti
diversi nel gel
Analisi quantitativa delle proteine presenti nel campione di interesse
Determinazione del peso molecolare di proteine sconosciute
Analisi qualitativa delle proteine presenti nel campione di interesse (colorazione con Coomassie o nitrato drsquoargento o western-blotting)
Applicazioni dellrsquoSDS-PAGEApplicazioni dellrsquoSDS-PAGE
Tecniche di rivelazioneTecniche di rivelazione
Il gel egrave immerso in una soluzione che contiene Coomassie Brilliant Blue R-250 sciolto in acido acetico diluito e metanolo Rivela 01 g di proteina
Coomassie Brilliant BlueIl gel si colora con una miscela di sali drsquoargento e formaldeideGli ioni drsquoargento reagiscono con i gruppi basici e tiolici delle proteine 100 volte piugrave sensibile
Silver
Al termine della corsa elettroforetica le proteine sono trasferita su un
filtro di nitrocellulosa mediante una procedura definita elettroblotting Il gel e la nitrocellulosa sono posti in un apposito cestello a forma
di sandwich immerso in un tampone nel quale ci sono due elettrodi
paralleli La corrente in direzione perpendicolare al gel trasferisce le proteine
sul foglio di nitrocellulosa
St C1 C2 C3 C4 C5 C6
Elettroforesi delle sieroproteineElettroforesi delle sieroproteine
Il termine cromatografia indica un insieme di tecniche che hanno lo
scopo di separare una miscela nei suoi componenti per permetterne il
riconoscimento qualitativo e quantitativo
Queste tecniche sono basate sulla distribuzione differenziale dei vari
componenti fra due fasi una chiamata fase fissa o fase stazionaria e
lrsquoaltra chiamata fase mobile o eluente che fluisce in continuo attraverso
la fase fissa
Cromatografia
Le fasi essenziali di un processo cromatografico sono 3
Caricamento del campione o della miscela da analizzare in una zona
ristretta della fase stazionaria
Eluizione della miscela dalla fase stazionaria per effettuare la
separazione nei singoli componenti
Rivelazione dei composti separati
In base alla forma del letto cromatograficondashCromatografia su colonna (impaccata open-tubular)
ndashCromatografia planare (su carta su strato sottile)
In base allo stato fisico della fase mobilendashCromatografia Liquida (LC)ndashGascromatografia (GC)
In base al meccanismo di separazionendashScambio ionicondashEsclusionendashAffinitagrave
Forma del letto cromatografico
Cromatografia su colonna la fase
stazionaria egrave contenuta allrsquointerno
di una colonna cilindrica che puograve
riempire completamente (colonna
impaccata) oppure rivestirne la
superficie interna (colonna
tubulare)
Cromatografia planare la fase
stazionaria egrave distribuita su una
superficie piana che puograve essere un
supporto cartaceo (cromatografia su
carta PC) o una lastrina in vetro o
altri materiali (cromatografia su
strato sottile TLC)
Gel filtrazione o esclusione molecolare
Separa le proteine in base alle dimensioni la matrice presente
nella colonna egrave un polimero con molti legami crociati che
generano pori con un diametro specifico Le proteine piugrave grandi
potranno migrare nella colonna piugrave velocemente in quanto non
possono entrare nei pori dei granuli della matrice il loro
percorso saragrave quindi diretto verso il fondo della colonna Le
proteine piugrave piccole potranno invece entrare nei pori
allungando il percorso che devono compiere per arrivare al
fondo della colonna
La matrice solida della colonna egrave un polimero sintetico contenente
gruppi carichi (quelli con gruppi anionici sono detti scambiatori di
cationi mentre quelli con gruppi cationici sono detti scambiatori di
anioni)
Lrsquo affinitagrave delle singole proteine del campione per i gruppi carichi
sulla colonna dipende dal pH della soluzione (che determina lo
stato di ionizzazione delle proteine) e dalla concentrazione di sali
(in grado di competere con le cariche delle proteine)
La separazione puograve essere ottimizzata variando gradualmente il
pH o la concentrazione salina in modo da creare un gradiente di
pH o un gradiente salino
Scambio ionico
Cromatografia per affinitagrave
Separa le proteine in base alla loro specificitagrave di legame
Le proteine sono trattenute sulla colonna solo se sono in
grado di legarsi a uno specifico ligando ancorato alla matrice
solida
Dopo aver allontanato dalla colonna le proteine che non si
possono legare la proteina viene eluita usando una soluzione
contenente ligando libero
- Slide 1
- Slide 2
- Slide 3
- Slide 4
- Slide 5
- Slide 6
- Slide 7
- Slide 8
- Slide 9
- Slide 10
- Slide 11
- Slide 12
- Slide 13
- Slide 14
- Slide 15
- Slide 16
- Slide 17
- Slide 18
- Slide 19
- Slide 20
- Slide 21
- Slide 22
- Slide 23
- Slide 24
- Slide 25
- Slide 26
- Slide 27
- Slide 28
- Slide 29
- Slide 30
- Slide 31
- Slide 32
- Slide 33
- Slide 34
- Slide 35
- Slide 36
- Slide 37
- Slide 38
- Slide 39
- Slide 40
- Slide 41
- Slide 42
- Slide 43
- Slide 44
- Slide 45
- Slide 46
- Slide 47
- Slide 48
-

proteinaproteina
Sodio Dodecil SolfatoSodio Dodecil SolfatoCH3(CH2)10CH2OSO3
- Na+
ElettroforesiElettroforesi
Elettroforesi in condizioni native
Separazione di proteine preservando la loro attivitagrave biologica
Le proteine conservano la loro carica nativa si separano mediante
le loro differenti mobilitagrave elettroforetiche e gli effetti setaccio del gel
Esempio separazione dei complessi della catena respiratoria in un
gradiente lineare o esponenziale
SDS PAGE
I V III IV
Elettroforesi in condizioni native
I
V
III
II
IV
IsoelettrofocalizzazioneIsoelettrofocalizzazione
Separazione delle proteine in base al loro punto isoelettrico
In un gel viene creato un gradiente di pH mediante lrsquoaggiunta di
appropriati anfoliti
La miscela di proteine viene posta in un pozzetto sul gel e viene
applicato un campo elettrico Le proteine entrano nel gel e
migrano fino a che non raggiungono un pH equivalente al punto
isoelettrico
Le proteine con punti isoelettrici diversi si distribuiscono in punti
diversi nel gel
Analisi quantitativa delle proteine presenti nel campione di interesse
Determinazione del peso molecolare di proteine sconosciute
Analisi qualitativa delle proteine presenti nel campione di interesse (colorazione con Coomassie o nitrato drsquoargento o western-blotting)
Applicazioni dellrsquoSDS-PAGEApplicazioni dellrsquoSDS-PAGE
Tecniche di rivelazioneTecniche di rivelazione
Il gel egrave immerso in una soluzione che contiene Coomassie Brilliant Blue R-250 sciolto in acido acetico diluito e metanolo Rivela 01 g di proteina
Coomassie Brilliant BlueIl gel si colora con una miscela di sali drsquoargento e formaldeideGli ioni drsquoargento reagiscono con i gruppi basici e tiolici delle proteine 100 volte piugrave sensibile
Silver
Al termine della corsa elettroforetica le proteine sono trasferita su un
filtro di nitrocellulosa mediante una procedura definita elettroblotting Il gel e la nitrocellulosa sono posti in un apposito cestello a forma
di sandwich immerso in un tampone nel quale ci sono due elettrodi
paralleli La corrente in direzione perpendicolare al gel trasferisce le proteine
sul foglio di nitrocellulosa
St C1 C2 C3 C4 C5 C6
Elettroforesi delle sieroproteineElettroforesi delle sieroproteine
Il termine cromatografia indica un insieme di tecniche che hanno lo
scopo di separare una miscela nei suoi componenti per permetterne il
riconoscimento qualitativo e quantitativo
Queste tecniche sono basate sulla distribuzione differenziale dei vari
componenti fra due fasi una chiamata fase fissa o fase stazionaria e
lrsquoaltra chiamata fase mobile o eluente che fluisce in continuo attraverso
la fase fissa
Cromatografia
Le fasi essenziali di un processo cromatografico sono 3
Caricamento del campione o della miscela da analizzare in una zona
ristretta della fase stazionaria
Eluizione della miscela dalla fase stazionaria per effettuare la
separazione nei singoli componenti
Rivelazione dei composti separati
In base alla forma del letto cromatograficondashCromatografia su colonna (impaccata open-tubular)
ndashCromatografia planare (su carta su strato sottile)
In base allo stato fisico della fase mobilendashCromatografia Liquida (LC)ndashGascromatografia (GC)
In base al meccanismo di separazionendashScambio ionicondashEsclusionendashAffinitagrave
Forma del letto cromatografico
Cromatografia su colonna la fase
stazionaria egrave contenuta allrsquointerno
di una colonna cilindrica che puograve
riempire completamente (colonna
impaccata) oppure rivestirne la
superficie interna (colonna
tubulare)
Cromatografia planare la fase
stazionaria egrave distribuita su una
superficie piana che puograve essere un
supporto cartaceo (cromatografia su
carta PC) o una lastrina in vetro o
altri materiali (cromatografia su
strato sottile TLC)
Gel filtrazione o esclusione molecolare
Separa le proteine in base alle dimensioni la matrice presente
nella colonna egrave un polimero con molti legami crociati che
generano pori con un diametro specifico Le proteine piugrave grandi
potranno migrare nella colonna piugrave velocemente in quanto non
possono entrare nei pori dei granuli della matrice il loro
percorso saragrave quindi diretto verso il fondo della colonna Le
proteine piugrave piccole potranno invece entrare nei pori
allungando il percorso che devono compiere per arrivare al
fondo della colonna
La matrice solida della colonna egrave un polimero sintetico contenente
gruppi carichi (quelli con gruppi anionici sono detti scambiatori di
cationi mentre quelli con gruppi cationici sono detti scambiatori di
anioni)
Lrsquo affinitagrave delle singole proteine del campione per i gruppi carichi
sulla colonna dipende dal pH della soluzione (che determina lo
stato di ionizzazione delle proteine) e dalla concentrazione di sali
(in grado di competere con le cariche delle proteine)
La separazione puograve essere ottimizzata variando gradualmente il
pH o la concentrazione salina in modo da creare un gradiente di
pH o un gradiente salino
Scambio ionico
Cromatografia per affinitagrave
Separa le proteine in base alla loro specificitagrave di legame
Le proteine sono trattenute sulla colonna solo se sono in
grado di legarsi a uno specifico ligando ancorato alla matrice
solida
Dopo aver allontanato dalla colonna le proteine che non si
possono legare la proteina viene eluita usando una soluzione
contenente ligando libero
- Slide 1
- Slide 2
- Slide 3
- Slide 4
- Slide 5
- Slide 6
- Slide 7
- Slide 8
- Slide 9
- Slide 10
- Slide 11
- Slide 12
- Slide 13
- Slide 14
- Slide 15
- Slide 16
- Slide 17
- Slide 18
- Slide 19
- Slide 20
- Slide 21
- Slide 22
- Slide 23
- Slide 24
- Slide 25
- Slide 26
- Slide 27
- Slide 28
- Slide 29
- Slide 30
- Slide 31
- Slide 32
- Slide 33
- Slide 34
- Slide 35
- Slide 36
- Slide 37
- Slide 38
- Slide 39
- Slide 40
- Slide 41
- Slide 42
- Slide 43
- Slide 44
- Slide 45
- Slide 46
- Slide 47
- Slide 48
-

ElettroforesiElettroforesi
Elettroforesi in condizioni native
Separazione di proteine preservando la loro attivitagrave biologica
Le proteine conservano la loro carica nativa si separano mediante
le loro differenti mobilitagrave elettroforetiche e gli effetti setaccio del gel
Esempio separazione dei complessi della catena respiratoria in un
gradiente lineare o esponenziale
SDS PAGE
I V III IV
Elettroforesi in condizioni native
I
V
III
II
IV
IsoelettrofocalizzazioneIsoelettrofocalizzazione
Separazione delle proteine in base al loro punto isoelettrico
In un gel viene creato un gradiente di pH mediante lrsquoaggiunta di
appropriati anfoliti
La miscela di proteine viene posta in un pozzetto sul gel e viene
applicato un campo elettrico Le proteine entrano nel gel e
migrano fino a che non raggiungono un pH equivalente al punto
isoelettrico
Le proteine con punti isoelettrici diversi si distribuiscono in punti
diversi nel gel
Analisi quantitativa delle proteine presenti nel campione di interesse
Determinazione del peso molecolare di proteine sconosciute
Analisi qualitativa delle proteine presenti nel campione di interesse (colorazione con Coomassie o nitrato drsquoargento o western-blotting)
Applicazioni dellrsquoSDS-PAGEApplicazioni dellrsquoSDS-PAGE
Tecniche di rivelazioneTecniche di rivelazione
Il gel egrave immerso in una soluzione che contiene Coomassie Brilliant Blue R-250 sciolto in acido acetico diluito e metanolo Rivela 01 g di proteina
Coomassie Brilliant BlueIl gel si colora con una miscela di sali drsquoargento e formaldeideGli ioni drsquoargento reagiscono con i gruppi basici e tiolici delle proteine 100 volte piugrave sensibile
Silver
Al termine della corsa elettroforetica le proteine sono trasferita su un
filtro di nitrocellulosa mediante una procedura definita elettroblotting Il gel e la nitrocellulosa sono posti in un apposito cestello a forma
di sandwich immerso in un tampone nel quale ci sono due elettrodi
paralleli La corrente in direzione perpendicolare al gel trasferisce le proteine
sul foglio di nitrocellulosa
St C1 C2 C3 C4 C5 C6
Elettroforesi delle sieroproteineElettroforesi delle sieroproteine
Il termine cromatografia indica un insieme di tecniche che hanno lo
scopo di separare una miscela nei suoi componenti per permetterne il
riconoscimento qualitativo e quantitativo
Queste tecniche sono basate sulla distribuzione differenziale dei vari
componenti fra due fasi una chiamata fase fissa o fase stazionaria e
lrsquoaltra chiamata fase mobile o eluente che fluisce in continuo attraverso
la fase fissa
Cromatografia
Le fasi essenziali di un processo cromatografico sono 3
Caricamento del campione o della miscela da analizzare in una zona
ristretta della fase stazionaria
Eluizione della miscela dalla fase stazionaria per effettuare la
separazione nei singoli componenti
Rivelazione dei composti separati
In base alla forma del letto cromatograficondashCromatografia su colonna (impaccata open-tubular)
ndashCromatografia planare (su carta su strato sottile)
In base allo stato fisico della fase mobilendashCromatografia Liquida (LC)ndashGascromatografia (GC)
In base al meccanismo di separazionendashScambio ionicondashEsclusionendashAffinitagrave
Forma del letto cromatografico
Cromatografia su colonna la fase
stazionaria egrave contenuta allrsquointerno
di una colonna cilindrica che puograve
riempire completamente (colonna
impaccata) oppure rivestirne la
superficie interna (colonna
tubulare)
Cromatografia planare la fase
stazionaria egrave distribuita su una
superficie piana che puograve essere un
supporto cartaceo (cromatografia su
carta PC) o una lastrina in vetro o
altri materiali (cromatografia su
strato sottile TLC)
Gel filtrazione o esclusione molecolare
Separa le proteine in base alle dimensioni la matrice presente
nella colonna egrave un polimero con molti legami crociati che
generano pori con un diametro specifico Le proteine piugrave grandi
potranno migrare nella colonna piugrave velocemente in quanto non
possono entrare nei pori dei granuli della matrice il loro
percorso saragrave quindi diretto verso il fondo della colonna Le
proteine piugrave piccole potranno invece entrare nei pori
allungando il percorso che devono compiere per arrivare al
fondo della colonna
La matrice solida della colonna egrave un polimero sintetico contenente
gruppi carichi (quelli con gruppi anionici sono detti scambiatori di
cationi mentre quelli con gruppi cationici sono detti scambiatori di
anioni)
Lrsquo affinitagrave delle singole proteine del campione per i gruppi carichi
sulla colonna dipende dal pH della soluzione (che determina lo
stato di ionizzazione delle proteine) e dalla concentrazione di sali
(in grado di competere con le cariche delle proteine)
La separazione puograve essere ottimizzata variando gradualmente il
pH o la concentrazione salina in modo da creare un gradiente di
pH o un gradiente salino
Scambio ionico
Cromatografia per affinitagrave
Separa le proteine in base alla loro specificitagrave di legame
Le proteine sono trattenute sulla colonna solo se sono in
grado di legarsi a uno specifico ligando ancorato alla matrice
solida
Dopo aver allontanato dalla colonna le proteine che non si
possono legare la proteina viene eluita usando una soluzione
contenente ligando libero
- Slide 1
- Slide 2
- Slide 3
- Slide 4
- Slide 5
- Slide 6
- Slide 7
- Slide 8
- Slide 9
- Slide 10
- Slide 11
- Slide 12
- Slide 13
- Slide 14
- Slide 15
- Slide 16
- Slide 17
- Slide 18
- Slide 19
- Slide 20
- Slide 21
- Slide 22
- Slide 23
- Slide 24
- Slide 25
- Slide 26
- Slide 27
- Slide 28
- Slide 29
- Slide 30
- Slide 31
- Slide 32
- Slide 33
- Slide 34
- Slide 35
- Slide 36
- Slide 37
- Slide 38
- Slide 39
- Slide 40
- Slide 41
- Slide 42
- Slide 43
- Slide 44
- Slide 45
- Slide 46
- Slide 47
- Slide 48
-

Elettroforesi in condizioni native
Separazione di proteine preservando la loro attivitagrave biologica
Le proteine conservano la loro carica nativa si separano mediante
le loro differenti mobilitagrave elettroforetiche e gli effetti setaccio del gel
Esempio separazione dei complessi della catena respiratoria in un
gradiente lineare o esponenziale
SDS PAGE
I V III IV
Elettroforesi in condizioni native
I
V
III
II
IV
IsoelettrofocalizzazioneIsoelettrofocalizzazione
Separazione delle proteine in base al loro punto isoelettrico
In un gel viene creato un gradiente di pH mediante lrsquoaggiunta di
appropriati anfoliti
La miscela di proteine viene posta in un pozzetto sul gel e viene
applicato un campo elettrico Le proteine entrano nel gel e
migrano fino a che non raggiungono un pH equivalente al punto
isoelettrico
Le proteine con punti isoelettrici diversi si distribuiscono in punti
diversi nel gel
Analisi quantitativa delle proteine presenti nel campione di interesse
Determinazione del peso molecolare di proteine sconosciute
Analisi qualitativa delle proteine presenti nel campione di interesse (colorazione con Coomassie o nitrato drsquoargento o western-blotting)
Applicazioni dellrsquoSDS-PAGEApplicazioni dellrsquoSDS-PAGE
Tecniche di rivelazioneTecniche di rivelazione
Il gel egrave immerso in una soluzione che contiene Coomassie Brilliant Blue R-250 sciolto in acido acetico diluito e metanolo Rivela 01 g di proteina
Coomassie Brilliant BlueIl gel si colora con una miscela di sali drsquoargento e formaldeideGli ioni drsquoargento reagiscono con i gruppi basici e tiolici delle proteine 100 volte piugrave sensibile
Silver
Al termine della corsa elettroforetica le proteine sono trasferita su un
filtro di nitrocellulosa mediante una procedura definita elettroblotting Il gel e la nitrocellulosa sono posti in un apposito cestello a forma
di sandwich immerso in un tampone nel quale ci sono due elettrodi
paralleli La corrente in direzione perpendicolare al gel trasferisce le proteine
sul foglio di nitrocellulosa
St C1 C2 C3 C4 C5 C6
Elettroforesi delle sieroproteineElettroforesi delle sieroproteine
Il termine cromatografia indica un insieme di tecniche che hanno lo
scopo di separare una miscela nei suoi componenti per permetterne il
riconoscimento qualitativo e quantitativo
Queste tecniche sono basate sulla distribuzione differenziale dei vari
componenti fra due fasi una chiamata fase fissa o fase stazionaria e
lrsquoaltra chiamata fase mobile o eluente che fluisce in continuo attraverso
la fase fissa
Cromatografia
Le fasi essenziali di un processo cromatografico sono 3
Caricamento del campione o della miscela da analizzare in una zona
ristretta della fase stazionaria
Eluizione della miscela dalla fase stazionaria per effettuare la
separazione nei singoli componenti
Rivelazione dei composti separati
In base alla forma del letto cromatograficondashCromatografia su colonna (impaccata open-tubular)
ndashCromatografia planare (su carta su strato sottile)
In base allo stato fisico della fase mobilendashCromatografia Liquida (LC)ndashGascromatografia (GC)
In base al meccanismo di separazionendashScambio ionicondashEsclusionendashAffinitagrave
Forma del letto cromatografico
Cromatografia su colonna la fase
stazionaria egrave contenuta allrsquointerno
di una colonna cilindrica che puograve
riempire completamente (colonna
impaccata) oppure rivestirne la
superficie interna (colonna
tubulare)
Cromatografia planare la fase
stazionaria egrave distribuita su una
superficie piana che puograve essere un
supporto cartaceo (cromatografia su
carta PC) o una lastrina in vetro o
altri materiali (cromatografia su
strato sottile TLC)
Gel filtrazione o esclusione molecolare
Separa le proteine in base alle dimensioni la matrice presente
nella colonna egrave un polimero con molti legami crociati che
generano pori con un diametro specifico Le proteine piugrave grandi
potranno migrare nella colonna piugrave velocemente in quanto non
possono entrare nei pori dei granuli della matrice il loro
percorso saragrave quindi diretto verso il fondo della colonna Le
proteine piugrave piccole potranno invece entrare nei pori
allungando il percorso che devono compiere per arrivare al
fondo della colonna
La matrice solida della colonna egrave un polimero sintetico contenente
gruppi carichi (quelli con gruppi anionici sono detti scambiatori di
cationi mentre quelli con gruppi cationici sono detti scambiatori di
anioni)
Lrsquo affinitagrave delle singole proteine del campione per i gruppi carichi
sulla colonna dipende dal pH della soluzione (che determina lo
stato di ionizzazione delle proteine) e dalla concentrazione di sali
(in grado di competere con le cariche delle proteine)
La separazione puograve essere ottimizzata variando gradualmente il
pH o la concentrazione salina in modo da creare un gradiente di
pH o un gradiente salino
Scambio ionico
Cromatografia per affinitagrave
Separa le proteine in base alla loro specificitagrave di legame
Le proteine sono trattenute sulla colonna solo se sono in
grado di legarsi a uno specifico ligando ancorato alla matrice
solida
Dopo aver allontanato dalla colonna le proteine che non si
possono legare la proteina viene eluita usando una soluzione
contenente ligando libero
- Slide 1
- Slide 2
- Slide 3
- Slide 4
- Slide 5
- Slide 6
- Slide 7
- Slide 8
- Slide 9
- Slide 10
- Slide 11
- Slide 12
- Slide 13
- Slide 14
- Slide 15
- Slide 16
- Slide 17
- Slide 18
- Slide 19
- Slide 20
- Slide 21
- Slide 22
- Slide 23
- Slide 24
- Slide 25
- Slide 26
- Slide 27
- Slide 28
- Slide 29
- Slide 30
- Slide 31
- Slide 32
- Slide 33
- Slide 34
- Slide 35
- Slide 36
- Slide 37
- Slide 38
- Slide 39
- Slide 40
- Slide 41
- Slide 42
- Slide 43
- Slide 44
- Slide 45
- Slide 46
- Slide 47
- Slide 48
-

SDS PAGE
I V III IV
Elettroforesi in condizioni native
I
V
III
II
IV
IsoelettrofocalizzazioneIsoelettrofocalizzazione
Separazione delle proteine in base al loro punto isoelettrico
In un gel viene creato un gradiente di pH mediante lrsquoaggiunta di
appropriati anfoliti
La miscela di proteine viene posta in un pozzetto sul gel e viene
applicato un campo elettrico Le proteine entrano nel gel e
migrano fino a che non raggiungono un pH equivalente al punto
isoelettrico
Le proteine con punti isoelettrici diversi si distribuiscono in punti
diversi nel gel
Analisi quantitativa delle proteine presenti nel campione di interesse
Determinazione del peso molecolare di proteine sconosciute
Analisi qualitativa delle proteine presenti nel campione di interesse (colorazione con Coomassie o nitrato drsquoargento o western-blotting)
Applicazioni dellrsquoSDS-PAGEApplicazioni dellrsquoSDS-PAGE
Tecniche di rivelazioneTecniche di rivelazione
Il gel egrave immerso in una soluzione che contiene Coomassie Brilliant Blue R-250 sciolto in acido acetico diluito e metanolo Rivela 01 g di proteina
Coomassie Brilliant BlueIl gel si colora con una miscela di sali drsquoargento e formaldeideGli ioni drsquoargento reagiscono con i gruppi basici e tiolici delle proteine 100 volte piugrave sensibile
Silver
Al termine della corsa elettroforetica le proteine sono trasferita su un
filtro di nitrocellulosa mediante una procedura definita elettroblotting Il gel e la nitrocellulosa sono posti in un apposito cestello a forma
di sandwich immerso in un tampone nel quale ci sono due elettrodi
paralleli La corrente in direzione perpendicolare al gel trasferisce le proteine
sul foglio di nitrocellulosa
St C1 C2 C3 C4 C5 C6
Elettroforesi delle sieroproteineElettroforesi delle sieroproteine
Il termine cromatografia indica un insieme di tecniche che hanno lo
scopo di separare una miscela nei suoi componenti per permetterne il
riconoscimento qualitativo e quantitativo
Queste tecniche sono basate sulla distribuzione differenziale dei vari
componenti fra due fasi una chiamata fase fissa o fase stazionaria e
lrsquoaltra chiamata fase mobile o eluente che fluisce in continuo attraverso
la fase fissa
Cromatografia
Le fasi essenziali di un processo cromatografico sono 3
Caricamento del campione o della miscela da analizzare in una zona
ristretta della fase stazionaria
Eluizione della miscela dalla fase stazionaria per effettuare la
separazione nei singoli componenti
Rivelazione dei composti separati
In base alla forma del letto cromatograficondashCromatografia su colonna (impaccata open-tubular)
ndashCromatografia planare (su carta su strato sottile)
In base allo stato fisico della fase mobilendashCromatografia Liquida (LC)ndashGascromatografia (GC)
In base al meccanismo di separazionendashScambio ionicondashEsclusionendashAffinitagrave
Forma del letto cromatografico
Cromatografia su colonna la fase
stazionaria egrave contenuta allrsquointerno
di una colonna cilindrica che puograve
riempire completamente (colonna
impaccata) oppure rivestirne la
superficie interna (colonna
tubulare)
Cromatografia planare la fase
stazionaria egrave distribuita su una
superficie piana che puograve essere un
supporto cartaceo (cromatografia su
carta PC) o una lastrina in vetro o
altri materiali (cromatografia su
strato sottile TLC)
Gel filtrazione o esclusione molecolare
Separa le proteine in base alle dimensioni la matrice presente
nella colonna egrave un polimero con molti legami crociati che
generano pori con un diametro specifico Le proteine piugrave grandi
potranno migrare nella colonna piugrave velocemente in quanto non
possono entrare nei pori dei granuli della matrice il loro
percorso saragrave quindi diretto verso il fondo della colonna Le
proteine piugrave piccole potranno invece entrare nei pori
allungando il percorso che devono compiere per arrivare al
fondo della colonna
La matrice solida della colonna egrave un polimero sintetico contenente
gruppi carichi (quelli con gruppi anionici sono detti scambiatori di
cationi mentre quelli con gruppi cationici sono detti scambiatori di
anioni)
Lrsquo affinitagrave delle singole proteine del campione per i gruppi carichi
sulla colonna dipende dal pH della soluzione (che determina lo
stato di ionizzazione delle proteine) e dalla concentrazione di sali
(in grado di competere con le cariche delle proteine)
La separazione puograve essere ottimizzata variando gradualmente il
pH o la concentrazione salina in modo da creare un gradiente di
pH o un gradiente salino
Scambio ionico
Cromatografia per affinitagrave
Separa le proteine in base alla loro specificitagrave di legame
Le proteine sono trattenute sulla colonna solo se sono in
grado di legarsi a uno specifico ligando ancorato alla matrice
solida
Dopo aver allontanato dalla colonna le proteine che non si
possono legare la proteina viene eluita usando una soluzione
contenente ligando libero
- Slide 1
- Slide 2
- Slide 3
- Slide 4
- Slide 5
- Slide 6
- Slide 7
- Slide 8
- Slide 9
- Slide 10
- Slide 11
- Slide 12
- Slide 13
- Slide 14
- Slide 15
- Slide 16
- Slide 17
- Slide 18
- Slide 19
- Slide 20
- Slide 21
- Slide 22
- Slide 23
- Slide 24
- Slide 25
- Slide 26
- Slide 27
- Slide 28
- Slide 29
- Slide 30
- Slide 31
- Slide 32
- Slide 33
- Slide 34
- Slide 35
- Slide 36
- Slide 37
- Slide 38
- Slide 39
- Slide 40
- Slide 41
- Slide 42
- Slide 43
- Slide 44
- Slide 45
- Slide 46
- Slide 47
- Slide 48
-

IsoelettrofocalizzazioneIsoelettrofocalizzazione
Separazione delle proteine in base al loro punto isoelettrico
In un gel viene creato un gradiente di pH mediante lrsquoaggiunta di
appropriati anfoliti
La miscela di proteine viene posta in un pozzetto sul gel e viene
applicato un campo elettrico Le proteine entrano nel gel e
migrano fino a che non raggiungono un pH equivalente al punto
isoelettrico
Le proteine con punti isoelettrici diversi si distribuiscono in punti
diversi nel gel
Analisi quantitativa delle proteine presenti nel campione di interesse
Determinazione del peso molecolare di proteine sconosciute
Analisi qualitativa delle proteine presenti nel campione di interesse (colorazione con Coomassie o nitrato drsquoargento o western-blotting)
Applicazioni dellrsquoSDS-PAGEApplicazioni dellrsquoSDS-PAGE
Tecniche di rivelazioneTecniche di rivelazione
Il gel egrave immerso in una soluzione che contiene Coomassie Brilliant Blue R-250 sciolto in acido acetico diluito e metanolo Rivela 01 g di proteina
Coomassie Brilliant BlueIl gel si colora con una miscela di sali drsquoargento e formaldeideGli ioni drsquoargento reagiscono con i gruppi basici e tiolici delle proteine 100 volte piugrave sensibile
Silver
Al termine della corsa elettroforetica le proteine sono trasferita su un
filtro di nitrocellulosa mediante una procedura definita elettroblotting Il gel e la nitrocellulosa sono posti in un apposito cestello a forma
di sandwich immerso in un tampone nel quale ci sono due elettrodi
paralleli La corrente in direzione perpendicolare al gel trasferisce le proteine
sul foglio di nitrocellulosa
St C1 C2 C3 C4 C5 C6
Elettroforesi delle sieroproteineElettroforesi delle sieroproteine
Il termine cromatografia indica un insieme di tecniche che hanno lo
scopo di separare una miscela nei suoi componenti per permetterne il
riconoscimento qualitativo e quantitativo
Queste tecniche sono basate sulla distribuzione differenziale dei vari
componenti fra due fasi una chiamata fase fissa o fase stazionaria e
lrsquoaltra chiamata fase mobile o eluente che fluisce in continuo attraverso
la fase fissa
Cromatografia
Le fasi essenziali di un processo cromatografico sono 3
Caricamento del campione o della miscela da analizzare in una zona
ristretta della fase stazionaria
Eluizione della miscela dalla fase stazionaria per effettuare la
separazione nei singoli componenti
Rivelazione dei composti separati
In base alla forma del letto cromatograficondashCromatografia su colonna (impaccata open-tubular)
ndashCromatografia planare (su carta su strato sottile)
In base allo stato fisico della fase mobilendashCromatografia Liquida (LC)ndashGascromatografia (GC)
In base al meccanismo di separazionendashScambio ionicondashEsclusionendashAffinitagrave
Forma del letto cromatografico
Cromatografia su colonna la fase
stazionaria egrave contenuta allrsquointerno
di una colonna cilindrica che puograve
riempire completamente (colonna
impaccata) oppure rivestirne la
superficie interna (colonna
tubulare)
Cromatografia planare la fase
stazionaria egrave distribuita su una
superficie piana che puograve essere un
supporto cartaceo (cromatografia su
carta PC) o una lastrina in vetro o
altri materiali (cromatografia su
strato sottile TLC)
Gel filtrazione o esclusione molecolare
Separa le proteine in base alle dimensioni la matrice presente
nella colonna egrave un polimero con molti legami crociati che
generano pori con un diametro specifico Le proteine piugrave grandi
potranno migrare nella colonna piugrave velocemente in quanto non
possono entrare nei pori dei granuli della matrice il loro
percorso saragrave quindi diretto verso il fondo della colonna Le
proteine piugrave piccole potranno invece entrare nei pori
allungando il percorso che devono compiere per arrivare al
fondo della colonna
La matrice solida della colonna egrave un polimero sintetico contenente
gruppi carichi (quelli con gruppi anionici sono detti scambiatori di
cationi mentre quelli con gruppi cationici sono detti scambiatori di
anioni)
Lrsquo affinitagrave delle singole proteine del campione per i gruppi carichi
sulla colonna dipende dal pH della soluzione (che determina lo
stato di ionizzazione delle proteine) e dalla concentrazione di sali
(in grado di competere con le cariche delle proteine)
La separazione puograve essere ottimizzata variando gradualmente il
pH o la concentrazione salina in modo da creare un gradiente di
pH o un gradiente salino
Scambio ionico
Cromatografia per affinitagrave
Separa le proteine in base alla loro specificitagrave di legame
Le proteine sono trattenute sulla colonna solo se sono in
grado di legarsi a uno specifico ligando ancorato alla matrice
solida
Dopo aver allontanato dalla colonna le proteine che non si
possono legare la proteina viene eluita usando una soluzione
contenente ligando libero
- Slide 1
- Slide 2
- Slide 3
- Slide 4
- Slide 5
- Slide 6
- Slide 7
- Slide 8
- Slide 9
- Slide 10
- Slide 11
- Slide 12
- Slide 13
- Slide 14
- Slide 15
- Slide 16
- Slide 17
- Slide 18
- Slide 19
- Slide 20
- Slide 21
- Slide 22
- Slide 23
- Slide 24
- Slide 25
- Slide 26
- Slide 27
- Slide 28
- Slide 29
- Slide 30
- Slide 31
- Slide 32
- Slide 33
- Slide 34
- Slide 35
- Slide 36
- Slide 37
- Slide 38
- Slide 39
- Slide 40
- Slide 41
- Slide 42
- Slide 43
- Slide 44
- Slide 45
- Slide 46
- Slide 47
- Slide 48
-

Analisi quantitativa delle proteine presenti nel campione di interesse
Determinazione del peso molecolare di proteine sconosciute
Analisi qualitativa delle proteine presenti nel campione di interesse (colorazione con Coomassie o nitrato drsquoargento o western-blotting)
Applicazioni dellrsquoSDS-PAGEApplicazioni dellrsquoSDS-PAGE
Tecniche di rivelazioneTecniche di rivelazione
Il gel egrave immerso in una soluzione che contiene Coomassie Brilliant Blue R-250 sciolto in acido acetico diluito e metanolo Rivela 01 g di proteina
Coomassie Brilliant BlueIl gel si colora con una miscela di sali drsquoargento e formaldeideGli ioni drsquoargento reagiscono con i gruppi basici e tiolici delle proteine 100 volte piugrave sensibile
Silver
Al termine della corsa elettroforetica le proteine sono trasferita su un
filtro di nitrocellulosa mediante una procedura definita elettroblotting Il gel e la nitrocellulosa sono posti in un apposito cestello a forma
di sandwich immerso in un tampone nel quale ci sono due elettrodi
paralleli La corrente in direzione perpendicolare al gel trasferisce le proteine
sul foglio di nitrocellulosa
St C1 C2 C3 C4 C5 C6
Elettroforesi delle sieroproteineElettroforesi delle sieroproteine
Il termine cromatografia indica un insieme di tecniche che hanno lo
scopo di separare una miscela nei suoi componenti per permetterne il
riconoscimento qualitativo e quantitativo
Queste tecniche sono basate sulla distribuzione differenziale dei vari
componenti fra due fasi una chiamata fase fissa o fase stazionaria e
lrsquoaltra chiamata fase mobile o eluente che fluisce in continuo attraverso
la fase fissa
Cromatografia
Le fasi essenziali di un processo cromatografico sono 3
Caricamento del campione o della miscela da analizzare in una zona
ristretta della fase stazionaria
Eluizione della miscela dalla fase stazionaria per effettuare la
separazione nei singoli componenti
Rivelazione dei composti separati
In base alla forma del letto cromatograficondashCromatografia su colonna (impaccata open-tubular)
ndashCromatografia planare (su carta su strato sottile)
In base allo stato fisico della fase mobilendashCromatografia Liquida (LC)ndashGascromatografia (GC)
In base al meccanismo di separazionendashScambio ionicondashEsclusionendashAffinitagrave
Forma del letto cromatografico
Cromatografia su colonna la fase
stazionaria egrave contenuta allrsquointerno
di una colonna cilindrica che puograve
riempire completamente (colonna
impaccata) oppure rivestirne la
superficie interna (colonna
tubulare)
Cromatografia planare la fase
stazionaria egrave distribuita su una
superficie piana che puograve essere un
supporto cartaceo (cromatografia su
carta PC) o una lastrina in vetro o
altri materiali (cromatografia su
strato sottile TLC)
Gel filtrazione o esclusione molecolare
Separa le proteine in base alle dimensioni la matrice presente
nella colonna egrave un polimero con molti legami crociati che
generano pori con un diametro specifico Le proteine piugrave grandi
potranno migrare nella colonna piugrave velocemente in quanto non
possono entrare nei pori dei granuli della matrice il loro
percorso saragrave quindi diretto verso il fondo della colonna Le
proteine piugrave piccole potranno invece entrare nei pori
allungando il percorso che devono compiere per arrivare al
fondo della colonna
La matrice solida della colonna egrave un polimero sintetico contenente
gruppi carichi (quelli con gruppi anionici sono detti scambiatori di
cationi mentre quelli con gruppi cationici sono detti scambiatori di
anioni)
Lrsquo affinitagrave delle singole proteine del campione per i gruppi carichi
sulla colonna dipende dal pH della soluzione (che determina lo
stato di ionizzazione delle proteine) e dalla concentrazione di sali
(in grado di competere con le cariche delle proteine)
La separazione puograve essere ottimizzata variando gradualmente il
pH o la concentrazione salina in modo da creare un gradiente di
pH o un gradiente salino
Scambio ionico
Cromatografia per affinitagrave
Separa le proteine in base alla loro specificitagrave di legame
Le proteine sono trattenute sulla colonna solo se sono in
grado di legarsi a uno specifico ligando ancorato alla matrice
solida
Dopo aver allontanato dalla colonna le proteine che non si
possono legare la proteina viene eluita usando una soluzione
contenente ligando libero
- Slide 1
- Slide 2
- Slide 3
- Slide 4
- Slide 5
- Slide 6
- Slide 7
- Slide 8
- Slide 9
- Slide 10
- Slide 11
- Slide 12
- Slide 13
- Slide 14
- Slide 15
- Slide 16
- Slide 17
- Slide 18
- Slide 19
- Slide 20
- Slide 21
- Slide 22
- Slide 23
- Slide 24
- Slide 25
- Slide 26
- Slide 27
- Slide 28
- Slide 29
- Slide 30
- Slide 31
- Slide 32
- Slide 33
- Slide 34
- Slide 35
- Slide 36
- Slide 37
- Slide 38
- Slide 39
- Slide 40
- Slide 41
- Slide 42
- Slide 43
- Slide 44
- Slide 45
- Slide 46
- Slide 47
- Slide 48
-

Tecniche di rivelazioneTecniche di rivelazione
Il gel egrave immerso in una soluzione che contiene Coomassie Brilliant Blue R-250 sciolto in acido acetico diluito e metanolo Rivela 01 g di proteina
Coomassie Brilliant BlueIl gel si colora con una miscela di sali drsquoargento e formaldeideGli ioni drsquoargento reagiscono con i gruppi basici e tiolici delle proteine 100 volte piugrave sensibile
Silver
Al termine della corsa elettroforetica le proteine sono trasferita su un
filtro di nitrocellulosa mediante una procedura definita elettroblotting Il gel e la nitrocellulosa sono posti in un apposito cestello a forma
di sandwich immerso in un tampone nel quale ci sono due elettrodi
paralleli La corrente in direzione perpendicolare al gel trasferisce le proteine
sul foglio di nitrocellulosa
St C1 C2 C3 C4 C5 C6
Elettroforesi delle sieroproteineElettroforesi delle sieroproteine
Il termine cromatografia indica un insieme di tecniche che hanno lo
scopo di separare una miscela nei suoi componenti per permetterne il
riconoscimento qualitativo e quantitativo
Queste tecniche sono basate sulla distribuzione differenziale dei vari
componenti fra due fasi una chiamata fase fissa o fase stazionaria e
lrsquoaltra chiamata fase mobile o eluente che fluisce in continuo attraverso
la fase fissa
Cromatografia
Le fasi essenziali di un processo cromatografico sono 3
Caricamento del campione o della miscela da analizzare in una zona
ristretta della fase stazionaria
Eluizione della miscela dalla fase stazionaria per effettuare la
separazione nei singoli componenti
Rivelazione dei composti separati
In base alla forma del letto cromatograficondashCromatografia su colonna (impaccata open-tubular)
ndashCromatografia planare (su carta su strato sottile)
In base allo stato fisico della fase mobilendashCromatografia Liquida (LC)ndashGascromatografia (GC)
In base al meccanismo di separazionendashScambio ionicondashEsclusionendashAffinitagrave
Forma del letto cromatografico
Cromatografia su colonna la fase
stazionaria egrave contenuta allrsquointerno
di una colonna cilindrica che puograve
riempire completamente (colonna
impaccata) oppure rivestirne la
superficie interna (colonna
tubulare)
Cromatografia planare la fase
stazionaria egrave distribuita su una
superficie piana che puograve essere un
supporto cartaceo (cromatografia su
carta PC) o una lastrina in vetro o
altri materiali (cromatografia su
strato sottile TLC)
Gel filtrazione o esclusione molecolare
Separa le proteine in base alle dimensioni la matrice presente
nella colonna egrave un polimero con molti legami crociati che
generano pori con un diametro specifico Le proteine piugrave grandi
potranno migrare nella colonna piugrave velocemente in quanto non
possono entrare nei pori dei granuli della matrice il loro
percorso saragrave quindi diretto verso il fondo della colonna Le
proteine piugrave piccole potranno invece entrare nei pori
allungando il percorso che devono compiere per arrivare al
fondo della colonna
La matrice solida della colonna egrave un polimero sintetico contenente
gruppi carichi (quelli con gruppi anionici sono detti scambiatori di
cationi mentre quelli con gruppi cationici sono detti scambiatori di
anioni)
Lrsquo affinitagrave delle singole proteine del campione per i gruppi carichi
sulla colonna dipende dal pH della soluzione (che determina lo
stato di ionizzazione delle proteine) e dalla concentrazione di sali
(in grado di competere con le cariche delle proteine)
La separazione puograve essere ottimizzata variando gradualmente il
pH o la concentrazione salina in modo da creare un gradiente di
pH o un gradiente salino
Scambio ionico
Cromatografia per affinitagrave
Separa le proteine in base alla loro specificitagrave di legame
Le proteine sono trattenute sulla colonna solo se sono in
grado di legarsi a uno specifico ligando ancorato alla matrice
solida
Dopo aver allontanato dalla colonna le proteine che non si
possono legare la proteina viene eluita usando una soluzione
contenente ligando libero
- Slide 1
- Slide 2
- Slide 3
- Slide 4
- Slide 5
- Slide 6
- Slide 7
- Slide 8
- Slide 9
- Slide 10
- Slide 11
- Slide 12
- Slide 13
- Slide 14
- Slide 15
- Slide 16
- Slide 17
- Slide 18
- Slide 19
- Slide 20
- Slide 21
- Slide 22
- Slide 23
- Slide 24
- Slide 25
- Slide 26
- Slide 27
- Slide 28
- Slide 29
- Slide 30
- Slide 31
- Slide 32
- Slide 33
- Slide 34
- Slide 35
- Slide 36
- Slide 37
- Slide 38
- Slide 39
- Slide 40
- Slide 41
- Slide 42
- Slide 43
- Slide 44
- Slide 45
- Slide 46
- Slide 47
- Slide 48
-

Al termine della corsa elettroforetica le proteine sono trasferita su un
filtro di nitrocellulosa mediante una procedura definita elettroblotting Il gel e la nitrocellulosa sono posti in un apposito cestello a forma
di sandwich immerso in un tampone nel quale ci sono due elettrodi
paralleli La corrente in direzione perpendicolare al gel trasferisce le proteine
sul foglio di nitrocellulosa
St C1 C2 C3 C4 C5 C6
Elettroforesi delle sieroproteineElettroforesi delle sieroproteine
Il termine cromatografia indica un insieme di tecniche che hanno lo
scopo di separare una miscela nei suoi componenti per permetterne il
riconoscimento qualitativo e quantitativo
Queste tecniche sono basate sulla distribuzione differenziale dei vari
componenti fra due fasi una chiamata fase fissa o fase stazionaria e
lrsquoaltra chiamata fase mobile o eluente che fluisce in continuo attraverso
la fase fissa
Cromatografia
Le fasi essenziali di un processo cromatografico sono 3
Caricamento del campione o della miscela da analizzare in una zona
ristretta della fase stazionaria
Eluizione della miscela dalla fase stazionaria per effettuare la
separazione nei singoli componenti
Rivelazione dei composti separati
In base alla forma del letto cromatograficondashCromatografia su colonna (impaccata open-tubular)
ndashCromatografia planare (su carta su strato sottile)
In base allo stato fisico della fase mobilendashCromatografia Liquida (LC)ndashGascromatografia (GC)
In base al meccanismo di separazionendashScambio ionicondashEsclusionendashAffinitagrave
Forma del letto cromatografico
Cromatografia su colonna la fase
stazionaria egrave contenuta allrsquointerno
di una colonna cilindrica che puograve
riempire completamente (colonna
impaccata) oppure rivestirne la
superficie interna (colonna
tubulare)
Cromatografia planare la fase
stazionaria egrave distribuita su una
superficie piana che puograve essere un
supporto cartaceo (cromatografia su
carta PC) o una lastrina in vetro o
altri materiali (cromatografia su
strato sottile TLC)
Gel filtrazione o esclusione molecolare
Separa le proteine in base alle dimensioni la matrice presente
nella colonna egrave un polimero con molti legami crociati che
generano pori con un diametro specifico Le proteine piugrave grandi
potranno migrare nella colonna piugrave velocemente in quanto non
possono entrare nei pori dei granuli della matrice il loro
percorso saragrave quindi diretto verso il fondo della colonna Le
proteine piugrave piccole potranno invece entrare nei pori
allungando il percorso che devono compiere per arrivare al
fondo della colonna
La matrice solida della colonna egrave un polimero sintetico contenente
gruppi carichi (quelli con gruppi anionici sono detti scambiatori di
cationi mentre quelli con gruppi cationici sono detti scambiatori di
anioni)
Lrsquo affinitagrave delle singole proteine del campione per i gruppi carichi
sulla colonna dipende dal pH della soluzione (che determina lo
stato di ionizzazione delle proteine) e dalla concentrazione di sali
(in grado di competere con le cariche delle proteine)
La separazione puograve essere ottimizzata variando gradualmente il
pH o la concentrazione salina in modo da creare un gradiente di
pH o un gradiente salino
Scambio ionico
Cromatografia per affinitagrave
Separa le proteine in base alla loro specificitagrave di legame
Le proteine sono trattenute sulla colonna solo se sono in
grado di legarsi a uno specifico ligando ancorato alla matrice
solida
Dopo aver allontanato dalla colonna le proteine che non si
possono legare la proteina viene eluita usando una soluzione
contenente ligando libero
- Slide 1
- Slide 2
- Slide 3
- Slide 4
- Slide 5
- Slide 6
- Slide 7
- Slide 8
- Slide 9
- Slide 10
- Slide 11
- Slide 12
- Slide 13
- Slide 14
- Slide 15
- Slide 16
- Slide 17
- Slide 18
- Slide 19
- Slide 20
- Slide 21
- Slide 22
- Slide 23
- Slide 24
- Slide 25
- Slide 26
- Slide 27
- Slide 28
- Slide 29
- Slide 30
- Slide 31
- Slide 32
- Slide 33
- Slide 34
- Slide 35
- Slide 36
- Slide 37
- Slide 38
- Slide 39
- Slide 40
- Slide 41
- Slide 42
- Slide 43
- Slide 44
- Slide 45
- Slide 46
- Slide 47
- Slide 48
-

St C1 C2 C3 C4 C5 C6
Elettroforesi delle sieroproteineElettroforesi delle sieroproteine
Il termine cromatografia indica un insieme di tecniche che hanno lo
scopo di separare una miscela nei suoi componenti per permetterne il
riconoscimento qualitativo e quantitativo
Queste tecniche sono basate sulla distribuzione differenziale dei vari
componenti fra due fasi una chiamata fase fissa o fase stazionaria e
lrsquoaltra chiamata fase mobile o eluente che fluisce in continuo attraverso
la fase fissa
Cromatografia
Le fasi essenziali di un processo cromatografico sono 3
Caricamento del campione o della miscela da analizzare in una zona
ristretta della fase stazionaria
Eluizione della miscela dalla fase stazionaria per effettuare la
separazione nei singoli componenti
Rivelazione dei composti separati
In base alla forma del letto cromatograficondashCromatografia su colonna (impaccata open-tubular)
ndashCromatografia planare (su carta su strato sottile)
In base allo stato fisico della fase mobilendashCromatografia Liquida (LC)ndashGascromatografia (GC)
In base al meccanismo di separazionendashScambio ionicondashEsclusionendashAffinitagrave
Forma del letto cromatografico
Cromatografia su colonna la fase
stazionaria egrave contenuta allrsquointerno
di una colonna cilindrica che puograve
riempire completamente (colonna
impaccata) oppure rivestirne la
superficie interna (colonna
tubulare)
Cromatografia planare la fase
stazionaria egrave distribuita su una
superficie piana che puograve essere un
supporto cartaceo (cromatografia su
carta PC) o una lastrina in vetro o
altri materiali (cromatografia su
strato sottile TLC)
Gel filtrazione o esclusione molecolare
Separa le proteine in base alle dimensioni la matrice presente
nella colonna egrave un polimero con molti legami crociati che
generano pori con un diametro specifico Le proteine piugrave grandi
potranno migrare nella colonna piugrave velocemente in quanto non
possono entrare nei pori dei granuli della matrice il loro
percorso saragrave quindi diretto verso il fondo della colonna Le
proteine piugrave piccole potranno invece entrare nei pori
allungando il percorso che devono compiere per arrivare al
fondo della colonna
La matrice solida della colonna egrave un polimero sintetico contenente
gruppi carichi (quelli con gruppi anionici sono detti scambiatori di
cationi mentre quelli con gruppi cationici sono detti scambiatori di
anioni)
Lrsquo affinitagrave delle singole proteine del campione per i gruppi carichi
sulla colonna dipende dal pH della soluzione (che determina lo
stato di ionizzazione delle proteine) e dalla concentrazione di sali
(in grado di competere con le cariche delle proteine)
La separazione puograve essere ottimizzata variando gradualmente il
pH o la concentrazione salina in modo da creare un gradiente di
pH o un gradiente salino
Scambio ionico
Cromatografia per affinitagrave
Separa le proteine in base alla loro specificitagrave di legame
Le proteine sono trattenute sulla colonna solo se sono in
grado di legarsi a uno specifico ligando ancorato alla matrice
solida
Dopo aver allontanato dalla colonna le proteine che non si
possono legare la proteina viene eluita usando una soluzione
contenente ligando libero
- Slide 1
- Slide 2
- Slide 3
- Slide 4
- Slide 5
- Slide 6
- Slide 7
- Slide 8
- Slide 9
- Slide 10
- Slide 11
- Slide 12
- Slide 13
- Slide 14
- Slide 15
- Slide 16
- Slide 17
- Slide 18
- Slide 19
- Slide 20
- Slide 21
- Slide 22
- Slide 23
- Slide 24
- Slide 25
- Slide 26
- Slide 27
- Slide 28
- Slide 29
- Slide 30
- Slide 31
- Slide 32
- Slide 33
- Slide 34
- Slide 35
- Slide 36
- Slide 37
- Slide 38
- Slide 39
- Slide 40
- Slide 41
- Slide 42
- Slide 43
- Slide 44
- Slide 45
- Slide 46
- Slide 47
- Slide 48
-

Elettroforesi delle sieroproteineElettroforesi delle sieroproteine
Il termine cromatografia indica un insieme di tecniche che hanno lo
scopo di separare una miscela nei suoi componenti per permetterne il
riconoscimento qualitativo e quantitativo
Queste tecniche sono basate sulla distribuzione differenziale dei vari
componenti fra due fasi una chiamata fase fissa o fase stazionaria e
lrsquoaltra chiamata fase mobile o eluente che fluisce in continuo attraverso
la fase fissa
Cromatografia
Le fasi essenziali di un processo cromatografico sono 3
Caricamento del campione o della miscela da analizzare in una zona
ristretta della fase stazionaria
Eluizione della miscela dalla fase stazionaria per effettuare la
separazione nei singoli componenti
Rivelazione dei composti separati
In base alla forma del letto cromatograficondashCromatografia su colonna (impaccata open-tubular)
ndashCromatografia planare (su carta su strato sottile)
In base allo stato fisico della fase mobilendashCromatografia Liquida (LC)ndashGascromatografia (GC)
In base al meccanismo di separazionendashScambio ionicondashEsclusionendashAffinitagrave
Forma del letto cromatografico
Cromatografia su colonna la fase
stazionaria egrave contenuta allrsquointerno
di una colonna cilindrica che puograve
riempire completamente (colonna
impaccata) oppure rivestirne la
superficie interna (colonna
tubulare)
Cromatografia planare la fase
stazionaria egrave distribuita su una
superficie piana che puograve essere un
supporto cartaceo (cromatografia su
carta PC) o una lastrina in vetro o
altri materiali (cromatografia su
strato sottile TLC)
Gel filtrazione o esclusione molecolare
Separa le proteine in base alle dimensioni la matrice presente
nella colonna egrave un polimero con molti legami crociati che
generano pori con un diametro specifico Le proteine piugrave grandi
potranno migrare nella colonna piugrave velocemente in quanto non
possono entrare nei pori dei granuli della matrice il loro
percorso saragrave quindi diretto verso il fondo della colonna Le
proteine piugrave piccole potranno invece entrare nei pori
allungando il percorso che devono compiere per arrivare al
fondo della colonna
La matrice solida della colonna egrave un polimero sintetico contenente
gruppi carichi (quelli con gruppi anionici sono detti scambiatori di
cationi mentre quelli con gruppi cationici sono detti scambiatori di
anioni)
Lrsquo affinitagrave delle singole proteine del campione per i gruppi carichi
sulla colonna dipende dal pH della soluzione (che determina lo
stato di ionizzazione delle proteine) e dalla concentrazione di sali
(in grado di competere con le cariche delle proteine)
La separazione puograve essere ottimizzata variando gradualmente il
pH o la concentrazione salina in modo da creare un gradiente di
pH o un gradiente salino
Scambio ionico
Cromatografia per affinitagrave
Separa le proteine in base alla loro specificitagrave di legame
Le proteine sono trattenute sulla colonna solo se sono in
grado di legarsi a uno specifico ligando ancorato alla matrice
solida
Dopo aver allontanato dalla colonna le proteine che non si
possono legare la proteina viene eluita usando una soluzione
contenente ligando libero
- Slide 1
- Slide 2
- Slide 3
- Slide 4
- Slide 5
- Slide 6
- Slide 7
- Slide 8
- Slide 9
- Slide 10
- Slide 11
- Slide 12
- Slide 13
- Slide 14
- Slide 15
- Slide 16
- Slide 17
- Slide 18
- Slide 19
- Slide 20
- Slide 21
- Slide 22
- Slide 23
- Slide 24
- Slide 25
- Slide 26
- Slide 27
- Slide 28
- Slide 29
- Slide 30
- Slide 31
- Slide 32
- Slide 33
- Slide 34
- Slide 35
- Slide 36
- Slide 37
- Slide 38
- Slide 39
- Slide 40
- Slide 41
- Slide 42
- Slide 43
- Slide 44
- Slide 45
- Slide 46
- Slide 47
- Slide 48
-

Il termine cromatografia indica un insieme di tecniche che hanno lo
scopo di separare una miscela nei suoi componenti per permetterne il
riconoscimento qualitativo e quantitativo
Queste tecniche sono basate sulla distribuzione differenziale dei vari
componenti fra due fasi una chiamata fase fissa o fase stazionaria e
lrsquoaltra chiamata fase mobile o eluente che fluisce in continuo attraverso
la fase fissa
Cromatografia
Le fasi essenziali di un processo cromatografico sono 3
Caricamento del campione o della miscela da analizzare in una zona
ristretta della fase stazionaria
Eluizione della miscela dalla fase stazionaria per effettuare la
separazione nei singoli componenti
Rivelazione dei composti separati
In base alla forma del letto cromatograficondashCromatografia su colonna (impaccata open-tubular)
ndashCromatografia planare (su carta su strato sottile)
In base allo stato fisico della fase mobilendashCromatografia Liquida (LC)ndashGascromatografia (GC)
In base al meccanismo di separazionendashScambio ionicondashEsclusionendashAffinitagrave
Forma del letto cromatografico
Cromatografia su colonna la fase
stazionaria egrave contenuta allrsquointerno
di una colonna cilindrica che puograve
riempire completamente (colonna
impaccata) oppure rivestirne la
superficie interna (colonna
tubulare)
Cromatografia planare la fase
stazionaria egrave distribuita su una
superficie piana che puograve essere un
supporto cartaceo (cromatografia su
carta PC) o una lastrina in vetro o
altri materiali (cromatografia su
strato sottile TLC)
Gel filtrazione o esclusione molecolare
Separa le proteine in base alle dimensioni la matrice presente
nella colonna egrave un polimero con molti legami crociati che
generano pori con un diametro specifico Le proteine piugrave grandi
potranno migrare nella colonna piugrave velocemente in quanto non
possono entrare nei pori dei granuli della matrice il loro
percorso saragrave quindi diretto verso il fondo della colonna Le
proteine piugrave piccole potranno invece entrare nei pori
allungando il percorso che devono compiere per arrivare al
fondo della colonna
La matrice solida della colonna egrave un polimero sintetico contenente
gruppi carichi (quelli con gruppi anionici sono detti scambiatori di
cationi mentre quelli con gruppi cationici sono detti scambiatori di
anioni)
Lrsquo affinitagrave delle singole proteine del campione per i gruppi carichi
sulla colonna dipende dal pH della soluzione (che determina lo
stato di ionizzazione delle proteine) e dalla concentrazione di sali
(in grado di competere con le cariche delle proteine)
La separazione puograve essere ottimizzata variando gradualmente il
pH o la concentrazione salina in modo da creare un gradiente di
pH o un gradiente salino
Scambio ionico
Cromatografia per affinitagrave
Separa le proteine in base alla loro specificitagrave di legame
Le proteine sono trattenute sulla colonna solo se sono in
grado di legarsi a uno specifico ligando ancorato alla matrice
solida
Dopo aver allontanato dalla colonna le proteine che non si
possono legare la proteina viene eluita usando una soluzione
contenente ligando libero
- Slide 1
- Slide 2
- Slide 3
- Slide 4
- Slide 5
- Slide 6
- Slide 7
- Slide 8
- Slide 9
- Slide 10
- Slide 11
- Slide 12
- Slide 13
- Slide 14
- Slide 15
- Slide 16
- Slide 17
- Slide 18
- Slide 19
- Slide 20
- Slide 21
- Slide 22
- Slide 23
- Slide 24
- Slide 25
- Slide 26
- Slide 27
- Slide 28
- Slide 29
- Slide 30
- Slide 31
- Slide 32
- Slide 33
- Slide 34
- Slide 35
- Slide 36
- Slide 37
- Slide 38
- Slide 39
- Slide 40
- Slide 41
- Slide 42
- Slide 43
- Slide 44
- Slide 45
- Slide 46
- Slide 47
- Slide 48
-

Le fasi essenziali di un processo cromatografico sono 3
Caricamento del campione o della miscela da analizzare in una zona
ristretta della fase stazionaria
Eluizione della miscela dalla fase stazionaria per effettuare la
separazione nei singoli componenti
Rivelazione dei composti separati
In base alla forma del letto cromatograficondashCromatografia su colonna (impaccata open-tubular)
ndashCromatografia planare (su carta su strato sottile)
In base allo stato fisico della fase mobilendashCromatografia Liquida (LC)ndashGascromatografia (GC)
In base al meccanismo di separazionendashScambio ionicondashEsclusionendashAffinitagrave
Forma del letto cromatografico
Cromatografia su colonna la fase
stazionaria egrave contenuta allrsquointerno
di una colonna cilindrica che puograve
riempire completamente (colonna
impaccata) oppure rivestirne la
superficie interna (colonna
tubulare)
Cromatografia planare la fase
stazionaria egrave distribuita su una
superficie piana che puograve essere un
supporto cartaceo (cromatografia su
carta PC) o una lastrina in vetro o
altri materiali (cromatografia su
strato sottile TLC)
Gel filtrazione o esclusione molecolare
Separa le proteine in base alle dimensioni la matrice presente
nella colonna egrave un polimero con molti legami crociati che
generano pori con un diametro specifico Le proteine piugrave grandi
potranno migrare nella colonna piugrave velocemente in quanto non
possono entrare nei pori dei granuli della matrice il loro
percorso saragrave quindi diretto verso il fondo della colonna Le
proteine piugrave piccole potranno invece entrare nei pori
allungando il percorso che devono compiere per arrivare al
fondo della colonna
La matrice solida della colonna egrave un polimero sintetico contenente
gruppi carichi (quelli con gruppi anionici sono detti scambiatori di
cationi mentre quelli con gruppi cationici sono detti scambiatori di
anioni)
Lrsquo affinitagrave delle singole proteine del campione per i gruppi carichi
sulla colonna dipende dal pH della soluzione (che determina lo
stato di ionizzazione delle proteine) e dalla concentrazione di sali
(in grado di competere con le cariche delle proteine)
La separazione puograve essere ottimizzata variando gradualmente il
pH o la concentrazione salina in modo da creare un gradiente di
pH o un gradiente salino
Scambio ionico
Cromatografia per affinitagrave
Separa le proteine in base alla loro specificitagrave di legame
Le proteine sono trattenute sulla colonna solo se sono in
grado di legarsi a uno specifico ligando ancorato alla matrice
solida
Dopo aver allontanato dalla colonna le proteine che non si
possono legare la proteina viene eluita usando una soluzione
contenente ligando libero
- Slide 1
- Slide 2
- Slide 3
- Slide 4
- Slide 5
- Slide 6
- Slide 7
- Slide 8
- Slide 9
- Slide 10
- Slide 11
- Slide 12
- Slide 13
- Slide 14
- Slide 15
- Slide 16
- Slide 17
- Slide 18
- Slide 19
- Slide 20
- Slide 21
- Slide 22
- Slide 23
- Slide 24
- Slide 25
- Slide 26
- Slide 27
- Slide 28
- Slide 29
- Slide 30
- Slide 31
- Slide 32
- Slide 33
- Slide 34
- Slide 35
- Slide 36
- Slide 37
- Slide 38
- Slide 39
- Slide 40
- Slide 41
- Slide 42
- Slide 43
- Slide 44
- Slide 45
- Slide 46
- Slide 47
- Slide 48
-

In base alla forma del letto cromatograficondashCromatografia su colonna (impaccata open-tubular)
ndashCromatografia planare (su carta su strato sottile)
In base allo stato fisico della fase mobilendashCromatografia Liquida (LC)ndashGascromatografia (GC)
In base al meccanismo di separazionendashScambio ionicondashEsclusionendashAffinitagrave
Forma del letto cromatografico
Cromatografia su colonna la fase
stazionaria egrave contenuta allrsquointerno
di una colonna cilindrica che puograve
riempire completamente (colonna
impaccata) oppure rivestirne la
superficie interna (colonna
tubulare)
Cromatografia planare la fase
stazionaria egrave distribuita su una
superficie piana che puograve essere un
supporto cartaceo (cromatografia su
carta PC) o una lastrina in vetro o
altri materiali (cromatografia su
strato sottile TLC)
Gel filtrazione o esclusione molecolare
Separa le proteine in base alle dimensioni la matrice presente
nella colonna egrave un polimero con molti legami crociati che
generano pori con un diametro specifico Le proteine piugrave grandi
potranno migrare nella colonna piugrave velocemente in quanto non
possono entrare nei pori dei granuli della matrice il loro
percorso saragrave quindi diretto verso il fondo della colonna Le
proteine piugrave piccole potranno invece entrare nei pori
allungando il percorso che devono compiere per arrivare al
fondo della colonna
La matrice solida della colonna egrave un polimero sintetico contenente
gruppi carichi (quelli con gruppi anionici sono detti scambiatori di
cationi mentre quelli con gruppi cationici sono detti scambiatori di
anioni)
Lrsquo affinitagrave delle singole proteine del campione per i gruppi carichi
sulla colonna dipende dal pH della soluzione (che determina lo
stato di ionizzazione delle proteine) e dalla concentrazione di sali
(in grado di competere con le cariche delle proteine)
La separazione puograve essere ottimizzata variando gradualmente il
pH o la concentrazione salina in modo da creare un gradiente di
pH o un gradiente salino
Scambio ionico
Cromatografia per affinitagrave
Separa le proteine in base alla loro specificitagrave di legame
Le proteine sono trattenute sulla colonna solo se sono in
grado di legarsi a uno specifico ligando ancorato alla matrice
solida
Dopo aver allontanato dalla colonna le proteine che non si
possono legare la proteina viene eluita usando una soluzione
contenente ligando libero
- Slide 1
- Slide 2
- Slide 3
- Slide 4
- Slide 5
- Slide 6
- Slide 7
- Slide 8
- Slide 9
- Slide 10
- Slide 11
- Slide 12
- Slide 13
- Slide 14
- Slide 15
- Slide 16
- Slide 17
- Slide 18
- Slide 19
- Slide 20
- Slide 21
- Slide 22
- Slide 23
- Slide 24
- Slide 25
- Slide 26
- Slide 27
- Slide 28
- Slide 29
- Slide 30
- Slide 31
- Slide 32
- Slide 33
- Slide 34
- Slide 35
- Slide 36
- Slide 37
- Slide 38
- Slide 39
- Slide 40
- Slide 41
- Slide 42
- Slide 43
- Slide 44
- Slide 45
- Slide 46
- Slide 47
- Slide 48
-

Forma del letto cromatografico
Cromatografia su colonna la fase
stazionaria egrave contenuta allrsquointerno
di una colonna cilindrica che puograve
riempire completamente (colonna
impaccata) oppure rivestirne la
superficie interna (colonna
tubulare)
Cromatografia planare la fase
stazionaria egrave distribuita su una
superficie piana che puograve essere un
supporto cartaceo (cromatografia su
carta PC) o una lastrina in vetro o
altri materiali (cromatografia su
strato sottile TLC)
Gel filtrazione o esclusione molecolare
Separa le proteine in base alle dimensioni la matrice presente
nella colonna egrave un polimero con molti legami crociati che
generano pori con un diametro specifico Le proteine piugrave grandi
potranno migrare nella colonna piugrave velocemente in quanto non
possono entrare nei pori dei granuli della matrice il loro
percorso saragrave quindi diretto verso il fondo della colonna Le
proteine piugrave piccole potranno invece entrare nei pori
allungando il percorso che devono compiere per arrivare al
fondo della colonna
La matrice solida della colonna egrave un polimero sintetico contenente
gruppi carichi (quelli con gruppi anionici sono detti scambiatori di
cationi mentre quelli con gruppi cationici sono detti scambiatori di
anioni)
Lrsquo affinitagrave delle singole proteine del campione per i gruppi carichi
sulla colonna dipende dal pH della soluzione (che determina lo
stato di ionizzazione delle proteine) e dalla concentrazione di sali
(in grado di competere con le cariche delle proteine)
La separazione puograve essere ottimizzata variando gradualmente il
pH o la concentrazione salina in modo da creare un gradiente di
pH o un gradiente salino
Scambio ionico
Cromatografia per affinitagrave
Separa le proteine in base alla loro specificitagrave di legame
Le proteine sono trattenute sulla colonna solo se sono in
grado di legarsi a uno specifico ligando ancorato alla matrice
solida
Dopo aver allontanato dalla colonna le proteine che non si
possono legare la proteina viene eluita usando una soluzione
contenente ligando libero
- Slide 1
- Slide 2
- Slide 3
- Slide 4
- Slide 5
- Slide 6
- Slide 7
- Slide 8
- Slide 9
- Slide 10
- Slide 11
- Slide 12
- Slide 13
- Slide 14
- Slide 15
- Slide 16
- Slide 17
- Slide 18
- Slide 19
- Slide 20
- Slide 21
- Slide 22
- Slide 23
- Slide 24
- Slide 25
- Slide 26
- Slide 27
- Slide 28
- Slide 29
- Slide 30
- Slide 31
- Slide 32
- Slide 33
- Slide 34
- Slide 35
- Slide 36
- Slide 37
- Slide 38
- Slide 39
- Slide 40
- Slide 41
- Slide 42
- Slide 43
- Slide 44
- Slide 45
- Slide 46
- Slide 47
- Slide 48
-

Gel filtrazione o esclusione molecolare
Separa le proteine in base alle dimensioni la matrice presente
nella colonna egrave un polimero con molti legami crociati che
generano pori con un diametro specifico Le proteine piugrave grandi
potranno migrare nella colonna piugrave velocemente in quanto non
possono entrare nei pori dei granuli della matrice il loro
percorso saragrave quindi diretto verso il fondo della colonna Le
proteine piugrave piccole potranno invece entrare nei pori
allungando il percorso che devono compiere per arrivare al
fondo della colonna
La matrice solida della colonna egrave un polimero sintetico contenente
gruppi carichi (quelli con gruppi anionici sono detti scambiatori di
cationi mentre quelli con gruppi cationici sono detti scambiatori di
anioni)
Lrsquo affinitagrave delle singole proteine del campione per i gruppi carichi
sulla colonna dipende dal pH della soluzione (che determina lo
stato di ionizzazione delle proteine) e dalla concentrazione di sali
(in grado di competere con le cariche delle proteine)
La separazione puograve essere ottimizzata variando gradualmente il
pH o la concentrazione salina in modo da creare un gradiente di
pH o un gradiente salino
Scambio ionico
Cromatografia per affinitagrave
Separa le proteine in base alla loro specificitagrave di legame
Le proteine sono trattenute sulla colonna solo se sono in
grado di legarsi a uno specifico ligando ancorato alla matrice
solida
Dopo aver allontanato dalla colonna le proteine che non si
possono legare la proteina viene eluita usando una soluzione
contenente ligando libero
- Slide 1
- Slide 2
- Slide 3
- Slide 4
- Slide 5
- Slide 6
- Slide 7
- Slide 8
- Slide 9
- Slide 10
- Slide 11
- Slide 12
- Slide 13
- Slide 14
- Slide 15
- Slide 16
- Slide 17
- Slide 18
- Slide 19
- Slide 20
- Slide 21
- Slide 22
- Slide 23
- Slide 24
- Slide 25
- Slide 26
- Slide 27
- Slide 28
- Slide 29
- Slide 30
- Slide 31
- Slide 32
- Slide 33
- Slide 34
- Slide 35
- Slide 36
- Slide 37
- Slide 38
- Slide 39
- Slide 40
- Slide 41
- Slide 42
- Slide 43
- Slide 44
- Slide 45
- Slide 46
- Slide 47
- Slide 48
-

La matrice solida della colonna egrave un polimero sintetico contenente
gruppi carichi (quelli con gruppi anionici sono detti scambiatori di
cationi mentre quelli con gruppi cationici sono detti scambiatori di
anioni)
Lrsquo affinitagrave delle singole proteine del campione per i gruppi carichi
sulla colonna dipende dal pH della soluzione (che determina lo
stato di ionizzazione delle proteine) e dalla concentrazione di sali
(in grado di competere con le cariche delle proteine)
La separazione puograve essere ottimizzata variando gradualmente il
pH o la concentrazione salina in modo da creare un gradiente di
pH o un gradiente salino
Scambio ionico
Cromatografia per affinitagrave
Separa le proteine in base alla loro specificitagrave di legame
Le proteine sono trattenute sulla colonna solo se sono in
grado di legarsi a uno specifico ligando ancorato alla matrice
solida
Dopo aver allontanato dalla colonna le proteine che non si
possono legare la proteina viene eluita usando una soluzione
contenente ligando libero
- Slide 1
- Slide 2
- Slide 3
- Slide 4
- Slide 5
- Slide 6
- Slide 7
- Slide 8
- Slide 9
- Slide 10
- Slide 11
- Slide 12
- Slide 13
- Slide 14
- Slide 15
- Slide 16
- Slide 17
- Slide 18
- Slide 19
- Slide 20
- Slide 21
- Slide 22
- Slide 23
- Slide 24
- Slide 25
- Slide 26
- Slide 27
- Slide 28
- Slide 29
- Slide 30
- Slide 31
- Slide 32
- Slide 33
- Slide 34
- Slide 35
- Slide 36
- Slide 37
- Slide 38
- Slide 39
- Slide 40
- Slide 41
- Slide 42
- Slide 43
- Slide 44
- Slide 45
- Slide 46
- Slide 47
- Slide 48
-

Cromatografia per affinitagrave
Separa le proteine in base alla loro specificitagrave di legame
Le proteine sono trattenute sulla colonna solo se sono in
grado di legarsi a uno specifico ligando ancorato alla matrice
solida
Dopo aver allontanato dalla colonna le proteine che non si
possono legare la proteina viene eluita usando una soluzione
contenente ligando libero
- Slide 1
- Slide 2
- Slide 3
- Slide 4
- Slide 5
- Slide 6
- Slide 7
- Slide 8
- Slide 9
- Slide 10
- Slide 11
- Slide 12
- Slide 13
- Slide 14
- Slide 15
- Slide 16
- Slide 17
- Slide 18
- Slide 19
- Slide 20
- Slide 21
- Slide 22
- Slide 23
- Slide 24
- Slide 25
- Slide 26
- Slide 27
- Slide 28
- Slide 29
- Slide 30
- Slide 31
- Slide 32
- Slide 33
- Slide 34
- Slide 35
- Slide 36
- Slide 37
- Slide 38
- Slide 39
- Slide 40
- Slide 41
- Slide 42
- Slide 43
- Slide 44
- Slide 45
- Slide 46
- Slide 47
- Slide 48
-

- Slide 1
- Slide 2
- Slide 3
- Slide 4
- Slide 5
- Slide 6
- Slide 7
- Slide 8
- Slide 9
- Slide 10
- Slide 11
- Slide 12
- Slide 13
- Slide 14
- Slide 15
- Slide 16
- Slide 17
- Slide 18
- Slide 19
- Slide 20
- Slide 21
- Slide 22
- Slide 23
- Slide 24
- Slide 25
- Slide 26
- Slide 27
- Slide 28
- Slide 29
- Slide 30
- Slide 31
- Slide 32
- Slide 33
- Slide 34
- Slide 35
- Slide 36
- Slide 37
- Slide 38
- Slide 39
- Slide 40
- Slide 41
- Slide 42
- Slide 43
- Slide 44
- Slide 45
- Slide 46
- Slide 47
- Slide 48
-