L’Atomo e le Molecole - santangela.info · TUTTO CIO’ CHE OCCUPA UNO SPAZIO Ha una MASSA (Kg)...
Transcript of L’Atomo e le Molecole - santangela.info · TUTTO CIO’ CHE OCCUPA UNO SPAZIO Ha una MASSA (Kg)...
LA MATERIA
TUTTO CIO’ CHE OCCUPA UNO SPAZIO
Ha una MASSA (Kg) Occupa un VOLUME (m3)
FORMATA DA MOLECOLE
FORMATE DA ATOMI
Tutte le sostanze sono fatte di MOLECOLE
MOLECOLA: la più piccola quantità di
materia che ne conserva tutte le
caratteristiche chimiche.
Se divido la molecola ottengo gli ATOMI,
ma questi non hanno più nulla a che
vedere con la sostanza di partenza.
Immaginiamo di dividere un granello di SALE GROSSO: otteniamo granellini più piccoli che mantengono le proprietà del sale: salati e si sciolgono in un liquido! Questo non va all'infinito! Ad un certo punto otteniamo una coppia di atomi di Na (sodio) e Cl (cloro), non più salati e non più in grado di sciogliersi in un liquido!
Molecola di acqua
ossigeno
Molecola di idrogeno
rompo
LA MATERIA
UN SOLO ATOMO
PIU’ ATOMI UGUALI
PIU’ ATOMI DIVERSI
SOSTANZE SEMPLICI o
ELEMENTI
SOSTANZE COMPOSTE o
COMPOSTI
C4H10 butano composto formato da: 4 atomi di C + 10 atomi di H
CO2 anidride carbonica formata da: 1 atomo di C + 2 di O
H2O acqua formata da: 1 atomo di O + 2 di H
Come fanno gli atomi a legarsi fra loro per costituire le molecole?
Come si possono distinguere un atomo di un elemento da quello di un
altro elemento?
L’ATOMO
Il termine ATOMO deriva dal greco atomos e
significa «indivisibile».
Infatti, fino al XIX secolo, gli scienziati ritenevano
che l’atomo fosse la più piccola parte della materia.
SCOPERTA DI CARICHE ELETTRICHE
L'atomo è composto da 3 tipi di particelle elementari piccolissime:
i protoni, i neutroni e gli elettroni.
NEUTRONI
PROTONI
ELETTRONI
Protoni e Neutroni I protoni e i neutroni formano insieme quello che si può definire il cuore dell'atomo: il NUCLEO.
Queste due particelle hanno più o meno la stessa MASSA, cioè sono formate da una quantità di materia quasi uguale.
Il protone, però, è diverso dal neutrone perché ha una proprietà, chiamata carica elettrica positiva, che il neutrone non possiede.
PROTONI
Gli elettroni hanno una MASSA circa 2000 volte inferiore rispetto a quella dei protoni e dei neutroni.
Anche gli elettroni hanno una carica elettrica, ma essa è diversa da quella del protone: è una carica elettrica negativa.
• Gli elettroni che ruotano intorno al nucleo non sono distribuiti a caso, ma si muovono all’interno di orbite concentriche dette gusci elettronici.
• I gusci elettronici sono posti
a distanze crescenti dal nucleo.
• Ad ogni guscio corrisponde una particolare energia che dipende dalla vicinanza al nucleo: l’elettrone che occupa l’orbitale più vicino al nucleo ha più energia perché è maggiormente attratto dai protoni, carichi positivamente (esempio: la calamita).
• Ogni guscio elettronico ospita un numero fisso di elettroni:
il primo guscio: 2 e-
l’ultimo guscio: al max 8 e-
• Nei diversi atomi gli elettroni occupano i gusci a partire da quello più vicino al nucleo.
• Solo quando un guscio è completo, gli elettroni incominciano ad occupare il guscio successivo.
L’atomo neutro
In condizioni normali il numero degli elettroni è sempre uguale a quello dei protoni: a un certo numero di cariche positive corrisponde un ugual numero di cariche negative. L'atomo, dunque, risulta neutro, né positivo né negativo.
PROTONI = ELETTRONI
…ci sono tanti elementi diversi…
…eppure gli atomi hanno la stessa struttura (protoni,
neutroni, elettroni)…
COSA DIFFERENZIA L’ATOMO DI CIASCUN
ELEMENTO???
Ciò che distingue l’atomo di un elemento da quello di un altro elemento è il numero di protoni del suo nucleo.
Z
NUMERO ATOMICO
Massa Atomica
La SOMMA delle MASSE di PROTONI, NEUTRONI ed ELETTRONI
di un atomo di un elemento
Considerando che la massa degli elettroni è circa 2000 volte inferiore
rispetto a quella delle altre particelle, non contribuisce molto alla
massa atomica.
UNITA’ DI MISURA = Unità di Massa Atomica (u.m.a.) = 1/12 della MASSA dell’atomo di CARBONIO
Ogni elemento chimico, per brevità, è indicato con un simbolo, che deriva dal nome latino dell'atomo.
Ogni simbolo è formato dalla prima o dalle prime due lettere del nome dell'atomo, per non creare confusione tra atomi i cui nomi hanno la stessa iniziale.
Per esempio il simbolo del carbonio è
C (si legge ci), quello del calcio è Ca
(si legge ci-a) e quello del cloro è Cl
(si legge ci-elle).
Ci sono poi alcuni elementi il cui
simbolo è molto diverso da quello del
loro nome.
Così il simbolo dell'oro è Au, perché
è ricavato dal termine latino aurum;
quello del rame è Cu, perché gli
antichi romani chiamavano il rame
cuprum.
Elemento Nome latino Simbolo Lettura
Idrogeno
Ossigeno
Calcio
Ferro
Mercurio
Carbonio
hydrogenum
oxygenum
calcium
ferrum
hydrardyrum
carbonium
H
O
Ca
Fe
Hg
C
acca
o
ci-a
effe-e
acca-g
ci
ISOTOPI • Atomi di uno stesso elemento hanno lo stesso
numero di PROTONI.
• Mentre il numero di NEUTRONI può variare.
• Ciò significa che nell’atomo di un elemento è fisso il numero atomico Z, ma può variare il numero di massa A.
Si definiscono ISOTOPI tutti gli atomi di uno stesso elemento che differiscono per il numero di massa A, ossia hanno lo stesso numero di PROTONI, ma diverso numero di NEUTRONI.
ISOTOPI DELL’IDROGENO (H)
L’idrogeno ha 3 ISOTOPI, che hanno masse diverse (1, 2, 3), ma le loro proprietà chimiche sono identiche.
La Tavola Periodica degli Elementi
La tavola periodica degli elementi è lo schema col
quale vengono ordinati e classificati gli atomi degli
elementi sulla base del loro numero atomico.
E’ stata ideata, nel 1869, dal chimico
russo Mendeleev, il quale aveva
notato che, ordinando gli elementi
(allora conosciuti) dal più leggero al
più pesante (in base alla loro massa
atomica), le loro proprietà si
ripetevano periodicamente. •http://www.dayah.com/periodic/
• Inizialmente contava numerosi spazi vuoti,
previsti per gli elementi che sarebbero stati
scoperti in futuro, taluni nella seconda metà del
1900.
• L’attuale tavola periodica conta 118 atomi di cui
92 naturali e 26 artificiali, ottenuti in
laboratorio, il più pesante è il Ununoctium.
• In essa si contano: 7 righe orizzontali dette PERIODI
8 colonne verticali dette GRUPPI
1 gruppo di elementi detti di
TRANSIZIONE
2 sottogruppi dei lantanidi e degli attinidi
• Sono in ordine di peso atomico crescente in modo
tale che elementi appartenenti allo stesso GRUPPO
hanno proprietà simili, dovute a un uguale numero
di elettroni nel guscio esterno.
Le PROPRIETA’ CHIMICHE di un elemento sono determinate dal NUMERO DI ELETTRONI
presenti nel GUSCIO PIU’ ESTERNO
Nella tavola di Mendeleev gli elementi sono
raggruppati in:
•metalli
•non metalli
•semimetalli
•gas nobili
MA COSA LI
CONTRADDISTINGUE?
1. A temperatura ambiente sono solidi
(tranne il mercurio, che è liquido)
2. Sono lucenti e splendenti
3. Hanno alto punto di ebollizione e
fusione
4. Sono duttili (ridotti in fili)
5. Sono malleabili (ridotti in fogli)
6. Buoni conduttori di elettricità e
calore
• gas nobili: hanno tutti il guscio esterno completo
con 8 elettroni.
Molto stabili.
• metalli:
1. A temperatura ambiente la
maggior parte si trova allo stato
gassoso, il Br è liquido mentre C,
S, e Si sono solidi
2. Sono opachi
3. Hanno bassi punti di fusione e di
ebollizione
4. Non sono nè duttili nè malleabili
5. Sono fragili
6. Sono cattivi conduttori di calore
(ecc. C)
• non metalli:
ZOLFO
DIAMANTE
• Semimetalli: 1. Si trovano lungo la linea di
separazione tra metalli e non
metalli.
2.Presentano caratteristiche
intermedie
3.Un esempio di utilizzo è
l’elettronica moderna:
dispositivi nei computer,
cellulari, televisori, satelliti.
Quando gli atomi si uniscono: La Molecola
Gli atomi hanno la
capacità di unirsi tra loro
formando le MOLECOLE.
Le Formule Chimiche
Per indicare le molecole si usano le
FORMULE CHIMICHE che indicano il tipo
ed il numero di atomi presenti in una
molecola. O2
idrogeno ossigeno
Nella molecola ci son 2 atomi di idrogeno
La presenza del simbolo e l’assenza di un numero indica che nella molecola c’è un solo atomo di ossigeno
Acqua Si legge acca-due-o
Si scrivono i simboli degli atomi che le costituiscono e, in basso a destra di ogni simbolo, si indica un numero (indice), che
corrisponde al numero di atomi di quell'elemento nella molecola stessa.
Simbolo del calcio
Simbolo del carbonio
Simbolo dell’ossigeno
Sono privi di indice quindi c’è un solo atomo
Sono presenti 3 atomi di ossigeno
Si legge cia-ci-otre
Simbolo del carbonio
Simbolo dell’idrogeno
Sono presenti 4 atomi di idrogeno
Si legge ci-acca-quattro
Le Formule Chimiche
Il NUMERO delle MOLECOLE si indica prima della formula del composto.
2CaCO3 2 molecole di carbonato di calcio
• Un numero relativamente piccolo di atomi può originare un numero elevatissimo di composti chimici.
• Come abbiamo già visto, questo si origina mettendo insieme diversi tipi di atomi.
• Ciò è resa possibile grazie alla capacità degli atomi di formare legami chimici.
Come si formano questi legami?
• Gli elementi dei gas nobili hanno 8 elettroni sull’orbitale esterno.
• Sappiamo che tali elementi erano tutti sconosciuti a Mendeleev perché non formano composti con gli altri atomi.
• Ciò si verifica perché tali atomi hanno l’orbitale esterno completo e quindi sono molto stabili.
Elio e Neon hanno
l’orbitale esterno
completo
Perché non pensare che anche gli atomi possano cercare di legarsi per raggiungere questa configurazione elettronica esterna
particolarmente stabile?
Gli atomi che non hanno l’orbitale esterno completo sono elementi chimicamente instabili e sono fortemente reattivi cioè tendono a formare legami con altri atomi, per raggiungere la configurazione elettronica del gas nobile più vicino nella tavola periodica.
Idrogeno e ossigeno non hanno l’orbitale esterno completo e perciò sono fortemente reattivi.
• Gli atomi quando si incontrano entrano i contatto tramite gli elettroni dell’orbitale esterno perciò sono questi che formano legami.
• Questi elettroni sono anche detti elettroni di valenza e il loro numero stabilisce quanti legami può formare l’atomo.
• Si dice VALENZA il numero di legami chimici che un atomo può fare.
Gli elementi del gruppo I hanno valenza 1
Gli elementi del gruppo II hanno valenza 2
Gli elementi del gruppo III hanno valenza 3
Gli elementi del gruppo VI hanno valenza 4
Gli elementi del gruppo V hanno valenza 3
Gli elementi del gruppo VI hanno valenza 2
Gli elementi del gruppo VII hanno valenza 1
Gli elementi del gruppo VIII hanno valenza 0
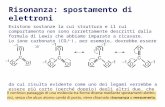
Gli atomi possono formare un legame chimico cedendo, acquistando o
mettendo in comune gli elettroni di valenza, per completare il loro guscio
esterno.
Legame Covalente
Se due atomi sono carenti di elettroni, possono completare il loro guscio esterno condividendo alcuni elettroni, formando
così un legame covalente.
L’atomo di cloro ha 7e sull’orbitale
Manca un solo elettrone per raggiungere la struttura elettronica
dell’argo
Vediamo in che modo due atomi di cloro possono risolvere il problema • A questo punto i due atomi di cloro
hanno avuto un elettrone extra
• Che ha portato alla formazione dell’orbitale esterno completo: l. covalente
• Nel legame covalente i due elettroni appartengono contemporaneamente ai due atomi di cloro
Prendiamo in considerazione un atomo di cloro e uno di idrogeno. Un atomo di cloro può raggiungere la configurazione elettronica di un gas nobile se acquisisce un elettrone. La stessa cosa succede per l’atomo di idrogeno che in questo modo acquisisce la configurazione elettronica esterna dell’elio.
A ciascuno dei due perciò serve un elettrone.
Se condividono due elettroni risolvono il problema raggiungendo entrambi 8 elettroni.
La coppia condivisa forma un legame covalente fra l’atomo di cloro e l’atomo di idrogeno.
I due elettroni condivisi si muovono intorno ad entrambi gli atomi.
Il legame covalente fra atomi diversi
Fonte http://www.apprendiscienza.it
Quando un atomo cede uno o più elettroni ad un altro atomo, tra i due si forma un
legame ionico.
Il legame ionico
Il sodio acquista la sua configurazione elettronica stabile cedendo l’elettrone dell’orbitale n=3 diventando Na+.
Cedendo il suo elettrone all’atomo di cloro che diventa Cl-.
In questo modo anche il cloro raggiunge la configurazione di gas nobile.
A questo punto abbiamo un catione sodio con carica positiva e un anione cloruro con carica negativa.
Gli ioni con carica opposta si attraggono per forza elettrostatica.
Si origina così un nuovo composto: il cloruro di sodio con la formazione di un legame ionico.
Il legame ionico è la conseguenza dell'attrazione elettrostatica che si manifesta tra i due ioni di carica opposta.
• Nei metalli gli atomi perdono facilmente gli elettroni più esterni, estremamente mobili, trasformandosi in ioni positivi.
• Questi ioni vanno ad occupare il minor spazio possibile sistemandosi all'interno di un reticolo cristallino.
• Gli elettroni persi non appartengono ad un singolo atomo, ma a tutto il reticolo del solido, muovendosi da un atomo all’altro.
• Essi sono liberi di muoversi fra gli ioni positivi, garantendo la neutralità del sistema e fungendo da collante per gli ioni metallici.
• Il legame metallico è dovuto quindi all’attrazione elettrostatica tra gli elettroni mobili e gli ioni positivi.
Il legame metallico
Le Reazioni Chimiche
Il legno di un fiammifero brucia combinandosi con l’ossigeno dell’aria,
produce anidride carbonica e sprigiona energia (calore e luce) trasformandosi in
cenere.
Le Reazioni Chimiche
Il ferro di un chiodo, reagendo con l’ossigeno dell’aria, dà origine ad una serie
di composti di colore rossiccio che chiamiamo ruggine.
Le Reazioni Chimiche
Una reazione chimica è un processo in cui partendo da alcune sostanze (reagenti) si
ottengono sostanze diverse (prodotti).
Le Reazioni Chimiche
Una reazione chimica, in genere, libera energia sotto forma di calore come nel caso del fiammifero che brucia. Queste
reazioni si dicono esotermiche.
Le Reazioni Chimiche
Le reazioni chimiche che sottraggono calore si dicono
endotermiche.
I sacchetti che usano i dentisti per raffreddare le gengive ed
evitare che si gonfino contengono nitrato di potassio
che, reagendo con l’acqua, fa scendere la temperatura a -5°C.
Le Reazioni Chimiche
Legge di Lavoisier
In una reazione chimica nulla si crea e nulla si distrugge: la somma delle masse dei reagenti è uguale alla somma delle masse dei prodotti.
Le leggi fondamentali delle reazioni chimiche
Le Reazioni Chimiche
Nel 1799 il chimico francese J.L. Proust, notò che la pirite conteneva ferro e zolfo e che questi due elementi erano presenti secondo un rapporto fisso e costante: per ogni grammo di ferro erano sempre presenti 0,57 g di zolfo.
Le leggi fondamentali delle reazioni chimiche
Le Reazioni Chimiche
Legge di Proust
In un composto chimico gli elementi che lo costituiscono sono sempre presenti in rapporti in massa costanti e definiti.
Le leggi fondamentali delle reazioni chimiche