INTRODUZIONE ALLA TERAPIA · PDF filel’eliminazione dell’urea con la dialisi e la...
Transcript of INTRODUZIONE ALLA TERAPIA · PDF filel’eliminazione dell’urea con la dialisi e la...

ROMASEU
1Principi generali dell’Emodialisi
CAPITOLO I
PRINCIPI GENERALI DELL’EMODIALISI
INTRODUZIONE ALLA TERAPIA SOSTITUTIVASandro De Angelis
La terapia sostitutiva della funzione renale si basa sui seguenti trattamenti:
• Trapianto renale;• Dialisi peritoneale;• Emodialisi.Il trapianto renale, descritto nel capitolo X,
è la modalità terapeutica di scelta nel paziente con insuffi cienza renale cronica (IRC) in termi-ni di costi, qualità di vita ed aspettativa di vita.
In particolare, il trapianto renale da dona-tore vivente offre i risultati migliori per quanto concerne la sopravvivenza dell’organo trapian-tato.
La dialisi peritoneale (PD), descritta nel capitolo II, è il trattamento di scelta in alcune aree del mondo come il Messico, la Nuova Zelanda, l’Australia, il Canada, nelle quali la metodica di dialisi intracorporea si è imposta non solo per i costi più contenuti, ma soprat-tutto per la grande autonomia del paziente da strutture sanitarie di riferimento non facilmente raggiungibili.
L’emodialisi (HD) è attualmente il tratta-mento sostitutivo più diffuso al mondo, oggetto di continua evoluzione tecnologica per quanto
concerne le apparecchiature, il materiale d’uso e la terapia di supporto (eritropoietina, chelanti del fosforo, vitamina D, etc.).
È la metodica che risponde alle necessità cliniche sia del paziente acuto che del paziente cronico, ma a costi superiori alle altre metodi-che e destinati a crescere in misura direttamen-te proporzionale all’incremento del numero dei pazienti in trattamento.
In linea generale, la scelta del tipo di tratta-mento del singolo paziente può essere la risul-tante di vari fattori che infl uiscono nel processo decisionale:
• Aspetti economici ed organizzativi;• Aspetti clinici del paziente;• Aspetti legati all’esperienza ed alla pre-
ferenza dei nefrologi.
L’eterogeneità delle situazioni è dunque talmente ampia da rendere diffi cile la sempli-fi cazione di criteri di indirizzo utilizzabili nella scelta della metodica; tuttavia sono stati pro-posti algoritmi che possono aiutare a risolvere almeno in parte il problema decisionale.
Cap_01.indd 1Cap_01.indd 1 01/10/2007 12.03.3601/10/2007 12.03.36

ROMASEU
2 La dialisi: tecnica e clinica
PRINCIPI FISICO-CHIMICI DELL’EMODIALISI
Stefano Condò
Fig. I.1 –Algoritmo raffi gurante le modalità di scelta della metodica terapeutica più idonea al singolo paziente ( da Princi-ples and practice of dialysis, 3rd edition, W.L.Henrich 2004 by LIPPINCOTT WILLIAMS & WILKINS, modifi cata).
Storia della Dialisi
Thomas Graham (1805-1869), Professore di Chimica dell’Università di Londra, coniò per primo il termine dialisi per descrivere il movi-mento dei colloidi sospesi in un fl uido attraver-so una membrana vegetale essiccata e rivesti-ta da albumina (Fig. I.2).
Nel 1913 Abel, Roundtree e Turner, presso la Johns Hopkins Medical School di Baltimora, realizzarono con successo la rimozione di soluti dal sangue di animali nefrectomizzati mediante la circolazione extracorporea del sangue all’in-terno di tubi di collodio semipermeabile, della lunghezza di 40 cm e del diametro di 8 mm, immersi in un bagno di dialisi.
Cap_01.indd 2Cap_01.indd 2 01/10/2007 12.03.3901/10/2007 12.03.39

ROMASEU
3Principi generali dell’Emodialisi
Fig. I.2 – Thomas Graham (1805-1869) ed il dispositivo utilizzato per studiare il movimento dei colloidi attraverso una membrana vegetale rivestita da albumina.
Fig. I.3 – John Abel ed il dispositivo di tubi di collodio realizzato per la ricerca sperimentale sulla depurazione di animali uremici (nefrectomizzati).
Nel 1926 Georg Haas (1886-1971) utilizzò per la prima volta nell’uomo la medesima tec-nica, con tubi di collodio della lunghezza di 120 cm in grado di assicurare una grande superfi -cie di scambio per la diffusione dei soluti (Fig. I.4).
Infi ne nel 1940 Johan Kolff, sperimentò una membrana di cellophane, derivato dalla cellulo-sa rigenerata ed utilizzato per avvolgere le sal-sicce, gettando le basi allo sviluppo delle attuali
membrane artifi ciali per la dialisi nel paziente acuto (Fig. I.5).
Le tappe successive che hanno effettiva-mente contribuito alla diffusione della dialisi nei pazienti cronici sono però rappresentate dallo shunt di Quinton e Scribner, che realizzavano nel 1960 il primo duraturo accesso vascolare, nonché l’utilizzo, negli stessi anni, dell’eparina che consentiva il blocco del sistema di emo-coagulazione del paziente nel corso della cir-colazione extracorporea (Fig. I.6).
Cap_01.indd 3Cap_01.indd 3 01/10/2007 12.03.3901/10/2007 12.03.39

ROMASEU
4 La dialisi: tecnica e clinica
Fig. I.4 – Georg Haas nel 1926 utilizza il medesimo dispositivo realizzato con tubi di collodio nell’uomo, aumentando però notevolmente la superfi cie di scambio.
Fig. I.5 – Johan Kolff nel 1940 sperimenta una membrana di cuprophan in un paziente con insuffi cienza renale acuta, gettando le basi della terapia dialitica attuale.
Cap_01.indd 4Cap_01.indd 4 01/10/2007 12.03.4001/10/2007 12.03.40

ROMASEU
5Principi generali dell’Emodialisi
Principi fi sico-chimici
Con i trattamenti sostitutivi della funzionali-tà renale si è cercato di imitare quello che av-viene fi siologicamente nell’organismo umano.
Le membrane cellulari si comportano come membrane semipermeabili, caratterizzate cioè da una completa permeabilità all’acqua ed una limitata permeabilità ai soluti in essa disciolti.
Gli spostamenti dell’acqua da un compar-timento all’altro avvengono pertanto sotto la spinta di una pressione idraulica esercitata su uno dei compartimenti, oppure della pressio-ne osmotica esercitata tra i due versanti della membrana dalla differente composizione delle soluzioni. Infatti, in due compartimenti chiusi contenenti acqua pura e separati da una mem-brana semipermeabile, l’agitazione termica delle molecole d’acqua è responsabile di un movimento continuo bidirezionale delle stesse attraverso la membrana, denominato movi-mento diffusivo.
Se si applica una pressione idraulica su un versante dei due compartimenti si osser-verà un fl usso di acqua dal compartimento a pressione maggiore verso il compartimento a pressione minore fi no al ripristino dell’equilibrio
pressorio. Il fl usso di acqua sarà direttamente proporzionale alla permeabilità idraulica della membrana.
Se invece aggiungiamo in uno dei due com-partimenti un soluto non in grado di attraversa-re la membrana semipermeabile, si osserve-rà un passaggio di acqua dal compartimento senza soluto a quello con il soluto introdotto, sino all’equilibrio della concentrazione tra le due soluzioni. Questo fenomeno viene defi nito “osmosi” e la differenza di pressione idraulica che si realizza tra i due compartimenti viene denominata “pressione osmotica”.
La pressione osmotica viene espressa per-tanto dalla concentrazione molare (numero di moli per litro di soluzione) dal momento che dipende dal numero di particelle disciolte nella soluzione.
A parità di peso molecolare del soluto, i soluti più piccoli eserciteranno una maggiore pressione osmotica.
La pressione osmotica esercitata dalle pro-teine nel sangue viene detta pressione oncoti-ca ed è pari a 21 mmHg.
Tale pressione, durante la dialisi, si oppone alla pressione idraulica negativa applicata al versante del liquido di dialisi.
Fig. I.6 – Belding Scribner nel 1960 realizza il primo “shunt”, dispositivo che costituisce l’accesso vascolare al paziente uremico.
Cap_01.indd 5Cap_01.indd 5 01/10/2007 12.03.4001/10/2007 12.03.40

ROMASEU
6 La dialisi: tecnica e clinica
La dialisi ha due obiettivi principali: il primo è il passaggio di sostanze tossiche dal sangue del paziente al dialisato (soluzione con la quale si confronta il sangue), come ad esempio il po-tassio e l’urea, o l’aggiunta di soluti al sangue del paziente, come ad esempio il bicarbonato ed il calcio; il secondo è la sottrazione di volu-me (ultrafi ltrazione), questi due processi pos-sono avvenire simultaneamente o indipenden-temente uno dall’altro.
I due meccanismi principali su cui si basa il primo obiettivo della dialisi sono la diffusione e la convezione a cui si oppone la pressione oncotica delle proteine ematiche.
La diffusione come abbiamo visto è il pas-saggio di soluti dal compartimento ad alta con-centrazione verso quello a più bassa concen-trazione, tale fenomeno è dipendente dal peso molecolare del soluto.
La convezione invece è il passaggio di solu-ti da un compartimento ad un altro secondo un gradiente di pressione idrostatica.
Il secondo obiettivo della dialisi è la sottra-zione di volume che avviene mediante l’ultrafi l-trazione che per defi nizione è il passaggio del solvente da un compartimento ad un altro gra-zie ad una differenza di pressione idrostatica.
Poiché esiste una relazione tra l’entità del-l’eliminazione dell’urea con la dialisi e la morbili-tà del paziente dializzato si è potuto stabilire che l’urea è un indice perfettamente adatto alla valu-tazione dell’effi cacia del trattamento dialitico.
Qui di seguito verranno riportate alcune formule matematiche che forniscono una vali-da base ai fi ni dell’ottimizzazione della terapia dialitica.
Vi è un tasso di formazione di urea dipen-dente dal tempo e dal metabolismo = tasso di generazione dell’urea: G.
A causa della neoformazione cambia, in rapporto al tempo, la concentrazione dell’urea: C(t) nel suo costante spazio di distribuzione.
Il paziente dializzato ha due possibilità di ri-durre di nuovo la concentrazione dell’urea:
• attraverso la diuresi residua renale = clearance residua dell’urea = KR che può essere determinata attraverso la raccolta dell’urina tra due dialisi e dosando la con-centrazione urinaria e sierica dell’urea;
• attraverso il dializzatore la cui clearance dell’urea KD è nota;
La clearance totale è data, quindi, da:
(clearance totale = clearance dell’urea residua + clearance dell’urea del dializzatore).
La variazione della concentrazione del-l’urea è data dalla differenza tra il tasso di ge-nerazione G e l’escrezione (clearance totale x concentrazione).
La concentrazione dell’urea C(t) in rapporto al tempo si calcola con la formula:
dove: C(t): Concentrazione dell’urea in rapporto al
tempo.Co: Concentrazione iniziale dell’urea, per
esempio azotemia predialisi.G: Tasso di generazione dell’urea.KT: Clearance totale dell’urea.V: Volume di distribuzione dell’urea.t: Durata della dialisi
Nel modello dell’urea del National Coope-rative Dialysis Study (N.C.D.S.) la clearance residua renale viene posta ora con un valore uguale a zero; ciò è assolutamente ammissibi-le, poiché la clearance residua renale dell’urea è pressochè trascurabile se paragonata alla clearance dell’urea attraverso il dializzatore.
Il volume di distribuzione per l’urea viene ot-tenuto calcolando il 58% del peso corporeo.
Per semplifi care si può assumere che la for-mazione dell’urea durante il tempo di dialisi tD può essere considerata trascurabile; (ciò è am-missibile quando si compara l’alta clearance dell’urea di un dializzatore con il ridotto tasso di formazione nel “breve” tempo di dialisi).
Si delinea pertanto questa relazione:
dove:C(t): Concentrazione dell’urea in rapporto al
tempo.Co: Concentrazione iniziale dell’urea.KD: Clearance dell’urea del dializzatore.t: Durata della dialisi.V: Volume di distribuzione dell’urea.
Cap_01.indd 6Cap_01.indd 6 01/10/2007 12.03.4101/10/2007 12.03.41

ROMASEU
7Principi generali dell’Emodialisi
Dopo la dialisi (t=tD) il valore fi nale dell’urea C T è :
dove:CT: Valore fi nale dell’urea.Co: Concentrazione iniziale dell’urea (azo-
temia predialisi).KD: Clearance dell’urea del dializzatore.tD: Durata della dialisi.V: Volume di distribuzione dell’urea.
L’esponente viene indicato come in-dice di trattamento standardizzato e determina l’effi cacia della dialisi.
Il tasso del catabolismo proteico PCR si cal-cola nel modo seguente:
dove:G: Tasso di generazione dell’urea-azoto
ureico.V: Volume di distribuzione dell’urea-azoto
ureico.
G: Esprime l’aumento della concentrazione sierica di urea-azoto ureico interdialitico, per cui l’azotemia deve essere deter-minata al termine di una dialisi e prima della dialisi successiva; nella pratica si userà il valore ottenuto dalla media di di-verse misurazioni.
Per impiegare valori non falsati viene racco-mandato di effettuare i dosaggi su campioni di sangue prelevati durante il periodo lungo inter-dialitico (per esempio il venerdì al termine della dialisi e il lunedì prima dell’inizio della dialisi).
Poiché la clearance totale dell’urea tra due sedute dialitiche può essere considerata ugua-le a zero, il tasso di generazione G dell’urea-azoto ureico sarà dato da:
dove:ΔC: Differenza di concentrazione di urea-
azoto ureico tra due dialisi.V: Volume di distribuzione dell’urea-azoto
ureico.t : Durata della dialisi.
Il DIALISATO
Sandro De Angelis
La composizione del dialisato in emodialisi ed in dialisi peritoneale ha lo scopo di assicu-rare il bilancio idro-elettrolitico del paziente con insuffi cienza renale cronica terminale.
Il dialisato per l’emodialisi viene ottenuto dalla miscelazione dell’acqua deionizzata con le taniche di concentrato (acida e basica) la cui composizione chimica viene scelta sulla base delle conoscenze e dell’esperienza del respon-sabile del trattamento dialitico.
Nella pratica clinica la medesima soluzione dialitica è di regola ben tollerata dalla maggior parte dei pazienti, mentre in alcuni pazienti la medesima soluzione può provocare instabilità emodinamica e sintomi da disequilibrio diali-tico.
In questi casi è necessario variare la com-posizione del dialisato in rapporto alle caratte-ristiche cliniche del paziente, personalizzando in pratica il trattamento dialitico.
Composizione del dialisato per l’emodialisi
Il Sodio
La composizione del dialisato utilizzato in emodialisi ha subìto un’evoluzione dettata dal-la necessità di migliorare la tolleranza della procedura dialitica.
Cap_01.indd 7Cap_01.indd 7 01/10/2007 12.03.4101/10/2007 12.03.41

ROMASEU
8 La dialisi: tecnica e clinica
All’inizio della dialisi, fi no ai primi anni ’70, veniva utilizzato un dialisato con basso con-tenuto di sodio (130-135 mEq/L) allo scopo di ridurre le complicanze del sovraccarico idrico, l’ipertensione volume-dipendente e lo scom-penso cardiaco.
Con la successiva riduzione della durata del trattamento e la maggiore effi cienza delle tecniche dialitiche, il basso contenuto di sodio appariva inadeguato contribuendo a sua vol-ta all’instabilità intradialitica ed aggravando la sindrome da disequilibrio per la riduzione ra-pida dell’osmolalità plasmatica e del volume intravascolare. Il contenuto del sodio nel diali-sato veniva dunque aumentato sino a 139-144 mEq/L, livello tuttora utilizzato nella maggio-ranza delle procedure dialitiche.
Il timore che l’aumento del contenuto di sodio nel dialisato avesse un effetto dipsoge-no, causando quindi un aumento ponderale del paziente ed uno scarso controllo dei valori pressori è stato smentito dalla pratica clinica. Infatti l’aumento del sodio nel bagno di dialisi ha consentito una migliore tolleranza all’ultra-fi ltrazione e quindi un controllo ottimale dell’in-cremento ponderale interdialitico del paziente.
Di recente è stato introdotto un dispositi-vo che consente di variare la concentrazione di sodio del dialisato nel corso del trattamen-to dialitico, delineando un profi lo “a campana” del sodio, elevato all’inizio della dialisi, quin-di isotonico ed infi ne ipotonico al termine del trattamento. Questa variazione programmata consente sia di limitare il rapido declino del-l’osmolalità plasmatica indotta all’inizio del trat-tamento dalla diffusione dell’urea e degli altri soluti di piccolo peso molecolare, sia di con-tenere lo sviluppo dell’ipertonicità plasmatica, della sete e quindi dell’incremento ponderale nell’intervallo interdialitico. Altri sintomi effi ca-cemente corretti dal sodio variabile sono l’emi-crania intradialitica, i crampi e l’ipotensione ar-teriosa alla fi ne del trattamento.
Per quanto concerne la sindrome da dise-quilibrio in pazienti iperazotemici che iniziano il primo trattamento dialitico, la migliore strategia terapeutica consiste nel ridurre una quantità di urea relativamente minore rispetto ai trat-tamenti cronici standard, programmando cioè nell’arco di alcuni giorni la discesa graduale e lenta della concentrazione ematica dell’urea.
Inoltre, l’utilizzo del sodio variabile nel dialisato consente in questi pazienti di limitare il pas-saggio di liquidi all’interno del compartimento intracellulare, limitando così le complicanze neurologiche.
Il Potassio
La rimozione del potassio ematico in ec-cesso viene ottenuta dall’utilizzo di un dialisato con bassa concentrazione di potassio (nell’or-dine di 2-3 mEq/L), che crea un gradiente fa-vorevole alla diffusione del potassio dal san-gue al liquido di dialisi. Tuttavia tale rimozione presenta una notevole variabilità da paziente a paziente legata alla diversa distribuzione dello ione potassio (prevalentemente intracellulare) rispetto allo ione sodio (prevalentemente ex-tracellulare). Infatti il passaggio del potassio dall’interno all’esterno della cellula e quindi dal liquido extracellulare al dialisato è condiziona-to dai seguenti fattori:
• equilibrio acido-base;• concentrazione di glucosio ed insulina;• attività delle catecolamine;• osmolalità plasmatica.
Il movimento del potassio dallo spazio in-tracellulare all’extracellulare è infl uenzato dalle modifi cazioni dell’equilibrio indotte dal trattamento dialitico. Un’alcalosi extracellulare favorisce il passaggio del potassio all’interno della cellula mentre l’acidosi ne favorisce il passaggio inverso. Pertanto nel corso della dialisi la correzione dell’equilibrio acido-base del paziente, prodotta dall’aggiunta di basi del dialisato, tende a ridurre progressivamente la rimozione del potassio.
Redaelli ha dimostrato che un dialisato pri-vo di potassio favoriva un minor assorbimento di basi al paziente rispetto all’uso di un dialisa-to con 2 mEq/L.
Ne consegue l’ipotesi che un elevato gra-diente plasma/dialisato della concentrazione di potassio possa ridurre lo spostamento degli ioni idrogeno dal compartimento intracellulare determinando una minore diffusione di bicar-bonati dal dialisato al compartimento extracel-lulare. Nel trattamento dialitico di pazienti con acidosi metabolica severa deve essere atten-tamente valutata tale condizione.
Cap_01.indd 8Cap_01.indd 8 01/10/2007 12.03.4101/10/2007 12.03.41

ROMASEU
9Principi generali dell’Emodialisi
È noto che l’insulina determina l’incorpora-zione del potassio da parte delle cellule per-tanto può infl uenzare la rimozione del potassio durante il trattamento dialitico.
L’uso di dialisati privi di glucosio ha deter-minato la rimozione di quantità maggiori di potassio rispetto all’uso di dialisati contenenti glucosio in riferimento ad una minore presenza di insulina prodotta dal paziente. Le variazioni dell’osmolalità plasmatica si rifl ettono sulla di-stribuzione del potassio tra i due compartimen-ti, intra ed extracellulare.
La somministrazione di soluzioni saline iper-toniche o di mannitolo, utilizzati nella pratica clinica per correggere l’ipotensione arteriosa durante dialisi, favoriscono lo spostamento del potassio dalle cellule verso spazio interstiziale, una maggiore rimozione del potassio col liqui-do di dialisi, quindi una riduzione della kaliemia del paziente.
L’ipokaliemia aumenta le resistenze perife-riche tuttavia Pogglitsch ha osservato una ri-duzione degli episodi ipotensivi in seguito alla somministrazione aggiuntiva di potassio esegui-ta nei 30 minuti fi nali del trattamento dialitico.
La spiegazione di questo apparente para-dosso è insita nella nota interazione esistente tra l’ipokaliemia ed il sistema nervoso autono-mo. Infatti, nei pazienti con insuffi cienza renale terminale può essere presente una disfunzione del sistema autonomo provocata dall’uremia, pertanto riduzioni della kaliemia indotte dalla dialisi possono provocare una riduzione della concentrazione plasmatica delle catecolamine quindi un’alterata risposta vasoattiva.
Nei pazienti emodializzati con cardiopatie, in trattamento con digossina, l’ipokaliemia può provocare aritmie di gravità variabile sino alla fi brillazione ventricolare, in particolare all’inizio del trattamento dialitico quando la discesa del potassio è più repentina.
Redaelli e collaboratori hanno studiato gli effetti di un modello di potassio variabile allo scopo di minimizzare gli effetti della riduzione del potassio nella prima fase del trattamento dialitico. In pazienti soggetti a frequenti aritmie intradialitiche, è stato mantenuto costante un gradiente sangue/dialisato di 1,5 mEq/L per tutta la durata del trattamento, col risultato di un’evidente riduzione dei complessi prematuri ventricolari.
Il Tampone Bicarbonato
Il tampone bicarbonato ha sostituito com-pletamente l’acetato da circa 20 anni a causa dei problemi di instabilità emodinamica provo-cati dall’effetto vasodilatatore dell’acetato. La produzione del dialisato con bicarbonato av-viene ad opera del monitor che provvede alla miscelazione del concentrato acido e del con-centrato basico con l’acqua deionizzata.
L’esclusione dell’acido lattico, del calcio e del magnesio dal concentrato di bicarbonato impedisce la precipitazione di questi cationi (come magnesio e calcio carbonato) che po-trebbe altrimenti verifi carsi nella soluzione ad alto tenore di bicarbonato.
Nella pratica clinica la concentrazione fi nale del bicarbonato è generalmente compresa tra 33 e 38 mmol/L.
L’utilizzo del tampone bicarbonato nel diali-sato non è esente da complicazioni:
• contaminazione microbica resa possibile dal fatto che la soluzione di bicarbonato è un ottimo terreno di cultura dei batteri;
• ipossiemia conseguente all’aumento del pH
• alcalosi metabolica, responsabile di confusione mentale, letargia, debolezza e crampi muscolari.
Queste complicanze sono state per lo più ri-solte dalla sostituzione del concentrato liquido con quello in polvere, disponibile in cartuccia, diluito on-line dal monitor.
La concentrazione ottimale di bicarbonato nel dialisato è dunque quella minima atta a prevenire l’alcalosi postdialitica e quella mas-sima atta a controllare l’incremento dell’acidosi nell’intervallo interdialitico.
Recentemente Ahmad ha proposto la so-stituzione nel concentrato acido dell’acetato con l’acido citrico, migliorando l’effi cienza del trattamento dialitico, probabilmente per l’effetto anticoagulante dell’acido citrico sulla superfi cie della membrana.
Il Calcio
La concentrazione del calcio nel dialisa-to prevalentemente utilizzata è di 3,5 mEq/L, quantità che può risultare eccessiva determi-
Cap_01.indd 9Cap_01.indd 9 01/10/2007 12.03.4101/10/2007 12.03.41

ROMASEU
10 La dialisi: tecnica e clinica
nando ipercalcemia nei pazienti che assumo-no contemporaneamente il calcio per os quale chelante del fosforo e sono in terapia con vita-mina D.
Infatti Slatopolsky in questi pazienti sugge-risce di ridurre il calcio del dialisato a 2,5 mEq/L lasciando inalterato il dosaggio del calcio uti-lizzato come chelante del fosforo e sommini-strando la vitamina D per evitare la stimolazio-ne del Paratormone da parte del dialisato con basso contenuto di calcio.
Tuttavia, in aggiunta agli effetti sul metabo-lismo minerale, la variazione della concentra-zione del calcio nel dialisato può infl uire sulla stabilità emodinamica del paziente nel corso della dialisi.
In uno studio condotto su pazienti con ridu-zione della frazione di eiezione inferiore al 40% è stata infatti rilevata una minore incidenza di episodi ipotensivi con 3,5 mEq/L di calcio nel dialisato rispetto ai pazienti dializzati con con-centrazioni di 2,5 mEq/L. Questo dato è stato posto in relazione all’infl uenza della concen-trazione sierica del calcio sia sulle resistenze periferiche sia sull’output cardiaco.
Pertanto, la scelta di una concentrazione di calcio nel dialisato inferiore a 3,0 mEq/L impo-ne un monitoraggio del calcio sierico e del PTH onde evitare gli effetti sul circolo e sul metabo-lismo minerale di un bilancio negativo del cal-cio, in particolare nei pazienti che assumono Sevelamer come chelante del fosforo.
Il Magnesio
La concentrazione usuale del magnesio nel dialisato è di 0,5 – 1,0 mEq/L ed ha lo scopo di mantenere costante la magnesiemia del pa-ziente a livelli di 1,58-2,55 mg/dL. Una riduzio-ne della concentrazione di magnesio nel dia-lisato può essere necessaria nei pazienti che assumono idrossido di magnesio come che-lante del fosforo.
Il Fosforo
Normalmente il dialisato è privo di fosforo, tuttavia esistono in clinica alcune condizioni che possono richiedere l’aggiunta di fosforo alla soluzione di dialisi:
• ipofosfatemia da malnutrizione severa;• ipofosfatemia da intossicazioni o da
overdose;• ipofosfatemia nei pazienti in dialisi not-
turna prolungata.
La comparsa di ipofosfatemia nei pazienti in dialisi notturna condotta oltre le 6 ore di tratta-mento comporta una riduzione del fosforo non adeguatamente compensata dall’apporto ali-mentare, come segnalato da Pierratos e colla-boratori, facilmente correggibile con l’aggiunta del fosforo nel dialisato.
MONITORAGGIO DELLA QUALITÀ DEI LIQUIDI PER DIALISI
Enzo Ancarani
Dall’inizio della terapia dialitica è stato af-frontato il problema della depurazione del-l’acqua necessaria per il trattamento dialitico e contenuta nelle soluzioni dai contaminanti chimici e batteriologici. Furono individuate le patologie di accumulo dei contaminanti chimici e fu messa in evidenza l’importanza dei conta-minanti batterici, delle loro eso ed endotossine. Fu reso obbligatorio il trattamento dell’acqua di rete mediante deionizzazione ed infi ne per mezzo di osmosi inversa.
Contaminanti chimici
La qualità dei liquidi per dialisi può essere infl uenzata da vari fattori relativi ai singoli costi-tuenti del sistema dialitico, così rappresentati:
– acqua di diluizione;– soluzioni concentrate;– soluzioni di reinfusione;– biomateriali artifi ciali di dialisi;– membrane;– tipo di sterilizzazione.
Cap_01.indd 10Cap_01.indd 10 01/10/2007 12.03.4101/10/2007 12.03.41

ROMASEU
11Principi generali dell’Emodialisi
Di particolare importanza è conoscere la qualità dell’acqua proveniente dall’acquedotto cittadino: il possibile inquinamento delle falde acquifere dipende dalla provenienza delle ac-que, se superfi ciali,profonde o di bacino, dalla presenza nei terreni di rifi uti industriali, dall’uso e dal tipo di fertilizzanti, dalla presenza di so-stanze radioattive.
Le patologie da accumulo dei contaminanti chimici sono rappresentate nella Tabella I.1.
Particolare attenzione va rivolta alla possi-bile contaminazione chimica legata ai conteni-tori delle soluzioni concentrate e dei liquidi di sostituzione.
È stato descritto infatti il rilascio di mono-meri liberi (CVM) e di plastifi canti (ftalati), i cui possibili effetti sono rappresentati, dato il note-vole volume delle reinfusioni, soprattutto legato alle tecniche convettive, a un’interazione con le strutture cellulari dell’organismo con induzione di reazioni allergiche, aumento dell’incidenza dei tumori e intolleranza dialitica.
La conoscenza di tali problematiche deve indirizzare i responsabili a forniture di soluzioni con contenitori privi di ftalati.
Effetto del tipo di sterilizzazione dei biomateriali
Il tipo di sterilizzazione può determinare di per sé una contaminazione diretta o indiretta dell’acqua per dialisi e un’alterazione chimica delle membrane costituenti i fi ltri per dialisi.
La sterilizzazione mediante ETO può deter-minare abbondante residuo di ossido di etilene nei materiali, produzione di anticorpi anti-ETO e reazioni allergiche determinanti intolleranza dialitica.
La sterilizzazione mediante raggi gamma, con particolare riguardo al poliacrilonitrile, al policarbonato, all’acetato di cellulosa ed al propilene, pur non alterando la biocompatibili-tà dei materiali, ne può alterare la stabilità con modifi ca delle proprietà meccaniche (maggio-re fragilità) e alterazione delle caratteristiche estetiche (odore, colore).
La sterilizzazione con vapore offre a dif-ferenza degli altri metodi i seguenti vantaggi: non altera la stabilità dei biomateriali, mantiene inalterata la biocompatibilità e non sembra rila-sciare carcinogeni.
Sistemi di depurazione dell’acqua
Deionizzazione
Determina lo scambio ionico di anioni e cationi, raggiungendo un notevole grado di pu-rezza dell’acqua. Le problematiche presentate da questo sistema sono rappresentate da:
• possibile contaminazione batterica;• rilascio monomeri;• alterazione pH dell’acqua;• impurità da HCl e soda caustica;• problemi ecologici di scarico.
Contaminante Effetti tossici
Sintomi
Alluminio Encefalopatia, danno osseo
Calcio-magnesio Nausea, vomito,dolori muscol.
Cloramine Emolisi, anemia,metaemoglobinemia
Rame Nausea, cefalea, senso di freddo,danno epatico,emolisi
Fluoro Osteomalacia,osteoporosi
Solfati Nausea, vomito, acidosi
Zinco Anemia, nausea, febbre,vomito
Nitrati Metaemoglobinemia con cianosi, ipotensione, nausea
pH Inattivazione eparina, prurito, nausea, vomito,acidosi
Tabella I.1 – Effetti tossici e sintomi provocati dai possibili contaminanti chimici dell’acqua.
Cap_01.indd 11Cap_01.indd 11 01/10/2007 12.03.4201/10/2007 12.03.42

ROMASEU
12 La dialisi: tecnica e clinica
Osmosi inversa
È caratterizzata dalla seguente sequenza di procedimenti, aventi ciascuno una determinata fi nalità:
• clorazione → disinfezione• prefi ltrazione → eliminazione delle impu-
rità grossolane• addolcimento → trattamento acqua dura• declorazione → salvaguardia moduli
osmotici• microfi ltrazione → eliminazione impurità
più fi ni• osmosi inversa → dissalazione.
Permette l’eliminazione del 90-95% dei sali, il 100% delle sostanze organiche, il 99% dei batteri e dei pirogeni con il vantaggio dal punto di vista ecologico di totale mancanza di scari-chi aggressivi.
Possibili problemi sono rappresentati dal danneggiamento e rottura delle membrane con possibile contaminazione batterica e dalla non perfetta depurazione di coramine,fl uoruri e nitrati. A questo si può rimediare raddoppiando i moduli e instaurando una procedura di bio-smosi, che consiste in un doppio passaggio consequenziale dell’acqua, consentendone la massima depurazione.
Un quadro riassuntivo viene offerto dalla Tabella I.2, che mette a confronto i risultati del-la depurazione dell’acqua mediante deionizza-zione ed osmosi inversa.
Per quel che riguarda la carica microbica nei vari passaggi dell’acqua attraverso i diver-
si sistemi di depurazione, la Figura I.7 mostra come la possibile contaminazione batterica sia rappresentata nella massima misura nel-l’ambito delle colonne di carbone attivo della deionizzazione, viene azzerata dalla osmosi inversa, ma diviene sensibile, e quindi oggetto di particolare cautela, a carico dell’impianto di distribuzione nei suoi diversi tratti, azzerandosi di nuovo se si ha l’accortezza di dotare di ultra-fi ltro ciascuna attrezzatura per emodialisi.
Sistema di distribuzione
Il sistema di distribuzione dell’acqua costi-tuisce un elemento di fondamentale importan-za da tenere costantemente sotto osservazio-
Demineralizzatore Osmosi inversa
Ca Mg +++ +++
inorganici +++ ++
organici 0 ++
particelle 0 +++
batteri 0 +++
pirogeni 0 +++
colloidi 0 +++
cloro 0 +
cloramine 0 +
fl uoro +++ +
nitrati +++ +
metalli pesanti + +++
Tabella I.2 – Risultati a confronto della depurazione otte-nuta rispettivamente mediante deionizzazione ed osmosi inversa dell’acqua di rete.
Fig. I.7 – Possibili sedi di contaminazione batterica nei diversi tratti dell’impianto di distribuzione.
Cap_01.indd 12Cap_01.indd 12 01/10/2007 12.03.4201/10/2007 12.03.42

ROMASEU
13Principi generali dell’Emodialisi
ne: esso deve garantire la conservazione delle caratteristiche chimiche, fi siche e batteriolo-gice dell’acqua osmotizzata; deve mantenere l’acqua in circolazione continua senza punti di ristagno e deve garantire l’alimentazione dei punti di prelievo in costanza di portata e di pressione.
In passato esso veniva costruito utilizzan-do il PVC, che secondo l’esperienza maturata negli anni ha dimostrato di essere passibile di corrosione col passare del tempo o con l’uso dei disinfettanti chimici, portando alla formazio-ne di porosità che permettono l’annidamento batterico.
Inoltre le giunzioni tra le parti del circuito co-stituivano una rugosità che favoriva la conta-minazione batterica. Queste irregolarità com-portavano la costituzione di un biofi lm batterico e incrostazioni, dai quali avveniva il rilascio di endotossine.
Il materiale ideale per l’impianto di distribu-zione è rappresentato attualmente dall’acciaio inossidabile (molto costoso) e dal PVDF con saldature interne che non devono permettere la formazione di gradini >0,4 micron.
L’impianto di distribuzione va sottoposto a un programma di disinfezione o sanitizzazio-ne.
I disinfettanti più comunemente utilizzati sono il cloro e l’acido peracetico che hanno ottime capacità di rimozione anche del biofi lm dalla superfi cie dei materiali. La sanitizzazione va compiuta almeno ogni due mesi, ma il suo ritmo dipende essenzialmente dalle caratteri-stiche messe in rilievo dagli esami di labora-torio
Occorre ricordare che nel costruire l’im-pianto di distribuzione è necessario inserire nei punti strategici punti di prelievo in acciaio inossidabile (che può essere “fl ambato”) e pre-cisamente:
1) all’uscita dall’osmosi;2) nel punto medio del loop o all’ingresso di
ciascuna unità dialitica;3) alla chiusura del loop.Conosciuta la qualità dell’acqua di rete
di una certa zona ed essendo disponibile un impianto di osmosi inversa, le caratteristiche fi sico-chimiche dell’acqua di dialisi possono considerarsi stabili ed essere controllate ogni tre-sei mesi.
Contaminanti batterici
Il monitoraggio batteriologico ed endotos-sinico (Tab.I.3) assume invece un’importanza prioritaria, poiché da esso dipendono qualità di vita, tolleranza dialitica, condizioni cliniche del paziente in dialisi.
Tale monitoraggio, compiuto mediante de-terminazione della carica microbica a 22°C con incubazione per settegiorni e a 37°C e utiliz-zando per le endotossine il LAL test con meto-do semiquantitativo, va effettuato ogni tre mesi: l’ impianto di distribuzione non garantisce infatti la persistenza delle caratteristiche di purezza batteriologica ed endotossinica dell’acqua, qua-le esse sono all’uscita dall’impianto di osmosi.
Lal test
Mi sembra utile dare alcune notizie relati-ve a questo test che si è rivelato di particolare importanza per determinare la biocompatibilità del sistema dialisi. Esso è utile per la determi-nazione semiquantitativa delle endotossine da batteri Gram negativi.
È un acronimo di Limulus Amebocyte Lysa-te che rappresenta l’estratto acquoso di cellule del sangue (amebociti) del Limulus Poliphe-mus, artropode acquatico, che vive lungo le coste orientali degli Stati Uniti, in Papuasia e in Malesia; si trova a basse profondità in acque melmose e si nutre di anellidi.
La coagulazione del sangue del Limulus fu scoperta nel 1885 da Howell, ma fu Bang negli anni 50 a scoprire che i batteri Gram-negativi causavano la coagulazione del sangue del Li-mulus.
Tabella I.3 – Principali contaminanti batterici dell’acqua.
CONTAMINANTI BATTERICI
– MICRORGANISMI - coliformi- Pseudomonas- Gram negativi
– ENDOTOSSINE
– ESOTOSSINE
- lipopolisaccaride complesso LPS 10.000-1.000.000Daltons LAL +- frammenti di LPS1000 - 20.000 Daltons LAL + - muramilpeptidi400 - 1.000 Daltons LAL - LAL -
Cap_01.indd 13Cap_01.indd 13 01/10/2007 12.03.4201/10/2007 12.03.42

ROMASEU
14 La dialisi: tecnica e clinica
Levin e Bang successivamente scoprirono che la reazione era enzimatica e che l’enzima si trovava nei granuli degli amebociti. Essi inol-tre dimostrarono che la coagulazione ha inizio da un componente della parete cellulare dei batteri chiamata endotossina o lipopolisacca-ride .
La reazione che porta alla formazione del gel è una reazione enzimatica a cascata.
I reagenti disponibili sono divisi in lotti con differenti sensibilità a partire da 0,03 sino a 0,25 UE/ml , che rappresenta la massima con-centrazione endotossinica consentita.
Monitoraggio
Tenendo conto delle caratteristiche dell’ac-qua greggia, dell’impianto di osmosi e di distri-buzione, del ritmo di sanitizzazione, un monito-
raggio effi cace può essere proposto secondo le modalità descritte nella Tabella I.4.
Dialisato ultrapuro e tecniche on line
Negli ultimi anni sono state sviluppate tec-niche dialitiche ad elevata effi cienza con rein-fusione di quantità elevate di liquidi proprio per migliorare la depurazione delle piccole e delle medie molecole.
Le tecniche on line permettono reinfusioni di molte decine di litri a differenza della emo-diafi ltrazione ed emofi ltrazione standard per-mettono anche un risparmio economico, non dovendo utilizzare soluzioni confezionate.
La necessità di reinfondere on line elevate quantità di liquidi, utilizzando l’acqua osmotiz-zata pone il problema di una ancora maggio-re sorveglianza sulla sua qualità. D’altra parte
Parametro Frequenza Prelievo
Calcio Tre-sei mesi Inizio loop
Magnesio “ “
Potassio “ “
Sodio “ “
Bario “ “
Arsenico “ “
Cadmio “ “
Cromo “ “
Piombo “ “
Mercurio “ “
Selenio “ “
Argento “ “
Zinco “ “
Alluminio Tre mesi Inizio,medio,fi ne loop
Rame Tre-sei mesi Inizio loop
Composti organoalogen “ “
Cloramine Tre mesi Inizio,medio,fi ne loop
Cloro libero Tre-sei mesi Inizio loop
Fluoruri “ “
Cloruri “ “
Nitrati Tre mesi Inizio,medio,fi ne loop
Fosfati Tre-sei mesi Inizio loop
Solfati “ “
Carica microb. 22°C Tre mesi Inizio,medio,fi ne loop
Carica microb. 37°C “ “
LAL test “ “
Tabella I.4 – Modalità del monitoraggio sia nei tempi (frequenza) che nelle sedi del prelievo.
Cap_01.indd 14Cap_01.indd 14 01/10/2007 12.03.4201/10/2007 12.03.42

ROMASEU
15Principi generali dell’Emodialisi
sono comparsi recentemente studi sul benefi co effetto del dialisato ultrapuro sulla sopravviven-za e la qualità della vita del paziente in dialisi.
Schiffl e collaboratori hanno compiuto uno studio sul rallentamento della perdita della fun-zione renale residua, utilizzando dialisato ultra-puro e dimostrando livelli inferiori di PCR e di Il-6 e che la qualità microbiologica del dialisato è un determinante indipendente della perdita della funzione renale residua.
Sempre più è stato posto l’accento sul mec-canismo mediante il quale la contaminazione batterica del dialisato e la presenza di endo-tossine attiverebbero una cascata di eventi infi ammatori con produzione di citochine IL-1, IL-6, TNFα che portano all’aumento della PCR e alla produzione di beta2microglobulina e di amiloide.
Inoltre Schiffl aveva dimostrato gli effetti del dialisato ultrapuro sullo stato nutrizionale dei pazienti in dialisi con aumento del peso corpo-reo, aumento dell’albumina sierica, dell’IGF-1, della concentrazione della leptina , del protein catabolic rate e miglioramento delle misure an-tropometriche.
Il ruolo della qualità del dialisato è stato fo-calizzato anche da Gerdemann, che ha dimo-strato, nell’ambito di una policentrica tedesca, livelli più bassi di AGE’s nei pazienti sottoposti a trattamenti convettivi, utilizzando reinfusioni ultrapure.
La qualità del dialisato è inoltre importante nel determinare la risposta alla terapia con eri-tropoietina, come dimostrato da Fluck in uno studio in cui viene riportata l’emolisi indotta da contaminazione di cloramine, che maschera-va una resistenza alla terapia con EPO; così come l’assenza di endotossine può a lungo mi-gliorare la risposta all’EPO.
Fatte queste premesse appare evidente che l’evoluzione della ricerca scientifi ca e le strategie dialitiche più avanzate richiedono una maggiore attenzione per la qualità dei li-quidi destinati al procedimento dialitico con particolare riferimento ai contaminanti batterici e ai loro prodotti.
Il valore massimo stabilito per le endotos-sine, mediante LAL test, di 0,25 EU/ml viene considerato ancora molto elevato per permet-tere reinfusioni on line di diverse decine di litri di acqua osmotizzata.
Il concetto di dialisato ultrapuro, secondo gli studi cui si è accennato in premessa, non lo consente.
Il meccanismo di base con il quale nelle tec-niche on line si consegue un dialisato ultrapuro è rappresentato dagli ultrafi ltri mediante i quali, a livello di ciascuna unità dialitica, i contami-nanti sono non solo ultrafi ltrati, ma anche ad-sorbiti dalla membrana dell’ultrafi ltro; anche i frammenti di endotossine sono trattenuti fi no a raggiungere valori < 0,125 EU/ml.
I principali sistemi attualmente disponibili per le terapie on line sono rappresentati da si-stemi che utilizzano o due ultrafi ltri: uno subito dopo la diluizione proporzionale del concentra-to e l’altro, che serve come riserva in caso di non funzionamento del primo, subito prima del-l’uscita del liquido di sostituzione; prima di ogni trattamento essi vengono testati per valutarne l’integrità, oppure vengono usati tre ultrafi ltri: il primo per l’acqua in arrivo alla macchina, il secondo subito dopo il sistema proporzionan-te e il terzo prima dell’infusione al paziente: il terzo ultrafi ltro viene sostituito dopo ogni trat-tamento.
Data l’impressionante capacità adsorbente degli ultrafi ltri qualunque residua contamina-zione dell’acqua viene annullata, purchè gli ul-trafi ltri vengano assemblati e sostituiti secondo le istruzioni della Ditta produttrice.
Questo comporterebbe una minore respon-sabilità medico legale, se si tiene conto che i liquidi di sostituzione, in alcuni Paesi, sono considerati prodotto farmaceutico.
Normativa
A fronte delle ricerche e dell’evoluzione tecnologica non vi è stato un adeguamento legislativo recente a livello mondiale, europeo e nazionale per fi ssare i limiti massimi dei con-taminanti chimici e batterici dei liquidi di dialisi (Tab. I.5).
Le indicazioni AAMI del 1982 e della Far-macopea Europea costituiscono il riferimento al quale si sono adeguate anche alcune Regio-ni Italiane, come la Regione Lazio che le ha re-cepite mediante una circolare inviata ai Centri Dialisi nel 1999 (Tab.I.6).
Cap_01.indd 15Cap_01.indd 15 01/10/2007 12.03.4201/10/2007 12.03.42

ROMASEU
16 La dialisi: tecnica e clinica
Conclusioni
L’utilizzo dell’acqua per il trattamento dialiti-co viene considerato come facente parte di un sistema che deve avere insieme alla membra-na dialitica complessivamente caratteristiche di biocompatibilità.
La qualità del dialisato garantisce non solo la sopravvivenza del paziente, ma anche la sua qualità di vita. Essa viene assicurata da una continua sorveglianza delle varie compo-nenti del “sistema acqua” mediante:
1) adeguamento agli standard fi sico-chimi-ci AAMI e Farmacopea europea dell’ac-qua di rete;
Contaminante AAMI 92 Farmac.EU Contaminante AAMI 92 Farmac.EU
Calcio 2,0 2,0 zinco 0,1
magnesio 4,0 2,0 arsenico 0,005
sodio 70,0 50,0 cromo 0,014
potassio 8,0 2,0 piombo 0,005
fl uoruri 0,2 argento 0,005
cloro 0,5 alluminio 0,01
cloramine 0,1 cadmio 0,001
nitrati 2,0 2,0 selenio 0,009
solfati 100,0 50,0 mercurio 0,0002 0,0001
rame 0,1 carica microbica 200 ufc/ml 100 ufc/ml
bario 0,1 endotossine 0,25 EU7ml 0,25 EU/ml
Tabella I.6 – Massima concentrazione di contaminanti mg/L permessa dall’AAMI e dalla Farmacopea Europea per il liquido di dialisi.
2) ottimizzazione di un sistema di depura-zione mediante osmosi inversa;
3) ottimizzazione di un impianto di distribu-zione costruito con materiali adatti;
4) sanitizzazione mensile o bimestrale;5) adeguata manutenzione degli impianti;6) controllo microbiologico trimestrale con cul-
ture testate a 22°C e 37°C per sette giorni nei punti strategici del loop di distribuzione
7) LAL test (possibilmente con metodo quantitativo) effettuato nei punti strategi-ci del loop ogni tre mesi;
8) nelle tecniche on line utilizzo degli ultra-fi ltri con scrupolosa attenzione alle diret-tive delle Ditte produttrici.
Tabella I.5 – Successione temporale delle normative sia nazionali che internazionali relative ai limiti massimi dei contami-nanti chimici e batterici del liquido di dialisi.
AAMI 1981 standards americani acqua per dialisi
F.U.IX.Ediz. 1985 soluz. perfus. e per dialisi
Risoluzione CEE 1986 A1 < 10 micro gr./L.
F.U.IX Ediz. 1 agg. 1987 avvertenze generali
DPR n° 236 1988 caratteristiche acqua potabile
F.U.IX Ed. 1 suppl. 1988 acqua di diluiz per soluz. concentrate A1
Ministero Sanità nota 1988 cleramine - uso fi ltri carbone
Ministero Sanità circ. 1988 composti organo alogenati
F.U.IX Ed. 2 aggiorn 1989 soluz. concentrate dialisi
Pro Pharmacopea 1989 cloramine
Pro Pharmacopea 1990 preparazioni infusionali
Pro Pharmacopea 1991 controllo particelle nelle soluz. parenterali
AAMI 1992 revisione standards americani
Farmac. Europea 1983 acqua di diluiz. soluzioni concentr, per dialisi
Cap_01.indd 16Cap_01.indd 16 01/10/2007 12.03.4201/10/2007 12.03.42

ROMASEU
17Principi generali dell’Emodialisi
SCELTA DELLA TECNICA E DELLA MEMBRANA
Sandro De Angelis
La scelta di una tecnica di dialisi, sia essa extracorporea (Emodialisi) o intracorporea (Dialisi Peritoneale), è fi nalizzata a garantire la migliore sopravvivenza e qualità di vita del paziente ed è oggi prevalentemente condizio-nata dagli aspetti clinici, organizzativi ed eco-nomici.
I dati della letteratura internazionale sulla sopravvivenza dei pazienti in emodialisi (HD) ed in dialisi peritoneale (PD) sono ancora con-troversi, tuttavia i dati dei registri pubblicati in Italia, adeguatamente corretti per fattori di co-morbidità come il sesso, l’età anagrafi ca e la razza, indicano una sopravvivenza equivalente in HD e PD.
Emodialisi
Finalità del trattamento dialitico
Gli obiettivi primari dell’emodialisi nel lungo periodo sono: mantenere la stabilità dello stato nutrizionale, ridurre la morbilità e mortalità dei pazienti uremici.
Tali obiettivi sono resi possibili dagli effetti dell’emodialisi sull’organismo, essenzialmente costituiti da:
• trattamento dei sintomi uremici;• correzione dell’acidosi metabolica;• correzione degli squilibri elettrolitici;• ricostituzione del bilancio dei soluti ema-
tici;• ricostituzione del bilancio idrico. Tuttavia, le problematiche determinate dal-
l’emodialisi sono costituite sia dalla risposta infi ammatoria del paziente alla biocompatibilità della membrana del dializzatore e delle linee ematiche utilizzate, sia dalle sequele indotte dal trattamento cronico.
Lo sviluppo delle varie tecniche dialitiche, della tecnologia degli accessi vascolari, dei dializzatori a fi bre cave e delle membrane bio-compatibili, l’introduzione dell’eritropoietina
ricombinante e dei farmaci in grado di control-lare il bilancio calcio-fosforo, hanno consentito il prolungamento della sopravvivenza dei pa-zienti con insuffi cienza renale cronica terminale negli ultimi 20 anni. Nonostante ciò la mortalità dei pazienti in terapia sostitutiva rimane ancora elevata rispetto alla popolazione generale.
Tecnica dell’emodialisi
La tecnica dell’emodialisi si basa sull’as-semblaggio di 2 circuiti : il circuito ematico ex-tracorporeo ed il circuito del dialisato.
Il circuito ematico extracorporeo: compren-de l’accesso vascolare del paziente, la linea ematica arteriosa che trasporta il sangue al-l’apparecchiatura di dialisi (Monitor), il fi ltro di dialisi o dializzatore, la linea ematica venosa che consente il rientro del sangue depurato al paziente.
L’accesso vascolare del paziente può es-sere realizzato sia da una fi stola artero-veno-sa (FAV) confezionata chirurgicamente nei vasi dell’arto superiore, sia dal posizionamento di un catetere venoso centrale (CVC) nella vena femorale, nella vena giugulare interna o nella vena succlavia. Dalla FAV il sangue viene pre-levato mediante venopuntura con appositi aghi delle dimensioni variabili da 17 a 14 Gauge, mentre dal CVC mediante la connessione di-retta ai rispettivi terminali arterioso e venoso del catetere.
La quantità di sangue prelevato dal pazien-te (Qb) è di solito compresa tra 200 e 400 ml/minuto, con variazioni dettate dalle condizioni cliniche del paziente o dalle necessità peculiari della metodica dialitica utilizzata.
Il sangue procede all’interno della linea ematica arteriosa grazie ad una pompa pe-ristaltica, regolabile anch’essa in base alle necessità del trattamento, che realizza una pressione negativa che aspira il sangue sino al dializzatore. Questo è costituito da una matas-sa di migliaia di capillari cavi, assemblati all’in-terno di un contenitore cilindrico.
Cap_01.indd 17Cap_01.indd 17 01/10/2007 12.03.4301/10/2007 12.03.43

ROMASEU
18 La dialisi: tecnica e clinica
Il sangue percorre il lume del capillare men-tre la parete del capillare costituisce la mem-brana semipermeabile tramite la quale avviene il passaggio dell’acqua plasmatica e dei soluti in essa presenti, condizionato dalle dimensioni dei pori della membrana medesima (cut-off di membrana).
Il circuito a valle del fi ltro è costituito dalla linea venosa di rientro del sangue al paziente, dotata di appositi pozzetti per il controllo emodi-namico della circolazione extracorporea. Nella linea venosa è presente una pressione positiva determinata ovviamente dalle resistenze peri-feriche create dal rientro del sangue nell’ago venoso posizionato nell’accesso vascolare del paziente.
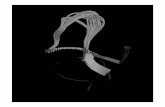
Il circuito del dialisato: è costituito da una linea esterna (Fig. I.8) che raggiunge il monitor fornendo acqua demonizzata, da una seconda linea interna al monitor e dal collegamento di quest’ultima con lo scarico a parete o a terra.
All’interno del monitor avviene la miscela-zione dell’acqua deionizzata con la soluzione concentrata, contenuta in sacche o taniche, sino al raggiungimento della composizione elettrolitica prestabilita della soluzione di diali-si, denominata per l’appunto “dialisato”.
Il dialisato fl uisce all’interno del dializzatore (Fig. I.9) con direzione controcorrente al san-gue presente all’interno dei capillari grazie ad
Fig. I.8 – Monitor di dialisi, cui ven-gono collegate le linee ematiche (arteriosa e venosa) e la tanica di concentrato per realizzare l’assem-blaggio dei due circuiti: ematico e del dialisato.
Fig. I.9 – Filtro capillare costituito da una matassa di oltre 10.000 fi bre capillari cave all’interno.
una pressione negativa realizzata da un’appo-sita pompa del monitor.
Scorrendo all’esterno dei capillari, la solu-zione di dialisi riceve tutti i soluti che attraver-sano la membrana dei capillari e li trasporta al-l’uscita del dializzatore nella linea di drenaggio verso lo scarico con l’esterno.
Il fl usso del dialisato (Qd) varia di solito da 500 a 800 ml/minuto.
Il trattamento dell’acqua di rete per ottenere l’acqua deionizzata, e possibilmente ultrapura,
Linee ematiche
Tanica del
concentrato
Monitor di dialisi
Cap_01.indd 18Cap_01.indd 18 01/10/2007 12.03.4301/10/2007 12.03.43

ROMASEU
19Principi generali dell’Emodialisi
viene realizzato da un apposito impianto che prevede il passaggio dell’acqua di rete in una serie di fi ltri ed infi ne in un’apparecchiatura ad osmosi inversa.
Il trattamento di demineralizzazione rimuo-ve dall’acqua tutte le sostanze ed i metalli in essa presenti, in particolare l’alluminio, re-sponsabile nel passato di gravi patologie nei pazienti emodializzati cronici.
Diffusione ed ultrafi ltrazione
La diffusione dei soluti attraverso la mem-brana del dializzatore è condizionata dalle di-mensioni del soluto, dal suo peso molecolare e dal gradiente di concentrazione nell’interfaccia sangue-dialisato.
Il processo di diffusione è caratterizzato inoltre dalla rimozione dei soluti di dimensio-ne compatibile con il cut-off della membrana utilizzata. Pertanto, questo tipo di trasporto consente la rimozione dal sangue di sostanze di piccolo peso molecolare, arrestandosi alle dimensioni di circa 11.800 Daltons (come la β2-microglobulina), cioè al limite inferiore del range delle medie molecole. È stato infatti pro-posto (HEMO study) di utilizzare la clearance della β2-microglobulina quale mezzo per defi -nire le caratteristiche di permeabilità dei dializ-zatori.
Così, una clearance <10 mL/min identifi ca dializzatori a bassa permeabilità (Low-Flux ) mentre la clearance > 20 mL/min identifi ca dia-lizzatori ad alta permeabilità (High-Flux ).
La quantità del soluto trasferita (Qd) dipen-de dal gradiente di concentrazione, dalla su-perfi cie della membrana utilizzata (S) e dal suo coeffi ciente di permeabilità (K) per cui:
dove: Qd = quantità del soluto trasferita K = coeffi ciente di permeabilità della
membrana Ci = concentrazione del soluto all’in-
gresso nel dializzatore C0 = concentrazione del soluto al-
l’uscita dal dializzatore Cuf = concentrazione del soluto nel
dialisato
Il volume di acqua plasmatica rimossa dal sangue sotto la spinta della pressione idro-statica del circuito ematico viene defi nito ul-trafi ltrato, ed è destinato ad essere rimosso dal dialisato, assicurando così la sottrazione di acqua del paziente programmata all’inizio del trattamento.
Durante il processo di ultrafi ltrazione ven-gono rimossi i soluti e gli elettroliti contenuti nel volume di acqua plasmatici ultrafi ltrata e tale tipo di trasporto viene defi nito convettivo.
I soluti vengono trasferiti insieme al solven-te per cui l’equazione che descrive questo tra-sferimento è la seguente:
dove: Quf = quantità del soluto trasferito K = coeffi ciente di permeabilità della mem-
branaS = superfi cie della membranaPtm = pressione trans-membrana
Il trasporto convettivo da solo non comporta variazioni signifi cative della concentrazione dei soluti plasmatici mentre questa viene notevol-mente modifi cata dal trasporto diffusivo. Infatti il termine “Alta Effi cienza” contraddistingue i dia-lizzatori in grado di rimuovere notevoli quantità di urea, sostanza di piccolo peso molecolare rimossa facilmente dal trasporto diffusivo per l’elevato gradiente tra il sangue iperazotemico ed il dialisato totalmente privo di urea.
La pressione transmembrana, che si viene a realizzare tra i due lati della membrana dia-litica all’interno del dializzatore infl uisce inoltre su entrambi i meccanismi di trasporto descrit-ti, pertanto con l’aumentare della pressione transmembrana aumenta proporzionalmente il trasporto di acqua e soluti dal sangue al diali-sato.
Caratteristiche fi sico-chimiche della membrana
Le membrane di cellophane originate dalla cellulosa sono costituite da unità polisaccaridi-che contigue, a somiglianza della struttura del-la parete di una cellula batterica, e da gruppi idrossilici.
Cap_01.indd 19Cap_01.indd 19 01/10/2007 12.03.4301/10/2007 12.03.43

ROMASEU
20 La dialisi: tecnica e clinica
Negli anni ’60 venivano utilizzate sotto forma di fogli assemblati tra due piastre di plexiglas (Rene artifi ciale di Keel) o in tubi avvolti a roto-lo (Twin-Coil). Il cuprophan ed il cuprammonio rayon, originati dalla cellulosa rigenerata, han-no consentito lo sviluppo di membrane sottili, molto resistenti, dotate di grande permeabilità ai soluti di piccole dimensioni (Fig. I.10).
Tuttavia, i gruppi idrossilici presenti sulla su-perfi cie di queste membrane innescavano l’at-tivazione del complemento e la produzione di citochine, il che ha stimolato la ricerca di nuove membrane che limitassero la reazione infi am-matoria e nel contempo favorissero la clearan-ce di soluti uremici di maggior peso molecolare. Nelle membrane di acetato di cellulosa, costi-tuite da polimeri di diacetato di cellulosa, veni-vano per la prima volta sostituiti i gruppi idros-silici con residui di acetile ed incrementata la permeabilità all’acqua ed alle medie molecole.
Nelle membrane cellulo-sintetiche (He-mophan) i gruppi idrossilici venivano sostituiti da gruppi amminici, mentre nuove membrane di cellulosa modifi cata sono state ottenute dai polimeri triacetati, ancora più effi cienti dei poli-meri diacetati.
Le membrane sintetiche realizzate nei primi anni ’80 risultano ancora più idrofobiche delle membrane in cellulosa rigenerata, essendo dota-te di pori larghi al punto da assicurare sia la rimo-zione di soluti e molecole di dimensioni maggiori, sia alti coeffi cienti di ultrafi ltrazione, riducendo nel contempo la reazione infi ammatoria.
Fig. I.10 – Diametro della sezione e spessore della parete del singolo capillare.
Tipo di Membrana Composizione chimica
Cellulosa
Cellulosa modifi cata
Cellulosa sintetica Sintetica
Cellulosa rigenerataCuprophanCuprammonio rayonAcetato di cellulosaDiacetato di cellulosaTriacetato di cellulosaHemophanPoliacrilonitrile (PAN)PoliammidePolisulfonePolimetilmetacrilatoPolicarbonato
Tabella I.7 – Tipi di membrane e composizione chimica del materiale.
Biologia della membrana di dialisi
L’adsorbimento delle proteine plasmatiche e la loro fi ssazione sulla superfi cie della mem-brana dialitica costituisce l’evento iniziale del contatto del sangue nel corso della circolazio-ne extracorporea.
Tale fenomeno è il risultato di forze elettro-statiche, forze idrofobiche e legame dei termi-nali H+ delle proteine con quelli presenti sulla superfi cie della membrana.
I diversi tipi di membrane fi ssano differen-ti quantità e qualità di proteine plasmatiche. Inoltre, l’adsorbimento delle proteine sulla su-perfi cie della membrana è invariabilmente se-guito dalla fi ssazione sulle medesime proteine adese alla membrana di piastrine e leucociti responsabili a loro volta della trombogenesi e dell’attivazione complementare.
Infatti, la presenza sulla superfi cie della membrana di cariche elettriche negative favo-risce il legame col fattore di Hageman (Fatto-re XII) che innesca l’attivazione della cascata emocoagulativa e la conversione della pro-trombina in trombina. La formazione di trombi-na induce a sua volta l’attivazione, l’aderenza e le modifi cazioni morfologiche delle piastrine.
Queste rilasciano quindi il Trombossano A2 , l’Adenosin Di fosfato (ADP), il fattore 4 piastri-nico (PF4) e la β-tromboglobulina.
Un’ulteriore aggregazione piastrinica e de-granulazione sono quindi indotte dal trombos-sano A2 e dall’ADP.
Cap_01.indd 20Cap_01.indd 20 01/10/2007 12.03.4301/10/2007 12.03.43

ROMASEU
21Principi generali dell’Emodialisi
La trombogenesi e la formazione di coaguli riducono progressivamente la superfi cie della membrana disponibile per il trasporto dei soluti.
Tutti i tipi di membrane hanno mostrato la capacità di formare aggregati di piastrine e leu-cociti, tuttavia numerosi dati della letteratura indicano come il fenomeno sia più attivo con l’utilizzo di membrane in cuprophan rispetto alle membrane in hemophan o in polisulfone .
Il legame del fattore XII con il chininogeno ad alto peso molecolare circolante (HMWK), complessato con la precallicreina, porta alla formazione di callicreina attivata. Una volta at-tivata, la callicreina è responsabile del rilascio di bradichinina, potente vasodilatatore capace di ridurre le resistenze periferiche arteriose e mediare la risposta infi ammatoria.
L’inibizione del sistema renina-angiotensi-na operato dagli ACE inibitori è stato pertanto implicato nella patogenesi delle reazioni anafi -lattiche descritte nei pazienti che utilizzavano membrane in Poliacrilonitrile ed avevano as-sunto ACE inibitori. Infatti, poiché l’enzima di conversione dell’angiotensina catalizza la di-sgregazione della bradichinina, in presenza di ACE inibibizione questa si accumula e si lega alle cariche elettriche negative delle membrane in poliacrilonitrile, generando nuova bradichini-na responsabile degli effetti sopra descritti.
Biocompatibilità della membrana
Il termine “biocompatibilità” della membra-na di dialisi identifi ca la reazione che si svilup-pa nella fase del contatto del sangue con la membrana del dializzatore, caratterizzata da una risposta infi ammatoria probabilmente di-pendente dalle caratteristiche fi sico-chimiche della membrana e dal sistema immunitario del paziente.
Kaplow e Goffi ner nel 1968 descrissero per primi una temporanea neutropenia che ve-niva osservata all’inizio del trattamento dialitico eseguito con membrane cellulosiche.
Contemporaneamente Craddock descri-veva l’attivazione della via alterna del com-plemento e come l’elevazione dei livelli sierici delle citochine correlasse con i livelli sierici del complemento, codifi cando questi due parame-tri quali markers della biocompatibilità delle membrane di dialisi.
Studi condotti in vivo ed in vitro hanno dimo-strato che l’esposizione del sangue alle mem-brane di dialisi stimola l’attivazione delle protei-ne della cascata emocoagulativa, l’espressione di molecole di adesione della superfi cie cellu-lare da parte dei leucociti, delle piastrine, dei monociti, così come la degranulazione e se-questrazione dei neutrofi li.
La produzione di citochine da parte dei ma-crofagi e dei linfociti è stata proposta quale re-sponsabile delle crisi acute febbrili e dell’ami-loidosi osservate nei pazienti emodializzati.
L’entità della risposta infi ammatoria e l’atti-vazione dei meccanismi cellulari sono variabili da paziente a paziente, probabilmente dipen-denti solo in parte dalle caratteristiche chimi-che della membrana di dialisi. Infatti la mem-brana dialitica agisce da barriera nei confronti dei batteri, ma nonostante gli sforzi per il trat-tamento dell’acqua, il dialisato può contenere sia batteri che endotossine in grado di attivare le citochine.
Le endotossine hanno un peso molecolare suffi cientemente grande da non consentire l’at-traversamento della membrana, tuttavia nel-l’utilizzo di dializzatori high-fl ux può verifi carsi l’adsorbimento di frammenti di endotossine da parte delle membrane ed il loro passaggio nel sangue.
Questo passaggio è per lo più favorito sia dal sottile spessore delle membrane che da componenti strutturali in grado di realizzare una differenza di carica elettrica tra la membrana ed i lipolisaccaridi di origine batterica. Inoltre la grandezza dei pori delle membrane high-fl ux può consentire una retrodiffusione (backfi ltration) di endotossine dal dialisato al sangue innescan-do l’attivazione complementare. Tale fenomeno viene infatti ritenuto responsabile dell’aumento della proteina C reattiva prodotta da monociti e macrofagi nei pazienti in dialisi cronica.
Cheung e collaboratori hanno dimostrato che l’adesione di prodotti dell’attivazione del complemento avviene più facilmente sulla su-perfi cie delle membrane sintetiche rispetto a quelle cellulosiche.
La scelta di dializzatori high-fl ux dovrebbe pertanto privilegiare quelli con membrane di spessore maggiore e privi di componenti strut-turali che favoriscono l’adesione dei lipolisac-caridi di origine batterica.
Cap_01.indd 21Cap_01.indd 21 01/10/2007 12.03.4301/10/2007 12.03.43

ROMASEU
22 La dialisi: tecnica e clinica
Tuttavia, la biocompatibilità delle membrane di dialisi non è l’unico fattore responsabile della reazione infi ammatoria del paziente uremico, in-fatti Kimmel ha dimostrato che elevati livelli di cito-chine erano rilevabili sia nei pazienti in emodialisi
che in quelli in dialisi peritoneale. Inoltre, elevati livelli sierici di cellule T preattivate e di Il-2 veni-vano rilevate sia nei pazienti in emodialisi sia nei pazienti con insuffi cienza renale cronica che non avevano ancora iniziato il trattamento dialitico.
ADEGUATEZZA DIALITICA
Alessandro Naticchia
Dose dialitica: cenni storici
Fin dagli albori della dialisi i nefrologi hanno sentito il bisogno di quantifi care l’appropriata dose di dialisi, concetto che ha subíto modifi -che nel corso degli anni successivi.
Nei primi anni 60 aveva molta importanza il bilancio idrico più che la rimozione di soluti.
Quindi l’interesse si è spostato sul migliora-mento di segni e sintomi presenti nel paziente uremico, dato estremamente soggettivo, quin-di diffi cile da quantifi care.
In seguito si è cercato di chiarire la patoge-nesi della sindrome uremica, posta in relazio-ne a numerose sostanze, di piccole e medie dimensioni molecolari, ritenute di volta in volta responsabili del quadro clinico dell’uremia.
Oggi, più semplicemente, la sindrome ure-mica può essere considerata come la risul-tante dell’accumulo di acqua e varie sostanze (soluti), che normalmente sono eliminati dal rene, e che hanno un tossicità concentrazione dipendente.
Già nell’800 veniva descritta un’elevata con-centrazione di urea in pazienti con danno rena-le, che veniva pertanto considerata all’epoca la principale tossina uremica.
Nel 1996 Vanholder e collaboratori hanno individuato più di 40 soluti organici con PM che varia da 60 Daltons (Urea) fi no ad oltre 106 Dal-tons, ma solo di alcune è stata individuata una potenziale tossicità organo-specifi ca (Tab. I 8).
Nel 2003 l’European Uremic Toxin (EUTox) Work Group ha iniziato una classifi cazione del-
Soluti di piccole dimensioni Soluti legati alle proteine Medie Molecole
Dimetil Arginina AsimmetricaBenzilalcoolβ-LipotropinaCreatininaGuanidinaAcido GuanidinoaceticoAcido GuanidinosuccinicoIpoxantinaMalondialdeideMetilguanidinaMioinositoloAcido OroticoOssalatoDimetil Arginina SimmetricaUreaAcido UricoXantina
3-DeossiglucosioFructoselinaGliossaleAcido IppuricoOmocisteinaIdrochinoneAcido AceticoChinureninaAcido ChinurenicoMetilgliossaleN-CarbossimetillisinaP-CresoloPentosidinaFenoloAcido QuinolinicoSpermidinaSpermina
AdrenomedullinaPeptide Natriuretico Strialeβ2-Microglobulinaβ-Endorfi naColecistochininaCistatina CEndotelina Acido ialuronicoInterleuchina 1βInterleuchina 6Catene leggere KappaCatene leggere LambdaLeptinaMetioninaParatormoneProteina legante il retinoloTumor Necrosis Factor α
Tabella I.8 – Alcune delle principali tossine uremiche riconosciute potenziali tossici organo-specifi ci(da Kidney Int.2003 Suppl.84, modifi cata).
Cap_01.indd 22Cap_01.indd 22 01/10/2007 12.03.4301/10/2007 12.03.43

ROMASEU
23Principi generali dell’Emodialisi
le tossine uremiche, che sono state divise in tre gruppi:
1. molecole solubili a basso PM, come l’urea e la creatinina;
2. medie molecole, con PM maggiore di 500 Daltons, come la β2-microglobulina;
3. soluti a basso PM legati alle proteine.
Teoricamente sarebbe necessario stabilire una dose dialitica per ognuna di queste cate-gorie di molecole, ma attualmente solo le pic-cole molecole (urea) vengono usate per il cal-colo della dose dialitica, essendo stati proposti negli anni modelli cinetici per il comportamento dell’urea e non delle altre molecole successi-vamente scoperte.
Nel 1971 De Palma defi niva adeguato: “il trattamento emodialitico che permette al pa-ziente di essere pienamente riabilitato, avere un soddisfacente stato nutrizionale, una suffi -ciente produzione di globuli rossi, un buon con-trollo pressorio e prevenire la neuropatia”.
Questa defi nizione non comprendeva dei parametri oggettivamente quantifi cabili né confrontabili tra loro, per cui era sentito il bi-sogno di stabilire dei parametri di laboratorio misurabili e quindi confrontabili tra di loro, che fossero utili per la quantifi cazione della dose dialitica.
Gotch, che insieme al matematico Sargent negli anni ’70 proponeva un modello per quan-tifi care la dose dialitica diede questa defi nizio-ne:
”la dialisi è una terapia empirica del-l’insuffi cienza renale terminale, basata sul concetto razionale che la sindrome uremi-ca dipende dalla concentrazione dei soluti tossici che si accumulano nell’insuffi cienza renale.
Sebbene queste tossine non sono state ancora ben identifi cate, l’urea è stata usa-ta con successo come marker per defi nire un’adeguata terapia dialitica, attraverso il modello cinetico dell’urea”.
Nel 1979 Teschan propose come target di effi cienza dialitica una clearance di 3000 ml/settimana/litro di acqua corporea.
Il punto di riferimento era un indice pari ad 1, ricavato considerando il volume di distribu-zione dell’urea e, a regime di tre dialisi setti-
manali, un target di 1000 ml/sett./litro acqua corporea che corrispondeva all’1 dell’indice suddetto.
Attualmente i metodi per quantifi care la dose dialitica sono basati sulla misurazione del tasso riduzione dell’urea.
Misura della dose dialitica
La defi nizione di Gotch riassume bene il concetto di dose dialitica: poiché non si cono-scono tutte le tossine che contribuiscono alla sindrome uremica, la clearance dell’urea può essere usata come riferimento per l’effi cien-za dialitica, in quanto la clearance delle altre tossine non note correla in qualche modo con quella dell’urea.
Perché è stata scelta proprio l’urea come marker per la quantifi cazione della dose dia-litica?
1) la sua concentrazione aumenta nell’ure-mia;
2) ha un basso Peso Molecolare (PM 60Da);
3) la sua diffusione tra i compartimenti è ra-pida e si può usare per la maggior parte delle applicazioni un modello a singolo compartimento;
4) il suo volume di distribuzione coincide con l’acqua corporea totale (TBW);
5) è facilmente dializzabile attraverso qual-siasi tipo di membrana dialitica;
6) la sua concentrazione è facilmente do-sabile sia nel sangue che nel liquido di dialisi;
7) è il prodotto fi nale del catabolismo protei-co, quindi è correlata all’intake proteico.
URR (Urea Reduction Ratio)
È dato dal rapporto tra la differenza di azo-temia pre-dialisi e quella post-dialisi, diviso quella pre-dialisi:
Il vantaggio di questo indice è quello di es-sere semplice, quindi adatto per studiare gran-di popolazioni di emodializzati tuttavia non può essere usato per defi nire lo stato nutrizionale
Cap_01.indd 23Cap_01.indd 23 01/10/2007 12.03.4401/10/2007 12.03.44

ROMASEU
24 La dialisi: tecnica e clinica
di un paziente (predittore indipendente di mor-bilità e mortalità); inoltre non prende in consi-derazione l’urea rimossa con l’ultrafi ltrazione. Per questi motivi le linee guida internazionali (NKF-KDOQI) non raccomandano l’uso di que-sto indice per il calcolo della dose dialitica.
Kt/V
La diffusione di una molecola durante il trattamento emodialitico segue un processo cinetico di primo ordine, cioè: la quantità di un soluto distribuito in un dato volume diminuisce esponenzialmente in funzione del tempo,inoltre il passaggio del soluto attraverso la membrana semipermeabile è funzione del gradiente di concentrazione.
Se si assume che il volume di distribuzione V sia costante (UF=0) e che durante il tratta-mento emodialitico non viene prodotta urea, allora la seguente formula traduce matemati-camente il modello che abbiamo descritto:
dove :Ct = concentrazione del soluto al tempo tC0 = concentrazione del soluto al tempo 0K = clearance dovuta al tipo di membrana
dialitica e all’eventuale funzione renale residua
t = durata del trattamento dialiticoV = volume di distribuzione
dove il rapporto Kt/V rappresenta la clearance dell’urea al tempo di dialisi t per unità di volume di distribuzione e può essere calcolato teorica-mente determinando la concentrazione emati-ca di urea al tempo 0 ed al tempo t:
Però in realtà il volume di distribuzione del-l’urea non è costante poiché varia con l’ultra-fi ltrazione intradialitica e con l’introito di acqua interdialitico; inoltre Ct non è dipendente solo dalla rimozione dell’urea, ma anche dalla ge-nerazione dell’urea stessa.
Il modo più accurato per determinare il Kt/V è dato dal cosiddetto modello cinetico dell’urea
formale(UKM) il cui calcolo richiede l’ausilio di un computer per risolvere l’equazione differen-ziale in cui le variabili sono:
V =volume di distribuzione dell’urea (circa sovrapponibile al TBW)
K=valore estrapolato dal K0A (coeffi ciente di tranfer dell’urea per un dato dializzatore)
G =velocità di generazione dell’urea, dal quale si può calcolare il protein catabolic rate (nPCR).
L’urea viene determinata all’inizio e alla fi ne della prima seduta dialitica della settimana ed all’inizio della seduta successiva.
Viene determinato il peso pre e post diali-si del primo trattamento settimanale; il tempo di trattamento esatto in minuti del primo trat-tamento settimanale; la clearance effettiva del dializzatore misurata in vivo e non quella in vi-tro riportata dalla casa costruttrice.
Per ovviare alla complessità computaziona-le del modello formale dell’urea, Daurgidas nel 1993 propose una formula di più facile appli-cabilità (DAURGIDAS II) che prende in consi-derazione l’urea rimossa con l’ultrafi ltrazione e la generazione dell’urea durante il trattamento dialitico:
ln = logaritmo naturaleR = BUN post dialisi/BUN predialisit = durata del trattamento dialiticoUF = volume in litri di ultrafi ltratoW = peso post dialisi del soggetto
Questa formula è stata inclusa nelle linee guida NKF-K/DOQI per la misurazione di scel-ta dell’adeguatezza dialitica, essendo l’UKM troppo complessa pur rimanendo questo il Gold Standard.
La formula (☼) si applica per il modello a singolo compartimento ideato da Gotch.
Però l’urea non segue una cinetica a singolo compartimento, come dimostrato dalla presen-za di un rebound dell’urea dopo il trattamento dialitico. Inizialmente si pensava che il rebound potesse dipendere da un ritardato spostamen-to dell’urea dai compartimenti intracellulari a quelli extracellulari. In seguito si è capito che il rebound era invece dovuto al sequestro di urea
Cap_01.indd 24Cap_01.indd 24 01/10/2007 12.03.4401/10/2007 12.03.44

ROMASEU
25Principi generali dell’Emodialisi
nei compartimenti a bassa perfusione (musco-li, pelle, osso).
Per ovviare a questo errore di stima (sovra-stima del Kt/V), Garred e Canard hanno ideato
una formula per stimare il basato sul BUN postdialisi (modello a singolo compartimento) e sul tempo di trattamento:
calcolato con la formula (☼).
HEMO study
HEMO study è un trial prospettico rando-mizzato, multicentrico disegnato per studia-re gli effetti della dose dialitica e del fl usso di membrana (membrane ad alto e basso fl usso) sulla morbilità e mortalità dei pazienti in tratta-mento emodialitico.
I pazienti sono stati randomizzati usando una matrice 2 x 2 secondo i seguenti parame-tri: dialisi a dose standard (Kt/V equilibrato; eKt/V) di 1,05 e dialisi ad alta dose dialitica, 1,45 e fl usso di membrana basso (low fl ux) o alto (high-fl ux), avendo come outcome prima-rio la mortalità per tutte le cause.
Al termine dello studio non sono emerse signifi cative differenze, per tutte le cause di mortalità, tra i pazienti trattati con emodialisi a dose standard e a dose elevata, e a basso o alto fl usso.
Sono emersi dei dati interessanti valutando le interazioni statistiche fra il tipo di trattamen-to dialitico e le sette caratteristiche prestabi-lite per i pazienti: età, sesso, razza, diabete mellito, età dialitica, comorbidità (secondo lo score ICED, e la concentrazione di albumina sierica).
La sola variabile che correlava con la dose dialitica era il sesso; le donne sottoposte a trat-tamenti ad alta dose dialitica (Kt/V=1,45) ave-vano un tasso di mortalità minore, differenza non riscontrata tra gli uomini.
Sembrerebbe che il motivo del differente comportamento tra i due sessi non dipenda
dalla massa corporea ma da qualche altro fat-tore ancora sconosciuto.
Sorprendentemente non è stata riscontra-ta nessuna interazione tra dose dialitica, età, diabete ed altre comorbilità, suggerendo che l’aumento della dose dialitica non prolunga la sopravvivenza nei pazienti anziani e nei dia-betici rispetto ad una coorte di dializzati senza comorbilità.
Per quanto riguarda i trattamenti a basso o alto fl usso è emerso che il sottogruppo di pa-zienti con età dialitica > 3,7 anni , sottoposti a terapia dialitica con tecnica high-fl ux, avevano una diminuzione di mortalità rispetto ai pazienti trattati con tecnica low-fl ux. Questo dato non veniva però riscontrato nei pazienti con età dialitica < 3,7 anni.
Non sono state riscontrate differenze signifi -cative neppure per outcomes secondari come: tutte le cause di mortalità o prima ospedalizza-zione per motivi cardiaci, tutte le cause di mor-talità o prima ospedalizzazione per infezioni, tutte la cause di mortalità o primo declino dei valori di albumina.
Veniva rilevata tuttavia una riduzione del 20% di mortalità cardiovascolare nel gruppo sottoposto a trattamento high-fl ux.
Riassumendo, da questo grande trial si può dedurre che l’aumento della dose dialitica o il trattamento con metodiche high-fl ux non mi-gliora la mortalità per tutte le cause, nell’intera popolazione studiata (1846 pazienti).
Tuttavia in alcuni sottogruppi (donne, pa-zienti con età dialitica >3,7 anni), una dose dia-litica maggiore o l’uso di metodiche high-fl ux conseguivano un miglioramento del rischio di mortalità.
Dialisi intermittente di lunga durata
La lunga durata del trattamento dialitico è stata attivata in Francia da Tassin, articolata su trattamente dialitici di 8 ore a giorni alterni.
I risultati della dialisi di lunga durata hanno dimostrato come questo trattamento si associ ad un buon controllo pressorio e ad una buona sopravvivenza, al contrario di un trattamento emodialitico breve che può infl uenzare nega-tivamente il controllo della volemia, della pres-
Cap_01.indd 25Cap_01.indd 25 01/10/2007 12.03.4401/10/2007 12.03.44

ROMASEU
26 La dialisi: tecnica e clinica
sione arteriosa, ed in ultima analisi dell’outco-me dei pazienti emodializzati.
Dialisi notturna
La dialisi quotidiana, eseguita di notte a domicilio del paziente, venne proposta per la prima volta da Robert Uldall nel 1994 in Ca-nada.
Il razionale era basato sulle caratteristiche di effi cacia e tollerabilità dei trattamenti conti-nui eseguiti in terapia intensiva. La dialisi not-turna, tuttora in uso, viene programmata su 6 o 7 giorni la settimana, variando dalle 6 alle 10 ore per trattamento, con un fl usso sangue di 250 mL/min ed un fl usso del dialisato di 300 mL/min. Vengono utilizzati dializzatori di super-fi cie variabile da 0,7 a 1,7 m2.
La composizione del dialisato è la seguente:
Na 140 mEq/L K 2 mEq/L Bicarbonato da 28 a 35 mEq/L Ca 3 - 3,5 mEq/L.
In alcuni pazienti è necessaria l’aggiunta di fosfato al bagno dialisi allo scopo di prevenire un’ipofosfatemia. In considerazione dell’au-mentata frequenza dei trattamenti dialitici vie-ne raccomandato l’uso di acqua demineraliz-zata “ultrapura”, inserendo un apposito fi ltro a monte del monitor di dialisi.
La dialisi notturna è risultata particolarmen-te indicata nei pazienti cardiopatici, nei pazien-ti con instabilità emodinamica ed in quelli con ascite. Dalla maggior parte dei pazienti trattati è stato riferito un netto miglioramento dello sta-to di benessere e della forza muscolare.
TECNICHE AD ALTA EFFICIENZA CONVETTIVE E DIFFUSIVO-CONVETTIVE
Luigi Iorio, Paolo Ghezzi, Sandro De Angelis, Giuseppe Nacca, Gennaro Iengo
Lo sviluppo delle diverse tecniche di dialisi è derivato dalla necessità di raggiungere i prin-cipali obiettivi della terapia sostitutiva :
• Una correzione ottimale dell’acidosi ure-mica
• La rimozione di un ampio range di soluti ematici
• La riduzione dei tempi di trattamento• Una soddisfacente stabilità emodinami-
ca intradialitica• La migliore biocompatibilità del circuito
extracorporeoLe tecniche di dialisi, a seconda del tipo di
meccanismo di trasporto dei soluti utilizzato, comprendono:• Emodialisi (HD)–trasporto per diffusione• Emofi ltrazione (HF)-trasporto per con-
vezione• Emodiafi ltrazione (HDF)–trasporto per
diffusione + convezione
La quantità dei soluti rimossi dalla tecnica dialitica utilizzata defi nisce invece l’effi cienza della dialisi, espressa dal coeffi ciente di rimo-zione dell’urea: KoA urea.
L’aumento dell’effi cienza dialitica si ottiene in primo luogo aumentando la superfi cie della membrana di dialisi (>1,5 m2) al fi ne di otte-nere un valore di KoA urea > 450 ml/min, che
Tabella I.9 – Caratteristiche tecniche della dialisi ad alta effi cienza.
Membrana Cellulosica ad ampia superfi cie (> 1.5m2)
Tampone Bicarbonato
Flusso dialisi ~ 500 ml/min
Flusso sangue ≥ 300 ml/min
UF Solo calo ponderale
Durata < 4 ore
Apparecchiatura Come per bicarbonato convenzionale
Cap_01.indd 26Cap_01.indd 26 01/10/2007 12.03.4401/10/2007 12.03.44

ROMASEU
27Principi generali dell’Emodialisi
corrisponde in vivo ad una urea clearance di 200 mL/min. In secondo luogo, la sostituzio-ne delle membrane tradizionali cellulosiche con membrane sintetiche ad alta permeabilità (membrane “High-Fux), migliora ulteriormente l’effi cienza dell’emodialisi tradizionale.
I vantaggi della dialisi ad alta effi cienza sono principalmente rappresentati da:
• riduzione dei tempi di trattamento;• ampio range di rimozione di tossine ure-
miche, come la β2 microglobulina.Mentre gli svantaggi sono costituiti da:• rischio di insorgenza della sindrome da
squilibrio osmotico;• rischio di back-fi ltration (insorgenza di
reazioni pirogeniche);• necessità di fl ussi ematici piuttosto ele-
vati.
L’emofi ltrazione
L’emofi ltrazione, fra i trattamenti sostitutivi dell’insuffi cienza renale, rappresenta la mi-gliore imitazione della funzione glomerulare. Essa è basata sul principio della convezione,
ove l’allontanamento dei soluti avviene, come in fi siologia, senza discriminazione della taglia molecolare, fi no al cut-off della membrana (li-mite massimo di peso molecolare dei soluti che possono attraversare la membrana).
In questa tecnica la funzione tubulare vie-ne, invece, mimata dalla reinfusione, in post-diluizione e/o prediluizione con liquidi sterili ed apirogeni a composizione controllata, che compensano qualitativamente e quantitativa-mente la sottrazione di acqua plasmatica.
Storia
Questa tecnica, già conosciuta dal 1947, nel 1967, con la produzione di nuove membra-ne ad alta permeabilità idraulica, fu applicata sperimentalmente da Henderson, Quellhorst et al. nel trattamento di uremici con ultrafi ltrazio-ne di elevati volumi di acqua plasmatici, reinte-grati dall’infusione di soluzioni saline sterili.
La sua storia può essere defi nita da tre dif-ferenti fasi:
– una prima fase intorno alla seconda metà del 1980, caratterizzata da un grosso entusiasmo basato sulla similari-
Fig. I.11 – L’evoluzione delle tecniche dialitiche dal prototipo del rene di Kolff sino ad oggi.
Cap_01.indd 27Cap_01.indd 27 01/10/2007 12.03.4401/10/2007 12.03.44

ROMASEU
28 La dialisi: tecnica e clinica
tà con la fi ltrazione glomerulare. Questa nuova terapia conservativa fu creduta la panacea della dialisi. Nel 1982 fu fonda-ta persino una società scientifi ca dedica-ta alla HF. Nel 1984 il registro dell’EDTA mostrava un 2,2% della popolazione dializzata trattata con HF;
– una seconda fase di declino, successi-va, in cui l’entusiasmo verso l’HF si spe-gneva. L’HF veniva considerata costosa per l’utilizzo di importanti quantità di vo-lumi ed infusioni, nonché tecnicamente complessa. I benefi ci erano sicuramente evidenti, ma il clima della dialisi in quei tempi non era favorevole alla terapia convettiva. La bicarbonato dialisi e l’eri-tropoietina, largamente usate, rendeva-no migliore la qualità di vita, e l’uso di membrane ad alto fl usso rendeva possi-bile rimuovere maggiori quantità di soluti anche in emodialisi;
– una terza fase coincide con la terza de-cade di HF. L’introduzione in commer-cio di sistemi di trattamento, mediante i quali è possibile l’utilizzo di alti volumi di infusione on-line in prediluizione, risol-ve i problemi del basso fl usso, dell’urea clearance e della viscosità. Più recen-temente l’utilizzo del bicarbonato come tampone ha creato un rinnovato interes-se in HF, che può trovare conferma nel lieve ma costante incremento del nume-ro dei pazienti trattati con tale tecnica.
Principi fi sici
I meccanismi di trasporto di acqua e/o so-luti attraverso una membrana semipermeabile si basano su due principi fi sici fondamentali: convezione e diffusione.
La diffusione è un processo di trasporto passivo di soluto attraverso una membrana se-mipermeabile, dovuto al gradiente di concen-trazione chimica.
Le molecole di soluto, per effetto di movi-menti causali, tendono ad occupare tutto lo spazio ad esse a disposizione. La risultante netta di questo movimento causale è un pas-saggio da una zona a più elevata concentra-zione ad una zona a minore concentrazione chimica (Legge di Fick).
Le molecole attraversano la membrana in funzione della loro dimensione e di quella dei pori della membrana. In questo processo non c’è trasporto di acqua.
La convezione è un processo di trasporto simultaneo di soluti ed acqua attraverso una membrana semipermeabile ed è dovuto al gra-diente di pressione di transmembrana.
Le molecole d’acqua attraversano la mem-brana semipermeabile (ultrafi ltrazione) in fun-zione di:
• TMP (pressione di transmembrana);• Km (coeffi ciente di permeabilità idrauli-
ca della membrana);• A (superfi cie della membrana).I soluti sono trascinati dall’acqua attraver-
so la membrana e la oltrepassano in funzione della loro dimensione e di quella dei pori della membrana.
La clearance è il termine clinico che de-scrive il trasporto dei soluti, rappresenta la quantità di sangue completamente depurata o riequilibrata rispetto ad un determinato soluto nell’unità di tempo, e si esprime in ml/min.
La clearance convettiva di un soluto è de-fi nita dal prodotto del fl usso di ultrafi ltrazione per il coeffi ciente di sieving della membrana.
Il coeffi ciente di sieving (o di setacciamen-to) esprime la capacità di un soluto di attraver-sare i pori della membrana. Il suo valore va da 0, per i soluti che non attraversano la mem-brana, a 1 per quelli che passano liberamente. Tutte le membrane da dialisi ad esempio han-no S = 1 per l’urea ed S = 0 per l’albumina.
A differenza della diffusione ove si assiste ad una progressiva riduzione della clearance
Cap_01.indd 28Cap_01.indd 28 01/10/2007 12.03.4501/10/2007 12.03.45

ROMASEU
29Principi generali dell’Emodialisi
con l’aumento del peso molecolare dei soluti, in convezione le clearance sono relativamente costanti per poi azzerarsi bruscamente oltre un determinato limite di peso molecolare. Poiché nell’emofi ltrazione il volume/minuto di ultra-fi ltrato è limitato, ed è inferiore alla clearance diffusiva dell’urea della dialisi standard, si dice comunemente che la clearance convettiva dei piccoli soluti è inferiore di quella diffusiva, men-tre più elevata è la clearance dei soluti di alto peso molecolare.
La clearance è tanto maggiore quanto più elevati sono il volume dell’ultrafi ltrato e il coef-fi ciente di Sieving.
Il volume minuto dell’ultrafi ltrato dipende dalle caratteristiche dell’emofi ltro, da parametri operativi e dalle peculiarità del sangue trattato.
Le caratteristiche dell’emofi ltro derivano dal-le dimensioni della superfi cie, dalla permeabili-tà idraulica e dalla conformazione strutturale.
I parametri variabili, sono rappresentati dal-la pressione di transmembrana (TMP) e dal fl usso ematico.
Poiché la Puf (pressione ultrafi ltro) è nega-tiva, dovuta alla pompa di aspirazione, essa apporta un contributo positivo alla pressione di fi ltrazione. Aumentando il TMP il valore dell’ul-
trafi ltrato aumenta proporzionalmente fi no ad un valore limite oltre cui ogni aumento del TMP non sortisce alcun effetto. Pertanto vi è una fase iniziale in cui il fattore limitante la TMP è dato dalla permeabilità della membrana, suc-cessivamente lo stesso è limitato dallo strato di cellule e proteine che si concentrano sulla superfi cie della membrana limitando l’ultrafi l-trazione. In questa fase un aumento del volu-me di ultrafi ltrato può essere ottenuto solo con l’aumento del fl usso ematico determinante per ottenere clearance elevate.
Quando la TMP è elevata la concentrazione delle proteine sulla membrana supera il limite di solubilità e dà luogo alla formazione di un gel proteico (protein cake) sulla parete inter-na del capillare. Lo spessore di questo strato è inversamente proporzionale alla velocità del fl usso ematico nel capillare del fi ltro. Pertan-to per aumentare questa mobilizzazione delle proteine stratifi cate sulla membrana e quindi l’ultrafi ltrato occorre aumentare il Qb o ridurre il diametro delle fi bre.
La concentrazione delle proteine plasma-tiche esercita un’infl uenza negativa sulla for-mazione dell’ultrafi ltrato, il cui fl usso si riduce proporzionalmente all’aumento della concen-
Tabella I.10 – Il trasporto di soluti tramite convezione è regolato dalla legge di Staverman ed è dovuto al gradiente di pressione transmembrana.
Cap_01.indd 29Cap_01.indd 29 01/10/2007 12.03.4501/10/2007 12.03.45

ROMASEU
30 La dialisi: tecnica e clinica
trazione stessa, con un più rapido raggiungi-mento del plateau.
Anche la composizione qualitativa delle proteine ha un ruolo importante, in quanto le proteine di più grosse dimensioni, diffondendo più lentamente ostacolando maggiormente la formazione di ultrafi ltrato. Alle lipopoproteine, in particolare, vengono attribuite diversità di fl usso di ultrafi ltrato osservate tra pazienti con sovrapponibili valori di protidemia ed emato-crito.
I globuli rossi aumentando le velocità di fl usso laminare sulla membrana facilitano il di-stacco delle proteine dalla membrana. Tuttavia per valori di ematocrito superiori al 25% l’in-fl uenza dei GR è negativa e la formazione di ultrafi ltrato è inferiore. L’aumento dell’ematocri-to determina infatti reciproche interferenze fra i GR riducendone i movimenti che aumentano il coeffi ciente di retrodiffusione delle proteine.
Tecniche
In questa tecnica convettiva gli elevati volu-mi di acqua plasmatici ultrafi ltrati, vanno rein-tegrati dall’infusione di soluzioni saline sterili e apirogene.
Il volume di sostituzione richiesto (Vi) è pari alla differenza tra il volume di ultrafi ltrato totale ed il volume del liquido in eccesso da sottrarre al paziente nel corso del trattamento.
L’infusione di questi liquidi può avvenire in pre ed in post-diluizione.
Prediluizione
In questa modalità il sangue viene diluito con un volume di soluzioni sterili ed apirogene, prima di giungere all’emofi ltro, dove a seguito dell’ultrafi ltrazione, viene riportato al suo vo-lume iniziale, meno il calo peso programma-to. La velocità di infusione e di ultrafi ltrazione sono collegate tra loro e vengono determinate più dalla capacità di ultrafi ltrazione della mem-brana che non dalla velocità del fl usso sangue
Fig. I.12 – Modalità di reinfusione dei liquidi : in prediluizio-ne o in postdiluizione.
e dalla sua composizione. Solitamente i para-metri del trattamento sono fi ssati per raggiun-gere una velocità di infusione pari all’80-120% del fl usso sangue.
Postdiluizione
Nella postdiluizione il sangue del paziente arriva all’emofi ltro ove viene ultrafi ltrato e con-centrato per mezzo di una pompa in aspirazio-ne che esercita sulla membrana una pressione negativa. L’infusione di liquidi di sostituzione avviene all’uscita dell’emofi ltro in una camera posta sulla linea venosa, ove il sangue viene ri-portato al volume iniziale meno il calo peso de-siderato. La velocità massima di ultrafi ltrazione è in genere intorno al 30% del fl usso sangue. In tale condizione il sangue si concentra all’inter-no dell’emofi ltro al punto in cui non è più pos-sibile aumentare la velocità di UF. L’ematocrito e i livelli di proteine e lipidi nel plasma fi ssano questo limite per la capacità di ultrafi ltrazione. Per cui nell’HF in post-diluizione possono esse-re necessari una velocità di fl usso sangue ele-vata e/o un tempo più lungo del trattamento, al fi ne di raggiungere la dose dialitica desiderata.
Parametri di trattamento
Dose dialitica in HF
Applicando l’indice dialitico di Gotch, un Kt/V di 0,9 – 1, inadeguato in emodialisi, risulta suffi ciente a fornire una buona depurazione in emofi ltrazione.
Cap_01.indd 30Cap_01.indd 30 01/10/2007 12.03.4501/10/2007 12.03.45

ROMASEU
31Principi generali dell’Emodialisi
Volume di ultrafi ltrazione
Per i piccoli soluti, per i quali la membrana dell’emofi ltro è assolutamente permeabile, il volume di acqua plasmatica ultrafi ltrata deter-mina la clearance globale. In modalità predi-luizione deve essere preso in considerazione anche il fattore di diluizione QB/(QB+Qinf); quan-do il sangue è diluito con la stessa quantità di liquido di sostituzione, l’ultrafi ltrato viene dilui-to nella stessa misura. Nel caso in cui Qinf sia uguale a QB, la clearance è metà dell’ultrafi ltra-zione. Così, per raggiungere un Kt/V dell’urea di 1.0 in HF in prediluizione, il volume totale di UF deve essere di circa due volte il volume di distribuzione dell’urea, oppure 110-120% il peso corporeo. In post diluizione il valore corri-spondente di UF è 55-60 % il peso corporeo.
Emofi ltro
Per soluti più grandi, quali la β2-microglo-bulina (β2-m), la proprietà di fi ltrazione della membrana diventa un fattore addizionale de-terminante della clearance. Il coeffi ciente di fi l-trazione che indica la permeabilità della mem-brana ai soluti, varia nelle singole membrane ma può anche variare a seconda della durata del trattamento e della velocità dei fl ussi appli-cata.
Per l’emofi ltrazione in prediluizione l’emo-fi ltro deve avere una membrana ad alto fl us-so con una elevata capacità di UF. Inoltre la superfi cie della membrana deve essere gran-de. La membrana dovrebbe anche mostrare un coeffi ciente di sieving elevato e stabile per soluti della grandezza della β2-m o superiore, ed infi ne, essere pressoché impermeabile al-l’albumina.
Durata del trattamento
L’emofi ltrazione in postdiluizione è un trat-tamento volume-dipendente e non tempo-di-pendente, in quanto la sessione ha termine quando viene raggiunto un determinato volume di ultrafi ltrato. La durata del trattamento non è prevedibile per tutti i motivi precedentemente descritti.
Il fl usso ematico è un parametro condizio-nante e l’ultrafi ltrazione massima non supera il 50% del fl usso plasmatico.
Con un fl usso ematico di 400 ml/min ed una fi ltrazione media inferiore solo del 10% della massima teorica, la durata del trattamento per un paziente di 70 Kg è superiore alle 5 ore.
Velocità del fl usso sangue
Se tutti i parametri restano invariati, la clea-rance nell’HF in prediluizione aumenta con l’incremento della velocità del fl usso sangue. L’effetto sulla clearance diviene ancora più marcato con un concomitante aumento del vo-lume di infusione, a generare maggiore ultra-fi ltrazione.
Nell’HF in post-diluizione, una velocità del fl usso sangue elevata offre maggiori possibi-lità di ultrafi ltrazione; si può raggiungere una maggiore UF prima che l’emoconcentrazione la limiti.
Nella fi gura I.13 si nota come la clearance dell’urea in HF in prediluizione rimane stabil-mente più elevata rispetto alla HF in post-dilui-zione e come il Qb abbia maggior importanza nella post rispetto alla pre-diluizione.
Nella fi gura I.14 il grafi co indica il rapporto tra volume da reinfondere e peso corporeo in funzione del Kt/V dell’urea.
Fig. I.13 – Clearance dell’urea in emofi ltrazione (stabilmente più elevata in prediluizione rispetto alla HF in postdiluizione.
In genere un trattamento di HF in modalità di prediluizione dura 3,5 – 4,5 ore.
Cap_01.indd 31Cap_01.indd 31 01/10/2007 12.03.4501/10/2007 12.03.45

ROMASEU
32 La dialisi: tecnica e clinica
Nelle Tabelle I.11 e I.12 si riportano i princi-pali parametri tecnici della emofi ltrazione utiliz-zati negli studi più recenti:
Indicazioni della tecnica
L’elevata stabilità emodinamica e la ridu-zione della sintomatologia intra e postdialitica sono l’indice di superiorità della emofi ltrazione rispetto all’emodialisi tradizionale.
Come per l’ultrafi ltrazione isolata anche in emofi ltrazione il paziente mantiene le capaci-tà di aumentare il tono simpatico, adattandosi all’ipovolemia provocata dalla sottrazione di liquidi. In HF il mantenimento di buoni valo-ri pressori è legato ad un aumento dei livelli plasmatici di noradrenalina e delle resistenze periferiche.
Il bilancio sodico, meno negativo che in emodialisi per la formazione di un ultafi ltrato iponatriemico rispetto al plasma, determina un maggiore potere osmotico di quest’ultimo che richiamando acqua dal compartimento in-tracellulare (refi lling) determina un compenso della riduzione del volume plasmatico.
Anche se alcuni autori avrebbero dimostra-to non signifi cative differenze nel bilancio so-dico fra le tecniche diffusive e convettive, co-munque risulta sempre una maggiore stabilità emodinamica. Pertanto altri fattori non dimo-strati dovrebbero intervenire, tra questi si può ipotizzare una rimozione di soluti vasoditatativi fra cui il fattore natriuretico intratriale.
Sicuramente un’origine multifattoriale è alla base della maggiore stabilità emodinamica di questa tecniche convettiva che determinando una rimozione di fl uidi più adeguata e meno sintomatica migliora anche il controllo dell’iper-tensione arteriosa. Altri aspetti di questa tecni-ca sono:
• una maggiore l’eliminazione di soluti quali la β2-microglobulina con un’estra-zione media di 120/140 mg/m2/seduta (produzione media giornaliera di circa 3 mg/kg/die);
• un bilancio del calcio legato alla quanti-tà contenuta nel bagno ed all’entità del-l’UF;
• una rimozione di potassio maggiore in post che in prediluizione, ma comunque in minor misura rispetto all’emodialisi;
• un guadagno di basi più rapido ed inten-so nei trattamenti on-line con tampone bicarbonato, ma senza conferma della
Fig. I.14 – Emofi ltrazione in prediluizione: rapporto tra il volume da reinfondere ed il peso corporeo in funzione del Kt/V dell’urea.
Qb(ml/min)
OUF(ml/min)
Vol UF(L) seduta
K urea(ml/min)
∆ β2 – m Emofi ltroSuperfi cie m2
Post HF 400 164 29 157 - 66 % 2 – 2,1
Pre-HF 400 317 57 162 -71% 1,8 - 2
Tabella I.11 – Principali parametri tecnici e risultati dell’emofi ltrazione.
Na K Cl Ca Mg HCO3 Acetato Glucosio Ratio Infusioni/peso secco139-140 1,8-2 109,2 1,6-1,7 0,49 31,5-33,7 5,34 5,33 1,15 – 1,25 in preHF
0,60 in postHF
Tabella I.12 – Composizione e quantità reinfusato (mmol/l).
Cap_01.indd 32Cap_01.indd 32 01/10/2007 12.03.4601/10/2007 12.03.46

ROMASEU
33Principi generali dell’Emodialisi
maggior effi cacia sull’acidosi metabolica rispetto all’emodialisi;
• una migliore risposta immune con ridu-zione di IL6 ed TNFα;
• una riduzione degli AGEs, mioglobina, osteocalcina, TNFα, omocisteina, Dime-tilarginina asimmetrica (ADMA);
• una perdita di albumina da 2 a 20 g ses-sione che non determinano effetti nega-tivi sullo stato nutrizionale;
• maggiore rimozione di molecole inibito-rie dell’eritropoiesi con miglioramento dell’anemia e minori dosi di epo.
Alla luce di quanto sopra tali tecniche con-vettive trovano indicazione in pazienti con in-stabilità vascolare come gli anziani, i diabetici, i cardiopatici con ischemia, con disfunzioni cine-tiche e con aritmie, inoltre soggetti con osteo-patie ed amiloidosi dialitica.
L’emofi ltrazione continua è stata utilizzata come terapia acuta nella grave insuffi cienza cardiaca (II – IV classe NYHA) già nel 1987 e nel 1997 contava almeno 400 pazienti trattati in paesi Europei e non Europei con trattamenti che potevano sottrarre da 2 a 40 kg di fl uidi con durata per singolo trattamento che andavano da 2 ore a 126 ore.
In altre esperienze il trattamento veniva utilizzato non in modo acuto ma in maniera ripetitiva nelle anurie refrattarie alla terapie
diuretiche. Queste esperienze utilizzavano trattamenti giornalieri con reinfusato in post-di-luizione di circa 10 litri e una ultrafi ltrazione di 12 litri con effettiva perdita di circa due chilo-grammi di liquidi al giorno.
L’introduzione in commercio di sistemi di trattamento in cui è possibile l’utilizzo di alti volumi di infusione on-line in prediluizione ha ridotto il ricorso alla HF in post-diluizione e recentemente con le l’utilizzo del bicarbonato come tampone ha creato un rinnovato interes-se in HF, che è convalidata da un aumento dei pazienti trattati.
L’emodiafi ltrazione
L’emodiafi ltrazione (HDF) è la metodica ba-sata sulla combinazione dei trattamenti diffusi-vi (Emodialisi: HD) e convettivi (Emofi ltrazione: HF).
Le tecniche di emodiafi ltrazione nel cor-rente uso clinico comprendono: HDF standard (Fig.I.15), HDF on-line (Fig. I.16), PFD (Fig. I.17), HFR on-line (Fig. I.20), AFB (Fig. I.24).
I vantaggi della metodica mista derivano principalmente da:
• l’utilizzo di membrane biocompatibili;• la biocompatibilità del circuito extracor-
poreo;
Fig. I.15 –Schema della tecnica HDF.
Cap_01.indd 33Cap_01.indd 33 01/10/2007 12.03.4601/10/2007 12.03.46

ROMASEU
34 La dialisi: tecnica e clinica
• la correzione ottimale dell’acidosi uremi-ca;
• la personalizzazione del trattamento;• la riduzione dei tempi di trattamento; • la maggiore stabilità del sistema cardio-
vascolare.
Associando i due sistemi di trasporto trans-membrana l’HDF ottiene infatti una migliore rimozione di tossine uremiche di medio-alto peso molecolare (quando paragonata alla HD) e di piccolo peso molecolare (quando parago-nata alla HF) .
Tuttavia, il trasferimento di soluti ottenibile in HDF non è dato dalla somma della diffusio-ne e della convezione dal momento che per un soluto diffusibile come l’urea, la coesistenza dei due processi nella stessa membrana pro-voca un’interferenza negativa.
Il trasporto convettivo dei soluti di piccolo peso molecolare viene infatti inibito proprio dal contemporaneo trasporto diffusivo.
Pertanto, la K convettiva (Kconv) è calcola-bile mediante l’ equazione:
dove:Quf = portata di ultrafi ltrazioneCbo = concentrazione ematica del soluto in
uscita fi ltro
Cbi = concentrazione ematica del soluto in ingresso fi ltro.
Ne consegue che: quanto più basso è il valore di Cbo rispetto a Cbi (cioè quanto più elevata è la K diffusiva di un fi ltro), tanto più risulterà < 1 il loro rapporto.
Elevate quote di Quf, entro i limiti consentiti dal fl usso ematico (Qb), dall’ ematocrito (Hct), dalle proteine totali (TP) e dalla frazione di fi l-trazione (ff), migliorano la resa depurativa ren-dendo però indispensabili idonee quantità di soluzioni di reinfusione.
Normalmente si reinfondono, in postdilui-zione, dai 10 ai 20 litri di sacche ready-to-use prodotte dall’industria farmaceutica (Fig. I.16).
Tuttavia la reinfusione pone i seguenti pro-blemi:
• connessioni ripetute alle linee ematiche,• stoccaggio delle sacche;• costi del materiale e degli ambienti di
stoccaggio. Si comprende pertanto il successivo ricorso
a sistemi alternativi di produzione del liquido di infusione, prelevato direttamente dall’impianto di osmosi del centro dialisi, reso sterile ed ul-trapuro dall’azione di 2 o più fi ltri posti a monte del monitor di dialisi (Fig. I.17).
La soluzione di infusione così prodotta può essere utilizzata in prediluizione, in postdilui-zione o in modo combinato.
Fig. I.16 – Schema della tecnica HDF con reinfusione in postdiluizione.
Cap_01.indd 34Cap_01.indd 34 01/10/2007 12.03.4601/10/2007 12.03.46

ROMASEU
35Principi generali dell’Emodialisi
L’elevata biocompatibilità della soluzione di infusione è testimoniata dalla ridotta attivazione del sistema immunitario del paziente. Tuttavia, sussiste il problema della certezza di sterilità e apirogenicità delle soluzioni prodotte on-line, dal momento che i risultati dei controlli programmati o estemporanei (culture, Limulus Amebocyte Li-sate [LAL]) sono ovviamente disponibili solo in tempi successivi al trattamento dialitico.
La sicurezza dell’effettiva qualità dei liquidi di reinfusione non può essere dunque garan-tita ma solo statisticamente presunta. L’otti-mizzazione dell’HDF deve pertanto risolvere i seguenti problemi:
• interferenza diffusione/convezione;• diffi coltà operative e costi del trattamen-
to;
Fig. I.17 – Schema del trattamento HDF on line.
Fig. I.18 – PFD schema della metodica.
Cap_01.indd 35Cap_01.indd 35 01/10/2007 12.03.4701/10/2007 12.03.47

ROMASEU
36 La dialisi: tecnica e clinica
• garanzia di qualità della soluzione di reinfusione preparata on-line.
Allo scopo di migliorare l’effi cienza depura-tiva dell’HDF eliminando l’interferenza diffusio-ne/convezione, Ghezzi e collaboratori nel 1983 hanno proposto di utilizzare separatamente la diffusione e la convezione.
La nuova tecnica era basata infatti su di un sistema a doppia camera composto da due fi l-tri in serie, il primo costituito da una membrana sintetica ad alta permeabilità idraulica per l’al-lontanamento convettivo dei soluti, il secondo da una membrana cellulosica ad alta permea-bilità diffusiva e bassa permeabilità idraulica per l’allontanamento diffusivo dei soluti e il controllo del peso del paziente.
Fra i due settori del doppio fi ltro veniva rein-fusa una soluzione di sostituzione in quantità pari al Quf, in modo da ricostituire il Qb effet-tivo.
Il metodo, defi nito Paired Filtration Dialysis (PFD), evita l’interferenza fra convezione e dif-fusione minimizzando il rischio di backfi ltration a livello del secondo fi ltro e assicurando una disponibilità continua di ultrafi ltrato non mesco-lato con la soluzione dializzante.
Tali caratteristiche garantiscono l’effi cacia di questo trattamento depurativo nei confronti dei
soluti sia a basso che a medio-alto peso mole-colare associata a un’alta tolleranza clinica.
La disponibilità continua di ultrafi ltrato ca-ratteristica della PFD, ha suggerito l’ipotesi di una sua utilizzazione, dopo opportuna “rigene-razione”, come liquido di reinfusione “endoge-no”, nel tentativo di risolvere i problemi relativi all’utilizzazione di soluzioni in sacca preparate dall’industria o alla preparazione on-line a par-tenza dalla soluzione dializzante.
Nel 1992 è stato dunque messo a punto un sistema di “rigenerazione” a circuito chiuso, costituito da una cartuccia contenente 130 ml di carbone non ricoperto, inserita sul circuito di ultrafi ltrazione.
La metodica, denominata Hemo Filtrate Reinfusion (HFR) e schematizzata nella Figura I.20, rappresenta una HDF con liquido endo-geno che ha dato risultati positivi non solo dal punto di vista operativo ma anche da quello cli-nico, permettendo un miglioramento ulteriore della tolleranza della seduta emodialitica, cor-relato probabilmente, fra l’altro, a un ottimale bilancio dei bicarbonati, alla diminuzione dello stimolo infi ammatorio legato alla purezza della soluzione di reinfusione.
Disegno del circuito idraulico dell’HFR standardIl sistema a doppia camera consiste in 2 fi ltri
posti in serie. Il primo è un emofi ltro in polisul-
Fig. I.19 – Rigenerazione e reinfusione dell’ultrafi ltrato.
Cap_01.indd 36Cap_01.indd 36 01/10/2007 12.03.4701/10/2007 12.03.47

ROMASEU
37Principi generali dell’Emodialisi
fone ad alta permeabilità di 0,5 mq, il secondo è un fi ltro a bassa permeabilità di 1,9 mq. Il sangue viene prima ultrafi ltrato e successiva-mente depurato.
L’HDF con tecnica HFR è stata ulteriormen-te perfezionata con la messa a punto di una cartuccia rigenerante ad adsorbimento inte-grato, contenente 20 ml di resina a interazione
idrofobica e 120 ml di carbone minerale non ricoperto, sterilizzata a vapore umido.
L’ultrafi ltrato prodotto dall’emofi ltro attraver-sa una cartuccia contenente carbone e resina, nella quale verranno adsorbite solo alcune so-stanze. Successivamente l’ultrafi ltrato viene reinfuso all’ingresso del secondo fi ltro dove verrà ulteriormente depurato delle sostanze che non sono state adsorbite.
Fig. I 20 – HFR standard.
Fig. I 21 – HFR on-line, caratteristiche della cartuccia sorbente Selecta Plus.
Cap_01.indd 37Cap_01.indd 37 01/10/2007 12.03.4701/10/2007 12.03.47

ROMASEU
38 La dialisi: tecnica e clinica
La resina adsorbe le seguenti sostanze:• β2-microglobulina;• omocisteina;• cisteina;• glutatione (ossidato e ridotto);• peptidi ad attività vasodilatatoria;• aminoacidi (in quantità minima rispetto
alle membrane di dialisi);il carbone adsorbe a sua volta:• creatinina; • acido urico; • tossine uremiche a basso peso moleco-
lare (identifi cabili con HPLC in fase in-versa) [30];
• Ca++ (solo nei primi 5-15 min di tratta-mento);
• glucosio (nei primi 60-90 min).
Urea, Na+, K+, fosfati e bicarbonati non ven-gono adsorbiti e rimangono pertanto presenti nell’ultrafi ltrato all’uscita dalla cartuccia.
In particolare, i bicarbonati presenti nell’ul-trafi ltrato, non subendo variazioni a livello della cartuccia adsorbente, vengono reinfusi come tampone fi siologico “endogeno”.
A tale proposito occorre sottolineare che il liquido di reinfusione ottenuto dopo la “rige-nerazione” non contiene acetato o lattato, che sono entrambi presenti nelle sacche precosti-tuite in commercio o nelle soluzioni preparate on-line a partire dal dialisato.
L’ultrafi ltrato così rigenerato a circuito chiu-so costituisce pertanto una soluzione di reinfu-sione “endogena” sterile, ultrapura, contenente i bicarbonati e gli aminoacidi originali del pa-ziente.
Il rilascio di particelle e metalli pesanti ri-spetta le normative vigenti.
Acetate free biofi ltration (AFB)
L’AFB è una Emodiafi ltrazione basata prin-cipalmente sull’utilizzo di un bagno dialisi com-pletamente privo di tampone acetato, sterile e apirogeno.
L’aggiunta di acetato di sodio (CH3COONa) nel bagno dialisi (acetato dialisi) era utilizzata negli anni ’60 e ’70 per il raggiungimento del-l’equilibrio acido-base (EAB).L’acetato di sodio, fi siologicamente assente nell’organismo uma-
no, passa nel corso della dialisi dal comparto del dialisato al sangue, svolgendo la funzione tampone. La scelta dell’acetato come tampone nel bagno dialisi era dovuta alle seguenti ca-ratteristiche:
• basso peso molecolare della sostanza;• stabilità della sostanza in soluzione con-
centrata; • rapido metabolismo; • permanenza in soluzione degli ioni Ca++
e Mg++. È stato però successivamente dimostrato che l’acetato presenta nume-rosi effetti clinici negativi;
• Graefe et al. hanno rilevato che, usando membrane ad elevata superfi cie dializ-zante, si ha una brusca riduzione intra-dialitica del pH e della bicarbonatemia nel paziente, con successivo aumento circa una/due ore dopo il termine della seduta dialitica.
Inoltre, esiste una soglia di metabolismo degli acetati, oltre la quale la sostanza non segue più la via che porta alla formazione dei bicarbonati, ma innesca processi diversi, come quello del metabolismo lipidico, potendo così causare dislipidemia nel paziente.
Gli ulteriori effetti negativi derivanti dall’uso dell’acetato sono evidenziati nella Figura I.22.
La valutazione dei numerosi effetti collatera-li, che si accentuano in metodiche dialitiche ad alta effi cienza, ha indotto, a partire dagli anni ‘80, all’utilizzo del bicarbonato come tampone.
La correzione dell’EAB avviene pertanto esclusivamente mediante l’infusione, in post-diluizione, di una soluzione sterile di bicarbo-nato di sodio (NaHCO3).
Il fatto che il dialisato sia completamente privo di tampone fa sì che in AFB i meccanismi
Fig. I.22 – Effetti collaterali dell’acetato.
Cap_01.indd 38Cap_01.indd 38 01/10/2007 12.03.4801/10/2007 12.03.48

ROMASEU
39Principi generali dell’Emodialisi
di acquisizione e cessione del bicarbonato sia-no completamente separabili tra loro.
Questo permette di calcolare più facil-mente la quantità di HCO3- somministra-ta al paziente e quindi di prevederne la bi-carbonatemia al termine del trattamento.In particolare, attraverso il dializzatore si rea-lizza sempre un passaggio di bicarbonato dal sangue al dialisato; è questa la sola via di perdita (output)le grazie ad un gradiente dif-fusivo ed al trasporto convettivo. Viceversa, il bicarbonato viene acquisito dal sangue (input) esclusivamente attraverso l’infusione in postdi-luizione (Fig. I 23).
In tal modo, si tende a raggiungere uno stato di equilibrio (steady-state) in cui input ed output di bicarbonato si equivalgono, consen-tendo la quantifi cazione del bilancio di massa del bicarbonato.
Per tale motivo l’AFB è comunemente defi -nita “autolimitante” per quanto riguarda la cor-rezione dell’EAB.
Tra gli obiettivi del trattamento dialitico è prioritario riportare le concentrazioni elettroli-tiche ed il pH ad un valore prossimo a quello fi siologico. A seguito di questo meccanismo di reciprocità, infatti, la correzione dell’equilibrio acido base dà luogo ad uno scambio ionico tra gli ambienti intracellulare ed extracellulare, che causa l’ingresso di potassio nella cellula e il possibile insorgere di ipokaliemia. Anche in questo caso, come in iperkaliemia, il rischio cli-nico è lo sviluppo di aritmie dialitiche precoci.
Le moderne apparecchiature di dialisi sono concepite per fornire un profi lo di concentrazio-ne del potassio durante il trattamento, i cui limiti sono determinati dalla concentrazione di potas-sio nelle sacche di preparazione del dialisato.
Fig. I.24 –Schema funzionale della tecnica AFB.
Fig. I.23 – Cinetica del bicarbonato in AFB.
Cap_01.indd 39Cap_01.indd 39 01/10/2007 12.03.4801/10/2007 12.03.48

ROMASEU
40 La dialisi: tecnica e clinica
BIDIALISI ON-LINE: UNA NUOVA SOLUZIONE DEPURATIVA PER I PAZIENTI IPERCATABOLICI O CON ELEVATO PESO CORPOREO
Giorgio Splendiani, Stefano Condò
la prima utilizzava due emodializzatori in Cu-prophan da un metro quadrato in sequenza, ciascuno connesso separatamente alla solu-zione dializzante (Double Filter System: DFS).
Sono stati trattati 15 pazienti con peso cor-poreo eccedente gli 80 Kg; i risultati sono stati confrontati con quelli ottenuti con emodialisi convenzionale (Conventional Hemodialysis: CHD).
Con quella nuova tecnica il Kt/V è aumen-tato da 1,10 a 1,29 (18%) pur essendo invariati il fl usso di sangue, la superfi cie dializzante, lo spessore della membrana ed i tempi di dialisi.
Il miglioramento del Kt/V potrebbe essere dovuto all’incremento del fl usso della soluzione dializzante (1000ml/min) ed al più lungo tempo di transito attraverso i due emodializzatori in sequenza con un più lungo tempo di contatto tra sangue e superfi cie della membrana.
Quella nuova tecnica si era dimostrata utile nei pazienti con peso eccedente gli 80 Kg al fi ne di ottenere un incremento della diffusione dei soluti senza effetti collaterali ed importante modifi cazione dei costi.
Successivamente abbiamo sperimentato una variante della tecnica sopra menziona-ta vale a dire che abbiamo utilizzato sempre due emodializzatori in sequenza ciascuno con-nesso separatamente al dializzato fresco ma il primo dializzatore era in polisulfone a basso fl usso da 1,2 metri quadrati ed il secondo era in polisulfone ad alto fl usso di 1,3 metri quadrati, con reinfusione on line di 200 ml/min tra il pri-mo ed il secondo fi ltro (Double Filter System on-line: DFS-on line) (Fig.I.25).
Sono stati trattati 10 pazienti con peso corpo-reo eccedente i 73 Kg ed i risultati sono stati con-frontati con quelli ottenuti con l’emodialisi con-venzionale (Conventional Hemodialysis: CHD).
Con questa nuova tecnica (DFS-on line) si è osservato una riduzione dei valori di β2 mi-croglobulina ed il Kt/V è aumentato da 1,11 a 1,9 (79%) pur essendo invariati il fl usso di san-gue ed i tempi di dialisi.
La sfi da della dialisi nel terzo millennio può essere individuata, oltre che nella riduzione della mortalità e della morbilità, nel migliora-mento della qualità di vita dei pazienti uremici.
Il tentativo più importante è quello di au-mentare la rimozione dei soluti tossici senza effetti collaterali ed ottenere, per quanto possi-bile, la riduzione dei tempi di dialisi.
Per i pazienti con un peso corporeo che ec-cede i 80 kg, con una grande massa muscola-re o con ipercatabolismo, è diffi cile giungere, attraverso le tecniche convenzionali, ad un ac-cettabile livello di depurazione.
I pazienti più grandi, in termini di peso cor-poreo, sono perciò spesso sottodializzati in quanto richiederebbero un periodo di tratta-mento di 5 o più ore in genere non accettato.
Un trattamento adeguato durante un ragio-nevole periodo di tempo (4 ore o meno) può essere ottenuto solo se vengono impiegate nuove tecniche.
Come è noto la dialisi è un trattamento sosti-tutivo della funzionalità renale che si basa sullo scambio di sostanze tra il sangue ed un liquido contenente sali utili per l’organismo, attraverso membrane semipermeabili a piccoli fori.
Per aumentare l’effi cienza depurativa del trattamento si deve aumentare il tempo di con-tatto fra il sangue ed il liquido dializzante, op-pure la superfi cie di scambio.
L’aumento del tempo di dialisi non è accet-tato dai pazienti che vedono prolungarsi il pe-riodo di sosta nei centri dialisi con conseguente diminuzione del tempo libero.
L’aumento della superfi cie della membra-na semipermeabile e/o del diametro dei pori comporta un rapido scambio di sostanze tra il sangue ed il liquido dializzante con conse-guente malessere del paziente sottoposto al trattamento dialitico ed un aumentato rischio di ipotensione o aritmie cardiache.
Abbiamo sperimentato delle nuove tecni-che di dialisi che permettono una adeguata depurazione in soggetti di grossa corporatura,
Cap_01.indd 40Cap_01.indd 40 01/10/2007 12.03.4901/10/2007 12.03.49

ROMASEU
41Principi generali dell’Emodialisi
Il miglioramento del Kt/V potrebbe esse-re dovuto oltre che all’incremento del fl usso della soluzione dializzante (1000ml/min) ed al più lungo tempo di transito attraverso i due emodializzatori in sequenza con un più lungo tempo di contatto tra sangue e superfi cie della membrana, come per la prima tecnica, anche allo sfruttamento del sistema convettivo, che avviene a livello del secondo fi ltro grazie alla reinfusione on line di 200 ml/min tra il primo ed il secondo fi ltro, ed alle caratteristiche e su-perfi ci delle membrane utilizzate (il primo dia-lizzatore in polisulfone a basso fl usso da 1,2 metri quadrati ed il secondo in polisulfone ad alto fl usso di 1,3 metri quadrati).
Anche la DFS on-line si è dimostrata utile nei pazienti con peso eccedente i 73 Kg al fi ne di ottenere una migliore depurazione ematica senza effetti collaterali ed importante modifi ca-zione dei costi.
Le tecniche sperimentate hanno dato buoni risultati in termini di depurazione senza effetti collaterali e con costi contenuti.
Il trattamento con due emodializzatori in sequenza e reinfusione on-line è semplice da applicare e ben accettato dai pazienti.
Può essere eseguito con tutti gli apparecchi di dialisi, richiedendo solo piccole modifi che.
Infi ne va ricordato che come indicato dalle linee guida National Kidney Fondation (NKF DOQI) (4) la riduzione degli effetti collaterali durante la dialisi migliora la possibilità di realiz-zare il trattamento programmato.
Bibliografi a
1. Mendelsshon DC: Refl ections on the optimal dialysis modalità distribution:a North American perspective. NNI 2002; 16(4):26-30
Fig. I.25 – Metodica di Bidialisi on-line (Double Filter System on-line: DFS-on line).
Cap_01.indd 41Cap_01.indd 41 01/10/2007 12.03.4901/10/2007 12.03.49

ROMASEU
42 La dialisi: tecnica e clinica
2. Cunningham R: Choosing the best dialysis options in the patient with chronic renal failure.Principles and practice of dialysis.W.L.Henrich.3rd ed.2003:103-110
3. Drukker W: Haemodialysis: a historical review. In: Maher JF, ed. Replacement of renal function by dialysis. Dordrecht, the Netherlands: Kluwer Academic, 1989: 20-86
4. Trattato Italiano di dialisi. Vincenzo Cambi. Wicching Editore
5. Il rene sesta edizione. Brenner & Rector. Verduci Editore
6. Redaelli B, et al.: Potassium removal as a factor limitino the correction of acidosis during dialysis. Proc EDTA 1982; 19:366
7. Spital A, et al.: Potassium hoeostasis in dialysis patients. Semin Dial 1988; 1:14-20
8. Pogglitsch H, et al.: The cause of inadequate hemodynamic reactions during ultradiffusion. Proc Eur Dial Transplant Assoc 1978; 8:245-252
9. Redaelli B, et al.: Effect of a new model of hemodialysis potassium removal on the control of ventricular arrhytmias. Kidney Int 1996; 50:609-617
10. Leunissen KLM, et al.: Bicarbonate dialysis: a review and future perspectives. Semin Dial 1994; 7:186-191
11. Ahmad S, et al.: Dialysate made from chemicals us-ing citric acid increases dialysis dose. Am J Kidney Disease 2000; 35:493-499
12. Slatopolsky E, et al.: Long-term effects of calcium carbonate and 2.5 mEq/L calcium dialysate on min-eral metabolism. Kidney Int 1989; 36: 897
13. van der Sande FM, et al.: Effect of dialysate calcium concentrations on intradialytic blood pressure course in cardiac-compromised patients. Am J Kidney Dis 1998; 32:125-131
14. Pierratos A, et al.: Nocturnal hemodialysis: three-year experience. J Am Soc Nephrol 1998; 9:859-868
15. Schiffl H, Lang SM, Fischer R: Ultrapure dialysis fl uid slows loss of residual renal function in new dialysis pa-tients. Nephrol. Dial Transplant 2002; 17:1814-1818
16. Lonnemann G, Koch KM: Effi cacy of ultrapure dia-lysate the therapy and prevention of haemodialy-sis-associated amyloidosis. Nephrol Dial Transplant 2001; 16(suppl 4):17-22
17. Schiffl H, Lang S, Stratakis D, Fischer R: Effects of ultrapure dialysis fl uid on nutritional status and infl ammatory parameters. Nephrol Dial Transplant 2001; 16:1863-1869
18. Gerdemann A, Wagner Z, Solf A, Bahner U, et al.: Plasma levels of advanced glycation end products during haemodialysis,haemodiafi ltration and haemo-fi ltration: potential importance of dialysate quality. Nephrol Dial Transplant 2002; 17:1045-1049
19. Fluck S, McKane W, Cairns T, Fairchild V et al.: Chlo-ramine-induced haemolysis presenting as erythropi-etin resistance. Nephrol Dial Transplant 1999; 14: 1687-1691
20. Matsuhashi, Yoshioka T: Endotoxin-free dialysate improves response to erythropoietin in hemodialysis patients. Nephron 2002, 92: 601-604
21. Association for the advancement of medical instru-mentation: American national standard for Haemodi-alysis Sistems (RD-5-1992) Arlington, Virginia 1992
22. Giannattasio M: Emodialisi o peritoneodialisi come terapia di prima scelta dell’uremia cronica? Giornale Italiano di Nefrologia 2000; 2:161-169
23. Drukker W: Haemodialysis: a historical review. In: Maher JF, ed.Replacement of renal function by dialy-sis. Dordrecht, the Netherlands: Kluwer Academic, 1989; 20-86
24. Port FK: Morbidity and mortality in dialysis patients. Kidney Int 1994; 46:1728-1737
25. Ajuria JL: Choice of the hemodialysis membrane. In Henrich W, Principles and practice of dialysis. Lip-pincott W&Wilkins 2003; 1-15
26. Gohl H. et al.: Membranes and fi lters for hemofi ltra-tion. In:Henderson LW, et al.,eds Hemofi ltration. Ber-lin:Springer-Verlag, 1986; 63-64
27. Greene T, et al.: Design and statistical issues of the hemodialysis (HEMO) study. Con Clin Trials 2000; 21:502-525
28. Leypoldt JK: Solute fl uxes in different treatment. Ne-phrol Dial Transplant 2000; 15(Suppl):3-9
29. Hoenich NA, et al.: Haemodialysis membranes: a mat-ter of fact or taste? Contrib Nephrol 2001; 133:81-104
30. Hakim RM, et al.: Hemodialysis associated platelet activation and thrombocytopenia. Am J Med 1985; 78:575-580
31. Green D, et al.: Elevated β- thromboglobulin in pa-tients with chronic renal failure: effect of hemodialy-sis. J Lab Clin Med 1980; 95:679-685
32. Gawez MP, et al.: Platelet-leukocyte aggregates dur-ing hemodialysis: effect of membrane type. Artif Or-gans 1999; 23:29-36
33. Tielemans C, et al.: Anaphylactoid reactions during hemodialysis on AN69 membranes in patients re-ceiving ACE inhibitors. Kidney Int 1990; 38:982-984
34. Kaplow L, et al.: Profound neutropenia durino the early phase of hemodialysis. JAMA 1968; 203:133-135
35. Craddock PR, et al.: Hemodialysis leukopenia: pul-monary vascular leukostasis resulting from comple-ment activation by dializer cellophane membranes. J Clin Invest 1977; 59:879-888
36. Laude-Sharpe M, et al.: Induction of IL-1 during he-modialysis:transmembrane passage of intact endo-toxins (LPS). Kidney Int 1990; 38:1089-1094
37. Baurmeister U, et al.: Dialysate contamination and back fi ltration may limit the use of high-fl ux dialysis membranes. ASAIO Trans 1989; 35:519-522
38. Kimmel PL, et al.: Effect of renal replacement therapy on cellular cytochine production in patients with renal disease. Kidney Int 1990; 38:129-135
39. Vanholder R, et al.: Replacement of Renal Function by Dialysis, 4th edition, Kluver Academic Publishers, Dordrecht 1996; 1-34
40. Vanholder R, De Smet R, Glorieux G, Baurmeister U, Brunet P, Clark W, et al.: Review on uremic toxins:classifi cation, concentration, and interindividual vari-ability. Kidney Int 2003; 63:1934-1943
41. De Palma JR, Bolton CF, Baltzan MA, Baltzan RB: Adequate hemodialysis schedule. N Eng J Med 1971; 285(6):353-354
42. Gotch, Sargent, Keen, Proc Clin Dial Transpl Forum 1974; 1:27-37
Cap_01.indd 42Cap_01.indd 42 01/10/2007 12.03.4901/10/2007 12.03.49

ROMASEU
43Principi generali dell’Emodialisi
43. Teschan PE, Ginn HE, Bourne JR, Ward JW, Hamel B, Nunnally JC, Musso M, Vaughn WK: Quantitative indi-ces of clinical uremia. Kidney Int 1979; 15: 676-697
44. Gotch FA, Sargent JA: A mechanistic analysis of the National Cooperative Study (NCDS). Kidney Int 1985; 28:526-534
45. Daurgidas JT: Second generation logaritmic esti-mates of single-pool variable volume Kt/V: an analy-sis of error. J Am Soc Nephrol 1993; 4:1205-1213
46. Garred. ASAI LJ, Barichelo DL, Di Giuseppe B, Mc-Cready WG, Canard BC: Simple Kt/V formulas based on urea mass bilance theory. ASAIO J 1994; 40(4): 997-1004
47. Daugirdas JT, Depner TA, Greene T, Cheung AK, Gotch FA, Leypoldt JK: Dialyzer performance in the HEMO Study: in vivo KOA and true blood fl ow deter-mined from a model of cross-dialyzer urea extraction. ASAIO J 2004; 50(1):85-93
48. Eknoyan G, Gepald J, Cheung AK et al.: Effect of dialysis dose and membrane fl ux in maintenance he-modialysis. New Eng J Med 2002; 347:25
49. Uldall PR, et al.: Simplifi ed nocturnal home hemodi-alysis (SNHHD): a new approach to renal replace-ment therapy. J Am Soc Nephrol 1994; 5:428
50. Daugirdas JT, et al.: Handbook of dialysis, 3rd ed. Phil-adelphia:Lippincott Williams & Wilkins, 2001;670-676
51. Henderson LW: Hemofi ltration and the middle mol-ecule. Blood Purif 1999; 17:175-77
52. David S, Ferrari ME, Cambi V: Emofi ltrazioneTrattato Italiano di Dialisi. Wichting Editore- Giugno 1999; Sez.4, Cap3:25-42-67
53. Iorio L, Merola MB, Nacca RG: L’Emofi ltrazione con membrana in poliacrilonitrile – AN 69 – nel trattamen-to della ipertensione uremica non volume dipendenteAtti dei Simposi di Nefrologia e Dialisi ALaMMU Chieti 1981; 27-31
54. Ledebo I: Highly permeable membranes in dialysis: Optimal therapy design. Nephrology 1966; 2 (suppl 1):S178-S182
55. Ledebo I: Predilution hemofi ltration: a new technol-ogy applied to a old therapy. Artif Organs 1995; 18 (11):735-742
56. Leber HW, Wizemann V, Goubeaud G, et al.: Hemo-diafi ltration, an effective alternative to hemofi ltration and conventional hemodialysis in the treatment of uremic patients. Opuscula Medico-Technica Lunden-sia 1977; 18:107-17
57. De Francisco AL, Botella J, Escallada R, et al.: H with sorbent-regenerated ultrafi ltrate as replacement fl u-id: a multicenter study. Nephrol Dial Transplant 1997; 12:528-34
58. Ghezzi PM, Frigato G, Fantini GF, et al.: Theoretical model and fi rst clinical results of the Paired Filtration Dialysis (PFD). Life Support Syst 1983; 1(suppl): 271-4
59. De Nitti C, Giordano R, Gervasio R, et al.: Choosing new adsorbents for endogenous ultrapure infusion fl uid: performances, safety and fl ow distribution. Int J Artif Organs 2001; 24(11):765-76
60. Fasianos E, Saccheti A, Cataldi G, et al.: Hemodiafi l-tration with on-line reinfusion (on-line HFR) induces a minor loss of essential amino acids during hemo-dialysis treatment. Nephrol Dial Transplant 2003; 18 (suppl 4)193 (Abstract from the World Congress of Nephrology – June 8-12, 2003 Berlin)
61. Movilli E, Camerini C, Zein H, et al.: A prospective comparison of bicarbonate dialysis, hemofi ltration, and acetate-free biofi ltration in the elderly. Am J Kid-ney Dis 1996; 27:541-547
62. Redaelli B: Electrolite modelling in haemodialysis-potassium.Nephrol Dial Transplant 1996; 11:39-41
63. Splendiani G, Zazzaro D, Colombo R, et al.: Clinical experience after 6 months of treatment. The Interna-tional J Artifi cial Organs 1998; Vol 21/No 10 October, p.625
64. Splendiani G, Zazzaro D, Tullio T, et al.: Hemodi-alysis with two sequential hemodialyzers. American Journal of Nefrology 2000; 20:429-436
65. Splendiani G, Zazzaro D, Tullio T, et al.: A new tec-nique. The international J of Artifi cial Organs 2001; 24/No 2:70-78
66. NKF-DOQI Clinical Practice guidelines for hemodi-alysis adequacy. Am J Kidney Dis 1997; 30(Suppl): 515-63
Cap_01.indd 43Cap_01.indd 43 01/10/2007 12.03.4901/10/2007 12.03.49