INFEZIONI RESPIRATORIE · VI zione B, dedicata alle infezioni delle vie respiratorie superiori,...
-
Upload
hoanghuong -
Category
Documents
-
view
223 -
download
0
Transcript of INFEZIONI RESPIRATORIE · VI zione B, dedicata alle infezioni delle vie respiratorie superiori,...
INFEZIONI
RESPIRATORIE
EEEEERRRRRCOLECOLECOLECOLECOLE C C C C CONCIAONCIAONCIAONCIAONCIA
Direttore Divisione Clinicizzata
di Malattie Infettive
Università degli Studi di Verona
Copyright ©1999 Pharma Project Group s.r.l.Via Volonterio, 21 - 21047 Saronno (VA)
2° Edizione: Dicembre 2001
Realizzazione editoriale:Pharma Project Group Edizioni Scientifiche - Via Volonterio, 21- 21047 Saronno (VA)
Grafica ed impaginazione: Michela Solbiati
Finito di stampare nel mese di Dicembre 2001
ISBN: 88-86758-10-3
I diritti di traduzione, di riproduzione, di memorizzazione elettronica, di adattamento totale eparziale con qualsiasi mezzo (compresi i microfilm e le copie fotostatiche) sono riservati pertutti i Paesi.
NOTA:La Medicina è una scienza in continuo divenire. L’Autore e l’Editore di questa opera hannoposto ogni cura nel garantire la precisione dei dosaggi riportati, in accordo con le conoscenzescientifiche al momento della pubblicazione. Tuttavia, il medico dovrà sempre consultare leinformazioni contenute nella scheda tecnica che accompagna ciascun prodotto farmaceuticocitato, per assicurarsi che non siano sopraggiunte nuove controindicazioni e che i dosaggiraccomandati siano quelli realmente suggeriti dalle Aziende produttrici, in modo particolareper i farmaci di recente introduzione o raramente utilizzati.
E’ obiettivo dell’Editore produrre nel massimo rispetto dell’ambiente. Questo volumeè stato stampato su carta proveniente da foreste sostenibili e con tecnologie avanzate(CTP) che non necessitano della produzione di pellicole fotografiche.
IndiceIndiceIndiceIndiceIndice
Prefazione . . . . . . . . . . . . . . . . . . . . . . . . . . VPrefazione alla II Edizione. . . . . . . . . . . . VIIContributi fotografici . . . . . . . . . . . . . . . . IXSigle ed abbreviazioni. . . . . . . . . . . . . . . . XI
Sezione A
Diagnostica delle infezioni respiratorie
1. Indagini non invasive . . . . . . . . . . . . . . . 3Tampone faringeo. . . . . . . . . . . . . . . . . . . 4Tampone e lavaggio nasofaringeo. . . . . . . 5Valutazione dell’escreato. . . . . . . . . . . . . 6
Microscopia dell’escreato. . . . . . . . . . . 7Coltura dell’escreato. . . . . . . . . . . . . . . 8
Imaging. . . . . . . . . . . . . . . . . . . . . . . . . . . 82. Indagini invasive . . . . . . . . . . . . . . . . . . 13
Timpanocentesi. . . . . . . . . . . . . . . . . . . . 13Aspirato sinusale. . . . . . . . . . . . . . . . . . . 13Aspirato transtracheale. . . . . . . . . . . . . . 13Aspirato pleurico. . . . . . . . . . . . . . . . . . . 14Broncoscopia e lavaggiobroncoalveolare (BAL). . . . . . . . . . . . . . 14Biopsia polmonare e pleurica. . . . . . . . . 15
Sezione B
Infezioni delle vie respiratorie superiori
3. Raffr eddore comune. . . . . . . . . . . . . . . 19Epidemiologia. . . . . . . . . . . . . . . . . . . . . 19Etiologia . . . . . . . . . . . . . . . . . . . . . . . . . 19Presentazione clinica. . . . . . . . . . . . . . . . 21Trattamento. . . . . . . . . . . . . . . . . . . . . . . 21
4. Sinusite. . . . . . . . . . . . . . . . . . . . . . . . . . 23Epidemiologia. . . . . . . . . . . . . . . . . . . . . 23Etiologia . . . . . . . . . . . . . . . . . . . . . . . . . 23Diagnosi . . . . . . . . . . . . . . . . . . . . . . . . . 24Presentazione clinica. . . . . . . . . . . . . . . . 26
Trattamento. . . . . . . . . . . . . . . . . . . . . . . 265. Otite . . . . . . . . . . . . . . . . . . . . . . . . . . . . 29
Epidemiologia. . . . . . . . . . . . . . . . . . . . . 29Etiologia . . . . . . . . . . . . . . . . . . . . . . . . . 30Diagnosi . . . . . . . . . . . . . . . . . . . . . . . . . 31Presentazione clinica. . . . . . . . . . . . . . . . 32Trattamento. . . . . . . . . . . . . . . . . . . . . . . 32
Otite media acuta. . . . . . . . . . . . . . . . 32Otite media cronica . . . . . . . . . . . . . . . 33
6. Faringite . . . . . . . . . . . . . . . . . . . . . . . . . 35Epidemiologia. . . . . . . . . . . . . . . . . . . . . 35Etiologia . . . . . . . . . . . . . . . . . . . . . . . . . 36Diagnosi . . . . . . . . . . . . . . . . . . . . . . . . . 37
Diagnosi colturale. . . . . . . . . . . . . . . . 38Determinazione rapida dell’antigene. 38
Presentazione clinica. . . . . . . . . . . . . . . . 39Febbre reumatica . . . . . . . . . . . . . . . . 39Glomerulonefrite. . . . . . . . . . . . . . . . . 40Scarlattina. . . . . . . . . . . . . . . . . . . . . . 40
Trattamento. . . . . . . . . . . . . . . . . . . . . . . 40
Sezione C
Infezioni delle vie respiratorie inferiori
7. Bronchite . . . . . . . . . . . . . . . . . . . . . . . . 45Bronchite acuta. . . . . . . . . . . . . . . . . . . . 45Bronchite cronica. . . . . . . . . . . . . . . . . . 46Riacutizzazioni della bronchite cronica(AECB) . . . . . . . . . . . . . . . . . . . . . . . . . . 47Epidemiologia. . . . . . . . . . . . . . . . . . . . . 47Etiologia . . . . . . . . . . . . . . . . . . . . . . . . . 48Patogenesi. . . . . . . . . . . . . . . . . . . . . . . . 48Diagnosi e presentazione clinica. . . . . . . 50Trattamento. . . . . . . . . . . . . . . . . . . . . . . 52
Pattern infettivi . . . . . . . . . . . . . . . . . . 52Spettro antibatterico . . . . . . . . . . . . . . 53Meccanismo d’azione. . . . . . . . . . . . . 53
Penetrazione nei tessuti. . . . . . . . . . . . 53Modalità di somministrazione. . . . . . . 53Interazioni farmacologiche. . . . . . . . . 54Rapporto costo/efficacia. . . . . . . . . . . 54
8. Polmonite acquisita in comunità . . . . . 57Classificazione. . . . . . . . . . . . . . . . . . . . 57Epidemiologia. . . . . . . . . . . . . . . . . . . . . 58
Incidenza. . . . . . . . . . . . . . . . . . . . . . . 59Fattori di rischio e mortalità. . . . . . . . 59Andamento stagionale e fattoriambientali . . . . . . . . . . . . . . . . . . . . . . 60
Etiologia . . . . . . . . . . . . . . . . . . . . . . . . . 60Presentazione clinica. . . . . . . . . . . . . . . . 63Diagnosi . . . . . . . . . . . . . . . . . . . . . . . . . 64
Esame obiettivo. . . . . . . . . . . . . . . . . . 65Radiologia. . . . . . . . . . . . . . . . . . . . . . 65Reperti radiologici in pediatria. . . . . . 69Laboratorio . . . . . . . . . . . . . . . . . . . . . 70
Trattamento. . . . . . . . . . . . . . . . . . . . . . . 71Terapia empirica nell’adulto. . . . . . . . 72Terapia empirica nel neonatoe nel bambino. . . . . . . . . . . . . . . . . . . 73Terapia mirata nell’adulto . . . . . . . . . 73Durata e via di somministrazione. . . . 75Switching. . . . . . . . . . . . . . . . . . . . . . . 75Valutazione della risposta. . . . . . . . . . 76Profilassi . . . . . . . . . . . . . . . . . . . . . . . 76
9. Polmonite nosocomiale. . . . . . . . . . . . . 79Epidemiologia. . . . . . . . . . . . . . . . . . . . . 79Etiologia . . . . . . . . . . . . . . . . . . . . . . . . . 80Patogenesi. . . . . . . . . . . . . . . . . . . . . . . . 83Diagnosi e valutazione del rischio. . . . . 85Presentazione clinica. . . . . . . . . . . . . . . . 86Trattamento. . . . . . . . . . . . . . . . . . . . . . . 88
Monoterapia versus terapia combinata88Terapia sequenziale. . . . . . . . . . . . . . . 89
Sezione D
Infezioni respiratorie nell’AIDS e dapatogeni emergenti
10.Polmonite nel pazienteimmunocompromesso. . . . . . . . . . . . . . 93Diagnosi di polmonite nel pazientecon AIDS . . . . . . . . . . . . . . . . . . . . . . . . 96Quadri clinici . . . . . . . . . . . . . . . . . . . . . 99
Polmonite da Aspergillus . . . . . . . . . . 99Polmonite da Cytomegalovirus. . . . . 102Polmonite da Pneumocystis carinii. . 103
Trattamento del paziente conneutropenia febbrile. . . . . . . . . . . . . . . 105
Terapia combinata. . . . . . . . . . . . . . . 10611.Tubercolosi. . . . . . . . . . . . . . . . . . . . . . 109
Epidemiologia. . . . . . . . . . . . . . . . . . . . 109Fattori di rischio . . . . . . . . . . . . . . . . 112
Etiologia . . . . . . . . . . . . . . . . . . . . . . . . 112Patogenesi. . . . . . . . . . . . . . . . . . . . . . . 113
Tubercolosi primaria. . . . . . . . . . . . . 114Tubercolosi secondaria. . . . . . . . . . . 114Tubercolosi disseminata (miliare) . . . 114
Diagnosi . . . . . . . . . . . . . . . . . . . . . . . . 115Diagnosi microbiologica. . . . . . . . . . 115Test immunologici. . . . . . . . . . . . . . . 117Diagnosi radiografica. . . . . . . . . . . . 118
Presentazione clinica. . . . . . . . . . . . . . . 120Forma polmonare . . . . . . . . . . . . . . . 120Complicanze polmonari. . . . . . . . . . 120Tubercolosi extrapolmonare . . . . . . . 121
Trattamento. . . . . . . . . . . . . . . . . . . . . . 123Profilassi. . . . . . . . . . . . . . . . . . . . . . . . 125
Indice analitico . . . . . . . . . . . . . . . . . . . . . 127
V
PrefazionePrefazionePrefazionePrefazionePrefazione
Le infezioni respiratorie costituiscono una delle più importanti cause di morbilità nel-la popolazione generale; nei pazienti anziani, nei neonati e nell’immunocompromessosono ancora oggi gravate da elevata mortalità. Le variazioni demografiche intervenutenegli ultimi trent’anni nei paesi industrializzati hanno significativamente aumentato l’in-cidenza di tutte le malattie infettive.
Inoltre, l’aumento della sopravvivenza ottenuto nei pazienti neoplastici con protocollidi terapia antiblastica particolarmente aggressivi, il considerevole aumento dei trapiantie l’emergenza dell’AIDS hanno imposto un notevole tributo in termini di pazienti suscet-tibili. In quest’ultimo contesto, infezioni respiratorie con decorso benigno in soggettialtrimenti sani assumono particolare rilevanza. Le infezioni respiratorie sono inoltre ca-ratterizzate da notevole impatto economico. Benchè considerate di secondaria importan-za in termini di mortalità, esse sono gravate da elevata morbilità e costituiscono una dellepiù importanti cause di ore lavorative e scolastiche perse.
Il corretto approccio al paziente con infezione delle vie respiratorie richiede un’ampiaconoscenza dei quadri clinici, epidemiologici e delle tecniche diagnostiche: solo la cor-retta conoscenza dei pattern infettivi, l’incidenza locale dei ceppi resistenti ed una valu-tazione attenta dei reperti, consentono la scelta della terapia antibiotica più idonea. Inquesto volume abbiamo cercato di integrare questi dati in un quadro unico, al fine disemplificare gli interventi terapeutici. Per aiutare il lettore abbiamo cercato di illustrare esintetizzare nel modo più efficace gli aspetti clinici e diagnostici con l’ausilio di figure,tabelle e fotografie. La trattazione di infezioni sostenute da particolari patogeni, tipici diaree geografiche distanti è stata volutamente trascurata a favore di patologie più facil-mente riscontrabili nella pratica quotidiana; tuttavia, la crescente presenza nei nostri am-bulatori di soggetti di varie etnie ci ha indotto ad esaminare anche alcune infezioni rite-nute accademiche e secondarie fino a pochi anni fa.
Noi speriamo che questo Testo-Atlante sia di aiuto per tutti quei medici che, nellapratica quotidiana, sono coinvolti nella gestione del paziente con infezioni delle vie re-spiratorie. L’opera è stata suddivisa in quattro Sezioni, ciascuna costituita da vari capito-li: nella Sezione A sono state esaminate le più importanti procedure volte ad identificarei patogeni responsabili di infezione, con particolare riferimento alle tecniche diagnosti-che invasive che tanta parte hanno nella gestione del paziente ospedalizzato. Nella Se-
VI
zione B, dedicata alle infezioni delle vie respiratorie superiori, abbiamo iniziato la tratta-zione con le malattie influenzali per terminare con le tracheiti batteriche, includendo leinfezioni dell’orecchio medio e dei seni nasali. Particolare cura è stata riservata a quelleinfezioni che per frequenza, gravità o criticità delle scelte terapeutiche richiedono mag-giore vigilanza da parte del medico. Nella Sezione C sono state affrontate le infezionibronco-polmonari e le infezioni respiratorie nel paziente ospedalizzato. L’ultima sezioneè dedicata alla tubercolosi ed all’immunocompromesso. Per ciascuna patologia si è se-guito il medesimo ordine: aspetti epidemiologici e quantitativi, accertamenti diagnostici,quadri clinici ed interventi terapeutici. Particolare cura è stata posta nella ricerca e nellaselezione delle immagini. La diagnostica radiologica è stata supportata, quando utile, daimmagini TAC e di RMN. In qualche caso è stato possibile presentare il reperto istologi-co.
Riteniamo che strutturato in questo modo il volume possa essere di reale aiutoall’infettivologo, allo specialista in medicina respiratoria ed al pediatra. Tuttavia, lanostra esperienza ci dice che il ruolo del medico di medicina generale è fondamentale neltrattamento di infezioni che, quasi mai, sono fatali: la corretta e tempestiva diagnosieffettuata dal medico di famiglia consente un miglior utilizzo delle risorse ospedaliere edarreca minor disagio al malato ed ai suoi familiari. La preparazione di un’opera così riccadi dati ed immagini richiede la collaborazione di molte persone. Sento quindi il dovere diringraziare i Colleghi di varie istituzioni per la concessione ad utilizzare immagini senzale quali la realizzazione di questo volume non sarebbe stata possibile; la signora StefaniaLeonardi che si è interfacciata con diligenza con l’Editore; il dottor Paride Iannella,direttore editoriale, per avere gestito le varie fasi produttive dell’opera, adornandola diuna veste a dir poco sontuosa.
Verona, Aprile 1999
VII
Il successo ottenuto dalla precedente edizione di questo volume, testimoniato dallefrequenti richieste alle librerie e talvolta all’Editore stesso di nuove copie, mi ha indottoa preparare una edizione aggiornata e riveduta. L’impostazione generale dell’opera èrimasta invariata, ma alcuni aspetti di terapia sono stati riveduti alla luce dei nuovi far-maci disponibili e delle più recenti Linee Guida eventualmente rilasciate da varie Istitu-zioni.
Spero che il Lettore possa giovarsi di questo restyling che, oltre a modificare alcunicontenuti, ha anche dato un formato più moderno al materiale. Tutto ciò, ne sono certo,lo porterà ad apprezzare l’opera come in passato.
Verona, Dicembre 2001
Prefazione alla II EdizionePrefazione alla II EdizionePrefazione alla II EdizionePrefazione alla II EdizionePrefazione alla II Edizione
IX
Contributi fotograficiContributi fotograficiContributi fotograficiContributi fotograficiContributi fotografici
Dr. J. C. ButlerCenters for Disease Control and PreventionAtlanta, Georgia, USAFigura 10.11
Dr. R. D. deShazoUniversity of South Alabama College of MedicineDepartment of MedicineMobile, AL, USAFigura 4.2a
Prof. Dr. E. Thiel/Dr. S. SchwartzFreie Universität BerlinHämatologie, Onkologie und TransfusionsmedizinBerlin, GermanyFigure 1.13, 10.12, 10.14, 10.15, 10.16, 10.19
Massachusetts Medical Society1440 Main StreetWaltham, MAFigure 4.2a, 10.16
The University of Chicago Press5801 South Ellis AvenueChicago, ILFigura 10.11
XI
Sigle ed abbreviazioniSigle ed abbreviazioniSigle ed abbreviazioniSigle ed abbreviazioniSigle ed abbreviazioni
AECB: Acute Exacerbations of Chronic BronchitisAIPO: Associazione Italiana Pneumologi
OspedalieriAML: Acute Myeloid LeukemiaAOM: Acute Otitis MediaARC: AIDS Related ComplexASCO: American Society of Clinical OncologyASOT: Anti Streptolisin-O TitleATP: Adenosine TriphosphateATS: American Thoracic SocietyAUC: Area Under CurveBAL: Bronco-Alveolar LavageBCG: Bacillo di Calmette-GuerinBCYE: Buffered Charcoal Yeast Extractb.i.d.: Bis in dieBTS: British Thoracic SocietyBUN: Blood Urea NitrogenCAP: Community Acquired PneumoniaCDC: Centers for Disease ControlCFU: Colony Forming UnitsCHF: Congestive Heart FailureCML: Chronic Myeloid LeukemiaCOPD: Chronic Obstructive Pulmonary DiseaseCPA: Consorzi Provinciali AntitubercolariCSF: Colony Stimulating FactorEIA: Enzyme Immuno-AssayELISA: Enzyme-Linked Immunosorbent AssayEORTC: European Organization for Research and
Treatment of CancerGABHS: Group A Streptococcus β-hemoliticusGISTA: Gruppo Italiano di Studio per la Tuberco-
losi
HAP: Hospital Acquired PneumoniaICU: Intensive Care UnitIDSA: Infectious Disease Society of Americai.m.: Intramuscolarei.p.: Intraperitonealei.v.: IntravenosoMAC: Mycobacterium Avium ComplexMBC: Minimum Bactericidal ConcentrationMDR-TB: Multi Drug Resistent TuberculosisMIC: Minimum Inhibitory ConcentrationMOTT: Mycobacteria Other Than TuberculosisMRSA: Methicillin Resistant Staphylococcus
AureusNICU: Neonatal Intensive Care UnitNNIS: National Nosocomial Infection Surveil-
lancePCP: Pneumocystis carinii PneumoniaPCR: Polymerase Chain ReactionPEF: Picco Espiratorio ForzatoPPD: Purified Proteine DerivatePSB: Protected Specimen Brushingq.i.d.: Quater in dieRIA: Radio Immuno-AssayRMN: Risonanza Magnetica NucleareRSV: Respiratory Syncytial Virussc: SubcutaneousTAC: Tomografia Assiale ComputerizzataTB: Tubercolosit.i.d.: Ter in dieTU: Tuberculin UnitVAP: Ventilator Associated PneumoniaVES: Velocità di Eritrosedimentazione
3
Indagini non invasiveIndagini non invasiveIndagini non invasiveIndagini non invasiveIndagini non invasive
Capitolo 1
Il ruolo del laboratorio di mi-crobiologia nella diagnosi di in-fezione respiratoria è di impor-tanza cruciale, anche se nellaquasi totalità dei pazienti la te-rapia viene iniziata in modo em-pirico prima dell’identificazio-ne del patogeno. In questa Se-zione saranno passati in rasse-gna i test e le procedure di la-boratorio più utilizzate o piùutili, le loro limitazioni e le po-tenzialità future. Nei pazienticon forme più gravi risultanodi particolare aiuto procedurediagnostiche invasive che, perla difficoltà di esecuzione, sonoeseguite prevalentemente nelpaziente ospedalizzato: questesaranno trattate separatamen-te nel Capitolo 2, dedicato alla
TTTTTabella 1.1.abella 1.1.abella 1.1.abella 1.1.abella 1.1. Obiettivi e modalità diagnostiche nel management del paziente con infezione respiratoria. Il
valore relativo di ciascuna tecnica è classificato come molto buono (++), discreto (+), dubbio (+/-) ed irrilevan-
te (-).
Tecnica Obiettivi
Identificazione del patogeno Valutazione generale Valutazione della risposta
Esame obiettivo +/- ++ ++
Chimica clinica - ++ +
Microbiologia ++ - ++
Imaging + ++ ++
diagnosi delle infezioni dellebasse vie respiratorie.
Il ruolo del laboratorio nonè solo quello di confermare ladiagnosi clinica, identificandoi patogeni responsabili di infe-zione, ma supportare il clinicoper tutta la durata della malat-tia, aiutandolo a:• scegliere la terapia più adegua-
ta• verificare i miglioramenti e
l’eventuale guarigione• valutare le condizioni generali
del paziente.Quest’ultimo aspetto è es-
senziale per stabilire se il ma-lato può essere trattato a do-micilio o deve essere ospeda-lizzato (tabella 1.1). L’esamemicroscopico dell’escreato e la
coltura su piastra costituisco-no ancora oggi una pietra mi-liare nella diagnosi della mag-gior parte delle infezioni respi-ratorie. In taluni casi possonoessere necessarie colorazioni oterreni particolari ma, per lasensibilità e la rapidità dell’in-dagine, la microscopia e l’esa-me colturale rimangono quellipiù frequentemente richiesti allaboratorio di microbiologia.
Le indagini possono essere ditipo invasivo o non invasivo infunzione del reperto che si inten-de esaminare e del valore diagno-stico potenzialmente atteso. Que-sto, a sua volta, sarà richiesto dalclinico in relazione ad una seriedi parametri che spaziano dal tipoe dalla gravità dell’infezione, allo
INFEZIONI DELLE VIE RESPIRATORIE
4
stato generale del malato, alla pre-dittività della tecnica, alla facilitàe rapidità di esecuzione ed al co-sto complessivo connesso all’in-dagine. Per costo complessivodevono intendersi i costi di pre-lievo, conservazione, spedizioneed analisi dei campioni. In tabel-la 1.2 sono riportati i più frequen-ti campioni di valutazione per ladiagnosi microbiologica di infe-zione respiratoria e le relativeprocedure di prelievo.
Tampone faringeo
Il tampone faringeo è effettua-to prevalentemente per la ricer-ca dello Streptococcus pyogenes(β-emolitico di gruppo A). Lacavità orale deve essere ben illu-minata, con luce chiara posta allespalle dell’operatore che, tenen-do la lingua abbassata, guida iltampone fino al faringe posterio-re ed ai pilastri tonsillari (figura1.1). Dopo il prelievo, il tampo-ne viene conservato in una pro-
TTTTTabella 1.2.abella 1.2.abella 1.2.abella 1.2.abella 1.2. Materiali biologici, tecniche di prelievo e principali tipi di indagine nella diagnosi di infezione
respiratoria.
Campione Tipo di prelievo Tipo di indagine
Gram BAP CHOC-CO2 MAC PD CNA
Secrezioni faringee Tampone faringeo ✓ ✓
Secrezioni nasali Tampone/aspirato nasofaringeo ✓ ✓
Secrezioni dell’orecchio medio Timpanocentesi ✓ ✓ ✓ ✓ ✓
Essudato dei seni nasali Aspirato sinusale ✓ ✓ ✓ ✓ ✓ ✓
Escreato Induzione dello sputo ✓ ✓ ✓ ✓
Secrezioni tracheobronchiali Aspirato transtracheale ✓ ✓ ✓ ✓
Essudato pleurico Aspirato intercostale ✓ ✓ ✓ ✓ ✓
Secrezioni polmonari Lavaggio broncoalveolare (BAL) ✓ ✓ ✓ ✓ ✓
Tessuto pleurico/polmonare Biopsia pleurica/polmonare ✓ ✓ ✓ ✓
Sangue Prelievo venoso ✓ ✓ ✓
BAP=agar-sangue, CHOC-CO2=agar-cioccolato-CO2, MAC=Mac Konkey-agar, PD=agar con fecola di patate + destro-sio + antibiotici, CNA=agar-sangue + colistina + ac. nalidissico.
Figura 1Figura 1Figura 1Figura 1Figura 1.1..1..1..1..1. Tecnica di esecuzio-
ne del tampone faringeo. In molti
casi è possibile rilevare la presen-
za di differenti patogeni sui due
pilastri tonsillari.
vetta sterile ed inviato al labora-torio. Nel caso in cui l’obiettivodell’indagine sia esclusivamentelo Streptococco β-emolitico digruppo A (GABHS), il campio-ne deve essere mantenuto seccodurante il trasporto: una ridottatensione di H2O facilita infatti l’ar-ricchimento di questo microrga-nismo a scapito dei commensalieventualmente presenti1. E’ inol-tre utile “toccare” entrambe letonsille, poichè la flora microbi-ca può risultare differente neidue siti2.
Negli ultimi anni si è afferma-to l’uso di tamponi in poliesterein sostituzione di quelli in coto-ne; questi sono indispensabili percondurre la ricerca diretta del-l’antigene con l’impiego di anti-corpi fluorescenti (figura 1.2).Gli antigeni possono essere rile-vati per agglutinazione, coagglu-tinazione o reazione ELISA conuna specificità dell’85-98%3,4. Ilpunto di forza della ricerca di-retta dell’antigene è costituito
dalla rapidità di esecuzione deltest (15-20 minuti). Tuttavia, poi-chè la sensibilità è compresa frail 60 ed il 90%, è utile prelevareun campione doppio, uno per laricerca diretta dell’antigene ed unsecondo per l’accertamento col-
1. INDAGINI NON INVASIVE
5
turale, nell’evenienza che il pri-mo risulti negativo. Questa pro-cedura, nel caso in cui il micror-ganismo ricercato sia il GABHS,è raccomandata dall’AmericanAcademy of Pediatrics, che haripetutamente sottolineato l’im-portanza della conferma colturaledopo test dell’antigene negativose il paziente presenta un quadroclinico suggestivo di faringite daStreptococco β-emolitico digruppo A5. Alcuni Autori hannorecentemente riportato la possi-bilità di prelevare ed evidenziarecon il tampone faringeo anchepatogeni “atipici”, quali C. pneu-moniae e M. pneumoniae6. Tut-tavia, allo stato attuale, questaprocedura si rivela troppo lungae costosa, richiedendo passaggimultipli e l’inoculo di linee cellu-lari selezionate.
Tampone e lavaggionasofaringeo
La raccolta delle secrezioninasofaringee costituisce una tec-
Figura 1.3.Figura 1.3.Figura 1.3.Figura 1.3.Figura 1.3. L’aspirazione del li-
quido di lavaggio del nasofaringe
viene eseguita prevalentemente
nei soggetti immunocompromessi
con presunta infezione da virus
respiratori. Il soggetto, preceden-
temente istruito sulla manovra, è
tenuto in posizione supina con il
capo leggermente reclinato all’in-
dietro.
Figura 1.2. Figura 1.2. Figura 1.2. Figura 1.2. Figura 1.2. Test di agglutinazione su Latex® per la ricerca diretta del-
l’antigene.
nica oggi poco usata per la scar-sa attendibilità microbiologicadel reperto. Il campione è otte-nuto con l’aiuto di un tamponeflessibile che viene inserito inuna narice e sospinto lungo il set-to nasale fino al faringe poste-riore. L’otite media e la pertossecostituivano nel passato indica-zione al tampone nasofaringeo:questa indagine è stata oggi so-stituita, nei casi di otite media pu-rulenta e refrattaria al trattamen-to, dalla timpanocentesi. La vac-cinazione contro la pertosse e ladisponibilità di antibiotici attivicontro queste due patologie nehanno ulteriormente ridottol’uso.
Nel caso in cui la ricerca siadiretta ad identificare un virusrespiratorio quale responsabile difaringite o sinusite, il tamponenasofaringeo è sostituito dal li-quido di lavaggio del nasofarin-ge (figura 1.3). Il materiale di la-vaggio è ottenuto facendo arri-vare una sottile cannula di polie-tilene al faringe posteriore. At-
traverso una siringa vengono in-stillati 10-20 mL di soluzione sa-lina, facendo attenzione che la te-sta del paziente sia sufficiente-mente reclinata per evitare re-flusso nella cavità nasale. Il li-quido viene quindi riaspirato echiuso in un contenitore sterileper colture virali. Il campionepuò essere inoculato su mono-strati di linee cellulari sensibiliall’effetto citopatico dei poten-ziali patogeni (Hep2, cellule re-nali di scimmia, etc); in alterna-tiva può essere sottoposto a co-lorazione con anticorpi fluore-scenti per la ricerca diretta del-l’antigene. Questa procedura sidimostra particolarmente utileper la rilevazione del virus respi-ratorio sinciziale (RSV), del vi-rus influenzale A e, più recente-mente, di Pneumocystis cariniie Legionella pneumophila (figu-ra 1.4)
INFEZIONI DELLE VIE RESPIRATORIE
6
Valutazionedell’escreato
L’escreato costituisce il cam-pione più frequentemente invia-to al laboratorio di microbiologiaper l’isolamento di patogeni re-spiratori in corso di bronchitecronica e polmonite. Benchèmolti studi abbiano sottolineatola scarsa predittività di questoreperto, esso costituisce ancorail primo step diagnostico nelle in-fezioni delle basse vie respirato-rie7,8. In realtà la bontà dei cam-pioni di escreato è correlata alla
co. Il campione deve essere pre-levato al risveglio, quando la con-centrazione batterica è massimae deve essere preceduto da gar-garismo con acqua per “decon-taminare” il cavo orale. Il pazien-te è disteso su un lato e poggia illabbro inferiore sul bordo delcontenitore per minimizzare lacontaminazione ambientale. Sedopo i primi tentativi il materialenon è ritenuto sufficientementerappresentativo, il paziente puòessere aiutato ad espettorare piùprofondamente con l’ausilio diun nebulizzatore ad ultrasuonicaricato con soluzione salina al3%. La qualità del campione èimmediatamente verificabile dal-l’operatore (figura 1.5).
I campioni ottenuti devono es-sere testati entro 4-6 ore. Nono-stante la corretta esecuzione delprelievo, il 15-30% dei campionipresenta contaminazione orofa-ringea. E’ buona norma, quindi,prima di inoculare i terreni dicoltura, eseguire un esame mi-croscopico preliminare con lacolorazione di Gram per stabili-re l’entità dell’eventuale conta-minazione e, se questa superadeterminati valori, richiedere unnuovo campione. La valutazione
Figura 1.5.Figura 1.5.Figura 1.5.Figura 1.5.Figura 1.5. L’escreato si presenta con colorazione, densità e viscosità
differente in rapporto al patogeno ed alla gravità della malattia. Il colore
varia dal giallo paglierino (A) al ruggine (B).
A B
Figura 1.4.Figura 1.4.Figura 1.4.Figura 1.4.Figura 1.4. Marcatura con anticorpi fluorescenti di secrezioni nasofaringee ottenute con la procedura descrit-
ta nel testo. In (A) sono riportate le tracce lasciate da anticorpi fluorescenti anti-RSV; in (B) sono stati colorati
con la stessa tecnica alcuni ceppi di L. pneumophila.
AB
correttezza della tecnica di ese-cuzione che, a sua volta, dipen-de molto dalla collaborazione delpaziente. I tre fattori limitanti con-nessi all’ottenimento di un cam-pione di escreato di buona quali-tà sono:• contaminazione orofaringea• difficoltà a produrre secrezio-
ni profonde• difficoltà ad ottenere campio-
ni in quantità adeguata.Queste limitazioni possono es-
sere parzialmente superate conadeguato supporto al malato daparte del personale infermieristi-
1. INDAGINI NON INVASIVE
7
TTTTTabella 1.3.abella 1.3.abella 1.3.abella 1.3.abella 1.3. Sistemi di classificazione di Bartlett e Murray per valuta-
re la qualità dei campioni di escreato. In entrambi i casi l’osservazione
viene condotta previa colorazione di Gram a basso ingrandimento (10x)
contando le cellule in almeno 20 differenti campi.
Sistema di Bartlett Sistema di Murray
Parametri Score Parametri
Neutrofili Neutrofili Cell. epiteliali
<10 0 <10 >25
10-25 +1 10-25 >25
>25 +2 >25 >25
Muco +1 >25 10-25
Cell. epiteliali
10-25 -1 >25 <10
>25 -2
TTTTTabella 1.4.abella 1.4.abella 1.4.abella 1.4.abella 1.4. Colorazioni impiegate in microscopia ottica per l’esame di campioni provenienti dalle vie
respiratorie.
Morfologia generale Morfologia per gruppi Colorazioni specie-specifiche
Wright-Giemsa Gram+ Blu-metilene Ziehl-Neelsen Fluorocromo Ab-fluorescenti Sonde DNA
Screening primario Stafilococchi C. diphtheriae Micobatteri Micobatteri C. trachomatis Cytomegalovirus
Inclusioni virali Streptococchi P. carinii Nocardia Funghi B. pertussis Adenovirus
Parassiti Bacilli Funghi L. pneumophila H. simplex
P. carinii P. carinii
T. gondii
preliminare dei campioni diescreato si basa sull’osservazio-ne al microscopio di 3 parame-tri:• muco• neutrofili• cellule epiteliali.
Muco e neutrofili costituisco-no indici positivi, poichè indica-no rispettivamente che il campio-ne origina dalle zone più distalidell’albero bronchiale (muco) edin prossimità del focolaio infiam-matorio (neutrofili). Viceversa, lapresenza di cellule epiteliali squa-mose è indice di contaminazionesalivare. Negli ultimi 20 annisono stati proposti vari sistemidi screening dell’escreato9-11:quelli più adottati sono il sistema
a punti di Bartlett ed il sistema diMurray (tabella 1.3).
Nel sistema di Bartlett, un pun-teggio ≤0 denota la presenza dicontaminazione orofaringea didimensioni tali da invalidare ilcampione; un punteggio 1-3 in-dica la presenza di potenzialecontaminazione, benchè il cam-pione sia giudicato idoneo per lacoltura; un punteggio ≥3 identi-fica campioni idonei per accer-tamenti colturali, di tipizzazionee per i test di sensibilità. Nel me-todo di Murray il muco non co-stituisce elemento di valutazioneed i campioni sono suddivisi in 5gruppi. Inoltre, l’efficacia dia-gnostica di ciascun gruppo nonè correlata al valore assoluto di
neutrofili e cellule epiteliali ma alloro rapporto. Con questo siste-ma di classificazione solo i re-perti appartenenti al Gruppo 5vengono ritenuti significativi esottoposti a coltura. Stabilita l’at-tendibilità del reperto, l’escreatopuò essere sottoposto ad ulterioriindagini microscopiche e coltu-rali (tabella 1.4 e figura 1.6).
Microscopia dell’escreato
La colorazione di Gram con-sente un primo screening. Ulte-riori chiarimenti microscopicigiungono, contemporaneamenteall’accertamento colturale, conl’impiego di altre colorazioni (ta-bella 1.4).
La fucsina basica fenicata acaldo (Ziehl-Neelsen) attraversala parete con elevato contenutodi lipidi e cere di micobatteri efunghi. Questa, una volta assor-bita, non è più asportata dal la-vaggio con alcool ed acidi inor-ganici, permettendo il rilevamen-to dei bacilli colorati (fucsia) sulblu di metilene impiegato comecontrasto. Mycobacterium tuber-culosis costituisce il target tipi-co di questa colorazione (figura1.7). Varianti di questa tecnicasono utili per l’identificazione diNocardia asteroides e Rhodococ-cus.
INFEZIONI DELLE VIE RESPIRATORIE
8
Figura 1.6.Figura 1.6.Figura 1.6.Figura 1.6.Figura 1.6. Streptococcus pneumoniae (A) appare intensamente colorato e forma caratteristici agglomerati
“a catena”. Attorno ad alcuni elementi singoli sono visibili aree chiare (frecce) costituite dai componenti muco-
polisaccaridici della capsula esterna. In (B) si possono osservare numerose colonie su terreno BCYE di Legionel-
la pneumophila.
A
Figura 1.7.Figura 1.7.Figura 1.7.Figura 1.7.Figura 1.7. Escreato colorato con Ziehl-Neelsen (x 160). Si
notano in fucsia bacilli inframezzati a leucociti.
L’arancio di acridina è impie-gato nella colorazione di moltimicrorganismi difficilmente evi-denziabili con altre tecniche, so-prattutto in strisci di sangue nelpaziente con batteriemia. L’acri-dina attraversa la parete cellula-re di Gram positivi e negativi elega il DNA, emettendo fluore-scenza arancione quando il cam-pione è illuminato da luce a bas-sa lunghezza d’onda (figura1.8).
Nella pneumocistosi l’impie-go della colorazione argenticacon metenamina secondo Gomo-ri-Grocott e la colorazione con
Figura 1.8.Figura 1.8.Figura 1.8.Figura 1.8.Figura 1.8. Coppie di stafilococchi in un campione
di sangue colorati con arancio di acridina.
B
blu di toluidina consentono di evi-denziare le cisti del protozoo:queste appaiono delle dimensio-ni di 6-8 µ, contenenti al loro in-terno numerosi corpuscoli intra-cistici (figura 1.9).
Coltura dell’escreato
L’escreato viene coltivato inprima battuta su agar-sangue;questo terreno consente la cre-scita della maggior parte dei pa-togeni respiratori. H. influenzaeviene coltivato su agar-sangue dicavallo con colistina ed acido na-lidissico (CNA). Nella figura 1.6sono riportati i risultati colturali
dell’escreato di pazienti affetti dainfezione delle vie respiratorie in-feriori sostenute da S. pneumo-niae e Legionella pneumophila.L’importanza di campioni corret-tamente prelevati è chiaramentevisibile in figura 1.10.
Imaging
Le tecniche radiografiche co-stituiscono lo standard di riferi-mento per la diagnosi di infezio-ne polmonare. La diagnosi di pol-monite deve essere formulatasulla base della triade: opacità pol-monare più almeno due segni
1. INDAGINI NON INVASIVE
9
Figura 1.10.Figura 1.10.Figura 1.10.Figura 1.10.Figura 1.10. Campione di escreato non significativo per la presenza di
numerose cellule epiteliali con molteplici specie commensali. Questo cam-
pione non soddisfa i parametri di Bartlett per la totale assenza di neutro-
fili e muco: l’osservazione microscopica a fresco ha evitato un accerta-
mento colturale privo di valore diagnostico.
Figura 1.9.Figura 1.9.Figura 1.9.Figura 1.9.Figura 1.9. Cisti di P. carinii colorate con metenamina-argento (x 480).
Il dettaglio della singola cisti, con diversa colorazione, è evidente nella
figura 10.20 (pag. 108).
Figura 1.11. Figura 1.11. Figura 1.11. Figura 1.11. Figura 1.11. Opacità polmonare
con aree di cavitazione secondaria
a TB post-primaria.
obiettivi. E’ inoltre noto il ruolodeterminante svolto dal radiolo-go fin dall’inizio di questo seco-lo nella diagnosi e nel monitorag-gio della tubercolosi. Nonostan-te l’introduzione di tecniche diimaging dotate di maggior defi-nizione, l’Rx torace rimane persemplicità ed economicità l’esa-me più richiesto. Opacità polmo-
nari possono essere generate daprocessi infettivi, neoplasie, ede-mi ed infiammazioni; nei pazien-ti anziani, in quelli immobilizzatinei quali è necessario l’impiegodi apparecchiature portatili ed inquelli con edema polmonare edenfisema, l’interpretazione dellaradiografia del torace può risul-tare particolarmente complessa.
L’interpretazione del radiogram-ma deve essere eseguita con-giuntamente all’esame fisico edall’anamnesi. Nella maggior partedei casi è impossibile stabilirel’etiologia sulla base dei soli re-perti radiografici, benchè alcuniquadri indirizzino la diagnosi ver-so particolari microrganismi: lecavitazioni del lobo superiore daMycobacterium tuberculosis ed ipneumatoceli da Staphylococcusaureus sono ben noti (figure1.11, 1.12 e 1.13).
Le principali caratteristiche ra-diografiche della polmonite sonoriportate nel Capitolo 8 e riassun-te in tabella 8.7 (pag. 68). Sfor-tunatamente in molti casi è pos-sibile rilevare, per infezioni so-stenute dallo stesso microrgani-smo, l’intero spettro dei poten-ziali quadri radiologici: nelle pol-moniti da Mycoplasma pneumo-niae è possibile osservare inte-ressamento alveolare, interstizialeo contemporaneamente alveolareed interstiziale in rapporto all’etàed allo stadio della malattia. Al-cune caratteristiche radiografi-che sono inoltre significativa-



























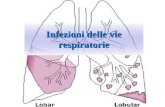
![Ministero Della Salute Uso Corretto degli Antibiotici · principalmente per infezioni delle vie respiratorie [9, 14, 15]. ... (BPCO) con aumento dell’espettorato, gli ... [22–24]](https://static.fdocumenti.com/doc/165x107/5c6ff3ec09d3f29a798c51bb/ministero-della-salute-uso-corretto-degli-antibiotici-principalmente-per-infezioni.jpg)