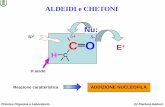
ALDEIDI&e&CHETONI& R CO R - Omero - Il database della...
Transcript of ALDEIDI&e&CHETONI& R CO R - Omero - Il database della...
Addizione Nucleofila in ambiente BASICO
addoFo tetraedrico
Addizione Nucleofila in ambiente ACIDO
addoFo tetraedrico
Ordine di Stabilità 1) Gruppi ELETTRON DONATORI aumentano la densità ele6ronica sul carbonio
carbonilico (riducono la parziale carica posi@va) lo rendono meno reaBvo 2) I gruppi R ingombran@ nel carbonio sp2 si dispongono più lontani tra loro
(SPINTA STERICA), per cui c’è meno tendenza a formare l’addo6o tetradrico il gruppo carbonilico è meno reaBvo
Le aldeidi sono più rea:ve dei chetoni
O
R R
O
R H
O
H Hterziario > secondario > primario
O
R R
O
R H
O
H H
chetone > aldeide > formaldeide
I composI aromaIci sono più stabili dei corrispondenI composI alifaIci
O O
H3C
O
H3C CH3
O O
H3C
O
H3C CH3
O
H
O
H CH3
O
H
O
H CH3
stabilità stabilità
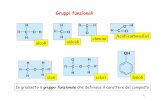
Reazioni di addizione nucleofile al carbonile (aldeidi e chetoni)
• Formazione di GEM-‐DIOLI • Formazione di emiacetali e acetali • Formazione di immine ed enammine • Riduzione • Ossidazione • Addizione di reaBvi di Grignard
Gem-‐Dioli I gem-‐dioli si formano degli aldeidi o chetoni per addizione di H2O . L’idratazione di un aldeide o chetone è catalizzata sia da acidi che da basi. L’equilibrio è generalmente spostato verso la forma non idrata, con l’eccezione della formaldeide e altre aldeidi par@colarmente reaBve.
H3C CH3
O
H3C CH3
HO OHH2O
(0.1%)(99.9%)
H H
O
H HHO OHH2O
(99.9 %)(0.1 %)H3C H
O
H3C HHO OHH2O
(58%)(42%)
H3C CH3
O
H3C CH3
O H
H3C CH3
O H
OH
H
O HCH3H3C
OH H O
H
H
HOH
H
OHCH3H3C
OH+ H3O+
H3C CH3
O
H3C CH3
O
OH
OCH3H3C
OH
OHH
OHCH3H3C
OH+ HO-
ambiente ACIDO
ambiente BASICO
Acetali ed Emiacetali
R-OH R-OH2H+catalisi ACIDA
H3C CH3
O
H3C CH3
O H
OH
R
O HCH3H3C
OR H O
H
R
HOR
HOH
CH3H3COR
+ ROH2+
emiacetale
La reazione prosegue
O RCH3H3C
OR H O
H
R
OR ORCH3H3C
OH H O
H
R
ROH
HCH3H3COH
H3C CH3
O R ORCH3H3C
OR+ ROH2+
H3C CH3
O R
H3C CH3
O R
Intermedio “chiave”
acetale
NB: E’una reazione di equilibrio
OHCH3H3C
OR+ RO-
catalisi BASICA
emiacetale
NB: in ambiente BASICO la reazione non prosegue perchè non è possibile la formazione dell’intermedio “chiave”
R-OH R-OBase
H3C CH3
O
OR
OCH3H3C
OR
OHR
IMP: in ambiente BASICO gli ACETALI sono STABILI
Gli EMICETALI sono sempre in EQUILIBRIO con la forma carbonilica (sia in ambiente acido che basico), la forma carbonilica prevale ecce6o nel caso in cui la reazione sia INTRAMOLECOLARE e dia origine ad un ciclo a 5 o 6.
O
tetraidropirano
O
tetraidrofurano
O
CH3OH
O OHCH3
OOH+
H+ o OH- CH3
O H
O
H
H+ o OH- O OHH +
O HOH
coppia di enantiomeri
R-NH2 R-NH3H+ NB: la quanItà di acido DEVE essere CATALITICA
H3C CH3
O
H3C CH3
O H
NHH
N HH R H
R
O HCH3H3C
NH2R
R-NH2 O HCH3H3C
NHR
+ R-NH2
H
OCH3H3C
NHR
+ R-NH2
HH
H3C CH3
N HR
H3C CH3
N HR
+ R-NH2 + H2O
H3C CH3
N R+ R-NH3
IMMINE
IONE IMMINIO
amminale
IMMINA
Ammina 1°
Importanza delle Immine dal punto di vista biologico
(vitamina A) Proteina della re@na
L’assorbimento di fotoni isomerizza il doppio legame da cis a trans generando l’impulso
ENAMMINA
Amminazione Ridu:va
O
H3C CH3+
R N R
H
ammina 2°H3C CH3
NR
H3C CH2
N+ R-NH2
R
H3C CH2
NR R
H
R-N-R+R RH
Rα
RIDUZIONE
O
R H<H>
R HOH
HRid.
Aldeide Alcol 1°
O
R R'<H>
R HOH
R'Rid.
Chetone Alcol 2°
Riduzione CataliIca
H
O H2/PdH
OH
H
O
H2/Pt
OH
H BH
HH
HB
H H
H+
H2O
O
R R
δ-
δ+
OR RH
R RO
H
BH
HH
(R-CH-O)4BR
R-CH-OHR
+ B(OH)3
Riduzione con Idruri
O
R R'
1)NaBH4/MeOH
2) H2O/H+R H
OH
R'
O
R R'
1)LiAlH4/THF
2) H2O/H+R H
OH
R'
Meccanismo
Trialchil-‐borato )
HBH
H H NaHAlH
H H Li
OSSIDAZIONE Ossidazione delle Aldeidi con Anidride Cromica
L’ossidazione dei chetoni avviene in condizioni molto più dras@che e coinvolge la ro6ura di legami carbonio-‐carbonio.
Rea:vo di Tollens
CHO
3-metil-pentanale
CrO3
H2SO4COOH
Acido 3-metil-pentanoico
Ag+NO3- + 2NH3 Ag(NH3)2+ + NO3-
Ossidazione delle Aldeidi con Sali d’Argento
CHOAg2O
NaOH/H2O
COO Na
benzaldeide benzoato di sodio
+ Ag0 R-CHOAg(NH3)2+
H2O/NH3R-COO NH4 + Ag0