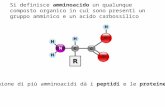
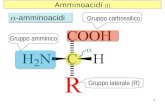
Alanina Una coppia di amminoacidi può legarsi attraverso una reazione di condensazione fra il...
-
Upload
cleto-berardino -
Category
Documents
-
view
218 -
download
1
Transcript of Alanina Una coppia di amminoacidi può legarsi attraverso una reazione di condensazione fra il...

alanina
Una coppia di amminoacidi può legarsi attraverso una reazione di condensazione fra il gruppo carbossilico di un amminoacido e il gruppo amminico dell'altro, in modo da formare un dipeptide
alanina
+
glicina

+ H3N
1° aa
2° aa
3° aa
4° aa
5° aa

Il legame ammidico si forma per condensazione
Unisce il carbonile CO a NH
Può essere ripetuto moltevolte
Il legame ha una direzione N C
L’idrolisi del legame peptidico avviene molto lentamente per l’elevata energia di attivazsione, anche se è una reazione esoergonica
+ H2O
+ H2O

Risonanza
•Le parziali caratteristiche di doppio legame impediscono la libera rotazione attorno al legame peptidico, C-N, che costituisce così un punto di rigidità della catena polipeptidica.
•La barriera energetica che si oppone alla libera rotazione è circa 20 kcal/mole (84 kJ/mole).


Studi di diffrazione ai raggi X hanno mostrato che nel gruppo peptidico
• il legame C-N è più breve (1.33 Å) di un normale legame C-N (1.46 Å)
•il legame C=O è leggermente più lungo (1.24 Å) di un normale doppio legame C=O (1.20 Å).
Il legame peptidico ha quindi parziali caratteristiche di doppio legame (oltre il 40%), mentre il doppio legame C=O si comporta in parte (40%) come un legame singolo.
Tutto ciò trova giustificazione nel fenomeno della risonanza del gruppo peptidico fra due strutture limite



Angoli di torsione dello scheletro covalente di un polipeptide
Sono mostrati 2 gruppi peptidici planari.
Le sole rotazioni possibili sono intorno al legame C-N () e intorno al legame C-C ()
Per convenzione gli angoli e sono uguali a 180° quando il peptide è nella conformazione completamente estesa e tutti i gruppi peptidici sono sullo stesso piano

Interferenze steriche tra gruppi peptidici adiacenti
Una rotazione può portare a una conformazione in cui l’atomo di H ammidico di un residuo e l’atomo di O carbonilico del residuo successivo sono più vicini delle loro distanze di van der Waals

La conformazione nello spazio dello scheletro della proteina (sequenza ripetuta N-C-C)è determinata dagli angoli di questi legami:
• phi (φ) rappresenta l’angolo del legame N-C• psi (ψ) rappresenta l’angolo del legame C-C• omega (Ω) rappresenta l’angolo del legamepeptidico che assume quasi sempre un valoredi 180° e quindi è “planare”.
La distribuzione degli angoli phi e psi per gli aminoacidi di una particolare proteina è rappresentata tramite il grafico Ramachandran plot.Analisi delle collisioni degli atomi considerandoil raggio di van der Waals.Zona rossa: nessuna collisione.Zona gialla: al limite della collisione.Zona bianca: collisione tra atomi se presenti certi angoli phi e psi.

Ogni conformazione rispetto agli angoli diedri è caratterizzata da una propria energia
Il grafico di Ramachandran rappresenta l’energia potenziale in funzione di coppie di valori φ e ψ per ciascun aminoacido
Le conformazioni considerate possibili sono quelle che non presentano o presentano poche interferenze steriche, basate su calcoli in cui sono utilizzati i raggi di van der Waals e gli angoli di legame

La Gly non ha impedimenti sterici e presenta la zona permessa più grande

Peptidi e proteine
• Sono polimeri lineari di 20 tipi di monomeri
• Peptidi: polimeri più piccoli (5.000 Dalton)
– Di-, tripeptidi (2, 3 aa)
– Oligopeptidi (< 10 aa)
– Polipeptidi (> 10 aa)
• Proteine: polimeri più lunghi (50-2700 aa) con una struttura definita.




Struttura primaria
Ordine con cui gli amminoacidi si susseguono nella catena polipeptidica
L'ordine con cui gli amminoacidi si susseguono nella catena non è casuale, ma è rigorosamente immutabile per ogni particolare proteina di un organismo.
Ogni proteina ha in ogni individuo appartenente alla stessa specie sempre la stessa composizione in amminoacidi, legati l'uno all'altro sempre con lo stesso ordine.
Ribonucleasi: Mr 13000 aa, 124 aa., secreta dal pancreas.Catalizza l’idrolisi di acidi nucleici ingeriti con la dieta

Struttura Primariasequenza degli aa dall’N-terminale al C-terminale

Struttura Primaria dell’insulina
ponti disolfurici

Struttura secondaria
Conformazione locale che assumono tratti più o meno lunghi della catena polipeptidica.
• La conformazione della catena è fortemente condizionata dalle restrizioni cui devono sottostare le coppie di angoli diedrici, ψ e ϕ È quindi è in buona parte correlata con la sequenza amminoacidica (struttura primaria) della proteina.
• Un altro contributo determinante all’organizzazione conformazionale della catena deriva dalla tendenza a generare ripiegamenti che consentano di ottimizzare la formazione di legami a ponte di idrogeno intracatena.

Fattori che determinano la struttura secondaria di una proteina e
che hanno l'effetto di rendere minima l'energia potenziale della
molecola
• minimizzazione dell'ingombro sterico fra i gruppi R
• ottimizzazione della formazione di legami H intracatena
Il risultato di queste restrizioni fa sì che gli elementi di struttura
secondaria si possano ricondurre sostanzialmente a tre diverse
tipologie stabili:
α-elica
strutture β
anse o ripegamenti (loop)


• L‘-elica si forma quando un certo numero di coppie successive di angoli diedrici, ψ e ϕ, hanno valori compresi fra -60° e -50°.
In questo modo i piani peptidici si dispongono in maniera elicoidale intorno ad un asse longitudinale
• L' -elica ha un passo di 5.4 Å e ogni spira dell'elica è costituita da 3.6 residui amminoacidici.
L'eccezionale stabilità di questa conformazione dipende dal fatto che tutti gli NH e i C=O dei gruppi peptidici sono impegnati in legami a ponte di idrogeno.Ogni legame a H si forma fra l'idrogeno dell' NH di un residuo e l'ossigeno del C=O del quarto residuo successivo. La direzione dei legami a H è pressoché parallela all'asse dell'elica


• L' -elica presente nelle proteine è quasi sempre destrorsa (l'andamento è quello della filettatura di una vite tradizionale)
Gli amminoacidi proteici sono tutti nella configurazione "L" e in un'elica sinistrorsa i gruppi laterali R risulterebbero troppo vicini ai gruppi C=O, destabilizzando l'elica.
• Le catene laterali R dei residui amminoacidici sono tutte rivolte verso l'esterno dell'elica. La polarità di questi gruppi influenzerà il modo in cui le strutture ad -elica si disporranno a costituire la struttura terziaria della proteina.
• Alcuni amminoacidi sono considerati "buoni formatori" di -eliche, altri, quali la prolina e la glicina, possono invece destabilizzare l'elica provocandone un ripiegamento.La prolina, ad es., avendo il gruppo R richiuso ad anello sull'N imminico, non ha un NH che possa formare un legame a H e a causa dell'anomalo ingombro sterico del proprio gruppo laterale, costringe il piano peptidico ad assumere angoli diedrici non idonei alla formazione dell'α-elica.

Modello spaziale di una -elica
Carbonio
Azoto
Ossigeno
Idrogeno
Le catene laterali ( ) si proiettano verso l’esterno dell’elica

L’avvolgimento dell’elica consente l’interazione tra la catena laterale di un aa e quella del residuo distante 3 residui. Due aa aromatici possono essere distanziati di 3 aa per generare una interazione idrofobica. Gli aa carichi + possono essere distanziati di 3 residui da aa carichi – per formare interazioni ioniche

Ava Helen and Linus Pauling standing beside a model of the alpha helix. AP News features photo. Photographer unknown. 1963

• È fatto da due o più regioni differenti di almeno 5-10 amminoacidi
• È stabilizzato da legami H tra NH e CO di legami peptidici di segmenti adiacenti
• I beta sheet sono pieghettati: i carboni alfa del legame alternano tra sopra e sotto il piano del foglio
• Possono essere paralleli o antiparalleli
Foglietto pieghettato(Beta-sheet)

Le strutture β
I tratti della catena peptidica a conformazione β sono distesi in una struttura con andamento a zig-zag dei piani peptidici. I residui laterali sono diretti perpendicolarmente al piano mediano della struttura, orientandosi in maniera alternata da un lato o dall'altro del piano
Due o più filamenti beta (β-strands) tendono ad affiancarsi lateralmente e, formando legami a ponte di idrogeno fra di loro, generano strutture estese, pieghettate, dette foglietti β
Nelle strutture β, i legami a H si formano quindi fra tratti di catene affiancate, anziché fra residui vicini del medesimo tratto, come nell'α-elica

Normalmente i foglietti β non sono planari, ma tendono ad assumere nell'insieme una forma incurvata e lievemente "avvitata"




La distribuzione (pattern) dei ponti idrogeno è differente nel caso dei foglietti paralleli e antiparalleli.
I foglietti paralleli sono più instabili in quanto i ponti-H sono distorti in tensione (sempre interni alla catena polipeptidica, non esposti)
I foglietti antiparalleli sono più stabili e più esposti in superficie.
Ciascun aminoacido di un filamento interno di un foglietto β forma due ponti idrogeno con gli aminoacidi “adiacenti”, mentre gli aminoacidi dei filamenti esterni solo un ponte.
Gli angoli phi e psi degli aminoacidi in unfoglietto β variano notevolmente in unaregione precisa del Ramachandran plot.La predizione della localizzazione dei foglietti βè molto più complessa di quella delle -eliche.

•Sono relativamente flessibili e, soprattutto, consentono cambi di direzione, anche repentini, alle sequenze a conformazione e β.•Molto comuni sono i brevi loop di 3-5 residui che collegano due filamenti β consecutivi, orientati in modo antiparallelo (β-turns).•Inoltre, i loop partecipano spesso alla formazione di siti di legame (vedi loop "a forcina" degli anticorpi) o del sito attivo degli enzimi.•Nelle regioni loop è quasi costante la presenza degli amminoacidi glicina o prolina
Ripiegamenti e anse
Nelle proteine sono presenti tratti di catena apparentemente disorganizzati, di lunghezza anche molto variabile e più o meno convoluti. Questi tratti, definiti loop, fanno da collegamento fra α eliche o filamenti β ed hanno un ruolo assai importante nella organizzazione 3D della catena peptidica.

Combinazioni di elementi di struttura secondaria costituiscono la cosiddetta struttura super-secondaria Alcuni esempi:

Motivi strutturali
Gli elementi fondamentali di struttura secondaria si trovano combinati in particolari motivi strutturali di struttura supersecondaria.Spesso è anche possibile associare alcuni motivi strutturali, o più propriamente la loro organizzazione in domini, a particolari funzioni di una proteina.
I motivi strutturali più ricorrenti sono: elica-loop- elica presente in molte proteine che legano il Ca++
(calmodulina e troponina C). β-turn due filamenti β antiparalleli uniti da un breve loop di 2-5 residui. chiave greca quattro filamenti β (minimo), due brevi loop e un loop
più lungo. β--β due filamenti β paralleli, intercalati da un‘-elica.

•Caratteristica del motivo a chiave greca è che l'ordine dei filamenti β antiparalleli non segue l'ordine che essi hanno nella catena peptidica. Per questa ragione, uno dei loop presenti in questo motivo è molto lungo
•Per poter formare un motivo a due filamenti β paralleli è necessaria una catena di congiunzione molto più lunga di quella che occorre nei β-turn, in cui i filamenti sono antiparalleli. È infatti necessario che l'inizio di un filamento β venga portato in corrispondenza dell'inizio dell'altro filamento β.
•Il motivo β--β è quasi sempre generato unendo i due filamenti con un‘ elica mediante due brevi loop. L'asse dell'elica del motivo β--β è parallelo a quello dei filamenti β.
I due loop di collegamento possono avere talvolta lunghezze assai variabili (da 2 fino a 100 residui) ed hanno spesso funzioni specifiche diverse. Accade spesso che il primo loop, tra il C-terminale del primo filamento β e l'N-terminale dell'elica, formi il sito funzionale della proteina.


Le Proteine - Forma e funzione
Stretta correlazione fra forma e funzione delle proteine
È la conformazione tridimensionale che conferisce alla proteina l'attività biologica specifica
Le proteine svolgono numerose e svariate funzioni: SOSTEGNO Proteine strutturali, quali collageno, cheratina, elastina, fibroina MOVIMENTO Proteine contrattili, quali actina e miosina TRASPORTO Emoglobina, mioglobina, lipoproteine, albumina, proteine di membrana. CATALISI Tutti gli enzimi ORMONI ad es Insulina e GlucagoneDIFESA Immunoglobuline (anticorpi)ATTACCO Tossine batteriche, veleni dei serpenti RISERVA Normalmente le proteine non hanno un ruolo di riserva di amminoacidi, ma ovoalbumina e caseina sono esempi di proteine con questa funzione

• Le proteine di sostegno e alcune di quelle contrattili hanno una forma fibrosa
Sono costituite da catene polipeptidiche allungate, disposte in fasci lungo uno stesso asse a costituire le fibreSono insolubili in acqua
• Gli enzimi, gli anticorpi e le proteine di trasporto hanno invece una forma globulare
Le catene sono strettamente avvolte in forma compatta, sferica o globulare, come un gomitolo Sono solubili in acqua

Le proteine fibrose
•Le proteine fibrose hanno una forma allungata e, a differenza delle proteine globulari, sono costituite da un unico elemento di struttura secondaria: eliche o strutture β
•Sono in genere caratterizzate da elevata resistenza meccanica alla trazione, rigidità e compattezza, ma alcune sono flessibili ed elastiche. Sono quindi particolarmente adatte a svolgere funzioni strutturali
•Una di esse, il collageno è la più abbondante delle proteine fibrose nei vertebrati ed è il componente fondamentale dei tessuti connettivi (ossa, tendini, cartilagini, pelle, vasi sanguigni, etc.)

Collageno
• L'unità fondamentale del collageno, il tropocollageno, è una struttura elicoidale superavvolta con andamento destrorso formata da tre catene polipeptidiche, ciascuna delle quali ha una struttura secondaria ad elica (elica del collageno), diversa dall‘-elica.
• L'elica del collageno è sinistrorsa, è più "stirata" (ha un passo quasi doppio rispetto all'-elica) ed ha un diametro inferiore, avendo solo tre residui amminoacidici per giro.
• Ogni singola catena è formata da circa 1000 amminoacidi ed è pressoché completamente avvolta ad elica. • La torsione opposta delle eliche (simile a quella di una fune ritorta) conferisce al collageno notevoli proprietà di rigidità, un elevato carico di rottura e la possibilità di mantenere costante la sezione sotto tensione.

La struttura tipica dell'elica del collageno
è dovuta alla particolare sequenza amminoacidica delle catene, che è costituita per oltre un terzo da glicina e per almeno un quinto da prolina e idrossiprolina
Esistono diversi tipi di collageno, ma in tutti quanti si ritrova una ripetizione monotona di triplette con sequenza Gly-X-Y, in cui X è spesso Prolina e Y è spesso Idrossiprolina.Ogni "terzo" residuo della catena è quindi una glicina e solo questa presenza, in questa posizione, rende possibile il superavvolgimento estremamente compatto della tripla elica.
HO

A loro volta, le fibre si organizzano con modalità diverse -fasci paralleli, fogli o disordinatamente- a seconda della funzione tipica del tessuto che vanno a formare
Le unità del tropocollageno si organizzano in fibre, disponendosi in maniera sfalsata, parallelamente, lungo l'asse della fibra.
La fibra è resa ancor più resistente e rigida dalla formazione di legami crociati, di tipo covalente, che si instaurano fra residui di lisina o di istidina delle unità e anche all'interno della stessa unità, tra le singole catene polipeptidiche.

Le proteine fibrose
Cheratina• Le cheratine sono il componente fondamentale, pressoché unico, degli annessi cutanei degli animali: capelli, peli, unghie, strati superficiali della pelle, piume, etc.
• L'unità della cheratina è costituita da una coppia di -eliche (destrorse) strettamente superavvolte con andamento sinistrorso e rinforzate da numerosi ponti disolfuro intercatena. Le superfici dove le due eliche si toccano nella struttura avvolta sono rivestite da aa idrofobici (Ala, Val, Leu, Met, Phe)
A loro volta, due di queste unità si avvolgono fra loro a formare una protofibrilla.

Elevato grado di organizzazione nella struttura dell’a-cheratina
a) 2 polipeptidi di cheratina formano un dimero avvolto
b) I protofilamenti si formano da 2 file sfalsate di dimeri avvolti che si associano testa a coda
c) I protofilamenti dimerizzano a loro volta formando protofibrille e l’associazione di 4 protofibrille porta alla formazione delle microfibrille o filamenti intermedi
Un capello è un aggregato di molti filamenti di -cheratina

Fibroina•La fibroina è la proteina della seta.
•A differenza di collageno e cheratina, la fibroina ha una struttura beta, organizzata in estesi foglietti, pieghettati a ventaglio.•La fibroina è ricchissima di alanina e glicina, che si alternano nella sequenza primaria.Ciò consente ai foglietti β di disporsi in piani sovrapposti, ravvicinati e compatti, tenuti insieme da deboli interazioni apolari fra i residui laterali di alanina e glicinaQuesta particolare organizzazione rende la seta morbida e flessibile