5. Gli Enzimi e La Catalasi
-
Upload
hellena1821 -
Category
Documents
-
view
10 -
download
0
description
Transcript of 5. Gli Enzimi e La Catalasi

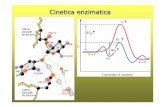
Gli enzimi e la catalisi


Distribuzione di energia in una popolazionedi molecole
• Normalmente, le molecole stabili sono per lo più presenti ad un livellodi energia relativamente basso
• Solo una piccola frazione di esse possiede sufficiente energia persuperare la barriera dell’energia di attivazione

GLI ENZIMI: CATALIZZATORI BIOLOGICI
•Accelerano le reazioni chimiche (REAGENTE CHE SITRASFORMA IN PRODOTTO)
•Non possono alterare l’equilibrio della reazione masolamente accelerare la velocità di reazione riducendol’energia di attivazione richiesta per iniziare la reazione
•Dalla regolazione degli enzimi dipende l’adattabilitàmetabolica
•Gli enzimi sono proteine GLOBULARI

GLI ENZIMI: CATALIZZATORIBIOLOGICI
• Permettono alle reazioni di andare versocondizioni che l’organismo può tollerare
• Può processare milioni di molecole ognisecondo
• Agiscono in modo molto specifico, solocon pochi tipi di molecole (substrati)

S P
REAZIONE TIPO


La spontaneità di una reazione è determinata dalle proprietàe dalle concentrazioni dei reagenti

La spontaneità di una reazione è determinata dalle proprietàe dalle concentrazioni dei reagenti
Ma se una reazione spontanea non significa che sia veloce……….potrebbe avvenire in tempi lunghissimi
(quindi, in termini biologici, come se non avvenisse)

S P
Velocità = k (S)
Inversamente proporzionaleAll’energia di attivazione


E + S ES EP E + P
REAZIONE ENZIMATICA TIPO
FORMAZIONE DEL COMPLESSO ES

SITO ATTIVO DELL’ ENZIMA


La teoria dello stato di transizione
• stato fondamentale (reagenti)• stato di transizione (specie chimiche con legami noncompletamente formati)• intermedi (specie chimiche con legami completamente formati)• prodotti
Questa teoria considera una reazione solo in termini di:

Enzimi: catalizzatori biologici
XY
GReazione noncatalizzata
ΔG
ΔG*
ΔG*
Reazionecatalizzata
• Gli enzimi si combinano transientemente col substrato e ne abbassanol’energia di attivazione
• Non spostano l’equilibrio della reazione, ma aumentano la velocità con cuil’equilibrio viene raggiunto
• Non subiscono modificazioni permanenti durante la reazione e sono subitodisponibili per catalizzare una nuovo ciclo di reazione

Analogies for NRG barriers



Determinanti del potere catalitico
• Formazione di legami covalenti traenzima e substrato
• Instaurazione di numerose interazioni noncovalenti
ENERGIA DI LEGAME (ΔGB)

Le interazioni debolisono ottimali nellostato di transizione

Il complesso enzima-substrato
E + S ES
Sito attivo
Sito di legame
Sito catalitico




SITO ATTIVOregione specifica delle molecole enzimatiche
dove il substrato si lega e reagisce per formareil prodotto. Esistono due modelli per interpretare
l’interazione sito attivo-substrato
modello chiave-serratura(Fischer 1894)
modello adattamento induttivo(Koshland 1954)
(modello eccessivamente semplificato) l’enzima è una serratura in cui può girare solo
la chiave specifica; infatti, solo una determinatamolecola di substrato ha la forma che le permettedi entrare nella fessura del sito attivovdell’enzima
in modo che la reazione possa avvenire
la forma assunta dall’enzima è adatta a far avvenirela reazione solo dopo che questo si è legato al
substrato: tale fenomeno serve a portare i gruppi funzionali specifici dell’enzima nell’orientamento
corretto necessario per la catalisi della reazione

Funzione dell’energia di legame nella catalisi

Reversibilità delle reazioni enzimaticheReversibilità delle reazioni enzimatiche
• L’enzima favorisce il raggiungimento dell’equilibrio,quindi catalizza anche la reazione inversa
A <====> B
• Ma, se B è substrato di una reazione successiva, laprima reazione diventa praticamente irreversibile
A -----> B <====> C
• Ciò vale per catene anche molto lunghe di reazioni(catene enzimatiche)


TIPI DI CATALISI

CATALISI ACIDO-BASE


• CATALISI COVALENTE

• CATALISI COVALENTE
• CATALISI DA IONI METALLICI


Struttura generale degli enzimiStruttura generale degli enzimi
APOENZIMA (Parte proteica)
OLOENZIMA
coenzima (vitamina)
ione metallicogruppo prostetico(legato covalentemente)


I coenzimi sono molecole organiche che si associano alle proteine peraiutarle a svolgere la funzione catalitica. Essi generalmente sonovitamine del gruppo B modificate (attivate)
Coenzima nelle reazioni di carbossilazione (trasportounità monocarboniosa ossidata)Biotina (H)
Coenzima correlato all' FH4 per il trasporto dei gruppimonocarboniosiCobalamina (B12)
Coenzima FH4 - trasporto dei gruppi monocarboniosiridottiAcido folico
Coenzima A - trasporto gruppi acilici e in particolareacetatoAcido pantotenico
Coenzima PLP (piridossalfosfato) - trasporto gruppiamminici e metabolismo aa in generalePiridossina (B6)
Coenzimi NAD e NADP - trasporto idrogeno edelettroniNiacina (PP)
Coenzima FAD e FMN - trasporto idrogeno edelettroniRiboflavina (B2)
Coenzima TPP (tiamina pirofosfato) - rimozionegruppi CO2
Tiamina (B1)
FUNZIONEVITAMINA

CLASSIFICAZIONE INTERNAZIONALECLASSIFICAZIONE INTERNAZIONALEENZIMI:ENZIMI:
• OSSIDOREDUTTASI• TRANSFERASI• IDROLASI• LIASI• ISOMERASI• LIGASI


• ossidoreduttasi: reazioni di ossido-riduzione– 1.1 agisce sul gruppo CHOH del donatore– 1.2 agisce sul gruppo aldeidico o chetonico del donatore– 1.3 agisce sul gruppo CH-CH del donatore– 1.4 agisce sul gruppo CH-NH2 del donatore (ammina primaria)
– 1.5 agisce sul gruppo C-NH del donatore– 1.6 agisce su NADH o NADPH .– 1.7 agisce su altri composti azotati– 1.8 agisce su gruppi solforati– 1.9 agisce sui gruppi eme
Esempio: DEIDROGENASI, CATALASI, OSSIDASI, PEROSSIDASI, IDROSSILASIREDUTTASI
CLASSIFICAZIONE INTERNAZIONALECLASSIFICAZIONE INTERNAZIONALEENZIMI:ENZIMI:

• 3 - idrolasi: reazioni di idrolisi– 3.1 legami esterei– 3.2 legami glicosidici– 3.3 altri legami– 3.4 legami peptidici– 3.5 legami C-N non peptidici– 3.6 legami anidridici– 3.7 legami C-C
Esempi: ESTERASI, GLICOSIDASI, PEPTIDASI, FOSFATASI,TIOLASI, LIPASI…….
CLASSIFICAZIONE INTERNAZIONALECLASSIFICAZIONE INTERNAZIONALEENZIMI:ENZIMI:

NOMENCLATURA
Diidrossiacetone fosfato <-------> gliceraldeide deidrogenasiTRIOSOFOSFATO DEIDROGENASI
EC 5.3.1.1.5. ISOMERASI3. ossidazione di una parte del substrato e riduzione in un ‘altra1. Interconversione di aldosi in chetosi e viceversa1. Primo ingresso nella sotto-sottoclasse 5.3.3.
Nomenclatura enzimatica (academic Press, 1992) 3196 enzimi

Denominazione costituita da 3 parti:
• Nome del substrato• Nome del coenzima• Nome della reazione catalizzata + “asi”
Esempi:
Alcool + NAD+ <-------> aldeide (o chetone) + NADHAlcool : NAD+ ossidoreduttasiEC 1.1.1.1
ATP + Creatina <-------> creatina-fosfato + ADPATP : Creatina fosfotrasferasiEC 2.7.3.2


Introduzione agli enzimi (un po’ di storia…)
1850: Pasteur • fermentazione dello zucchero in alcol è catalizzata da “fermenti” (lievito)• li chiama enzimi e postula che siano inseparabili dalla struttura della cellula vivente
1897: Buchner gli enzimi coinvolti nella fermentazione possono funzionare anche una volta rimossi dalla struttura della cellula vivente
1926: Sumner • isola e cristallizza l’enzima ureasi• postula che gli enzimi siano proteine
fine anni ’30: Northrop verifica che gli enzimi sono proteine
Haldane scrive un trattato intitolato “Enzimi”
seconda metà XX sec: sono stati purificati migliaia di enzimi e di centinaiadi essi è stata determinata la struttura e il meccanismochimico






![Lezione 6 - Enzimi 2 2008 [modalità compatibilità]omero.farm.unipi.it/matdidFarm/16/lez.8 Enzimi.pdf · • Gli enzimi che catalizzanoGli enzimi che catalizzano reazioni a più](https://static.fdocumenti.com/doc/165x107/5c68406909d3f2bf4a8d36ad/lezione-6-enzimi-2-2008-modalita-compatibilitaomerofarmunipiitmatdidfarm16lez8.jpg)