GLI ENZIMI - chimicaelab.altervista.org ENZIMI.pdf · inorganici, gli enzimi sono altamente...
Transcript of GLI ENZIMI - chimicaelab.altervista.org ENZIMI.pdf · inorganici, gli enzimi sono altamente...
CHE COSA SONO?
Sono delle proteine
altamente
specializzate con
attività catalitica,
accelerano le reazioni
chimiche rimanendo
inalterati al termine
della reazione stessa.
NOMENCLATURA
Numero di classificazione
formato: (ECX.Y.Z.W)
(esempio:EC 1.1.1.1)
“EC”: EnzymeCommission
X: Classe
Y: Sottoclasse
Z: Sotto-sottoclasse
W: numero individuale
Catalisi chimica e catalisi enzimatica
gli enzimi catalizzano specifiche reazioni chimiche attraverso
meccanismi di per sé molto simili a quelli operanti nella normale
catalisi chimica
il meccanismo catalitico di un enzima è sempre una combinazione di più meccanismi elementari di catalisi chimica
il processo catalitico di un enzima interessa principalmente una porzione della molecola della proteina enzimatica, detta sito attivo
nel sito attivo sono presenti vari gruppi funzionali, detti gruppi
catalitici, disposti e orientati in modo opportuno per legare i substrati e promuovere la loro trasformazione nei prodotti
l’interazione tra enzima e substrato avviene a
livello di un infossamento, una tasca o una cavità,
definiti sito attivo "
SPECIFICITA’
Diversamente dai catalizzatori
inorganici, gli enzimi sono
altamente specifici sia verso il
substrato sul quale agiscono, sia
verso il tipo di reazione che
catalizzano.
La maggior parte di enzimi agisce su
di un unico substrato o su un
numero molto limitato di composti.
Modello CHIAVE-serratura
Complementarità fra sito attivo dell’ enzima e il
substrato e nessun cambio conformazionale dovuto al
legame del substrato
ADATTAMENTO INDOTTO
il sito attivo più che essere complementare al
substrato, è complementare allo stato di
transizione
La proteina enzimatica senza il suo cofattore è detto apoenzima, mentre la
sua forma completa e cataliticamente attiva è detta oloenzima.
I cofattori possono essere suddivisi in due gruppi:
possono essere ioni inorganici (Fe, Mg, Mn, Zn, Mo etc.) o molecole
organiche (coenzimi) che possono essere: legati debolmente alla
proteina o legati saldamente alla proteina (gruppo prostetico)
CATALISI ENZIMATICA
Gli Enzimi catalizzano tutte le reazioni che avvengono
nell’ambiente cellulare dove le condizioni di temperatura e
concentrazione esistenti comporterebbero tempi di reazione
molto lunghi.
ATTIVITA’ ENZIMATICA
Unità enzimatica (UI) : quantità di enzima
capace di trasformare una mmole di S in
un minuto a 25 °C nelle condizioni ottimali
del saggio.
Un KATAL : quantità di enzima capace di
trasformare una mole di S in
un secondo a 25 °C nelle condizioni
ottimali del saggio.
Numero di turnover ed
efficienza catalitica
Si definisce la costante catalitica
numero di turnover:
numero di molecole di substrato
convertite in prodotto per molecola
di enzima per unità di tempo
quando l’enzima è saturato con il
substrato
Fattori che influenzano attività
enzimatica
Temperatura
pH
Concentrazione del substrato
Concentrazione dell’enzima
EFFETTO DELLA TEMPERATURA
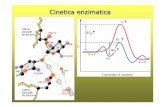
La velocità delle reazioni enzimatiche varia col crescere della temperatura secondo il grafico a campana riportato.
Si può osservare che, inizialmente, la velocità cresce al crescere della temperatura, raggiunge un massimo in corrispondenza di una certa temperatura definita ottimale, si riduce, in seguito, per effetto della denaturazione dell’enzima.
Effetto della concentrazione del
substrato
curva di saturazione del substrato :
[S] bassa ⇒
v proporzionale ad [S]
[S] alta ⇒v indipendente da [S] ⇒effetto di saturazione
ogni molecola di enzima ha il sito di legame occupato da S
EQUAZIONE DI MICHAELIS –MENTEN
A basse concentrazioni di substrato,
v = Vmax [S] / Km + [S] cioè, la velocità è direttamente
proporzionale alla concentrazione del
substrato.
Ad alte concentrazioni di substrato,
quando [S] è molto più grande di Km, Km
diventa trascurabile e si ha
v = Vmax,
cioè, la velocità è la massima,
indipendentemente dalla concentrazione
del substrato.
COSTANTE DI Michaelis-Menten
Km corrisponde alla concentrazione di S alla quale la
velocità è = Vmax/2
se Km è bassa, in ogni istante è necessaria una bassa
concentrazione di substrato per saturare metà delle
molecole di enzima e questo è segno di alta affinità
dell’enzima per il substrato
se Km è alta, occorre una più alta concentrazione di
substrato per saturare metà delle molecole di enzima in
ogni istante e questo vuol dire che l’enzima presenta
bassa affinità per il substrato.
Il valore di Km è indipendente dalla concentrazione
dell'enzima e dalla concentrazione del substrato.
Enzimi multimerici regolatori: Cooperatività tra subunità ed effetto allosterico
in alcuni casi il legame di uno, o più, effettori induce variazioni conformazionali che fanno variare l’attività di un enzima"
Gli effettori possono essere attivatori o inibitori"
gli enzimi modulati dal proprio substrato sono
definiti omotropici; presentano il solo sito attivo
gli enzimi modulati da effettori diversi dal proprio substrato sono definiti eterotropici; presentano il sito attivo e uno, o più, siti regolatori o allosterici nella stessa subunità o in subunità diverse"
COMPARAZIONE TRA CURVE DI ATTIVITÀ DI UN ENZIMA NORMALE E UN ENZIMA ALLOSTERICO
la cinetica sigmoide riflette la presenza
di interazioni cooperative tra subunità"
la variazione di struttura di una subunità
dà luogo a variazioni nelle altre"
Il controllo per modificazione
covalente: la fosforilazione induce cambiamenti strutturali reversibili"
attivatori oppure inibitori"
Modificazioni covalenti irreversibili:
Proteolisi (zimogeni)
L’attivazione proteolitica del chimotripsinogeno
Inibizione enzimatica
Gli inibitori enzimatici interagiscono
reversibilmente
o irreversibilmente con un enzima
Tra i reversibili, si distinguono:
• inibitori competitivi
• inibitori non competitivi
INIBIZIONE REVERSIBILE
COMPETITIVA
L’inibitore possiede una struttura molto simile a
quella del substrato la similitudine porta il
substrato e l’inibitore a competere per lo stesso
sito attivo dell’enzima. L’esito della competizione
dipende dalla concentrazione delle due molecole
che si contendono il sito attivo
Può essere completamente rimossa
aumentando notevolmente la
concentrazione di substrato
L’inibitore si lega all’enzima in una zona diversa
da quella del sito attivo dando luogo al
complesso EI inattivo. Il legame dell’inibitore
deforma la conformazione spaziale dell’enzima
ed il suo sito catalitico pur potendosi legare al
substrato risulta inattivo.
NON COMPETITIVA
L’aumento della [S] aumenta la
probabilità che sia S a legarsi all’enzima
invece dell’inibitore. Alti valori di [S]
possono annullare l’effetto di I.
La Vmax rimane invariata (infatti a
concentrazione elevata di substrato
tutta l’inibizione viene rimossa) mentre
la Km aumenta.
L’inibitore ed il substrato si legano a siti
diversi dell’enzima e il legame di I non
influenza il legame di S
A qualsiasi concentrazione di substrato
la velocità di reazione in presenza di
inibitore è sempre minore che in sua
assenza. Quindi la Vmax diminuisce
mentre la Km rimane costante.





































![Lezione 6 - Enzimi 2 2008 [modalità compatibilità] · • Gli enzimi che catalizzanoGli enzimi che catalizzano reazioni a più substrati agiscono mettendo i substrati in contatto](https://static.fdocumenti.com/doc/165x107/5c6848f909d3f23a018d3bf6/lezione-6-enzimi-2-2008-modalita-compatibilita-gli-enzimi-che-catalizzanogli.jpg)












