3 Anatomia e fisiologia dell’ipofisi · Anatomia e fisiologia dell’ipofisi 5...
Transcript of 3 Anatomia e fisiologia dell’ipofisi · Anatomia e fisiologia dell’ipofisi 5...

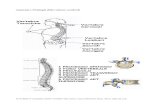
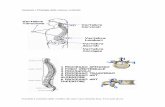
lobo anteriore (AL, anterior lobe) e la neuroipofisi o lobo posteriore (PL, posterior lobe).2 Durante l’embriogenesi, l’adenoipofisi si sviluppa a partire dalla tasca di Rathke, un’estroflessione della volta della cavità orale primitiva a contatto con la base dell’encefalo. In seguito, la tasca di Rathke si separa per costrizione dalla cavità orale. La sua parete anteriore si ispessisce, dando origine alla parte distale dell’adenoipofisi. La parete posteriore della tasca di Rathke aderisce strettamente al tessuto nervoso della neuroipofisi e dà origine alla parte intermedia (PI, pars intermedia), il cui nome deriva dalla sua posizione tra le due porzioni principali della ghiandola, la parte distale e il PL (Fig. 1.1). Simultaneamente si forma la neuro-ipofisi, che origina a partire da un’evaginazione me-diana del tessuto nervoso del pavimento dell’ipotalamo (diencefalo). Al termine dell’organogenesi, la neuroipo-fisi conserva la sua connessione anatomica con l’ipota-lamo e, come l’adenoipofisi, rimane in stretta vicinanza di questa struttura diencefalica. La stretta associazione anatomica tra l’ipotalamo e le tre parti dell’ipofisi è un prerequisito indispensabile per la loro interazione fun-zionale, che nel complesso viene descritta come asse ipotalamo-ipofisario.3
Anatomia e fisiologia dell’ipofisiSara Galac, DVM, PhD
Anatomia dell’ipofisiL’ipofisi viene chiamata “ghiandola master” poiché, nonostante le sue piccole dimensioni, svolge un ruolo centrale nella regolazione di tutto il sistema endocrino.1 È una ghiandola impari, nota anche come ghiandola pi-tuitaria. L’ipofisi è accolta in una depressione dello sfe-noide, chiamata sella turcica, situata immediatamente al di sotto dell’ipotalamo. La sua posizione come appendice dell’encefalo è indicativa del suo ruolo di relè tra i mec-canismi nervosi e umorali che intervengono congiun-tamente nel controllo di diverse funzioni. Le particolari caratteristiche topografiche dell’ipofisi influenzano sia la modalità di espansione dei tumori ipofisari sia l’approc-cio chirurgico più conveniente, che nel gatto avviene per via transfenoidale. Le masse in accrescimento tendono a espandersi lungo la via a minore resistenza, che nel gatto è situata dorsalmente in direzione dell’ipotalamo in quanto la sella turcica, con la sua conformazione a coppa poco profonda, impedisce la crescita in direzione ventrale o laterale dei tumori.
L’ipofisi è costituita da due parti, con origine embrio-logica differente e con funzioni distinte: l’adenoipofisi o
FIGURA 1.1 Istopatologia e rap-presentazione schematica dell’i-pofisi felina. AL: adenoipofisi o lobo anteriore; PI: parte inter-media; PL: neuroipofisi o lobo posteriore. Parzialmente adattato da: Mol JA. Pituitary function. In: Kaneko JJ, Harvey JW, Bruss ML, eds. Clinical Biochemistry of Domestic Animals. Elsevier. 2008:561-604.
PI
PL
AL
3CAPITOLO 1
Libro_Feldman_ITA.indb 3 30/09/19 14:55

alla sintesi della molecola precursore POMC, da cui ori-ginano l’ACTH e peptidi correlati) e cellule gonadotrope (secernenti LH e FSH) (Fig. 1.2). La distribuzione delle varie cellule secretorie dell’adenoipofisi non è casuale, ma presenta una specifica organizzazione topologica e numerica. Nell’adenoipofisi si riconoscono una porzione cuneiforme centrale, contenente le cellule tireotrope e corticotrope, e due ali laterali contenenti le cellule soma-totrope e lattotrope. Le cellule gonadotrope sono distribu-ite in maniera diffusa in tutta la ghiandola.5
La PI contiene due tipi di cellule in grado di sintetiz-zare la POMC. Uno è simile alle cellule corticotrope, men-tre nel secondo l’ACTH viene scisso in α-MSH e nel pep-tide del lobo intermedio corticotropino-simile (ACTH18-39 o CLIP, corticotropin-like intermediate-lobe peptide).3,5
La neuroipofisi è composta da un gruppo di neuroni magnocellulari i cui corpi cellulari si trovano nei nuclei sopraottico e paraventricolare dell’ipotalamo, mentre gli assoni discendono lungo il peduncolo ipofisario per ter-minare a livello dei vasi sanguigni fenestrati del PL.2
Vascolarizzazione dell’ipofisiL’adenoipofisi e la neuroipofisi sono vascolarizzate da due sistemi indipendenti. Le arterie ipofisarie rostrali formano il plesso capillare dell’eminenza mediana, una rete capillare con un’organizzazione unica, situata in stretta prossimità dei terminali nervosi dei neuroni ipofisiotropi. Tale plesso capillare forma un “sistema ematico portale” che, as-sieme al sistema presente nel fegato, costituisce uno dei due sistemi portali noti. Nell’area dell’eminenza mediana, la barriera ematoencefalica è incompleta e permette agli ormoni proteici e peptidici di passare negli spazi interca-pillari e raggiungere i terminali nervosi in essi contenuti.2,4 Questi terminali nervosi rispondono agli stimoli umorali e nervosi sintetizzando e secernendo nel sistema por-tale fattori “di rilascio” e “di inibizione”. I capillari portali confluiscono in una serie di vasi che discendono lungo il peduncolo ipofisario, per poi formare un secondo plesso capillare che circonda le cellule adenoipofisarie.
Le arterie ipofisarie caudali apportano sangue alla neuroipofisi. Il sangue fluisce nella circolazione sistemica dal plesso primario della neuroipofisi, ma anche attra-verso l’adenoipofisi e l’ipotalamo.1 La vascolarizzazione della PI è strettamente legata a quella del PL; tuttavia, mentre quest’ultimo riceve un ricco apporto ematico, la PI è scarsamente vascolarizzata (Fig. 1.2).3
Differenziazione delle cellule ipofisarieLe cellule adenoipofisarie seguono tre vie principali di differenziazione: 1. Cellule che esprimono la pro-opiomelanocortina
(POMC), dalla quale originano l’ormone adrenocorti-cotropo (ACTH, adrenocorticotropic hormone) e l’or-mone melanocita-stimolante α (α-MSH, melanocyte-stimulating hormone), secreti rispettivamente dalle cellule corticotrope e melanotrope.
2. Cellule gonadotrope che secernono l’ormone follicolo-stimolante (FSH, follicle-stimulating hormone) e l’or-mone luteinizzante (LH, luteinizing hormone).
3. Linee cellulari Pit1-dipendenti (cellule somatotrope, lattotrope e tireotrope), che secernono l’ormone della crescita (GH, growth hormone), la prolattina (PRL) e l’ormone tireostimolante (TSH, thyroid-stimulating hormone).
Al termine del processo di differenziazione, l’adenoipofisi risulta popolata da almeno cinque tipi diversi di cellule endocrine, responsabili della sintesi e della secrezione dei sei ormoni tropici: cellule somatotrope (secernenti GH), cellule lattotrope (secernenti PRL), cellule tireo-trope (secernenti TSH), cellule corticotrope (deputate
FIGURA 1.2 Rappresentazione schematica della relazione tra ipotalamo e ipofisi. L’ipotalamo esercita un controllo sul lobo an-teriore (AL) attraverso i fattori di rilascio e di inibizione che rag-giungono le cellule adenoipofisarie attraverso i capillari del siste-ma portale ipotalamo-ipofisario. Il lobo posteriore (PL) dell’ipofisi rappresenta un prolungamento ventrale dell’ipotalamo. La parte intermedia (PI) è controllata direttamente da neurotrasmettitori. Adattato da: Meij BP, Kooistra HS, Rijnberk A. Hypothalamus-pituitary system. In: Rijnberk A, Kooistra HS, eds. Clinical Endo-crinology of Dogs and Cats. Schlütersche. 2010:13-54.
Ormoni ipotalamici
Ormoni ipofisari
ACTH GH PRL TSH LHFSH α-MSH AVP
GHRH TRH LHRHCRH Altri
Ossitocina
PI
PL
AL
SEZIONE 1. Ipotalamo e ipofisi4
Libro_Feldman_ITA.indb 4 30/09/19 14:55

Il sistema neuroendocrinoIl sistema neuroendocrino stabilisce una connessione tra l’adenoipofisi e gruppi di cellule secernenti peptidi e monoamine situati nell’ipotalamo ventrale. I prodotti di queste cellule sono rappresentati da “fattori di rilascio” e “fattori di inibizione”, come l’ormone di rilascio del GH (GHRH, growth hormone-releasing hormone), l’ormone di rilascio della tireotropina (TRH, thyrotropin-releasing hormone), l’ormone di rilascio della corticotropina (CRH, corticotropin-releasing hormone), l’ormone di rilascio delle gonadotropine (GnRH, gonadotropin-releasing hor-mone), la somatostatina e la dopamina (Fig. 1.3). Que-sti prodotti vengono immagazzinati nei terminali nervosi dell’eminenza mediana a concentrazioni 10-100 volte superiori rispetto a qualsiasi altra parte dell’ipotalamo. Dall’eminenza mediana, i fattori ipofisiotropi vengono immessi nei capillari del sistema portale ipotalamo-ipofisario e in seguito trasportati all’adenoipofisi, dove regolano la produzione e la secrezione degli ormoni adenoipofisari. Dal momento che il flusso di sangue por-tale non è compartimentalizzato, gli ormoni di rilascio ipotalamici hanno accesso a tutte le cellule endocrine
Fisiologia dell’ipofisiNozioni generaliL’asse ipotalamo-ipofisario costituisce l’asse princi-pale del sistema neuroendocrino. Attraverso l’integra-zione dei segnali provenienti dalla periferia e dall’en-cefalo, l’ipofisi controlla alcune funzioni di importanza vitale come la crescita, la riproduzione, la lattazione, il metabolismo basale e la risposta allo stress.3 L’asse ipotalamo-ipofisario è costituito da tre componenti principali: un sistema neuroendocrino connesso a un sistema endocrino attraverso la circolazione portale, una via neurosecretiva e il sistema di regolazione ner-vosa diretta della PI.4
Tutti gli ormoni tropici secreti dall’adenoipofisi sono di natura peptidica, tranne la dopamina. Oltre al suo ruolo principale come neurotrasmettitore, la dopamina rappre-senta il più importante inibitore della secrezione di PRL. Tutti gli ormoni ipofisiotropi vengono secreti con anda-mento pulsatile.6,8
FIGURA 1.3 Schema semplificato della regolazione della secrezione degli ormoni adenoipofisari da parte dei fattori ipofisiotropi. ACTH: ormone adrenocorticotropo; AL: lobo anteriore; AVP: arginina-vasopressina; CRH: ormone di rilascio della corticotropina; DA: dopamina; FSH: ormone follicolo-stimolante; GH: ormone della crescita; GHRH: ormone di rilascio dell’ormone della crescita; IGF-1: fattore di crescita insulino-simile 1; LH: ormone luteinizzante; α-MSH: ormone melanocita-stimolante α; PI: parte intermedia; PIF: fattore di inibizione della prolattina; PRH: ormone di rilascio della prolattina; PRL: prolattina; TRH: ormone di rilascio della tireotropina; TSH: ormone tireostimolante; +: stimolazione; –: inibizione. Adattato da: Meij BP, Kooistra HS, Rijnberk A. Hypothalamus-pituitary system. In: Rijnberk A, Kooistra HS, eds. Clinical Endocrinology of Dogs and Cats. Schlütersche. 2010:13-54.
+ + + + + + + + ----
Ambiente/Stress
Ipotalamo
Ipofisi(ghiandola pituitaria)
AVP CRH GnRH GHRH Somatostatina TRH PRH PIF(DA) DA
α-MSHACTH
cortisolo testosterone estradiolo IGF-1 tiroxina
ACTHLH FSH GH TSH PRL PIAL
Capitolo 1. Anatomia e fisiologia dell’ipofisi 5
Libro_Feldman_ITA.indb 5 30/09/19 14:55

di peptidi nelle cellule adenoipofisarie, in un processo in cui ogni singola fase della sintesi e della liberazione finale degli ormoni rappresenta un potenziale punto di controllo nella regolazione delle concentrazioni di ormoni circolanti. La modulazione delle quantità di mRNA, l’efficienza dei processi di trascrizione e traduzione, la conversione del pre-pro-ormone a pro-ormone e infine a ormone, nonché la degradazione intracellulare degli ormoni immagazzinati determinano, singolarmente o congiuntamente, la quantità di ormone disponibile per il rilascio.
GHLa secrezione di GH è controllata da fattori inibitori (so-matostatina) e stimolatori (GHRH) prodotti dall’ipotalamo, nonché dall’influenza diretta della grelina a livello dell’ipo-fisi. Il GHRH viene rilasciato in risposta a stimoli fisiologici come l’esercizio fisico, il digiuno, la lattazione e l’ipoglice-mia.8 La grelina stimola il rilascio di GH in maniera dose-dipendente. Le principali cellule bersaglio del GH sono gli epatociti, le cellule muscolari striate, gli adipociti e i condrociti delle cartilagini di accrescimento. Gli effetti del GH possono essere suddivisi in azioni metaboliche rapide ed effetti anabolici a sviluppo più lento. Le risposte me-taboliche acute comportano la lipolisi e la riduzione del trasporto del glucosio attraverso la membrana cellulare. Gli effetti di lunga durata del GH sono prevalentemente mediati dal fattore di crescita insulino-simile 1 (IGF-1, in-sulin-like growth factor 1), sintetizzato nel fegato. Il GH è responsabile della sua stessa down-regulation (feedback negativo ad ansa corta) attraverso la stimolazione dei neuroni ipotalamici produttori di somatostatina. La secre-zione di GH è inoltre modulata dall’IGF-1 attraverso un meccanismo di controllo a feedback ad ansa lunga.9
PRLLa secrezione di PRL è regolata prevalentemente dall’ini-bizione tonica esercitata dalla dopamina prodotta dall’i-potalamo. La dopamina si lega allo specifico recettore di membrana presente sulle cellule lattotrope e inibisce il rilascio di PRL. Lo stress neurogeno e gli stimoli senso-riali legati alla suzione possono annullare l’effetto inibito-rio esercitato dalla dopamina. Oltre al tono inibitorio do-paminergico, è noto che diverse sostanze promuovono il rilascio di PRL, come il TRH, la VP e l’angiotensina II. La PRL si lega agli specifici recettori presenti sui neuroni do-paminergici dell’ipotalamo, inducendo un aumento della sintesi e del rilascio di dopamina e, di conseguenza, una maggiore inibizione del suo stesso rilascio. Il ruolo più noto della PRL è la stimolazione della ghiandola mam-maria e della lattazione.3,8
dell’adenoipofisi. La specificità d’azione si consegue gra-zie alla presenza di recettori specifici su ogni singolo tipo di cellula adenoipofisaria.
La via neurosecretoriaLa via neurosecretoria partecipa all’osmoregolazione at-traverso la produzione e il rilascio di vasopressina (VP). Una via simile è coinvolta nel parto e nell’allattamento attraverso la secrezione di ossitocina e prolattina. I tre ormoni vengono sintetizzati dalle popolazioni di neuroni magnocellulari e immagazzinati all’interno di vescicole secretorie nei terminali nervosi del PL. A questo livello, vengono secreti nella circolazione sistemica in risposta a uno stimolo appropriato.
Regolazione nervosa direttaLa PI dell’ipofisi è regolata da un meccanismo di inibizione tonica dopaminergica e di stimolazione β-adrenergica.6 I principali ormoni sintetizzati nella PI sono l’ACTH e l’α-MSH; altre proteine correlate alla POMC comprendono la β-endorfina e la β-lipotropina.7 La dopamina secreta dal nucleo arcuato dell’ipotalamo inibi-sce l’attività di secrezione della PI, mentre le condizioni di stress lieve, come la manipolazione e la contenzione fisica dell’animale, inducono un considerevole aumento delle concentrazioni plasmatiche di ACTH e α-MSH.
Ormoni dell’adenoipofisiIn condizioni fisiologiche e nella maggior parte delle condi-zioni patologiche, le concentrazioni plasmatiche basali di ciascuno dei sei ormoni adenoipofisari (ACTH, LH e FSH, TSH, GH, PRL) sono regolate attraverso un meccanismo a feedback (a circuito chiuso).3,8 La secrezione degli or-moni ipofisiotropi viene a sua volta inibita dai prodotti delle ghiandole endocrine bersaglio, come la tiroide, il surrene e le gonadi. Oltre a questo meccanismo a feedback ad ansa lunga, alcuni ormoni secreti nella circolazione generale, come la PRL e il GH, regolano la loro stessa secrezione agendo direttamente sull’ipotalamo (feedback ad ansa corta). Inoltre, alcune evidenze indicano l’esistenza di un feedback ad ansa ultracorta, nel quale l’ormone agisce all’interno dell’ipofisi attraverso un meccanismo di comu-nicazione autocrina e paracrina. A questi meccanismi regolatori si sovrappongono altri segnali mediati da neu-rotrasmettitori e ormoni ipofisiotropi prodotti in risposta a influenze ambientali (temperatura, luce, buio), allo stress (dolore, paura) e a meccanismi di ritmicità intrinseca. Que-sti fattori di regolazione influenzano la sintesi e/o il rilascio
SEZIONE 1. Ipotalamo e ipofisi6
Libro_Feldman_ITA.indb 6 30/09/19 14:55

CRH e VP. Il CRH viene rilasciato da piccoli neuroni del nucleo paraventricolare in risposta a un segnale nervoso. La VP presente nel sangue portale ipofisario deriva prin-cipalmente dai neuroni contenenti CRH ed è pertanto distinta dalla VP coinvolta nell’omeostasi idrica.3 Nel con-trollo neuroendocrino della secrezione di ACTH si pos-sono distinguere quattro meccanismi:4
1. Secrezione episodica: la secrezione di ACTH è pul-satile e quella di cortisolo è indipendente dal ritmo circadiano.
2. Risposta allo stress: in condizioni di stress, l’ACTH e il cortisolo vengono secreti rapidamente in seguito al rilascio di CRH e VP dal sistema nervoso centrale. Nel gatto, anche uno stress lieve come la manipolazione può indurre un’intensa risposta da stress.
3. Inibizione a feedback da parte del cortisolo: l’ACTH si lega agli specifici recettori presenti sulle cellule adre-nocorticali e attiva la trascrizione degli enzimi coinvolti nella steroidogenesi. Le azioni inibitorie dei glicocor-ticoidi si esercitano sulla produzione di CRH e VP a livello ipotalamico, nonché sulle cellule corticotrope dell’adenoipofisi. Le cellule della PI che producono POMC sono resistenti all’inibizione dipendente dai gli-cocorticoidi a causa dell’assenza di recettori specifici per questi ormoni.
4. Fattori immunologici: le citochine proinfiammatorie attivano invariabilmente l’asse ipotalamo-ipofisario sti-molando la secrezione di CRH.
α-MSHL’α-MSH circolante, sintetizzato a partire dalla molecola precursore POMC, origina principalmente dalla PI. Il suo rilascio è controllato da un meccanismo di inibizione do-paminergica, ma nel gatto la secrezione di α-MSH si ve-rifica anche in risposta allo stress neurogeno e alla stimo-lazione β-adrenergica. Diversamente da quanto osservato per altri ormoni tropici, in un terzo circa dei gatti è stata documentata la presenza di una secrezione circadiana di α-MSH.10 Gli effetti biologici dell’-αMSH sono correlati alla regolazione della pigmentazione, ma comprendono anche il controllo del peso corporeo ed effetti antinfiammatori.
Ormoni della neuroipofisiL’ossitocina e la VP vengono sintetizzate a partire da una molecola precursore di grandi dimensioni, costituita da un peptide segnale, dall’ormone e da una proteina tra-sportatrice chiamata neurofisina, nonché, nel caso della VP, da un glicopeptide.3
TSHLa secrezione ipofisaria di TSH è controllata dall’azione stimolatoria del TRH ipotalamico e dagli ormoni tiroidei. Il TRH interagisce con lo specifico recettore presente sulle cellule tireotrope, ma si lega anche alle cellule lat-totrope inducendo il rilascio di PRL. Il TSH è una glico-proteina che viene trasportata attraverso il circolo san-guigno alle cellule epiteliali della tiroide, dove stimola la proliferazione cellulare, la sintesi e l’immagazzinamento della tireoglobulina, nonché il rilascio degli ormoni tiroidei triiodotironina (T3) e tetraiodotironina (T4). La secrezione di TSH è inibita principalmente dalla T3 prodotta local-mente per deiodazione della T4, ma anche dalla T3 deri-vata dal pool sistemico di T3 libera. Il feedback negativo, che si verifica a livello dell’ipotalamo e dell’ipofisi, regola rispettivamente la produzione di TRH e TSH.8
FSH e LHDiversamente dagli altri ormoni dell’adenoipofisi che vengono secreti ciascuno da uno specifico tipo cellulare, l’FSH e l’LH sono secreti dallo stesso tipo di cellula (cel-lula gonadotropa). Il principale fattore di stimolazione, il GnRH, viene rilasciato da neuroni sparsi diffusamente nell’ipotalamo. Sebbene sia plausibile che l’FSH e l’LH vengano secreti in uguali concentrazioni dalle cellule go-nadotrope, al momento non è ancora chiaro se la loro regolazione sia comune o differenziale.8 Nella femmina, l’FSH si lega a specifici recettori presenti sulle cellule epiteliali dei follicoli ovarici, mentre nel maschio si lega a recettori presenti sulle cellule sustentacolari del testi-colo (cellule di Sertoli). In entrambi i sessi, l’FSH stimola la produzione di estrogeni. Nella femmina, l’LH si lega a specifici recettori espressi dalle cellule della teca interna, stimolando la produzione di testosterone. Si lega inoltre ai recettori presenti sulle cellule follicolari e tecali del fol-licolo postovulatorio, stimolando la sintesi e la secrezione di progesterone. Anche le cellule dello stroma intersti-ziale ovarico producono testosterone. Nel maschio, l’LH si lega agli specifici recettori delle cellule interstiziali del testicolo (cellule di Leydig), stimolando la sintesi e la se-crezione di testosterone. La secrezione di gonadotropine è controllata da un meccanismo a feedback mediato da-gli ormoni gonadici. Gli steroidi prodotti dalle gonadi si legano alle cellule dell’ipotalamo, inibendo la produzione di GnRH e gonadotropine.2,8
ACTHLa secrezione di ACTH da parte dell’adenoipofisi è re-golata dall’ipotalamo e dal sistema nervoso centrale at-traverso neurotrasmettitori che inducono la liberazione di
Capitolo 1. Anatomia e fisiologia dell’ipofisi 7
Libro_Feldman_ITA.indb 7 30/09/19 14:55

Bibliografia
1. Konig HE, Liebich HG. Endocrine glands. In: Konig HE, Lieb-ich HG, eds. Veterinary Anatomy of Domestic Animals. Schat-tauer 2004:537-546.
2. Dyce K, Sack W, Wensing C. The endocrine glands. In: Dyce K, Wensing C, eds. Textbook of Veterinary Anatomy. Saunders 2010:216-222.
3. Meij BP, Kooistra HS, Rijnberk A. Hypothalamus-pituitary sys-tem. In: Rijnberk A, Kooistra HS, eds. Clinical Endocrinology of Dogs and Cats. Schlütersche 2010:13-54.
4. Galac S, Reusch C, Kooistra HS RA. Adrenals. In: Rijnberk A, Kooistra HS, eds. Clinical Endocrinology of Dogs and Cats. Schlütersche 2010:93-154.
5. Capen C. Endocrine glands. In: Maxie M, ed. Jubb, Kennedy, and Palmer’s Pathology of Domestic Animals. 5th ed. St Louis: Saunders 2007:505-525.
6. Kemppainen RJ, Peterson ME. Regulation of alpha-melano-cyte-stimulating hormone secretion from the pars intermedia of domestic cats. Am J Vet Res 1999;60:245-249.
7. Peterson ME, Kemppainen RJ, Orth DN. Plasma con-centrations of immunoreactive proopiomelanocortin pep-tides and cortisol in clinically normal cats. Am J Vet Res 1994;55:295-300.
8. Goff JP. The Endocrine system. In: Erickson HH, ed. Duke’s Physiology of Domestic Animals. John Wiley & Sons 2015:617-725.
9. Reusch CE. Disorders of Growth hormone. In: Feldman EC, Nelson RW, Reusch CE, Scott-Moncrieff JC, Behrend EN, eds. Canine and Feline Endocrinology. Elsevier 2015:37-76.
10. Kemppainen RJ, Peterson ME. Domestic cats show episodic variation in plasma concentrations of adrenocorticotropin, al-pha-melanocyte-stimulating hormone (alpha-MSH), cortisol and thyroxine with circadian variation in plasma alpha-MSH concentrations. Eur J Endocrinol 1996;134:602-609.
OssitocinaIl rilascio di ossitocina per esocitosi dei granuli secretori avviene attraverso un meccanismo mediato dal calcio, stimolato dall’attivazione delle sinapsi nervose che le cellule secernenti contraggono con i neuroni di una rete sensoriale situata nel tronco encefalico. In seguito al ri-lascio, l’ossitocina si lega agli specifici recettori presenti sulle cellule mioepiteliali degli alveoli e dei dotti mam-mari, determinando la contrazione dei miofilamenti di tali cellule e la conseguente secrezione di latte. Inoltre, l’os-sitocina si lega a specifici recettori presenti sulle cellule muscolari lisce del miometrio, inducendo la contrazione dell’utero e il parto.1,8
VPIl principale fattore determinante nel rilascio di VP è l’au-mentata osmolarità plasmatica. Nell’ipotalamo anteriore, in prossimità del nucleo sopraottico, sono concentrati al-cuni neuroni specifici, chiamati osmocettori.2 Oltre all’o-smoregolazione, anche variazioni significative del volume di sangue circolante e della pressione ematica possono influenzare il rilascio di VP.8 Gli effetti della VP sono me-diati da tre sottotipi recettoriali: recettori V1a nei vasi san-guigni, recettori V2 sulle cellule epiteliali dei dotti collettori
Punti chiave
■ L’ipofisi svolge un ruolo centrale nella regolazione dell’intero sistema endocrino.
■ L’ipofisi è costituita dall’adenoipofisi e dalla neuro-ipofisi, separate dalla PI, che anatomicamente ap-partiene all’adenoipofisi.
■ I sei principali ormoni tropici secreti dall’adenoipo-fisi sono ACTH, LH e FSH, TSH, GH e PRL.
■ Gli ormoni prodotti dalla neuroipofisi sono l’ossito-cina e la VP.
■ Nella PI vengono sintetizzati e secreti ACTH e α-MSH.
del rene e recettori V3 (chiamati anche V1b) nell’adenoi-pofisi. Nel rene, il legame della VP ai recettori V2 attiva i canali dell’acqua (acquaporina 2) a livello della mem-brana apicale delle cellule dei dotti collettori ed esercita un effetto antidiuretico. Il legame della VP ai recettori V1a determina aumento del tono dei miociti, vasocostrizione e aumento della pressione ematica. Nell’ipofisi, i recettori V3 mediano la secrezione di ACTH.3
SEZIONE 1. Ipotalamo e ipofisi8
Libro_Feldman_ITA.indb 8 30/09/19 14:55

stati descritti solo pochi casi felini con un eccesso di GH, per cui la condizione si considerava rara; “sarebbe una fortuna incontrare anche un solo gatto con questa ma-lattia nella propria carriera veterinaria”. Di conseguenza, in molte facoltà di medicina veterinaria venivano fornite solo poche informazioni o nessuna in merito a questo disturbo. Inoltre, le descrizioni della condizione, quando e se fornite, si incentravano sulla sua presentazione nel gatto diabetico con marcate caratteristiche morfologiche da acromegalia.
Uno studio condotto nel Regno Unito ha modificato la percezione di questa patologia; in tale studio, tutti i gatti diabetici inclusi furono sottoposti a screening per questa malattia, indipendentemente dal loro livello di resistenza all’insulina e dalla presenza o meno delle classiche ca-ratteristiche esterne acromegaliche (Fig. 2.1).1,2 Così, nel 2003, la malattia fu “riscoperta” e ciò diede impulso a ricerche mirate che apportarono una grande quantità di nuove conoscenze su questa vecchia patologia, tra cui il fatto che essa non è sempre associata a caratteristiche esterne acromegaliche, al diabete mellito difficile da con-trollare o al diabete mellito in generale (Fig. 2.1).
Profilo storicoL’acromegalia è la sindrome clinica derivante da un’i-persecrezione di ormone della crescita (GH, growth hor-mone). Dal momento che i pazienti con “acromegalia” sono quelli che presentano i caratteristici segni clinici, i puristi della lingua potrebbero sostenere che sia più corretto utilizzare il termine ipersomatotropismo (HST, hypersomatotropism) che include sia i pazienti che ma-nifestano segni clinici, sia quelli che, pur presentando un eccesso di GH, non hanno ancora sviluppato tali segni. Sebbene questa considerazione possa sembrare mera-mente semantica, la ricerca ha dimostrato che nel gatto, così come nell’uomo, l’ipersecrezione di GH si sviluppa in un lungo periodo di tempo che precede la comparsa delle caratteristiche acromegaliche esterne (vedi Caratte-ristiche cliniche e diagnosi).
Un tempo, l’HST era considerato un’affezione rara nell’uomo. Tuttavia, l’HST/acromegalia viene attual-mente riconosciuto con maggiore frequenza e con una varietà di presentazioni. Una situazione simile sembra verificarsi anche nel gatto. Fino a dieci anni fa erano
Ipersecrezione di GH: acromegalia (ipersomatotropismo)Stijn J.M. Niessen, DVM, PhD, DECVIM, PGCertVetEd, FHEA, MRCVSChristopher J. Scudder, BVSc, PhD, DACVIM, MRCVS
FIGURA 2.1 L’importanza dell’acro-megalia nei gatti diabetici è stata di-mostrata in uno studio condotto nel Regno Unito su un gruppo randomiz-zato di gatti diabetici, il quale ha rive-lato che il 32% dei soggetti presen-tava concentrazioni sieriche di IGF-1 >1000 ng/ml; nella sottopopolazione sottoposta a neuroimaging (TC o RM) o a esame post-mortem (PM), il 94% dei casi con concentrazioni di IGF-1 >1000 ng/ml presentava una massa ipofisaria.
TC-RM-PM
Gatti diabetici sottoposti a screening dell’IGF-1
32% 94%
9CAPITOLO 2
Libro_Feldman_ITA.indb 9 30/09/19 14:55

questo proposito si basa sul fatto che, essendo gene-ralmente accettato lo screening dei gatti diabetici per la presenza di infezioni del tratto urinario (prevalenza stimata pari al 12%), sembra coerente raccomandare anche lo screening di questi pazienti per la presenza di HST/acromegalia (prevalenza stimata pari al 18-32%). Considerate le enormi implicazioni sulla scelta del migliore protocollo terapeutico, sul potenziale di remissione del diabete e sulla prognosi, ogni gatto con diagnosi recente di diabete dovrebbe essere valutato per questa condizione sottostante.
Il diabete mellito è sempre presente?Nel gatto, il diabete mellito è più difficile da controllare quando è secondario all’HST. Questo concetto trova supporto nei dati di letteratura, secondo i quali le dosi di insulina richieste per la gestione dei gatti diabetici con HST sono più elevate rispetto a quelle necessa-rie per i gatti con diabete mellito non complicato (non associato a HST).1,2 Tuttavia, nelle fasi iniziali del dia-bete associato a HST, questa differenza potrebbe non essere così evidente. Alcuni di questi pazienti si pre-sentano come ogni altro gatto diabetico e, addirittura, il diabete mellito potrebbe anche essere assente in al-cuni gatti con HST. La prevalenza del diabete mellito nei gatti con HST sembra essere più elevata rispetto all’uomo, dove varia tra il 9% e il 52%.4 Il rischio di sviluppare diabete mellito è più elevato nei pazienti umani con acromegalia cronica non trattata e in quelli con concentrazioni più elevate di IGF-1.5,6 Pertanto, questa differenza clinica potrebbe essere dovuta al fatto che, nel gatto, la diagnosi di HST viene formulata più tardivamente nel decorso della malattia.
Gatti non diabetici con HSTQuando lo screening viene esteso a una popolazione più ampia, comprendente anche i gatti non diabetici, emer-gono vari scenari clinici. Queste condizioni, in cui l’HST può rappresentare la patologia sottostante che agisce da fattore scatenante, comprendono malattie simili alla car-diomiopatia ipertrofica (HCM, hypertrophic cardiomyo-pathy) (tra cui il riscontro accidentale di ispessimento miocardico durante lo screening di routine o gli esami preanestetici), i ronchi o gli stertori a insorgenza tardiva nella vita e anomalie del sistema nervoso centrale, tra cui crisi convulsive e altri segni associati alla presenza di una neoformazione ipofisaria in accrescimento. Con l’aumentare dell’indice di sospetto, è probabile che la presenza di diabete mellito concomitante al momento della presentazione iniziale non sarà più così comune
Incidenza e patogenesiNel gatto, l’acromegalia è forse 10 volte più prevalente che nell’uomo, interessando una popolazione stimata di 1 gatto su 800 considerando gatti diabetici e non diabetici.2-5
Studi di screeningCome è stato accennato, sebbene l’HST fosse consi-derato raro, una volta messe da parte le idee precon-cette sulla sua presentazione, gli studi di screening hanno mostrato l’esistenza di un quadro differente. Il più grande studio di screening condotto fino a oggi ha valutato 1221 gatti diabetici, di cui 319 (26,1%) presen-tavano concentrazioni sieriche di fattore di crescita insu-lino-simile 1 (IGF-1, insulin-like growth factor 1) >1000 ng/ml (intervallo di confidenza al 95%: 23,6-28,6%).2 Di questi 319 gatti, 63 (20%) furono sottoposti a studi di imaging dell’ipofisi e/o a necroscopia, che permisero di rilevare che 60 gatti su 63 (95%) presentavano una neoformazione ipofisaria; 56 masse furono identificate mediante tomografia computerizzata (TC), 3 mediante risonanza magnetica (RM) e 1 alla necroscopia. Questi dati indicano che il dosaggio dei livelli sierici di IGF-1 ha un valore predittivo positivo per l’HST pari al 95% (inter-vallo di confidenza al 95%: 90-100%); ciò suggerisce che il 25% circa di tutti i gatti diabetici del Regno Unito sia affetto da acromegalia. Tuttavia, solo il 24% dei vete-rinari indicava un forte sospetto pre-test di acromegalia nei propri pazienti prima delle procedure diagnostiche, dal momento che la maggior parte non mostrava i segni fenotipici caratteristici dell’acromegalia.2 Studi condotti nei Paesi Bassi e in Svizzera hanno dimostrato una pre-valenza simile: approssimativamente 1 gatto diabetico su 5 era affetto da HST.3
Bisogna sottoporre a screening ambulatoriale i gatti diabetici?Il dibattito scientifico sulla prevalenza dell’HST/acro-megalia tra i gatti diabetici è ancora aperto. Le diffe-renze nei risultati potrebbero essere correlate all’uso di differenti metodi di dosaggio dell’IGF-1 e di differenti criteri nella scelta dei soggetti da esaminare, a in-fluenze geografiche e anche alla diversa esposizione a certe tossine (vedi in seguito). In ogni caso, dal punto di vista clinico, l’esito di questo dibattito non modificherà l’indicazione generale suggerita dagli studi condotti negli ultimi dieci anni: in tutti i gatti affetti da diabete mellito, bisogna escludere l’HST/acromegalia quale possibile causa. L’argomentazione avanzata a
SEZIONE 1. Ipotalamo e ipofisi10
Libro_Feldman_ITA.indb 10 30/09/19 14:55

Malattie dell’ipofisiLa maggior parte dei gatti con acromegalia presenta un adenoma somatotropo dell’ipofisi (Figg. 2.2 e 2.3). Altre diagnosi istologiche comprendono l’iperplasia ipofisaria e “alterazioni carcinomatose”. Anche se in base a dati re-centi la causa dell’HST felino è stata identificata nella mag-gior parte dei casi in un adenoma somatotropo, 10 ipofisi “adenomatose” su 17 mostravano anche una concomi-tante iperplasia acinosa ipofisaria. Questa osservazione suggerisce la possibilità che l’iperplasia preceda le altera-zioni adenomatose e potrebbe fornire indizi in merito all’e-ziologia della malattia (ossia, iperstimolazione responsabile di iperplasia, a sua volta esitante in adenoma [Fig. 2.2]).
In seguito a trasformazione neoplastica delle cellule ipofisarie, i normali cicli di secrezione pulsatile del GH au-mentano in frequenza e ampiezza. Dal momento che, oc-casionalmente, essi sono associati a basse concentrazioni di GH, la somministrazione di dosi elevate di insulina eso-gena può risultare periodicamente dannosa (Fig. 2.4). Gli effetti dell’insulina possono essere alquanto differenti nel medesimo paziente in relazione al livello di GH (elevato o ridotto) presente al momento della somministrazione.
Nell’uomo è comune il riscontro di adenomi secer-nenti sia GH sia prolattina (fino al 30%). In una coorte di gatti con HST valutata recentemente, non si è osservata alcuna secrezione concomitante di prolattina. In quello studio, gli adenomi somatotropi erano di dimensioni
come lo è attualmente. Benché non sia nota l’esatta pre-valenza dell’HST/acromegalia in queste popolazioni non diabetiche, è prevedibile che l’identificazione e il tratta-mento corretto dei gatti con acromegalia porteranno a un miglioramento degli esiti. Alcuni dati non pubblicati sug-geriscono che il 5-7% dei gatti con ispessimento mio-cardico diagnosticato come HCM è in realtà affetto da HST. Si tratta di un aspetto particolarmente importante, considerato che l’HCM non è curabile, mentre l’HST può essere trattato.
Anche se “acromegalia” è un termine medico ge-nerale impiegato per descrivere qualsiasi disturbo che nell’uomo è causato da un’ipersecrezione cronica di GH, nella maggior parte dei casi esso è associato a un adenoma somatotropo dell’ipofisi. Altre cause includono carcinomi somatotropi o malattie extraipofisarie (per es., tumori polmonari) responsabili di una liberazione ec-cessiva del fattore di rilascio del GH.6 Nell’uomo, l’acro-megalia può esitare in gigantismo qualora la condizione preceda la chiusura delle epifisi, anche se più comune-mente esordisce in individui di mezza età o più anziani. Alcuni individui con gigantismo sono alquanto alti, po-tendo raggiungere una statura >2,4 metri. Nel gatto, le forme di HST/acromegalia segnalate fino a questo mo-mento risultano secondarie a un’anomalia ipofisaria e tutti i casi riportati sembrano avere un’insorgenza nell’età adulta: nella letteratura peer-review non è stato segnalato alcun caso di gigantismo felino.
FIGURA 2.2 Immagine TC in proiezione trasversale dell’en-cefalo di un gatto con HST. È chiaramente visibile un ingros-samento dell’ipofisi, che protrude dalla sella turcica a livello della base dell’encefalo. La larghezza massima è indicata dalla linea orizzontale verde, l’altezza massima dalla linea verticale rossa.
FIGURA 2.3 Istopatologia (colorazione EE; ingrandimento 100× e 400×) della parte distale neoplastica dell’ipofisi di un gatto acromegalico. Normalmente si osserva una combina-zione bilanciata di cellule basofile e acidofile; questo tessuto, ottenuto da un gatto con adenoma somatotropo, rivela una predominanza di cellule acidofile (colorazione rossa).
100×
400×
Capitolo 2. Ipersecrezione di GH: acromegalia (ipersomatotropismo) 11
Libro_Feldman_ITA.indb 11 30/09/19 14:55

di alterazioni endocrine. Quest’ultimo problema è interes-sante, considerato che uno studio ha riportato la presenza di alti livelli di composti organoalogenati nei gatti con HST rispetto a quelli senza HST.7 Inoltre, i composti organoalo-genati condividono alcune caratteristiche con gli estrogeni che, a loro volta, sono in grado di indurre la formazione di adenomi somatotropi. Attualmente è dimostrata la pre-senza di recettori per gli estrogeni nell’ipofisi felina, fatto che conferisce credibilità a questa teoria. Nella prevalenza dell’HST felino bisogna prendere in considerazione un possibile ruolo dell’ambiente (Fig. 2.5).
Determinati fattori rendono i gatti particolarmente vul-nerabili alla formazione di adenomi somatotropi. I gatti possiedono un gene importante nel metabolismo dei composti o degli xenobiotici organoalogenati (il gene codificante per la proteina di inibizione degli idrocarburi arilici o gene AIP [aryl-hydrocarbon-inhibiting protein]). Nei gatti, in particolare in quelli affetti da HST, sono stati descritti alcuni polimorfismi per questo gene.8 Nelle no-stre abitazioni sono presenti tossine e sostanze chimiche potenzialmente pericolose nei tappeti, nei mobili, nei de-tergenti e in altri materiali. La taglia e il comportamento naturale dei gatti (girovagare per casa; diretto contatto con agenti pericolosi durante toelettature particolar-mente intense) aumentano ulteriormente il loro rischio di accumulare agenti “perturbatori endocrini” o tossine oncogene presenti nell’ambiente domestico. È quindi possibile fare un paragone con le ipotesi riguardanti l’e-ziologia dell’ipertiroidismo, nel quale sono state chiamate in causa queste stesse sostanze chimiche, compresi i composti ignifughi. Pertanto, le differenze geografiche nella prevalenza dell’HST potrebbero anche trovare una spiegazione nei diversi livelli di contaminazione da parte di tossine ambientali.
variabili, da neoformazioni minuscole fino a masse coin-volgenti quasi l’intera ipofisi anteriore con ingrossamento macroscopico dell’adenoipofisi.
I profili di espressione genica dei gatti con e senza HST non hanno rivelato differenze in nessuno dei principali or-moni adenoipofisari, mentre hanno mostrato correlazioni nell’espressione genica di molti di questi ormoni. Sono quindi giustificati ulteriori studi riguardanti la possibile causa dell’iperplasia somatotropa. Tali studi potrebbero includere la determinazione dell’espressione dei recettori inibitori, lo studio di mutazioni nella linea germinale e la valutazione di un’eventuale associazione dell’acromegalia felina con l’esposizione a sostanze chimiche responsabili
454035302520151050
GH (n
g/m
l)
Tempo
FIGURA 2.4 La linea blu indica il normale andamento secreto-rio pulsatile del GH nel gatto. Gli adenomi secernenti GH con-servano tale caratteristica secretoria, che tuttavia mostra una maggiore frequenza e una maggiore quantità di ormone secreto (linea rossa). A volte, la somministrazione di alte dosi di insulina esogena, spesso necessaria nel gatto con HST, può causare ipo-glicemia iatrogena quando le concentrazioni di GH sono basse.
FIGURA 2.5 La struttura molecolare di composti organoalogenati come le sostanze ignifughe (destra) è simile a quella degli estro-geni (sinistra); ciò implica che tali composti possono stimolare i recettori per gli estrogeni presenti nell’ipofisi del gatto, inducendo la trasformazione adenomatosa.
OH
HO Br Br
O
SEZIONE 1. Ipotalamo e ipofisi12
Libro_Feldman_ITA.indb 12 30/09/19 14:55

uno stato diabetico. Inoltre, l’eccesso di GH e di IGF-1 si ripercuote gradualmente sui tessuti molli, sull’osso e sulla cartilagine e potrebbe interferire con vari sistemi corpo-rei. Pertanto, alcuni gatti affetti da HST presentano molte somiglianze cliniche con i pazienti umani acromegalici, tra le quali complicazioni ossee, cardiovascolari e respira-torie.1-3 Sia per il gatto sia per l’uomo è descritta la com-parsa di organomegalia viscerale e ipertrofia cardiaca, po-tenzialmente reversibili con il trattamento.1,9,10,11 Nei gatti con HST è comunemente riportata la presenza di stridori e ronchi inspiratori.1,2,10
Caratteristiche cliniche e diagnosiPresentazioneI gatti affetti da HST possono sviluppare una varietà di segni clinici. La condizione può interessare tutte le razze ed entrambi i sessi, con una possibile predilezione verso i maschi castrati, i gatti domestici a pelo corto e i gatti Maine Coon. La Tabella 2.1 mette a confronto le caratte-ristiche salienti dei gatti con e senza aumentate concen-trazioni di IGF-1. Considerato il decorso lento, insidioso e progressivo della condizione, al momento della pre-sentazione i gatti possono non mostrare alcun segno o manifestarne molti e tali segni possono essere di entità variabile da lieve a grave e preoccupante, analogamente a quanto si verifica nell’uomo.
Anche se l’HST è stato descritto quasi esclusiva-mente in gatti diabetici, grazie all’atteggiamento pro-attivo nei confronti dello screening della condizione, attualmente si stanno mettendo in luce alcune pre-sentazioni in pazienti non diabetici. A rigor di logica, nelle fasi iniziali della malattia non dovrebbero essere presenti segni clinici. Una volta insorti, i segni di HST saranno inizialmente molto lievi, rendendo difficile il
Conseguenze delle malattie dell’ipofisiUna volta instauratasi l’ipersecrezione di GH, gli effetti combinati anabolici e catabolici di questo ormone, as-sieme all’anomalo aumento nella produzione di IGF-1, portano all’insorgenza della malattia. L’IGF-1 deriva prin-cipalmente dal fegato e per la sua produzione è necessa-ria la presenza di insulina nel sangue portale. Pertanto, la mancanza di insulina nel diabete potrebbe rappresentare un elemento interferente quando si cerca di correlare le concentrazioni di GH e IGF-1 (vedi paragrafo Diagnosi).
L’aumento di dimensioni di un tumore ipofisario solo raramente costituisce la causa dei segni di presentazione principali. Sembra che i gatti siano in grado di tollerare neoformazioni ipofisarie anche voluminose senza mo-strare alcuna compromissione a carico del SNC. In ogni caso, non è possibile escludere che la presenza di males-sere e di disfunzione (per es., cefalea o cecità periferica) sia dovuta a un voluminoso tumore ipofisario. Dal mo-mento che il GH interferisce con la sensibilità all’insulina, un suo eccesso può portare allo sviluppo di diabete mel-lito a volte difficile da controllare. Le cause della ridotta sensibilità all’insulina non sono state completamente chiarite, anche se alcuni fattori presumibilmente coinvolti comprendono una riduzione dei recettori per l’insulina e la competizione tra il GH e l’insulina per le vie di comuni-cazione post-recettoriali da essi condivise. Dal momento che i gatti affetti da HST sono diversi da quelli con dia-bete mellito non complicato e, in via di principio, presen-tano cellule β pancreatiche sane, l’aumentata produzione di insulina endogena compenserebbe inizialmente la maggiore resistenza a questo ormone. In molti gatti con HST l’aumento dei cicli di secrezione dell’insulina non può essere mantenuto a lungo, per cui la resistenza all’in-sulina finisce per prendere il sopravvento sull’aumentata produzione dell’ormone, con conseguente sviluppo di
TABELLA 2.1 Razza, sesso e peso corporeo in gatti con concentrazioni sieriche di IGF-1 superiori o inferiori a 1000 ng/ml.
Età media (anni) Razze comuni Sesso Peso corporeo medio (kg)
IGF-1 <1000 ng/ml 11,8
DSH 83%DLH 9%
Burmese 2%Abissino 0,8%
Maine Coon 0,6%
M castrato 65%M intero 1,6%
F sterilizzata 32%F intera 0,8%
5,2
IGF-1 >1000 ng/ml 11,3
DSH 85%DLH 7%
Burmese 2%Maine Coon 1,6%
M castrato 71%M intero 2,5%
F sterilizzata 26%F intera 0,6%
5,4
Adattato da Niessen et al.2 DLH: domestico a pelo lungo (domestic long-haired); DSH: domestico a pelo corto (domestic short-haired).
Capitolo 2. Ipersecrezione di GH: acromegalia (ipersomatotropismo) 13
Libro_Feldman_ITA.indb 13 30/09/19 14:55

pancreatiche con conseguente riduzione della produ-zione di insulina endogena.
Nelle fasi iniziali dell’HST, considerata in particolare l’assenza di una predisposizione intrinseca al diabete (a differenza di quanto si osserva nei gatti con diabete mel-lito primario), l’eccesso di GH sarà controbilanciato da una maggiore sintesi e liberazione di insulina endogena da parte del pancreas. Questo fenomeno è inizialmente possibile in quanto, nello stadio precoce dell’acromega-lia, la maggior parte dei gatti non presenta una disfun-zione delle cellule β. Inoltre, all’inizio della terapia con insulina esogena in seguito all’insorgenza del diabete, gli effetti combinati dell’insulina esogena, del conseguente abbassamento del glucosio ematico e della riduzione degli effetti tossici del glucosio sulle cellule β possono portare a un miglioramento della sintesi endogena di insulina e persino consentire una temporanea remis-sione del diabete. Ci si deve aspettare, tuttavia, che tale remissione sia di breve durata. Una volta riconosciuta la presenza di diabete in un gatto, è possibile prevedere che i pazienti con HST presentino un aumento del peso corporeo nonostante lo scarso controllo glicemico. Oltre
riconoscimento della loro origine acromegalica. Nel più grande studio di screening condotto finora, solo un vete-rinario su quattro sospettava la presenza di acromegalia sulla base della visita clinica in gatti in cui successiva-mente fu emessa la diagnosi di HST.2
il gatto diabetico con HStNei gatti con HST, il quadro clinico può apparire quello del diabete non complicato con i classici segni di po-liuria, polidipsia e polifagia quali uniche manifestazioni osservate. Alcuni possono essere inizialmente sensi-bili all’insulina, mentre in altri la condizione può essere estremamente difficile da trattare. Altri pazienti presen-tano un fabbisogno apparentemente illimitato di insulina esogena. È prevedibile che, con il passare del tempo, la maggior parte dei gatti con diabete secondario a HST diventi meno sensibile all’insulina e con una condizione più difficile da controllare. Questa progressione è presu-mibilmente correlata all’esposizione cronica a concen-trazioni eccessive di GH, forse in continuo aumento via via che il tumore ipofisario si ingrandisce. Si può inoltre manifestare una progressiva insufficienza delle cellule β
TABELLA 2.2 Segni clinici in gatti diabetici con HST confermato, rispetto ad altri soggetti con diabete mellito primario (non acromegalico).
Segni cliniciPrevalenza nei gatti con diabete mellito secondario a HST
Prevalenza nei gatti con diabete mellito
non complicato
Poliuria 87% 75%
Polidipsia 87% 85%
Polifagia 75%, di cui estrema: 20% 55%, di cui estrema: 0%
Calo ponderale 42% 60%
Aumento ponderale 17% 0%
Stridori/ronchi respiratori 38% 10%
Segni del SNC (esclusa letargia) 1,7% 0%
Letargia 25% 35%
Rigidità/disturbi della mobilità 10% 10%
Organomegalia addominale (nefromegalia e/o epatomegalia) 40% 25%
Prognatismo inferiore 18% 10%
Aspetto a clava delle zampe 13% 0%
Tratti facciali larghi 37% 0%
Soffio cardiaco 18% 20%
Stazione plantigrada 3% 10%
Adattato da Niessen et al.2
SEZIONE 1. Ipotalamo e ipofisi14
Libro_Feldman_ITA.indb 14 30/09/19 14:55

a questa indicazione per lo screening dell’HST, anche la prevalenza di questa condizione (25% nel Regno Unito) suggerisce la necessità di prendere in considerazione la possibile presenza di HST in tutti i gatti diabetici.
In alcuni gatti con HST e diabete mellito secondario, l’impatto del diabete incontrollato sembra prevalere sugli effetti anabolici associati alla presenza di concentrazioni eccessive di GH e IGF-1. Si tratta di gatti che presentano una tendenza a perdere peso. È giusto ricordare che mancano caratteristiche patognomoniche attraverso le quali discriminare tra gatti con diabete mellito incontrol-lato e gatti con diabete secondario all’acromegalia. Alcuni gatti diabetici acromegalici richiedono piccole dosi di in-sulina, mentre in altri anche dosi estremamente elevate non sembrano avere un impatto sulle concentrazioni ematiche di glucosio (Tab. 2.2).
FIGURA 2.6 In questo gatto acromegalico è evidente l’allarga-mento dei tratti facciali.
FIGURA 2.7 Ecocardiografia di un gatto con HST. Le immagini ot-tenute da gatti con HST rivelano spesso un quadro simile a quello dell’HCM; ciò nonostante, si deve sempre prendere in considera-zione un possibile HST, anche nel paziente non diabetico.
il gatto non diabetico con HStAttualmente, viene identificato un numero sempre più elevato di gatti non diabetici affetti da acromegalia.12 Ciò dimostra non solo che nel gatto l’HST non è sempre re-sponsabile dello sviluppo di diabete mellito, ma anche che la condizione decorre probabilmente per un consi-derevole periodo di tempo prima che il diabete diventi conclamato. I segni clinici associati all’HST non diabe-tico sono prevalentemente legati agli effetti anabolici di eccessive concentrazioni di GH e IGF-1. I pazienti affetti vanno incontro a una crescita anomala dei tessuti molli, delle cartilagini e del tessuto osseo (Figg. 2.6-2.9). La Tabella 2.3 elenca alcuni esempi di manifestazioni os-servate nei gatti con HST in assenza di diabete mellito. Si avverte comunque il lettore che questo elenco non è completo, ragion per cui il clinico dovrebbe mantenere un
TABELLA 2.3 Alterazioni patologiche e possibili quadri clinici di presentazione nei gatti non diabetici con HST.
Alterazioni patologiche Quadro di presentazione
Alterazioni ipertrofiche del miocardio Soffio cardiaco, insufficienza cardiaca congestizia
Stimolo del centro della fame da parte del GH Polifagia (estrema)
Impatto del GH e dell’IGF-1 sul metabolismo e sulla massa dei tessuti molli
Aumento ponderale
Crescita di tessuti molli nelle vie aeree Ronchi, stridori, ostruzione delle vie aeree superiori
Alterazioni cartilaginee e dei tessuti molli Artrite e malformazioni articolari
Crescita ossea a livello di faccia e artiTratti facciali larghi, prognatismo inferiore e allargamento dei piedi (da cui il nome “acromegalia”)
Crescita di una neoformazione ipofisariaSegni a carico del sistema nervoso centrale: crisi convulsive, apatia, cecità periferica (descritta nell’uomo, ma difficile da valutare nel gatto)
Capitolo 2. Ipersecrezione di GH: acromegalia (ipersomatotropismo) 15
Libro_Feldman_ITA.indb 15 30/09/19 14:55

DiagnosiMisura delle concentrazioni sieriche di iGF-1Per la maggior parte dei medici veterinari, la misura delle concentrazioni sieriche totali di IGF-1 rappresenta il mezzo più pratico e accessibile per lo screening dell’HST nel gatto. Il valore predittivo positivo di un aumento delle con-centrazioni di IGF-1 (>1000 ng/ml, RIA) nei gatti diabetici è risultato pari al 95% (intervallo di confidenza al 95% 90-100%), fatto che indica la sua affidabilità clinica.2 Il limite di soglia arbitrario di 1000 ng/ml è probabilmente elevato e da ciò derivano una maggiore specificità ma una minore sensibilità delle determinazioni di IGF-1. Concentrazioni di IGF-1 >1000 ng/ml possono essere raggiunte solo quando il GH viene secreto stabilmente in quantità estremamente elevate. Dal momento che la secrezione di GH conserva probabilmente il caratteristico ciclo secretorio pulsatile (anche in caso di adenoma), è prevedibile che molti gatti con HST non presentino costantemente concentrazioni di IGF-1 circolante così elevate. Pertanto, anche valori in-feriori di IGF-1 (600-1000 ng/ml) sono in via di principio anomali (anche se provvisti di una minore specificità per la diagnosi) e, qualora vengano riscontrati, dovrebbero perlomeno essere tenuti sotto controllo. Si invita il lettore a diffidare di test di dosaggio non validati, per i quali non siano disponibili dati clinici a supporto dei limiti di soglia suggeriti. Esistono inoltre differenze tra i vari laboratori e tra i vari metodi di dosaggio di IGF-1.
Dinamica di iGF-1 e suo impatto sulla diagnosiL’insulina pancreatica viene normalmente secreta nella vena porta, a livello intraepatico, prima che questo vaso
atteggiamento aperto nei confronti di altri segni che po-trebbero essere correlati agli effetti catabolici e anabolici del GH e agli effetti anabolici dell’IGF-1. Inoltre, quanto più precocemente viene condotto lo screening, tanto più facilmente sarà possibile riconoscere i segni clinici più impercettibili.
Caso 1: esempio di gatto acromegalico non diabetico12
Gatto maschio castrato di 9 anni, di razza europea a pelo corto (DSH, domestic short-haired) con anamnesi di 2 mesi di incremento ponderale nonostante un appe-tito normale. Il proprietario aveva tentato diverse strate-gie dietetiche, che si erano dimostrate inefficaci. Alla vi-sita clinica non erano emersi reperti degni di nota, fatta forse eccezione per un certo allargamento dei tratti fac-ciali (reperto soggettivo basato sull’esperienza). Il profilo ematologico e quello biochimico erano nella norma. La glicemia e le concentrazioni sieriche di fruttosamina mi-surate inizialmente e circa 3 settimane dopo rientravano nei rispettivi intervalli di riferimento. L’esame delle urine aveva rivelato un peso specifico (USG, urine specific gravity) di 1038 e assenza di glucosio. All’ecocardiogra-fia bidimensionale era evidente una lieve ipertrofia della parete libera del ventricolo sinistro (6,5 mm in diastole). La diagnosi di HST era supportata da un aumento della concentrazione di IGF-1 (1468 ng/ml) e dalla succes-siva documentazione di un aumento della lunghezza (0,63 cm), della larghezza (0,65 cm) e dell’altezza (0,4 cm) dell’ipofisi mediante tomografia computerizzata con contrasto.
FIGURA 2.8 L’ispessimento miocardico è un reperto comune nell’HST; in questo caso si osserva ispessimento sia del setto interventricolare sia della parete libera del ventricolo sinistro.
FIGURA 2.9 L’aumento ponderale in un gatto con diabete non controllato deve costituire un campanello d’allarme; molti gatti raggiungono un peso corporeo al di sopra della media a causa degli effetti anabolici del GH e dell’IGF-1.
SEZIONE 1. Ipotalamo e ipofisi16
Libro_Feldman_ITA.indb 16 30/09/19 14:55

si immetta nella circolazione sistemica. Una percentuale significativa dell’insulina pancreatica viene utilizzata dal fegato per varie attività, tra cui la sintesi e la secrezione di IGF-1. Poiché i gatti con diagnosi recente di diabete mostrano spesso un deficit di insulina, anche le concen-trazioni di IGF-1 saranno ridotte, fatto potenzialmente in grado di generare risultati falsi-negativi. Inoltre, un au-mento dei livelli di IGF-1 è stato riportato anche in gatti diabetici non acromegalici.
Considerato il possibile impatto della riduzione della concentrazione di insulina endogena sulla produzione di IGF-1, recentemente abbiamo condotto uno studio nel tentativo di dare risposta a due domande: 1. Quanti gatti con diagnosi recente di diabete e sottopo-
sti a trattamento presentano concentrazioni sieriche di IGF-1 entro l’intervallo di riferimento e solo in un secondo tempo mostrano un aumento dei valori al di sopra della soglia per la diagnosi di HST?
2. Qual è la forza della correlazione tra concentrazioni di insulina endogena e concentrazioni di IGF-1 nei gatti diabetici non trattati?
Ai fini dello studio prospettico sono stati considerati cam-pioni seriali di sangue di gatti diabetici ottenuti da clini-che veterinarie di prima consultazione del Regno Unito. Per essere inclusi nello studio, i gatti non dovevano es-sere stati trattati con insulina per più di 180 giorni. Sono state valutate le concentrazioni sieriche di IGF-1 e di in-sulina endogena basale nei campioni di sangue di 219 gatti. Tra i gatti con concentrazioni di IGF-1 >1000 ng/ml, 20 (9,1%) mostravano inizialmente livelli di IGF-1 <1000 ng/ml; è pertanto possibile che, in questi gatti, il clinico responsabile avesse escluso la possibilità di HST, considerando il risultato di un singolo test inconfutabile e specifico al 100%. In questi 20 gatti, l’aumento mediano della concentrazione di IGF-1, dopo una terapia insulinica iniziale della durata media di 2 mesi, era pari a 594 ng/ml. I livelli basali di insulina endogena nei gatti diabetici non trattati e con concentrazioni di IGF-1 <1000 ng/ml erano significativamente più bassi rispetto a quelli con concentrazioni di IGF-1 >1000 ng/ml. Nei gatti non trattati
è stata riscontrata una moderata correlazione positiva tra concentrazioni di insulina endogena e concentrazioni di IGF-1. Lo studio ha concluso che, quando si utilizza il sud-detto valore limite, approssimativamente 1 gatto su 10 con diagnosi recente di diabete e con concentrazioni di IGF-1 indicative di un HST sottostante mostra inizialmente un valore negativo. Pertanto, valori più bassi di insulina en-dogena, che presentano una moderata correlazione con le concentrazioni di IGF-1, e/o l’adozione di valori soglia subottimali potrebbero costituire dei fattori contribuenti.
Caso 2: dati clinici e di laboratorio di gatto diabetico (maschio castrato di 11 anni, razza DSH) con concentrazioni crescenti di IGF-1Il mese 0 rappresenta il momento della presentazione iniziale e l’inizio della terapia con insulina esogena. Lo screening all’avvio del trattamento non escludeva la pre-senza di HST (Tab. 2.4).
test di soppressione del GH siericoNei pazienti umani in cui si sospetta una condizione cau-sata da un’ipersecrezione ormonale, i test di soppressione rappresentano comunemente il metodo di riferimento per discriminare gli individui che potrebbero essere affetti dalla disendocrinia a causa di una “soppressione ano-mala”. Attualmente, nel gatto, i test di soppressione del GH non sono raccomandati come strumento diagnostico a causa della loro dipendenza dalla valutazione delle con-centrazioni sieriche di GH, per le quali non sono disponi-bili in commercio test di dosaggio. Tuttavia, per il gatto, è stato validato un dosaggio radioimmunologico del GH, ragion per cui potrebbe rendersi commercialmente di-sponibile un test di dosaggio per questa specie.14 La sop-pressione del GH attraverso la somministrazione di gluco-sio rappresenta un valido strumento in medicina umana, mentre nei gatti il valore di riferimento per sospetto HST ancora non è stato stabilito. In uno studio, il test di tolle-ranza al glucosio per via EV non ha soppresso le concen-trazioni di GH nei gatti sani.15 Infine, è stato descritto un test di soppressione con octreotide, che tuttavia è stato impiegato solo a fini di ricerca.16
TABELLA 2.4 Dati clinici di un gatto maschio castrato di 11 anni, razza DSH, con concentrazioni di IGF-1 inizialmente normali.
Fruttosamina (µmol/l) Dose di insulina esogena (unità/kg/iniezione, q12h) Peso corporeo (kg) IGF-1 sierico (ng/ml)
Mese 0 680 1 3,95 212
Mese 1 654 4 3,95 505
Mese 2 575 5 4,5 1143
Capitolo 2. Ipersecrezione di GH: acromegalia (ipersomatotropismo) 17
Libro_Feldman_ITA.indb 17 30/09/19 14:55

mellito da HST aumentano significativamente, mentre le variazioni nei livelli di IGF-1 non risultano significative. Ciò suggerisce un possibile ruolo della grelina sierica quale marker dell’effetto del trattamento.
Diagnostica per immaginiDopo aver stabilito che un gatto con sospetto di HST pre-senta un aumento delle concentrazioni di IGF-1, la dia-gnostica per immagini (TC o RM della regione ipofisaria) rappresenta a rigor di logica il passo successivo dell’iter diagnostico. Nella maggior parte dei gatti con concen-trazioni di IGF-1 >1000 ng/ml, l’ipofisi protrude oltre il margine dorsale della sella turcica, reperto che indica un ingrossamento della ghiandola (Fig. 2.1). Nel gatto, un’al-tezza dell’ipofisi >4 mm è considerata indicativa di ingros-samento ipofisario.2,13 La RM si è dimostrata più sensibile della TC nell’identificare un ingrossamento o la presenza di irregolarità nell’ipofisi. Ciò nonostante, considerata la fa-cilità di esecuzione e il costo ridotto della TC nella maggior parte dei centri, spesso si opta per la TC con contrasto.
Se si pianifica una TC rapida, è raccomandabile sedare il gatto con una combinazione di midazolam e ketamina IM o EV (idealmente dopo un’ecocardiografia). Circa il 95% dei gatti con HST presenta un’anomalia ipofisaria alla TC. Si tratta di una percentuale elevata, considerato soprattutto che i tumori esordiscono sempre sotto forma di piccoli ammassi di cellule. Trattandosi di una condizione diagnosticata negli stadi avanzati, è probabile che sia sotto-diagnosticata. La Figura 2.10 illustra in ulteriore dettaglio la sensibilità della TC e della RM nella diagnosi di HST.
il riscontro di un tumore mediante imaging è necessario per la diagnosi?Si sottolinea che, al loro esordio, i tumori ipofisari sono di piccole dimensioni (microscopici), per cui ci si potrebbe
Dosaggio delle concentrazioni sieriche del propeptide del procollageneL’HST felino è associato a un’anomala crescita dei tes-suti. Recentemente, nel gatto, le concentrazioni sieriche del propeptide del procollagene di tipo III (PIIIP, type III procollagen propeptide), un indicatore periferico del turnover del collagene, si sono dimostrate in grado di for-nire evidenze di malattia attiva o di bioattività del GH. Le concentrazioni sieriche mediane di PIIIP sono risultate cinque volte più elevate nei gatti con HST e diabete se-condario rispetto ai gatti con diabete mellito non compli-cato. È stata inoltre riscontrata una correlazione signifi-cativa tra le concentrazioni sieriche di IGF-1 e di PIIIP. Dato che il PIIIP non dipende dalla disponibilità di insu-lina a livello portale (epatico), questo parametro potrebbe dimostrarsi utile, forse come componente di un panel analitico, per aumentare la possibilità di diagnosticare in maniera affidabile l’HST felino senza la necessità di ricor-rere alla diagnostica per immagini intracranica.
il potenziale utilizzo della misurazione della grelina siericaNei pazienti umani con HST, è stato osservato che il pep-tide oressizzante grelina, un secretagogo del GH, viene soppresso attraverso un meccanismo di down-regula-tion, mentre le sue concentrazioni aumentano quando la terapia è efficace. Nel gatto, le concentrazioni sieriche di grelina si sono rivelate significativamente più elevate nei gatti di controllo rispetto a quelli con diabete mellito indotto dall’HST.17 Tuttavia, i gatti con diabete mellito indotto dall’HST presentavano concentrazioni simili a quelle osservate nei gatti con diabete mellito non com-plicato, fatto che rende questo test inutile per fini diagno-stici. In ogni caso, in seguito a radioterapia dell’ipofisi, le concentrazioni sieriche di grelina nei gatti con diabete
Gatti diabetici:IGF-1 >1000 ng/ml
85% positivi alla TC 15% negativi alla TC
50% positivi alla RM 50% negativi alla RM
PM: 25% ipofisi normale
PM: 75% iperplasia ipofisaria
Diagnosi di HST
FIGURA 2.10 Vengono illustrati i risultati del più grande studio di screening sull’HST condotto fino a oggi, dal quale emergono anche alcune informazioni sulla sensibilità della TC e della RM, nonché il fatto che i casi di al-terazione microscopica dell’ipo-fisi, per es. l’iperplasia somato-tropa, possono essere associati a reperti TC e RM normali. PM: post-mortem.
SEZIONE 1. Ipotalamo e ipofisi18
Libro_Feldman_ITA.indb 18 30/09/19 14:55

il solo trattamento di altre conseguenze indotte dal-l’HST in gatti non diabetici è di rado soddisfacente. Ciò vale soprattutto nel lungo termine. Tuttavia, nei gatti diabetici, è possibile tentare la terapia insulinica qualora le altre opzioni non siano possibili. Tenden-zialmente, i gatti diabetici con HST richiedono dosi più elevate di insulina. Ma quanta insulina è esatta-mente necessaria? Sebbene si tratti di una domanda legittima, bisogna ricordare che ogni gatto è diverso e che il fabbisogno di insulina deve essere determi-nato caso per caso, come accade per ogni altro gatto diabetico. Nessun tipo particolare di insulina si è di-mostrato superiore rispetto agli altri, benché si possa affermare che sia preferibile ricorrere a tipi di insulina privi di un marcato effetto picco, soprattutto quando siano richiesti dosaggi estremamente elevati dell’or-mone. Un’insulina priva di un marcato effetto picco e in grado di assicurare una curva di effetto relati-vamente costante riduce le possibilità di ipoglicemia iatrogena. L’educazione del proprietario è essenziale, sia in termini di aspettative sia in termini di compli-canze, in particolare in riferimento all’ipoglicemia. I proprietari dovrebbero anche essere opportunamente informati in merito ai segni di insufficienza cardiaca congestizia. Una valutazione regolare della qualità della vita, preferibilmente condotta mediante stru-menti appropriati, è essenziale per prevenire la sof-ferenza continua del paziente, sia essa più o meno silente. A tal fine è possibile scaricare liberamente online alcuni strumenti di valutazione della qualità di vita, come il DiaQoL-pet, costituito da una serie di do-mande rilevanti e validate psicometricamente.19
chiedere se il riscontro di un ingrossamento dell’ipofisi sia realmente essenziale per la conferma di una dia-gnosi di HST. In ultima analisi, le tecniche di imaging avanzate non vengono utilizzate per la diagnosi, ma per ottenere informazioni in merito alle opzioni terapeutiche e alla prognosi. I test ormonali identificano la condizione nei gatti con tumori microscopici, invalidando eventuali reperti di imaging negativi. Come minimo, bisogna evi-tare di escludere un sospetto di HST sulla sola base di reperti negativi agli esami di imaging intracranico. An-che i migliori centri di imaging non sarebbero in grado di visualizzare una massa il cui diametro massimo sia <3-4 mm.
In uno studio caso-controllo condotto su 68 gatti con HST e 36 gatti di controllo, la TC ha permesso di rilevare che nei gatti con HST l’osso frontale e l’osso parietale erano più spessi (0,8 mm), la distanza tra le arcate zigomatiche era in media maggiore di 5,4 mm rispetto ai controlli e i rami della mandibola erano in media 1,1 mm più spessi.13 Lo stesso studio ha rivelato che, mediamente, nei gatti con HST, la cute e i tessuti sottocutanei situati dorsalmente all’osso frontale erano 0,4 mm più spessi, i tessuti situati lateralmente all’ar-cata zigomatica erano 0,7 mm più spessi e quelli situati ventralmente ai rami della mandibola erano 1,1 mm più spessi. L’area media della sezione trasversale del rinofa-ringe era di 11,1 mm2 più piccola nei gatti con HST. Nei gatti con HST si osservavano con maggiore frequenza reperti di prognatismo mandibolare e segni di malforma-zione dell’articolazione temporomandibolare. Tuttavia, le differenze tra gatti affetti da HST e gatti non affetti erano piccole. Pertanto, a rigor di logica, lo studio ha concluso che nei gatti con acromegalia le variazioni nei tratti fac-ciali non erano né frequenti né particolarmente evidenti, ragion per cui l’esame della sola fisionomia facciale non avrebbe una sensibilità accettabile ai fini della diagnosi.
TrattamentoSono disponibili diverse opzioni di trattamento. Di seguito saranno discussi i dettagli relativi a ciascuna terapia, mentre un loro riepilogo viene fornito nel Box 2.1 e nella Tabella 2.5. Queste informazioni comprendono i vantaggi e gli svantaggi di ciascuna opzione terapeutica.
Trattamento delle conseguenze di un’ipersecrezione di GHIl solo trattamento del diabete mellito secondario al-l’HST si dimostra raramente soddisfacente. Anche
BOX 2.1 Opzioni di trattamento
1. Riduzione/rimozione della causa dell’eccesso di GH (potenzialità di cura permanente)a. Ipofisectomia.b. Radioterapia.c. Pasireotide/inibizione medica dell’ipofisi.d. Crioterapia.
2. Trattamento delle conseguenze (gestione me-dica) del solo HST; esempi:a. Insulina esogena per il diabete mellito.b. Farmaci cardiaci per l’insufficienza cardiaca
congestizia.c. Analgesia per le artropatie.
Capitolo 2. Ipersecrezione di GH: acromegalia (ipersomatotropismo) 19
Libro_Feldman_ITA.indb 19 30/09/19 14:55

con concentrazioni sieriche di IGF-1 >1000 ng/ml. No-nostante la necessità di ricorrere all’imaging intracranico (TC o RM) per la pianificazione prechirurgica, un ingros-samento dell’ipofisi non è considerato un prerequisito per l’intervento chirurgico. La procedura chirurgica è descritta in dettaglio nel Capitolo 4; bisogna comunque sottolineare che presso il centro in cui operano gli autori i gatti vengono posizionati in decubito sternale con la te-sta immobilizzata rigidamente mediante un apposito te-laio chirurgico disponibile in commercio (Brainsight™). Questo sistema consente di conseguire un accurato po-sizionamento della testa, con il palato duro in posizione pressoché verticale.
integrazione post-chirurgicaDopo l’intervento di ipofisectomia, il paziente viene trat-tato con desmopressina per via congiuntivale, nonché con idrocortisone per infusione finché non è in grado di alimentarsi; a quel punto si passa al trattamento a lungo termine per via orale con idrocortisone, nonché con le-votiroxina. È opportuno monitorare attentamente le con-centrazioni di glucosio e regolare le dosi di insulina in
IpofisectomiaQuesto libro dedica un capitolo apposito alla chirurgia dell’ipofisi. Pertanto, il presente paragrafo si limiterà a descrivere la chirurgia dal punto di vista internistico e a fornire i dati raccolti nella Acromegalic Cat Clinic presso cui operano gli autori.
Esperienza chirurgica in aumentoDa molto tempo, l’escissione chirurgica è considerata il trattamento di elezione per i pazienti umani affetti da acromegalia. La chirurgia si dimostra più efficace ri-spetto alla terapia medica o alla radioterapia, da sole o in associazione. Nei Paesi Bassi, Meij et al. hanno im-piegato per molti anni l’ipofisectomia transfenoidale per il trattamento di cani e gatti con ipercortisolismo di ori-gine ipofisaria, a conferma del fatto che nel gatto la chi-rurgia dell’ipofisi può essere eseguita con successo.20,21 Fino a poco tempo fa, l’esperienza riguardante la chi-rurgia ipofisaria nel trattamento di gatti con HST era al-quanto limitata. Presso il centro in cui operano gli autori, l’ipofisectomia è un intervento chirurgico comune, che viene proposto di routine ai proprietari di gatti diabetici
TABELLA 2.5 Opzioni di trattamento per l’HST, con rispettivi vantaggi e svantaggi più importanti.
Modalità di trattamento Vantaggi Svantaggi
Ipofisectomia
Tasso di successo molto elevato.Tratta la causa sottostante e rimuove il tumore.La maggior parte dei gatti va incontro a remissione diabetica.Esito prevedibile.Normalizza i livelli di IGF-1.
Disponibilità.Costo.Morbilità e mortalità (<10%).
Radioterapia
Può ridurre la dimensione del tumore.Scarsa morbilità e mortalità.Una minoranza di gatti va incontro a remissione diabetica.
Disponibilità.Non normalizza i livelli di ormoni: l’aumento dell’IGF-1 persiste.Progressione della patologia indotta da GH e IGF-1.In genere necessità di molteplici anestesie.Costo.Non rimuove il tumore, recidive relativamente frequenti.Imprevedibilità dell’effetto.
PasireotideTasso di successo modesto.Nessuna richiesta di anestetici.Scarsa morbilità e mortalità.
Costo.Non normalizza I livelli di ormoni.Lascia il tumore in sede.Alcuni effetti indesiderati gastrointestinali autolimitanti.
Trattamento delle conseguenze dell’eccesso di GH, non dell’HST
Ampia disponibilità.Una minoranza di gatti (circa 1 su 5) può mostrare un’adeguata qualità della vita per un certo periodo di tempo.
La maggior parte dei gatti non presenta un’adeguata qualità di vita nonostante il trattamento insulinico ad alte dosi.Ipoglicemia con dosi elevate di insulina quando la secrezione pulsatile di GH è bassa.Lascia il tumore in sede.Progressione della patologia indotta da GH e IGF-1.
Crioterapia Tasso di successo riportato in due casi. Esperienza molto limitata.
SEZIONE 1. Ipotalamo e ipofisi20
Libro_Feldman_ITA.indb 20 30/09/19 14:55

opinioni correnti e controindicazioni riguardanti la chirurgia dell’ipofisiGrazie all’esperienza crescente nell’uso dell’ipofisectomia per il trattamento definitivo dell’HST/acromegalia felina, è ormai sempre più evidente che questo approccio costitu-isce l’opzione terapeutica di riferimento. Esistono tuttavia alcune controindicazioni, tra cui l’eccessiva dimensione del tumore, la presenza di comorbilità significative che impediscano un recupero anestetico e post-chirurgico si-curo (in particolare, malattie renali di grado significativo) o la completa avversione al rischio del proprietario. In caso di insufficienza cardiaca, la chirurgia può essere contem-plata in seguito a stabilizzazione. Per questi gatti, l’ipofi-sectomia rappresenta l’unica opzione di trattamento con un’autentica potenzialità di contrastare la cardiomiopatia.
L’impegno economico iniziale potrebbe rappresentare un ostacolo alla chirurgia. Tuttavia, è importante che il ve-terinario e il proprietario realizzino che un anno di tratta-mento inefficace mediante terapia insulinica o radioterapia potrebbe presentare costi simili. L’esperienza riguardante l’ipofisectomia nei gatti acromegalici è pertanto in linea con quella riguardante i pazienti umani. L’alto tasso di remis-sione del diabete dimostra l’enorme capacità di ripresa delle cellule β del pancreas, alcune delle quali sembrano non risentire degli effetti di mesi o anni di progressiva resi-stenza all’insulina. Per la maggior parte dei proprietari dei gatti, il tasso di mortalità peri- e postoperatoria è accetta-bile, considerata la scarsa disponibilità di modalità tera-peutiche alternative parimenti efficaci (Fig. 2.11).
base a quanto richiesto da ogni paziente. Nell’80% dei casi l’integrazione con desmopressina può essere inter-rotta dopo l’immediato postoperatorio.
Risultati ottenuti finoraLe concentrazioni sieriche di IGF-1 si riducono rapida-mente, marcatamente e costantemente nelle 4 setti-mane immediatamente successive all’intervento chirur-gico, fino a raggiungere un livello mediano di 60 ng/ml (range 15-1975). Oltre il 90% dei gatti mostra una nor-malizzazione delle concentrazioni sieriche di IGF-1 e il 70% circa va incontro a remissione diabetica.
ComplicanzeGli effetti avversi della chirurgia, tra cui insufficienza cardiaca congestizia, paresi facciale temporanea e atassia vestibolare transitoria, si sono rivelati per lo più infrequenti e trattabili. Una percentuale di gatti ha ma-nifestato polifagia e aumento ponderale in seguito all’i-pofisectomia. Tra i gatti di cui era stato registrato il peso corporeo più di 2 mesi dopo l’intervento (range da 2 mesi a 3 anni), approssimativamente il 70% mostrava un aumento ponderale, in media del 12% circa. È pos-sibile che questo effetto rifletta un fenomeno simile a quello che si osserva nell’uomo, in cui esiste una rela-zione ben stabilita tra deficit di GH e obesità.22 In questi gatti, non vi sono evidenze di un associato effetto nega-tivo sulla qualità di vita a questo stadio. È raccomanda-bile che, nel periodo post-ipofisectomia, i proprietari dei gatti prestino attenzione a un eventuale aumento ponde-rale. Quando necessario, è possibile ricorrere a una dieta a ridotto contenuto calorico.
BOX 2.2 Integrazioni post-HST
1. Integrazione con glicocorticoidi (per es., idrocor-tisone o cortisone acetato 0,5 mg/kg q12-24h; a volte prednisolone può essere troppo potente).
2. Integrazione tiroidea (per es., levotiroxina 0,1 mg q24h).
3. Desmopressina per via congiuntivale (una goc-cia q8h, ridurre gradualmente nell’arco di 1 mese, cessazione completa possibile nell’80% dei casi).
4. Iniezioni di insulina (secondo necessità; l’85% dei pazienti cessa di richiedere insulina in caso di diabete prechirurgico).
FIGURA 2.11 Concentrazioni sieriche di IGF-1 prima e dopo ipo-fisectomia (HPX) in gatti diabetici acromegalici. Tra tutti i metodi di trattamento, l’ipofisectomia è stata associata con la riduzione più rapida e marcata delle concentrazioni sieriche di IGF-1, fatto che spiega gli alti tassi di remissione del diabete, nonché il suo effetto in termini di neutralizzazione delle alterazioni miocardiche.
2000
1500
1000
500
0
IGF-
1 (ng
/ml)
Prima della HPX Dopo HPX
Capitolo 2. Ipersecrezione di GH: acromegalia (ipersomatotropismo) 21
Libro_Feldman_ITA.indb 21 30/09/19 14:55

ipofisario alla TC. I 12 gatti sono stati trattati con 8 mg/kg SC di pasireotide LAR una volta al mese per 6 mesi. All’inizio del trattamento e, in seguito, una volta al mese, al fine di monitorare la risposta al trattamento sono state misurate le concentrazioni di fruttosamina e di IGF-1 e sono state eseguite le curve glicemiche. Al termine dello studio sono state eseguite TC ripetute dell’ipofisi. Sette gatti su 12 hanno completato lo studio; 3 gatti su 12 sono andati incontro a remissione diabetica. Il ritiro dallo studio si verificava dopo un periodo di tempo mediano di 2 mesi (range: 1-4,5 mesi) a causa della persistenza di diabete mellito non controllato (n=1), di diarrea (n=2), di un evento ipoglicemico (n=1) e di un episodio di che-toacidosi diabetica (n=1). Sono state documentate ri-duzioni significative nelle concentrazioni di IGF-1, nella dose di insulina e nelle concentrazioni di fruttosamina. Gli eventi avversi comprendevano feci temporaneamente malformate (9/12), polifagia progressiva (3/12), ipoglice-mia (4/12) e ritardata ricrescita del pelo (1/12). L’altezza massima dell’ipofisi risultava aumentata in 2 gatti su 7, ridotta in 4 su 7 e invariata in 1 gatto su 7. Dopo il com-pletamento dello studio, i gatti continuavano a ricevere il trattamento con pasireotide, con aggiustamento preciso del dosaggio. Al ridursi dell’incidenza e della gravità degli effetti indesiderati, pasireotide diventava un trattamento potenzialmente contemplabile dai proprietari, a patto di disporre dei mezzi finanziari per acquistare il farmaco.
Pasireotide è il primo farmaco che si è dimostrato in grado di migliorare sia i parametri biochimici sia quelli clinici nei gatti con HST. In alcuni casi consente persino di conseguire la remissione diabetica. Ulteriori studi do-vranno incentrarsi sull’ottimizzazione della dose al fine di conseguire tassi di successo più elevati e minori tassi di sospensione del trattamento, cercando nello specifico di ridurre gli eventi avversi gastrointestinali. La riduzione della dimensione del tumore ipofisario osservata in alcuni gatti è a ulteriore supporto dell’utilità di questo farmaco quale trattamento primario a lungo termine, sebbene anche il suo utilizzo preoperatorio possa essere di bene-ficio, grazie alla stabilizzazione glicemica e alla riduzione delle dimensioni del tumore prima dell’ipofisectomia.
agonisti dopaminergiciNei tumori felini di più grandi dimensioni è stata dimo-strata una riduzione dell’espressione dei recettori D2R. Questa osservazione potrebbe suggerire un possibile mec-canismo in grado di permettere la crescita incontrollata del tumore, oltre a confermare la probabile causa dell’in-successo di precedenti terapie basate sull’uso di agonisti della dopamina, come cabergolina. In via aneddotica, il
Gestione medicapossibili target recettoriali Il trattamento dei gatti con HST mediante gli agonisti del recettore della somatostatina 2 (SSTR2, somatostatin re-ceptor 2) octreotide o lanreotide o mediante L-deprenyl non si è dimostrato efficace. Questi agenti aumentano in-direttamente le concentrazioni extracellulari di dopamina (attraverso il recettore 2 della dopamina [D2R]). Fino a poco tempo fa, il profilo SSTR e D2R degli adenomi so-matotropi felini non era noto. Oltre a spiegare la scarsa risposta dei gatti con HST ai suddetti farmaci, il profilo di espressione dei recettori di questi tumori potrebbe fornire le evidenze molecolari necessarie per orientare la scelta di terapie farmacologiche alternative per i gatti con HST. Alcuni studi molecolari hanno mostrato un’aumen-tata espressione di somatostatina SSTR1, 2 e 5 nei gatti con HST rispetto ai controlli sani. Tuttavia, l’espressione di SSTR1 e SSTR5 è risultata più elevata rispetto a quella di SSTR2, fatto che potrebbe spiegare la scarsa risposta a octreotide e lanreotide osservata nel gatto.23,24
pasireotidePasireotide è un nuovo analogo della somatostatina con affinità di legame per SSTR1, 2, 3 e 5. In un pic-colo studio, condotto utilizzando la forma a breve durata d’azione del farmaco, ai giorni 1 e 5 venivano misurate le concentrazioni plasmatiche di IGF-1 e monitorata la glicemia tramite curva glicemica delle 24 ore.24 Nei giorni 2, 3 e 4 i gatti ricevevano pasireotide 0,03 mg/kg SC ogni 12 ore. Dopo ver confrontato le concentrazioni di IGF, la dose di insulina e la sensibilità stimata all’insulina prima e dopo il trattamento, in tutti e 12 i gatti che avevano completato lo studio è stata osservata una riduzione delle concentrazioni di IGF-1 (concentrazione mediana al giorno 1: 2000 ng/ml; concentrazione mediana al giorno 5: 1105 ng/ml). Inoltre, la dose di insulina risultava più bassa al giorno 5 rispetto al giorno 1, mentre la sensibi-lità all’insulina mostrava un marcato miglioramento, con conseguente riduzione forzata della dose di insulina o persino cessazione del trattamento insulinico. Non sono emersi effetti avversi clinicamente rilevanti.
È stata sviluppata una formulazione a rilascio prolun-gato (LAR, long-acting release) di pasireotide in grado di consentire il dosaggio una volta al mese. L’uso di questo farmaco ha portato a un efficace controllo biochimico del-l’HST umano. Uno studio ha dimostrato l’efficacia della formulazione a LAR anche nei gatti.23 Questo studio è stato condotto su 12 gatti diabetici con diagnosi di HST formulata in base alle aumentate concentrazioni sieriche di IGF-1 (>1000 ng/ml) e al riscontro di un ingrossamento
SEZIONE 1. Ipotalamo e ipofisi22
Libro_Feldman_ITA.indb 22 30/09/19 14:55

890 ng/ml; mese 1: 929 ng/ml). Sembra quindi che nei gatti diabetici acromegalici esaminati nello studio la te-rapia con cabergolina, alla dose e per il periodo di trat-tamento utilizzati, non abbia determinato una riduzione delle concentrazioni di IGF-1, mentre il miglioramento del controllo glicemico è stato osservato solo in un gatto. Considerate le segnalazioni aneddotiche in merito alla risposta positiva a questo farmaco, sarebbe probabil-mente opportuno valutare ulteriori casi, con regimi di dosaggio alternativi e un follow-up a più lungo termine.
RadioterapiaLa radioterapia viene descritta nel Capitolo 5. Dal punto di vista internistico, la prima segnalazione in merito all’uso della radioterapia per il trattamento dell’acrome-galia felina risale al 1990, quando due gatti furono trat-tati con radioterapia al cobalto.25 La risposta non risultò soddisfacente ed entrambi i gatti richiesero un ulteriore trattamento. Trattamenti ipofrazionati, somministrati una volta alla settimana per cinque settimane, con una di-mensione del campo di irradiazione di 3,5-4 cm, hanno portato a un aumento del tasso di remissione del dia-bete mellito in 5 gatti su 8, ma le concentrazioni di IGF-1 nel follow-up non sono state riportate. In ogni caso, ra-ramente è stato documentato il controllo biochimico dell’IGF-1 e non tutti i gatti hanno manifestato un miglio-ramento del controllo del diabete mellito.25-29 La neces-sità di anestesie multiple e la limitata disponibilità di cen-tri in grado di offrire questo servizio limitano l’utilità della radioterapia. Alcuni articoli descrivono l’uso della radio-terapia stereotassica nel controllo dell’HST felino, ripor-tando una risposta al trattamento variabile in maniera si-mile a quella conseguita con i trattamenti ipofrazionati.26
In sintesi (Tab. 2.6), è ragionevole considerare la ra-dioterapia come opzione terapeutica quando non è di-sponibile l’ipofisectomia oppure in presenza di un tumore ipofisario voluminoso. I medici veterinari e i proprietari
trattamento con agonisti dopaminergici si è rivelato effi-cace in singoli gatti. Tuttavia, quando il trattamento con questi farmaci è stato valutato in maniera più strutturata in una casistica di gatti, non è stato osservato alcun effetto.
Un recente studio prospettico di coorte condotto su gatti diabetici acromegalici di proprietà ha valutato l’ef-ficacia degli agonisti dopaminergici. I 6 gatti coinvolti nello studio sono stati ammessi in ospedale al giorno 0, sottoposti a esami di imaging dell’ipofisi e quindi trattati con terapia a base di cabergolina (giorno 1). I pazienti sono stati monitorati in ospedale fino al giorno 4 e in se-guito dimessi con un trattamento continuo da proseguire a domicilio. Le concentrazioni sieriche di IGF-1 e frutto-samina sono state misurate ai giorni 0 e 4 e al mese 1. Ogni eventuale effetto indesiderato associato al farmaco è stato registrato. Tre gatti sono stati trattati con cabergo-lina 5 µg/kg PO q24h, mentre gli altri tre con cabergolina 10 µg/kg PO q24h. La concentrazione mediana di IGF-1 al giorno 0 era pari a 1797 ng/ml, un valore statistica-mente non differente da quelli registrati al giorno 4 e al mese 1 (rispettivamente, 1884 ng/ml e 1754 ng/ml). La concentrazione mediana di fruttosamina al giorno 0 era pari a 551 µmol/l (range: 454-887), statisticamente non differente dai valori ottenuti al giorno 4 e al mese 1 (rispettivamente, 551 e 569). Tutti i gatti sono stati trat-tati con insulina PZI e la dose mediana al giorno 0 (1,1 unità/kg ogni 12 ore) non era differente rispetto alle dosi somministrate al giorno 4 e al mese 1 (rispettivamente 1,1 e 1,2). Tre pazienti hanno manifestato un singolo evento avverso gastrointestinale (inappetenza, diarrea), risoltosi nell’arco di tre giorni. Un gatto ha riportato un miglioramento del controllo del diabete (le concentra-zioni di fruttosamina erano pari a 454 µmol/l al giorno 0 e a 288 µmol/l al mese 1, mentre la dose di insulina era di 1 unità/kg ogni 12 ore al giorno 0 e di 0,2 unità/kg ogni 12 ore al mese 1), anche se non sono state os-servate riduzioni nella concentrazione di IGF-1 (giorno 0:
TABELLA 2.6 Riepilogo di diversi risultati ottenuti con la radioterapia. Studio Numero Sorgente Dose Protocollo Esito
Peterson, 199025 2 Cobalto-60 48 Non fornito; 4 settimane 1 CR
Kaser-Hotz, 200230 2 Elettroni 38,5 11 fr.; 3/sett. 1 CR
42 12 fr.; 3/sett. 1 PR
Brearley, 200629 8 Acc. lin. 38 5 fr.; 1/sett. 5 CR; 1 PR; 2 SD
Mayer, 200627 8 Acc. lin. 45-54 2,7-3,0 Gy fr., 4/sett. 5/7 endo R; 5/5 neuro
Dunning, 200928 14 Acc. lin. 37 10 fr.; 3/sett. 13/14
CR: remissione completa (complete remission); PR: remissione parziale (partial remission); SD: malattia stabile (stable disease).
Capitolo 2. Ipersecrezione di GH: acromegalia (ipersomatotropismo) 23
Libro_Feldman_ITA.indb 23 30/09/19 14:55

PrognosiNei gatti con HST, l’ipofisectomia è la modalità terapeutica associata alla prognosi migliore. Dal 2012, la nostra clinica ha eseguito oltre 60 interventi di ipofisectomia per il trat-tamento dell’HST e del diabete mellito felino, con esiti ec-cellenti nella maggior parte dei casi. La mortalità periope-ratoria nelle prime tre settimane si è ridotta nel tempo ed è attualmente del 10%, di cui la maggior parte dei casi è occorsa durante i primi due anni di esperienza. Le cause di morte perioperatoria includono emorragia cerebrale, in-farto ischemico e meningite settica. Il tasso di remissione del diabete nei gatti che sopravvivono è del 70% circa e la maggior parte della percentuale restante manifesta co-munque un miglioramento del controllo glicemico.
La maggior parte dei gatti che conseguono la remis-sione diabetica rimane in questo stato nel lungo termine e al momento sono stati individuati solo 4 casi di recidiva (nei gatti sottoposti a un follow-up di durata variabile da 1 a 5,8 anni). Il tasso di sopravvivenza a 1 anno (esclusi i casi di morte dovuta a cause sconosciute o non correlate) è risultato del 97%, con una frazione libera da recidiva a 1 anno pari al 95% tra i gatti andati incontro a remissione completa dopo l’intervento. Nel complesso, dal 2012, il tempo di sopravvivenza mediano considerando tutte le cause di morte è di 2,3 anni per i gatti sopravvissuti al pe-riodo postoperatorio e la maggior parte degli eventi fatali registrati è dovuta a comorbilità non correlate. Nella no-stra esperienza, sulla base di strumenti validati di valuta-zione della qualità di vita, la maggior parte dei proprietari
dovrebbero comprendere che il successo del trattamento è meno certo rispetto a quanto osservato per la chirurgia e che il momento e l’entità di un eventuale esito positivo, qualora presente, sono imprevedibili, potendo richiedere anche più di un anno. Vale la pena notare che i tassi di remissione del diabete sono inferiori in seguito alla radio-terapia e che l’irradiazione si basa di solito su molteplici interventi (che richiedono un pari numero di procedure anestetiche). Per alcuni gatti, ciò potrebbe rappresentare un rischio inaccettabile. In alcuni pazienti il successo della radioterapia può essere seguito dalla remissione. Dal punto di vista ormonale, la radioterapia non riduce ef-ficacemente le concentrazioni di GH e IGF-1 (Figg. 2.12-2.13). Presso la clinica degli autori, numerosi gatti con recidiva della malattia in seguito a radioterapia sono stati sottoposti con successo a ipofisectomia, un risultato che appare incoraggiante. Ciò implica che, nel caso di grandi tumori ipofisari e pertanto con possibile rischio di compli-canze associate all’ipofisectomia, si potrebbe inizialmente ricorrere alla radioterapia in modo da ridurre le dimen-sioni del tumore, per poi procedere con l’ipofisectomia al fine di ottenere la cura definitiva.
CrioterapiaLa crioterapia consiste nell’esposizione di un tumore ipo-fisario a temperature estremamente basse al fine di dan-neggiarlo. Sono stati descritti solo due casi di crioterapia condotta per il trattamento di un tumore ipofisario ed è quindi difficile fornire valide raccomandazioni a favore o contro questa opzione terapeutica.31
FIGURA 2.12 Concentrazioni sieriche di IGF-1 prima e dopo trattamento radioterapico in gatti diabetici acromegalici. È sta-to dimostrato che la radioterapia è associata a effetti deludenti sulle concentrazioni sieriche di IGF-1, il che spiega i modesti tassi di remissione diabetica a essa associati e la persistenza di alterazioni acromegaliche nonostante la remissione del diabete.
2000
1500
1000
500
0
IGF-
1 (ng
/ml)
Prima della RT Dopo RT
2500
2000
1500
1000
500
0
Sx
Rx
IGF-1 (ng/ml)
0 33 57Settimane dal trattamento
FIGURE 2.13 Concentrazioni sieriche di IGF-1 in due gatti con HST; uno è stato trattato mediante radioterapia (Rx: linea aran-cione), il secondo mediante ipofisectomia (Sx: linea blu).
Intervallo normale IGF-1
SEZIONE 1. Ipotalamo e ipofisi24
Libro_Feldman_ITA.indb 24 30/09/19 14:55

sottostante e sulla normalizzazione delle eccessive con-centrazioni di GH, la maggior parte delle alterazioni può essere eliminata, con conseguente normalizzazione dell’aspettativa e della qualità di vita del paziente.
riferisce un miglioramento significativo nella qualità di vita del paziente in seguito alla procedura.
Analogamente a quanto osservato nella gestione chi-rurgica dell’acromegalia umana, le concentrazioni sieriche postoperatorie di IGF-1 sembrano essere fortemente pre-dittive di successo chirurgico a lungo termine, con livelli minimi raggiunti a quattro settimane dopo l’intervento. Tutti i gatti con una normalizzazione documentata delle concentrazioni sieriche di IGF-1 entro quattro settimane hanno manifestato una remissione completa (83%) o par-ziale (17%) del diabete. Tutti e quattro i gatti con aumento delle concentrazioni sieriche di IGF-1 nel postoperatorio (>1000 ng/ml) sono rimasti diabetici. Un gatto ha presen-tato un miglioramento parziale nel controllo glicemico.
La prognosi associata alle altre modalità di trattamento è apparentemente meno favorevole, nonostante manchino dati accurati. Finora, la radioterapia e il trattamento con pa-sireotide non hanno permesso di prevenire la progressione delle alterazioni fisiche acromegaliche interne ed esterne, con conseguente danno d’organo nel lungo termine e successiva insufficienza d’organo. L’insufficienza cardiaca congestizia è una causa comune di morte, così come l’eu-tanasia praticata in caso di diabete mellito incontrollato.
Quando il proprietario sceglie di non trattare il tumore sottostante, è consigliabile procedere a una regolare va-lutazione della qualità di vita utilizzando strumenti vali-dati.19 In questa condizione, la valutazione della qualità di vita sulla sola base dell’entità dell’appetito è spesso inappropriata, a causa dell’effetto polifagico dell’eccesso di GH; di fatto, la polifagia e l’ossessione per il cibo ri-ducono spesso la qualità di vita. Sono pertanto indicati colloqui continui, programmati a intervalli regolari, con il team veterinario al fine di prevenire una sofferenza non documentata. Si sottolinea comunque che, quando il trattamento si incentra sulla rimozione del tumore
Box 2.3 Prognosi
1. Negli ultimi anni, la prognosi del gatto con HST è migliorata.
2. La prognosi migliore si consegue con il tratta-mento della causa sottostante, ossia il tumore o l’iperplasia dell’ipofisi.
3. Quando non si opta per il trattamento definitivo, è indicata una valutazione frequente della qualità di vita.
4. L’appetito non costituisce un parametro adeguato per misurare la qualità di vita nel gatto con HST.
Punti chiave 1
Punti chiave 3
Punti chiave 2
■ L’HST e l’acromegalia sono termini correlati ma dif-ferenti.
■ Il termine ipersomatotropismo implica semplice-mente una produzione eccessiva di GH.
■ Il termine acromegalia implica la presenza di alte-razioni fisiche e conseguenze metaboliche rilevabili, conseguenti all’HST.
■ Il ruolo dell’ipersomatotropismo/acromegalia tra i gatti diabetici e non diabetici è in via di ridefinizione.
■ La determinazione delle concentrazioni sieriche o plasmatiche di IGF-1 rappresenta il test diagnostico di screening più utile.
■ L’assenza di tumore ipofisario agli esami di imaging non esclude l’HST.
■ Sia la TC sia la RM risultano utili nella visualizzazione dell’ipofisi.
■ La RM è leggermente più sensibile, la TC può essere eseguita sotto sedazione.
■ La vera prevalenza dell’HST può essere solo stima-ta. La prevalenza sembra essere maggiore nei gatti diabetici.
■ Le stime tra i gatti diabetici variano da 1 su 2 a 1 su 5. ■ Le stime tra i gatti non diabetici con fenotipo simil-HCM raggiungono valori massimi di 1 su 20.
■ Attualmente stanno emergendo altre presentazioni non diabetiche grazie allo screening della malattia nella popolazione generale.
■ In genere la causa è rappresentata da un tumore della parte distale dell’ipofisi anteriore.
■ L’eccessiva secrezione di GH e IGF-1 è la causa re-sponsabile delle patologie osservabili.
■ Solo raramente la neoformazione ipofisaria è di per sé motivo di visita per un gatto, a causa di un effetto massa.
Capitolo 2. Ipersecrezione di GH: acromegalia (ipersomatotropismo) 25
Libro_Feldman_ITA.indb 25 30/09/19 14:55

Bibliografia
1. Niessen SJ, Petrie G, Gaudiano F, et al. Feline acromeg-aly: an underdiagnosed endocrinopathy? J Vet Intern Med 2007;21:899-905.
2. Niessen SJ, Forcada Y, Mantis P, et al. Studying cat (Fe-lis catus) diabetes: beware of the acromegalic imposter. PLoS One 2015;10:e0127794. doi: 10.1371/journal.pone.0127794.
3. Schaefer S, Kooistra HS, Riond B, et al. Evaluation of insu-lin-like growth factor-1, total thyroxine, feline pancreas-spe-cific lipase and urinary corticoid-to-creatinine ratio in cats with diabetes mellitus in Switzerland and the Netherlands. J Feline Med Surg 2017;19:888-896.
4. Vilar L, Vilar CF, Lyra R, et al. Acromegaly: clinical features at diagnosis. Pituitary 2017;20:22-32.
5. Dreval AV, Trigolosova IV, Misnikova IV, et al. Prevalence of diabetes mellitus in patients with acromegaly. Endocr Con-nect 2014;3:93-98.
6. Melmed S, Kleinberg DL, Bonert V, Fleseriu M. Acromegaly: assessing the disorder and navigating therapeutic options for treatment. Endocr Pract 2014;20 Suppl 1:7-17.
7. Dirtu AC, Niessen SJ, Jorens PG, Covaci A. Organohalo-genated contaminants in domestic cats’ plasma in relation to spontaneous acromegaly and type 2 diabetes mellitus: a clue for endocrine disruption in humans? Environ Int 2013;57-58:60-67.
8. Scudder CJ, Niessen SJ, Catchpole B, et al. Feline hyperso-matotropism and acromegaly tumorigenesis: a potential role for the AIP gene. Domest Anim Endocrinol 2017;59:134-139.
9. Borgeat K, Niessen SJM, Wilkie L, et al. Time spent with cats is never wasted: Lessons learned from feline acrome-galic cardiomyopathy, a naturally occurring animal model of the human disease. PLoS One 2018;13:e0194342. doi: 10.1371/journal.pone.0194342.
10. Lourenço BN, Randall E, Seiler G, Lunn KF. Abdominal ul-trasonographic findings in acromegalic cats. J Feline Med Surg 2015;17:698-703.
11. Norman EJ, Mooney CT. Diagnosis and management of dia-betes mellitus in five cats with somatotrophic abnormalities. J Feline Med Surg 2000;2:183-190.
12. Fletcher JM, Scudder CJ, Kiupel M, et al. Hypersomatotro-pism in 3 cats without concurrent diabetes mellitus. J Vet Intern Med 2016;30:1216-1221.
13. Lamb CR, Ciasca TC, Mantis P, et al. Computed tomo-graphic signs of acromegaly in 68 diabetic cats with hyper-somatotropism. J Feline Med Surg 2014;16:99-108.
14. Niessen SJ, Khalid M, Petrie G, Church DB. Validation and application of a radioimmunoassay for ovine growth hormone in the diagnosis of acromegaly in cats. Vet Rec 2007;160:902-907.
15. Kokka N, Garcia JF, Morgan M, George R. Immunoassay of plasma growth hormone in cats following fasting and admin-istration of insulin, arginine, 2-deoxyglucose and hypotha-lamic extract. Endocrinology 1971;88:359-366.
16. Slingerland LI, Voorhout G, Rijnberk A, Kooistra HS. Growth hormone excess and the effect of octreotide in cats with dia-betes mellitus. Domest Anim Endocrinol 2008;35:352-361.
17. Jensen KB, Forcada Y, Church DB, Niessen SJ. Evalua-tion and diagnostic potential of serum ghrelin in feline hy-persomatotropism and diabetes mellitus. J Vet Intern Med 2015;29:14-20.
18. Keyte SV, Kenny PJ, Forcada Y, et al. Serum N-Terminal Type III procollagen propeptide: an indicator of growth hor-mone excess and response to treatment in feline hyperso-matotropism. J Vet Intern Med 2016;30:973-982.
19. Niessen SJ, Powney S, Guitian J, et al. Evaluation of a quali-ty-of-life tool for cats with diabetes mellitus. J Vet Intern Med 2010;24:1098-1105.
20. Van Rijn SJ, Galac S, Tryfonidou MA, et al. The influence of pituitary size on outcome after transsphenoidal hypoph-ysectomy in a large cohort of dogs with pituitary-dependent hypercortisolism. J Vet Intern Med 2016;30:989-995.
21. Meij BP, Auriemma E, Grinwis G, et al. Successful treatment of acromegaly in a diabetic cat with transsphenoidal hy-pophysectomy. J Feline Med Surg 2010;12:406-410.
22. Jørgensen JO, Vestergaard E, Gormsen L, et al. Meta-bolic consequences of GH deficiency. J Endocrinol Invest 2005;28(5 Suppl):47-51.
23. Gostelow R, Scudder C, Keyte S, et al. Pasireotide long-act-ing release treatment for diabetic cats with underlying hy-persomatotropism. J Vet Intern Med 2017;31:355-364.
24. Scudder CJ, Gostelow R, Forcada Y, et al. Pasireotide for the medical management of feline hypersomatotropism. J Vet Intern Med 2015;29:1074-1080.
25. Peterson ME, Taylor RS, Greco DS, et al. Acromegaly in 14 cats. J Vet Intern Med 1990;4:192-201.
26. Sellon RK, Fidel J, Houston R, et al. Linear-accelera-tor-based modified radiosurgical treatment of pituitary tumors in cats: 11 cases (1997-2008). J Vet Intern Med 2009;23:1038-1044.
27. Mayer MN, Greco DS, LaRue SM. Outcomes of pitu-itary tumor irradiation in cats. J Vet Intern Med 2006; 20:1151-1154.
28. Dunning MD, Lowrie CS, Bexfield NH, et al. Exogenous in-sulin treatment after hypofractionated radiotherapy in cats with diabetes mellitus and acromegaly. J Vet Intern Med 2009;23:243-249.
29. Brearley MJ, Polton GA, Littler RM, Niessen SJ. Coarse fractionated radiation therapy for pituitary tumours in cats: a retrospective study of 12 cases. Vet Comp Oncol 2006;4:209-217.
30. Kaser-Hotz B, Rohrer CR, Stankeova S, et al. Radiother-apy of pituitary tumours in five cats. J Small Anim Pract 2002;43:303-307.
31. Blois SL, Holmberg DL. Cryohypophysectomy used in the treatment of a case of feline acromegaly. J Small Anim Pract 2008;49:596-600.
SEZIONE 1. Ipotalamo e ipofisi26
Libro_Feldman_ITA.indb 26 30/09/19 14:55