Volume 6 Indice - MediPrint · Esame obiettivo e indagini diagnostiche Il paziente presenta...
Transcript of Volume 6 Indice - MediPrint · Esame obiettivo e indagini diagnostiche Il paziente presenta...
R-bendamustina come terapia di prima linea in un paziente 2anziano affetto da leucemia linfatica cronicaP. Sportoletti, F. Falzetti
Bendamustina in leucemia linfatica cronica recidivata 4dopo plurimi regimi di trattamento incluso ASCTC. Lambertini
Bendamustina in associazione a rituximab in una paziente con leucemia 6linfatica cronica “highest-risk” pluritrattataR. Rizzi, A. Mestice, C. Germano, G. Nardelli, A. Giordano, P. Curci, G. Specchia
Trattamento di prima linea con lo schema bendamustina-rituximab 9in un linfoma follicolareG. Gini, S. Trappolini, P. Leoni
Efficacia e tollerabilità della terapia con bendamustina-rituximab 12in prima linea in un paziente affetto da linfoma non-Hodgkin marginale S. Trappolini, G. Gini, P. Leoni
Efficacia del trattamento con bendamustina-rituximab in paziente 14con linfoma non-Hodgkin indolenteE. Albi, C. Camerini, G. Casarola
Bendamustina è un farmaco sicuro ed efficace nel paziente affetto 16da linfoma di Hodgkin refrattarioO. Soffritti, G.M. Rigolin, A. Cuneo
Bendamustina in paziente affetto da linfoma di Hodgkin 18con seconda recidiva M. Dell’Olio
Bendamustina nella terapia di salvataggio in un caso di linfoma di Hodgkinrefrattario trattato in prima linea secondo una strategia “PET-risk adapted” 21A. Romano, A. Figuera
Immunocitoma e utilizzo off-label di bendamustina in una giovane paziente 24A. Monti
Esperienze cliniche in ematologia sul territorio nazionaleVolume 6
Indice
2
Presentazione del caso
Paziente e anamnesiPaziente di sesso maschile di 81anni, in discrete condizioni disalute, che giunge alla nostraattenzione in seguito al riscontrooccasionale di linfocitosi e lievepiastrinopenia.
Esame obiettivo e indaginidiagnosticheIl paziente presenta numeroseadenopatie superficiali diffuse atutti i distretti esplorabili condimensioni massime di 4 cm insede ascellare destra. L’emocromomostra globuli bianchi pari a16.950/mm3 con linfociti pari al71%, emoglobina 14,7 g/dl, piastri-ne 119.000/mm3. Il quadro immu-nofenotipico su sangue perifericorisulta compatibile con la diagnosidi leucemia linfatica cronica (LLC).I fattori prognostici analizzatimostrano negatività dello ZAP70e CD38, stato non-mutato dei geniIgVH e delezione 13q14 non com-prendente il gene RB1.Un’e cografia addome documen-ta, al retro peritoneo, la presenzadi numerosissimi linfonodi pato-logici del diametro fino a 4 cm.Presenta linfoadenopatie volumi-nose in sede sottorenale bilatera-
le che, a sinistra, determinanoidronefrosi per inglobamentodel tratto ureterale; non è pre-sente splenomegalia.
Approccio terapeutico,valutazione a distanza eaggiustamentiterapeutici
A fronte di questa diagnosi conquadro addominale a rischio dicomplicanze renali si decide di ini-ziare immediatamente una che-mioterapia citoriduttiva. Il pazien-te è sottoposto a una terapia di 1ªlinea comprendente bendamusti-na 70 mg/m2/die, per 2 giorni con-secutivi (giorni 1 e 2 di ogni ciclo)e rituximab 375 mg/m2 al giorno1, di cui esegue 3 cicli totali .L’intervallo tra i cicli è stato di 30giorni e ha consentito di comple-tare la terapia nel mese diDicembre 2012. La tolleranza allaterapia è buona e il paziente nonpresenta alcuna tossicità d’organoné ematologica. Una rivalutazioneecografica, a distanza di un mesedall’ultimo ciclo di chemioimmu-noterapia, mostra una completascomparsa delle linfoadenomega-lie addominali segnalate alla dia-gnosi. All’esame obiettivo non
sono più apprezzabili linfoadeno-megalie superficiali.
Discussione del caso erazionale delle scelteterapeutiche
L’obiettivo terapeutico nella LLC èdi ottimizzare le risposte, riducen-do al minimo la tossicità e miglio-rando la qualità della vita. Neipazienti anziani spesso risulta dif-ficile utilizzare terapie aggressivebasate sull’impiego della fludara-bina, preferendo regimi menotossici ma con una più modestaefficacia. La bendamustina è unfarmaco ibrido con proprietà diagente alchilante e analogo dellepurine, che mostra una significati-va attività come singolo agentenel trattamento di diversi disordi-ni linfoproliferativi. L’efficacia dibendamustina è stata dimostratain studi di confronto con cloram-bucil e anche in trial clinici diimmuno-chemioterapia con l’an-ticorpo monoclonale anti-CD20. Ilpresente report dimostra la sicu-rezza e l’efficacia di bendamusti-na in associazione ad anti-CD20usata in 1ª linea nel pazienteanziano. La somministrazione dibendamustina si è dimostrata
R-bendamustina come terapia di prima linea in unpaziente anziano affetto da leucemia linfatica cronicaP. Sportoletti, F. FalzettiIstituto di Ematologia, Università degli Studi di Perugia
R-BENDAMUSTINA COME TERAPIA DI PRIMA LINEA IN UN PAZIENTE ANZIANO AFFETTO DA LEUCEMIA LINFATICA CRONICA
3
essere molto efficace anche inpresenza di grosse masse adeno-patiche profonde. Il dosaggio uti-lizzato ha consentito di ottenerela completa scomparsa delle
linfoadenomegalie in assenza dineutropenia severa e prolungata,che rappresenta l’evento avversoprincipale della terapia con ben-damustina. In conclusione la
combinazione di bendamustina erituximab rappresenta una strate-gia terapeutica sicura ed efficacenel trattamento di 1ª linea delpaziente anziano affetto da LLC.
Bibliografia• Cheson BD, Wendtner CM, Pieper A et al.Optimal use of bendamustine in chroniclymphocytic leukemia, non-Hodgkinlymphomas, and multiple myeloma:treatment recommendations from aninternational consensus panel. ClinLymphoma Myeloma Leuk 2010;10:21-27.
• Fischer K, Cramer P, Busch R et al .Bendamustine combined with ritux-
imab in patients with relapsed and/orrefrac tory chronic lymphocyt icleukemia: a multicenter phase II trialof the German Chronic LymphocyticLeukemia Study Group. J Clin Oncol2011;29(26):3559-3566.
• Knauf WU, Lissichkov T, Aldaoud AJ et al.Phase III randomized study of ben-damustine compared with chlorambucil
in previously untreated patients withchronic lymphocytic leukemia. J ClinOncol 2009;27(26):4378-4384.
• Leoni LM, Bailey B, Reifert J et al.Bendamustine (Treanda) displays a dis-tinct pattern of cytotoxicity and uniquemechanistic features compared withother alkylating agents. Clin Cancer Res2008;14:309-317.
Presentazione del caso
Paziente, anamnesiIl presente articolo tratta il casoclinico di una paziente di 55anni: nell’Ottobre del 2003 leviene effettuata una diagnosi dileucemia linfatica cronica (CLL)con stadio II secondo Rai e sta-dio B secondo Binet; nel Lugliodel 2005 viene intrapresa, pressoun altro centro, una terapia conclorambucile e prednisone,seguita da immuno-chemiotera-pia secondo lo schema FCR (flu-darabina, ciclofosfamide e rituxi-mab) -5 cicli- e successivo tra-pianto autologo di cellule stami-nali ematopoietiche (ASCT )nell’Aprile 2007, con ottenimen-to di r isposta completa. NelGiugno del 2012 si verifica unaricaduta di malattia con il riscon-tro, all’esame obiettivo, di epato-megalia e adenomegalie super-ficiali in sede ascellare e latero-cervicale, bilateralmente.
Esame obiettivo e indaginidiagnosticheGli esami ematochimici evidenzia-no: emoglobina 13,8 g/dL, piastri-ne 179x109/L, leucociti 31,7x109/Lcon linfocitosi assoluta (23x109/L).La FISH (fluorescence in situ hybri-
dization), eseguita su sangue peri-ferico, evidenzia una delezione alivello di ATM (11q23). L’RX torace ènei limiti di norma. All’esame eco-grafico si evidenziano molteplicilinfonodi, aumentati di volume insede ascellare bilateralmente(massimo 5 cm a destra), piccolilinfonodi non superiori al centime-tro in sede inguinale e a livello late-rocervicale (massimo 1,5 cm), fega-to aumentato di dimensioni, pre-senza di linfonodo ingrandito alivello dell’ilo epatico (3,4 cm) ealtri linfonodi in sede periaortica.
Approccio terapeutico
In relazione alla giovane età e allarecidiva di malattia, con rapidaprogressione della sindrome infil-trativa, in una paziente preceden-temente sottoposta a diversi trat-tamenti immuno-chemioterapicie trapianto autologo di cellule sta-minali ematopoietiche, si è consi-derato il trattamento immuno-chemioterapico combinato conrituximab e bendamustina (BR) afronte dell’evidenza dei promet-tenti risultati, in letteratura, inpazienti pluritrattati come nelnostro caso. Lo schema di trattamento tera-
peutico ha previsto la sommini-strazione di r i tuximab 375mg/m2 al giorno 1 e bendamu-stina 90 mg/m2 al giorno 2 e 3(1); al termine del primo cicloimmuno-chemioterapico secon-do lo schema BR, eseguito inregime di ricovero ospedaliero er isultato ben tol lerato dal lapaziente, l’esame emocromoci-tometrico mostrava i seguentivalori: emoglobina 12,9 g/dl, pia-str ine 173x109/L , leucocit i6,7x109/L con normalizzazionedella linfocitosi. All’esame obiet-t ivo r isultavano regredite lelinfoadenomegalie superficialiapprezzabili e l’epatomegalia. Si decideva, pertanto, di prosegui-re con il medesimo schema ogni28 giorni. Alla TC total body di riva-lutazione, dopo 3 cicli terapeutici,si confermava il quadro di remis-sione completa di malattia.A distanza di 3 settimane dal ter-mine del quarto ciclo, l’emocro-mo evidenziava emoglobina11,8 g/dL, piastrine 200x109/L eleucociti 2,2x109/L con normaliz-zazione della formula leucocita-ria (neutrofili 41%, linfociti 21%).A fronte della risposta completasi è deciso di proseguire l’iterterapeutico con ulteriori 2 cicli dimantenimento con BR.
4
Bendamustina in leucemia linfatica cronica recidivatadopo plurimi regimi di trattamento incluso ASCTC. Lambertini U.O. Ematologia e Centro Trapianti Midollo Osseo, Dipartimento Onco-Ematologico internistico, Azienda Ospedaliero-Universitaria di Parma
BENDAMUSTINA IN LEUCEMIA LINFATICA CRONICA RECIDIVATA DOPO PLURIMI REGIMI DI TRATTAMENTO INCLUSO ASCT
5
Discussione del caso erazionale delle scelteterapeutiche
In considerazione della storia(numerosi cicli di immuno-che-mioterapia e recidiva dopo auto-trapianto), della giovane età dellapaziente e dei crescenti dati di let-teratura riguardanti l’efficacia, latollerabilità e la sicurezza di benda-
mustina, nonché la provata azionesinergica con rituximab, è statodeciso un programma di tratta-mento immuno-chemioterapicosecondo lo schema BR (2-4). Il dop-pio meccanismo d’azione alchilan-te e antimetabolita della benda-mustina promette una buona effi-cacia terapeutica e consente, a dif-ferenza di altri chemioterapici, diridurre notevolmente la tossicità,
sia ematologica che extraematolo-gica, senza compromettere l’atti-vità antitumorale (5,6).Nel nostro caso sono stati giàeffettuati i primi 4 cicli, con unacompleta tollerabilità senza lacomparsa alcuna di effetti collate-rali extra-midollari e nemmeno dialopecia; si sono così potuti evita-re gli effetti psicologici negativilegati alla caduta dei capelli.
Bibliografia1. Cheson BD, Wendtner CM, Pieper A et al.Optimal use of bendamustine in chroniclymphocytic leukemia, non-Hodgkin lym-phomas, and multiple myeloma: treat-ment recommendations from an interna-tional consensus panel. Clin LymphomaMyeloma Leuk 2010;10(1):21-27.2. Fischer K, Cramer P, Busch R et al.Bendamustine combined with rituximabin patients with relapsed and/or refracto-ry chronic lymphocytic leukemia: a multi-center phase II trial of the German Chronic
Lymphocytic Leukemia Study Group. J ClinOncol 2011;29(26):3559-3566.3. Bergmann MA, Goebeler ME et al.German CLL Study Group. Efficacy of ben-damustine in patients with relapsed orrefractory chronic lymphocytic leukemia:results of a phase I/II study of the GermanCLL Study Group. Haematologica 2005;90(10):1357-1364.4. Iannitto E, Morabito F, Mancuso S et al.Bendamustine with or without ritux-imab in the treatment of relapsed chron-
ic lymphocytic leukemia: an Italian retro-spective study. Br J Haematol 2011;153(3):351-357.5.Montillo M, Ricci F, Tedeschi A, VismaraE, Morra E. Bendamustine: new perspec-tive for an old drug in lymphoprolifera-tive disorders. Expert Rev Hematol 2010; 3(2):131-148. 6. Vel Veliz M, Pinilla-Ibarz J. Treatment ofRelapsed or Refractory ChronicLymphocytic Leukemia. Cancer Control2012;19(1):37-53.
6
Presentazione del caso
Paziente e anamnesi Una paziente di 62 anni giungeva,alla nostra osservazione nel 2009per leucocitosi (14.340) con linfo-citosi (8.070), rilevata 6 mesi pri-ma. All’anamnesi remota risultava-no un’infezione da HBV (HepatitisB virus), ipertensione arteriosa eobesità.
Esame obiettivo e indaginidiagnosticheAdenopatie di dimensioni compre-se tra 2 e 4 cm erano presenti insede laterocervicale, sottomandi-bolare, sovraclaveare, ascellare einguinale, bilateralmente. La milzaera palpabile 3 dita trasverse dall’ar-cata costale. La TAC confermava idati dell’esame clinico e dimostravaadenopatie multiple e confluenti, didiametro variabile tra 2 e 6 cm nellesedi addominali profonde e spleno-megalia (diametro longitudinale 16cm); inoltre il work-up diagnosticoevidenziava: leucocitosi (51.600)con linfocitosi (47.000), piccoli linfo-citi e rarissimi prolinfociti nello stri-scio di sangue periferico, profiloimmunofenotipico caratteristicodella leucemia linfatica cronica(LLC) (CD5+/CD19+/CD23+), infil-trazione midollare linfoide dell’80%
con pattern diffuso, stadio II Rai/BBinet, gene IgVH non mutato, posi-tività di CD38 e ZAP-70, incrementodella β2-microglobulina (3,3 �g/ml),doubling time linfocitario <6 mesi,buona fitness fisica.
Approccio terapeutico
Dopo aver definito la diagnosi diLLC II/B, lo stato di attività dellamalattia e la positività di parame-tri configuranti l’alto rischio pro-gnostico, veniva iniziata una che-mioimmunoterapia secondo loschema RFC (rituximab, fludarabi-na, ciclofosfamide); contempora-neamente era stata avviata la pro-filassi della riattivazione dell’HBV. La rivalutazione dello stato dimalattia, dopo 6 cicli di RFC, dimo-strava il conseguimento di unarisposta parziale (RP), con patterndi infiltrazione midollare intersti-ziale e nodulare. Alla TAC di con-trollo le linfoadenopatie si pre-sentavano ridotte in numero evolume; in particolare in sedeparaortica sinistra i linfonodi ave-vano un diametro massimo di 2,5cm e la splenomegalia era ridotta(diametro longitudinale 14 cm). Ileucociti erano 4.620 con 1.130linfociti), che all’analisi immunofe-
notipica si rivelavano T CD3+; ilvalore della β2-microglobulinaera ridotto (2,6 �g/ml).
Valutazione a distanza eaggiustamentiterapeutici
Meno di 6 mesi dopo il completa-mento dei cicli di RFC veniva evi-denziata una progressione dimalattia con la ricomparsa di ade-nopatie a localizzazione laterocer-vicale e ascellare bilaterale.Un’ulteriore TAC dimostrava, insede addominale, la presenza diadenopatie polidistrettuali (di dia-metro fino a 3,8 cm) e splenomega-lia (diametro longitudinale 15 cm). L’esame emocromocitometricorivelava 8.660 leucociti con 4.270linfociti; nello striscio di sangueperiferico, oltre a piccoli linfociti ea qualche prolinfocito, si osserva-vano alcuni grandi linfociti e cellu-le clivate. Il 40% dei linfociti circo-lanti dimostrava un fenotipoCD5+/CD19+ e CD5+/CD23+; laβ2-microglobulina era aumentata(3,1 �g/ml); si procedeva quindi allabiopsia escissionale di un linfono-do laterocervicale, il cui esameistologico risultava coerente conla diagnosi di LLC/linfoma linfociti-
Bendamustina in associazione a rituximab in una pazientecon leucemia linfatica cronica “highest-risk” pluritrattataR. Rizzi, A. Mestice, C. Germano, G. Nardelli, A. Giordano, P. Curci, G. SpecchiaSezione di Ematologia con Trapianto, Dipartimento dell’Emergenza e dei Trapianti d’Organo (DETO), Università degli Studi di Bari
BENDAMUSTINA IN ASSOCIAZIONE A RITUXIMAB IN UNA PAZIENTE CON LEUCEMIA LINFATICA CRONICA “HIGHEST-RISK” PLURITRATTATA
7
co. Rilevata la progressione dimalattia, la paziente riceveva una2ª linea di chemioimmunoterapiacon R-CHOP (rituximab, ciclofosfa-mide, doxorubicina, vincristina eprednisone) ogni 28 giorni; il trat-tamento veniva interrotto dopo 3cicli per mancanza di risposta etossicità epatica.L’analisi in FISH (fluorescence insitu hybridization) dimostrava lapresenza di del11(q22) (54%);dopo il superamento della mielo-soppressione post-terapia e dellatossicità epatica, la conta linfocita-ria raggiungeva, entro 2 mesi, ilvalore di 36.600, con neutropeniadi grado lieve e nello striscio disangue periferico si notava l’au-mento di cellule clivate e prolinfo-citi. D’altra parte la TAC documen-tava la comparsa di nuove linfoa-denopatie in sede mediastinica didimensioni fino a 3,8 cm, mentre ildiametro maggiore di quelleaddominali superava i 4 cm; venivapertanto intrapresa una che-mioimmunoterapia di 3ª lineasecondo lo schema BR (bendamu-stina, rituximab), che era protrattaper 6 cicli con intervalli di 28 giorni.I dati clinici e la TAC di rivalutazionedimostravano una regressione siadelle linfoadenopatie in numero edimensioni sia della splenomega-
lia. Si rilevavano anemia (Hb 9,8),leucopenia con neutropenia (GB2520 con N 870, L 1350) e PLT158.000; i linfociti circolanti erano TCD3+, i linfociti midollari rappre-sentavano il 15%. Tali risultati indicavano l’otteni-mento di una risposta che, a causadell’incompleto recupero midolla-re, poteva essere definita RPi. Ildecorso clinico era successiva-mente complicato da un’infezionepolmonare maggiore, con positi-vità dell’espettorato per Klebsiellapneumoniae; l’infezione si risolvevacon terapia antibiotica sistemica(tigeciclina) durante l’ospedalizza-zione. La persistenza della neutro-penia rendeva necessaria la som-ministrazione di G-CSF. Meno di 6mesi dopo il completamento dellaterapia si manifestava la progres-sione di malattia con linfoadeno-patie mediastiniche e addominali(>5 cm) sintomatiche.
Discussione del caso erazionale delle scelteterapeutiche
Per la discussione del nostro casodi LLC, caratterizzata da IGVH(immunoglobulin variable heavychain) non mutato, del(11q),
aumentata β2-microglobulina erefrattarietà a RFC, ci siamo riferitialla valutazione del rischio inpazienti fit con LLC trattata con che-mioimmunoterapia, recentementeconsiderata da Zenz et al. (1); poi-ché nella nostra paziente i marca-tori biologici indicavano un altorischio prognostico (“high-risk”),veniva intrapreso un trattamentodi 1ª linea con 6 cicli della combi-nazione RFC. Dopo una RP didurata <6 mesi si manifestavauna progressione di malattia conaggravamento del rischio, chedall’iniziale “high-risk” si modifi-cava in “highest-risk” (1); si davapertanto inizio a una 2ª linea conR-CHOP, anche in considerazionedella presentazione clinica pre-minentemente nodale; la man-canza di risposta e la tossicitàepatica rendevano però necessa-ria l’interruzione del trattamentodopo 3 cicli. Veniva quindi intra-presa una 3ª linea rappresentatadall’associazione BR (2-4); dopo 6cicli si osservava una rispostadefinibile come RPi (5) che, sen-za la persistente citopenia,avrebbe invece soddisfatto i cri-teri della risposta completa (RC);la risposta si rivelava di duratacomunque <6 mesi e gravata dainfezione.
M. RIZZI, A. MESTICE, C. GERMANO, G. NARDELLI, A. GIORDANO, P. CURCI, G. SPECCHIA
8
Bibliografia1. Zenz T, Gribben JG, Hallek M, Döhner H,Keating MJ, Stilgenbauer S. Risk categoriesand refractory CLL in the era of chemoim-munotherapy. Blood 2012;119:4101-4107.2. Fisher K, Cramer P, Busch R at al.Bendamustine combined with rituximabin patients with relapsed and/or refracto-ry chronic lymphocytic leukemia: a multi-center phase II trial of the German ChronicLymphocytic Leukemia Study Group. JClinOncol 2011;29: 3559-3566.3. Iannitto E, Morabito F, Mancuso S et al.Bendamustine with or without rituximabin the treatment of relapsed chronic lym-
phocytic leukaemia: an italian retrospec-tive study. Br J Haematol 2011;153:351-357.4. Vidal L, Gafter-Gvili A, Gurion R, RaananiP, Dreyling M, Shpilberg O. Bendamustinefor patients with indolent B cell lymphoidmalignancies including chronic lympho-cytic leukaemia. Cochrane Database SystRev 2012;9:CD009045.5. Tam CS, O’Brien S, Wierda W et al. Long-term results of the fludarabine, cyclophos-phamide, and rituximab regimen as initialtherapy of chronic lymphocytic leukemia.Blood 2008;112:975-980.6. Hallek M, Cheson BD, Catovsky D et al.
Guidelines for the diagnosis and treat-ment of chronic lymphocytic leukaemia: areport from the International Workshopon Chronic Lymphocytic Leukemia updat-ing the National Cancer Instistute-Working Group 1996 guidelines. Blood2008;111:5446-5456.7.Mauro FR, Bandini G, Barosi G et al. ItalianSociety of Hematology; Società Italiana diEmatologia Sperimentale; Gruppo ItalianoTrapianto di Midollo Osseo. SIE, SIES, GITMOupdated clinical recommendations for themanagement of chronic lymphocyticleucemia. Leuk Res 2012;36:459-466.
D’altra parte tale evoluzioneescludeva “a posteriori” che essapotesse essere tradizionalmenteclassificata come RCi legata a tos-sicità della terapia (6). Alla luce dell’efficacia, sebbene
temporanea, dimostrata dallabendamustina in combinazionecon rituximab (già usato in 1ª e 2ªlinea nella nostra paziente), si èportati a ipotizzare che un antici-pato impiego della bendamusti-
na in 2ª linea avrebbe potutoconsentire una risposta di piùlunga durata, permettendo quin-di l’utilizzazione di terapie alter-native e/o maggiormente eradi-canti (allo-SCT) (7).
9
Presentazione del caso
Paziente e anamnesiT.A., uomo, 57 anni. Il caso clinico siriferisce a un uomo di 57 anni, di cuisegnaliamo, all’anamnesi patologicaremota, un diabete mellito di tipo IIin trattamento con ipoglicemizzantiorali associato a obesità severa.A Giugno del 2010, in occasione diun ricovero ospedaliero per coleci-stite acuta litiasica, il paziente ese-guiva una TAC total body chedocumentava la presenza, nellaporzione caudale della radicemesenterica del piccolo intestino,di una formazione ovalare solida di8x6 cm di diametro, riferibile alinfoadenomegalie confluenti eparzialmente colliquate; si segna-lava, inoltre, la presenza di multiplelinfoadenomegalie diffuse su tuttoil mesentere, in sede paraorticasinistra, e intercavoaortica di 3 cmdi diametro; veniva quindi sotto-posto a intervento chirurgico dicolecistectomia e biopsia dei linfo-nodi mesenterici, ponendo dia-gnosi di linfoma B centrofollicolarecon pattern nodulare di grado II.
Esame obiettivo e indaginidiagnostichePresso il nostro centro il pazienteeseguiva tutte le indagini per ter-
minare la stadiazione di malattia,come di seguito indicato.• Esami ematochimici: nella norma.• Biopsia osteomidollare: midolloindenne da localizzazione dimalattia.
• Indagine di biologia molecolareda sangue midollare: bcl2 positivo.
• Indagine citogenetica: normale.• PET total body: voluminosa areadi captazione in sede addomina-le mediana, in corrispondenzadella massa mesenteriale visua-lizzata alla TC e riferibile a bulkyaddominale; ulteriore area diminori dimensioni in sede para-mediana sinistra all’altezza di L3;piccole linfoadenomegalie insede lomboaortica sinistra.
La diagnosi definitiva è di linfomafollicolare grado II, stadio II, FLIPI 1.
Approccio terapeutico
Nei l infomi a basso grado lamalattia si presenta, più spesso, instadio avanzato fin dal momentodella diagnosi, come in questocaso in cui abbiamo un bulkyaddominale; si è deciso quindi disottoporre il paziente all’efficacechemio-immunoterapia con ben-damustina-rituximab (BR), per untotale di 6 cicli ogni 28 giorni + 2
rituximab finali di consolidamen-to, con bendamustina al dosaggiodi 90 mg/m2 nei giorni 1-2 erituximab 375 mg/m2 al giorno 1;la terapia di supporto era costitui-ta da fattore di crescita granuloci-tario pegilato, somministrato ilgiorno successivo alla chemiote-rapia e darbepoeitina 150 µg 1 fl asettimana, con profilassi antibioti-ca con chinolonico e cotrimossa-zolo e antivirale con valaciclovir.Il paziente ha iniziato il tratta-mento a Luglio 2010, terminan-dolo a Dicembre dello stessoanno, con buona tolleranza indi-viduale e la sola tossicità extrae-matologica tipo neuropatia peri-ferica di grado II.
Valutazione a distanza eaggiustamentiterapeutici
Nonostante i risultati ottenutidall’aggiunta del rituximab neil infomi indolenti , miglioratianche con l’utilizzo della benda-mustina, rimane sempre uno zoc-colo duro di pazienti che ricado-no dopo la 1ª linea di trattamen-to; anche il nostro paziente èandato incontro a una ricaduta a15 mesi dal termine della terapia
Trattamento di prima linea con lo schema bendamustina-rituximab in un linfoma follicolareG. Gini, S. Trappolini, P. LeoniClinica di Ematologia, Ospedali Riuniti, Ancona
G. GINI, S. TRAPPOLINI, P. LEONI
10
con BR. La TAC total body, esegui-ta a Febbraio 2012, mostrava lacomparsa di multiple linfoadeno-megalie al cavo ascellare sinistrodi 4 cm di diametro e multiplelinfoadenomegalie nel contestodel tessuto adiposo mesenteriale,le maggiori del diametro di 50x36mm; alla PET total body emergevala comparsa di linfoadenomega-lie ipermetaboliche in sede ascel-lare sinistra (SUV 9), aree di iper-metabolismo glucidico in corri-spondenza delle formazioni linfo-nodali nel contesto del tessutoadiposo mesenteriale (SUV 6,9).La biopsia di un linfonodo confer-mava la ricaduta della malattia dibase; anche alla recidiva la bio-psia osteomidollare era risultataindenne da localizzazione dilinfoma.La nuova diagnosi alla ricadutaevidenziava un linfoma follicolaregrado II stadio IIIA FLIPI 2; il pazien-te iniziava così una terapia di 2ªlinea con 6 CHOP-8RTX da Marzo2012 fino a Dicembre 2012 senza
alcun problema e ottenendo unaremissione completa di malattia.Attualmente è in terapia di mante-nimento con rituximab 375mg/m2 ogni 2 mesi per un totale di2 anni.
Discussione del caso erazionale delle scelteterapeutiche
Rummel MJ ha recentemente pub-blicato importanti risultati riguar-danti lo schema immuno-chemio-terapico BR in 1ª linea nei linfominon-Hodgkin a basso grado dimalignità (1), la progression-freesurvival era di circa 24 mesi conoverall response rate del 90% e unacomplete remission rate (CR) del60%. Successivamente si sono sus-seguiti molteplici studi riguardantil’efficacia dell’utilizzo della benda-mustina in 1ª linea nella leucemialinfatica cronica (LLC) (2-4) e neipazienti anziani e fragili affetti dalinfoma B grandi cellule (5); sono
molto numerose, inoltre, le espe-rienze in 2ª linea del suo utilizzo, sianei linfomi indolenti, sia nella LLC(6). Recentemente è uscito ancheuno studio retrospettivo dellaFondazione Italiana Linfomi (FIL)che mette in luce, oltre all’efficacia,anche la sicurezza della bendamu-stina in pazienti pluritrattati (7).L’efficacia e la safety ci aveva quin-di indotto alla scelta in 1ª linea del-lo schema BR, anche se non anco-ra indicato al tempo, anche inragione delle comorbidità delpaziente e quindi dell’opportunitàdi effettuare uno schema efficaceprivo dello steroide, che avrebbepeggiorato il suo diabete instabi-le, come in effetti è poi successonella 2ª linea. Pertanto, nonostan-te la ricaduta del paziente, possia-mo affermare che lo schema BR èefficace, sicuro e, a nostro avviso,un’ottima scelta di 1ª linea, in par-ticolare in quei pazienti che posso-no presentare dei profili di rischioaumentati se sottoposti a terapiaclassica.
TRATTAMENTO DI PRIMA LINEA CON LO SCHEMA BENDAMUSTINA-RITUXIMAB IN UN LINFOMA FOLLICOLARE
11
Bibliografia1. Rummel MJ, Niederlin N, Maschneyer Get al. Study group indolent Lymphomas(StiL). Bendamustine plus rituximab ver-sus CHOP plus rituximab as first-line treat-ment for patients with indolent and man-tle-cell lymphomas: an open-label, multi-centre, randomised, phase 3 non-inferiori-ty trial. Lancet 2013;381(9873):1203-1210.2. Knauf WU, Lissichkov T, Aladaoud A etal. Phase III randomized study of ben-damustine compared with clotambucil inpreviously untreated patients with chron-ic lymphocytic leukemia. J Clin Oncol2009;27(26):4378-4384.3. Fischer K, Cramer P, Bush R et al.Bendamustine in combination with ritux-
imab for previously untreated patientswith chronic lymphocytic leukemia: amulticenter phase II trial of the GermanChronic Lymphocytic Leukemia StudyGroup. J Clin Oncol 2012;30(26):3209-3216.4.Vidal L, Gafter-Gvili A, Gurion R et al.Bendamustine for patients with indolentB cell lymphoid malignancies includingchronic lymphocytic leukaemia. CochraneDatabase Syst Rev 2012;9: CD009045.5. Horn J , K leber M, Hieke S et al .Treatment option of bendamustine incombination with rituximab in elderlyand frail patients with aggressive B-non-Hodgkin lymphoma: rational, efficacy,
and tolerance. Ann Hematol 2012;91(10):1579-1586.6. Cheson BD, Friedberg JW, Kahl BS et al.Bendamustine produces durableresponses with an acceptable safety pro-file in patients with rituximab-refractoryindolent non-Hodgkin lymphoma. ClinLymphoma Myeloma Leuk 2010;10(6):452-457.7. Rigacci L, Puccini B, Cortellazzo S et al.Bendamustine with or without rituximabfor the treatment of heavily pretreatednon-Hodgkin’s lymphoma patients : amulticenter retrospective study on behalfof the Italian Lymphoma Foundation (FIL).Ann Hematol 2012;91(7):1013-1022.
12
Presentazione del caso
Paziente e anamnesiPresentiamo qui il caso di F.S., unpaziente di 71 anni. All’anamnesipatologica remota non emergenulla di rilevante. Ad Aprile del2012, in occasione di un ricoveroospedaliero per una colica renaledestra, associata a ureteroidrone-frosi omolaterale con insufficien-za renale acuta di lieve entità, sir iscontra una componentemonoclonale pari a 11,3 g/dl. Agliesami ematochimici completi: Hb9,6 g/dl, PLT 123.000/mm3, WBC19.000/mm3, β2-microglobulina14,5 mg/l, proteinuria di BenceJones positiva, elettroforesi urina-ria tubulare con presenza di cate-ne leggere libere monoclonalikappa e creatinina 1,78 mg/dl.Data l’importante entità dellacomponente monoclonale e l’in-sufficienza renale, il pazienteveniva sottoposto a 2 successivesedute di plasmaferesi.
Esame obiettivo e indaginidiagnosticheNel Giugno del 2012 il pazientecompletava tutti gli esami di sta-diazione comprendenti la risonan-za magnetica total body, chemostrava una splenomegalia di 19
cm e una biopsia osteomidollare,che vedeva un midollo con cellula-rità del 90%, sostituito per l’80%da infiltrato linfoide nodularecomposto da piccoli linfociti conrari elementi blastici (infiltratoCD20+, CD79a+ monotipico per lacatena IgM kappa). Il controllo del-la componente monoclonale,dopo plasmaferesi, vedeva unanetta riduzione della stessa fino a4 g/dl. La diagnosi definitiva indi-cava un linfoma marginale concomponente monoclonale IgM/κ.
Approccio terapeutico
In considerazione delle buonecondizioni generali e dei risultatiottenuti in 1ª linea, in comparazio-ne fra clorambucil-rituximab ebendamustina-rituximab (BR) (1) ele pregresse esperienze in questosetting di pazienti refrattari o rica-duti (2), si è deciso di sottoporre lapaziente allo schema chemiotera-pico BR. Il suo programma avrebbeprevisto la somministrazione di 6cicli ogni 28 giorni con bendamu-stina al dosaggio di 90 mg/m2 neigiorni 1-2 e rituximab 375 mg/m2
nel giorno 1. La terapia di suppor-to era costituita da fattore di cre-scita granulocitario pegilato, som-
ministrato il giorno successivo allachemioterapia, e darbepoeitina150 µg 1 fl a settimana, con profi-lassi antibiotica con chinolonico ecotrimossazolo e antivirale convalaciclovir. Il paziente ha iniziato iltrattamento a Giugno 2012.
Valutazione a distanza eaggiustamentiterapeutici
ll paziente ha effettuato, senzaparticolari problemi, tutto il pro-gramma terapeutico completan-do l’ultimo ciclo BR a Novembredel 2012. La rivalutazione interme-dia di malattia ha mostrato unanetta riduzione della splenomega-lia fino a 14 cm, permanendo peròalta la componente monoclonaleper la quale il paziente ha conti-nuato a effettuare plasmaferesisettimanalmente. Gli esami di riva-lutazione finale, condotti aNovembre con risonanza magne-tica e biopsia osteomidollare, han-no mostrato la scomparsa dellacomponente marginale, pur tutta-via persistendo una quota supe-riore alla norma di plasmacellulecon una componente monoclona-le IgM superiore ai 4 g/dl; pertantoabbiamo ritenuto opportuno
Efficacia e tollerabilità della terapia con bendamustina-rituximab in prima linea in un paziente affetto da linfomanon-Hodgkin marginaleS.Trappolini, G. Gini, P. LeoniClinica di Ematologia, Ospedali Riuniti, Ancona
EFFICACIA E TOLLERABILITÀ DELLA TERAPIA CON BENDAMUSTINA-RITUXIMAB IN PRIMA LINEA IN UN PAZIENTE AFFETTO DALINFOMA NON-HODGKIN MARGINALE
13
intraprendere una terapia di man-tenimento con lenalinomide 15mg 1 cp/die per 21 giorni al meseal fine di garantire la stabilità dellamalattia.
Discussione del caso erazionale delle scelteterapeutiche
Benché la bendamustina non siaancora considerata un farmaco dautilizzare in 1ª linea, per questatipologia di malattie, abbiamoprovveduto a sottoporre il pazien-te a questo regime in virtù dellemolteplici esperienze con l’utiliz-zo di questo schema chemiotera-pico in pazienti con linfoma indo-
lente in 2ª linea e delle molteplicipubblicazioni che dimostrano unabuona tollerabilità di questo sche-ma chemioterapico nei pazientianziani (1-3). Horn ha pubblicato,nel 2012, un abstract dove ha ana-lizzato l’efficacia e la sicurezza diBR nei pazienti anziani e fragiliaffetti da linfoma B grandi cellule.I pazienti arruolati erano 20, la cuietà mediana era di 72 anni, lamediana del Comorbidity Indexsecondo Charlson era 4. Ottopazienti avevano segni di insuffi-cienza cardiaca; anche in questocaso veniva paragonato lo sche-ma BR e l’R-CHOP. L’ORR (overallremission rate) era del 55% e nelbraccio BR la terapia era moltoben tollerata con una mediana di
PFS (progression free survival) e diOS (overall survival) rispettiva-mente di 8,3 mesi e 19,4 mesi,dimostrando che lo schema BR èuna valida opzione allo schema R-CHOP, specialmente in questogruppo di pazienti (4); inoltre unarevisione effettuata da Vidal (5) hapreso in considerazione 5 studicon 1343 pazienti randomizzaticon linfomi indolenti, che compa-ravano la PFS e la qualità di vita trale diverse l inee di terapia.Dall’analisi di questi studi è risul-tato una maggiore PFS e OS, maanche una sovrapponibile tossi-cità di grado 3-4. Molto interes-sante sarà vedere gli effetti deicicli contenenti bendamustinasulla qualità della vita.
Bibliografia1. Leblond V, Laribi K, I lhan O et al.Rituximab in combination with ben-damustine or chlorambucil for treatingpatients with chronic lymphocyticleukemia: interim results of a phase IIbStudy (MaBle). ASH 2012. Abstract 2744.2. Cheson BD, Friedberg JW, Kahl BS et al.Bendamustine produces durable respons-es with an acceptable safety profile inpatients with rituximab-refractory indolent
non-Hodgkin lymphoma. Clin LymphomaMyeloma Leuk 2010;10(6):452-457.3 .Fischer K, Cramer P, Bush R et al.Bendamustine in combination with ritux-imab for previously untreated patientswith chronic lymphocytic leukemia: a mul-ticenter phase II trial of th German ChronicLymphocytic Leukemia Study Group. J ClinOncol 2012;30(26):3209-3216.4. Horn J, Kleber M, Hieke S et al. Treatment
option of bendamustine in combinationwith rituximab in elderly and frail patientswith aggressive B-non-Hodgkin lym-phoma: rational, efficacy, and tolerance.Ann Hematol 2012;91(10):1579-1586. 5.Vidal L, Gafter-Gvili A, Gurion R et al.Bendamustine for patients with indolentB cell lymphoid malignancies includingchronic lymphocytic leukaemia. CochraneDatabase Syst Rev 2012;9:CD009045.
14
Presentazione del caso
Paziente e anamnesiNel Marzo del 2012 abbiamo valu-tato una paziente di sesso femmi-nile di 65 anni. All’anamnesi pato-logica remota emergevano iper-tensione arteriosa e sindromeansioso-depressiva, all’anamnesipatologica prossima astenia ingra-vescente, per la quale la pazienteaveva eseguito un emocromo, cheevidenziava linfocitosi e anemiamoderata.
Esame obiettivo e indaginidiagnosticheAll’esame obiettivo si riscontravasplenomegalia moderata. La ripe-tizione dell’emocromo conferma-va linfocitosi (GB 26.760/mm3, L60%) e anemia ipocromica micro-citica (Hb 10,4 g/dl); si evidenziava,inoltre, una componente mono-clonale sierica IgM/lambda pari a3,4 g/l con proteinuria di BenceJones debolmente positiva.L’immunofenotipo su sangueperiferico risultava compatibilecon un disordine linfoproliferativocronico. L’ecografia confermava lapresenza di splenomegalia (DL 15cm) e assenza di linfoadenomega-lie addominali o superficiali. L’RXtorace risultava nella norma.
La biopsia osteomidollare con-sentiva di formulare la diagnosidi l infoma di derivazione dailinfociti B periferici, indolente,probabile l infoma marginalesplenico. All’esame citogeneticosu aspirato midollare: trisomiadella regione 3q23.
Approccio terapeutico evalutazione a distanza
Inizialmente la paziente è statainserita in un programma di watchand wait, ma nei 3 mesi successivisi è assistito a un notevole peggio-ramento dell’anemia (fino a valoridi Hb di 7,7 g/dl), con necessità disupporto trasfusionale; consen-sualmente si è assistito a un incre-mento della l infocitosi (GB46.450/mm3, L 66%) e a un aumen-to della LDH (lattato deidrogenasi)(inizialmente normale) e dellacomponente monoclonale (IgMtotali 2612 mg/dl, rispetto al valo-re di 950 mg/dl presente alla dia-gnosi); è stato pertanto deciso diprocedere a un trattamento citori-duttivo. Tenendo conto della seve-ra anemia e della sindrome ansio-so-depressiva della paziente si èoptato per un trattamento conbendamustina-rituximab (BR),
teoricamente gravato di minoretossicità rispetto ai protocolli R-CHOP (rituximab-ciclofosfamide,doxorubicina, vincristina e predni-sone) like. A partire da Giugno2012 sono stati somministrati 6cicli di bendamustina al dosaggiodi 90 mg/m2 (giorni 1-2) in associa-zione a rituximab (375 mg/m2 algiorno 1), seguiti da 2 ulteriorisomministrazioni di rituximab(375 mg/m2 al giorno 1). I cicli sonostati ben tollerati e sono stati ese-guiti regolarmente ogni 28 giorni.La tossicità ematologica è statamodesta, con neutropenia di gra-do II. Non si sono verificate alope-cia chemioindotta, né mucositeorofaringea o gastroenterica. La risposta al trattamento è stataottima: l’emocromo si è praticamen-te normalizzato dopo il 3° ciclo (GB4670/mm3 con N 63%, L 19%, Hb13,1 g/dl, PLT 140.000/mm3) e unarivalutazione ecografica, eseguitadopo il 4° ciclo, ha documentato lascomparsa della splenomegalia.Al termine del trattamento la riva-lutazione midollare, l’ecografia dicontrollo e gli esami ematobiochi-mici hanno evidenziato una remis-sione completa di malattia, conscomparsa anche della compo-nente monoclonale sierica e uri-naria di accompagnamento. A 3
Efficacia del trattamento con bendamustina-rituximab inpaziente con linfoma non-Hodgkin indolenteE. Albi, C. Camerini, G. Casarola Ematologia e Immunologia Clinica, Perugia
EFFICACIA DEL TRATTAMENTO CON BENDAMUSTINA-RITUXIMAB IN PAZIENTE CON LINFOMA NON-HODGKIN INDOLENTE
15
mesi dal termine della terapia lapaziente è in persistente remissio-ne completa.
Discussione del caso erazionale delle scelteterapeutiche
Il trattamento standard di 1ª linea,per i linfomi indolenti avanzati, èrappresentato dall’associazione dichemioterapia e immunoterapiacon rituximab. Dopo la dimostra-zione dell’efficacia di bendamu-stina in ionoterapia, nel tratta-mento dei linfomi indolenti (4,5),bendamustina, in associazione arituximab, si è confrontata favo-revolmente in numerosi trial cli-
nici con la chemio-immunotera-pia standard (R-CHOP-R like, FCR-f ludarabina, c ic lofosfamide,rituximab) sia nella terapia deilinfomi indolenti refrattari o rica-duti che, del tutto recentemente,nella terapia di 1ª linea.In particolare, come dimostratodagli studi pubblicati dal gruppotedesco di Rummel, bendamusti-na, associata a rituximab, puòessere ritenuta una valida alter-nativa nella terapia di 1° linea deilinfomi indolenti, di efficacia noninfer iore r ispetto a R-CHOP.L’autore sottolinea infatti l’otte-nimento, nella sua casistica, di unincremento della progressionelibera da malattia e il riscontro diminori effetti collaterali (1-3): in
par t icolare sono emersi unaridotta frequenza di alopecia,tossicità ematologica, infezioni,neuropatia periferica e stomatitecon l’unico rilievo di maggiorireazioni cutanee nei pazientitrattati con bendamustina. Nel nostro caso la scelta tera-peutica è stata dettata sia dallasevera anemia, presente all’ini-zio del trattamento, che dallapresenza di un’importante sin-drome ansioso-depressiva; talicondizioni rendevano necessa-rio sia ridurre la tossicità emato-logica che minimizzare gli effet-ti collaterali.Il trattamento con BR è risultatoeffettivamente ben tollerato dallapaziente ed efficace.
Bibliografia1. Rummel MJ, Niederle N, Maschmeyer Get al. Bendamustine plus rituximab versusCHOP plus rituximab as first line treat-ment for patients with indolent and man-tle-cell lymphomas: an open-label, multi-centre, randomized, phase 3 non-inferiority
trial. Lancet 2013;pii: S0140-6736(12)61763-
2. [Epub ahead of print].2. Rummel MJ, Niederle N, Maschmeyer Get al. Bendamustine plus rituximab versus
CHOP plus rituximab as first line treat-ment for patients with indolent and man-tle-cell lymphomas (MCL): updated resultsfrom the StilL NHL1 study. J Clin Oncol2012. 3. Zhao J, Xu Z, Liu D, Lu Q. Rituximab andnew regimens for indolent lymphoma: abrief update fort 2012 ASCO AnnualMeeting. Cancer Cell Int 2012;12(1):38.4. Hoy SM. Bendamustine: a review of its
use in the management of chronic lym-phocytic leukaemia, rituximab/refractoryindolent non-Hodgkin’s lymphoma andmultiple myeloma. Drugs 2012;72(14):1929-1950. 5. Vidal L, Gafter-Gvili A, Gurion R et al.Bendamustine for patients with indolentB cell lymphoid malignancies includingchronic lymphocytic leukaemia. CochraneDatabase Syst Rev 2012;9:CD009045.
16
Presentazione del caso
Paziente, anamnesiPresentiamo il caso di un pazientedi 17 anni, giunto alla nostra atten-zione nel Febbraio 2007 per la pre-senza di linfoadenomegalie late-rocervicali. L’anamnesi patologicaremota del paziente era sostan-zialmente negativa, fatta eccezio-ne per un intervento di chiusuradel dotto di Botallo nel 2004; ilragazzo lamentava, inoltre, da cir-ca 3 mesi, la presenza di sudora-zione profusa e prurito diffuso.
Esame obiettivo e indaginidiagnosticheAll’esame obiettivo si riscontravauna voluminosa tumefazione late-rocervicale destra, in assenza dialtre linfoadenomegalie superficia-li palpabili; è stata quindi eseguitauna TC toraco-addominale, che haevidenziato la presenza di un gros-solano pacchetto linfonodale late-rocervicale destro del diametro dicirca 11x5 cm e di ulteriori linfoade-nomegalie mediastiniche didimensioni inferiori. L’indagine PETevidenziava un iperaccumulo delradio-farmaco a livello laterocervi-cale destro e mediastinico e ilpaziente è stato pertanto sottopo-sto a biopsia linfonodale laterocer-
vicale con diagnosi di linfoma diHodgkin, variante sclerosi nodula-re. La stadiazione è stata completa-ta con la biopsia ossea, che haescluso la presenza di coinvolgi-mento midollare e ha assegnatopertanto uno stadio IIB.
Approccio terapeutico
Il paziente è stato trattato in 1ª lineacon 6 cicli ABVD (adriamicina, bleo-micina, vinblastina, dacarbazina)seguiti da radioterapia, con otteni-mento di una risposta parziale.Nella fase di ristadiazione è statadiagnosticata un’epatite cronica Battiva, che ha richiesto una terapiacon antivirali. A un controllo dopo 3mesi è stata osservata una progres-sione di malattia. Dopo conferma didiagnosi di linfoma di Hodgkin,mediante biopsia di linfonodo late-rocervicale, è stata impostata unaterapia di 2ª linea con gemcitabinae doxorubicina liposomiale. In faseneutropenica, dopo la somministra-zione del 1° ciclo, il decorso è statocomplicato dall’insorgenza di gravesepsi, evoluta in shock settico, cheha richiesto il ricovero in terapiaintensiva. Sono stati somministrati 6cicli totali. La terapia è stata tuttaviagravata da un’importante tossicità,
sia infettiva che ematologica, conaltri 3 ricoveri per complicanzeinfettive maggiori e con un crescen-te ricorso al supporto trasfusionale;oltre a questo, a fronte di un’inizialerisposta parziale, documentatadopo 4 cicli, si è manifestata unaprogressione di malattia dopo il ter-mine del 6° ciclo. A questo punto, difronte a una malattia refrattaria a 2linee di terapia e a un paziente com-promesso e fragile, si è optato perun trattamento con bendamustina:sono stati somministrati 4 cicli dibendamustina al dosaggio di 70mg/m2, ogni 28 giorni. Il trattamen-to è stato ottimamente tollerato,con minima tossicità ematologica(grado 2, nessun ricorso al supportotrasfusionale) e nessuna compli-canza infettiva. È stata ottenuta unarisposta parziale, mantenuta per 5mesi, dopo i quali il paziente è nuo-vamente progredito e decedutoper complicanze infettive nelDicembre 2010.
Discussione del caso erazionale delle scelteterapeutiche
Nonostante il trattamento deilinfomi di Hodgkin vanti un’altapercentuale di successo con gli
Bendamustina è un farmaco sicuro ed efficace nel pazienteaffetto da linfoma di Hodgkin refrattarioO. Sofritti, G.M. Rigolin, A. CuneoSezione di Ematologia, Dipartimento di Scienze Biomediche e Terapie Avanzate, Università di Ferrara
BENDAMUSTINA È UN FARMACO SICURO ED EFFICACE NEL PAZIENTE AFFETTO DA LINFOMA DI HODGKIN REFRATTARIO
17
attuali regimi polichemioterapici,ancora il 20-30% dei pazienti pre-senta forme resistenti o recidivan-ti. In questa categoria di pazienti iltrattamento di prima scelta è rap-presentato da regimi chemiotera-pici intensivi, seguiti da trapiantoautologo di cellule staminali (1).Nei casi non eleggibili o ricadutidopo trapianto autologo e nei casirefrattari, le opzioni terapeutichesono limitate. La sicurezza e l’effi-cacia di bendamustina è stataestensivamente documentata neilinfomi non-Hodgkin, nella leuce-mia linfatica cronica e nel mielo-
ma multiplo (2); solo più recente-mente ne è stata valutata l’attivitànei linfomi di Hodgkin. Bendamustina presenta analogiestrutturali e funzionali sia con i far-maci alchilanti, che con gli antime-taboliti. Esperimenti in vitro hannodimostrato che questa molecola haun profilo farmacologico distintorispetto agli altri agenti alchilanti,mostrando un’attività antitumoraleanche in linee cellulari resistenti (3).Nel setting dei linfomi di Hodgkinrefrattari o ricaduti bendamustina hadimostrato di avere un buon profilodi sicurezza, con tossicità ematologi-
ca moderata, per lo più costituita dapiastrinopenia, e una percentualecontenuta di complicanze infettivemaggiori (4). Recenti studi di fase IIhanno dimostrato, in questa cate-goria di pazienti, una percentualedi risposta di circa il 50% e unasopravvivenza libera da malattiaattorno ai 5 mesi (5). Per questecaratteristiche, oltre che nell’ambi-to di regimi di condizionamento ecome terapia “ponte” in attesa ditrapianto (6), bendamustina puòessere considerata una validaopzione terapeutica nel trattamen-to dei linfomi di Hodgkin refrattari.
Bibliografia1. Connors JM. State-of-the-art therapeu-tics: Hodgkin’s lymphoma J Clin Oncol2005;23(26):6400-6488.2. Cheson BD, Wendtner CM, Pieper A et al.Optimal use of bendamustine in chroniclymphocytic leukemia, non-Hodgkin lym-phomas, and multiple myeloma: treatmentrecommendations from an internationalconsensus panel. Clin Lymphoma MyelomaLeuk 2010;10(1):21-27.
3. Gandhi V. Metabolism and mechanismsof action of bendamustine: rationales forcombination therapies. Semin Oncol2002;29(4 Suppl 13):4-11.4. Corazzelli G, Angrilli F, D’Arco A. Efficacyand safety of bendamustine for the treat-ment of patients with recurring Hodgkinlymphoma. Br J Haematol 2013;160(2):207-215.5.Moskowitz AJ, Hamlin PA Jr, Perales MA.
Phase II Study of Bendamustine inRelapsed and Refractory HodgkinLymphoma. J Clin Oncol 20131;31(4):456-460.6. Visani G, Malerba L, Stefani PM. EAM(bendamustine, etoposide, cytarabine,melphalan) before autologous stem celltransplantation is safe and effective forresistant/relapsed lymphoma patients.Blood 2011;118(12):3419-3425.
18
Presentazione del caso
Paziente e anamnesiNel Marzo del 2003 giunge, allanostra osservazione, un uomo di67 anni con una storia di asteniaingravescente e comparsa dilinfoadenomegalie laterocervicalinegli ultimi 3 mesi: non emergonopatologie di rilievo né precedentiinterventi chirurgici.
Esame obiettivo e indaginidiagnosticheAll’esame obiettivo si evidenzianolinfoadenopatie superficiali in sedelaterocervicale bilateralmente einguinale sinistra di circa 3 cm. Gliesami ematochimici risultano nellanorma, la VES e il B2m (β2-micro-globulina) elevati. La TAC totalbody referta linfoadenomegalie insede lateocervicale bilateralmente(3 cm), mediastiniche (4 cm) einguinale bilateralmente (2 cm); sidecide, pertanto, di eseguire la bio-psia di un linfonodo laterocervicalesinistro, il cui esame istologico per-mette di formulare una diagnosi dilinfoma di Hodgkin (LH), varianteclassica tipo sclerosi nodulare. Labiopsia ossea risulta negativa perinfiltrazione linfomatosa e le con-clusioni diagnostiche danno indica-zione per LH CS (clinical staging) III.
Approccio terapeutico
Nel Marzo 2003 viene iniziato un trat-tamento di 1ª linea secondo lo sche-ma ABVD (adriamicina, bleomicina,vinblastina, dacarbazina): vengonoeseguiti 6 cicli di chemioterapia e,nell’Ottobre del 2003, la TAC totalbody evidenziava una remissionecompleta della malattia. Negli annisuccessivi il paziente esegue control-li periodici con TAC total body ed esa-mi ematochimici, che confermano laremissione completa della malattia.
Prima recidivaNell’Ottobre del 2008 si verifica lacomparsa di astenia, febbre seroti-na, dimagrimento. La TAC totalbody evidenzia linfoadenomega-lie laterocervicali, ascellari, ingui-nali bilateralmente e mediastini-che. La biopsia ossea presentaun’infiltrazione linfomatosa diHodgkin pari al 30% della cellula-rità totale. Gli esami ematochimicievidenziano un’anemia di grado 2,VES e B2m elevati; non viene per-tanto eseguita una biopsia linfo-nodale e le conclusioni diagnosti-che sono: LH CS IV B (mo +). Si ese-guono nuovamente 6 cicli di che-mioterapia secondo lo schemaABVD (essendo trascorsi 5 annidalla prima somministrazione di
tale schema di terapia) con remis-sione completa della malattia nelMaggio 2009.
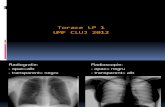
Seconda recidivaNell’Ottobre del 2011 si verifica lacomparsa di linfoadenomegalia insede ascellare destra; non emergonosintomi sistemici, gli esami emato-chimici sono nella norma, la VES e laB2m sono alterati; l’ECG è nei limiti el’ecocardiogramma FE=48%. Vieneeseguita una PET total body: aree dielevata captazione in linfoadenopa-tie a sede ascellare, interaortocavale(Suv 34), paraortica (Suv 8,0), iliaca eotturatoria (Suv 7,8) (Fig. 1). La TACtotal body conferma le localizzazio-ni, la biopsia ossea l’assenza di infil-trazione linfomatosa; quella dellinfonodo ascellare destra riconfer-ma la diagnosi LH variante classicatipo sclerosi nodulare dell’esordio:LH CS III. Il paziente ha ora 75 anni, einizia la chemioterapia con benda-mustina 90 mg/m2 giorno 1-2. Ilciclo di chemioterapia viene ripetu-to ogni 28 giorni per 6 cicli com-plessivi. La PET total body, dopo il 3°ciclo (Febbraio 2012) e dopo il 6°ciclo (Maggio 2012) (Fig. 2) confer-mano la remissione completa dellamalattia; il controllo PET total body,del Novembre 2012, riconferma laremissione completa della malattia.
Bendamustina in paziente affetto da linfoma di Hodgkincon seconda recidivaM. Dell’OlioUnità Trapianto di Midollo,U.O.C. di Ematologia, Casa Sollievo della Sofferenza, S. Giovanni Rotondo (FG)
BENDAMUSTINA IN PAZIENTE AFFETTO DA LINFOMA DI HODGKIN CON SECONDA RECIDIVA
19
Discussione del caso erazionale delle scelteterapeutiche
Al l ’esordio del la malatt ia i lpaziente non ha patologie con-
comitanti e pertanto è stato ese-guito lo schema classico perl’LH, cioè l’ABVD. Alla prima reci-diva, verificatasi dopo circa 5anni, abbiamo ritenuto opportu-no ripetere lo schema ABVD, siaperché era stato ben tolleratoprecedentemente, sia per la suaefficacia. Nella seconda recidiva,
in considerazione dell’età delpaziente e della ridotta coplian-ce cardiologica (FE=48%) abbia-mo escluso lo schema ABVD ealtri schemi di polichemiotera-pia tipo IGEV (ifosfamide, gemci-tabina, vinorelbina), BEACOPP(bleomicina, etoposide, doxoru-bicina ciclofosfamide, vincristi-na, prednisone, procarbazina),VBM (vinblastina, bleomicina emetotrexato) per la loro elevatatossicità. La scelta di usare labendamustina è derivata sia dal-la nostra esperienza, consolidatanella terapia dei linfomi recidi-vati con eccellenti risultati e conridotta tossicità, sia confortatadai più recenti risultati illustrati,in letteratura, dell’uso di tale far-maco anche nell’LH. La terapiacon bendamustina, in questopaziente alla seconda recidiva,ha permesso di ottenere unaremissione completa già dopo il3° ciclo; tale terapia è stata bentollerata e somministrata neitempi previsti con il supporto diG-CSF (granulocyte colony-sti-mulating factor). Non si è mani-festata a lcuna toss ic i tà nonematologica.
Figura 1. PET Ottobre 2011.
A
B
Figura 2. PET Maggio 2012.
A
B
M. DELL’OLIO
20
Bibliografia• De Filippi R, Aldinucci D, Galati D. Effectof bendamustine on apoptosis andcolony-initiating precursor in Hodgkinlymphoma cells. J Clin Oncol 2011;29:(suppl; abstr. e18559).
• D’Elia GM, De Angelis F, Breccia M et al.
Efficacy of bendamustine as salvage treat-
ment in heavily pre-treated Hodgkin
Lynphoma. Leuk Res2010;34(11):e300-e301.
• Jona A, Younes A. Novel treatment strate-
gies for patients with relapsed classical
Hodgkin lymphoma. Blood Rev 2010; 24
(6):233-238.
• Magyari F, Simon Z, Barna S, Udvardy M,Váróczy L, Illés Á. Successful administra-
tion of rituximab-bendamustine regimen
in the relapse of Hodgkin lymphoma
after autologous hemopoietic stem cell
transplantation. Hematol Oncol 2012;30
(2):98-100.
• Moskowitz AJ, Hamlin PA, GerecitanoJ et al. Bendamustine is highly activein heavily pre-treated relapsed andrefractory hodgkin lymphoma andserves as a bridge to allogeneic stemcell transplant. Blood 2009;114:abst720.
• Moskowitz AJ. Novel agents in Hodgkinlymphoma. Curr Oncol Rep 2012;14(5):419-423.
21
Presentazione del caso
Paziente e anamnesiIl sig. B.C., studente universitario di23 anni, giunge alla nostra osser-vazione nel Novembre 2010 condiagnosi, posta presso altra sede,su biopsia di un linfonodo ascella-re, confermata alla revisione isto-logica presso la nostra AnatomiaPatologica, di linfoma di Hodgkinclassico, ricco in linfociti, CD30+,CD15 positività puntiforme, PAX-5+, MUM1+, CD20-, CD30-, EMA-. Dall’anamnesi familiare negativaper patologia oncologica, nonemerge alcun disturbo di rilievo inpassato. Da qualche mese riferiscela presenza di una tumefazione alivello laterocervicale, una consi-stente perdita di peso (13 kg in unanno), sudorazioni notturne e,negli ultimi 2 mesi, febbre serotina(max 38,5 °C).
Esame obiettivo e indaginidiagnosticheAll’obiettività clinica si confer-mava la presenza di una grosso-lana tumefazione a livello latero-cervicale bilaterale e splenome-galia (3 cm al di sotto dell’arcatacostale); veniva eseguita stadia-zione di malattia con gli esami diseguito indicati.
TC: presenza di pacchetti linfono-dali a livello sovra- e sottodia-frammatici (a livello ascellare esovraclaveare sinistro max 35mm, a livello subdiaframmatico,paraortico sinistro, ilo splenico,asse femorale comune di sinistramax 30 mm). Milza aumentata divolume (16 cm). PET: accumuli di tracciante nellesedi evidenziate alla TC e a livellodel corpo di D6-D7, L3, L5, ala iliacasinistra, ischio bilaterale e alasacrale destra. RMN colonna cervico-dorso-lombare e bacino: lesioni ripeti-tive compatibili con localizzazio-ne scheletrica di malattia a livellodel corpo vertebrale di D6-D7, L3,L5, ala iliaca sinistra, ischio bilate-rale e ala sacrale destra. Biopsia osteomidollare: negati-va per localizzazione di malattia.Si concludeva per stadio IVB(localizzazione extranodale esplenica, febbricola, sudorazioninotturne, perdita di peso). Si com-pletavano le indagini diagnosti-che eseguendo ecocardiogram-ma, spirometria e valutazione deimarker virali (ndr). Data la giovane età si propone-va la c r iopreser vaz ione de lliquido seminale che il pazienterifiutava.
Approccio terapeutico,valutazione a distanza eaggiustamentiterapeutici
Il paziente veniva arruolato al pro-tocollo nazionale HD0607 e avvia-to a chemioterapia di 1ª lineasecondo ABVD (adriamicina, bleo-micina, vinblastina, dacarbazina).Alla rivalutazione precoce dimalattia con interim-PET, eseguitaentro 14 giorni dal termine del 2°ciclo, era ancora presente malattiaa elevata attività metabolica.Pertanto, in accordo con il proto-collo HD0607, veniva intrapresoun trattamento polichemioterapi-co secondo lo schema BEACOPPescalated (bleomicina, etoposide,adriamicina, vincristina, ciclofosfa-mide, prednisone, procarbazina)per 4 cicli, seguito da raccolta dicellule staminali (CD34+) da san-gue periferico (PBSC) al terminedel 1° ciclo. Si attivava, inoltre, laricerca di un donatore HLA compa-tibile nella fratria. A Maggio 2011,l’ottenuta negatività dell’esamePET in un quadro TC di rispostaparziale al trattamento induceva-no a continuare con ulteriori 4 ciclisecondo schema BEACOPP stan-dard, in accordo con il protocolloHD0607. Al termine del trattamen-
Bendamustina nella terapia di salvataggio in un caso dilinfoma di Hodgkin refrattario trattato in prima lineasecondo una strategia “PET-risk adapted”A. Romano, A. Figuera Divisione di Ematologia, Ospedale Ferrarotto, AOU Policlinico-OVE, Università di Catania
R. ROMANO, A. FIGUERA
22
to, a Giugno 2011, si concludevaper remissione completa di malat-tia e veniva intrapreso un follow-up a cadenza trimestrale. ANovembre del 2011 il pazientegiungeva in ambulatorio in discre-te condizioni generali, lamentan-do astenia e sudorazioni notturne,con evidenza di tumefazione alivello sovraclaveare sinistro. Labiospia escissionale deponeva perla ripresa di malattia di Hodgkin.Veniva intrapresa terapia di salva-taggio con 4 cicli di polichemiote-rapia secondo lo schema IGEV (ifo-sfamide, gemcitabina, vinorelbina,prednisolone), seguiti da autotra-pianto, ottenendo remissione par-ziale di malattia. Poiché il pazienterisultava essere aploidentico conla sorella veniva avviata la ricercadi un donatore non familiare, sen-za successo. Tuttavia le condizionigenerali rimanevano alquantomediocri per la presenza di doloriossei diffusi determinati da multi-ple localizzazioni scheletriche dimalattia, solo parzialmenteresponsivi alla terapia antidolorifi-ca e a somministrazione mensiledi bifosfonati. In attesa di individuare un donato-re di midollo compatibile per untrapianto allogenico, si decideva di
intraprendere un trattamento conbendamustina 120 mg/m2 per 2giorni al mese per 4 mesi, ottenen-do la remissione parziale di malat-tia documentata all’esame TC, ecompleta alla PET, ma permanen-do le lesioni ossee alla RMN dicolonna e bacino. Attualmente ilpaziente, in discrete condizionigenerali, intraprenderà a fine meseuna terapia con brentuximab qua-le approccio bridge-to-transplantin attesa di essere sottoposto a tra-pianto allogenico di midollo osseo.
Discussione del caso erazionale delle scelteterapeutiche
Circa il 20% dei pazienti affetti dalinfoma di Hodgkin con malattiaavanzata all’esordio presentanomalattia chemiorefrattaria alloschema ABVD. Fattori prognosticinegativi, quali il sesso maschile, lalinfopenia e l’anemia, che concor-rono alla determinazione delloscore di Hasenclever, non sonosufficientemente attendibili perintraprendere in 1ª linea tratta-menti più aggressivi, quali il BEA-COPP come tuttavia suggerito dal-la scuola tedesca. Recentemente
un approccio terapeutico, guidatodall’esito della valutazione PETeseguita precocemente dopo iprimi 2 cicli di terapia, ha mostratoessere efficace nel recuperare cir-ca la metà dei pazienti garantendouna remissione completa a lungotermine. Questo non è avvenutotuttavia nel caso del nostropaziente che, a dispetto di un’ini-ziale remissione completa doposhift precoce al regime BEACOPP, èandato incontro a relapse dimalattia, chemiorefrattaria al trat-tamento di 2ª linea e autotrapian-to. È stata recentemente riportatauna ridotta affidabilità dell’esitoPET-2 nei pazienti con HL-classico-variante ricca in linfociti, essendola PET-2 validata nell’ambito di HL-SN. In attesa di individuare un donato-re di midollo compatibile per untrapianto allogenico il trattamen-to con bendamustina è risultatoessere un regime ben tollerato,non richiedendo terapia di sup-porto con fattore di crescita nono-stante il paziente fosse statopesantemente pretrattato, conbeneficio soggettivo sui doloriossei (permanendo incontrollabilituttavia a livello lombare) e ridu-zione delle masse linfomatose.
BENDAMUSTINA NELLA TERAPIA DI SALVATAGGIO IN UN CASO DI LINFOMA DI HODGKIN REFRATTARIO TRATTATO IN PRIMALINEA SECONDO UNA STRATEGIA “PET-RISK ADAPTED”
23
Bibliografia1. Le Roux PY, Gastinne T, Le Gouill S et al.Prognostic value of interim FDG PET/CT in
Hodgkin’s lymphoma patients treated with
interim response-adapted strategy: com-
parison of International Harmonization
Project (IHP), Gallamini and London criteria.
Eur J Nucl Med Mol Imaging 2011;38(6):
1064-1071.
2. Gallamini A, Patti C, Viviani S et al. Gruppo
Italiano Terapie Innovative nei Linfomi
(GITIL). Early chemotherapy intensification
with BEACOPP in advanced-stage Hodgkin
lymphoma patients with a interim-PET posi-
tive after two ABVD courses. Br J Haematol
2011;152(5):551-560.
3. Gallamini A, Hutchings M, Avigdor A,
Polliack A. Early interim PET scan in Hodgkin
lymphoma: where do we stand? Leuk
Lymphoma 2008;49(4):659-662.
4. Moskowitz AJ, Hamlin PA Jr, Perales MA et
al. Phase II study of bendamustine in
relapsed and refractory Hodgkin lym-
phoma. J Clin Oncol 2013;31(4):456-460.
5. Corazzelli G, Angrilli F, D’Arco A. Efficacy
and safety of bendamustine for the treat-
ment of patients with recurring Hodgkin
lymphoma. Br J Haematol 2013;160(2):
207-215.
6. Hasenclever D, Diehl V. A prognostic score
for advanced Hodgkin’s disease.
International Prognostic Factors Project on
Advanced Hodgkin’s Disease. N Engl J Med
1998;19;339(21):1506-1514.
24
Presentazione del caso
Paziente e anamnesiViene qui presentato il caso clinicodi una donna di 48 anni: all’anam-nesi patologica remota non emer-ge nulla di significativo e, nelNovembre del 2012, si verifica ilriscontro occasionale di anemia(emoglobina 5,2 g/dl), piastrino-penia (64x109/l) , leucocitosi(11,8x109/l) con linfocitosi assolu-ta (9,5x109/l) e presenza di ele-menti prolinfocitoidi allo strisciodi sangue periferico.
Esame obiettivo e indaginidiagnosticheL’obiettività è negativa, la proti-demia totale è pari a 8,4 g/dl, IgG709 mg/dl, IgA 39 mg/dl, IgM4650 mg/dl. Componente mono-clonale su siero IgM/κ, rapportoκ/λ 9,73; catene κ e λ urinarie15,6 mg/dl e 0,4 mg/dl, rispettiva-mente; reticolociti 1,09%, il test diCoombs, diretto e indiretto, ènegativo; ricerca di crioagglutini-ne negativa, tipizzazione linfoci-taria periferica: proliferazione dilinfociti B maturi CD19+, CD20+,CD22+, CD25+, FMC7+/-, monoti-pici per la catena κ di superficie.La biopsia osteomidollare evi-denzia una cellularità al 95%.
Infiltrato linfoide diffuso (50%della cellularità) CD20+ e clonaleper catena κ; presenza di plasma-cellule, linfociti maturi, elementilinfoplasmocitari e immunobla-st i ; la granulo-er i t ropoiesi èridotta, l’iperplasia megacarioci-taria è moderata, la trama reticu-linica infittita. All’agoaspiratomidollare risulta l’espansione dilinfociti B CD19+CD20+ (72%della cellularità totale). Il carioti-po è normale, la TC total bodynegativa; è presente una condi-zione da iperviscosità con emor-ragie retiniche, essudati cotonosie apparato vascolare congesto alfondo oculare.
Approccio terapeutico evalutazione a distanza
In considerazione della diagnosi dilinfoma di derivazione dai linfocitiB periferici a tipo linfoma linfopla-smocitico (immunocitoma), dellagiovane età della paziente e dellerecenti pubblicazioni inerenti airisultati di bendamustina in asso-ciazione a rituximab, utilizzatacome schema immunochemiote-rapico di 1ª linea nei pazienti affet-ti da linfoma non-Hodgkin (LNH),si è ritenuto opportuno utilizzare il
suddetto regime di trattamentocon rituximab 375 mg/m2 al gior-no 1 e bendamustina 90 mg/m2 algiorno 2 e 3 (1). Il 1° ciclo di tratta-mento, effettuato in regime diricovero ospedaliero, è stato bentollerato dalla paziente e ha con-sentito un rapido e discreto ripri-stino della crasi ematica con emo-globina pari a 9,5 g/dl, piastrine69x109/l e leucociti 2,7x109/l; lapaziente è stata in seguito sotto-posta a ulteriori 2 cicli secondo ilmedesimo schema a distanza di28 giorni l’uno dall’altro in regimedi Day Hospital. A circa un mese dal termine del ter-zo ciclo l’esame emocromocitome-trico mostrava un ulteriore miglio-ramento con emoglobina 12,8 g/dl;piastrine 175x109/l; leucociti2,1x109/l (neutrofili 1,3x10/l, linfoci-ti 0,34x109/l). IgG 697 mg/dl, IgA 29mg/dl, IgM 685 mg/dl. La compo-nente monoclonale, su siero IgM/κ,è ridotta rispetto alla diagnosi, rap-porto κ/λ =3,64. La rivalutazione ecografica confer-mava l’assenza di linfoadenopatiesuperficiali, profonde e organo-megalia; netto il miglioramentodel quadro oculare. In considera-zione dell’ottima risposta al tratta-mento (ripresa della crasi ematica,riduzione della componente IgM e
Immunocitoma e utilizzo off-label di bendamustina in unagiovane pazienteA. Monti Ematologia e CTMO, Azienda Ospedaliero-Universitaria di Parma
25
IMMUNOCITOMA E UTILIZZO OFF-LABEL DI BENDAMUSTINA IN UNA GIOVANE PAZIENTE
assenza di sintomi sistemici) sidecideva di iniziare il manteni-mento con rituximab 375 mg/m2
ogni 3 mesi per 2 anni (2).
Discussione del caso erazionale delle scelteterapeutiche
Per la giovane età della paziente, lasua buona aspettativa di vita e lapeculiarità della sua malattia, è statoconsiderato un approccio terapeuti-co alternativo a schemi standardquali R-CHOP (ciclofosfamide, doxo-rubicina, vincristina, prednisone più
rituximab) o R-CVP (rituximab,ciclofosfamide, vincristina, predniso-ne), con l’obbiettivo di minimizzaregli effetti tossici, compresi quelli amedio-lungo termine; la bendamu-stina è stata scelta in virtù della suaben nota azione combinata alchilan-te e antimetabolita (3). Diversi recen-ti studi clinici hanno infatti conferma-to la validità dell’associazione immu-nochemioterapica rituximab-benda-mustina (RB) nel trattamento deiLNH, persino nei soggetti ricaduti erefrattari (3,4). L’utilizzo in 1ª linea diRB ha dimostrato, inoltre, buona tol-lerabilità e un vantaggio in termini disopravvivenza libera da progressio-
ne di malattia rispetto al classicoschema R-CHOP nei pazienti affettida LNH (5), riuscendo a garantire glistessi risultati con risposte durature afronte di un miglior profilo di tossicità(5,6). Ulteriori dati di letteratura han-no evidenziato come l’utilizzo di BRin 1ª linea abbia migliorato anche ipunteggi sulla qualità di vita rispettoa schemi immuno-chemioterapiciquali R-CHOP o R-CVP (7). Il presentecaso conferma l’efficacia del regimeBR e l’assenza di tossicità; si sono inol-tre potuti evitare gli effetti psicologi-ci negativi dell’alopecia, effetto colla-terale segnalato in letteratura rarocon l’utilizzo di bendamustina (6).
Bibliografia1. Cheson BD, Wendtner CM, Pieper A et al.Optimal use of bendamustine in chronic
lymphocytic leukemia, non-Hodgkin lym-
phomas, and multiple myeloma: treatment
recommendations from an international
consensus panel. Clin Lymphoma Myeloma
Leuk 201010(1):21-27.
2. Salles G, Seymour JF, Offner F. Rituximabmaintenance for 2 years in patients with
high tumour burden follicular lymphoma
responding to rituximab plus chemotherapy
(PRIMA): a phase 3, randomised controlled
trial. The Lancet 2011:9759;42-51.
3. Rigacci L, Puccini B, Cortelazzo S.Bendamustine with or without rituximab for
the treatment of heavily pretreated non-
Hodgkin’s lymphoma patients: a multicenter
retrospective study on behalf of the Italian
Lymphoma Foundation (FIL). Ann Hematol
2012 ;91(7):1013-1022.
4. Rummel MJ, Niederle N, Maschmeyer G.Bendamustine Plus Rituximab Is Superior in
Respect of Progression Free Survival and CR
Rate When Compared to CHOP Plus
Rituximab as First-Line Treatment of Patients
with Advanced Follicular, Indolent, and
Mantle Cell Lymphomas: Final Results of a
Randomized Phase III Study of the StiL
(Study Group Indolent Lymphomas,
Germany). ASH 2009 Abstract 405. J Clin
Oncol 2012;30(suppl; abstr 3).
5. Rummel MJ. Bendamustine plus rituximab
(BR) versus CHOP plus rituximab (CHOP-R) as
first-line treatment in patients with indolent
and mantle cell lymphomas (MCL): updated
results from the StiL NHL1 study. ASCO 2012
Abstract 3.
6.Garnock-Jones KP. Bendamustine: a reviewof its use in the management of indolent
non-Hodgkin lymphoma and mantle cell
lymphoma. Drugs 2010;70(13):1703-1718.
7. Burke JM, Van der Jagt RH, Kahl BS et al.Differences in quality of life between ben-
damustine plus rituximab compared with
standard first-line treatments in patients
with previously untreated advanced indo-
lent non-Hodgkin’s lymphoma or mantle cell
lymphoma. ASH 2012 Abstract.