Valutazione e trattamento del paziente con insufficienza ... · PDF filezione del gradiente...
Click here to load reader
Transcript of Valutazione e trattamento del paziente con insufficienza ... · PDF filezione del gradiente...

189
La storia clinica dell’insufficienza aor-tica (IA) cronica è caratterizzata da unlungo periodo di stabilità durante il quale,mentre il ventricolo sinistro attraverso nu-merosi meccanismi miocardici, neuro-umorali e vascolari, va incontro a gradua-le ingrandimento per far fronte al volumerigurgitante, i pazienti rimangono asinto-matici.
L’IA è un sovraccarico combinato dipressione e di volume in cui un nuovoprogramma genetico indotto dall’ipertro-fia modifica contrattilità e scheletro delcuore; ne consegue che le modifiche strut-turali, cui il ventricolo sinistro va incon-tro nelle fasi iniziali della malattia, sonogià il segno precoce di importanti altera-zioni.
Il cronico sovraccarico provoca consi-derevole cardiomegalia e, in accordo conla legge di Laplace, aumento della tensio-ne parietale e del consumo miocardico diossigeno. Ad una prima fase in cui la fun-zione ventricolare sinistra (VS), a volumielevati, è clinicamente accettabile, manon più normale, segue ulteriore deterio-ramento della funzione VS con comparsadi segni e sintomi di scompenso cardia-co1-3.
La valutazione clinica ed il trattamentodel paziente con IA deve scaturire dalla co-noscenza delle complesse e spesso dannoseconseguenze del persistere di tali meccani-smi, della storia naturale della valvulopatiae dei risultati ottenibili con la terapia medi-ca e chirurgica.
Eziologia
L’IA può essere causata da una malattiaprimitiva dei lembi valvolari aortici o dellaparete della radice aortica o dalla concomi-tanza di entrambe le condizioni.
Le cause della malattia delle cuspidivalvolari includono endocardite batterica,traumi, anomalie congenite, degenerazionemixomatosa e malattie reumatiche. Quelledella radice aortica includono, invece, iper-tensione arteriosa, dissezione aortica, sin-drome di Marfan, malattie reumatoidi e va-rie cause di aortite.
Negli ultimi anni si è assistito ad una va-riazione dell’eziologia della valvulopatia:l’incidenza dell’eziologia infiammatoria,infatti, che prima degli anni ’80 era del51%, si è ridotta negli anni successivi al37%, mentre la dilatazione della radice aor-tica è passata, nello stesso periodo, dal 17al 37% ed attualmente interessa oltre unterzo dei pazienti4-6.
Lo studio Framingham ha dimostratoche la prevalenza di rigurgito aortico au-menta con l’età7.
La valvola bicuspide rappresenta la for-ma più comune di IA congenita. Sebbene lacomplicanza più frequente a cui una valvo-la bicuspide va incontro sia la stenosi nellavita adulta, non è infrequente il riscontro diinsufficienza progressiva nell’infanzia epiù spesso nella terza e quarta decade8.
La degenerazione mixomatosa, definitacome distruzione significativa della partefibrosa della valvola, sostituzione con mu-
Key words:Aortic insufficiency;Medical therapy;Valvular surgery.
© 2003 CEPI Srl
Ricevuto il 30 aprile2002; nuova stesura il 7marzo 2003; accettato il10 marzo 2003.
Per la corrispondenza:
Dr. Giovanni Bisignani
Via Nazionale, 9887010 S. Agata d’Esaro (CS)E-mail:[email protected]
Valutazione e trattamento del pazientecon insufficienza aortica cronicaGiovanni Bisignani
U.O. di Cardiologia ed UTIC, Azienda Sanitaria n. 2, Ospedale Civile, Castrovillari (CS)
The management of patients with chronic aortic insufficiency is an important clinical problemsomeway still open.
A correct understanding of the patient should take into account the pathophysiology and naturalhistory of the disease, as well as the results that can be achieved with medical and surgical therapy.
This review will focus on the clinical and instrumental parameters that may bring to the best ther-apeutic decision for the individual patient.
Definitely the management of patients with chronic aortic insufficiency consists mainly in the de-finition of the right time to surgery with the lowest risk and the greatest benefit.
(Ital Heart J Suppl 2003; 4 (3): 189-200)

copolisaccaridi acidi e modificazione cistica, è un’altrapossibile causa di IA, riguardando circa un terzo dei ca-si esaminati, prevalentemente in pazienti anziani espesso secondaria ad ipertensione di lunga durata9,10.
È stata segnalata, inoltre, un’elevata incidenza di IAnei soggetti trattati con fenfluramina ed altri farmacianoressizzanti11.
Fisiopatologia e storia naturale
La fisiopatologia di questa valvulopatia ha sempresuscitato grande interesse, anche se inizialmente IA edinsufficienza mitralica sono state classificate insieme co-me sovraccarico di volume, ma in realtà si è visto che esi-stono importanti differenze fra le due condizioni, conimportanti ricadute sulle modalità di trattamento e sul si-gnificato degli indici di funzione ventricolare (Tab. I)12.
Nell’insufficienza mitralica, infatti, il flusso rigur-gitante viene trasferito in una camera a bassa pressione,quale è l’atrio sinistro, mentre nell’IA l’eccesso di vo-lume è espulso nella circolazione sistemica contro unapressione relativamente elevata e la frazione di eiezio-ne (FE), a differenza di quanto avviene nell’insuffi-cienza mitralica, non aumenta ma rimane nel range del-la normalità. Ne deriva che il sovraccarico nell’IA è unacombinazione di sovraccarico di volume e di pressionee l’eccesso di postcarico costituisce una parte rilevantedella fisiopatologia di questa valvulopatia.
L’entità del rigurgito aortico dipende essenzialmen-te dall’area dell’orifizio rigurgitante, dalla durata delladiastole e quindi dalla frequenza cardiaca e dal gra-diente di pressione esistente in diastole tra aorta e ven-tricolo sinistro13,14.
L’area dell’orifizio rigurgitante è stata per moltotempo considerata fissa e costante. Questa affermazio-ne, tuttavia, non si è dimostrata valida. Aumento del-l’orifizio rigurgitante può verificarsi per dilatazionedell’anulus aortico e/o degenerazione dei lembi valvo-lari. Con il progredire della lesione anatomica, conl’aumento della distanza tra i lembi valvolari e con ladilatazione del ventricolo e dell’aorta, l’area dinamicavaria e tale variazione nel tempo contribuisce alla sto-ria naturale della malattia13-15.
La durata della diastole è correlata alla frequenzacardiaca, e perciò, come evidenziato da Corrigan16 170anni fa, la bradicardia può aumentare il volume rigurgi-tante. Comunque la manipolazione pacing-indotta del-la frequenza cardiaca offre poco o nessun beneficio neipazienti con rigurgito aortico17.
Il terzo determinante del volume rigurgitante, comegià ricordato, è costituito dal gradiente di pressione dia-stolica transvalvolare13,14. La conoscenza di questa varia-bile costituisce il razionale per il trattamento dell’iper-tensione nei pazienti con IA, anche se bisogna ricordareche la maggior parte dei vasodilatatori riducono sia lapressione diastolica aortica che la pressione diastolicadel ventricolo sinistro, con conseguente minima varia-
190
Ital Heart J Suppl Vol 4 Marzo 2003
DT
S =
dia
met
ro te
lesi
stol
ico;
FE
= f
razi
one
di e
iezi
one;
IA
= in
suff
icie
nza
aort
ica;
IM
= in
suff
icie
nza
mitr
alic
a; n
l = n
orm
ale.
↑au
men
tato
. Da
Car
abel
lo12
, mod
ific
ata.
IM
Sovr
acca
rico
puro
di
volu
me
IA
Sovr
acca
rico
di v
olum
e e
pres
sion
e
Pre
IMIA
↑↑
Post
IMIA
nl↑
IM
Vas
odila
tato
ri in
tera
pia
acut
a
IA
Vas
odila
tato
ri in
tera
pia
cron
ica
IM
Poss
ibile
valv
ulop
last
ica
IA
Spes
so
sost
ituzi
one
IM
FE <
60%
DT
S >
45
mm
IA
FE <
50%
DT
S >
55 m
m
Tabe
lla I
.Raf
fron
to tr
a in
suff
icie
nza
mitr
alic
a ed
aor
tica.
Fisi
opat
olog
iaC
aric
oTe
rapi
a m
edic
aTe
rapi
a ch
irur
gica
Mar
ker
di d
isfu
nzio
ne V
S

zione del gradiente pressorio transvalvolare. La sola ma-nipolazione della pressione aortica non ha, perciò, unconsiderevole effetto sul volume di rigurgito valvolare.
Questo graduale sovraccarico provoca ipertrofia edilatazione e mette in atto tutta una serie di meccanismineuroumorali, miocardici e vascolari complessi e spes-so dannosi che hanno comunque l’intento di mantenereil più a lungo possibile un’adeguata funzione VS18-24.
Gli esatti meccanismi che condizionano l’ipertrofianon sono completamente conosciuti, anche se i fattoriresponsabili sono probabilmente rappresentati in primoluogo dalla modulazione ormonale, dall’attivazioneadrenorecettoriale e dal carico ventricolare25. Sebbenel’ipertrofia rappresenti un’importante risposta del cuo-re al cronico sovraccarico, le cellule ipertrofiche nonsono normali22,25.
Una diversa espressione genica con sintesi prefe-renziale di alterate isoforme di miosina (sintesi prefe-renziale di miosina lenta V3 al posto di V1), di isofor-me fetali di proteine miocardiche e di collagene è, spes-so, una delle alterazioni iniziali della valvulopatia22. Inrisposta al sovraccarico si instaura una sintesi preferen-ziale di catene pesanti V3 con produzione di una mag-giore quantità di miosina “lenta” al posto della “rapida”che, riducendo la velocità di interazione dei ponti acti-no-miosina, provoca una riduzione della contrattilitàmiocardica22. L’aumento del numero dei sarcomeri,senza allungamento delle fibre, rappresenta la rispostainiziale del cuore all’IA. Successivamente i sarcomeri,a causa dell’aumento dello stress parietale telesistolico,si replicano in parallelo; ne risulta, così, lo sviluppo diun’ipertrofia mista eccentrica e concentrica, ma constress ai limiti superiori della norma.
All’ipertrofia miocardica si associa inizialmente unrapido incremento della sintesi del collagene (tipo III eIV) e più tardivamente una fibrosi interstiziale26. Datirecenti27 suggeriscono che nell’IA la variazione dell’e-spressione genica della sintesi dei fibroblasti cardiaci,produce un’anormale produzione della matrice non col-lagena extracellulare, specialmente nella produzione difibronectina, con relativi piccoli cambiamenti nella sin-tesi del collagene. Tali dati sperimentali sembrano indi-care che la fibrosi miocardica può essere, anche se inparte, la prima risposta al sovraccarico di volume. L’im-portanza, inoltre, dell’interazione miociti-matrice noncollagena extracellulare nel mantenimento della funzio-ne sistolica, suggerisce che la fibrosi può contribuire al-l’instaurarsi della disfunzione sistolica per l’alterazionedi questa interazione, specialmente se si pensa che la fi-bronectina è un mediatore importante della connessionemiociti-matrice non collagena extracellulare27.
Ipertrofia e fibrosi, comunque, unitamente alla ri-dotta capillarogenesi ed alla ridotta velocità di diffusio-ne dell’ossigeno per aumento della distanza fra capilla-ri e miociti, nonché ad un aumento delle richieste me-taboliche per l’elevato postcarico e per aumento dellamassa miocardica, creano una condizione di ischemiacronica responsabile di una graduale riduzione della
contrattilità26. L’abbondanza di elementi contrattili,inoltre, determina un aumentato fabbisogno di adenosi-na trifosfato e di ossigeno, senza accompagnarsi ad uncorrispondente aumento della dotazione mitocondriale.Una relativamente scarsa capacità di produrre adenosi-na trifosfato può quindi annullare i potenziali vantaggidell’ipertrofia cellulare.
In breve, la risposta ipertrofica può avere un benefi-cio iniziale, ma rappresenta una risposta compensatoriaimperfetta perché, alla fine, le cellule ipertrofiche van-no incontro a deterioramento ed accelerata apoptosi.
Un aspetto importante, ma difficile da prevederenella fisiopatologia dell’IA, è il passaggio dalla fase dideterioramento reversibile a quello irreversibile dellafunzione ventricolare13. Durante questa fase di transi-zione si ha un innalzamento critico dello stress parieta-le e l’ipertrofia diviene ancora più inadeguata con in-cremento del rapporto raggio/spessore e con rapportomassa/volume uguale ad 1 e con progressiva riduzionedella contrattilità26.
La fase più avanzata è caratterizzata da un progres-sivo ingrandimento ventricolare, da un’elevata pressio-ne telediastolica, da un aumento dello stress telesistoli-co e del volume telesistolico e da un declino della FE edella portata cardiaca.
La disfunzione VS inizialmente può essere dovutaad eccesso di postcarico e/o a depressione della con-trattilità conseguente all’ischemia cronica in assenza dilesioni strutturali. Questa fase è ancora un fenomenoreversibile e recuperabile se la sostituzione valvolareaortica (AVR) viene eseguita tempestivamente.
La possibilità di normalizzare o di aumentare in mo-do significativo i parametri che quantificano la funzioneVS mediante manipolazione dei determinanti primamenzionati24, identifica la reversibilità della disfunzione.
Il miglioramento della funzione VS mediante la ri-duzione farmacologica delle condizioni di carico convasodilatatori come il nitroprussiato o la nifedipina oincrementando la contrattilità con stimoli inotropi, in-dica la dipendenza della disfunzione, al suo esordionell’IA, da un eccesso di carico o da un deficit contrat-tile in assenza di lesioni strutturali irreversibili. Nellefasi avanzate della malattia non è più ottenibile la nor-malizzazione della funzione VS con tali manipolazioni:ciò indica la presenza di un danno miocardico irrever-sibile. Questa fase rende la malattia indistinguibile dauna miocardiopatia dilatativa24.
Con il passare del tempo, dunque, la depressionedella contrattilità miocardica predomina sull’eccesso dicarico come causa di deterioramento della funzioneVS: quest’ultima fase potrebbe compromettere i bene-fici dell’AVR28-32.
Le diverse fasi evolutive descritte rendono ragionedella lunga fase di asintomaticità che caratterizza la sto-ria naturale dei pazienti con IA33-35.
Da una sintesi di sette studi sull’argomento36 su 490pazienti, in un periodo medio di osservazione di 6.4 an-ni, è riportata la comparsa di sintomi e/o disfunzione
G Bisignani - L’insufficienza aortica
191

ventricolare con una media del 4%/anno. Solo 6/490erano deceduti per morte improvvisa (mortalità < 0.2%/anno). Sei dei sette studi hanno segnalato la possibilitàdi sviluppo di disfunzione ventricolare in assenza disintomi: 36/463 pazienti presentavano disfunzione ven-tricolare a riposo, in assenza di sintomi, in un periododi osservazione di 5.9 anni con una frequenza di pro-gressione di 1.3%/anno.
La possibilità che si sviluppi disfunzione VS in as-senza di sintomi è da tener presente, ma in realtà taleevenienza è molto rara: nella maggior parte dei casi lasintomatologia precede o è ad essa contemporanea. Ipochi dati sui pazienti asintomatici con depressa fun-zione VS indicano che i sintomi si presentano nellamaggior parte dei casi nell’arco di 2 o 3 anni36.
La storia naturale subisce, però, un rapido cambia-mento con la comparsa dei sintomi. Non ci sono studirecenti su larga scala sulla storia naturale dei pazientisintomatici con IA, perché alla comparsa di sintomi es-si vengono inviati al chirurgo. I dati di letteratura, che
risalgono all’epoca prechirurgica, indicano una pro-gnosi infausta con una sopravvivenza media di 2 annidopo insorgenza di scompenso VS (mortalità > 20%/anno) e di 5 anni dopo insorgenza di angina pectoris(mortalità > 10%/anno)36.
La sopravvivenza dei pazienti sintomatici sottopostia chirurgia migliora in modo drammatico se confronta-ta con quella dei pazienti lasciati in terapia medica (Fig.1)31,37.
Il risultato della chirurgia è comunque condizionato,oltre che dalla perizia dell’equipe chirurgica, anche dal-la funzione VS preoperatoria (Fig. 2)38-44. Dalla figura 2emerge chiaramente che la funzione VS preoperatoria èun determinante importante della sopravvivenza dopointervento chirurgico. Mortalità operatoria e sopravvi-venza a distanza sono correlate, oltre che con l’entità, an-che con la durata della disfunzione ventricolare. Bonowet al.39 hanno riferito che l’AVR eseguita tempestiva-mente (non oltre i 14 mesi dall’insorgenza dei sintomie/o disfunzione) aveva un buon risultato operatorio.
192
Ital Heart J Suppl Vol 4 Marzo 2003
Figura 1. Curve di sopravvivenza in pazienti sintomatici con insufficienza aortica cronica. Dalla curva emerge il favorevole contributo della terapiachirurgica alla sopravvivenza. Da Domenicucci e Severino31 e Hoshino e Gaasch37, modificata.
Figura 2. Relazione tra la funzione ventricolare preoperatoria e sopravvivenza postoperatoria. I dati di Greves et al.38 a sinistra e quelli di Bonow etal.39 a destra, che valutano pazienti con parametri anormali, mostrano notevole concordanza. I dati di Cunha et al.40, al centro, valutano pazienti conparametri nel range della normalità. Questi dati evidenziano come la funzione ventricolare preoperatoria sia un fattore determinante della sopravvi-venza postoperatoria. ESD = diametro telesistolico; SEF = frazione di eiezione. Da Braunwald28, modificata.

In definitiva, la gestione del paziente con IA si con-cretizza nel dare elementi utili ai fini della decisone te-rapeutica e nel definire il momento giusto per la chirur-gia con il minor rischio ed il maggior vantaggio. Ma ilmomento giusto è tutt’altro che agevole da definire nelsingolo paziente e lo testimoniano i numerosi indiciproposti.
Parametri clinici e strumentali che portano alladecisione terapeutica
È questo un problema di grande interesse sin daipionieristici studi di Spagnuolo et al.45 che 30 anni fa,in 176 giovani pazienti con IA, descrissero alcuni para-metri a significato prognostico sfavorevole. Gli autori,sulla base dell’ingrandimento cardiaco alla radiografiadel torace di anomalie elettrocardiografiche (S in V2 +R in V5 > 51 mm; depressione ST nelle derivazioni si-nistre; T invertite in V5-V6-aVL) e valori della pressio-ne arteriosa (sistolica > 140 mmHg e diastolica < 40mmHg) identificarono un gruppo di pazienti ad alto ri-schio di eventi (87% aveva eventi, morte o sintomi a 6anni); in questi pazienti, concludevano Spagnuolo etal., è indicata la chirurgia anche se asintomatici.
La diagnosi di IA è usualmente fatta sulla base delsoffio diastolico e di altri segni clinici. È bene ricorda-re l’importanza di un attento esame obiettivo: è stata di-mostrata un’elevata correlazione tra l’intensità del sof-fio diastolico all’ascoltazione cardiaca e la severità delrigurgito valutata con eco-Doppler46. La presenza di ungaloppo protodiastolico, espressione dell’aumentatovolume telesistolico VS, è stata proposta come segnoper porre indicazione chirurgica28. Il terzo tono è spes-so una manifestazione del sovraccarico di volume e nonnecessariamente un segno di insufficienza cardiaca. Ilrumore di Austin Flint è un segno specifico di IA seve-ra. Numerosi rilievi ascoltatori (segno di Traube, diMuller, di Duroziez, di Quincke, di Hill) confermano lapresenza di un’ampia pressione differenziale. La gra-vità dell’IA non sempre si correla direttamente con lapressione arteriosa. Quando compare insufficienza car-diaca, per la vasocostrizione periferica la pressione ar-teriosa diastolica può innalzarsi, ma ciò non va inter-pretato come segno di diminuita gravità dell’IA28. L’e-lettrocardiogramma mostra un aumentato voltaggio VSed un quadro di sovraccarico ventricolare, tuttavia nonha valore predittivo riguardo alla gravità dell’IA28.
La comparsa di sintomi, dispnea o angina impone,come già ricordato, l’indicazione chirurgica.
Molti studi38-44, quello di Chaliki et al.42 in partico-lare, hanno dimostrato che i risultati postoperatori neipazienti asintomatici, ma con ridotta funzione VS, sonomeno favorevoli rispetto ai pazienti asintomatici e connormale funzione VS; nei pazienti sintomatici, invece,anche se con normale funzione VS, i risultati sono peg-giori se confrontati con quelli ottenuti negli asintomati-ci con normale funzione VS.
Il sintomo si pone, perciò, come predittore indipen-dente di sopravvivenza e, quando presente, condizionain modo sfavorevole la prognosi postoperatoria38,42,43:da ciò ne deriva che per i pazienti sintomatici l’indica-zione chirurgica è scelta obbligata41-44.
L’angina pectoris, spesso notturna, può comparirequando la frequenza cardiaca e la pressione diastolicascendono a livelli estremamente bassi. Altri fattori chepossono concorrere nel causare anormalità del flussocoronarico in tali pazienti sono: anomalie anatomichedei seni di Valsalva in caso di aorta bicuspide o effettoVenturi in alcuni casi47-49.
L’angina non correla con l’entità del rigurgito ed inquesta valvulopatia è sintomo di bassa sensibilità e spe-cificità perché spesso, come detto, non espressione dicoronaropatia organica50,51.
È comunque la misura della funzione ventricolare,perché fattore prognostico fondamentale, che riveste unruolo importante nella gestione del paziente con IA.Una FE < 50% a riposo, generalmente misurata conecocardiogramma, identifica la disfunzione VS.
Nelle ultime due decadi c’è stato molto interesse sulcomportamento della FE, misurata con angiocardio-scintigrafia, a riposo e sotto sforzo. Anche se è chiaroche una riduzione della FE durante esercizio, espres-sione di precoce compromissione della funzione sisto-lica, peggiora la prognosi52-56, rimane aperto il dibattitose questo indice ha un potere prognostico indipendenteche supera quello della FE a riposo.
Bonow et al.36 hanno dimostrato che la FE sottosforzo non dava indicazioni prognostiche aggiuntive ri-spetto alle dimensioni ecocardiografiche del ventricolosinistro. Un decremento della FE durante esercizio nondovrebbe essere usato, da solo, come indicazione al-l’AVR in pazienti asintomatici e con normale funzioneventricolare a riposo36. Variazioni della frequenza car-diaca, della pressione arteriosa ed altri effetti emodina-mici che si verificano sotto sforzo rendono difficile sta-bilire se il mancato aumento della FE è dovuto preva-lentemente ad una disfunzione VS13.
È perciò la compromessa funzione ventricolare a ri-poso che diventa la base sulla quale selezionare i pa-zienti da sottoporre ad intervento; una FE che non ri-sponde all’esercizio sottintende una compromessa fun-zione a riposo28. Un test da sforzo può essere comunqueutile per valutare la capacità funzionale e la rispostasintomatica in pazienti con storia di sintomi equivoci36.
Molto discusso il valore prognostico di alcuni para-metri ecocardiografici. Considerato che l’IA ha com-plessi effetti sia sul precarico che sul postcarico la scel-ta degli appropriati indici è una vera e propria sfida.
La dilatazione ventricolare, anche se non da sola, èun indice di severità della malattia. Ad un’analisi mul-tivariata effettuata da Bonow et al.35 risultava che le di-mensioni telesistoliche iniziali, il progressivo incre-mento annuo, unitamente al calo della FE a riposo, era-no elementi predittivi indipendenti di progressione del-la malattia: in particolare un diametro telesistolico
G Bisignani - L’insufficienza aortica
193

(DTS) > 50 mm portava al 19% il rischio di eventi car-diaci rispetto al 5% dell’intera popolazione in esame.Un DTS < 40 mm, invece, era associato ad un rischio dieventi trascurabile33.
Se si prendono in considerazione i volumi è statoevidenziato come un volume telesistolico > 60 ml/m2
ed un volume telediastolico > 150 ml/m2 erano associa-ti ad alto rischio di eventi34.
Henry et al.57,58 nel 1980 proposero, in uno studioconsiderato punto di riferimento per molti anni, comeindice prognostico negativo un DTS > 55 mm. Succes-sivamente tale parametro è stato ritenuto troppo rigidoe soggetto ad importanti limitazioni. Fioretti et al.59, in-fatti, dimostrarono che non esistevano differenze per lecomplicanze postoperatorie sulla base del DTS; anchein pazienti con DTS > 55 mm era possibile ottenere unbuon risultato operatorio ed attribuirono la peggioreprognosi segnalata da Henry et al., alla diversa prote-zione miocardica intraoperatoria e al tipo di protesi.
Un altro indice utilizzato è il rapporto raggio/spes-sore telediastolico, ottenuto dividendo la metà del dia-metro telediastolico (DTD) VS per lo spessore della pa-rete posteriore (oppure per la media degli spessori del-la parete posteriore e del setto interventricolare): unrapporto raggio/spessore > 4 rifletterebbe un’ipertrofiainadeguata e sarebbe predittivo di persistenza della dis-funzione VS postoperatoria.
La valutazione della severità del rigurgito aortico,nonostante i metodi proposti in letteratura ed adottatinella pratica clinica, presenta ancora importanti limita-zioni. Se è più semplice distinguere le forme lievi daquelle severe, di più difficile quantificazione risultanole forme intermedie. La quantificazione non invasivapiù attendibile di un rigurgito aortico si ottiene inte-grando le informazioni derivate da più metodi eco co-lor Doppler quali la misura dell’area e della lunghezzadel jet rigurgitante, del rapporto tra area del jet/area deltratto di efflusso del ventricolo sinistro, misura dello“slope” e del tempo di dimezzamento e la valutazionedel flusso retrogrado in aorta toracica discendente edaddominale60-66. Altri metodi di quantificazione del ri-gurgito (eco tridimensionale, PISA, vena contracta) perle numerose limitazioni sia teoriche che pratiche non ri-vestono attualmente significato clinico67-69.
Una metodica che si sta rivelando utile e prometten-te nello studio dell’IA è la risonanza magnetica70-76. Lametodica è in grado di offrire informazioni morfofun-zionali estremamente affidabili e ripetibili (stima preci-sa di massa, dimensioni, cinesi, volumi), non risente difattori limitanti quali la conformazione toracica, è mul-tiplanare, riproducibile e consente uno studio accuratodella radice aortica. Uno dei maggiori vantaggi di taletecnica è la possibilità, utilizzando le curve “phase ve-locity mapping”, di avere misure quantitative precise eripetibili del volume e della frazione rigurgitante, tantoche tale valutazione, come sottolineato da Chatzima-vroudis et al.76, può essere considerata il “gold standardto quantify blood flow”. La misura non è influenzata,
inoltre, dalla presenza di rigurgiti di altre valvole car-diache.
L’aumento dell’interesse dei cardiologi verso la me-todica e la sempre maggiore diffusione della macchina,renderanno lo studio dell’IA con risonanza magneticaun punto di riferimento importante per il follow-up eper ottimizzare il timing chirurgico70-76. Attualmente lelinee guida36 propongono la risonanza magnetica in ca-so di eco non ottimale o al posto dell’angiocardioscin-tigrafia da sforzo nei pazienti con dati eco non certi e/odiscordanti con la clinica. Sicuramente la maggiore di-sponibilità della macchina e la competenza nell’usodella metodica renderanno più estensive le suddette in-dicazioni.
Il cateterismo cardiaco, che ha apportato dati fisio-patologici non ottenibili con altre metodiche, trova lamaggiore indicazione per valutare l’eventuale corona-ropatia associata. Non trova più indicazione per valuta-re la diagnosi e la quantificazione del rigurgito valvola-re; nella grande maggioranza dei casi, infatti, è suffi-ciente l’esame ecocardiografico e, quando necessario,l’esame con risonanza magnetica. Le linee guida36, tut-tavia, consigliano il cateterismo nei rari casi di risultatidubbi dei test non invasivi ed in caso di discrepanza tradati non invasivi e quadro clinico.
Terapia medica
Lo scopo della terapia medica dovrebbe essere quel-lo di prolungare il periodo asintomatico preservando lafunzione ventricolare e ritardare la chirurgia.
Il razionale dell’impiego dei vasodilatatori è quellodi ottenere condizioni di carico più favorevoli con ridu-zione del volume rigurgitante, secondario all’abbassa-mento delle resistenze periferiche, e conseguente ridu-zione degli alti livelli di stress sistolico, delle dimen-sioni ventricolari e dell’ipertrofia e con preservazionedella funzione VS14,77.
Nell’IA effetti benefici, anche se con efficacia di-versa, sono stati dimostrati dopo terapia cronica conidralazina78,79, captopril80-82, enalapril83, quinapril84 enifedipina85.
Un nostro studio ha dimostrato come la terapia concaptopril ha effetti favorevoli sulle dimensioni e sullamassa del ventricolo sinistro. Le variazioni sono risul-tate significative già dopo 6 mesi di terapia, ma gli ef-fetti benefici si sono mantenuti invariati per tutta la du-rata dello studio80,81.
Scognamiglio et al.85 hanno dimostrato che la tera-pia con nifedipina, rispetto alla digitale, influenza inmodo favorevole la storia naturale dell’IA rallentandola progressione della malattia e ritardando la chirurgia.Nello stesso studio è stato affrontato il problema se il ri-tardo dell’intervento, favorito dalla terapia vasodilata-trice, potesse avere un effetto negativo sulla funzioneVS dopo la chirurgia: il confronto fra i due gruppi (pa-zienti operati per sintomi o per comparsa di disfunzio-
194
Ital Heart J Suppl Vol 4 Marzo 2003

ne ventricolare) non ha mostrato differenze nel recupe-ro della funzione VS.
Non sono disponibili dati similari sull’uso degliACE-inibitori; anche se tali farmaci hanno dimostratoun effetto favorevole sul decorso clinico86 ed un effettobenefico sulla risposta del ventricolo sinistro al caricorigurgitante80-84,86, per cui si può immaginare che essisiano ugualmente utili, ma non ci sono dimostrazioniscaturite da studi controllati, come invece è avvenutoper la nifedipina (Tab. II)78,79,81,83-85,87.
Uno studio di diretta comparazione tra ACE-inibito-ri e nifedipina potrebbe essere utile ed appropriato.
In conclusione i vasodilatatori non sono alternativialla chirurgia e non ci sono dati che ne raccomandinol’impiego in pazienti asintomatici con lieve IA e connormali o solo lievemente aumentate dimensioni ven-tricolari.
I vasodilatatori andrebbero somministrati36:• in pazienti asintomatici con rigurgito aortico modera-to e severo, con buona funzione VS ed aumento delledimensioni ventricolari;• in pazienti asintomatici e con ogni grado di iperten-sione arteriosa e rigurgito; l’ipertensione, infatti, fa au-mentare il flusso di rigurgito;• in pazienti con rigurgito severo che hanno sintomi e/odisfunzione ventricolare quando non è più possibile ef-fettuare l’intervento chirurgico per fattori cardiaci onon cardiaci; • come terapia di breve termine per migliorare le con-dizioni emodinamiche nei pazienti compromessi primadell’AVR.
Il rischio di porre indicazione tardiva all’interventoper l’effetto cosmetico dei vasodilatatori con ritardatacomparsa dei sintomi, può essere evitato se i pazientisono seguiti con controlli seriati e valutando parametririproducibili86.
Per quanto riguarda la terapia digitalica Braun-wald28 la consiglia, in associazione ai vasodilatatori,nei pazienti con grave rigurgito aortico, dilatazione delventricolo sinistro anche se a ritmo sinusale ed asinto-matici.
Bradiaritmie e fibrillazione atriale sono mal tollera-te da questi pazienti e, se possibile, bisogna cercare diimpedirne l’insorgenza28.
Quando pensare all’intervento chirurgiconel paziente asintomatico
Lo scopo della chirurgia nell’IA è quello di diminui-re i sintomi, prevenire danni miocardici irreversibili eprolungare la vita. La scelta chirurgica deve tener contoche, a differenza della valvulopatia mitralica, richiedequasi sempre una protesi valvolare, anche se negli ulti-mi anni è cresciuto l’interesse per la chirurgia riparativadella valvola aortica: questi pazienti sono perciò sotto-posti oltre che al rischio della chirurgia anche alle com-plicanze della protesi valvolare. La mortalità chirurgica,in casistiche allargate con associato intervento di bypassaortocoronarico è intorno al 2.4-4.9%88,89.
In pazienti senza malattia coronarica ed in pazientiall’esordio dei sintomi o della disfunzione VS la mor-talità è < 1%31.
Anche le complicanze dovute alla protesi valvolaredevono essere considerate nella scelta terapeutica: l’in-cidenza di serie complicanze dovute alla protesi è< 3%/anno, soprattutto se la terapia anticoagulante è se-guita correttamente, con una mortalità < 1%/anno88,89.
Se non esistono dubbi nel porre indicazione all’AVRall’inizio dei sintomi e/o ai primi segni di disfunzioneVS (FE < 50%), la decisione è molto più difficile neipazienti che non hanno queste due condizioni48,90.
Nei pazienti asintomatici anche se con normale FEviene raccomandata l’AVR in caso di estrema dilata-zione VS (DTD > 75 mm e DTS > 55 mm) per l’alto ri-schio di morte improvvisa di questi pazienti. Le donnetendono a sviluppare sintomi e/o disfunzione VS condimensioni ventricolari minori rispetto all’uomo, e ciòpuò essere in relazione alla superficie corporea, anchese non ci sono linee guida che suggeriscono di correg-gere le dimensioni ventricolari in rapporto alla superfi-cie corporea, in questi casi può essere di aiuto il giudi-zio clinico sul singolo caso91.
Nei pazienti con severa IA e normale FE, quando ilgrado di dilatazione non raggiunge, ma è vicino (DTD75 mm, DTS 55 mm), è consigliabile effettuare fre-quenti controlli ecocardiografici ogni 4-6 mesi. È co-munque consigliabile raccomandare in tali pazienti l’AVRin caso di scarsa tolleranza allo sforzo o anormale ri-sposta dei parametri emodinamici all’esercizio. L’inter-
G Bisignani - L’insufficienza aortica
195
Tabella II. Principali studi sull’impiego in cronico di vasodilatatori nell’insufficienza aortica.
Studio Farmaco N. pazienti Mesi VTD VTS FE DTD DTS
Kleaveland et al.78, 1986 Idralazina 17 6 0 0 0 0 0Greenberg et al.79, 1988 Idralazina 80 24 – – + 0 0Dumesnil et al.87, 1990 Idralazina 7 36 – –Lin et al.83, 1994 Enalapril 76 24 – – 0Schon et al.84, 1994 Quinazil 12 12 – – + – –Scognamiglio et al.85, 1994 Nifedipina 72 12 – +Bisignani et al.81, 1997 Captopril 11 24 + – –
DTD = diametro telediastolico; DTS = diametro telesistolico; FE = frazione di eiezione; VTD = volume telediastolico; VTS = volumetelesistolico. 0 invariato; – diminuito; + aumentato.

vento è anche generalmente indicato in caso di conco-mitante dilatazione della radice aortica (> 50 mm).
La Task Force dell’American College of Cardiologye dell’American Heart Association ha pubblicato dellelinee guida sulle indicazioni chirurgiche nell’IA e sonoriportate nella tabella III36,90.
Anche nel paziente sintomatico con grave disfun-zione VS (FE < 25% o DTS > 60 mm) la scelta chirur-gica non è semplice se si considerano i dati di mortalitàperioperatori ed il recupero della funzione VS. L’AVR,infatti, in tali pazienti continua ad essere associata, no-nostante i progressi chirurgici ed anestesiologici, ad unmaggior rischio di mortalità, circa il 10%, e con morta-lità postoperatoria nei primi 5 anni molto alta92.
Dobbiamo chiederci, perciò, “quando è troppo tardiper inviare tale paziente al chirurgo”? È un importante di-
lemma e non sempre di facile soluzione. L’intervento de-ve essere considerato in pazienti sintomatici con classefunzionale NYHA II o III soprattutto se sintomi e disfun-zione sono di recente insorgenza o se si ha un migliora-mento dei parametri emodinamici dopo un breve periododi terapia intensiva con vasodilatatori e/o agenti inotropi.
Le conclusioni delle linee guida36, comunque, rendo-no ancora più complessa la decisione clinica in questi pa-zienti perché così scrivono: “Tuttavia, anche in pazientisintomatici con classe NYHA IV e FE < 25%, l’alto ri-schio associato all’AVR e susseguente gestione terapeu-tica della disfunzione ventricolare postoperatoria, costi-tuisce un’alternativa migliore al rischio cui va incontro ilpaziente se lasciato in sola terapia medica”. Tale affer-mazione è rafforzata dal recente lavoro di Chaliki et al.42
che dimostra come nonostante una più alta mortalità(7.7%) intraoperatoria nel gruppo dei pazienti con IA se-vera e marcata depressione della FE (< 35%), la mag-gioranza dei pazienti (75%) mostra un miglioramentopostoperatorio senza comparsa di insufficienza cardiacaa 10 anni dall’intervento. Gli autori concludono con l’af-fermazione che nei pazienti con IA severa una marcatariduzione della FE non deve essere considerata una con-troindicazione all’intervento42.
Conclusioni
In conclusione, la gestione clinica del paziente conIA cronica rimane un importante problema clinico eper certi versi ancora aperto, e sul quale non esiste unaccordo unanime su quale sia la strategia migliore daadottare.
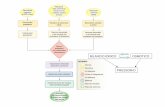
Nella figura 336 è riportata una flow-chart che sinte-tizza il comportamento del medico di fronte ad un pa-ziente con IA. La valutazione basale è una tappa im-portante che dovrà servire da riferimento per i control-li successivi. Considerato l’elevato contenuto informa-tivo, anche in termini decisionali, che rivestono le mi-sure ecocardiografiche nei pazienti con IA, in partico-lare le misure semplici e riproducibili come i diametridel ventricolo sinistro e la FE, è imperativo che questemisurazioni vengano rilevate con estrema precisione escrupolo dall’operatore.
Se il paziente è asintomatico, ha normale funzioneVS e dimensioni ventricolari solo lievemente aumenta-te (DTD < 60 mm, DTS < 45 mm), si può stabilire unprimo controllo a 3 mesi dalla valutazione iniziale e, incaso di condizioni stabili, si programmano controlliogni 6-12 mesi. In caso di DTD > 60 mm, che si man-tiene stabile nel tempo, è utile una valutazione clinicaogni 6 mesi ed un eco ogni 12 mesi, se invece tale pa-ziente è alla prima osservazione è utile rivalutarlo dopoi primi 3 mesi. Nei pazienti con normale FE, ma conDTD più marcato > 70 mm e DTS > 50 mm, nei qualiil rischio di sviluppare sintomi o disfunzione VS è tra il10 e 20%/anno, è ragionevole un controllo clinico edecocardiografico ravvicinato ogni 4-6 mesi.
196
Ital Heart J Suppl Vol 4 Marzo 2003
Tabella III. Raccomandazioni per la sostituzione valvolare nel-l’insufficienza aortica cronica severa36,90.
DTD = diametro telediastolico; DTS = diametro telesistolico; FE= frazione di eiezione; VS = ventricolare sinistra.
1.
2.
3.
4.
5.
6.
7.
8.
9.
10.
11.
Classe
I
I
I
I
I
IIa
IIa
IIb
IIb
III
IIbIII
III
Indicazioni
Pazienti con classe funzionale NYHA III o IV e fun-zione sistolica VS conservata (definita come FE nor-male a riposo ≥ 50%).
Pazienti con classe funzionale II e funzione sistolicaVS conservata, ma progressiva dilatazione VS o FEche tende a ridursi a riposo durante studi seriati o ri-dotta tolleranza allo sforzo durante test da sforzo.
Pazienti con classe funzionale CCS II o gradi mag-giori di angina, con o senza arteriopatia coronarica.
Paziente sintomatico o asintomatico con disfunzioneVS lieve o moderata a riposo (FE 25-49%).
Pazienti sottoposti a bypass aortocoronarico o altriinterventi chirurgici sull’aorta o su altre valvole.
Pazienti con classe funzionale NYHA II e funzionesistolica VS conservata (FE > 50%) con dimensionie funzione VS stabili in studi seriati e tolleranza allosforzo stabile.
Pazienti asintomatici con funzione sistolica VS nor-male (FE > 50%) ma con dilatazione VS severa(DTD > 75 mm o DTS > 55 mm) (considerare unasoglia più bassa per piccola superficie corporea; èsempre richiesto un giudizio clinico).
Pazienti con disfunzione VS severa (FE > 25%).
Pazienti asintomatici con normale funzione sistolicaa riposo (FE > 50%) e progressiva dilatazione VS,quando il grado di dilatazione è moderatamente se-vero (DTD 70-75 mm e DTS 50-55 mm).
Pazienti asintomatici con funzione sistolica normale ariposo (FE > 50%) ma con declino della FE durante: - angiografia da sforzo con radionuclidi- eco-stress.
Pazienti asintomatici con normale funzione sistolicaa riposo (FE > 50%) e dilatazione VS con grado didilatazione non severo (DTD < 70 mm, DTS < 50mm).

In caso di severa IA con paziente sedentario e/o sin-tomi equivoci può essere utile un test da sforzo perchiarire il quadro clinico, valutare la capacità funziona-le e la risposta emodinamica all’esercizio e per porre,insieme agli altri parametri, l’eventuale indicazione al-l’AVR.
In caso di misure ecocardiografiche dei parametriche quantificano la funzione VS incerte o subottimali
e/o discordanti con la clinica, possono risultare utilil’angiocardioscintigrafia o la risonanza magnetica.
Nei pazienti sintomatici o con funzione VS subnor-male o con estrema dilatazione ventricolare (DTD > 75mm, DTS > 55 mm) l’AVR, come già ricordato, diven-ta scelta obbligata.
La decisone se lasciare il paziente in terapia medicao avviarlo alla chirurgia non dovrà, comunque, basarsi
G Bisignani - L’insufficienza aortica
197
Figura 3. Raccomandazioni per la valutazione del paziente con insufficienza aortica. La valutazione basale è una tappa importante della gestione del-la valvulopatia. In alcuni centri con esperienza di angiocardioscintigrafia (RVG) o di risonanza magnetica (RM), la valutazione funzionale può essereeseguita con tali tecniche, soprattutto in caso di dati eco non ottimali o incerti. Il cateterismo può essere indicato in caso di discordanza tra clinica edaltri dati strumentali (eco). La coronarografia trova indicazione per valutare l’eventuale coronaropatia associata in base all’età, sintomi e fattori di ri-schio coronarico. La dizione “esame iniziale” si riferisce alla prima valutazione e quindi alle misure ecocardiografiche effettuate alla prima osserva-zione del paziente. AVR = sostituzione valvolare aortica; DTD = diametro telediastolico; DTS = diametro telesistolico; FE = frazione di eiezione. DaBonow et al.36, modificata.

su un singolo numero o parametro, anche perché lacomparsa di disfunzione VS rappresenta un continuumed una singola misura non può essere in assoluto il li-mite fra il normale e l’anormale. Una migliore cono-scenza della fisiopatologia molecolare e dei meccani-smi genetici responsabili delle alterazioni miocardicheche condizionano la risposta del ventricolo alla valvu-lopatia potrà, in futuro, affinare le nostre capacità pro-gnostiche e le scelte terapeutiche43. Attualmente solo laconoscenza della storia naturale dell’IA ed il compen-dio dei dati clinici e strumentali93 porteranno alla deci-sione migliore nel singolo paziente, ricordando che “…it is never possible to make a really asymptomatic pa-tient feel better through surgery. To advise surgery in anasymptomatic patient, there must be unequivocal evi-dence that the future benefits make the present realrisks of surgery worthwhile”94.
Riassunto
La gestione del paziente asintomatico con insuffi-cienza aortica cronica è un importante problema clini-co e per certi versi ancora aperto. Un corretto inquadra-mento del paziente dovrà tenere conto della fisiopato-logia e della storia naturale della malattia, ma anche deirisultati ottenibili con la terapia medica e chirurgica.L’insufficienza aortica è un modello di sovraccaricocombinato di volume e di pressione, in cui una nuovaespressione genetica indotta dall’ipertrofia modificacontrattilità e scheletro del cuore. Si descrive la storianaturale della valvulopatia ed il brusco e deleterio cam-biamento che essa subisce con la comparsa dei sintomi.Nell’articolo vengono discussi in modo dettagliato edalla luce delle recenti linee guida quali sono i parame-tri clinici e strumentali che portano alla migliore deci-sione terapeutica nel singolo paziente.
In particolare si sottolinea l’importanza della fun-zione ventricolare come parametro che condiziona lasopravvivenza ed i risultati postoperatori e di alcunisemplici e ripetibili parametri ecocardiografici, come idiametri ventricolari, per seguire nel tempo l’evoluzio-ne della malattia.
Viene anche discusso l’uso dei vasodilatatori e le in-dicazioni chirurgiche. Una corretta indicazione all’in-tervento di sostituzione valvolare dovrebbe essere po-sta al momento della comparsa dei sintomi e/o preco-cemente ai primi segni di disfunzione ventricolare sini-stra o, nei casi di estrema o progressiva dilatazione ven-tricolare, anche in presenza di normale frazione di eie-zione.
In definitiva la gestione del paziente con insuffi-cienza aortica cronica si concretizza nel definire il mo-mento giusto per la chirurgia con il minor rischio ed ilmaggior vantaggio.
Parole chiave: Chirurgia valvolare; Insufficienza aorti-ca; Terapia medica.
Bibliografia
1. Ross J Jr. Adaptations of the left ventricle to chronic volumeoverload. Circ Res 1974; 35 (Suppl II): II64-II70.
2. Ross J Jr. Afterload mismatch in aortic and mitral valve dis-ease: implications for surgery therapy. J Am Coll Cardiol1985; 72: 811-26.
3. Dalla Volta S. Trattamento dello scompenso nei vizivalvolari. In: Rovelli F, ed. Cardiologia 1986. Atti del XXCorso di Aggiornamento, Centro A De Gasperis. Milano:Ed Librex, 1986: 253-9.
4. Olson LJ, Subramanian R, Edwards WD. Surgical patholo-gy of pure aortic insufficiency: a study of 225 cases. MayoClin Proc 1984; 59: 835-41.
5. Becker AE. Surgical and pathological anatomy of aortic valveand root. Op Tech Cardiac Thorac Surg 1996; 1: 3014-21.
6. Antonini-Canterin F, Burelli C, Pavan D, Cassin M, NicolosiGL. Valvulopatia aortica. In: ANMCO, ed. Trattato di cardio-logia. Vol II. Milano: Excerpta Medica, 2000: 1757-90.
7. Singh JP, Evans JC, Levy D, et al. Prevalence and clinicaldeterminants of mitral, tricuspid, and aortic regurgitation(the Framingham Heart Study). Am J Cardiol 1999; 15:897-902.
8. Sabet HY, Edwards WD, Tazelaar HD, Daly RC. Congeni-tal bicuspid aortic valves: a surgical pathology study of 542cases (1991 through 1996) and literature review of 2715 ad-ditional cases. Mayo Clin Proc 1999; 74: 14-26.
9. Tonnemacher D, Reid C, Kawanishi D, et al. Frequency ofmyxomatous degeneration of the aortic valve as a cause ofisolated aortic regurgitation severe enough to warrant aorticvalve replacement. Am J Cardiol 1987; 60: 1194-6.
10. Allen WM, Matloff JM, Fishbein MC. Myxoid degenera-tion of the aortic valve and isolated severe aortic regurgita-tion. Am J Cardiol 1985; 55: 439-44.
11. Ryan DH, Bray GA, Helmcke F, et al. Serial echocardio-graphic and clinical evaluation of valvular regurgitation be-fore, during, and after treatment with fenfluramine ordexfenfluramine and mazindol or phentermine. Obes Res1999; 7: 313-22.
12. Carabello BA. Progress in mitral and aortic regurgitation.Prog Cardiovasc Dis 2001; 43: 457-75.
13. Gaasch WH, Sundaram M, Meyer TE. Managing asympto-matic patients with chronic aortic regurgitation. Chest1997; 111: 1702-9.
14. Levine HJ, Gaasch WH. Vasoactive drugs in chronic regur-gitant lesions of the mitral and aortic valves. J Am Coll Car-diol 1996; 28: 1083-91.
15. Reimold SC, Orav EJ, Come PC, Caguioa ES, Lee RT. Pro-gressive enlargement of the regurgitant orifice in patientswith chronic aortic regurgitation. J Am Soc Echocardiogr1998; 11: 259-65.
16. Corrigan DJ. On permanent patency of the aorta or inade-quacy of the aortic valves. Edinburgh Med Surg J 1832; 37:225-45.
17. Firth BG, Dehmer GJ, Nicod P, Willerson JT, Hillis LD. Ef-fect of increasing heart rate in patients with aortic regurgi-tation. Am J Cardiol 1982; 49: 1860-6.
18. Ross J Jr, Braunwald E. Aortic stenosis. Circulation 1968;38 (Suppl V): V61-V67.
19. Ricci DR, Mason MA. Ventricular performance in chronicaortic regurgitation: application to the conception of after-load mismatch and preload reserve. (abstr) Clin Res 1982;30: 18A.
20. Wisenbaugh T, Spann JF, Carabello BA. Differences in my-ocardial performance and load between patients with simi-lar amounts of chronic aortic versus mitral regurgitation. JAm Coll Cardiol 1984; 3: 916-23.
21. Scognamiglio R, Fasoli G, Nistri S, Palisi M, Dalla Volta S.
198
Ital Heart J Suppl Vol 4 Marzo 2003

ACE-inibitori o vasodilatatori nel trattamento delle insuffi-cienze valvolari. In: Rovelli F, ed. Cardiologia 1995. Attidel XX Corso di Aggiornamento, Centro A De Gasperis.Milano: Ed Librex, 1995: 692-9.
22. Katz AM. Cardiomyopathy of overload. A major determi-nant of prognosis in congestive heart failure. N Engl J Med1990; 322: 100-10.
23. Scognamiglio R, Roelandt J, Fasoli G, et al. Relation be-tween myocardial contractility, hypertrophy and pump per-formance in patients with chronic aortic insufficiency: anechocardiographic study. Int J Cardiol 1984; 6: 473-84.
24. Scognamiglio R, Fasoli G, Ponchia A, et al. Valutazionestrumentale dell’insufficienza aortica ai fini terapeutici. In:Cardiologia 1992. Atti del 26° Convegno Centro A DeGasperis. Milano: Ed Librex, 1992: 834-9.
25. Mann DL. Pathophysiology of valvular heart disease: basicmechanism. Curr Opin Cardiol 1991; 6: 191-6.
26. Grossman W, Jones A, McLaurin LP. Wall stress and pat-terns of hypertrophy in the human left ventricle. J Clin In-vest 1975; 56: 56-64.
27. Borer JS, Truter S, Herrold EM, et al. Myocardial fibrosis inchronic aortic regurgitation: molecular and cellular respons-es to volume overload. Circulation 2002; 105: 1837-42.
28. Braunwald E. Cardiopatie valvolari. In: Braunwald E, ed.Malattie del cuore. IV edizione. Padova: Piccin Nuova Li-braria, 1994: 586-686.
29. Bonow RO, Dodd JT, Maron BJ, et al. Long-term serialchanges in left ventricular function and reversal of ventric-ular dilation after valve replacement for chronic aortic re-gurgitation. Circulation 1988; 78: 1108-20.
30. Bonow RO, Epstein SE. Is preoperative left ventricularfunction predictive of survival and functional results afteraortic valve replacement for chronic aortic regurgitation? JAm Coll Cardiol 1987; 10: 713-6.
31. Domenicucci S, Severino S. Insufficienza valvolare aorticasevera in paziente asintomatico: quando pensare all’inter-vento chirurgico. G Ital Cardiol 1996; 26: 605-16.
32. Bonow R, Rosine D, Maron B, et al. Reversal of left ven-tricular dysfunction after valve replacement for chronic aor-tic regurgitation: influence of duration of preoperative leftventricular dysfunction. Circulation 1984; 70: 570-9.
33. Bonow RO, Douglas RR, McIntosh CL, et al. The naturalhistory of asymptomatic patients with aortic regurgitationand normal left ventricular function. Circulation 1983; 68:509-17.
34. Siemienczuk D, Greenberg B, Morris C, et al. Chronic aor-tic insufficiency: factors associated with progression to aor-tic valve replacements. Ann Intern Med 1989; 110: 587-92.
35. Bonow RO, Lakatos E, Maron BJ, et al. Serial long-term as-sessment of the natural history of asymptomatic patientswith chronic regurgitation and normal left ventricular sys-tolic function. Circulation 1991; 84: 1625-35.
36. Bonow RO, Carabello B, de Leon AC Jr, et al. Guidelinesfor the management of patients with valvular heart disease:executive summary. A report of the American College ofCardiology/American Heart Association Task Force onPractice Guidelines (Committee on management of patientswith valvular heart disease). Circulation 1998; 98: 1949-84.
37. Hoshino PK, Gaasch WH. When to intervene in chronicaortic regurgitation. Arch Intern Med 1986; 146: 349-52.
38. Greves J, Rahimtoola SH, McAnulty JH. Preoperative crite-ria predictive of late survival following valve replacement forsevere aortic regurgitation. Am Heart J 1981; 101: 300-8.
39. Bonow RO, Rosing DR, Kent KM. Timing of operation forchronic aortic regurgitation. Am J Cardiol 1982; 50: 325-36.
40. Cunha CL, Giuliani ER, Fuster V. Preoperative M-modeechocardiography as a predictor of surgical results in chron-
ic aortic insufficiency. J Thorac Cardiovasc Surg 1980; 79:256-65.
41. Schwarz F, Baumann P, Manthey J, et al. The effect of aor-tic valve replacement on survival. Circulation 1982; 66:1105-10.
42. Chaliki HP, Mohty D, Avierinos JF, et al. Outcomes afteraortic valve replacement in patients with severe aortic re-gurgitation and markedly reduced left ventricular function.Circulation 2002; 106: 2687-93.
43. Borer JS. Aortic valve replacement for the asymptomaticpatient with aortic regurgitation: a new piece of the strategicpuzzle. Circulation 2002; 106: 2637-9.
44. Dujardin KS, Enriquez-Sarano M, Schaff HV, Bailey KR,Seward JB, Tajik AJ. Mortality and morbidity of aortic re-gurgitation in clinical practice. A long-term follow-upstudy. Circulation 1999; 99: 1851-7.
45. Spagnuolo M, Kloth H, Taranta A, Doyle E, Pasternack B.Natural history of rheumatic aortic regurgitation. Criteriapredictive of death, congestive heart failure, and angina inyoung patients. Circulation 1971; 44: 368-80.
46. Desjardins VA, Enriquez-Sarano M, Tajik AJ, Bailey KR,Seward JB. Intensity of murmurs correlates with severity ofvalvular regurgitation. Am J Med 1996; 100: 149-56.
47. Ardehali A, Segal J, Cheitlin MD. Coronary blood flow re-serve in acute aortic regurgitation. J Am Coll Cardiol 1996;25: 1387-92.
48. Barlow JB. Cardiologic aspects of aortic valve surgery -who? when? what? Isr J Med Sci 1996; 32: 821-31.
49. Timmermans P, Willems JL, Piessens J, De Geest H. Angi-na pectoris and coronary artery disease in severe aortic re-gurgitation. Am J Cardiol 1988; 61: 826-9.
50. Tsai TP, Denton TA, Chaux A, et al. Results of coronaryartery bypass grafting and/or aortic or mitral valve opera-tion in patients ≥ 90 years of age. Am J Cardiol 1994; 74:960-2.
51. Lytle BW, Cosgrove DM, Gill CC, et al. Aortic valve re-placement combined with myocardial revascularization.Late results and determinants of risk for 471 in-hospital sur-vivors. J Thorac Cardiovasc Surg 1988; 95: 402-14.
52. Greenberg B, Massie B, Thomas D, et al. Association be-tween the exercise ejection fraction response and systolicwall stress in patients with chronic aortic insufficiency. Cir-culation 1985; 71: 458-65.
53. Gee D, Juni J, Santinga J, Buda AJ. Prognostic significanceof exercise-induced left ventricular dysfunction in chronicaortic regurgitation. Am J Cardiol 1985; 56: 605-9.
54. Lindsay J, Silverman A, Van Voorhees LB, Nolan NG. Prog-nostic implication of left ventricular function during exer-cise in asymptomatic patients with aortic regurgitation. An-giology 1987; 38: 386-92.
55. Borer JS, Herrold EM, Hochreiter C, et al. Natural historyof left ventricular performance at rest and during exerciseafter aortic valve replacement for aortic regurgitation. Cir-culation 1991; 84 (Suppl III): III133-III139.
56. Borer JS, Hochreiter C, Herrold EM, et al. Prediction of in-dications for valve replacement among asymptomatic orminimally symptomatic patients with chronic aortic regur-gitation and normal left ventricular performance. Circula-tion 1998; 97: 525-34.
57. Henry WL, Bonow RO, Borer JS, et al. Observations on theoptimum time for operative intervention for aortic regurgita-tion: I. Evaluation of the results of aortic valve replacement insymptomatic patients. Circulation 1980; 61: 471-83.
58. Henry WL, Bonow RO, Rosing DR, Epstein SE. Observa-tions on the optimum time for operative intervention foraortic regurgitation: II. Serial echocardiographic evaluationof asymptomatic patients. Circulation 1980; 61: 484-92.
59. Fioretti P, Roelandt J, Bos RJ, et al. Echocardiography in
G Bisignani - L’insufficienza aortica
199

chronic aortic insufficiency. Is valve replacement too latewhen left ventricular end-systolic dimension reaches 55mm? Circulation 1983; 67: 216-21.
60. Nishimura RA, Vonk GD, Rumberger JA. Semiquantifica-tion of aortic regurgitation by different Doppler echocar-diographic techniques and comparison with ultrafast com-puted tomography. Am Heart J 1994; 15: 1227-34.
61. Nicolosi GL, Pungercic E, Cervesato E, et al. Feasibilityand variability of six methods for the echocardiographicand Doppler determination of cardiac output. Br Heart J1988; 59: 299-303.
62. Mele D. Quantificazione dei rigurgiti valvolari. Che cosaoffre di nuovo l’ecocardiografia? G Ital Cardiol 1995; 25:1195-203.
63. Grayburn PA, Peshock RM. Non invasive quantification ofvalvular regurgitation. Getting to the core of the matter. Cir-culation 1996; 94: 119-21.
64. Dall’Aglio V, D’Angelo G, Moro E, et al. Interobserver andecho-angio variability of two-dimensional colour Dopplerevaluation of aortic and mitral regurgitation. Eur Heart J1989; 117: 133-9.
65. Dolan MS, Castello R, St Vrain JA, Aguirre F, Labovitz AJ.Quantitation of aortic regurgitation by Doppler echocardiog-raphy: a practical approach. Am Heart J 1995; 129: 1014-20.
66. Ekery DL, Davidoff R. Aortic regurgitation. Quantitativemethods by echocardiography. Echocardiography 2000; 17:293-302.
67. Belohlavek M, Foley DA, Gerber TC, Greenleaf JF, SewardJB. Three-dimensional reconstruction of color Doppler jets inthe human heart. J Am Soc Echocardiogr 1994; 7: 553-60.
68. Stato Y, Kawazoe K, Nasu M, Hiramori K. Clinical useful-ness of proximal isovelocity surface area method usingechocardiography in patients with eccentric aortic regurgi-tation. J Heart Valve Dis 1999; 8: 104-11.
69. Willett DL, Hall SA, Jessen ME, Wait MA, Grayburn PA.Assessment of aortic regurgitation by transesophageal col-or-Doppler imaging of the vena contracta: validationagainst an intraoperative aortic flow probe. J Am Coll Car-diol 2001; 37: 1450-5.
70. Honda N, Machida K, Hashimoto M. Aortic regurgitation:quantification with MR imaging velocity mapping. Radiol-ogy 1993; 186: 189-94.
71. Casolo GC, Rega L. Malattie valvolari. In: Hoffman E,Midiri M, eds. Risonanza magnetica cardiovascolare.Napoli: Gnocchi, 1996: 270-94.
72. Di Cesare E, Corridoni C, di Renzi P, Marsili E, Fedele F.Insufficienza valvolare aortica: RM vs ecocardiografia col-or Doppler. Cardiologia 1991; 2 (Suppl 2): 79-80.
73. Dulce MC, Mostbeck GH, O’Sullivan M, Cheitlin M, Hig-gins CB. Severity of aortic regurgitation: interstudy repro-ducibility of measurements with velocity-encoded cine MRimaging. Radiology 1992; 185: 234-40.
74. Globits S, Frank H, Mayr H. Quantitative assessment ofaortic regurgitation by magnetic resonance imaging. EurHeart J 1992; 13: 78-83.
75. Chatzimavroudis GP, Oshinski JN, Franch RH, PettigrewRI, Walker PG, Yoganathan AP. Quantification of the aor-tic regurgitation volume with magnetic resonance phasevelocity mapping: a clinical investigation of the impor-tance of imaging slice location. J Heart Valve Dis 1998; 7:94-101.
76. Chatzimavroudis GP, Oshinski JN, Franch RH, Walker PG,Yoganathan AP, Pettigrew RI. Evaluation of the precision ofmagnetic resonance phase velocity mapping for blood flowmeasurements. J Cardiovasc Magn Reson 2001; 3: 11-9.
77. Rahimtoola SH. Vasodilator therapy in chronic severe aor-tic regurgitation. J Am Coll Cardiol 1990; 16: 430-2.
78. Kleaveland JP, Keichek N, McCarthy DM, et al. Effects ofsix-month afterload reduction therapy with hydralazine inchronic aortic regurgitation. Am J Cardiol 1986; 57: 1109-16.
79. Greenberg BH, Massie B, Bristow JD, et al. Long-term va-sodilator therapy of chronic aortic insufficiency. A ran-domised double-blinded, placebo-controlled clinical trial.Circulation 1988; 78: 92-103.
80. Bisignani G, Guzzo D, Serafini O, Plastina F. Long-termcaptopril results in patients with chronic regurgitation:echocardiographic evaluation. (abstr) Eur Heart J 1992; 13(Suppl): 410.
81. Bisignani G, Serafini O, Caporale R, Guzzo D, Plastina F.Terapia a lungo termine con captopril in pazienti asin-tomatici con insufficienza aortica cronica di grado severo. GItal Cardiol 1997; 27: 925-30.
82. Globits S, Blake L, Bourne M, et al. Assessment of hemo-dynamic effects of angiotensin-converting enzyme inhibitortherapy in chronic aortic regurgitation by using velocity-en-coded cine magnetic resonance imaging. Am Heart J 1996;131: 289-93.
83. Lin M, Chiang HT, Lin SL, et al. Vasodilator therapy inchronic asymptomatic aortic regurgitation: enalapril ver-sus hydralazine therapy. J Am Coll Cardiol 1994; 24:1046-53.
84. Schon HR, Schroter G, Barthel P, et al. Effects of 12-monthquinapril therapy in asymptomatic patients with chronicaortic regurgitation. J Heart Valve Dis 1994; 3: 500-9.
85. Scognamiglio R, Rahimtoola MB, Fasoli G, Nistri S, DallaVolta S. Nifedipine in asymptomatic patients with severeaortic regurgitation and normal left ventricular function. NEngl J Med 1994; 331: 689-94.
86. Bonow RO. Management of chronic aortic regurgitation. NEngl J Med 1994; 331: 736-7.
87. Dumesnil JG, Tran K, Dagenais GR. Beneficial long-termeffects of hydralazine in aortic regurgitation. Arch InternMed 1990; 150: 757-60.
88. Aoyagi S, Oryoji A, Nishi Y, Tanaka K, Kosuga K, Oishi K.Long-term results of valve replacement with the St JudeMedical valve. J Thorac Cardiovasc Surg 1994; 108: 1021-9.
89. Scott WC, Miller DC, Havenich A, et al. Determinants ofoperative mortality for patients undergoing aortic valve re-placement. Discriminant analysis of 1479 operations. JThorac Cardiovasc Surg 1985; 89: 400-13.
90. Katz AS, Devereux RB. Timing of surgery in chronic aorticregurgitation. Echocardiography 2000; 17: 303-11.
91. Carabello BA. Aortic regurgitation in women. Circulation1996; 94: 2355-7.
92. Green R, Miller DC. Continuing dilemmas concerning aor-tic valve replacement in patients with advanced left ventric-ular systolic dysfunction. J Heart Valve Dis 1997; 6: 562-79.
93. Hicks GL, Massey HT. Update on indications for surgery inaortic insufficiency. Curr Opin Cardiol 2002; 17: 172-6.
94. Cheitlin MD. Finding “just the right moment” for operativeintervention in the asymptomatic patient with moderate tosevere aortic regurgitation. Circulation 1998; 97: 518-20.
200
Ital Heart J Suppl Vol 4 Marzo 2003