PROGETTAZIONE E SVILUPPO DEI MEDICINALI · 2017. 10. 3. · nella saliva Farmaci o metaboliti nei...
Transcript of PROGETTAZIONE E SVILUPPO DEI MEDICINALI · 2017. 10. 3. · nella saliva Farmaci o metaboliti nei...

1
PROGETTAZIONE E SVILUPPO DEI MEDICINALI
Tecnologia Socioeconomia Legislazione Farmaceutica 1 con laboratorio - CdLM CTF – 12 cfu
1° semestre –
Docente:
Prof.ssa Anna Maria Maccioni

2
MEDICAMENTO RISOLUZIONE DELLA PATOLOGIA
Vie di somministrazione Dosaggio Forma Farmaceutica
via orale (os), via rettale, via inalatoria, via parenterale (im), via endovenosa (ev), via transdermica, ecc.
FARMACO

3
•FORMA FARMACEUTICA (responsabile della quantità di farmaco che viene ceduto e che raggiunge inalterato la circolazione sistemica) e di conseguenza dagli ECCIPIENTI utilizzati.
•PROPRIETA’ CHIMICO FISICHE DEL FARMACO (responsabili della velocità con cui la quota di farmaco arriva al sito d’azione)
•VIA DI SOMMINISTRAZIONE (che ha effetti sull'assorbimento e sull'eliminazione del farmaco).
Entità e velocità con cui il principio attivo, inserito in un medicinale, viene assorbito e diventa disponibile al sito
d’azione
L'ENTITÀ DELLA RISPOSTA TERAPEUTICA DIPENDE
Quantità di Farmaco che raggiunge il circolo ematico

4
LA VALUTAZIONE DELLA BIODISPONIBILITA’ HA QUINDI UN
RUOLO CHIAVE NELLA VALUTAZIONE DELLA
EFFICACIA, QUALITA’, SICUREZZA
DI UN PRODOTTO FARMACEUTICO

5
Un bambino data un'iniezione i.m. potrebbe chiedere:
"Come è che quella riesce ad arrivare da lì al mio mal di
gola"?
La risposta a questa domanda è la base della FARMACOCINETICA,
ossia, come i farmaci si muovono nell'organismo e quanto rapidamente questo movimento si verifica.
Il corpo umano è un sistema molto complesso ed un farmaco subisce
molti passaggi dal momento che viene Assorbito, Distribuito attraverso il
corpo, Metabolizzato ed Escreto (ADME).

6
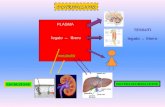
Assorbimento, Distribuzione, Metabolizzazione, Escrezione.
L’insieme dei processi che avvengono a carico del principio attivo una volta introdotto nell’organismo attraverso una delle possibili vie di somministrazione sistemica.
Vie di somministrazione sistemica =quando il principio attivo agisce in un organo diverso da
quello di somministrazione, attraverso un processo di assorbimento.
Tratto gastrointestinale
Bocca
Stomaco
Intestino tenue
Colon
Retto
Sis
tem
a V
asco
lare
f.f. orali
f.f. rettali
Buccale Sublinguale
Rettale
Sistema cardiocircolatorio (farmaci o metaboliti
Farmaci o metaboliti nella saliva
Farmaci o metaboliti nei tessuti o nei fluidi biologici(BIOFASE; Tessuto adiposo,ecc)
Endovena
Areosol
Vie respiratorie
Sistema vascolare Gas
Pelle
Sistema vascolare
Preparati transdermici
Sottocutanei
Intramuscolo
Reni
Farmaci o metaboliti nelle urine
Farmaci o metaboliti nelle feci
Escrezione
Eliminazione = metabolizzazione + escrezione
Fegato
Liberazione
Effetto di primo
passaggio

7
La Biofarmaceutica tiene quindi conto di tutti quei fattori legati alla FORMA FARMACEUTICA, ossia studia l’influenza dei materiali (farmaco, eccipienti, contenitori), del processo di fabbricazione e della forma farmaceutica stessa, responsabili della LIBERAZIONE del farmaco e sulle relazioni tra liberazione e assorbimento (Biodisponibilità) che possono influenzare a volte in modo drammatico l’attività biologica del farmaco,
ottimizzare l’attività farmacologica e terapeutico-clinica delle
forme farmaceutiche contenenti uno specifico farmaco
Scopo della Biofarmaceutica
FASE FARMACOCINETICA
BIOFASE p.a.
FASE
FARMACODINAMICA
FASE FARMACEUTICA

8
Queste tre fasi servono a valutare la biodisponibilità di un farmaco all’interno di una forma
farmaceutica che rende conto sia dell’aspetto quantitativo, ossia della concentrazione ematica del principio attivo che si riscontra in seguito alla somministrazione di una dose unitaria, sia dell’aspetto cinetico, ossia della velocità impiegata a raggiungere tale concentrazione.

9
Aspetto farmacocinetico
la velocità impiegata a raggiungere la concentrazione ematica ottimale in seguito alla somministrazione di una dose unitaria..
Possiamo immaginare la somministrazione orale come l'acqua che scorre da un secchio (che rappresenta il tratto GI) in un secondo secchio (che rappresenta «l’organismo»). In un primo momento il flusso e il livello dei farmaci nel bicchiere «organismo» salgono, con l'aumento della concentrazione dei farmaci; poi, dopo un picco, i livelli iniziano a diminuire e l'eliminazione sorpassa l’assorbimento.

10
Ka = costante velocità di assorbimento che esprime una misura della frazione di farmaco assorbita nell’unità di tempo, ed esprime la natura dinamica della velocità con cui avviene un passaggio di membrana.
Ke = costante velocità di eliminazione che esprime una misura della frazione di farmaco eliminata nell’unità di tempo ed è caratteristica per ogni specie chimica.
Zona A predomina l’assorbimento (Ka Ke)
Zona B rappresenta la fase di equilibrio (Ka = Ke).
Zona C fine della fase di assorbimento con rapida caduta dei livelli ematici che conduce all’azzeramento del valore di concentrazione (Ka < Ke).
In base all’ADME si hanno continue variazioni della concentrazione del p.a. per
ogni somministrazione
COSTANTI FARMACOCINETICHE
ZONE TEMPORALI

11
Aspetto quantitativo
Concentrazione ematica del principio attivo in seguito alla somministrazione di una dose unitaria per via extra vasale, ossia in seguito ad un processo di assorbimento.
T max = Tempo per raggiungere la massima concentrazione del p.a. Cmax = concentrazione massima raggiunta dal farmaco Tc = tempo necessario perché il farmaco raggiunga la MEC Intensità dell’effetto farmacologico (Tmax –Tc’) Durata dell’effetto farmacologico(Tc –Tc’) Tc’ = Tempo in cui la concentrazione del farmaco non è più efficace
Massima concentrazione tossica
Minima concentrazione efficace
MTC
Int
ens
ità
MEC Durata
Cmax
Tmax Tempo
Con
cent
razione
plasm
atica
Tc Tc’

12
Area Under Curve (Area sottesa dalla curva) che permette di misurare la quantità totale di un farmaco che raggiunge la circolazione sistemica e il tempo di permanenza, a prescindere dalla concentrazione efficace.
eld KV
DF
Cl
DFAUC
00
Somministrazione intra vasale (ev)
Somministrazione extra vasale (os)
Aspetto quantitativo

13
eld KV
DF
Cl
DFAUC
00
F = quantità di Farmaco assorbito
D0 = Dose di farmaco somministrato
Cl = Clearance
Clearance = Vd x Kel
Vd = Volume di distribuzione
Kel = Costante di eliminazione

14
è un parametro caratteristico per ogni sostanza, ossia è la grandezza che indica il volume del compartimento di riferimento che viene purificato dalla presenza di sostanza attiva nell’unità di tempo (clearance plasmatica, tissutale, epatica, renale,ecc.).
Ad esempio per definizione, la clearance renale è il volume di plasma che viene completamente depurato dal rene nell'unità di tempo. Il suo valore è dato dal rapporto fra il tasso di escrezione urinaria di una sostanza e la sua concentrazione plasmatica:
dove: C = clearance x = sostanza generica P = concentrazione plasmatica della sostanza U = concentrazione della sostanza nell'urina V = flusso di urina
Come si può osservare dai valori della tabella, minore è il valore ottenuto, maggiore è il riassorbimento della sostanza, quindi il suo rilievo per l'organismo: il glucosio, ad esempio, viene completamente riassorbito poiché fonte di energia. Al contrario, una sostanza di scarto come la Creatinina viene quasi totalmente eliminata.
Ipotizzando che il valore della Creatinina indichi un riassorbimento tubulare nullo, si può asserire che una sostanza avente la stessa clearance viene solo filtrata mentre, se il suo valore è minore, viene anche riassorbita dal tubulo del nefrone.
Vd•Kel

15
tCd
VtA
Posto At = quantità totale del farmaco nell’organismo al tempo t , essa può essere espressa in funzione di: Ct = la concentrazione plasmatica nel Vd
Vd =volume di distribuzione
La velocità di eliminazione Vel , è proporzionale alla quantità At secondo l’espressione:
tA
elK
dt
dAe
elV
dAe =variazione della quantità eliminata al variare del tempo dt Kel = costante di eliminazione; Vd .Kel = Clearance = Cl
(1)
(2)
dtCtClDFAe
00
AUCClDF 0
(3)
si ha da cui eld KV
DF
Cl
DFAUC
00
Ma la quantità eliminata al tempo infinito è direttamente correlata alla dose somministrata D0 e alla quantità di farmaco assorbita F per cui si può anche scrivere l’equivalenza:
eA
(4) (mg/ml . h)
Definizione matematica
AUCdtCt
0Poichè
Al tempo infinito ossia la quantità di farmaco eliminata, dall’espressione (2) si può scrivere: eA
dtCtClAe
0
tCCl
tC
dV
elK
dt
dAe
elV *

16
è fondamentalmente funzione della dose somministrata D0 con una particolare forma farmaceutica e della quantità di farmaco assorbita F e quindi da tutto ciò che condiziona il fenomeno di assorbimento.
Somministrazione endovenosa F = D0 = 1 Non esiste la fase di assorbimento
Altra via di somministrazione 0 ≤ F ≥ 1 Esiste la fase di assorbimento
F = 0 mancato assorbimento F = 1 totale assorbimento
Il valore di F è un indice della Biodisponibilità della forma farmaceutica presa in esame
eld KV
DF
Cl
DFAUC
00 (mg/ml . h)
Poiché il tempo di permanenza dipende dalle costanti di eliminazione e dalla Clearance caratteristiche per ogni farmaco,

17
Esempio di calcolo dell’AUC
Studi in dose multipla
Steady state Condizione in cui la quantità di farmaco eliminata nell’intervallo tra due successive somministrazioni (T2 – T1) eguaglia la dose. La concentrazione plasmatica fluttua tra il valore massimo Cmax e Cmin che rimangono costanti nel tempo

18
Il rapporto tra la dose di un farmaco che risulta letale nel 50% dei soggetti trattati e la dose dello stesso farmaco che risulta efficace nel 50% dei soggetti trattati.
INDICE TERAPEUTICO = DL 50/DE 50
DL = dose letale DE = dose efficace
L'indice terapeutico fornisce una misura della sicurezza di un farmaco, in quanto un valore elevato indica che la massima dose tollerabile (DL50) offre un buon margine di sicurezza rispetto alla dose necessaria per indurre una risposta positiva.

19
Confronto tra l’AUC prodotta dalla somministrazione di dosi equivalenti di farmaco allo stesso soggetto in tempi diversi, per via e.v. e per un'altra via di somministrazione. Se vengono impiegate dosi diverse, tale valore andrà introdotto come fattore di correzione.
fx dose
ev dose
AUC ev
AUC fx= assoluta bilitàBiodisponi
fx = forma farmaceutica in studio

20
Confronto tra l’AUC prodotta dalla forma farmaceutica in studio e l’AUC che si ottiene dalla somministrazione di una forma farmaceutica allo stesso dosaggio e alla stessa via di somministrazione utilizzata come standard o riferimento. Per dosi differenti si deve anche qui considerare la dose come fattore di correzione
fx dose
stdose
AUC st
AUC fx= relativa bilitàBiodisponi
fx = forma farmaceutica in studio
st = forma farmaceutica di riferimento
A = profilo ematico della forma farmaceutica di riferimento
B e C = profilo ematico delle forme farmaceutiche in studio (B formulazione inefficace)

21
Forme farmaceutiche equivalenti: sono forme farmaceutiche che contengono la stessa quantità del medesimo p.a. ( stesso sale o estere o formula chimica) somministrato per la stessa via , ma contengono eccipienti diversi. Devono essere identiche in titolo, qualità e purezza e presentare la stessa velocità di disaggregazione e di dissoluzione (quindi equivalenza da un punto di vista tecnologico).
Forme farmaceutiche alternative: sono forme farmaceutiche che contengono lo stesso p.a. o un suo precursore in forma di sale o estere, anche se non necessariamente presenti nella stessa quantità e nella stessa forma farmaceutica, i quali mostrano lo stesso effetto terapeutico.
Forme farmaceutiche bioequivalenti (estensione della Biodisponibilità relativa): sono forme farmaceutiche equivalenti o alternative che non differiscono in maniera significativa in velocità e grado di assorbimento,(parametri Biofarmaceutici simili: Cmax,Tmax,AUC,) quando sono somministrate alla stessa dose molare in condizioni sperimentali simili.

22
Si parla di bioequivalenza quando due forme farmaceutiche presentano, per quel principio attivo e per somministrazione della stessa dose, lo stesso o similare profilo ematico/tempo ossia AUC, Cmax e Tmax che non differiscano tra loro non più del 25% e non meno del 20%. Quando la formulazione standard è stata testata clinicamente, la bioequivalenza con questa formulazione indica anche un identica risposta terapeutica per le formulazioni messe a confronto.