POLITECNICO DI MILANO - politesi.polimi.it€¦ · all’attività della componente simpatica,...
Transcript of POLITECNICO DI MILANO - politesi.polimi.it€¦ · all’attività della componente simpatica,...
-
POLITECNICO DI MILANO
FACOLTÀ DI INGEGNERIA DEI SISTEMI
Corso di Laurea in Ingegneria Biomedica
Analisi dell'accoppiamento cardio-respiratorio:
valutazione del segnale SpO2 e dei parametri autonomici
in soggetti asmatici durante il sonno.
Relatore:
Prof. Anna Maria BIANCHI
Correlatori:
Ing. Federico ALETTI
Ing. Ramona CABIDDU
Dott.ssa Luciana Maria MALOSÁ SAMPAIO Tesi di Laurea di:
MATTEO BACI
Matricola 765462
Anno Accademico 2011-2012
-
2
Indice
Sommario ...................................................................................................... 4
Abstract ......................................................................................................... 9
Introduzione ................................................................................................ 15
Cenni sull’asma ......................................................................................... 15
Il Sistema Nervoso Autonomo ................................................................... 16
Studio della variabilità cardiaca ................................................................. 20
Attività respiratoria e ossigenazione del sangue ....................................... 23
La Polisonnografia ..................................................................................... 26
Studio del segnale HRV durante il sonno ................................................... 29
Scopo del lavoro ........................................................................................ 30
Materiali e Metodi ....................................................................................... 32
Soggetti ..................................................................................................... 32
Acquisizione polisonnografica ................................................................... 32
Processing dei segnali................................................................................ 33
Protocollo di analisi ................................................................................... 34
Software per l’analisi dei dati .................................................................... 43
Risultati ........................................................................................................ 48
Analisi monovariata del segnale HRV: potenza della banda LF .................. 48
Analisi monovariata del segnale HRV: frequenza centrale
del picco in banda LF.. ............................................................................... 51
Analisi monovariata del segnale HRV: potenza della banda HF ................ 52
Analisi monovariata del segnale HRV: frequenza centrale
del picco in banda HF ............................................................................... 54
Bilancia simpato-vagale (LF/HF) ................................................................ 55
Analisi monovariata del respirogramma ................................................... 56
-
3
Analisi bivariata dei segnali di variabilità cardiaca e respirogramma ......... 61
Analisi del segnale di saturazione dell’Ossigeno (SpO2) ............................. 65
Analisi di gruppi: confronto dei parametri tra soggetti che riportano
l’armonica a bassa frequenza nello spettro del segnale di respiro
e coloro che non la contengono ............................................................... 67
Analisi della correlazione tra parametri di interesse.................................. 70
Discussione e Conclusioni ............................................................................ 75
Bibliografia .................................................................................................. 83
-
4
1. Sommario
INTRODUZIONE
L’asma è una delle patologie croniche respiratorie più diffuse nel mondo [1,2], che affligge
pazienti di tutte le età, con particolare incidenza tra i bambini. Nei soggetti asmatici
compaiono fenomeni di eccessiva bronco-costrizione in risposta a determinati stimoli
indiretti (come allergeni e aria fredda) o diretti (ad esempio sostanze impiegate durante i
test specifici di provocazione bronchiale, come la metacolina) accompagnati da uno stato
cronico infiammatorio che genera un aumento della responsività bronchiale che, a sua
volta, causa crisi respiratorie (i cosiddetti ‘attacchi d’asma’), respiro sibilante, tosse [4]. In
clinica, sulla base della severità dei sintomi, si distingue tra asma ben controllato, non ben
controllato e di difficile controllo [5]. Nonostante le cause dell’asma appaiono tutt’ora
poco chiare (tendono ad essere collegate ad allergie, fattori ereditari, condizioni ambientali
ed altro), si ipotizza che l’eccessiva reazione di bronco-ostruzione sia associata ad una
anomala azione di controllo da parte del Sistema Nervoso Autonomo (SNA), in particolare
della componente vagale [8]. Studi presenti in letteratura hanno messo in evidenza che
l’alterato controllo autonomo del calibro delle vie aeree può parallelamente riflettersi in un
cambiamento nella regolazione della frequenza cardiaca [3]. Per studiare la modulazione
autonomica dell’attività cardiaca, la cui componente a bassa frequenza è associata
all’attività della componente simpatica, mentre quella ad alta frequenza alla parasimpatica
[10], viene spesso svolta l’analisi spettrale del segnale di variabilità cardiaca. Questo tipo
di indagine rappresenta un metodo robusto e non invasivo per valutare il funzionamento
del SNA: diversi studi ne fanno uso durante la valutazione delle patologie in cui è
coinvolta un’alterazione del funzionamento del SNA (come ad esempio il diabete) [14].
Dal momento che in diversi studi presenti in letteratura è stato osservato che molti disturbi
del sonno, inclusi l’insonnia e le apnee notturne, risultano associati a disturbi
cardiopolmonari, in questo elaborato viene condotto uno studio su soggetti affetti da asma
di difficile controllo durante la notte, così da minimizzare, oltretutto, l’effetto di fonti di
disturbo di natura esterna. Attraverso l’analisi spettrale monovariata e bivariata dei segnali
di variabilità cardiaca e respiratorio, e mediante l’osservazione del livello di ossigenazione
-
5
del sangue e dei principali indici polisonnografici tra cui l’Apnea-Hypopnea Index (AHI),
definita come numero di apnee o ipopnee che si manifestano nell’unità di tempo, e il
numero di risvegli, vengono estratti i valori medi di particolari parametri di interesse
(potenza spettrale del segnale HRV in bassa ed alta frequenza, bilancia simpato-vagale,
coerenza respiro-variabilità cardiaca e altri) e ne viene valutato l’andamento durante le
diverse fasi del sonno. Essi vengono inoltre paragonati ai corrispettivi valori dei soggetti
sani, ricavati in altri studi presenti in letteratura. Con l’aiuto degli indici di saturazione
dell’ossigeno e polisonnografici, si tenta in secondo luogo di ricavare delle correlazioni tra
parametri che possano descrivere ricorrenze nella sintomatologia dei soggetti analizzati.
Infine viene svolto un confronto dei valori dei parametri di interesse tra il gruppo dei
soggetti che presentano con ricorrenza un’armonica a bassa frequenza nello spettro del
respirogramma e quelli in cui tale fenomeno non compare, dal momento che questo fattore
rappresenta un comportamento anomalo rispetto al caso fisiologico.
MATERIALI E METODI
Hanno preso parte a questo studio, la cui fase di acquisizione è stata condotta presso il
laboratorio del sonno dell’Università Nove de Julho di San Paolo (Brasile), 19 pazienti tra
cui 6 maschi e 13 femmine, di età compresa tra i 12 e i 67 anni (età media di 46.3 anni,
deviazione standard di 15.8 anni): tutti i soggetti analizzati sono affetti da asma di difficile
controllo. Due dei soggetti sono stati esclusi dall’analisi. Nei 17 soggetti studiati sono state
estratte, contemporaneamente, numerose finestre dei segnali di variabilità cardiaca e
respiratorio dalle varie fasi del sonno, ovvero veglia, stadio S2, S4 e REM (sono state
escluse le fasi S1 e S3 perché presenti in maniera molto limitata). Il riconoscimento delle
diverse fasi è stato possibile grazie alla consultazione dell’ipnogramma presente nelle
schede riassuntive dei pazienti. Su ogni paziente, è stato ricavato il valore mediato dei
parametri di interesse all’interno della fase del sonno di appartenenza, utilizzando spezzoni
di segnale, relativi all’intera nottata di acquisizione (anche a diversi tratti della stessa fase
del sonno), dopo aver controllato che fosse rispettata la condizione di stazionarietà e aver
eliminato eventuali outliers. Per l’analisi dei dati è stata utilizzata un’interfaccia grafica
sviluppata in ambiente Matlab®. Sulle finestre temporali selezionate manualmente
dall’utente, si utilizza la metodologia parametrica per l’analisi monovariata finalizzata
all’ottenimento degli spettri di potenza del segnale di variabilità cardiaca e respiratorio e a
-
6
condurre l’analisi bivariata. Per la stima dei coefficienti del modello è stato usato il metodo
dei minimi quadrati basato sulle equazioni di Yule-Walker, mentre per selezionare l’ordine
del modello ci si è avvalsi della cifra di merito di Akaike. Relativamente all’analisi
bivariata, sono state valutate la coerenza quadratica tra i segnali di respiro e variabilità
cardiaca e la percentuale di potenza dello spettro del segnale HRV coerente con lo spettro
del respirogramma. Per l’analisi del segnale SpO2 si è fatto uso di un codice implementato
in ambiente Matlab® realizzato in questa sede. È stata infine condotta l’analisi statistica:
dapprima sono stati effettuati, sui dati da analizzare, dei test di gaussianità e di omogeneità
delle varianze per decidere, di volta in volta, il test più adatto da applicare. Dal momento
che le distribuzioni sono sempre risultate a varianza omogenea, si è deciso di applicare il
test parametrico ANOVA nei casi in cui venisse verificata l’ipotesi di distribuzione
gaussiana degli elementi costituenti i campioni, e il test non-parametrico di Kruskal-Wallis
laddove tale condizione non venisse rilevata. Per l’analisi a gruppi è stata implementata
una statistica “unpaired” utilizzando i test ANOVA e Kruskal-Wallis.
RISULTATI
Relativamente allo spettro del segnale HRV, emerge che le due componenti si sviluppano
attorno a questi range di frequenze: per la banda LF, (0.0882 ± 0.0224) Hz in fase di
veglia, (0.0849 ± 0.0174) Hz in fase S2, (0.0952 ± 0.0346) Hz in fase S4 e (0.0929 ±
0.0246) Hz in REM; per la banda HF, (0.2768 ± 0.0288) Hz in fase di veglia, (0.2681±
0.0347) Hz in S2, (0.2655 ± 0.0301) Hz in S4, (0.2681 ± 0.0427) Hz in REM. È evidente
dai dati ricavati in unità normalizzate, che la potenza della componente HF assume valori
ben superiori rispetto a quella in LF, soprattutto in quelle fasi (S2 e REM) dove
fisiologicamente si registra una considerevole attivazione simpatica (per la componente
HF: 0.58 ± 0.22 in fase di veglia, 0.61 ± 0.22 in fase S2, 0.65 ± 0.21 in fase S4 e 0.69 ±
0.22 in REM; per la componente LF: 0.42 ± 0.22 in veglia, 0.39 ± 0.22 in S2, 0.35 ± 0.21
in S4 e 0.31 ± 0.22 in REM). I valori di bilancia simpato-vagale, pur presentando elevata
variabilità, confermano questa situazione: 1.3545 ± 1.3318 in veglia, 1.3291 ± 3.2658 in
S2, 0.9678 ± 1.0664 in S4, 0.7562 ± 0.9227 in REM. Nei pazienti analizzati la fase del
sonno non appare essere un fattore determinante, dal momento che le analisi statistiche
effettuate confrontando i dati relativi alle diverse fasi non forniscono alcun risultato
significativo (p_value sempre superiori a 0.05). Nel respirogramma si è fatto riferimento
-
7
alla sola componente di HF, più rilevante di quella LF: lo spettro si attesta attorno a valori
di frequenza di (0.2704 ± 0.0363) Hz in veglia, (0.2733 ± 0.0326) Hz in fase S2, (0.2637 ±
0.0391) Hz in fase S4 e (0.2661 ± 0.0374) Hz in REM, ed è caratterizzato da valori di
potenza percentuale (espressa in termini decimali) di 0.6925 ± 0.1989 in veglia, 0.7950 ±
0.1377 in S2, 0.8003 ± 0.1552 in S4 e 0.8084 ± 0.1381 in REM. Anche in questo caso,
l’analisi statistica non rileva differenze significative tra le fasi (valori di p_value > 0.05).
Passando all’analisi bivariata, i valori di potenza del segnale HRV coerente con quello di
respiro calcolati sono i seguenti: (17.60 ± 9.67)% in veglia, (19.87 ± 7.70)% in S2, (17.43
± 10.33)% in S4 e (20.36 ± 13.08)% in REM. La situazione si mantiene piuttosto stabile tra
fase e fase, come testimoniato dal test statistico applicato (p_value > 0.05). Per ultimo, è
stato valutato il livello di ossigenazione del sangue, ottenendo questi valori: (93.7 ± 2.5)%
nella fase di veglia, (93.6 ± 1.9)% per la S2, (93.5 ± 2.2)% per la S4 e (93.8 ± 1.6)% in
REM. L’analisi statistica effettuata non identifica alcuna differenza significativa (p_value
> 0.05). È stato implementato il confronto dei valori dei parametri di interesse tra il gruppo
dei soggetti che presentano con ricorrenza l’armonica a bassa frequenza nello spettro del
respirogramma e quelli in cui tale fenomeno non compare, il quale mette in mostra dei
valori significativamente superiori (p_value
-
8
simpato-vagale tende a sbilanciarsi, durante il sonno, a favore di un incremento dell’attività
parasimpatica: tuttavia nei soggetti con asma di difficile controllo si assiste, soprattutto in
quelle fasi in cui normalmente i livelli di attivazione simpatica sono relativamente elevati,
ad una forte attivazione parasimpatica. A differenza dei sani, in cui si nota un suo
progressivo decremento con l’avanzare del sonno e ad un nuovo aumento in fase REM
(dove si raggiungono valori tipici della veglia), queste differenze sono piuttosto contenute
nei soggetti patologici qui analizzati, e in fase REM si raggiunge addirittura il livello più
alto di attivazione parasimpatica. Il segnale di respiro presenta il picco in HF attorno a
valori di frequenza comuni ai soggetti sani, tuttavia rispetto ad essi la potenza di questa
componente armonica risulta diminuita, e gli spettri meno concentrati attorno alla
frequenza centrale del picco, dimostrando che il respiro non diviene particolarmente
regolare nemmeno nelle fasi di sonno profondo, o quantomeno che la differenza con le
altre fasi non è netta. La mancanza di differenze significative sia nel caso dell’HRV sia nel
caso del respiro è confermata anche da studi presenti in letteratura. L’accoppiamento
cardio-polmonare, misurato attraverso i valori di coerenza e potenza coerente, presenta
valori medi decisamente inferiori rispetto al caso dei sani, e pure in questo caso senza
differenze di rilievo tra fase e fase. Anche questa considerazione trova conferme in
letteratura. La valutazione del segnale di SpO2 mette in mostra che il livello di
ossigenazione del sangue si attesta su valori inferiori rispetto al caso fisiologico,
nonostante non si possa parlare di stati di ipossiemia (i valori si attestano attorno al 93%).
Anche in questo caso i risultati non sono condizionati dalla fase del sonno. In secondo
luogo, l’analisi comparativa tra il gruppo di pazienti in cui compare la componente
armonica alle basse frequenze nello spettro del segnale di respiro e il gruppo in cui essa è
assente, mostra un miglior quadro clinico nei componenti del secondo raggruppamento,
soprattutto per quanto concerne i parametri di attivazione simpatica in banda LF, potenza
respiratoria, accoppiamento cardio-polmonare e livello di ossigenazione del sangue,
quest’ultimo in particolare durante il sonno. Infine, facendo uso anche dei parametri
polisonnografici, si è tentato di stabilire delle correlazioni tra indici per ottenere un quadro
delle possibili interazioni tra fattori. È stata verificata una certa coerenza di tipo negativo
tra SpO2 e AHI soprattutto in fase S2, una discreta coerenza di tipo negativo tra potenza
del respiro in banda HF e AHI, e una più notevole coerenza di tipo positivo, durante tutte
le fasi del sonno, tra SpO2 e potenza respiratoria.
-
9
2. Abstract
INTRODUCTION
Asthma is one of the most common chronic diseases of the airways in the world affecting
patients of all ages, with particular incidence among children. Asthmatic subjects are
characterized by the appearance of instances of excessive broncho-constriction in response
to indirect stimuli (such as allergens and cold air) or direct ones (i.e. substances used
during specific bronchial provocation tests, such as methacholine), accompanied by a
chronic inflammation that generates an increase of bronchial responsiveness, which causes
respiratory crises (the so-called 'asthma attacks'), wheezing and cough. On the basis of the
severity of the symptoms, asthma can be classified aswell controlled, not well controlled
and difficult to control. Although the causes of asthma are still unclear (they tend to be
linked to allergies, hereditary factors and environmental conditions) the broncho-
constriction is assumed to be associated with an abnormal control action by the
autonomous nervous system, specifically by the vagal component. Previous studies have
shown that an altered autonomic control of the airway caliber can be reflected in a change
in the regulation of the heart rate. A spectral analysis is hereby carried out of the heart rate
variability signal, whose low-frequency component is associated with the sympathetic
activity, while the high frequency is associated to the parasympathetic activity. This is a
robust and non-invasive method to assess how the autonomic nervous system works:
several studies use this method in the investigation of pathologies in which an alteration in
the functioning of the autonomic nervous system (such as diabetes) is involved. Since it
has been observed in several studies that many sleep disorders such as insomnia and sleep
apnea are associated with cardiovascular disorders, a study of patients with difficult to
control asthma during sleep is carried out in the present sudy. Through monovariate and
bivariate spectral analysis of the heart rate variability and the respiratory signals and by
analyzing the blood oxygenation and of the main polysomnographic indices (apnea-
hypopnea index, AHI, defined as the number of apneas or hypopneas occurring per unit of
time, and number of awakenings) the mean values of a group of parameters of interest are
extracted (including power spectral density of the Heart Rate Variability,HRV signal, in
-
10
the low and high frequency ranges, sympatho-vagal balance, coherence between breathing
and HRV) and the performances during the different sleep stages are evaluated. These
results are also compared to the corresponding ones obtaines in other studies from healthy
subjects. Correlations among the polysomnographic and oxygen saturation indexes were
also extracted. Finally, a comparison of the relevant parameters between the group of
subjects presenting a low frequency harmonic in the respirogram spectrum and the group
of subjects for whom this phenomenon was not observed is carried out, as the presence of a
low frequency harmonic in the respirogram spectrum represents an anomalous behavior
with respect to the physiological case.
MATERIALS AND METHODS
19 patients, 6 males and 13 females, aged between 12 and 67 years (mean age 46.3 years,
SD 15.8 years) participated in this study: all subjects were affected by difficult to control
asthma. Two of the subjects were excluded from the analysis, since REM sleep phases
were not present in one subject, and since the clinical state was too severe in the other
subject. Among the 17 analyzed subjects, many windows of heart rate variability and
respiratory signals from the various phases of interest, which are wakefulness, stage S2,
stage S4, and REM (stages S1 and S3 were excluded because they were too short in time)
were extracted. The recognition of the different sleep phases has been possible thanks to
the consultation of the hypnogram derived for each patient by a medical doctor. For each
subject, the mean value of the parameters of interest within the phase to which they belong
was obtained, using sections belonging to the entire night recording ; the stationarity of the
signal portions and the absence of outliers were always verified. For the data analysis, a
graphical interface developed in Matlab® environment was used. On the time windows
manually selected by the user, the software implements the spectral analysis parametric
method in order to obtain the spectra of the heart rate variability and the respiratory signals
and to carry out a bivariate analysis. Regarding the monovariate analysis, an Auto
Regressive model of the signal is calculated in order to obtain the spectra. To estimate the
coefficients of the model, the least squares method based on the Yule-Walker equations
was used, and to select the order of the model the Akaike Information Criterion was used.
As for the bivariate analysis, the square coherence between the respiration and the heart
-
11
rate variability was calculated. Finally, a statistical analysis was carried out: gaussianity
and homogeneity of variances were tested in order to decide what test was more suitable to
be applied. Since the distributions always presented an homogeneous variance, the
parametric test ANOVA was applied when the hypothesis of almost-Gaussian distribution
of the samples was verified, while the non-parametric Kruskal-Wallis test was used
otherwise. For the group analysis "unpaired" ANOVA or Kruskal-Wallis tests were used.
RESULTS
With regards to the HRV signal spectrum, the LF component is centered around these
frequency ranges:(0.0882 ± 0.0224) Hz during wakefulness, (0.0849 ± 0.0174) Hz in the
S2 phase, (0.0952 ± 0.0346) Hz in the S4 phase and (0.0929 ± 0.0246) Hz in the REM
phase; the HF component is centered around these frequency ranges: (0.2768 ± 0.0288) Hz
during wakefulness, (0.2681± 0.0347) Hz in the S2 phase, (0.2655 ± 0.0301) Hz in the S4
phase, (0.2681 ± 0.0427) Hz in REM. By analyzing the normalized units data the power of
the HF component showed much higher values (0.58 ± 0.22 during wakefulness, 0.61 ±
0.22 in the S2 phase, 0.65 ± 0.21 in the S4 phase and 0.69 ± 0.22 in REM) than the LF
power (0.42 ± 0.22 during wakefulness, 0.39 ± 0.22 in the S2 phase, 0.35 ± 0.21 in the S4
phase and 0.31 ± 0.22 in REM). Although a great variability of results was observed, the
values of the sympatho-vagal balance are in accordance with this situation: 1.3545 ±
1.3318 during wakefulness, 1.3291 ± 3.2658 in the S2 phase, 0.9678 ± 1.0664 in the S4
phase and 0.7562 ± 0.9227 in the REM phase. In the analyzed patients, the sleep stage does
not seem to be a determining factor, since the statistical analysis does not provide any
significant results (p_value > 0.05). In the respirogram, only the HF component was
considered: the spectrum is centered around the frequency values of (0.2704 ± 0.0363) Hz
during wakefulness, (0.2733 ± 0.0326) Hz in the S2 phase, (0.2637 ± 0.0391) Hz in the S4
phase and (0.2661 ±0.0374) Hz in REM, and it is characterized by power values of 0.6925
± 0.1989 during wakefulness, 0.7950 ± 0.1377 in S2, 0.8003 ± 0.1552 in S4 e 0.8084 ±
0.1381 in REM. Even in this case, the statistical analysis does not detect significant
differences among the phases (p_value > 0.05). The coherent power values calculated
within the bivariate analysis are as follows: (17.60 ± 9.67)% during wakefulness, (19.87 ±
7.70)% in the S2 phase, (17.43 ± 10.33)% in the S4 phase and (20.36 ± 13.09)% in REM.
The situation is fairly stable between phases, as evidenced by the statistical tests applied
-
12
(p_value > 0.05). The level of blood oxygenation was also analyzed and the resulting
values are as follows: (93.7 ± 2.5)% during wakefulness, (93.6 ± 1.9)% in the S2 phase,
(93.5 ± 2.2)% in the S4 phase and (93.8 ± 1.6)% in REM. The statistical analysis carried
out does not identify any significant difference (p_value > 0.05). After this, the group
analysis was implemented: subjects with a recurrent low-frequency harmonic in the
respirogram spectrum show significantly lower values (p_value
-
13
Secondly, the comparative analysis between the group of patients in which the harmonic
component at low frequencies in the spectrum of the signal of breathing appears and the
group in which it is absent, shows a better clinical condition in the components of the
second grouping, especially regarding the parameters of sympathetic activation in the LF
band, the respiratory power, the cardio-pulmonary coupling and the level of blood
oxygenation, especially during sleep.
Finally, using the polysomnographic parameters, we tried to establish correlations between
different indices to get an overview of the possible interactions between factors. A negative
correlation between SpO2 and AHI was observed during sleep stage S2 and between the
respiration power and the AHI remarkable positive consistency during all sleep stages was
observed between SpO2 and respiratory power.
-
14
A tutti coloro che, quest’oggi,
saranno felici per me
-
15
3. Introduzione
3.1. Cenni sull’Asma
L’asma è una patologia complessa che si manifesta attraverso una infiammazione cronica
delle vie aeree: è una delle patologie respiratorie più diffuse nel mondo, presente in tutti i
paesi anche se con livelli molto variabili [1]. Secondo l’Organizzazione Mondiale della
Sanità, ci sono tra i 100 e i 150 milioni di persone che soffrono di questa condizione in
tutto il mondo [2]. Le morti associate alla malattia, sempre secondo i dati dell’Oms, sono
circa 180 mila ogni anno. In Italia colpisce in media circa il 5% della popolazione e quasi il
10% dei bambini [1]. I soggetti affetti da asma presentano fenomeni di eccesiva bronco-
costrizione (figura 1) in risposta a determinati stimoli indiretti (polvere o allergeni, aria
fredda, pratica di attività fisica) o diretti (ad esempio, inalazione di sostanze impiegate
durante i test di provocazione bronchiale specifici, come la metacolina) coesistenti ad uno
stato cronico infiammatorio che genera un aumento della responsività bronchiale; questo, a
sua volta, causa episodi ricorrenti di crisi respiratorie (i cosiddetti ‘attacchi d’asma’),
respiro sibilante, senso di costrizione toracica e tosse [3].
Figura 1: Morfologia delle vie aeree nei soggetti sani e asmatici [4]
-
16
In ambito clinico è possibile procedere ad una distinzione, in base alla severità dei sintomi,
tra “asma ben controllato, asma non ben controllato e asma di difficile controllo”. I
parametri che consentono di discriminare tra queste condizioni includono: frequenza dei
sintomi, frequenza dei risvegli notturni dovuti alla loro comparsa, frequenza di utilizzo dei
farmaci, percentuale di picco di flusso espiratorio rispetto alle migliori performance (PEF).
La tabella riassume quantitativamente le caratteristiche relative ai diversi raggruppamenti
[5].
Tabella 1: Caratteristiche dei tre raggruppamenti di soggetti asmatici [5].
Le cause dell’asma appaiono tutt’ora poco chiare. Alcuni studi tendono a collegare la
patologia ad allergie, fattori ereditari, condizioni ambientali e caratteristiche fisiche del
paziente, quali ad esempio il peso.
3.2. Il Sistema Nervoso Autonomo
Nonostante il meccanismo fisiopatologico sotteso allo sviluppo dell’affezione asmatica
risulti tuttora per lo più ignoto, è verosimile l’ipotesi che l’eccessiva reazione di ostruzione
a livello bronchiale sia associata ad una anomala azione di controllo da parte del Sistema
Nervoso Autonomo (SNA) [3]. Il SNA comprende l'insieme dei recettori, delle cellule e
delle fibre che innervano gli organi interni e le ghiandole, svolgendo funzioni che
generalmente sono al di fuori del controllo volontario intervenendo, ad esempio, nella
regolazione del calibro dei vasi sanguigni e delle vie aeree, nell’attività secretoria
Ben controllato Non ben controllato Difficile controllo
Sintomi ≤ 2 volte alla settimana ≥ 2 volte alla settimana quotidianamente
Risvegli notturni < 2 volte al mese 1-3 volte alla settimana > 4 volte alla settimana
Uso inalatori ≤ 2 volte alla settimana ≥ 2 volte alla settimana quotidianamente
Peak Expiratory
Flow (PEF) ≥ 80% PEF 60-80% PEF < 60% PEF
-
17
ghiandolare, nel coordinamento delle funzioni cardiache, muscolari, viscerali, urogenitali e
in molte altre funzioni vitali [6]. Il SNA di divide in 2 componenti fondamentali [7]:
Simpatica: coordina le cosiddette reazioni “fight/flight/fright”
(lotta/fuga/spavento), perciò la sua azione risulta principalmente eccitatoria. Un
aumento dell’attività del sistema simpatico provoca, ad esempio, l’aumento della
frequenza e della contrattilità cardiaca (e di conseguenza della pressione arteriosa),
della frequenza respiratoria e del calibro delle vie aeree, della dilatazione delle
pupille, della sudorazione, della dilatazione dei vasi muscolari, del metabolismo del
glucosio ed altre funzioni. Solo relativamente ad alcune funzioni corporee, l’attività
simpatica provoca un effetto inibitorio: ad esempio, è responsabile della
diminuzione della motilità del sistema digerente, della salivazione e della
circolazione cutanea (vasocostrizione dei vasi cutanei con il conseguente fenomeno
del pallore).
Parasimpatica: la sua è un’azione opposta rispetto a quella del sistema simpatico.
Fatta eccezione per alcune situazioni infatti, come ad esempio la regolazione del
calibro dei vasi periferici, la quale risulta sotto l’esclusivo controllo della
componente simpatica, l’attività parasimpatica tende a bilanciare gli effetti dovuti a
quella simpatica, attraverso un’azione antagonista di contenimento. Si parla, ad
esempio, di bilancia simpato-vagale per quanto concerne la regolazione della
frequenza cardiaca da parte del SNA.
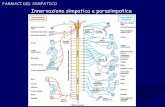
Vi sono altre differenze tra le due principali componenti del SNA [7], come mostrato in
figura 2. A livello anatomico, ad esempio, i corpi cellulari delle fibre nervose del sistema
simpatico sono contenuti a livello della sostanza grigia delle corna laterali del midollo
spinale (tratto della colonna vertebrale compreso tra le vertebre T1 e L2), mentre quelli del
parasimpatico risiedono nella sostanza grigia situata in corrispondenza del tronco
encefalico e delle corna laterali dei segmenti sacrali del midollo spinale (tratto S2-S4).
Conseguentemente, le vie efferenti del sistema simpatico sono costituite dai nervi spinali,
tra cui i nervi splancnici, mentre quelle del parasimpatico sono rappresentate dai nervi
cranici e dai nervi pelvici. Il più noto nervo parasimpatico è il “nervo vago”, da cui il
termine “vagale” per indicare l’attività dell’intero sistema parasimpatico. Altra differenza
anatomica riguarda la posizione dei gangli. Nel caso del sistema simpatico essi sono situati
in prossimità della colonna vertebrale (gangli della catena ganglionare simpatica e gangli
-
18
collaterali), di conseguenza gli assoni pre-ganglionari risultano brevi e lunghi i post-
ganglionari; viceversa, nelle fibre nervose parasimpatiche i gangli si trovano in prossimità
o addirittura all’interno degli organi innervati, perciò gli assoni pre-ganglionari appaiono
lunghi e brevi quelli post-ganglionari. Infine, nei due sistemi predomina l’azione di diversi
tipi di neurotrasmettitori: nel caso del sistema simpatico, i neurotrasmettitori
principalmente coinvolti sono la noradrenalina, l’adrenalina e la norepinefrina, mentre nel
sistema parasimpatico prevale l’azione dell’acetilcolina: quest’ultimo è un
neurotrasmettitore ad azione quasi istantanea per via della metabolizzazione rapida
dell’acetilcolina da parte dell’enzima colesterasi, e ciò garantisce brevissimi tempi di
intervento da parte del sistema parasimpatico nella sua azione di contenimento degli effetti
provocati dall’attività simpatica [7].
Figura 2: Componenti simpatica e parasimpatica a confronto [6].
-
19
I centri nervosi sopraspinali (figura 3) rappresentano le strutture di controllo del SNA. Di
seguito vengono riportati i principali siti [7]:
Midollo allungato e ponte: il midollo rostrale ventrolaterale, i nuclei del raphe, il
locus coeruleus e il nucleo del tratto solitario.
Ipotalamo: in particolare, nella zona posteriore e laterale vengono coordinate le
attività di natura eccitatoria, mentre nell’anteriore quelle di attività depressoria.
Sistema limbico: in particolare l’amigdala, che rappresenta un centro di controllo
eccitatorio.
Corteccia cerebrale: in particolare l’insula e la corteccia prefrontale, anche essi
centri di controllo eccitatori.
Figura 3: Centri nervosi sopraspinali di controllo del SNA. A sinistra i centri situati a
livello del cervello, a destra quelli situati a livello del midollo spinale [36] .
Relativamente al coinvolgimento del SNA nell’ambito della patologia asmatica, la
componente vagale appare implicata nella patogenesi dell’asma: diversi studi hanno ad
esempio suggerito l’esistenza di una sensibile alterazione delle funzioni del SNA
nell’esecuzione di esercizi da parte di soggetti patologici rispetto a quelli sani [8].
-
20
3.3. Variabilità cardiaca e Tacogramma
Un metodo efficace e non invasivo per valutare l’attività di regolazione da parte del SNA,
molto utilizzato nei vari studi pertinenti riportati in letteratura, è costituito dall’analisi
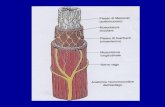
spettrale del segnale di variabilità cardiaca (HRV), detto tacogramma [9]. Il tracciato HRV
è semplicemente ottenuto ponendo in ascissa il numero di battiti e in ordinata il valore
temporale che intercorre tra il n-esimo e il (n-1)-esimo battito.
Figura 4: Elettrocardiogramma (ECG) ed estrazione dei complessi QRS [37]
Dopo essere stati digitalizzati, i dati provenienti da un’acquisizione ECG (figura 4)
vengono analizzati da un software che provvede a calcolare la distanza temporale esatta,
espressa in secondi, fra un battito cardiaco e l'altro (figura 4) ed in questo modo è possibile
ottenere il diagramma che esprime la distanza R-R fra un battito e l'altro, in funzione del
-
21
numero di battiti cardiaci (figura 5). Il tacogramma viene raccolto normalmente nell'arco di
4-5 minuti, anche se in base al tipo di indagine da compiere, a volte si considerano
segmenti più lunghi [9].
Figura 5: Esempio di tacogramma nel tempo [31].
Una volta ottenuto il tacogramma viene svolta un’analisi in frequenza del tracciato. Questo
approccio consente di applicare un robusto strumento di indagine e di ottenere risultati
affidabili evitando il ricorso a pratiche invasive. Diversi studi hanno individuato, nello
spettro del tacogramma, 3 componenti di frequenza principali all’interno del segnale HRV
[10] (figura 6):
Componente spettrale a frequenza molto bassa (Very Low Frequency, VLF):
ritmo derivante da meccanismi di regolazione a lungo termine come fattori umorali,
temperatura ed altre componenti lente. Il range di frequenze è compreso tra la
continua (0 Hz) e 0.04 Hz.
-
22
Componente spettrale a bassa frequenza (Low Frequency, LF): ritmo che
corrisponde in prevalenza all’azione del meccanismo baroriflesso sulla
modulazione del segnale HRV, considerato come indicatore dell’attivazione
simpatica. Il range di frequenze è compreso tra 0.04 e 0.15 Hz.
Componente spettrale ad alta frequenza (High Frequency, HF): ritmo
corrispondente all’azione respiratoria sulla modulazione del segnale HRV,
considerato come indicatore dell’attivazione vagale. Vengono considerate
appartenenti a questa banda le frequenze superiori a 0.15 Hz.
Figura 6: Componenti spettrali del segnale HRV [31].
Negli ultimi anni è stato manifestato un interesse crescente sul controllo cardiovascolare
durante il sonno: è stato stimato infatti che, ad esempio, in media circa l’8-10% degli
attacchi ischemici avvengono durante il sonno, con particolare prevalenza nelle prime ore
del mattino [13]. È stato inoltre osservato che molti disturbi del sonno, inclusi l’insonnia e
-
23
le apnee notturne, risultano associati a disturbi cardiovascolari e che il segnale HRV risulta
modificato durante le varie fasi del sonno.
3.4 Attività respiratoria e Ossigenazione del sangue
Il flusso d’aria e il volume polmonare vengono spesso registrati mediante la pletismografia
a induttanza variabile. Essa permette, mediante l’utilizzo di due fasce, una toracica ed una
addominale (figura 7), di identificare le escursioni respiratorie permettendo di derivare il
volume ed il flusso respiratori, al fine di individuare apnee ostruttive, ipopnee o apnee
centrali.
Figura 7: Pletismografo a induttanza variabile [12]
Il principio di funzionamento è basato sulla variazione del coefficiente di autoinduttanza
delle spire contenute all’interno delle fasce, alimentate da una sorgente di tensione
continua, al variare del volume toracico durante le diverse fasi della respirazione: il segnale
elettrico ottenuto in uscita, opportunamente elaborato, costituisce il respirogramma [12]
(figura 8).
-
24
Figura 8: Esempio di respirogramma.
La saturazione di ossigeno è un indice ematico che riflette la percentuale di emoglobina
satura di ossigeno rispetto alla quantità totale di emoglobina presente nel sangue [25]. In
condizioni normali, durante il passaggio nei polmoni, i globuli rossi ricchi di emoglobina si
caricano o saturano di ossigeno, che verrà poi trasportato e ceduto ai vari tessuti
dell'organismo. La percentuale di emoglobina satura di ossigeno in condizioni normali è
maggiore del 95%, con valori ottimali intorno al 97-98%; tuttavia, in presenza di alcune
malattie, principalmente polmonari, una percentuale inferiore di globuli rossi lega e
trasporta ossigeno all'organismo; di conseguenza la saturazione d'ossigeno scende al di
sotto del 95% e, raggiunti valori inferiori al 90%, si parla di ipossiemia, ovvero di una
ridotta quantità di ossigeno nel sangue. Un valore inferiore all'80% testimonia uno stato
ipossico grave. La curva di dissociazione dell’emoglobina (figura 9) è un andamento
grafico che mette in relazione il livello di saturazione percentuale (in ordinata), con la
pressione parziale di ossigeno del sangue e il contenuto di ossigeno legato all’emoglobina
(in ascissa), il tutto in relazione alla temperatura del sangue e al tasso di ematocrito,
quest’ultimo parametro definito come percentuale di parte corpuscolare (principalmente
eritrociti, leucociti e piastrine) presente nel sangue.
La saturazione dell’ossigeno viene invece registrata, in maniera non invasiva, tramite
pulsossimetria. Il dispositivo non permette di stabilire con quale gas è legata l'emoglobina,
ma solo la percentuale di emoglobina legata. Normalmente l'emoglobina lega l'ossigeno,
per cui è possibile ottenere una stima della quantità di ossigeno presente nel sangue. La
1.27 1.275 1.28 1.285 1.29 1.295
x 104
-2
-1.5
-1
-0.5
0
0.5
1
1.5Respirogram: S2
Time [s]
Ampli
tude
http://www.my-personaltrainer.it/fisiologia/emoglobina.htmlhttp://www.my-personaltrainer.it/fisiologia/polmoni.htmlhttp://www.my-personaltrainer.it/fisiologia/globuli-rossi.html
-
25
sonda è composta da due fotodiodi che generano fasci di luce nel campo del rosso e
dell'infrarosso e da una fotocellula che riceve la luce dopo che i fasci hanno attraversato la
cute e i vasi del paziente. L’emoglobina ossigenata, caratteristicamente, assorbe la luce in
quelle determinate lunghezze d’onda. Conoscendo la quantità di luce iniziale e quella
finale, l’apparecchiatura è in grado di calcolare la saturazione dell’ossigeno nel paziente
(indicata con l'abbreviazione SpO2 o SaO2) [11].
Figura 9: Curva di dissociazione dell’emoglobina [25].
-
26
3.5 La Polisonnografia
Lo studio del sonno e delle sue caratteristiche (polisonnografia) può essere condotto
attraverso tre misure psicofisiologiche [13]:
elettroencefalogramma (EEG), che registra l'attività elettrica dei neuroni della
corteccia cerebrale mediante elettrodi posti sullo scalpo (figura 10).
elettro-oculogramma (EOG), che registra i movimenti oculari tramite elettrodi
applicati intorno agli occhi.
elettromiogramma (EMG), che misura l’attività elettrica muscolare tramite
l'applicazione di elettrodi in corrispondenza dei muscoli oggetto di studio.
Figura 10: Onde caratteristiche del tracciato EEG.[10]
-
27
In figura 11 è mostrato il posizionamento degli elettrodi per la loro acquisizione.
Figura 11: Acquisizione EEG (a sinistra) e posizionamento classico degli elettrodi per
l’acquisizione dei segnali EEG, EOG ed EMG in polisonnografia [46].
La storia dello studio del sonno è abbastanza recente [13]. Nel 1936 si scoprì che l'EEG
presentava notevoli variazioni durante il sonno. Infatti, si alternavano delle onde ampie e
lente a onde rapide e di basso voltaggio, simili a quelle della veglia. Nel 1953 si scoprì che
proprio in questi momenti in cui c'erano onde frequenti e a basso voltaggio, gli occhi dei
soggetti si muovevano, al di sotto delle palpebre, con movimenti rapidi (Rapid Eyes
Movements). Questa fase del sonno prese il nome di sonno REM. Nel 1962 venne fatta
un'altra scoperta relativa al sonno REM. In questa fase, infatti, si notava un blocco
dell'attività dei muscoli facciali. Durante una notte di sonno l'EEG di un soggetto mostra 5
stadi differenti secondo la classificazione di Rechtschaffen e Kales (1968) [13]:
stadio 0 (Wake, W): è la fase della veglia tranquilla. In una situazione di tranquillità e
rilassamento, il tracciato EEG di un soggetto con le palpebre abbassate mostrerà onde a
bassa ampiezza ed alta frequenza che denotano la veglia che verranno interrotte dalle
cosiddette "onde alfa" più ampie e più lente.
-
28
stadio 1 (S1): il soggetto si sta addormentando, è nella fase di dormiveglia. Le onde
sono a bassa ampiezza e alta frequenza. Viene mantenuto il tono muscolare e gli occhi
presentano movimenti lenti.
stadio 2 (S2): questo stadio è detto anche sonno medio. È caratterizzato da un
abbassamento della frequenza e da un leggero incremento dell'ampiezza delle onde e
dalla presenza dei cosiddetti "complessi K". I complessi K presentano una deflessione
(un cambiamento di direzione) verso l'alto seguita da una deflessione verso il basso
dell'onda. Essi vengono anche chiamati per la loro forma "fusi del sonno".
stadio 3 (S3): questa fase del sonno si caratterizza per la presenza delle "onde delta", le
onde più lente. In questo stadio le onde delta sono presenti in una percentuale che varia
dal 20 al 50 per cento. È un sonno molto profondo dal quale è difficile risvegliarsi.
stadio 4 (S4): questa è la fase più profonda del sonno. Le onde delta sono presenti in una
percentuale che supera il 50 per cento.
Dopo aver passato qualche minuto nello stadio 4 il tracciato dell'EEG mostra un percorso
inverso. I soggetti tornano infatti alla fase 3, poi alla 2, ma dopo di essa compare uno stadio
diverso da quelli descritti in precedenza, caratterizzato dai rapidi movimenti oculari (Rapid
Eye Movement, REM) e da perdita del tono muscolare: è la fase del sonno REM. Un ciclo di
sonno che va dall'inizio dello stadio 1 alla fase della fase REM ha la durata di 90 minuti,
anche se all'interno di ciascun ciclo la durata degli stadi è variabile. Durante la notte i cicli
presentano una maggior durata dello stadio REM e una minor durata degli stadi 3 e 4
(chiamati anche sonno delta). Si descrive ora più nel dettaglio la fase del sonno REM.
Lo stadio REM viene definito anche "sonno paradosso" in quanto l’organismo, pur essendo
addormentato, presenta un’attività della corteccia cerebrale molto vicina a quella della
veglia. Il consumo di ossigeno nel cervello cresce, aumenta il ritmo respiratorio e la
pressione cardiaca, il battito cardiaco è meno regolare. Nonostante la mancanza di tono
muscolare possono esserci delle contrazioni al livello delle estremità del corpo. Tutte queste
caratteristiche hanno fatto pensare al sonno REM come legato ad eventi emozionali.
Proprio sulla base di queste ipotesi sono stati fatti i primi esperimenti per indagare la
relazione tra sonno REM e i sogni. Gli esperimenti si svolgevano risvegliando i soggetti
durante le fasi di sonno REM.
-
29
Effettivamente l'ipotesi fu confermata: non solo chi veniva risvegliato ricordava dei sogni,
ma questi risultavano molto più vividi rispetto a quelli che vengono ricordati (quando ciò
accade) al mattino. Tali esperimenti permisero di rilevare che addirittura nell'80 per cento
dei casi i soggetti ricordavano i propri sogni quando venivano risvegliati durante il sonno
REM, rispetto al 7 per cento che li ricordava dopo un risveglio in fase Non REM [13].
L’andamento temporale della fase del sonno in cui si trova il paziente può essere valutato
attraverso l’ipnogramma (figura 12): questo tracciato viene elaborato sulla base
dell’osservazione, da parte del personale medico, dei segnali EEG, EOG e EMG acquisiti.
Figura 12: Esempio di ipnogramma [33].
3.6 Studio del segnale HRV durante il sonno
L’analisi spettrale del segnale di variabilità cardiaca è una metodologia di indagine già
utilizzata in diversi studi presenti in letteratura ed applicata alle più diverse patologie: un
esempio è lo studio di Bianchi et al. [14] sui pazienti diabetici affetti da neuropatia
autonomica cardiovascolare, nei quali sono state evidenziate sostanziali anomalie. In
particolare, la densità spettrale di potenza (power spectral density, PSD) risulta
generalmente diminuita in questi ultimi e il picco corrispondente all’attivazione simpatica
(LF) rimane molto contenuto anche durante la fase di stand (paziente sveglio in posizione
eretta). Questo comportamento rappresenta un’anomalia rispetto al caso fisiologico, dove
-
30
si registra una consistente attivazione della componente simpatica (e quindi un visibile
picco in banda LF) dovuta al fatto che i barocettori carotidei avvertono una flessione della
pressione arteriosa dovuta al passaggio alla posizione eretta, che viene prontamente
bilanciata da un incremento dell’attività cardiaca al fine di garantire la corretta
ossigenazione dei distretti superiori del corpo.
Riguardo l’affezione asmatica, alcune ricerche hanno messo in evidenza che l’alterato
controllo autonomo del calibro delle vie aeree può parallelamente riflettersi in un
cambiamento nella regolazione della frequenza cardiaca [3]: di conseguenza, l’analisi del
tacogramma può rivelarsi di grande utilità nell’indagare i soggetti colpiti da tale patologia.
In ambito di polisonnografia, è stato infine osservato un incremento dell’attività di
regolazione simpatica durante le fasi REM maggiormente visibile con il procedere della
notte, e un prevalente controllo vagale durante le fasi Non REM (NREM) [23]. Anche il
segnale respiratorio appare condizionato dalle fasi del sonno, in particolare risulta più
profondo e regolare durante le fasi NREM, mentre assume una tendenza opposta durante
quelle REM [24]. Lo stesso studio testimonia inoltre, durante le fasi profonde del sonno,
una forte coerenza tra i segnali HRV e respiratorio particolarmente accentuata nella
componente HF, a confermare la prevalenza dell’azione modulatoria vagale in questi stadi.
3.7 Scopo del lavoro
Lo scopo di questa tesi è valutare la regolazione autonoma cardiaca e le variazioni
nell’accoppiamento cardiopolmonare durante le differenti fasi del sonno in soggetti
asmatici, utilizzando l’analisi spettrale e cross-spettrale dei segnali di variabilità cardiaca e
respirazione. Verranno in particolare presi in considerazione i valori di potenza spettrale
allocata nelle diverse bande dello spettro del segnale di variabilità cardiaca (in particolare
nelle bande LF e HF sopra descritte), la bilancia simpato-vagale, definita dal rapporto tra le
potenze allocate in banda LF e HF, le frequenze attorno alle quali si concentra la maggior
parte della potenza spettrale, sia per il segnale HRV che di respiro, e in quest’ultimo caso
verrà osservata la dispersione dell’ armonica principale per valutare la regolarità del
respiro. Infine verranno calcolate le percentuali di potenza del segnale HRV coerente e non
coerente con il respiro, oltre al loro rapporto, il quale funge da indice dell’influenza
-
31
dell’attività respiratoria sulla regolazione del ritmo cardiaco. Tutti questi parametri
vengono poi riutilizzati per confrontare, nelle diverse fasi del sonno, lo stato dei soggetti in
cui compare sovente una componente armonica nella banda LF del segnale di respiro con
quelli in cui non si assiste, o raramente, a questo fenomeno. L’intento è quello di
contribuire a fornire uno strumento di supporto per la diagnosi della patologia e la
valutazione dei rischi ad essa associati durante il sonno. È inoltre utile, a questo scopo,
correlare i parametri appena citati con quelli relativi all’ossigenazione del sangue, come il
livello di saturazione dell’ossigeno (SpO2%), e agli indicatori tipici dello stato della
patologia, in primo luogo il numero di risvegli e di ipopnee, con il fine di ottenere un
quadro completo delle possibili interazioni esistenti tra tutti questi fattori e confrontare i
risultati ottenuti con quelli relativi agli studi pertinenti presenti in letteratura. A tale scopo,
verrà applicato il metodo di regressione lineare agli andamenti grafici che riportano i due
parametri di volta in volta confrontati: verranno infine valutati gli indici di correlazione e
di regressione al fine di quantificare la natura e l’entità della relazione ipotizzata. I risultati
ottenuti verranno confrontati con quelli che sono stati ricavati, in altri studi pertinenti
presenti in letteratura, all’interno di gruppi di soggetti sani e patologici.
-
32
4. Materiali e metodi
4.1. Soggetti
Hanno preso parte a questo studio 19 pazienti, di cui 6 maschi e 13 femmine, di età
compresa tra i 12 e i 67 anni (età media di 46.3 anni, con deviazione standard pari a 15.8
anni): tutti i soggetti analizzati sono affetti da asma di difficile controllo. Nelle analisi
compiute, due soggetti sono stati esclusi per motivi differenti: nel primo non compariva
alcuna fase REM nell’ipnogramma, mentre nel secondo lo stato clinico era talmente
alterato da compromettere l’attendibilità delle analisi statistiche. Il campione di soggetti
analizzato è pertanto costituito da 17 soggetti.
4.2. Acquisizione polisonnografica
Il protocollo di acquisizione è stato eseguito presso il laboratorio del sonno dell’Università
Nove de Julho di San Paolo (Brasile). Per ogni soggetto sono stati registrati
simultaneamente diversi segnali attraverso polisonnografia standard, durante un’intera
notte di sonno. L'elettrocardiogramma (ECG) ed il respirogramma, necessari
rispettivamente per l’ottenimento del segnale HRV e per il monitoraggio dell’attività
respiratoria, sono stati acquisiti con una frequenza di campionamento di 256 Hz. Sono
stati inoltre registrati l'elettroencefalogramma (EEG), l’elettro-oculogramma (EOG), e il
segnale elettromiografico (EMG), con lo scopo ultimo di ricavare l’ipnogramma, un
tracciato che indica la fase del sonno in cui si trova il paziente, descritto più
dettagliatamente nel paragrafo 4.3. Lo studio è stato approvato dal Comitato Etico locale
indipendente.
-
33
4.3. Processing dei segnali
Per ogni soggetto è stato ricavato l’ipnogramma, attraverso l’assegnazione di un punteggio
da parte di un medico esperto basata sull’osservazione visiva eseguita sui segnali EEG,
EOG ed EMG, secondo la procedura standardizzata presentata nel Manuale per la
valutazione del sonno e di eventi associati dell’American Academy of Sleep Medicine
(AASM) [15]. Per quanto riguarda il punteggio visivo assegnato alle fasi del sonno, queste
nuove norme sono destinate a sostituire quelle introdotte nel 1968 da Rechtschaffen e
Kales e vengono accettate a livello mondiale. Secondo la classificazione AASM, le fasi del
sonno da S1 a S4 sono indicate come N1, N2 ed N3, con la fase N3 che comprende i due
stadi ad onde lente S3 e S4. Le fasi REM e di veglia vengono indicate, rispettivamente,
come fase R e fase W. In questo lavoro di tesi, tuttavia, verrà utilizzata la classificazione
tradizionale. Seguendo le indicazioni AASM, la veglia e le fasi del sonno sono state
segnate considerando periodi di 30 secondi.
Il tracciato degli intervalli RR è stato estratto dal segnale ECG: i picchi R sono stati rilevati
dall’ECG attraverso l’algoritmo di Pan-Tompkins [16], che effettua un riconoscimento
affidabile dei complessi QRS basato sull’analisi di andamento, pendenza e ampiezza degli
impulsi ottenuti nel segnale elaborato.
Poiché il segnale ECG originale potrebbe contenere valori anomali a causa di movimenti,
rumore, battiti ectopici, o aritmie, è stata eseguita la seguente procedura in modo da
identificare ed eliminare queste fonti di disturbo: è stata analizzata la sequenza RR derivata
dal segnale ECG, e i campioni sono stati considerati come valori anomali (outliers) nel
momento in cui veniva verificata la seguente condizione:
(4.1)
dove RRi è l’i-esimo campione del tacogramma e Average100 e Std100 sono,
rispettivamente, i valori di media e deviazione standard (standard deviation, SD) dei
precedenti 100 campioni in cui vi è totale assenza di outlier. È stato ricavato anche un
segnale filtrato, ottenuto attraverso l’applicazione di un filtro a media mobile con una
finestra di 1000 campioni: i valori fuori scala identificati nella sequenza RR originale sono
stati sostituiti con i valori dei campioni corrispondenti nella sequenza RR filtrata [17]. Il
-
34
respirogramma è stato estratto dal segnale di respirazione campionandolo in
corrispondenza di ogni picco R identificato nell’elettrocardiogramma [18]. Il segnale di
respirazione è stato ottenuto mediante pletismografia ad induttanza variabile, attraverso
l’utilizzo di una fascia applicata in prossimità del torace. Infine il segnale di saturazione
dell’ossigeno è stato ricavato mediante pulsossimetria.
4.4. Protocollo di analisi
Sono state manualmente selezionate, all'interno delle diverse fasi del sonno, porzioni di
segnale di tacogramma e respirogramma di 200 battiti cardiaci di lunghezza. Si è reso
necessario utilizzare questo valore piuttosto contenuto per garantire la stazionarietà degli
spezzoni analizzati, condizione necessaria per l’applicazione dei metodi di stima spettrale
parametrica utilizzati. Le finestre vengono scelte in maniera tale da ottenere andamenti nel
tempo stazionari e privi di artefatti o outliers. La metodologia utilizzata per l’analisi
spettrale degli spezzoni di segnale selezionati è quella della stima parametrica. L'approccio
parametrico per la stima della densità spettrale di potenza assume che la serie temporale
analizzata sia l'output di un dato processo i cui parametri risultano sconosciuti. A volte
sono note alcune informazioni a priori sul processo, o è almeno possibile prendere in
considerazione alcune ipotesi sul meccanismo di generazione della serie, e ciò rende
possibile una selezione più mirata della struttura del modello da usare. Più di frequente,
invece, il modello è indipendente dalla fisiologia o dall'anatomia del processo biologico
che genera i dati e la sua formulazione è basata su relazioni di tipo input-output, in accordo
con l’approccio black-box. Per poter ottenere un'affidabile stima spettrale, è necessaria una
validazione a posteriori del modello identificato. Questo tipo di approccio segue una
procedura che può essere riassunta in tre step principali:
1. Scelta del modello corretto per la descrizione dei dati
2. Stima dei parametri del modello basata sui dati acquisiti
3. Calcolo della densità spettrale di potenza (power spectral density-PSD) attraverso
delle equazioni proprie, in accordo al modello selezionato, nelle quali vengono
inseriti i parametri del modello stimato.
-
35
La letteratura fornisce vari modelli che possono essere utilizzati a questo proposito [20].
Nella pratica vengono utilizzati più di frequente modelli lineari con funzioni di
trasferimento razionali (figura 13), poiché questi ultimi possono descrivere affidabilmente
un ampio range di segnali differenti. Tra questi vengono preferiti i modelli autoregressivi
(AR) per via della loro funzione di trasferimento a tutti-poli: l'identificazione dei modelli
AR si riduce infatti alla soluzione di un sistema di equazioni lineari. Questo comunque non
è un limite: infatti come assicura il teorema di Wald, se l'ordine del modello è
sufficientemente elevato è equivalente ad un modello ARMA (Autoregressive Moving
Average) o ad un modello MA (Moving Average). Una corretta validazione del modello
selezionato è comunque sempre richiesta [26].
Figura 13: schema di un modello AR.
I modelli AR sono applicabili solo a segnali stazionari, e ciò non rappresenta un problema,
dal momento che a tal scopo, come già affermato, vengono selezionate solo finestre in cui
è garantita la condizione di stazionarietà del processo.
Vi sono due ragioni principali sul perché l'approccio AR per l'analisi spettrale venga
considerato superiore alle tecniche tradizionali basate sulla trasformata di Fourier:
1. la risoluzione in frequenza di uno spettro AR è infinita e non dipende dalla
lunghezza del segmento di dati che viene analizzato, questo è un particolare
vantaggio quando vengono considerati piccoli segmenti di dati [27];
2. lo spettro di potenza di un modello AR può essere visto come una sovrapposizione
di termini, ognuno corrispondente ad una certa componente in frequenza [28],
inoltre i tracciati appaiono meno frastagliati.
-
36
In ogni finestra è stata dunque effettuata un’analisi autoregressiva (AR) al fine di ottenere
un modello AR di ordine p, la cui espressione generale è la seguente:
dove y(t) è la serie in esame, y(t-k) rappresentano i p campioni precedenti (con k che
rappresenta un numero intero compreso tra 1 e p e che identifica istanti di tempo discreti ed
equidistanti), ak rappresentano i coefficienti autoregressivi da stimare per l’ottenimento del
modello ottimo, ovvero del modello per il quale viene minimizzato l’errore di stima, e ε(t)
è il segnale di rumore in ingresso al modello, la cui “bianchezza” deve essere sempre
verificata, con media nulla e varianza σx2.
La funzione di trasferimento nel dominio della trasformata Z è:
e lo spettro di potenza del processo è:
dove ω corrisponde alla frequenza di Nyquist (ovvero alla metà della frequenza di
campionamento).
Il modello AR può anche essere visto come un filtro lineare avente come ingresso un
rumore bianco. Il processo in uscita è stazionario se tutti i poli della funzione di
trasferimento (ovvero le radici del denominatore) sono all'interno della circonferenza
unitaria. Il rumore bianco è caratterizzato da uno spettro a banda piatta, lo spettro del
processo in uscita è invece completamente determinato dai parametri dell'AR [29].
L'ordine del modello è stato scelto utilizzando il criterio di informazione di Akaike
(Akaike Information Criterion, AIC): esso rappresenta una misura oggettiva
dell’adeguatezza del modello scelto che considera la modalità di adattamento e la
complessità di quest’ultimo [19]. Considerando una serie stazionaria tempo {Xt}, con t=1,
2,...,T, l’AIC consiste nella minimizzazione della funzione di costo:
(4.4)
(4.2)
(4.3)
-
37
con P = {0,1,2,…m}. σ2 rappresenta la stima della varianza del residuo per un modello
AR di ordine p, c(n) è un termine di penalità, n è il numero di osservazioni ed m è un
ordine autoregressivo superiore pre-determinato. Derivando questa funzione, si ottiene
l’espressione della formula di Akaike in relazione al p-esimo degli m ordini che si è deciso
di considerare:
La selezione dell’ordine del modello viene quindi effettuata considerando il modello per il
quale si ottiene il più basso valore di AIC. Un vantaggio dell’AIC risiede nel fatto che è
utile non solo per dati di test, ma anche per la predizione di nuovi campioni da parte del
modello: questo criterio è infatti progettato per ridurre al minimo la varianza dell'errore di
predizione.
Per quanto riguarda i coefficienti del modello, essi sono stati ottenuti utilizzando il metodo
dei minimi quadrati basato sulle equazioni di Yule-Walker [20]: (4.7) e (4.8)
con R che rappresenta la matrice dei coefficienti delle equazioni di Yule-Walker.
(4.7)
(4.8)
(4.9)
(4.5)
(4.6)
-
38
Il modello AR, come detto, è stato utilizzato per calcolare la densità spettrale di potenza
(PSD) di ciascuna porzione di segnale, che può essere espressa anche nel modo seguente:
(4.10)
dove H(ω) è la funzione di trasferimento del modello, z è definito come exp(2πifT), C(z) è
la funzione che contempla gli zeri del sistema, Δt è il periodo di campionamento e pk
rappresentano i poli del processo. I poli sono stati identificati al fine di scomporre la PSD
in singole componenti spettrali, secondo il metodo descritto da Baselli et al. [21],
ottenendo poi tramite inviluppo l’andamento grafico complessivo (figura 15).
Figura 14: Poli del modello necessari alla decomposizione della PSD di ogni componente
spettrale.
(4.10)
-
39
Figura 15: Spettro del segnale HRV come inviluppo delle campane corrispondenti alle singole
componenti spettrali [10].
In seguito sono stati quantificati i valori di frequenza e potenza associati a ciascuna
componente spettrale. Sono stati calcolati, per ciascuna porzione del segnale analizzato del
tacogramma, i valori di potenza percentuale delle componenti LF e HF, mentre per il
respirogramma è stato preso in considerazione solo il picco principale, corrispondente alla
componente HF (calcolato come percentuale della potenza in banda HF del respirogramma
sulla potenza totale del respirogramma). Per ciascuna porzione stazionaria del tacogramma
e del respirogramma è stata inoltre eseguita un'analisi bivariata al fine di ottenere il cross-
spettro tra i due segnali.
-
40
Figura 16: Serie temporali, autospettri e cross-spettri relativi ai segnali HRV e di respiro.
Secondo il metodo descritto in Bianchi et al. (1990) [14] è stato stimato un modello
bivariato AR, la cui espressione generale è la seguente:
dove Y(t) è il vettore delle serie y(t) e x(t) sotto esame, A è la matrice dei coefficienti di
autoregressione e W(t) è il vettore dei termini residui ε(t) e η(t). Il modello AR bivariato è
stato utilizzato per calcolare il cross-spettro di ciascuna porzione di segnale, che può essere
espresso come segue:
dove X(ω) e Y(ω) rappresentano gli autospettri dei segnali.
(4.11)
(4.12)
-
41
La coerenza quadratica tra i segnali nelle bande LF e HF è stata calcolata come:
dove il cross-spettro tra i segnali viene normalizzato in relazione alla PSD dei segnali.
Infine sono state calcolate, per ogni porzione di segnale analizzata, le percentuali di
potenza coerente e potenza non-coerente ed è stato inoltre calcolato il loro rapporto, che
vuole rappresentare un indicatore dell’influenza del segnale respiratorio su quello di
variabilità cardiaca.
Esempi di segnali nel dominio del tempo, di autospettri e cross-spettri, riferiti ad uno
studio compiuto su soggetti sani [33], sono illustrati in figura 16. I parametri di interesse
sono stati studiati, per tutta la notte, all'interno di ogni fase analizzata ed è stato calcolato,
relativamente ad ognuna di esse, il loro valore medio e gli scostamenti. Le fasi indagate
sono la veglia (W), la S2, la S4 e la REM. Sono state escluse dall’analisi le fasi S1 ed S3
poiché temporalmente troppo esigue. Per ciascun soggetto sono stati studiati la variazione
del rapporto LF/HF per il tacogramma e la coerenza tra segnali di tacogramma e
respirogramma nella banda HF in relazione con l’ipnogramma del soggetto, i valori medi
in tutta la notte sono stati calcolati su tutti i soggetti. È stato infine condotto sui dati un test
statistico implementando un’analisi di varianza ad una via (one way-ANOVA) al fine di
identificare differenze statisticamente significative nelle potenze del tacogramma in LF e
HF, nei valori del rapporto LF/HF, nella potenza percentuale del respirogramma in banda
HF, e nella coerenza tacogramma-respirogramma.
Per l’analisi statistica dei dati, nella prima parte del lavoro si è proceduto dapprima
svolgendo un test sulla gaussianità delle distribuzioni: si è utilizzato a questo scopo un test
di Lilliefors, più robusto del più noto test di Kolmogorov-Smirnov, per il quale
l’attendibilità dei risultati è assicurata in presenza di campioni numericamente consistenti.
Gli step fondamentali sono i seguenti [41]:
1. Si stimano la media e la varianza della popolazione.
2. Si identifica la discrepanza massima tra la funzione di ripartizione empirica e la
funzione di distribuzione cumulativa (CDF) della distribuzione normale
caratterizzata da valore atteso stimata e varianza precedentemente stimate.
(4.13)
-
42
3. Infine si valuta se la discrepanza massima è abbastanza grande da essere
statisticamente significativa, richiedendo così rifiuto l'ipotesi nulla.
L’ipotesi nulla di distribuzione gaussiana dei risultati viene rifiutata quando il risultato del
test statistico assume un valore inferiore a 0.05.
A questo punto, si è voluto indagare sull’omogeneità delle varianze delle distribuzioni
testate: a volte, infatti, valori globali di varianza ottenuti hanno fatto credere che tale
condizione non venisse verificata. Verificata o meno la guassianità dei campioni esaminati,
si è utilizzato il test di Bartlett nel primo caso, che è piuttosto sensibile agli scostamenti
dalla normalità, e il test di Levene nel secondo, quest’ultimo in quanto risulta essere un test
più robusto per effettuare le indagini statistiche nel caso non parametrico [42]. Nel caso di
non omogeneità delle varianze si dovrebbe poi procedere con altri tipi di test (ad esempio
test di Welch nel caso parametrico e test di Friedman in quello non-parametrico).
Dal momento che, attraverso l’uso dei test precedentemente descritti, non è mai stata
verificata l’ipotesi di non omogeneità delle varianze, sono stati utilizzati solamente due test
per cercare di identificare possibili differenze significative nella distribuzione dei
campioni: il test parametrico ANOVA nel caso di gaussianità e il test di Kruskal-Wallis nel
caso di gaussianità non verificata.
L'analisi della varianza (ANOVA) è un insieme di tecniche statistiche facenti parte
della statistica inferenziale che permettono di confrontare due o più gruppi di dati
confrontando la variabilità interna a questi gruppi con la variabilità tra i gruppi. L'ipotesi
alla base dell'analisi della varianza è che dati n gruppi, sia possibile scomporre
la varianza in due componenti: Varianza interna ai gruppi (anche detta within) e Varianza
tra i gruppi (between). La ragione che spinge a compiere tale distinzione è la convinzione,
da parte del ricercatore, che determinati fenomeni trovino spiegazione in caratteristiche
proprie del gruppo di appartenenza. L’ipotesi nulla di partenza è che i due campioni
presentino varianze interne simili in rapporto alla varianza tra gruppi già citata. Le ulteriori
assunzioni che assicurano la validità dell’applicazione del test statistico Anova, oltre alle
principali due già menzionate (omogeneità delle varianze e distribuzione
approssimativamente normale) sono [22]:
http://it.wikipedia.org/wiki/Statisticahttp://it.wikipedia.org/wiki/Statistica_inferenzialehttp://it.wikipedia.org/wiki/Varianza
-
43
1. Dimensione dei campioni superiore ai 10 elementi.
2. I risultati ottenuti con l’analisi di campioni si applicano alle popolazioni
3. Indipendenza fra media e varianza, ovvero l’errore di misura deve essere
indipendente dal valore misurato.
L’analisi per ranghi effettuata dal Kruskal-Wallis può essere concepita come l’equivalente,
nel caso non parametrico, dell’analisi della varianza Anova: in questo caso, l'ipotesi nulla è
che le popolazioni da cui provengono i campioni abbiano la stessa mediana. Anche in
questo caso, un valore di p_value inferiore a 0.05 tende a far rifiutare tale ipotesi.
Nella seconda parte del lavoro, volta al confronto tra gruppi di pazienti, sono state svolte
delle analisi ANOVA e Kruskal-Wallis di tipo “unpaired”, ovvero tra campioni con
diverso numero di elementi. A tale scopo, è stato in questa sede realizzato un codice in
ambiente Matlab® che rende molto rapido e pratico questo tipo di analisi.
4.5. Software per l’analisi dei dati
Le analisi prima descritte, svolte sui segnali di variabilità cardiaca e di respiro, sono state
implementate attraverso l’utilizzo di un’interfaccia grafica precedentemente realizzata in
ambiente Matlab®. Nella schermata principale (figura 17) vengono inizialmente caricati i
dati relativi ad ognuno dei pazienti coinvolti nell’analisi agendo sul tasto “Load”. A quel
punto appaiono due finestre in cui è possibile visualizzare, rispettivamente, l’andamento
temporale (lungo l’intera nottata di acquisizione) del segnale HRV e del respirogramma.
La sezione “Crop” permette di selezionare la finestra da 200 campioni desiderata: in tal
caso, nelle due finestre compariranno gli andamenti temporali relativi a queste ultime; la
selezione può essere svolta anche direttamente sul segnale attraverso il tasto “Manual
Crop”.
-
44
Figura 17: Schermata iniziale del software di analisi.
La sezione “Monovaried Analysis” (in basso a destra nella schermata principale) è
originariamente dedicata alla sola analisi monovariata dei 2 segnali. Una volta scelto il
segnale da analizzare, agendo sulla sezione “Channel to analize”, cliccando il pulsante
“Analysis” si apre una finestra (figura 18) nella quale è possibile visualizzare i poli del
modello autoregressivo, l’autospettro del segnale analizzato e una serie di indicatori, tra cui
ordine ottimo del modello, potenze spettrali nelle diverse bande e valori delle frequenze
centrali, indice LF/HF (bilancia simpato-vagale) ed altri che possono essere salvati in un
report (un file di testo). Infine la sezione ”Types of Analysis” (in basso a sinistra nella
schermata principale) permette di plottare gli spettri con ordine diverso da quello che il
software riconosce automaticamente come “ottimo”, permettendo l’impostazione da
desktop. Infine, tramite il tasto “XY” è possibile eseguire l’analisi bivariata: viene
visualizzato il diagramma della coerenza di fase e vengono salvati in un file di testo i dati
relativi a potenza coerente e non coerente (figura 19).
-
45
Figura 18: Finestra dedicata all’analisi monovariata.
Figura 19: Finestra dedicata all’analisi bivariata.
-
46
Vengono ora i passaggi tipici effettuati durante la procedura di analisi:
- Caricamento dei dati del singolo soggetto (agendo sul tasto “Load”);
- Selezione manuale del tratto di segnale da analizzare, coadiuvata dalla
sovrapposizione dell’ipnogramma alla finestra del segnale, con lo scopo di riuscire
ad identificare la fase del sonno a cui appartiene un certo spezzone selezionato;
- Una volta appurate la stazionarietà e l’assenza di outliers per entrambi i segnali, si
procede con l’analisi selezionando il segnale di interesse: settando “2” nell’area
“Channel to Analize” viene selezionato il tacogramma, impostando “3” viene
invece selezionato il respirogramma.
- Successivamente, agendo sul tasto “Analysis”, si apre la finestra in cui vengono
ricavati e visualizzati i parametri di interesse per le analisi: premendo il tasto
“Salva Report” essi vengono salvati in un documento di testo. Attraverso alcune
modifiche apportate all’interfaccia grafica originale, agendo sul tasto “Analysis” si
aprono anche delle figure che rappresentano il tacogramma, il respirogramma
normalizzato, gli autospettri dei due segnali, la Magnitude Square Coherence (il
cross-spettro) e la percentuale di potenza del segnale HRV coerente con quello di
respiro (figura 20): il tutto viene calcolato utilizzando l’ordine del modello che il
software di analisi individua come ordine ottimo.
- Eseguite tali operazioni per entrambi i segnali, attraverso il tasto “XY” vengono
visualizzati i dati di interesse dell’analisi bivariata: anche in questo caso, è possibile
salvarli in un file di testo agendo sul pulsante “Salva Report”.
Per l’analisi del segnale di saturazione, è stato in questa sede realizzato uno script in
ambiente Matlab®. Il codice chiede all’operatore di selezionare il paziente per il
caricamento dei suoi dati: a quel punto viene richiesto di inserire il frame iniziale delle
finestre da 200 campioni precedentemente analizzate. Il software continua a chiedere
l’inserimento di nuovi frame iniziali, e nel frattempo calcola il valore medio ottenuto in
ogni finestra salvandolo all’interno di un vettore di dati, fino a che l’utente non preme il
tasto “0”, che rappresenta la condizione di “break” del ciclo infinito impostato. A quel
punto, il codice inserisce, nel file .txt contente i dati relativi al tacogramma, i valori di
percentuale di SpO2 media all’interno di ogni finestra da 200 battiti, e la media
-
47
complessiva tra essi. Dal momento che l’utente, ad ogni ciclo, inserisce tutti i dati ottenuti
all’interno di ogni singola fase, la media complessiva rappresenta, per ognuna di esse, il
dato che verrà in seguito utilizzato durante le analisi statistiche.
Figura 20: Finestra riassuntiva di dati di interesse relativi all’analisi monovariata e bivariata
effettuata in un determinato spezzone di segnale.
1.985 1.99 1.995 2 2.005 2.01 2.015
x 104
0.95
1
1.05
1.1
1.15
1.2
1.25Tachogram: WAKE
Time [s]
[s/b
eat]
1.985 1.99 1.995 2 2.005 2.01 2.015
x 104
-2
-1
0
1
2Respirogram: WAKE
Time [s]
Am
plit
ude
0 0.1 0.2 0.3 0.4 0.50
0.005
0.01
0.015
0.02
0.025
0.03PSD of tachogram
PS
D [
s2/H
z]
Frequency [Hz]
0 0.1 0.2 0.3 0.4 0.50
20
40
60
80PSD of respirogram
PS
D [
Pow
er/
Hz]
Frequency [Hz]
0 0.1 0.2 0.3 0.4 0.50
0.2
0.4
0.6
0.8
1Magnitude Square Coherence
Frequency [Hz]
64.9423
% Coherent Power (in HF)
-
48
5. Risultati
Nel presente capitolo vengono raccolti e valutati i risultati ottenuti attraverso
l’applicazione dei metodi di analisi descritti in precedenza. Si farà riferimento dapprima
all’analisi monovariata compiuta sui segnali di variabilità cardiaca e di respiro: verranno
valutate le potenze relative alle componenti spettrali LF e HF e le frequenze centrali dei
picchi. Successivamente verranno mostrati i risultati relativi all’analisi bivariata compiuta
tra i due segnali e infine, in ultima analisi, verranno discussi quelli inerenti la curva di
saturazione dell’ossigeno, al fine di valutare il livello di ossigenazione del sangue. Tutti i
parametri vengono analizzati all’interno delle stesse finestre da 200 battiti di lunghezza.
Essi verranno confrontati con le schede riepilogative relative ad ogni paziente nelle quali
vengono riportati indicatori polisonnografici di grande importanza quali il numero di apnee
per unità di tempo e il numero di risvegli: verranno calcolati gli indici di correlazione e
regressione per valutare ipotetici legami tra i parametri di interesse analizzati. Le analisi
statistiche compiute saranno finalizzate all’identificazione di differenze tra le fasi del
sonno, eventualmente indicate da valori di p_value inferiori a 0.05. In seguito verrà
effettuata un’ulteriore analisi statistica per il confronto dei parametri tra due gruppi di
soggetti: coloro che presentano la comparsa di un’armonica in banda LF nello spettro del
respirogramma e coloro che invece non sono caratterizzati da tale fenomeno.
5.1. Analisi monovariata del segnale HRV:
potenza della banda LF
Di seguito, vengono dapprima riportate alcune immagini raffiguranti gli spettri ricavati
dalle finestre del segnale HRV scelte per l’analisi (figura 21). Esse si riferiscono,
nell’ordine, alle fasi Wake, S2, S4 e REM. La figura successiva (figura 22) rappresenta
graficamente la media e la deviazione standard relative alla quantità di potenza del segnale
HRV allocata in banda LF durante le diverse fasi del sonno valutata durante l’analisi di un
singolo soggetto, scelto come esempio, finalizzata a mostrare i livelli di variabilità dei dati
-
49
per un singolo paziente. Nella tabella sottostante (tabella 1) vengono infine riassunti alcuni
dei principali indicatori della statistica descrittiva effettuata sui dati appartenenti a tutti i
soggetti: media, varianza, deviazione standard e standard error, quest’ultimo parametro
definito dal rapporto tra la deviazione standard e il numero di elementi che costituiscono il
campione analizzato. Per ultimo, viene indicato il risultato del test statistico applicato su
tutta la casistica esaminata: in questo caso, il test di gaussianità (p>0.05 in tutte le fasi) e
quello di omogeneità delle varianze (p=0.675) hanno suggerito l’utilizzo del test statistico
ANOVA (p = 0.5387).
Figura 21: Potenza spettrale calcolata in finestre di segnale HRV appartenenti, nell’ordine, alla
fase Wake, S2, S4 e REM per un singolo soggetto.
0 0.05 0.1 0.15 0.2 0.25 0.3 0.35 0.4 0.45 0.50
0.001
0.002
0.003
0.004
0.005
0.006
0.007
0.008
0.009
0.01PSD of tachogram
PS
D [
s2/H
z]
Frequency [Hz]
0 0.05 0.1 0.15 0.2 0.25 0.3 0.35 0.4 0.45 0.50
0.001
0.002
0.003
0.004
0.005
0.006
0.007
0.008
0.009
0.01PSD of tachogram
PS
D [
s2/H
z]
Frequency [Hz]
0 0.05 0.1 0.15 0.2 0.25 0.3 0.35 0.4 0.45 0.50
0.001
0.002
0.003
0.004
0.005
0.006
0.007
0.008
0.009
0.01PSD of tachogram
PS
D [
s2/H
z]
Frequency [Hz]0 0.05 0.1 0.15 0.2 0.25 0.3 0.35 0.4 0.45 0.5
0
0.001
0.002
0.003
0.004
0.005
0.006
0.007
0.008
0.009
0.01PSD of tachogram
PS
D [
s2/H
z]
Frequency [Hz]
-
50
Figura 22: Valori medi e SD della potenza in banda LF nelle varie fasi del sonno per un singolo
soggetto.
Tabella 1: Potenza del segnale HRV allocata in banda LF: medie e scostamenti valutati
globalmente su tutti i soggetti. In basso, il risultato del test statistico applicato.
Si evince una consistente variabilità dei dati, sia sui valori relativi al singolo paziente,
come mostrato in figura 21, sia in quelli generali (tabella 1). Il risultato dell’analisi
statistica indica l’assenza di una significativa differenza del valore di potenza LF tra le
varie fasi del sonno.
0
0,2
0,4
0,6
0,8
1
1,2
WAKE S2 S4 REM
Pot. LF
Potenza HRV
In banda LF
Fase del sonno
WAKE S2 S4 REM
Media 0.2155 0.2291 0.1909 0.1717
Varianza 0.0164 0.0301 0.0211 0.0205
SD 0.1279 0.1736 0.1452 0.1431
SE 0.0310 0.0421 0.0352 0.0347
Test gaussianità p = 0.1991 p = 0.3937 p > 0.5000 p = 0.0985
Test varianze pBARTLETT = 0.6750
Test ANOVA p = 0.5387
-
51
5.2. Analisi monovariata del segnale HRV:
frequenza centrale del picco in banda LF
Scopo di questa sezione è quello di riepilogare i dati relativi ai valori di frequenza entro i
quali si muove il polo principale in banda LF, misurando a questo scopo la frequenza
centrale appartenente al picco in LF. Vengono di seguito riportate la figura contenente i
valori di media e SD all’interno di un singolo paziente (figura 23), e una tabella del tutto
analoga a quella raffigurata in precedenza (tabella 2) che include, relativamente ai dati
appartenenti ai 17 soggetti indagati, il valore medio, varianza, deviazione standard,
standard error e il risultato del test statistico utilizzato: visti i risultati del test di gaussianità
(p>0.05 nelle 4 fasi) e di quello di omogeneità delle varianze (p=0.0522) è stata condotta
un’analisi statistica ANOVA (p=0.6493).
Figura 23: Valori medi e SD della frequenza centrale della componente LF nelle varie fasi del
sonno per un singolo soggetto.
0
0,02
0,04
0,06
0,08
0,1
0,12
WAKE S2 S4 REM
fc LF
-
52
Tabella 2: Frequenza centrale dell’armonica principale in banda LF: medie e scostamenti valutati
globalmente su tutti i soggetti. In basso, il risultato del test statistico applicato.
Anche in questo caso non emergono significative differenze tra le varie fasi del sonno: in
esse, pertanto, la componente LF si sviluppa pressappoco attorno allo stesso range di
frequenze.
5.3. Analisi monovariata del segnale HRV:
potenza della banda HF
Di seguito viene riportato, come in precedenza, un grafico raffigurante il valore medio e la
deviazione standard dei valori di potenza allocata nella banda HF (figura 24) all’interno
delle 4 fasi in un soggetto preso come esempio. Successivamente, è riportata la tabella con
media, scostamenti e p_value del test statistici condotti: test di gaussianità (p>0.05 in tutte
le fasi), test di omogeneità delle varianze (p = 0.6534) e test ANOVA (p = 0.5853) (tabella
3).
Frequenza
centrale picco
in banda LF
Fase del sonno
WAKE S2 S4 REM
Media 0.0882 0.0849 0.