ORGANI - TESSUTI – parenchima e cellule funzionali tessuto di sostegno, connettivo
description
Transcript of ORGANI - TESSUTI – parenchima e cellule funzionali tessuto di sostegno, connettivo

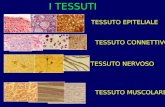
ORGANI - TESSUTI – parenchima e cellule funzionali tessuto di sostegno, connettivo
Muscolo scheletrico – miociti, fibrocellule; muscolo cardiaco: cardiomiociti; Encefalo: neuroni, astrociti, glia; Sangue: eritrociti; linfomonociti, granulociti, piastrine;Fegato: epatociti; rene: unità funzionale nefrone
Muscolo scheletrico – miociti, fibrocellule; muscolo cardiaco: cardiomiociti; Encefalo: neuroni, astrociti, glia; Sangue: eritrociti; linfomonociti, granulociti, piastrine;Fegato: epatociti; rene: unità funzionale nefrone
Matrice extracellulare - liquidi interstiziali, liquidi biologici: siero (plasma), liquor cefalorachidiano, liquido sinoviale, saliva, liquido amniotico.
Frazionamento cellulare, basilare per lo studio di proteine cellulari in organi e tessuti specifici o in linee cellulari: si devono ottenere frazioni definite di “arricchimento” di particolari componenti cellulari: ex. frazione citoplasmatica o solubile; frazione di membrane plasmatiche; frazione microsomiale; frazione mitocondriale; nuclei.
Le tecniche separative che si possono utilizzare si diversificano in relazione al tipo di tessuto/cellula e al grado di purezza della/e frazione/i subcellulare/i ritenuto necessario.
COLTURE CELLULARI: linee cellulari, cloni cellulari, etc.
Studio proteine: proteine extracellulari – cellulari Studio proteine: proteine extracellulari – cellulari
PROTEINE CELLULARI: legate alla membrana plasmatica e intracellulari
PROTEINE EXTRACELLULARI:

STUDIO DELLE PROTEINE CELLULARI- FRAZIONAMENTO CELLULARE STUDIO DELLE PROTEINE CELLULARI- FRAZIONAMENTO CELLULARE
Le cellule eucariotiche (ex. animali) sono organizzate in modo complesso:compartimenti, organelli, strutture subcellulari, dove le proteine sono variamente distribuite. Lo studio di proteine specifiche (enzimi, recettori, etc.) si effettua in frazioni cellulari (sub-cellulari): quelle, ad esempio, dove le proteine di nostro interesse sono >> espresse. Il frazionamento può anche servire per vedere il profilo di distribuzione di una o più proteine nella cellula; come fase iniziale di preparazione alla purificazione di una o più proteine, a partire da un omogenato grezzo.
Le cellule eucariotiche (ex. animali) sono organizzate in modo complesso:compartimenti, organelli, strutture subcellulari, dove le proteine sono variamente distribuite. Lo studio di proteine specifiche (enzimi, recettori, etc.) si effettua in frazioni cellulari (sub-cellulari): quelle, ad esempio, dove le proteine di nostro interesse sono >> espresse. Il frazionamento può anche servire per vedere il profilo di distribuzione di una o più proteine nella cellula; come fase iniziale di preparazione alla purificazione di una o più proteine, a partire da un omogenato grezzo.

FRAZIONAMENTO CELLULAREFRAZIONAMENTO CELLULARE
1) Fase di omogeneizzazione: disorganizzazione del tessuto e rottura di cellule
OMOGENATOOMOGENATO
2) Fase di separazione: reintroduce un ordine di nuovo tipo raggruppando le componenti cellulari contenute nell’omogenato in base a uguali caratteristiche e proprietà di tipo fisico quali dimensioni, densità.
CENTRIFUGAZIONE(differenziale, zonale,isopicnica)
CENTRIFUGAZIONE(differenziale, zonale,isopicnica)
Eterogeneità del tessuto Eterogeneità del tessuto
Procedure che devono essere eseguite al fine di ottenere la max. resa possibile;in particolare l’omogeneizzazione, deve essere adattata all’eterogeneità dei diversiorgani e tessuti: cellule che differiscono x dimensioni, densità e fragilità
Procedure che devono essere eseguite al fine di ottenere la max. resa possibile;in particolare l’omogeneizzazione, deve essere adattata all’eterogeneità dei diversiorgani e tessuti: cellule che differiscono x dimensioni, densità e fragilità
Mezzo, soluzione ; metodo di omogeneizzazioneMezzo, soluzione ; metodo di omogeneizzazione

L’omogeneizzazione avviene in tampone solitamente ipotonico e a pH fisiologico; il tampone ipotonico facilita la rottura delle cellule;
si cerca tuttavia di mantenere condizioni in vitro non troppo drastiche: nondeve essere alterata la struttura delle proteine che vogliamo studiare
L’omogeneizzazione avviene in tampone solitamente ipotonico e a pH fisiologico; il tampone ipotonico facilita la rottura delle cellule;
si cerca tuttavia di mantenere condizioni in vitro non troppo drastiche: nondeve essere alterata la struttura delle proteine che vogliamo studiare
(Blendor)
Ultraturrax; Potter-Dounce manuale; Potter-Elvejham-elettr.
Sonicazione: onde sonore alta freq.
(x omogenati di colture batteriche)

Condizioni opportune per l’omogeneizzazione di tessuti e cellule:Se eseguiamo il frazionamento cellulare per studiare la funzione di una o più proteine,dobbiamo ottenere, alla fine della procedura, una buona resa di queste(a) proteine(a). Per ogni tessuto, organo, tipo di frazione cellulare e proteine in studio esistono procedure e protocolli adattati e variabili al fine di ottenere risultati il più possibile ottimizzati.
Condizioni opportune per l’omogeneizzazione di tessuti e cellule:Se eseguiamo il frazionamento cellulare per studiare la funzione di una o più proteine,dobbiamo ottenere, alla fine della procedura, una buona resa di queste(a) proteine(a). Per ogni tessuto, organo, tipo di frazione cellulare e proteine in studio esistono procedure e protocolli adattati e variabili al fine di ottenere risultati il più possibile ottimizzati.
Temperatura: si opera in ghiaccio- 4°C – non si devono denaturare le proteine;a basse temperature si bloccano anche attività enzimatiche proteolitiche e digestiveche si trovano in lisosomi e perossisomi e si possono liberare durante la lisi – inibitori di proteasi. Composizione salina bilanciata e adattata, ipotonica per provocare rottura dellemembrane.
pH fisiologico, 7-7.4 – media che sono tamponi – uso di detergenti per solubilizzareproteine. Tamponi: impediscono cambiamenti del pH fisiologico x aggiunta di acidi o basi – acido o base deboli + loro sale ottenuto da base e acido forte. Tamponi fosfato, Tris-HCl, Hepes-NaOH, a varie conc. 5-100 mM vs. conc. salinaisotonica ≈120 mM NaCl.
Temperatura: si opera in ghiaccio- 4°C – non si devono denaturare le proteine;a basse temperature si bloccano anche attività enzimatiche proteolitiche e digestiveche si trovano in lisosomi e perossisomi e si possono liberare durante la lisi – inibitori di proteasi. Composizione salina bilanciata e adattata, ipotonica per provocare rottura dellemembrane.
pH fisiologico, 7-7.4 – media che sono tamponi – uso di detergenti per solubilizzareproteine. Tamponi: impediscono cambiamenti del pH fisiologico x aggiunta di acidi o basi – acido o base deboli + loro sale ottenuto da base e acido forte. Tamponi fosfato, Tris-HCl, Hepes-NaOH, a varie conc. 5-100 mM vs. conc. salinaisotonica ≈120 mM NaCl.
Calore, pH estremi, solventi organici, detergenti: possono provocare denaturazione delle proteineCalore, pH estremi, solventi organici, detergenti: possono provocare denaturazione delle proteine

)9
r)(2v
0
2MP
2P
f/fr
(
Velocità di sedimentazione di particelle in soluzione per centrifugazione
Tra le numerose applicazioni della centrifugazione vi è la separazione di particelle (cellule, organelli,frazioni sub-cellulari, macromolecole)- preparativa o analitica.
-La velocità di sedimentazione V incrementa proporz al quadrato del raggio particella (rp
2)
- La velocità di sedimentazione V aumenta. proporz. alla diff. tra densità particella edensità del mezzo
-La V sed. incrementa con l’incremento del campo di centrifugazione = 2r
-- La V sed. diminuisce all’aumento della viscosità del mezzo ( ) e di f/f0 =rapporto di attrito

Frazionamento sub-cellulare e centrifugazione
Organello Diametro (M) Densità (g/cm3)
Nucleo 5-10 1.40
Mitocondrio 1-2 1.18
Lisosoma 1-2 1.13
Ribosoma 0.02 1.61
Centrifugazione differenziale, zonale e isopicnica

Rotori ad angolo fisso
Rotori swing-out – a braccio oscillante

Centrifugazione differenziale
OMOGENATO
600 g
10 min
25,000 g10 min
PELLET 1Nuclei
PELLET 2MitocondriCloroplastiLisosomi
Perossisomi
PELLET 3Microsomi
PoliribosomiFrammenti di
membrane
PELLET 3Ribosomi
VirusGrandi Ma-
cromolecole
100,000 g60 min
300,000 g120 min
SOVRANATANTE1
SOVRANATANTE2
SOVRANATANTE3
CITOSOL
tecnica più usata per il frazionamento cellulare centrifugando un omogenato cellulare per tempi relativamente brevi ed a velocità modeste sarà possibile ottenere la sedimentazione dei nuclei ma non degli altri organelli, che hanno densità e/o dimensioni minori e che rimarranno nel surnatante. Il surnatante può essere ulteriormente processato per ottenere altri tipi di particelle
centrifugazioni ripetute: con una serie di centrifugazioni opportune si possono ottenere le principali frazioni sub-cellulari; con le metodiche in gradiente di densità le frazioni possono essere ottenute con un solo passaggio.
p – m > 0 p – m > 0

Relazione tra RCF (g) e RPM
Equazione di conversione

Esercitazione - Tessuto muscolare
1 gr di tessuto - Omogeneizzazione in tampone fosfato 100mM pH 7,4 (1:10 p:vol), in ghiaccio
Surnatante Pellet
Centrifugazione diff. a 10,000 g a 4°C
FRAZIONE “SOLUBILE”
(contenente citosol, microsomi, particelle e organelli + leggeri, proteine del citoplasma, enzimi)
Ultraturrax
Dosaggio delle proteine totali ottenute: metodo biureto
Dosaggio dell’enzima LDH in condizioni saturanti