Ogni reazione metabolica comporta un trasferimento sia di...
-
Upload
nguyenmien -
Category
Documents
-
view
218 -
download
0
Transcript of Ogni reazione metabolica comporta un trasferimento sia di...
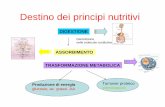
METABOLISMO: Descrive tutte le numerose reazioni con cui le molecolebiologiche sono sintetizzate e degradate, e chepermettono di ricavare, accumulare e utilizzare energia
BIOENERGETICA: Studia i cambiamenti energetici che siverificano durante le reazioni metaboliche.
Ogni reazione metabolica comporta un trasferimento sia di materia sia di energia.
Tutte le molecole in soluzione hanno una certa energia che dipende dallatemperatura, dalla pressione, dalla concentrazione, dal pH. Questa è chiamata:
Durante una reazione in cui un certo reagente è trasformato in un prodotto si
verifica una variazione di energia libera che è chiamata ΔG ed è uguale alla
differenza fra l’energia libera del prodotto e quella del reagente.
ENERGIA LIBERA DI GIBBS (G)
La variazione di energia libera diGibbs è stata misurata incondizioni standard per lediverse reazioni metaboliche.
ΔG0’ = variazione di energia libera in condizioni STANDARD
Pressione 1 atmTemperatura 25°C = 298 KpH = 7.0Concentrazione di ogni reagente e prodotto = 1M
La variazione di energia libera ΔG associata ad un processo può essere:ΔG < 0 (negativa) = processo SPONTANEO, avviene senza richiedere energia dall’esterno, anzi libera energia (ESOERGONICO).
ΔG > 0 (positiva) = processo NON SPONTANEO, richiede energia dall’esterno (ENDOERGONICO).
idrolisi di ATPATP → ADP + Pi
coordinata di reazione
ΔG
ΔG = 0 = processo all’equilibrio, in ogni processo, quando reagenti e prodotti raggiungono concentrazioni tali che la reazione diretta e quella inversa procedono
alla stessa velocità, allora viene raggiunto un equilibrio e non si verifica una variazione netta dei reagenti in prodotti e viceversa.
fosforilazione del glucosioGlu + Pi → Glu-6-P
- 30.5 KJ/mol
coordinata di reazione
+ 13.8 KJ/mol
Reazioni accoppiate
Reazione endoergonica
Reazione esoergonica
+ 13.8 KJ/mol
ΔG3 = + 13.8 KJ/mol + (-30.5 KJ/mol)= - 16.7 KJ/mol
Coordinata di reazione
Ener
gia
liber
a , G
Fosforilazione del glucosio
Una reazione termodinamicamente sfavorita può esser resa favorita accoppiandola ad una seconda reazione sufficientemente esoergonica. Le variazioni di energia libera sono additive
- 30.5 KJ/mol
ATP: Trasportatore di energia metabolica, è un donatore di energia e, nel contempo, un donatore di gruppi fosforici e adenilici
L’idrolisi di ATP è accoppiata nei processi metabolici a reazioni di sintesi di diversi metaboliti, reazioni che nell’ambiente cellulare sono endoergoniche.
L’energia liberata dall’idrolisi dell’ATP è la forza trainante della reazione, garantisce un ΔG < 0 all’intero processo.
Fattori che contribuiscono a rendere esoergonica l’idrolisi di ATP:
1) Nei prodotti di idrolisi si ottiene una maggiore neutralizzazione dellecariche negative dei gruppi fosfoanidridici da parte degli ioni Mg2+
(diminuzione della repulsione elettrostatica)
2) I prodotti di idrolisi (ADP, AMP, Pi) sono meglio solvatati che non l’ATPstesso. La sfera di solvatazione aiuta a schermare le cariche negative.
ADP (adenosina 5’-difosfato)
Idrolisi legame fosfoanidridico in γcon liberazione di fosfato e ADP
γ β α
3) I prodotti di idrolisi (ADP, AMP,Pi) sono più stabili dell’ATP. Lastabilizzazione si ha per risonanza:gli elettroni sugli atomi di ossigenoterminali sono maggiormentedelocalizzati che non sugli ossigeniche fanno da ponte nei legamifosfoanidridici.
Legame anidridico
:NH3
Glutammil-fosfato
se dovesse catalizzare la trasformazione del Glu in Gln in questo modo il processo sarebbe
sfavorito: ΔG0’ = + 14.5 KJ/mol
ATP + H2O ADP + Pi
ΔG0’ = - 30.5 KJ/mol
Occorre una spesa energetica: per mandare avanti la reazione è necessario accoppiarla
all’idrolisi di ATP
ΔG0’TOT = +14.5 KJ/mol + (- 30.5 KJ/mol)= - 16.0 KJ/mol REAZIONE ESOERGONICA
Glutammato + NH3 + ATP glutammina + ADP + Pi
Glutammina-sintetasi: sintetizza glutammina a partire da glutammato
+ H2O
COMPOSTI METABOLICI AD ALTO CONTENUTO ENERGETICO: COMPOSTI LA CUI IDROLISI LIBERA ENERGIA UTILE A MANDARE AVANTI I PROCESSI METABOLICI
Fosfoenolpiruvato
1,3-bisfosfoglicerato
Fosfocreatina
ADP→ AMP + Pi
ATP→ ADP + Pi
ATP→ AMP + PPi
AMP→ adenosina + Pi
PPi → 2 Pi
Glucosio 3-fosfato
Glucosio 6-fosfato Fruttosio 6-fosfato
Glicerolo 3-fosfato Acetil-CoA
FOSFOENOLPIRUVATO
PIRUVATO(FORMA ENOLICA)
PIRUVATO(FORMA CHETONICA)
Stabilizzazione per tautomerizzazione
KJ/mol
Idrolisi dell’estere enolico
Fosforilazione a livello del substrato
Legame fosfoanidridico1,3-bisfosfoglicerato
La sua idrolisi libera energia sufficiente a sintetizzare ATP a partire da ADP?
1,3-bisfosfoglicerato 3-fosfoglicerato 3-fosfoglicerato
Prodotto stabilizzato per risonanza
∆G°’ = - 49.3 Kj/mol
Legame fosfoammidico
Fosfocreatina
Stabilizzazione per risonanza
∆G°’ = - 43.0 Kj/mol
Posso utilizzare questa energia per sintetizzare ATP trasferendo il gruppo fosfato dalla fosfocreatina all’ADP.
In una reazione biochimica che avviene all’interno di un organismo vivente le condizioni di reazione non sono quelle standard e la variazione reale di energia
libera (e quindi la spontaneità della reazione) dipende dal rapporto fra le concentrazioni di reagenti e prodotti presenti nell’ambiente cellulare.
A + B C + D
R = cost. universale dei gas (8.315 J/K·mol)T = temperatura in Kelvin
[C] [D]ΔG’reaz = ΔG0’reaz + RT In
[A] [B]
Se la reazione metabolica raggiunge l’equilibrio: il rapporto di concentrazioni è uguale alla costante di equilibrio e la variazione di energia libera della reazione è
nulla (la reazione è facilmente reversibile)
[Ceq] [Deq]
[Aeq] [Beq]= Keq ΔG’reaz = ΔG0’reaz + RT In Keqe quindi:
ΔG’ > 0 reazione non favorita ΔG’ < 0 reazione favorita
Quando le concentrazioni di reagenti e prodotti sono lontane dall’equilibrio:
ΔG’ = 0 → ΔG0’ = - RT In Keq
Isomerizzazione del glucosio-6-fosfato fruttosio-6-fosfato
Se le concentrazioni sono all’equilibrio: ΔG = 0 le due reazioni procedono alla stessa velocità nei due sensi
Se [G6P] < [G6P]eq [F6P] > [F6P]eq
ΔG > 0 È favorita la formazione di glucosio 6-P (reazione inversa)
Se [G6P] > [G6P]eq [F6P] < [F6P]eq
ΔG < 0 È favorita la formazione di fruttosio 6-P (reazione diretta)
Variazione di energia libera nelle reazioni metaboliche di ossidoriduzione
È ASSOCIATA AL FLUSSO DI ELETTRONI SCAMBIATI TRA GLI INTERMEDI METABOLICI.
Il flusso di elettroni è “spontaneo” quando sono trasferiti da un donatore a basso potenziale di riduzione (bassa affinità per gli e– ) ad un accettore ad alto potenziale di riduzione (alta affinità per gli e–).
SE IL FLUSSO DI ELETTRONI E’ SPONTANEO LA REAZIONE E’ ESOERGONICA
LE REAZIONI DI OSSIDORIDUZIONE CHE AVVENGONO NEI SISTEMI BIOLOGICI PREVEDONO:
1) trasferimento diretto di elettroni:Fe3+ + 1 e- → Fe2+ (centri ferro/zolfo; citocromi)
2) trasferimento di 1 atomo di idrogeno:1 H+ + 1 e- (FAD; Ubichinone)
3) trasferimento di 1 ione idruro:H:- (1 protone e 2 elettroni) (NAD+)
4) incorporazione di ossigeno come OH o COOH da parte di ossigenasi
acetaldeide + NADH + H+ → etanolo + NAD+
CALCOLO DEL ∆G0’ DI UNA REAZIONE DI OSSIDORIDUZIONE IN CONDIZIONI STANDARD
∆G0’ = - n F ∆E0’
n = n° di elettroni scambiatiF = costante di Farady (96.5 kj/V▪ mole)∆E0’ = differenza fra i potenziali di riduzione standard delle coppie redox
∆E0’ = E0’ossidante - E0’riducente
Specie che nella reazionesi riduce (accetta elettroni)
Specie chenella reazionesi ossida (dona elettroni)
+ NADH
Acetaldeide (forma ossidata) >> si deve ridurre ad etanolo
forma ridotta >> si deve ossidare
Il NADH cede 2 e- e 1H+ (ione idruro H:-)al C carbonilico dell’acetaldeide,
L’ossigeno acquista un protone (1H+ ) dal mezzo
H+
CH3- CH2- OH +
Etanolo (forma ridotta)
NAD+
R
NAD+, forma ossidata
CH3 CO
HCH3 C
O
H
La reazione è reversibile, l’etanolo può essere ossidato nuovamente ad acetaldeide e il NAD+ può essere ridotto nuovamente a NADH
Per calcolarmi il ∆E0’ considero le due semirezioni di riduzione e i relativi potenziali di riduzione standard delle due coppie redox:
Acetaldeide + 2e- + 2 H+ → etanolo E0’ = - 0.197 VNAD+ + 2e- + H+ → NADH E0’ = - 0.320 V
∆E0’ = E0’ (Acet/Etan) - E0’ (NAD+/NADH)= - 0.197 – (- 0.320)= - 0.197 + 0.320= + 0.123 V
Accettore di e- nella reazione da noi considerata
Donatore di e- nella reazione da noi considerata
∆G0’ = - n F ∆E0’= - 2 x (96.5 Kj/V▪ mole) x (+ 0.123 V)= - 23.7 Kj/mole
In condizioni standard la reazione redox considerata è favorita dal punto di vista energetico: stiamo trasferendo elettroni da una coppia redox a più basso potenziale di riduzione
(NAD+/NADH) ad una a più alto potenziale di riduzione (Acetaldeide/etanolo).