Metodi elettrochimici - Zanichelli · 2020-01-23 · 1 Metodi elettrochimici 1 PRINCIPI GENERALI...
Transcript of Metodi elettrochimici - Zanichelli · 2020-01-23 · 1 Metodi elettrochimici 1 PRINCIPI GENERALI...

1
Metodielettrochimici 1
PRINCIPI GENERALILrsquoelettrochimica non gode di molte simpatie presso gli studenti (e non solo) Pos-siamo capirlo percheacute i principi teorici non sono cosigrave semplici e tutto sommato sitratta di generare o (tentare di) far passare corrente dentro laquoqualcosaraquo e ciograve chesuccede egrave raramente entusiasmante almeno prima di scoprire che il mondo dioggi quasi si fermerebbe senza le pile oppure che possiamo creare tutti i coloridellrsquoarcobaleno trattando sapientemente la superficie di un anello di titanio
I metodi elettrochimici di analisi strumentale si basano su unrsquoampia serie ditecniche associate alla misura del segnale elettrico fornito da un campione con ca-ratteristiche opportune (rappresentato in genere da una soluzione) quando vieneinserito in un sistema di misura
Tali metodi hanno spesso il vantaggio di essere relativamente rapidi e avere uncosto contenuto inoltre si prestano bene a determinazioni analitiche di ogni tipoche vanno dalla misura di importantissimi parametri chimico-fisici come il pH o laconducibilitagrave elettrica alla determinazione della concentrazione di numerose spe-cie chimiche fino alla valutazione dei vari stati di ossidazione di elementi molecolee ioni Infine ma non certo di secondaria importanza va citato lrsquoaccoppiamentocon altre tecniche di analisi (per esempio quelle cromatografiche) la cui strumenta-zione si avvale di sistemi di rivelazione appunto elettrochimici indispensabili perottenere determinate prestazioni
Per effettuare le misure il campione viene inserito in un sistema elettrochimicoovvero un insieme opportunamente strutturato di conduttori di prima e di secondaspecie
bull In un conduttore di prima specie (metalli semiconduttori) il passaggio di cor-rente avviene in seguito a un flusso di elettroni La legge fondamentale che de-scrive il fenomeno egrave nota come prima legge di Ohm
V = R times i (11)
dove bull V egrave la differenza di potenziale o tensione (abbreviata ddp) ai capi delconduttore bull R la resistenza elettrica bull i lrsquointensitagrave di corrente
1
Diamo per noto in questasede il principio delsignificato fisico deiparametri utilizzati nelleleggi proposte
2
1 Metodi elettrochimici
Nei metalli la resistenza aumenta con la temperatura percheacute aumenta lrsquoagitazionetermica degli atomi nel reticolo cristallino che ostacola il flusso di elettroni Neisemiconduttori invece la resistenza diminuisce con lrsquoaumento della temperaturapercheacute in queste sostanze gli elettroni richiedono un apporto di energia per fluireliberamente nel reticolo
bull In un conduttore di seconda specie il passaggio di corrente egrave dovuto allo spo-stamento di ioni i sali fusi le soluzioni elettrolitiche (in cui sono presenti ioniliberi solvatati in varia misura) e alcuni solidi ionici come per esempio AgCl eLaF3 sono conduttori di seconda specie Nei solidi ionici lo spostamento delleparticelle cariche egrave dovuto alla presenza di laquolacuneraquo distribuite in modo casualenel reticolo cristallino che consentono agli ioni di migrare in presenza di uncampo elettrico verso il polo di carica opposta
Per questi conduttori la prima legge di Ohm assume la seguente forma leggermentemodificata
V= R times i + EW (12)
Il termine aggiuntivo (EW) indica la differenza di potenziale laquoin piugraveraquo che egrave neces-sario applicare percheacute nel circuito si stabilisca la corrente i Infatti nei conduttoridi seconda specie egrave presente una forza controelettromotrice (corrispondente a EW)che genera una corrente opposta a i la quale deve essere perciograve controbilanciata
Anche nei conduttori di seconda specie la resistenza elettrica diminuisce conlrsquoaumento di temperatura percheacute tanto maggiore egrave la temperatura tanto maggiore egravelrsquoenergia e quindi la mobilitagrave cioegrave la laquocapacitagrave di muoversiraquo degli ioni in soluzione
Un sistema elettrochimico in sostanza egrave costituito da tre componenti principali( fig 11) un circuito esterno gli elementi sensibili (o elettrodi) e lrsquooggetto di analisi(o analita) che in genere egrave una soluzione elettrolitica
Il circuito esterno egrave lrsquoinsieme di dispositivi (tutti conduttori di prima specie) checonsentono di trasmettere impulsi elettrici alla soluzione in analisi (e quindi allespecie chimiche in essa contenute) eo di ricevere e misurare i segnali che si gene-rano in questrsquoultima Ciograve viene realizzato attraverso opportuni elementi sensibilicostituiti da conduttori di prima specie (o di seconda specie nei casi piugrave complessi)immersi nella soluzione gli elettrodi dunque costituiscono il tramite fra il circuitoesterno e la soluzione in analisi
Egrave necessario chiarire subito che per consuetudine ormai radicata il termineelettrodo puograve assumere in elettrochimica due diversi significati
Figura 11Schema di un sistema per misureelettrochimiche Gli elementi sen-sibili detti elettrodi trasferiscono alsistema oggetto di analisi (in genereuna soluzione) il segnale elettricogenerato dal circuito esterno oppurecomunicano a questrsquoultimo il segnaleproveniente dalla soluzione
3
CLASSIFICAZIONE
a in generale indica il conduttore di prima specie (un filo o una lamina metallicama anche una goccia di mercurio) immerso nella soluzione in esame
b nelle tecniche potenziometriche (gtCapitolo 2) indica invece lrsquointero sistema for-mato dal conduttore metallico e dalla soluzione in cui egrave immerso
Lrsquoinsieme degli elettrodi e della soluzione costituisce la cella elettrochimica I parametrisu cui si opera o che vengono misurati durante unrsquoanalisi di tipo elettrochimico sono
bull potenziale e differenza di potenziale (simbolo V oppure E)
bull intensitagrave di corrente (i)
bull quantitagrave di carica elettrica (q)
bull resistenza (R) oppure conduttanza (L lettera greca laquolambdaraquo maiuscola)
Il preciso significato e lrsquouso di queste grandezze in sede analitica sono trattati nellepagine che seguono per il momento stabiliremo una classificazione dei diversi me-todi di analisi elettrochimica facendo riferimento a questi parametri
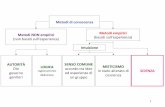
CLASSIFICAZIONEIn linea del tutto generale i metodi elettrochimici possono essere classificati in baseallrsquoentitagrave della corrente che fluisce nel sistema nel corso della misura
21 Metodi a corrente zero potenziometriaSi tratta di metodi in cui la misura viene effettuata raccogliendo il segnale prove-niente dalla soluzione mediante gli elettrodi si opera cioegrave in modo laquopassivoraquo ein condizioni di equilibrio turbando il meno possibile lo stato della soluzione inesame
In questo ambito rientra essenzialmente la potenziometria (gtCapitolo 2) ov-vero una serie di tecniche mediante le quali viene misurata la differenza di po-tenziale che si stabilisce tra due elettrodi immersi nella soluzione in analisi I dueelettrodi svolgono diverse funzioni uno (elettrodo di riferimento) mantiene unpotenziale costante lrsquoaltro (elettrodo di misura) si pone in equilibrio con la solu-zione Il potenziale del sistema formato dai due elettrodi dipende dalle concentra-zioni e piugrave rigorosamente dalle attivitagrave delle specie in soluzione e puograve essere ri-cavato in base alla legge di Nernst di cui ci occuperemo in dettaglio nel prossimocapitolo In linea generale per un generico sistema redox
ox + ne red
la legge di Nernst assume la forma seguente
(13)
I simboli V ed E sonotalvolta usatiindifferentemente ma ilsecondo indica a rigorela forza elettromotrice( fem) cioegrave la differenzadi potenziale della cellamisurata a corrente zeroIn alcuni casi egrave preferibileusare i simboliΔV eΔEdove la lettera greca deltamaiuscola (Δ) indica ladifferenza fra due diversivalori di V o Erispettivamente
2
4
1 Metodi elettrochimici
dove bull E egrave il potenziale assunto dallrsquoelettrodo di misura bull Edeg il potenziale standardassunto dallrsquoelettrodo (a 25 degC e 1 bar) quando le forme ossidata e ridotta han-no attivitagrave unitaria e la misura di potenziale viene effettuata rispetto allrsquoelettro-do standard a idrogeno (abbreviato SHE) bull R la costante termodinamica dei gasbull T la temperatura (in kelvin) bull F la costante di Faraday bull n il numero di elettroni(endash) scambiati nella reazione redox bull frac12oxfrac12 e frac12redfrac12 indicano le attivitagrave delle speciescritte fra le due barrette
La misura in genere viene eseguita con un millivoltmetro (o voltmetro elettronico)uno strumento in grado di misurare la differenza di potenziale fra gli elettrodi incondizioni di corrente praticamente nulla
Il valore di E o la sua variazione ΔE sono utili per determinare importanti pa-rametri chimico-fisici (come il pH) o per stabilire il punto di equivalenza nelle ti-tolazioni
22 Metodi a corrente diversa da zeroelettrogravimetria coulombometria voltammetriae conduttimetria
Nellrsquoambito di questi metodi si misura lrsquoentitagrave della corrente che attraversa la cellaquando a essa viene applicata attraverso gli elettrodi una differenza di potenzialefissa o fatta variare in maniera opportuna Si tratta insomma di operare inmodo laquoattivoraquo sul campione turbandone le condizioni di equilibrio in modo daraccogliere la laquorisposta elettricaraquo proveniente da esso
Il fenomeno principale che sta alla base di tutti questi metodi egrave quello dellrsquoelet-trolisi e per questo si parla anche di metodi elettrolitici Ce ne occuperemo ampia-mente nel Capitolo 3
Di seguito riassumiamo i principali metodi elettrolitici
ElettrogravimetriaLrsquoelettrogravimetria (gtCapitolo 4) egrave la piugrave antica tecnica elettrochimica che si basasul fenomeno dellrsquoelettrolisi Due elettrodi opportunamente conformati sono im-mersi nella soluzione in esame a determinati potenziali assunti dagli elettrodi siverifica la scarica (cioegrave lrsquoossidazione su un elettrodo e la riduzione sullrsquoaltro) dellespecie chimiche in analisi che se si depositano sugli elettrodi possono essere poideterminate per via gravimetrica
CoulombometriaIl termine laquocoulombometriaraquo (gtCapitolo 4) deriva da coulomb lrsquounitagrave di misuradella quantitagrave di carica elettrica In questa tecnica si impone unrsquoopportuna diffe-
Ricordiamo che nelSistema Internazionale ilbar (= 105 Pa) hasostituito lrsquoatmosfera(atm)
ATTIVITAgrave DELLE SPECIE IN SOLUZIONEAPPROFONDIMENTO
5
CLASSIFICAZIONE
renza di potenziale fra due elettrodi e si misura la corrente che circola in un deter-minato intervallo di tempo in seguito ai fenomeni di elettrolisi che si verificanoagli elettrodi
La coulombometria si basa sulla legge di Faraday
(14)
dove bull m egrave la massa bull MM la massa molare della specie chimica che si scaricaallrsquoelettrodo bull F la costante di Faraday bull n il numero di elettroni scambiati nellareazione di scarica bull i lrsquointensitagrave di corrente bull t il tempo
VoltammetriaIn voltammetria (gtCapitolo 5) si misura la variazione della corrente (Δi) che passafra gli elettrodi immersi nella soluzione in analisi al variare del potenziale applicatoa uno di essi (elettrodo di lavoro) Lrsquoelettrodo di lavoro puograve essere allo stato solidooppure egrave costituito da una singola goccia di mercurio pendente da un capillare Se lagoccia di mercurio cade ritmicamente dal capillare e quindi viene continuamenterinnovata durante la scansione si parla piugrave propriamente di polarografia
Lrsquoamperometria egrave una variante della tecnica voltammetrica che consente di ef-fettuare titolazioni Il potenziale dellrsquoelettrodo di lavoro viene mantenuto a un va-lore costante tale da garantire il passaggio di corrente la variazione dellrsquointensitagravedi corrente che si ha durante lrsquoaggiunta di titolante consente di individuare il puntodi equivalenza
ConduttimetriaIn conduttimetria (gtCapitolo 6) si misura la conducibilitagrave elettrica (lrsquoinverso dellaresistenza elettrica) della soluzione in analisi Si possono effettuare misure diret-te mediante elettrodi di conformazione adatta che consentono di determinare peresempio il contenuto salino di una soluzione oppure si possono eseguire titola-zioni registrando la variazione di conducibilitagrave dovuta allrsquoaggiunta del titolante Laconduttimetria sfrutta a fini analitici la seconda legge di Ohm che per soluzionielettrolitiche assume la forma
L = cK (15)
dove bull L egrave la conduttanza della soluzione bull c (lettera greca laquochiraquo) la conducibilitagravespecifica della soluzione bull K la costante di cella
mMM
nF= int i t
0
t
d
La massa molare (MM)di un elementomonoatomico di unamolecola di uno ione oradicale corrisponde allamassa di un numero diAvogadro delle particellein questione Essacoincide con la massaatomica o molecolareespressa in gmol
Con questa tecnica sipossono raccogliereinformazioni siaqualitative siaquantitative sulle speciechimiche presenti insoluzione secondo lamodalitagrave con cui queste siscaricano allrsquoelettrodo
Di solito la misura vieneeffettuata in correntealternata per evitarefenomeni indesiderati dielettrolisi Usandocorrente alternata ad altafrequenza si possonodeterminare anche lecostanti dielettriche disistemi liquidi
6
Potenziometria2
TEORIA
ELETTRODI E POTENZIALE DI ELETTRODOConsideriamo un sistema relativamente semplice (fig 21a) costituito da una lami-na metallica (per esempio di rame Cu) immersa in acqua pura o in una soluzionemolto diluita di un suo sale (per esempio il solfato) Un sistema di questo tipo costi-tuisce una semicella (o semielemento o semplicemente elettrodo)
Allrsquoinizio sia il metallo sia la soluzione sono elettricamente neutri quasi imme-diatamente dopo il contatto perograve si verifica uno scambio spontaneo di materia frail metallo e la soluzione piugrave precisamente si verifica un passaggio di ioni Cu2+ insoluzione
1
Se si usa una lamina dirame laquomarcataraquo cioegravecontenente isotopiradioattivi del rame in uncerto tempo anche lasoluzione manifesta unaleggera radioattivitagravequesto dimostra che unaquantitagrave sia pure minimadi rame egrave passata insoluzione sia in formaionica sia elementare Egravestato infatti dimostratoche in soluzione sonopresenti anche cluster diatomi neutri
Figura 21(a) Semplice semicella elettrochi-mica (b) Rappresentazione sem-plificata del doppio strato elettricoche si forma quando il metalloossidandosi cede ioni positivi allasoluzione Le molecole dipolaridellrsquoacqua sono laquoorientateraquo sianella sfera di solvatazione degliioni sia vicino alla superficie delmetallo che ha carica negativa
Si crea cosigrave uno squilibrio elettrico la soluzione assume carica positiva percheacute gliioni solfato non compensano la carica degli ioni Cu2+ passati in soluzione mentrela lamina di rame che ha trattenuto due elettroni per ogni nuovo ione Cu2+ assumecarica elettrica negativa
Si forma perciograve un doppio strato elettrico (fig 21b) cioegrave una separazione dicarica allrsquointerfaccia metallosoluzione che viene descritta come una differenza di
Caricanegativa
Interfacciametallosoluzione
7
ELETTRODI E POTENZIALE DI ELETTRODO
potenziale (abbreviata ddp) fra la lamina di metallo e la soluzione questa ddp egravedetta potenziale di semicella (o potenziale di elettrodo) Nel nostro esempio lalamina di rame assume carica negativa e quindi ha potenziale negativo mentre lasoluzione assume potenziale positivo
Il potenziale di semicella puograve essere espresso indifferentemente come la diffe-renza di potenziale fra il metallo e la soluzione oppure fra la soluzione e il metallosi tratta di una pura convenzione In questo libro seguiremo la convenzione euro-pea adottata a livello internazionale dalla IUPAC (International Union of Pure andApplied Chemistry) nel 1953 in base alla quale
a se si indica con ye il potenziale del metallo (fase solida) e con ys quello dellasoluzione (fase liquida) la ddp egrave uguale a ye ndash ys Quindi nel nostro esempio ilpotenziale di elettrodo egrave negativo
b le reazioni redox associate a una semicella devono essere scritte nel senso dellariduzione
Quindi per lrsquoelettrodo di rame la reazione di semicella egrave scritta nella forma seguente
Cu2+ + 2endash Cu
Il significato chimico-fisico del potenziale (Ve) assunto dallrsquoelettrodo di rame in se-guito al passaggio spontaneo di ioni Cu2+ in soluzione (per effetto di una ossidazione)egrave il seguente esso rappresenta il lavoro (Le) per unitagrave di carica (q) che bisogna com-piere per realizzare il processo non spontaneo opposto cioegrave il deposito di rame sullalamina (per effetto di una riduzione) Poicheacute i fenomeni in gioco sono sia di naturachimica sia elettrica si parla piugrave correttamente di potenziale elettrochimico dellrsquoe-lettrodo
I potenziali elettrochimici dipendono da un insieme di condizioni standard di tem-peratura pressione e concentrazione fissate inizialmente da coloro che per primi se nesono occupati per esempio 298K per la temperatura e 1 bar per la pressione
Lo stato standard egrave
bull per i solidi il solido purobull per i solventi il solvente purobull per i soluti una soluzione 1 Mbull per i gas il gas puro alla pressione di 1 bar
Il tutto assumendo un comportamento ideale per ogni sistema
In linguaggio matematico
VL
qe
e=
Ovviamente queste considerazioni sono valide anche per il caso in cui la reazionedi riduzione egrave il processo che avviene spontaneamente Ciograve si verifica per esempioquando la soluzione ha una concentrazione di ioni Cu2+ cosigrave elevata che lrsquoeffetto nettodegli scambi metallosoluzione consiste nel trasferimento di ioni sul metallo che per-ciograve acquista una carica positiva e quindi un potenziale positivo rispetto alla soluzioneEsiste anche unrsquounica concentrazione di ioni Cu2+ per la quale non si verifica scam-
Il termine elettrodo chein potenziometria siriferisce allrsquointero sistemametallosoluzione spessoviene riferito alla sola fasesolida (la laminametallica) seguendo cosigravela consuetudine in usonelle tecnicheelettrolitiche
Il lavoro necessario perdepositare uno ione sullalamina riducendolo egrave ditipo sia elettrico (neiconfronti delle forze delcampo elettrostaticogenerato dallrsquoelettrodo)sia elettrico di superficie(per superare il doppiostrato di cariche) siachimico (percheacute nelprocesso di riduzione delloione sul metallointervengono forze dinatura chimica)
8
2 Potenziometria
bio apparente di materia fra il metallo e la soluzione a questa concentrazione le duereazioni opposte (riduzione e ossidazione) procedono alla stessa velocitagrave e il sistemasi trova in uno stato di equilibrio termodinamico fin dallrsquoistante in cui il metalloviene immerso in soluzione
LA FISICA DEI SISTEMI ELETTROCHIMICIAPPROFONDIMENTO
11 Classificazione degli elettrodiUn metallo immerso in una soluzione dei suoi ioni costituisce un elettrodo di pri-ma specie il cui potenziale dipende dalla concentrazione (piugrave precisamente dallrsquoat-tivitagrave) degli ioni in soluzione
Quando invece il metallo si trova in equilibrio con la soluzione di un suo salepoco solubile si ha un elettrodo di seconda specie un filo drsquoargento immerso inuna soluzione satura di AgCl tutto ricoperto dal sale egrave un tipico elettrodo di secon-da specie La reazione di elettrodo egrave
AgCl + endash Ag + Clndash
Un elettrodo di terza specie egrave costituito da un metallo inerte immerso in una solu-zione contenente una coppia redox Un tipico esempio egrave costituito da un filo di pla-tino (un metallo nobile e quindi inerte nelle normali condizioni di lavoro) immersoin una soluzione di ioni Fe2+ e Fe3+ Il metallo si pone in equilibrio con la soluzionedi cui assume il potenziale Infatti la superficie di platino diventa sede dello scam-bio di elettroni fra le due specie ioniche che danno luogo alla reazione
Fe3+ + endash Fe2+
Infine gli elettrodi di quarta specie (che possono essere considerati come una va-riante dei precedenti) sono i cosiddetti elettrodi a gas in cui il metallo inerte e poro-so viene saturato da un gas (per esempio idrogeno) e posto a contatto con una solu-zione contenente la forma ionica del gas (nellrsquoesempio H+) Nel caso dellrsquoidrogeno
2H+ + 2endash H2
12 Calcolo dei potenziali di elettrodo legge di Nernst
Il potenziale di elettrodo egrave tanto maggiore in valore assoluto quanto maggiore egravela differenza di carica nel doppio strato (per esempio quella che si instaura allrsquoe-quilibrio fra i due lati dellrsquointerfaccia metallosoluzione) e dipende sia dalla naturachimica della coppia redox sia dalla concentrazione attiva ovvero dallrsquoattivitagrave degliioni in soluzione
Consideriamo lrsquoequilibrio per una generica semireazione di elettrodo
aox + bB + nendash cred + dD
Allrsquoequilibrio il potenziale di elettrodo che in realtagrave egrave una differenza di potenzialefra il metallo e la soluzione egrave espresso dalla legge di Nernst
+ (21)
Questa legge che prende ilnome dal chimico tedescoWalther H Nernst puograveessere ricavata in base aconsiderazionitermodinamiche edelettrochimiche su cui nonci soffermeremo Si notiin particolare chelrsquoargomento dellogaritmo egrave lrsquoinverso delquoziente di reazione
9
ELETTRODI E POTENZIALE DI ELETTRODO
dove bull E egrave il potenziale di elettrodo (in volt V) bull R la costante dei gas (che vale831451 Jmol times K) bull T la temperatura assoluta (in kelvin K) bull F la costante diFaraday (che vale 96 485 coulombmol) bull n il numero di elettroni scambiati nellasemireazione bull frac12 frac12 indica lrsquoattivitagrave di ciascuna specie scritta fra le due barrette
Edeg egrave il potenziale standard della coppia redox cioegrave il potenziale che la semicellaassume alla temperatura di 25 degC (29815 K) quando tutte le specie hanno attivitagraveunitaria e i gas si trovano alla pressione parziale di 1 bar (100 kPa) o piugrave precisa-mente hanno fugacitagrave unitaria
Lrsquoattivitagrave di ogni specie egrave uguale al prodotto g ∙ C dove g egrave il coefficiente di atti-vitagrave e C la concentrazione analitica espressa in moli su litro (molL)
Se si tiene conto dei coefficienti di attivitagrave e si inseriscono le parentesi quadre [ ]che indicano le concentrazioni in molL (gtpag 33) si ottiene
E ERT
nF
a b
c d= +deg ln
[ox] [B]
[red] [D]acute (22)
dove al posto di Eo compare il cosiddetto potenziale formale (Eoacute) della coppia redoxin oggetto
Il potenziale formale puograve differire in modo significativo dal potenziale standarde si rivela piugrave utile di esso per una valutazione anche solo orientativa del compor-tamento della coppia redox in quanto tiene meglio conto delle reali condizioni incui si opera per esempio il pH della soluzione Ricordiamo infatti che il pH allrsquointer-no di una cellula vale circa 7 (a parte pochissime eccezioni) per cui il potenziale re-dox standard che fa riferimento a pH 0 non risulta molto adatto a descriverne de-terminate caratteristiche Inoltre il potenziale standard delle coppie O2H2O vale123 V ma scende a 081 V a pH 7 Analogamente il potenziale della coppia deidro-ascorbicoascorbico passa da +390 V a +0058 V diventando nettamente riducentecome si addice alle ben note proprietagrave antiossidanti della vitamina C
Quando si lavora con soluzioni molto diluite (al di sotto di 10ndash3 M) si puograveassumere con buona approssimazione che il coefficiente di attivitagrave di tutte lespecie sia uguale a 1 In tali condizioni se si inserisce il valore numerico di RF e ilfattore numerico per la conversione ai logaritmi decimali si ottiene
(23)
Alla temperatura di 25 degC (29815 K) la legge di Nernst assume la sua forma piugravenota e usata
+ (24)
Per esempio per la semireazione
Cu2+ + 2endash Cu
la legge di Nernst (a 25 degC) assume la forma
+
La costante di Faradayequivale alla caricaelettrica di un numerodi Avogadro (cioegrave diuna mole) di elettroniUna mole contiene602214076 times 1023
entitagrave elementari(gtpag 457)
La fugacitagrave egrave la grandezzafisica adottata per i gas alposto della pressione alloscopo di tener conto delloro comportamento nonideale
ln = 23026 log
10
2 Potenziometria
In questa equazione non compare la concentrazione della forma ridotta percheacutelrsquoattivitagrave di una specie chimica pura nelle condizioni standard viene convenzio-nalmente assunta uguale a 1
In effetti spesso si lavora con soluzioni non particolarmente diluite quindi neicalcoli bisogna fare riferimento alle attivitagrave invece che alle concentrazioni di con-seguenza lrsquoequazione (24) diventa
+ log
IL POTENZIALE FORMALEAPPROFONDIMENTO
13 Polarizzazione degli elettrodiIn tutti i casi in cui il sistema dellrsquoelettrodo si discosti dalle condizioni di equilibriotermodinamico la legge di Nernst diventa inadeguata a descrivere il sistema stessoCiograve accade per esempio quando allrsquoelettrodo viene imposto un potenziale arbitra-rio eo la corrente che lo attraversa egrave molto intensa in questi casi il potenziale dielettrodo risulta diverso da quello previsto in base alla legge di Nernst e si dice chelrsquoelettrodo egrave polarizzato
In particolare quando la concentrazione degli ioni alla superficie di un elettrodoegrave diversa da quella nel resto della soluzione si verifica una polarizzazione di con-centrazione in quanto il sistema non si trova nelle condizioni di equilibrio cui fariferimento il modello di Nernst
La polarizzazione puograve derivare anche dal cambiamento dello stato chimico eofisico della superficie di elettrodo oppure dal verificarsi di reazioni chimiche colla-terali alla reazione di elettrodo
LEGGE DI NERNST E GRANDEZZE TERMODINAMICHE COLLEGATEAPPROFONDIMENTO
CELLE GALVANICHE O PILESe si collegano elettricamente fra loro due semicelle (elettrodi) si realizza un dispo-sitivo che puograve erogare corrente si tratta di una cella galvanica (o pila fig 22)
In una pila le due semicelle sono separate da un setto poroso o da un ponte salinoche hanno il solo compito di assicurare il contatto elettrico evitando il rapido me-scolamento delle soluzioni Secondo le caratteristiche dei singoli elettrodi ai duecapi della pila si crea una differenza di potenziale (ddp) detta anche tensione (opotenziale) di cella che quando raggiunge il suo valore massimo egrave detta forzaelettromotrice (abbreviata fem e indicata con il simbolo E) tutti questi terminiindicano che la pila puograve compiere un lavoro (elettrico)
Dal punto di vista fisico la fem di una pila corrisponde al lavoro massimo cheessa puograve fornire In altri termini la fem equivale al lavoro per unitagrave di carica ne-cessario per mantenere costante la ddp fra i due elettrodi
La fem coincide con la ddp solo nel caso in cui il sistema lavori in condizionidi reversibilitagrave termodinamica (ovvero a corrente nulla) In un circuito chiuso in-
Il termine polarizzazionesoprattutto nelleapplicazioni viene spessousato in modo fin troppogenerico per definiresituazioni poco chiare peresempio nellrsquoindustriagalvanica si parla spesso dipolarizzazione quando ilprocesso produttivo nonsegue lrsquoandamento previstoanche se le vere cause sonotutte da definire
2
La fem viene misurata acircuito aperto (ossia incondizioni di equilibrio acorrente nulla) e conterminali di platinomediante un potenziometroo un voltmetro elettronico
Se le soluzioni simescolassero ben prestosi verificherebberoreazioni chimiche direttelaquoindesiderateraquo (peresempio fra elettrodi esoluzione) con rapidoesaurimento del sistema(pila Daniell gtparagrafo24) e sviluppo di calore
11
CELLE GALVANICHE O PILE
vece dove la corrente circola (e non egrave nulla) la ddp in uscita dalla pila egrave sempreminore della fem a causa della laquocaduta di tensioneraquo provocata dal passaggio dicorrente Vale infatti con buona approssimazione la relazione
ddp= fem ndash Ri
dove bull R egrave la resistenza del circuito bull i lrsquointensitagrave di corrente
Per esempio se si collegauna comune pila da 45 Va una lampadina e simisura la ddp ai capi delcircuito si ottiene unvalore piugrave basso (peresempio 33 V)Il valore nominale ditensione sullrsquoinvolucrodella pila infatti indica lafem non la ddp inuscita (che dipende dallaquocaricoraquo effettivo delcircuito)
Figura 22Cella galvanica (pila) Il setto poroso divide (pur mantenen-doli in contatto elettrico fra loro) i due comparti del recipien-te che costituiscono le due semicelle Queste possono con-tenere due diversi elettroliti oppure lo stesso elettrolita maa diversa concentrazione in modo che allrsquoinizio i potenzialisiano diversi Nel primo caso le due lamine sono in generedi metalli differenti nel secondo caso sono uguali fra loroIl circuito esterno egrave formato da conduttori di prima specie ecomprende il dispositivo per la misura della tensione dellapila la corrente (i) e gli elettroni (e-) percorrono il circuito indirezioni opposte
Lrsquoelettrodo piugrave ricco di elettroni cioegrave a potenziale minore egrave detto anodo e costitu-isce il polo negativo della pila mentre lrsquoelettrodo piugrave povero di elettroni cioegrave a po-tenziale maggiore egrave detto catodo e costituisce il polo positivo Attraverso il circuitoesterno lrsquoanodo tende a cedere elettroni al catodo sotto la laquospintaraquo della spontaneatendenza del sistema a eguagliare i potenziali delle due semicelle
Il flusso di elettroni dallrsquoanodo al catodo altera quindi lo stato drsquoequilibrio ini-ziale di ciascuna semicella esso puograve venire ripristinato mediante reazioni di ossida-zione allrsquoanodo e contemporaneamente mediante reazioni di riduzione al catodoInfatti in base alla legge di Nernst (gtparagrafo 12) le reazioni di ossidazione tendo-no a innalzare il potenziale di elettrodo percheacute aumenta la concentrazione dellaforma ossidata (al numeratore dellrsquoargomento logaritmico) viceversa le reazioni diriduzione tendono ad abbassarlo La corrente che si stabilisce nel circuito egrave dovutaalla tendenza spontanea del sistema a raggiungere lrsquoequilibrio termodinamico per-ciograve quando i potenziali dei due elettrodi diventano uguali il flusso di elettronicessa e si dice che la pila egrave laquoscaricaraquo
La pila quindi egrave un dispositivo mediante il quale gli elettroni in gioco in unareazione redox passano attraverso un circuito da una specie chimica a unrsquoaltraOssidante e riducente infatti non vengono posti direttamente a contatto cosiccheacute glielettroni che si scambierebbero sono laquocostrettiraquo a passare attraverso il circuitoesterno Ciograve consente di convertire in energia elettrica e quindi in lavoro lrsquoenergiache si libera in un processo redox spontaneo che genererebbe calore il flusso di
12
2 Potenziometria
corrente si arresta quando egrave soddisfatta la costante di equilibrio della reazione chegenera la pila
Per ragioni storiche il funzionamento delle pile egrave stato spiegato in termini di unflusso di corrente elettrica dovuto a inesistenti cariche elettriche positive che migra-no dal polo a potenziale maggiore (catodo) verso il polo a potenziale minore (ano-do) Per questo motivo il verso convenzionale della corrente elettrica egrave opposto aquello in cui effettivamente circolano gli elettroni
21 Potenziali standard di ossidoriduzioneIn linea di principio per misurare la ddp fra una lamina di metallo e la soluzionein cui egrave immersa (si veda la figura 21a) occorre inserire il dispositivo di misura inmodo che un terminale sia collegato al metallo e lrsquoaltro alla soluzione In questomodo tuttavia si crea un nuovo contatto metallosoluzione e lo strumento finiscecol misurare la ddp fra i due metalli senza dare informazioni sul valore del poten-ziale di ciascuno di essi Quindi il potenziale assoluto di un singolo elettrodo o diuna coppia redox (che egrave la stessa cosa) non puograve essere misurato Si egrave costretti perciogravea effettuare una misura relativa dei potenziali ponendo a confronto due semicellela semicella di cui si vuole misurare il potenziale e una semicella di riferimento co-struita in modo da assumere un potenziale costante
In pratica lrsquoelettrodo di cui si vuole misurare il potenziale viene accoppiato a unelettrodo di riferimento e si misura la ddp di questa pila in condizioni precisamentedefinite
In base a criteri di opportunitagrave pratica e a considerazioni termodinamiche si egravescelto come elettrodo di riferimento il cosiddetto elettrodo standard a idrogeno(SHE Standard Hydrogen Electrode) A tale elettrodo (fig 23) viene assegnato perconvenzione un potenziale di semicella di 00000 V valido a tutte le temperatureper una soluzione che contiene ioni idrogeno ad attivitagrave unitaria e idrogeno gassosoa fugacitagrave unitaria (in pratica alla pressione parziale di 1 bar)
Nella prima fasedi sviluppodellrsquoelettrochimica siparlava anche di elettrodonormale a idrogeno(NHE Normal HydrogenElectrode) riferendosi a unelettrodo di platinoimmerso in una soluzione1 N di un acido forte inquesta soluzione perogravelrsquoattivitagrave del protone egravecirca 08 e quindi ilpotenziale realedellrsquoelettrodo egrave ben diversoda zero Per questo motivonon egrave corretto usare lasigla NHE per indicare ilriferimento standard[Fonte RW RametteJ Chem Ed vol 64 10(ott 1987)]
Figura 23Elettrodo a idrogeno secondo la realizzazione ideata da SPLSoslashrensen Nel gorgogliatore entra idrogeno gassoso purissi-mo che attraversa la soluzione acida e lambisce la lamina diplatino platinato prima di uscire dal secondo gorgogliatore Idue gorgogliatori e lrsquoampolla centrale contengono la stessasoluzione acida La lamina di platino egrave saldata a un filo di plati-no che fuoriesce dal tappo e assicura il collegamento elettricocon lo strumento di misura Il rubinetto e il sifone mettono incontatto la soluzione acida con lrsquoaltro elettrodo formando cosigraveuna pila Quando lrsquoattivitagrave di H+ e la fugacitagrave di H2 sono unitarielrsquoelettrodo egrave in condizioni standard
13
CELLE GALVANICHE O PILE
Le tabelle dei potenziali standard di ossidoriduzione riportano appunto i po-tenziali di coppie redox ad attivitagrave unitaria misurati rispetto allo SHE (a 25 degC) Sele reazioni sono scritte secondo le convenzioni IUPAC cioegrave nel senso della ridu-zione (elettroni a sinistra) egrave piugrave preciso parlare di potenziali standard di riduzione(tab 21) Nelle tabelle le coppie con potenziale positivo sono tendenzialmentepiugrave ossidanti della coppia H+H2 mentre le coppie con potenziale negativo sono piugraveriducenti
In generale per due coppie qualsiasi quella con potenziale standard maggiore egraveossidante (nelle condizioni imposte) nei confronti della coppia con potenziale stan-dard minore Per esempio se si immerge un foglio di alluminio in una soluzionecontenente solfato di rame e solfato di alluminio (ad attivitagrave unitaria) il foglio di
TABELLA 21 | Alcuni potenziali standard di riduzione (Edeg) misurati a 25 degC
Semireazione Edeg(V) Semireazione Edeg(V)
O H e O H O3 2 22 2+ + ++ minus 2076 Cu e Cu s2
2+ minus+ ( ) 0342
S O e SO2 82
422 2minus minus minus+ 2010 Hg Cl s e Hg Cl2 2 2 2 2( )+ +minus minus
0268
H O H e H O2 2 22 2 2+ ++ minus 1776 AgCl s e Ag Cl( )+ +minus minus
0222
MnO H e MnO s H O4 2 24 3 2minus + minus+ + + ( ) 1679 Cu e Cu2+ minus ++ 0153
Ce e Ce4 3+ minus ++ 172 Sn e Sn in HCl M4 22 1+ minus ++ ( ) 0151
MnO H e Mn H O42
28 5 4minus + minus ++ + + 1507 S H e H S g+ ++ minus2 2 2 ( ) 0142
PbO H e Pb H O22
24 2 2+ + ++ minus + 1455 S O e S O4 6
22 3
22 2minus minus minus+ 008
Cl e Cl2 2 2+ minus minus 1358 AgBr s e Ag Br( )+ +minus minus
0071
Cr O H e Cr H O2 72 3
214 6 2 7minus + minus ++ + + 1350 2H ++ 2e-H2 00000
O g H e H O2 24 4 2( )+ ++ minus 1229 Pb e Pb2
2+ minus+ ndash0126
2 12 10 63 2 2IO H e I H Ominus + minus+ + + 1195 Sn e Sn22
+ minus+ ndash0137
Br l e Br2 2 2( )+ minus minus 1066 Ni e Ni2
2+ minus+ ndash0257
NO H e HNO H O3 2 23 2minus + minus+ + + 0934 Co e Co22
+ minus+ ndash0282
2 22
2
2Hg e Hg+ minus ++ 0920 Fe e Fe22
+ minus+ ndash0447
Cu I e CuI2+ minus minus+ + 086 Zn e Zn22
+ minus+ ndash0762
Ag e Ag+ minus+ 0799 Mn e Mn22
+ minus+ ndash1185
Hg e Hg2
22 2
+ minus+ 0797 Al e Al33
+ minus+ ndash1662
Fe e Fe3 2+ minus ++ 0771 Mg e Mg22
+ minus+ ndash2372
O g H e H O2 2 22 2( )+ ++ minus 0695 Na e Na+ minus+ ndash2710
I e I3 2 3minus minus minus+ 0536 Ca e Ca22
+ minus+ ndash2868
I e I2 2 2+ minus minus 0535 K e K+ minus+ ndash2931
Cu e Cu+ minus+ 0521 Li e Li+ minus+ ndash3040
Fe CN e Fe CN( ) ( )63
64minus minus minus+ 0358
14
2 Potenziometria
alluminio si dissolve mentre si deposita rame metallico Infatti i potenziali stan-dard delle due coppie redox sono
Cu2+ + 2endash Cu Edeg= +034 V
Al3+ + 3endash Al Edeg= ndash166 V
Nella soluzione quindi lo ione Cu2+ (forma ossidata della coppia con potenzialemaggiore) tende a ossidare Al (forma ridotta della coppia con potenziale minore)
TABELLA DEI POTENZIALI STANDARD DI RIDUZIONEAPPROFONDIMENTO
22 Tensione pratica (ddp) di una pila
Lrsquoinsieme dei conduttori di prima e di seconda specie che in sequenza opportunaformano una pila (o in generale un sistema elettrochimico) costituisce una catenagalvanica La differenza di potenziale (Ecella) che si misura ai capi di una pila durantelrsquoerogazione di corrente egrave dovuta a diversi contributi piugrave precisamente egrave uguale allasomma algebrica di tutte le cadute di tensione che si verificano lungo lrsquointero circuito
Ecella= E1 + E2 + E3 + E4 + E5 (25)
dove bull E1 egrave la ddp dovuta allrsquoeventuale passaggio di corrente nel circuito (cadutaohmica) bull E2 la ddp di contatto metallometallo (tensione di Volta) bull E3 la ddpdi contatto soluzionesoluzione (tensione o potenziale di giunzione liquida) bull E4 edE5 le ddp di contatto metallosoluzione (tensione di Nernst) per ciascun elettrodo
Esaminiamo ora il significato dei singoli contributi
Caduta ohmica Quando la cella egrave attraversata da corrente inevitabilmente si ve-rifica una caduta di tensione E = R times i (prima legge di Ohm) Ovviamente se lamisura del potenziale di cella viene effettuata in condizioni tali da minimizzareo eliminare il passaggio di corrente (cioegrave a circuito aperto) la caduta ohmica siannulla (cioegrave E1= 0)
Tensione di Volta Quando due diversi metalli vengono posti a contatto si generasempre una ddp Questo fenomeno detto effetto Volta egrave dovuto al fatto che glielettroni di conduzione sono trattenuti con diversa energia dai diversi metalli Per-ciograve il contatto fra due metalli provoca un trasferimento di elettroni istantaneo daparte del metallo che li trattiene con minore energia Il processo perograve non prose-gue indefinitamente il trasferimento di elettroni infatti prosegue fino allrsquoequili-brio quando insorge una ddp (in genere di pochi millivolt) sufficiente a bloccarlo
Si puograve verificare sperimentalmente (e dimostrare) che la ddp agli estremi diuna catena di conduttori di prima specie egrave uguale a quella che si stabilisce se i duemetalli che ne costituiscono gli estremi vengono posti a diretto contatto (fig 24)Di conseguenza se gli ingressi del misuratore di tensione sono costituiti dallo stessometallo lrsquoeffetto Volta complessivo egrave nullo (E2= 0)
In altri termini la formaossidata della coppia conpotenziale piugrave alto egraveossidante nei confrontidella forma ridotta dellacoppia con potenzialepiugrave basso
A rigore si dovrebbe usareil simbolo V (o ∆V)percheacute si tratta di unaddp misurata in una pilain funzione e dunquenon di una fem Il pedicelaquocellaraquo puntualizza che sitratta in generale di unacella elettrochimica
R egrave la resistenza delconduttore e i lrsquointensitagravedi corrente
15
CELLE GALVANICHE O PILE
Potenziale di giunzione liquida In una pila le due semicelle sono separate matenute in contatto elettrico mediante un setto poroso o un ponte salino che con-sente un mescolamento lentissimo (praticamente nullo) delle soluzioni Questidispositivi (si veda la figura 25) perograve creano unrsquoulteriore caduta di tensione fragli elettrodi detta potenziale di giunzione liquida (Eg) o anche potenziale dicontatto (o di diffusione) Il potenziale di giunzione liquida puograve essere sia po-sitivo sia negativo e quindi fa aumentare o viceversa diminuire la ddp fra glielettrodi
Lrsquoinsorgere di un potenziale di giunzione egrave causato dal fatto che gli ioni si dif-fondono con diversa mobilitagrave attraverso le superfici di contatto di due mezzi di-versi un setto poroso per esempio egrave diversamente permeabile agli ioni propriosecondo la loro mobilitagrave
Tensione di Nernst I potenziali di contatto metallosoluzione (E4 E5) si calco-lano in teoria mediante la legge di Nernst e perciograve sono detti potenziali nern-stiani
LA MOBILITAgrave DEGLI IONI IN SOLUZIONEAPPROFONDIMENTO
23 Calcolo della tensione teorica (fem) di una pilaSe si opera in modo da rendere trascurabili i primi tre termini dellrsquoequazione (22)la ddp ai capi della pila coincide in pratica con la sua fem che puograve essere cal-colata semplicemente in base agli ultimi due termini cioegrave ai potenziali di elettrodoNei calcoli occorre tenere presente che
a la fem di una pila in quanto strettamente collegata al lavoro da essa compiutodeve necessariamente avere segno positivo
b lrsquoelettrodo a potenziale maggiore su cui avviene la riduzione egrave il catodo lrsquoelet-trodo a potenziale minore su cui avviene lrsquoossidazione egrave lrsquoanodo
Di conseguenza la fem di una pila cioegrave di una cella elettrochimica ottenuta colle-gando due semicelle (catodica e anodica) egrave espressa dalla seguente relazione
Ecella = Ec ndash Ea (26)
ovvero
Ecella = Emaggiore ndash Eminore (27)
Questa seconda scrittura mostra chiaramente che la fem della pila egrave sempre posi-tiva anche nel caso in cui i potenziali delle due semicelle siano entrambi negativi
Indichiamo con Ec ilpotenziale del catodo (opotenziale catodico) econ Ea il potenzialedellrsquoanodo (o potenzialeanodico)
Figura 24Nonostante ogni superficie di contatto fra due metallisia sede di una ddp dovuta allrsquoeffetto Volta la ddpche si instaura fra rame e zinco egrave la stessa sia nel caso(a) sia nel caso (b) Infatti se cosigrave non fosse chiudendola catena aperta (a) si dovrebbe osservare un passaggiodi corrente e questo in realtagrave non avviene
a b
16
2 Potenziometria
ESEMPIO 1UNA IPOTETICA PILA Egrave COSTITUITA DALLE COPPIE REDOX Al3+Al E Ni2+NiQUAL Egrave LA FEM DELLA PILA SE LE ATTIVITAgrave DI TUTTE LE SPECIE IONICHE SONOUNITARIE
Dal momento che le attivitagrave sono unitarie il calcolo fornisce la tensione (o forzaelettromotrice) standard della pila
Innanzitutto dalla tabella dei potenziali standard si ricavano i potenziali stan-dard per ciascuna coppia redox
Al3+ + 3endash Al Eo
= ndash166 V
Ni2+ + 2endash Ni Eo
= ndash026 V
Lrsquoelettrodo della coppia Ni2+Ni costituisce il catodo percheacute ha il potenziale mag-giore mentre lrsquoelettrodo della coppia Al3+Al costituisce lrsquoanodo percheacute ha il poten-ziale minore Si puograve anche costruire un diagramma di questo tipo
Al3+Al Ni2+Ni H+H2
ndash166 ndash026 00000 Edeg(V rif a SHE)
Quindi la fem della pila in condizioni standard egrave
Ecella= Ec ndash Ea= Emaggiore ndash Eminore= ndash026 ndash (ndash166)= +140 V
La reazione di ossidoriduzione che genera la pila si ottiene formalmente combi-nando le due semireazioni bilanciate quella di riduzione al catodo e quella di os-sidazione allrsquoanodo Ciascuna semireazione deve essere moltiplicata per un fattorenumerico tale che il numero di elettroni ceduti dalla specie che si ossida sia uguale aquello degli elettroni acquistati dalla specie che si riduce Quindi nel caso dellrsquoesem-pio proposto si moltiplica la semireazione della coppia Al3+Al per 2 e quella dellacoppia Ni2+Ni per 3
2 middot (Al Al3+ + 3endash) Edeg= ndash(ndash166 V) (ndash)
3 middot (Ni2+ + 2endash Ni) Edeg= ndash026 V (+)
2Al + 3Ni2+ 2Al3+ + 3Ni Edeg= +140 V
Attenzione per ottenere il bilancio della reazione di cella si moltiplica per un coeffi-ciente opportuno ciascuna semireazione ma non il rispettivo potenziale Infatti i po-tenziali di elettrodo (e quindi anche il potenziale di cella) esprimono un lavoro elettricoper unitagrave di carica e perciograve sono proprietagrave intensive che non dipendono dalla quantitagravedi materia contenuta nel sistema ovvero dal numero di cariche elettriche trasportate
Se le attivitagrave non sono unitarie per calcolare il potenziale di elettrodo occorreapplicare lrsquoequazione di Nernst
Egrave ovvio comunque che il lavoro complessivo che puograve essere fornito da una piladipende anche dalla massa e dalla geometria degli elettrodi Per questo motivo unapila o un insieme di pile (cioegrave una batteria) che viene utilizzata per esempio permuovere un veicolo puograve avere dimensioni ingombranti Questo accadeva fino anon molti anni fa per le vecchie batterie al piombo ora sempre piugrave sostituite dabatterie come quelle al litio decisamente piugrave compatte e che infatti stanno rendendopossibile il progressivo passaggio allrsquoauto parzialmente o completamente elettrica
UNA IPOTETICA PILA Egrave COSTITUITA DALLE COPPIE REDOX Al3+Al E Ni2+NiQUAL Egrave LA FEM DELLA PILA SE LE ATTIVITAgrave DI TUTTE LE SPECIE IONICHE SONOUNITARIE
Nella pila la reazionedella coppiadella coppia Ni2+Ni(Ni2+ si riduce) avvienenel senso conforme allaconvenzione adottata per ipotenziali (elettroni asinistra) invece lareazione della coppiaAl3+Al (Al si ossida)avviene nel senso oppostoa quello convenzionalePerciograve il potenziale Edegdella coppia Al3+Al vieneconsiderato con segnoopposto a quello tabulato(+166 V) Se si sommaalgebricamente ilpotenziale dellrsquoelettrodoche si riduce (Ec) conquello dellrsquoelettrodo che siossida cambiato di segno(Ea) la tensione della pilarisulta positiva
17
CELLE GALVANICHE O PILE
ESEMPIO 2UNA IPOTETICA PILA Egrave COSTITUITA DALLE COPPIE REDOX Al3+Al E Ni2+NiQUAL Egrave LA FEM DELLA PILA A 25 degC SE LE CONCENTRAZIONI DELLE SPECIEIONICHE SONO RISPETTIVAMENTE [Al3+] = 2 10ndash2 M E [Ni2+] = 10ndash2 M
Approssimando le attivitagrave con le concentrazioni si ottiene
La situazione non egrave sostanzialmente cambiata rispetto alle condizioni standardpercheacute anche in questo caso la reazione di cella comporta lrsquoossidazione dellrsquoallumi-nio e la riduzione del nichel La fem della pila quindi egrave
Ecella= Ec ndash Ea= ndash032 ndash (ndash167)= +135 V
24 Alcuni tipi di pile
Pila DaniellUna semicella egrave costituita da una lamina di rame immersa in una soluzione diCuSO4 lrsquoaltra semicella da una lamina di zinco immersa in una soluzione di ZnSO4
(fig 25) Le due semicelle sono separate da un setto poroso (in pratica una mem-brana di vetro sinterizzato o analogo materiale inerte) oppure si trovano in duediversi recipienti collegati da un ponte salino
Le reazioni di elettrodo sono
Zn2+ + 2endash Zn Edeg= ndash0762 V
Cu2+ + 2endash Cu Edeg= 0342 V
Le concentrazioni dei sali nelle rispettive semicelle sono in genere tali da renderenegativo il semielemento di zinco che perciograve tende a cedere elettroni al rame (ossi-dandosi) La lamina di zinco egrave dunque il polo negativo (anodo) della pila e il rameegrave il polo positivo (catodo)
La rappresentazione della catena galvanica di questa pila secondo le convenzioniIUPAC egrave
(ndash) Zn(s)|ZnSO4(aq)||CuSO4(aq)|Cu(s) (+)
UNA IPOTETICA PILA Egrave COSTITUITA DALLE COPPIE REDOX Al3+Al E Ni2+NiQUAL Egrave LA FEM DELLA PILA A 25 degC SE LE CONCENTRAZIONI DELLE SPECIEIONICHE SONO RISPETTIVAMENTE [Al3+] = 2 10ndash2 M E [Ni2+] = 10ndash2 M
Si noti che se i duescomparti non fosseroscomparti non fosseroben separati dal settoben separati dal settoporoso ben presto gli ioniporoso ben presto gli ionirame disponibilirame disponibiliraggiungerebbero lrsquoraggiungerebbero lrsquoanododi zinco ossidandolo eandando a depositarsi sudi esso come Cumetallico nondiversamente da quanto sipuograve osservareimmergendo una barrettadi zinco in una soluzionedi solfato di rameesaurendo quindirapidamente la pila esviluppando calore
Figura 25Pila Daniell (a) con settoporoso e (b) con pontesalino
a b
18
2 Potenziometria
La coppia di barrette verticali (||) al centro rappresenta il setto poroso o il pontesalino che separano le due semicelle lrsquoanodo egrave scritto a sinistra e per ciascun elet-trodo la forma ridotta della coppia redox egrave scritta verso lrsquoesterno Le lettere scrittefra parentesi indicano lo stato fisico di ogni specie chimica
La reazione di cella egrave
Zn + Cu2+ Zn2+ + Cu
Per calcolare la fem teorica di questa pila che puograve anche trovarsi in condizionidiverse da quelle standard si applica la legge di Nernst a ciascuna semicella
(28)
(29)
I potenziali standard delle due semicelle sono cosigrave diversi fra loro che nelle normalicondizioni operative di una pila Daniell il rame rappresenta il polo positivo e lozinco il polo negativo
Sottraendo il potenziale minore da quello maggiore si ottiene il potenziale dicella
Ecella = ECu2+Cu - EZn2+Zn
Ponendo Edegcella = EdegCu2+Cu ndash EdegZn2+Zn (= 0342 V + 0762 V) e quindi sottraendo la(28 dalla 29) si ricava infine
Questa equazione consente dunque di calcolare il potenziale di Nernst se egrave notoil valore effettivo dellrsquoattivitagrave degli ioni Zn2+ e Cu2+ Tuttavia il calcolo si presta aerrori anche significativi lrsquoattivitagrave degli ioni per esempio varia in funzione dellaforza ionica della soluzione e non puograve essere calcolata Perciograve la fem reale piugraveesattamente la ddp che si misura si discosta dal valore calcolato sostanzialmenteper due motivi
a il sistema non si comporta in maniera ideale (per esempio gli elettrodi possonopolarizzarsi)
b il contributo della caduta ohmica (gtequazione 25) puograve essere praticamente an-nullato se nel circuito viene fatta circolare una corrente trascurabile invece ilpotenziale di giunzione liquida per quanto piccolo non puograve essere soppresso enon egrave prevedibile in base a equazioni teoriche
Pile a concentrazioneIn questo tipo di pila le due semicelle contengono due soluzioni di una stessa cop-pia redox ma a diversa concentrazione gli elettrodi sono inerti oppure dello stes-so metallo e le semicelle sono collegate da un setto poroso o da un ponte salino(fig 26)
In questo calcolotrascuriamo i contributidei termini E1 E2 E3 dellaequazione (25)
Lrsquoequazione rappresentain pratica la legge diNernst applicata allareazione redox globalescritta nel verso dellaspontaneitagrave tenendoconto degli elettroniscambiati (2) e inserendonellrsquoargomento dellogaritmo lrsquoinverso delquoziente di reazione
+
19
CELLE GALVANICHE O PILE
Le due soluzioni si scambiano elettroni attraverso il circuito esterno mentre ilsetto poroso (o il ponte salino) che le collega consente il passaggio di ioni e quin-di chiude il circuito Il sistema raggiunge lrsquoequilibrio quando le attivitagrave degli ioninelle due semicelle diventano uguali perciograve egrave prevedibile che nella soluzione piugravediluita avvenga lrsquoossidazione il rame metallico si dissolve e si formano ioni Cu2+ insoluzione questo dunque egrave lrsquoanodo Contemporaneamente gli elettroni passanonellrsquoaltro comparto (a destra in figura 26) attraverso il circuito esterno e riduconogli ioni Cu2+ che si depositano sullrsquoelettrodo come rame metallico questo dunqueegrave il catodo
In pratica egrave come se gli ioni Cu2+ si trasferissero dalla soluzione piugrave concentrataalla soluzione piugrave diluita Queste pile dunque trasformano in lavoro elettrico lrsquoe-nergia che si libera nel processo spontaneo con cui due soluzioni a diretto contattotendono a raggiungere lrsquoequilibrio di concentrazione
La rappresentazione convenzionale della catena elettrodica di questa pila a con-centrazione egrave la seguente
(-) Cu(s) |Cu2+(001 M)||Cu2+(1 M)|Cu(s) (+)
Per calcolare la tensione teorica della pila si applica la legge di Nernst a ciascun elet-trodo Approssimando le attivitagrave con le concentrazioni (a 25 degC) si ottiene
(soluzione piugrave diluita anodo)
(soluzione piugrave concentrata catodo)
Quindi
Ecella= Emaggiore ndash Eminore= 0342- 0283= 0059 V
ALTRI TIPI DI CELLE GALVANICHE O PILEAPPROFONDIMENTO
Figura 26Pila a concentrazione il compartoanodico (a sinistra) contiene ioni Cu2+
in concentrazione 001 M e il com-parto catodico (a destra) contieneioni Cu2+ in concentrazione 1 M Ilcollegamento fra le due semicelle egraverealizzato con un ponte salino
20
2 Potenziometria
STRUMENTAZIONEIn potenziometria si misura la differenza di potenziale che si stabilisce fra due semi-celle allo scopo di determinare la concentrazione di uno ione o per seguire lrsquoanda-mento di una titolazione
Il dispositivo completo per una misura potenziometrica (fig 27) consiste es-senzialmente di
bull un potenziometro o meglio un millivoltmetro elettronicobull un elettrodo di riferimentobull un elettrodo di misura
Il potenziometro serve per misurare la ddp fra i due elettrodi senza alterare il lorostato di equilibrio perciograve si lavora a corrente praticamente nulla
Gli elettrodi collegati al potenziometro sono immersi nella soluzione su cui sieffettuano le misure Lrsquoelettrodo di riferimento egrave costruito in modo tale da mante-nere costante il suo potenziale di conseguenza ogni variazione di ddp misurata egraveimputabile esclusivamente allrsquoelettrodo di misura (piugrave precisamente alla soluzioneanalizzata)
ELETTRODI DI RIFERIMENTOLrsquoelettrodo standard a idrogeno (SHE gtparagrafo 21) egrave lrsquoelettrodo di riferimentoprimario Tuttavia nella pratica quotidiana di laboratorio si usano elettrodi di ri-ferimento secondari piugrave semplici e maneggevoli che hanno comunque la proprie-tagrave di mantenere il proprio potenziale costante a temperatura costante Tratteremoora in maggior dettaglio gli elettrodi di uso piugrave comune
31 Elettrodo ad argentocloruro drsquoargento
Si tratta senzrsquoaltro dellrsquoelettrodo piugrave diffuso Il dispositivo egrave costituito da un sem-plice filo drsquoargento rivestito di AgCl e immerso in una soluzione di KCl (egrave dunqueun elettrodo di seconda specie) Il tutto egrave contenuto in un tubicino di vetro dotatodi setto poroso per assicurare il contatto elettrico con lrsquoesterno ovvero con la so-luzione in cui viene immerso lrsquooggetto dellrsquoanalisi
Figura 27Rappresentazione schematica deldispositivo completo per misurepotenziometriche
3
21
ELETTRODI DI RIFERIMENTO
La rappresentazione convenzionale dellrsquoelettrodo (fig 28) egrave
Ag(s)|AgCl(aq)|KCl(aq)
La reazione di elettrodo egrave
AgCl + endash Ag + Clndash
E il potenziale di elettrodo
E= EdegAgClAg
Considerando unitarie le attivitagrave dei solidi puri si ottiene
E= EdegAgClAg ndash 01984 10ndash3 T log[Clndash] (210)
Se lrsquoattivitagrave degli ioni cloruro egrave costante (a temperatura costante) il potenziale dielettrodo rimane costante Gli elettrodi piugrave comuni contengono soluzioni sature diKCl (circa 42 M) e perciograve sono detti saturi (SSC Saturated Silver-Silver ChlorideElectrode) A 25 degC il potenziale di SSC vale 0197 V Questo elettrodo puograve essereusato fino a 105 degC Nella tabella 1 ndash lab 1 (gtpag 39) sono riportati i potenziali alvariare della temperatura per lrsquoelettrodo saturo e 3 M
Gli anioni (come il solfuro) che formano con Ag+ sali meno solubili di AgClpossono danneggiare questo tipo di elettrodo Anche gli ossidanti e i riducenti fortie gli agenti complessanti possono interferire con la reazione di elettrodo per proteg-gere lrsquoelettrodo da queste sostanze si usa un elettrolita intermedio come nel casodellrsquoelettrodo a calomelano saturo (SCE gtparagrafo 32)
Gli elettrodi ad argentocloruro di argento sono usati come riferimento internonegli elettrodi a vetro (gtparagrafo 41)
32 Elettrodo a calomelano
laquoCalomelanoraquo egrave il nome comune del cloruro mercuroso (I) Hg2Cl2 che fa parteappunto di questo elettrodo (fig 29a) La rappresentazione convenzionale dellrsquoe-lettrodo egrave
Hg(l)|Hg2Cl2(s)|KCl(aq)
La reazione di elettrodo egrave
Hg2Cl2 + 2endash 2Hg + 2Clndash
e il potenziale di elettrodo in base alla legge di Nernst
In condizioni standard lrsquoattivitagrave di solidi e liquidi puri egrave considerata uguale a 1quindi
da cui
ndash 01984 10ndash3 T log|Clndash| (211)
Sono anche molto diffusigli elettrodi contenentiKCl 3 M cioegrave quasisaturi Il vantaggio egrave chein queste soluzioni non siformano cristalli di KClche possono danneggiarelrsquoelettrodo ostruendoil setto poroso che sta sulfondo
Figura 28Elettrodo ad AgAgCILa soluzione tamponeinterna contiene ioni K+
e CIndash ad attivitagrave costante
22
2 Potenziometria
Il potenziale dellrsquoelettrodo a calomelano dunque dipende solo dallrsquoattivitagrave delloione cloruro e dalla temperatura Se la temperatura egrave costante e lrsquoattivitagrave dello ionecloruro nella soluzione interna allrsquoelettrodo non varia il potenziale rimane costante
Gli elettrodi a calomelano piugrave comuni contengono soluzioni sature di KCl (circa42 M) e perciograve sono detti saturi (SCE Saturated Calomel Electrode) Si usano ancheelettrodi a KCl 1 M e 01 M la tabella 22 riporta il potenziale assunto da questielettrodi secondo la concentrazione di KCl
TABELLA 22 | Potenziale (mV) di alcuni elettrodi di riferimento a 25 degC
AgAgCl Calomelano HgHgO HgHgSO4 Thalamid
KCl 01 M 288 KCl 01 M 334 NaOH 01 M 165 H2SO4 05 M 682 KCl 3 M -567
KCl 1 M 235 KCl 1 M 280 NaOH 1 M 140 K2SO4 sat 650 KCl sat -577
KCl 3 M 210 KCl 35 M 250
KCl 35 M 205 KCl sat 241
KCl sat 199 NaCl sat 236
NaCl 3 M 209
NaCl sat 197
Lrsquoelettrodo a calomelano puograve essere usato fino a circa 70 degC a temperature piugrave alteil calomelano si dismuta (Hg2Cl2 Hg + HgCl2)
I solfuri gli ossidanti i forti riducenti e gli agenti complessanti che formanoamalgami con gli ioni Hg2
2+ possono danneggiare questo tipo di elettrodo Perciogravequando si lavora in presenza di queste sostanze si usano elettrodi a doppia giun-zione (fig 29b) in cui fra lrsquoelettrodo e la soluzione egrave interposto un contenitoreriempito con un elettrolita intermedio (per esempio KNO3)
Va infine segnalata la tendenza a non usare il mercurio per motivi tossicologicie questo spiega il progressivo abbandono nella pratica comune di questo tipo dielettrodo con grande rammarico dagli elettrochimici percheacute lrsquoelettrodo a calomela-no egrave il piugrave stabile
bullELETTRODI DI PRIMA E DI SECONDA SPECIE bullALTRI ELETTRODI DI RIFERIMENTO
APPROFONDIMENTI
Figura 29(a) Elettrodo a calomelano (b) Nella versione adoppia giunzione egrave presente una seconda cameraper lrsquoelettrolita intermedio che viene immessoattraverso la bocchetta laterale il setto porosoassicura il contatto elettrico con la soluzioneesterna
a b

2
1 Metodi elettrochimici
Nei metalli la resistenza aumenta con la temperatura percheacute aumenta lrsquoagitazionetermica degli atomi nel reticolo cristallino che ostacola il flusso di elettroni Neisemiconduttori invece la resistenza diminuisce con lrsquoaumento della temperaturapercheacute in queste sostanze gli elettroni richiedono un apporto di energia per fluireliberamente nel reticolo
bull In un conduttore di seconda specie il passaggio di corrente egrave dovuto allo spo-stamento di ioni i sali fusi le soluzioni elettrolitiche (in cui sono presenti ioniliberi solvatati in varia misura) e alcuni solidi ionici come per esempio AgCl eLaF3 sono conduttori di seconda specie Nei solidi ionici lo spostamento delleparticelle cariche egrave dovuto alla presenza di laquolacuneraquo distribuite in modo casualenel reticolo cristallino che consentono agli ioni di migrare in presenza di uncampo elettrico verso il polo di carica opposta
Per questi conduttori la prima legge di Ohm assume la seguente forma leggermentemodificata
V= R times i + EW (12)
Il termine aggiuntivo (EW) indica la differenza di potenziale laquoin piugraveraquo che egrave neces-sario applicare percheacute nel circuito si stabilisca la corrente i Infatti nei conduttoridi seconda specie egrave presente una forza controelettromotrice (corrispondente a EW)che genera una corrente opposta a i la quale deve essere perciograve controbilanciata
Anche nei conduttori di seconda specie la resistenza elettrica diminuisce conlrsquoaumento di temperatura percheacute tanto maggiore egrave la temperatura tanto maggiore egravelrsquoenergia e quindi la mobilitagrave cioegrave la laquocapacitagrave di muoversiraquo degli ioni in soluzione
Un sistema elettrochimico in sostanza egrave costituito da tre componenti principali( fig 11) un circuito esterno gli elementi sensibili (o elettrodi) e lrsquooggetto di analisi(o analita) che in genere egrave una soluzione elettrolitica
Il circuito esterno egrave lrsquoinsieme di dispositivi (tutti conduttori di prima specie) checonsentono di trasmettere impulsi elettrici alla soluzione in analisi (e quindi allespecie chimiche in essa contenute) eo di ricevere e misurare i segnali che si gene-rano in questrsquoultima Ciograve viene realizzato attraverso opportuni elementi sensibilicostituiti da conduttori di prima specie (o di seconda specie nei casi piugrave complessi)immersi nella soluzione gli elettrodi dunque costituiscono il tramite fra il circuitoesterno e la soluzione in analisi
Egrave necessario chiarire subito che per consuetudine ormai radicata il termineelettrodo puograve assumere in elettrochimica due diversi significati
Figura 11Schema di un sistema per misureelettrochimiche Gli elementi sen-sibili detti elettrodi trasferiscono alsistema oggetto di analisi (in genereuna soluzione) il segnale elettricogenerato dal circuito esterno oppurecomunicano a questrsquoultimo il segnaleproveniente dalla soluzione
3
CLASSIFICAZIONE
a in generale indica il conduttore di prima specie (un filo o una lamina metallicama anche una goccia di mercurio) immerso nella soluzione in esame
b nelle tecniche potenziometriche (gtCapitolo 2) indica invece lrsquointero sistema for-mato dal conduttore metallico e dalla soluzione in cui egrave immerso
Lrsquoinsieme degli elettrodi e della soluzione costituisce la cella elettrochimica I parametrisu cui si opera o che vengono misurati durante unrsquoanalisi di tipo elettrochimico sono
bull potenziale e differenza di potenziale (simbolo V oppure E)
bull intensitagrave di corrente (i)
bull quantitagrave di carica elettrica (q)
bull resistenza (R) oppure conduttanza (L lettera greca laquolambdaraquo maiuscola)
Il preciso significato e lrsquouso di queste grandezze in sede analitica sono trattati nellepagine che seguono per il momento stabiliremo una classificazione dei diversi me-todi di analisi elettrochimica facendo riferimento a questi parametri
CLASSIFICAZIONEIn linea del tutto generale i metodi elettrochimici possono essere classificati in baseallrsquoentitagrave della corrente che fluisce nel sistema nel corso della misura
21 Metodi a corrente zero potenziometriaSi tratta di metodi in cui la misura viene effettuata raccogliendo il segnale prove-niente dalla soluzione mediante gli elettrodi si opera cioegrave in modo laquopassivoraquo ein condizioni di equilibrio turbando il meno possibile lo stato della soluzione inesame
In questo ambito rientra essenzialmente la potenziometria (gtCapitolo 2) ov-vero una serie di tecniche mediante le quali viene misurata la differenza di po-tenziale che si stabilisce tra due elettrodi immersi nella soluzione in analisi I dueelettrodi svolgono diverse funzioni uno (elettrodo di riferimento) mantiene unpotenziale costante lrsquoaltro (elettrodo di misura) si pone in equilibrio con la solu-zione Il potenziale del sistema formato dai due elettrodi dipende dalle concentra-zioni e piugrave rigorosamente dalle attivitagrave delle specie in soluzione e puograve essere ri-cavato in base alla legge di Nernst di cui ci occuperemo in dettaglio nel prossimocapitolo In linea generale per un generico sistema redox
ox + ne red
la legge di Nernst assume la forma seguente
(13)
I simboli V ed E sonotalvolta usatiindifferentemente ma ilsecondo indica a rigorela forza elettromotrice( fem) cioegrave la differenzadi potenziale della cellamisurata a corrente zeroIn alcuni casi egrave preferibileusare i simboliΔV eΔEdove la lettera greca deltamaiuscola (Δ) indica ladifferenza fra due diversivalori di V o Erispettivamente
2
4
1 Metodi elettrochimici
dove bull E egrave il potenziale assunto dallrsquoelettrodo di misura bull Edeg il potenziale standardassunto dallrsquoelettrodo (a 25 degC e 1 bar) quando le forme ossidata e ridotta han-no attivitagrave unitaria e la misura di potenziale viene effettuata rispetto allrsquoelettro-do standard a idrogeno (abbreviato SHE) bull R la costante termodinamica dei gasbull T la temperatura (in kelvin) bull F la costante di Faraday bull n il numero di elettroni(endash) scambiati nella reazione redox bull frac12oxfrac12 e frac12redfrac12 indicano le attivitagrave delle speciescritte fra le due barrette
La misura in genere viene eseguita con un millivoltmetro (o voltmetro elettronico)uno strumento in grado di misurare la differenza di potenziale fra gli elettrodi incondizioni di corrente praticamente nulla
Il valore di E o la sua variazione ΔE sono utili per determinare importanti pa-rametri chimico-fisici (come il pH) o per stabilire il punto di equivalenza nelle ti-tolazioni
22 Metodi a corrente diversa da zeroelettrogravimetria coulombometria voltammetriae conduttimetria
Nellrsquoambito di questi metodi si misura lrsquoentitagrave della corrente che attraversa la cellaquando a essa viene applicata attraverso gli elettrodi una differenza di potenzialefissa o fatta variare in maniera opportuna Si tratta insomma di operare inmodo laquoattivoraquo sul campione turbandone le condizioni di equilibrio in modo daraccogliere la laquorisposta elettricaraquo proveniente da esso
Il fenomeno principale che sta alla base di tutti questi metodi egrave quello dellrsquoelet-trolisi e per questo si parla anche di metodi elettrolitici Ce ne occuperemo ampia-mente nel Capitolo 3
Di seguito riassumiamo i principali metodi elettrolitici
ElettrogravimetriaLrsquoelettrogravimetria (gtCapitolo 4) egrave la piugrave antica tecnica elettrochimica che si basasul fenomeno dellrsquoelettrolisi Due elettrodi opportunamente conformati sono im-mersi nella soluzione in esame a determinati potenziali assunti dagli elettrodi siverifica la scarica (cioegrave lrsquoossidazione su un elettrodo e la riduzione sullrsquoaltro) dellespecie chimiche in analisi che se si depositano sugli elettrodi possono essere poideterminate per via gravimetrica
CoulombometriaIl termine laquocoulombometriaraquo (gtCapitolo 4) deriva da coulomb lrsquounitagrave di misuradella quantitagrave di carica elettrica In questa tecnica si impone unrsquoopportuna diffe-
Ricordiamo che nelSistema Internazionale ilbar (= 105 Pa) hasostituito lrsquoatmosfera(atm)
ATTIVITAgrave DELLE SPECIE IN SOLUZIONEAPPROFONDIMENTO
5
CLASSIFICAZIONE
renza di potenziale fra due elettrodi e si misura la corrente che circola in un deter-minato intervallo di tempo in seguito ai fenomeni di elettrolisi che si verificanoagli elettrodi
La coulombometria si basa sulla legge di Faraday
(14)
dove bull m egrave la massa bull MM la massa molare della specie chimica che si scaricaallrsquoelettrodo bull F la costante di Faraday bull n il numero di elettroni scambiati nellareazione di scarica bull i lrsquointensitagrave di corrente bull t il tempo
VoltammetriaIn voltammetria (gtCapitolo 5) si misura la variazione della corrente (Δi) che passafra gli elettrodi immersi nella soluzione in analisi al variare del potenziale applicatoa uno di essi (elettrodo di lavoro) Lrsquoelettrodo di lavoro puograve essere allo stato solidooppure egrave costituito da una singola goccia di mercurio pendente da un capillare Se lagoccia di mercurio cade ritmicamente dal capillare e quindi viene continuamenterinnovata durante la scansione si parla piugrave propriamente di polarografia
Lrsquoamperometria egrave una variante della tecnica voltammetrica che consente di ef-fettuare titolazioni Il potenziale dellrsquoelettrodo di lavoro viene mantenuto a un va-lore costante tale da garantire il passaggio di corrente la variazione dellrsquointensitagravedi corrente che si ha durante lrsquoaggiunta di titolante consente di individuare il puntodi equivalenza
ConduttimetriaIn conduttimetria (gtCapitolo 6) si misura la conducibilitagrave elettrica (lrsquoinverso dellaresistenza elettrica) della soluzione in analisi Si possono effettuare misure diret-te mediante elettrodi di conformazione adatta che consentono di determinare peresempio il contenuto salino di una soluzione oppure si possono eseguire titola-zioni registrando la variazione di conducibilitagrave dovuta allrsquoaggiunta del titolante Laconduttimetria sfrutta a fini analitici la seconda legge di Ohm che per soluzionielettrolitiche assume la forma
L = cK (15)
dove bull L egrave la conduttanza della soluzione bull c (lettera greca laquochiraquo) la conducibilitagravespecifica della soluzione bull K la costante di cella
mMM
nF= int i t
0
t
d
La massa molare (MM)di un elementomonoatomico di unamolecola di uno ione oradicale corrisponde allamassa di un numero diAvogadro delle particellein questione Essacoincide con la massaatomica o molecolareespressa in gmol
Con questa tecnica sipossono raccogliereinformazioni siaqualitative siaquantitative sulle speciechimiche presenti insoluzione secondo lamodalitagrave con cui queste siscaricano allrsquoelettrodo
Di solito la misura vieneeffettuata in correntealternata per evitarefenomeni indesiderati dielettrolisi Usandocorrente alternata ad altafrequenza si possonodeterminare anche lecostanti dielettriche disistemi liquidi
6
Potenziometria2
TEORIA
ELETTRODI E POTENZIALE DI ELETTRODOConsideriamo un sistema relativamente semplice (fig 21a) costituito da una lami-na metallica (per esempio di rame Cu) immersa in acqua pura o in una soluzionemolto diluita di un suo sale (per esempio il solfato) Un sistema di questo tipo costi-tuisce una semicella (o semielemento o semplicemente elettrodo)
Allrsquoinizio sia il metallo sia la soluzione sono elettricamente neutri quasi imme-diatamente dopo il contatto perograve si verifica uno scambio spontaneo di materia frail metallo e la soluzione piugrave precisamente si verifica un passaggio di ioni Cu2+ insoluzione
1
Se si usa una lamina dirame laquomarcataraquo cioegravecontenente isotopiradioattivi del rame in uncerto tempo anche lasoluzione manifesta unaleggera radioattivitagravequesto dimostra che unaquantitagrave sia pure minimadi rame egrave passata insoluzione sia in formaionica sia elementare Egravestato infatti dimostratoche in soluzione sonopresenti anche cluster diatomi neutri
Figura 21(a) Semplice semicella elettrochi-mica (b) Rappresentazione sem-plificata del doppio strato elettricoche si forma quando il metalloossidandosi cede ioni positivi allasoluzione Le molecole dipolaridellrsquoacqua sono laquoorientateraquo sianella sfera di solvatazione degliioni sia vicino alla superficie delmetallo che ha carica negativa
Si crea cosigrave uno squilibrio elettrico la soluzione assume carica positiva percheacute gliioni solfato non compensano la carica degli ioni Cu2+ passati in soluzione mentrela lamina di rame che ha trattenuto due elettroni per ogni nuovo ione Cu2+ assumecarica elettrica negativa
Si forma perciograve un doppio strato elettrico (fig 21b) cioegrave una separazione dicarica allrsquointerfaccia metallosoluzione che viene descritta come una differenza di
Caricanegativa
Interfacciametallosoluzione
7
ELETTRODI E POTENZIALE DI ELETTRODO
potenziale (abbreviata ddp) fra la lamina di metallo e la soluzione questa ddp egravedetta potenziale di semicella (o potenziale di elettrodo) Nel nostro esempio lalamina di rame assume carica negativa e quindi ha potenziale negativo mentre lasoluzione assume potenziale positivo
Il potenziale di semicella puograve essere espresso indifferentemente come la diffe-renza di potenziale fra il metallo e la soluzione oppure fra la soluzione e il metallosi tratta di una pura convenzione In questo libro seguiremo la convenzione euro-pea adottata a livello internazionale dalla IUPAC (International Union of Pure andApplied Chemistry) nel 1953 in base alla quale
a se si indica con ye il potenziale del metallo (fase solida) e con ys quello dellasoluzione (fase liquida) la ddp egrave uguale a ye ndash ys Quindi nel nostro esempio ilpotenziale di elettrodo egrave negativo
b le reazioni redox associate a una semicella devono essere scritte nel senso dellariduzione
Quindi per lrsquoelettrodo di rame la reazione di semicella egrave scritta nella forma seguente
Cu2+ + 2endash Cu
Il significato chimico-fisico del potenziale (Ve) assunto dallrsquoelettrodo di rame in se-guito al passaggio spontaneo di ioni Cu2+ in soluzione (per effetto di una ossidazione)egrave il seguente esso rappresenta il lavoro (Le) per unitagrave di carica (q) che bisogna com-piere per realizzare il processo non spontaneo opposto cioegrave il deposito di rame sullalamina (per effetto di una riduzione) Poicheacute i fenomeni in gioco sono sia di naturachimica sia elettrica si parla piugrave correttamente di potenziale elettrochimico dellrsquoe-lettrodo
I potenziali elettrochimici dipendono da un insieme di condizioni standard di tem-peratura pressione e concentrazione fissate inizialmente da coloro che per primi se nesono occupati per esempio 298K per la temperatura e 1 bar per la pressione
Lo stato standard egrave
bull per i solidi il solido purobull per i solventi il solvente purobull per i soluti una soluzione 1 Mbull per i gas il gas puro alla pressione di 1 bar
Il tutto assumendo un comportamento ideale per ogni sistema
In linguaggio matematico
VL
qe
e=
Ovviamente queste considerazioni sono valide anche per il caso in cui la reazionedi riduzione egrave il processo che avviene spontaneamente Ciograve si verifica per esempioquando la soluzione ha una concentrazione di ioni Cu2+ cosigrave elevata che lrsquoeffetto nettodegli scambi metallosoluzione consiste nel trasferimento di ioni sul metallo che per-ciograve acquista una carica positiva e quindi un potenziale positivo rispetto alla soluzioneEsiste anche unrsquounica concentrazione di ioni Cu2+ per la quale non si verifica scam-
Il termine elettrodo chein potenziometria siriferisce allrsquointero sistemametallosoluzione spessoviene riferito alla sola fasesolida (la laminametallica) seguendo cosigravela consuetudine in usonelle tecnicheelettrolitiche
Il lavoro necessario perdepositare uno ione sullalamina riducendolo egrave ditipo sia elettrico (neiconfronti delle forze delcampo elettrostaticogenerato dallrsquoelettrodo)sia elettrico di superficie(per superare il doppiostrato di cariche) siachimico (percheacute nelprocesso di riduzione delloione sul metallointervengono forze dinatura chimica)
8
2 Potenziometria
bio apparente di materia fra il metallo e la soluzione a questa concentrazione le duereazioni opposte (riduzione e ossidazione) procedono alla stessa velocitagrave e il sistemasi trova in uno stato di equilibrio termodinamico fin dallrsquoistante in cui il metalloviene immerso in soluzione
LA FISICA DEI SISTEMI ELETTROCHIMICIAPPROFONDIMENTO
11 Classificazione degli elettrodiUn metallo immerso in una soluzione dei suoi ioni costituisce un elettrodo di pri-ma specie il cui potenziale dipende dalla concentrazione (piugrave precisamente dallrsquoat-tivitagrave) degli ioni in soluzione
Quando invece il metallo si trova in equilibrio con la soluzione di un suo salepoco solubile si ha un elettrodo di seconda specie un filo drsquoargento immerso inuna soluzione satura di AgCl tutto ricoperto dal sale egrave un tipico elettrodo di secon-da specie La reazione di elettrodo egrave
AgCl + endash Ag + Clndash
Un elettrodo di terza specie egrave costituito da un metallo inerte immerso in una solu-zione contenente una coppia redox Un tipico esempio egrave costituito da un filo di pla-tino (un metallo nobile e quindi inerte nelle normali condizioni di lavoro) immersoin una soluzione di ioni Fe2+ e Fe3+ Il metallo si pone in equilibrio con la soluzionedi cui assume il potenziale Infatti la superficie di platino diventa sede dello scam-bio di elettroni fra le due specie ioniche che danno luogo alla reazione
Fe3+ + endash Fe2+
Infine gli elettrodi di quarta specie (che possono essere considerati come una va-riante dei precedenti) sono i cosiddetti elettrodi a gas in cui il metallo inerte e poro-so viene saturato da un gas (per esempio idrogeno) e posto a contatto con una solu-zione contenente la forma ionica del gas (nellrsquoesempio H+) Nel caso dellrsquoidrogeno
2H+ + 2endash H2
12 Calcolo dei potenziali di elettrodo legge di Nernst
Il potenziale di elettrodo egrave tanto maggiore in valore assoluto quanto maggiore egravela differenza di carica nel doppio strato (per esempio quella che si instaura allrsquoe-quilibrio fra i due lati dellrsquointerfaccia metallosoluzione) e dipende sia dalla naturachimica della coppia redox sia dalla concentrazione attiva ovvero dallrsquoattivitagrave degliioni in soluzione
Consideriamo lrsquoequilibrio per una generica semireazione di elettrodo
aox + bB + nendash cred + dD
Allrsquoequilibrio il potenziale di elettrodo che in realtagrave egrave una differenza di potenzialefra il metallo e la soluzione egrave espresso dalla legge di Nernst
+ (21)
Questa legge che prende ilnome dal chimico tedescoWalther H Nernst puograveessere ricavata in base aconsiderazionitermodinamiche edelettrochimiche su cui nonci soffermeremo Si notiin particolare chelrsquoargomento dellogaritmo egrave lrsquoinverso delquoziente di reazione
9
ELETTRODI E POTENZIALE DI ELETTRODO
dove bull E egrave il potenziale di elettrodo (in volt V) bull R la costante dei gas (che vale831451 Jmol times K) bull T la temperatura assoluta (in kelvin K) bull F la costante diFaraday (che vale 96 485 coulombmol) bull n il numero di elettroni scambiati nellasemireazione bull frac12 frac12 indica lrsquoattivitagrave di ciascuna specie scritta fra le due barrette
Edeg egrave il potenziale standard della coppia redox cioegrave il potenziale che la semicellaassume alla temperatura di 25 degC (29815 K) quando tutte le specie hanno attivitagraveunitaria e i gas si trovano alla pressione parziale di 1 bar (100 kPa) o piugrave precisa-mente hanno fugacitagrave unitaria
Lrsquoattivitagrave di ogni specie egrave uguale al prodotto g ∙ C dove g egrave il coefficiente di atti-vitagrave e C la concentrazione analitica espressa in moli su litro (molL)
Se si tiene conto dei coefficienti di attivitagrave e si inseriscono le parentesi quadre [ ]che indicano le concentrazioni in molL (gtpag 33) si ottiene
E ERT
nF
a b
c d= +deg ln
[ox] [B]
[red] [D]acute (22)
dove al posto di Eo compare il cosiddetto potenziale formale (Eoacute) della coppia redoxin oggetto
Il potenziale formale puograve differire in modo significativo dal potenziale standarde si rivela piugrave utile di esso per una valutazione anche solo orientativa del compor-tamento della coppia redox in quanto tiene meglio conto delle reali condizioni incui si opera per esempio il pH della soluzione Ricordiamo infatti che il pH allrsquointer-no di una cellula vale circa 7 (a parte pochissime eccezioni) per cui il potenziale re-dox standard che fa riferimento a pH 0 non risulta molto adatto a descriverne de-terminate caratteristiche Inoltre il potenziale standard delle coppie O2H2O vale123 V ma scende a 081 V a pH 7 Analogamente il potenziale della coppia deidro-ascorbicoascorbico passa da +390 V a +0058 V diventando nettamente riducentecome si addice alle ben note proprietagrave antiossidanti della vitamina C
Quando si lavora con soluzioni molto diluite (al di sotto di 10ndash3 M) si puograveassumere con buona approssimazione che il coefficiente di attivitagrave di tutte lespecie sia uguale a 1 In tali condizioni se si inserisce il valore numerico di RF e ilfattore numerico per la conversione ai logaritmi decimali si ottiene
(23)
Alla temperatura di 25 degC (29815 K) la legge di Nernst assume la sua forma piugravenota e usata
+ (24)
Per esempio per la semireazione
Cu2+ + 2endash Cu
la legge di Nernst (a 25 degC) assume la forma
+
La costante di Faradayequivale alla caricaelettrica di un numerodi Avogadro (cioegrave diuna mole) di elettroniUna mole contiene602214076 times 1023
entitagrave elementari(gtpag 457)
La fugacitagrave egrave la grandezzafisica adottata per i gas alposto della pressione alloscopo di tener conto delloro comportamento nonideale
ln = 23026 log
10
2 Potenziometria
In questa equazione non compare la concentrazione della forma ridotta percheacutelrsquoattivitagrave di una specie chimica pura nelle condizioni standard viene convenzio-nalmente assunta uguale a 1
In effetti spesso si lavora con soluzioni non particolarmente diluite quindi neicalcoli bisogna fare riferimento alle attivitagrave invece che alle concentrazioni di con-seguenza lrsquoequazione (24) diventa
+ log
IL POTENZIALE FORMALEAPPROFONDIMENTO
13 Polarizzazione degli elettrodiIn tutti i casi in cui il sistema dellrsquoelettrodo si discosti dalle condizioni di equilibriotermodinamico la legge di Nernst diventa inadeguata a descrivere il sistema stessoCiograve accade per esempio quando allrsquoelettrodo viene imposto un potenziale arbitra-rio eo la corrente che lo attraversa egrave molto intensa in questi casi il potenziale dielettrodo risulta diverso da quello previsto in base alla legge di Nernst e si dice chelrsquoelettrodo egrave polarizzato
In particolare quando la concentrazione degli ioni alla superficie di un elettrodoegrave diversa da quella nel resto della soluzione si verifica una polarizzazione di con-centrazione in quanto il sistema non si trova nelle condizioni di equilibrio cui fariferimento il modello di Nernst
La polarizzazione puograve derivare anche dal cambiamento dello stato chimico eofisico della superficie di elettrodo oppure dal verificarsi di reazioni chimiche colla-terali alla reazione di elettrodo
LEGGE DI NERNST E GRANDEZZE TERMODINAMICHE COLLEGATEAPPROFONDIMENTO
CELLE GALVANICHE O PILESe si collegano elettricamente fra loro due semicelle (elettrodi) si realizza un dispo-sitivo che puograve erogare corrente si tratta di una cella galvanica (o pila fig 22)
In una pila le due semicelle sono separate da un setto poroso o da un ponte salinoche hanno il solo compito di assicurare il contatto elettrico evitando il rapido me-scolamento delle soluzioni Secondo le caratteristiche dei singoli elettrodi ai duecapi della pila si crea una differenza di potenziale (ddp) detta anche tensione (opotenziale) di cella che quando raggiunge il suo valore massimo egrave detta forzaelettromotrice (abbreviata fem e indicata con il simbolo E) tutti questi terminiindicano che la pila puograve compiere un lavoro (elettrico)
Dal punto di vista fisico la fem di una pila corrisponde al lavoro massimo cheessa puograve fornire In altri termini la fem equivale al lavoro per unitagrave di carica ne-cessario per mantenere costante la ddp fra i due elettrodi
La fem coincide con la ddp solo nel caso in cui il sistema lavori in condizionidi reversibilitagrave termodinamica (ovvero a corrente nulla) In un circuito chiuso in-
Il termine polarizzazionesoprattutto nelleapplicazioni viene spessousato in modo fin troppogenerico per definiresituazioni poco chiare peresempio nellrsquoindustriagalvanica si parla spesso dipolarizzazione quando ilprocesso produttivo nonsegue lrsquoandamento previstoanche se le vere cause sonotutte da definire
2
La fem viene misurata acircuito aperto (ossia incondizioni di equilibrio acorrente nulla) e conterminali di platinomediante un potenziometroo un voltmetro elettronico
Se le soluzioni simescolassero ben prestosi verificherebberoreazioni chimiche direttelaquoindesiderateraquo (peresempio fra elettrodi esoluzione) con rapidoesaurimento del sistema(pila Daniell gtparagrafo24) e sviluppo di calore
11
CELLE GALVANICHE O PILE
vece dove la corrente circola (e non egrave nulla) la ddp in uscita dalla pila egrave sempreminore della fem a causa della laquocaduta di tensioneraquo provocata dal passaggio dicorrente Vale infatti con buona approssimazione la relazione
ddp= fem ndash Ri
dove bull R egrave la resistenza del circuito bull i lrsquointensitagrave di corrente
Per esempio se si collegauna comune pila da 45 Va una lampadina e simisura la ddp ai capi delcircuito si ottiene unvalore piugrave basso (peresempio 33 V)Il valore nominale ditensione sullrsquoinvolucrodella pila infatti indica lafem non la ddp inuscita (che dipende dallaquocaricoraquo effettivo delcircuito)
Figura 22Cella galvanica (pila) Il setto poroso divide (pur mantenen-doli in contatto elettrico fra loro) i due comparti del recipien-te che costituiscono le due semicelle Queste possono con-tenere due diversi elettroliti oppure lo stesso elettrolita maa diversa concentrazione in modo che allrsquoinizio i potenzialisiano diversi Nel primo caso le due lamine sono in generedi metalli differenti nel secondo caso sono uguali fra loroIl circuito esterno egrave formato da conduttori di prima specie ecomprende il dispositivo per la misura della tensione dellapila la corrente (i) e gli elettroni (e-) percorrono il circuito indirezioni opposte
Lrsquoelettrodo piugrave ricco di elettroni cioegrave a potenziale minore egrave detto anodo e costitu-isce il polo negativo della pila mentre lrsquoelettrodo piugrave povero di elettroni cioegrave a po-tenziale maggiore egrave detto catodo e costituisce il polo positivo Attraverso il circuitoesterno lrsquoanodo tende a cedere elettroni al catodo sotto la laquospintaraquo della spontaneatendenza del sistema a eguagliare i potenziali delle due semicelle
Il flusso di elettroni dallrsquoanodo al catodo altera quindi lo stato drsquoequilibrio ini-ziale di ciascuna semicella esso puograve venire ripristinato mediante reazioni di ossida-zione allrsquoanodo e contemporaneamente mediante reazioni di riduzione al catodoInfatti in base alla legge di Nernst (gtparagrafo 12) le reazioni di ossidazione tendo-no a innalzare il potenziale di elettrodo percheacute aumenta la concentrazione dellaforma ossidata (al numeratore dellrsquoargomento logaritmico) viceversa le reazioni diriduzione tendono ad abbassarlo La corrente che si stabilisce nel circuito egrave dovutaalla tendenza spontanea del sistema a raggiungere lrsquoequilibrio termodinamico per-ciograve quando i potenziali dei due elettrodi diventano uguali il flusso di elettronicessa e si dice che la pila egrave laquoscaricaraquo
La pila quindi egrave un dispositivo mediante il quale gli elettroni in gioco in unareazione redox passano attraverso un circuito da una specie chimica a unrsquoaltraOssidante e riducente infatti non vengono posti direttamente a contatto cosiccheacute glielettroni che si scambierebbero sono laquocostrettiraquo a passare attraverso il circuitoesterno Ciograve consente di convertire in energia elettrica e quindi in lavoro lrsquoenergiache si libera in un processo redox spontaneo che genererebbe calore il flusso di
12
2 Potenziometria
corrente si arresta quando egrave soddisfatta la costante di equilibrio della reazione chegenera la pila
Per ragioni storiche il funzionamento delle pile egrave stato spiegato in termini di unflusso di corrente elettrica dovuto a inesistenti cariche elettriche positive che migra-no dal polo a potenziale maggiore (catodo) verso il polo a potenziale minore (ano-do) Per questo motivo il verso convenzionale della corrente elettrica egrave opposto aquello in cui effettivamente circolano gli elettroni
21 Potenziali standard di ossidoriduzioneIn linea di principio per misurare la ddp fra una lamina di metallo e la soluzionein cui egrave immersa (si veda la figura 21a) occorre inserire il dispositivo di misura inmodo che un terminale sia collegato al metallo e lrsquoaltro alla soluzione In questomodo tuttavia si crea un nuovo contatto metallosoluzione e lo strumento finiscecol misurare la ddp fra i due metalli senza dare informazioni sul valore del poten-ziale di ciascuno di essi Quindi il potenziale assoluto di un singolo elettrodo o diuna coppia redox (che egrave la stessa cosa) non puograve essere misurato Si egrave costretti perciogravea effettuare una misura relativa dei potenziali ponendo a confronto due semicellela semicella di cui si vuole misurare il potenziale e una semicella di riferimento co-struita in modo da assumere un potenziale costante
In pratica lrsquoelettrodo di cui si vuole misurare il potenziale viene accoppiato a unelettrodo di riferimento e si misura la ddp di questa pila in condizioni precisamentedefinite
In base a criteri di opportunitagrave pratica e a considerazioni termodinamiche si egravescelto come elettrodo di riferimento il cosiddetto elettrodo standard a idrogeno(SHE Standard Hydrogen Electrode) A tale elettrodo (fig 23) viene assegnato perconvenzione un potenziale di semicella di 00000 V valido a tutte le temperatureper una soluzione che contiene ioni idrogeno ad attivitagrave unitaria e idrogeno gassosoa fugacitagrave unitaria (in pratica alla pressione parziale di 1 bar)
Nella prima fasedi sviluppodellrsquoelettrochimica siparlava anche di elettrodonormale a idrogeno(NHE Normal HydrogenElectrode) riferendosi a unelettrodo di platinoimmerso in una soluzione1 N di un acido forte inquesta soluzione perogravelrsquoattivitagrave del protone egravecirca 08 e quindi ilpotenziale realedellrsquoelettrodo egrave ben diversoda zero Per questo motivonon egrave corretto usare lasigla NHE per indicare ilriferimento standard[Fonte RW RametteJ Chem Ed vol 64 10(ott 1987)]
Figura 23Elettrodo a idrogeno secondo la realizzazione ideata da SPLSoslashrensen Nel gorgogliatore entra idrogeno gassoso purissi-mo che attraversa la soluzione acida e lambisce la lamina diplatino platinato prima di uscire dal secondo gorgogliatore Idue gorgogliatori e lrsquoampolla centrale contengono la stessasoluzione acida La lamina di platino egrave saldata a un filo di plati-no che fuoriesce dal tappo e assicura il collegamento elettricocon lo strumento di misura Il rubinetto e il sifone mettono incontatto la soluzione acida con lrsquoaltro elettrodo formando cosigraveuna pila Quando lrsquoattivitagrave di H+ e la fugacitagrave di H2 sono unitarielrsquoelettrodo egrave in condizioni standard
13
CELLE GALVANICHE O PILE
Le tabelle dei potenziali standard di ossidoriduzione riportano appunto i po-tenziali di coppie redox ad attivitagrave unitaria misurati rispetto allo SHE (a 25 degC) Sele reazioni sono scritte secondo le convenzioni IUPAC cioegrave nel senso della ridu-zione (elettroni a sinistra) egrave piugrave preciso parlare di potenziali standard di riduzione(tab 21) Nelle tabelle le coppie con potenziale positivo sono tendenzialmentepiugrave ossidanti della coppia H+H2 mentre le coppie con potenziale negativo sono piugraveriducenti
In generale per due coppie qualsiasi quella con potenziale standard maggiore egraveossidante (nelle condizioni imposte) nei confronti della coppia con potenziale stan-dard minore Per esempio se si immerge un foglio di alluminio in una soluzionecontenente solfato di rame e solfato di alluminio (ad attivitagrave unitaria) il foglio di
TABELLA 21 | Alcuni potenziali standard di riduzione (Edeg) misurati a 25 degC
Semireazione Edeg(V) Semireazione Edeg(V)
O H e O H O3 2 22 2+ + ++ minus 2076 Cu e Cu s2
2+ minus+ ( ) 0342
S O e SO2 82
422 2minus minus minus+ 2010 Hg Cl s e Hg Cl2 2 2 2 2( )+ +minus minus
0268
H O H e H O2 2 22 2 2+ ++ minus 1776 AgCl s e Ag Cl( )+ +minus minus
0222
MnO H e MnO s H O4 2 24 3 2minus + minus+ + + ( ) 1679 Cu e Cu2+ minus ++ 0153
Ce e Ce4 3+ minus ++ 172 Sn e Sn in HCl M4 22 1+ minus ++ ( ) 0151
MnO H e Mn H O42
28 5 4minus + minus ++ + + 1507 S H e H S g+ ++ minus2 2 2 ( ) 0142
PbO H e Pb H O22
24 2 2+ + ++ minus + 1455 S O e S O4 6
22 3
22 2minus minus minus+ 008
Cl e Cl2 2 2+ minus minus 1358 AgBr s e Ag Br( )+ +minus minus
0071
Cr O H e Cr H O2 72 3
214 6 2 7minus + minus ++ + + 1350 2H ++ 2e-H2 00000
O g H e H O2 24 4 2( )+ ++ minus 1229 Pb e Pb2
2+ minus+ ndash0126
2 12 10 63 2 2IO H e I H Ominus + minus+ + + 1195 Sn e Sn22
+ minus+ ndash0137
Br l e Br2 2 2( )+ minus minus 1066 Ni e Ni2
2+ minus+ ndash0257
NO H e HNO H O3 2 23 2minus + minus+ + + 0934 Co e Co22
+ minus+ ndash0282
2 22
2
2Hg e Hg+ minus ++ 0920 Fe e Fe22
+ minus+ ndash0447
Cu I e CuI2+ minus minus+ + 086 Zn e Zn22
+ minus+ ndash0762
Ag e Ag+ minus+ 0799 Mn e Mn22
+ minus+ ndash1185
Hg e Hg2
22 2
+ minus+ 0797 Al e Al33
+ minus+ ndash1662
Fe e Fe3 2+ minus ++ 0771 Mg e Mg22
+ minus+ ndash2372
O g H e H O2 2 22 2( )+ ++ minus 0695 Na e Na+ minus+ ndash2710
I e I3 2 3minus minus minus+ 0536 Ca e Ca22
+ minus+ ndash2868
I e I2 2 2+ minus minus 0535 K e K+ minus+ ndash2931
Cu e Cu+ minus+ 0521 Li e Li+ minus+ ndash3040
Fe CN e Fe CN( ) ( )63
64minus minus minus+ 0358
14
2 Potenziometria
alluminio si dissolve mentre si deposita rame metallico Infatti i potenziali stan-dard delle due coppie redox sono
Cu2+ + 2endash Cu Edeg= +034 V
Al3+ + 3endash Al Edeg= ndash166 V
Nella soluzione quindi lo ione Cu2+ (forma ossidata della coppia con potenzialemaggiore) tende a ossidare Al (forma ridotta della coppia con potenziale minore)
TABELLA DEI POTENZIALI STANDARD DI RIDUZIONEAPPROFONDIMENTO
22 Tensione pratica (ddp) di una pila
Lrsquoinsieme dei conduttori di prima e di seconda specie che in sequenza opportunaformano una pila (o in generale un sistema elettrochimico) costituisce una catenagalvanica La differenza di potenziale (Ecella) che si misura ai capi di una pila durantelrsquoerogazione di corrente egrave dovuta a diversi contributi piugrave precisamente egrave uguale allasomma algebrica di tutte le cadute di tensione che si verificano lungo lrsquointero circuito
Ecella= E1 + E2 + E3 + E4 + E5 (25)
dove bull E1 egrave la ddp dovuta allrsquoeventuale passaggio di corrente nel circuito (cadutaohmica) bull E2 la ddp di contatto metallometallo (tensione di Volta) bull E3 la ddpdi contatto soluzionesoluzione (tensione o potenziale di giunzione liquida) bull E4 edE5 le ddp di contatto metallosoluzione (tensione di Nernst) per ciascun elettrodo
Esaminiamo ora il significato dei singoli contributi
Caduta ohmica Quando la cella egrave attraversata da corrente inevitabilmente si ve-rifica una caduta di tensione E = R times i (prima legge di Ohm) Ovviamente se lamisura del potenziale di cella viene effettuata in condizioni tali da minimizzareo eliminare il passaggio di corrente (cioegrave a circuito aperto) la caduta ohmica siannulla (cioegrave E1= 0)
Tensione di Volta Quando due diversi metalli vengono posti a contatto si generasempre una ddp Questo fenomeno detto effetto Volta egrave dovuto al fatto che glielettroni di conduzione sono trattenuti con diversa energia dai diversi metalli Per-ciograve il contatto fra due metalli provoca un trasferimento di elettroni istantaneo daparte del metallo che li trattiene con minore energia Il processo perograve non prose-gue indefinitamente il trasferimento di elettroni infatti prosegue fino allrsquoequili-brio quando insorge una ddp (in genere di pochi millivolt) sufficiente a bloccarlo
Si puograve verificare sperimentalmente (e dimostrare) che la ddp agli estremi diuna catena di conduttori di prima specie egrave uguale a quella che si stabilisce se i duemetalli che ne costituiscono gli estremi vengono posti a diretto contatto (fig 24)Di conseguenza se gli ingressi del misuratore di tensione sono costituiti dallo stessometallo lrsquoeffetto Volta complessivo egrave nullo (E2= 0)
In altri termini la formaossidata della coppia conpotenziale piugrave alto egraveossidante nei confrontidella forma ridotta dellacoppia con potenzialepiugrave basso
A rigore si dovrebbe usareil simbolo V (o ∆V)percheacute si tratta di unaddp misurata in una pilain funzione e dunquenon di una fem Il pedicelaquocellaraquo puntualizza che sitratta in generale di unacella elettrochimica
R egrave la resistenza delconduttore e i lrsquointensitagravedi corrente
15
CELLE GALVANICHE O PILE
Potenziale di giunzione liquida In una pila le due semicelle sono separate matenute in contatto elettrico mediante un setto poroso o un ponte salino che con-sente un mescolamento lentissimo (praticamente nullo) delle soluzioni Questidispositivi (si veda la figura 25) perograve creano unrsquoulteriore caduta di tensione fragli elettrodi detta potenziale di giunzione liquida (Eg) o anche potenziale dicontatto (o di diffusione) Il potenziale di giunzione liquida puograve essere sia po-sitivo sia negativo e quindi fa aumentare o viceversa diminuire la ddp fra glielettrodi
Lrsquoinsorgere di un potenziale di giunzione egrave causato dal fatto che gli ioni si dif-fondono con diversa mobilitagrave attraverso le superfici di contatto di due mezzi di-versi un setto poroso per esempio egrave diversamente permeabile agli ioni propriosecondo la loro mobilitagrave
Tensione di Nernst I potenziali di contatto metallosoluzione (E4 E5) si calco-lano in teoria mediante la legge di Nernst e perciograve sono detti potenziali nern-stiani
LA MOBILITAgrave DEGLI IONI IN SOLUZIONEAPPROFONDIMENTO
23 Calcolo della tensione teorica (fem) di una pilaSe si opera in modo da rendere trascurabili i primi tre termini dellrsquoequazione (22)la ddp ai capi della pila coincide in pratica con la sua fem che puograve essere cal-colata semplicemente in base agli ultimi due termini cioegrave ai potenziali di elettrodoNei calcoli occorre tenere presente che
a la fem di una pila in quanto strettamente collegata al lavoro da essa compiutodeve necessariamente avere segno positivo
b lrsquoelettrodo a potenziale maggiore su cui avviene la riduzione egrave il catodo lrsquoelet-trodo a potenziale minore su cui avviene lrsquoossidazione egrave lrsquoanodo
Di conseguenza la fem di una pila cioegrave di una cella elettrochimica ottenuta colle-gando due semicelle (catodica e anodica) egrave espressa dalla seguente relazione
Ecella = Ec ndash Ea (26)
ovvero
Ecella = Emaggiore ndash Eminore (27)
Questa seconda scrittura mostra chiaramente che la fem della pila egrave sempre posi-tiva anche nel caso in cui i potenziali delle due semicelle siano entrambi negativi
Indichiamo con Ec ilpotenziale del catodo (opotenziale catodico) econ Ea il potenzialedellrsquoanodo (o potenzialeanodico)
Figura 24Nonostante ogni superficie di contatto fra due metallisia sede di una ddp dovuta allrsquoeffetto Volta la ddpche si instaura fra rame e zinco egrave la stessa sia nel caso(a) sia nel caso (b) Infatti se cosigrave non fosse chiudendola catena aperta (a) si dovrebbe osservare un passaggiodi corrente e questo in realtagrave non avviene
a b
16
2 Potenziometria
ESEMPIO 1UNA IPOTETICA PILA Egrave COSTITUITA DALLE COPPIE REDOX Al3+Al E Ni2+NiQUAL Egrave LA FEM DELLA PILA SE LE ATTIVITAgrave DI TUTTE LE SPECIE IONICHE SONOUNITARIE
Dal momento che le attivitagrave sono unitarie il calcolo fornisce la tensione (o forzaelettromotrice) standard della pila
Innanzitutto dalla tabella dei potenziali standard si ricavano i potenziali stan-dard per ciascuna coppia redox
Al3+ + 3endash Al Eo
= ndash166 V
Ni2+ + 2endash Ni Eo
= ndash026 V
Lrsquoelettrodo della coppia Ni2+Ni costituisce il catodo percheacute ha il potenziale mag-giore mentre lrsquoelettrodo della coppia Al3+Al costituisce lrsquoanodo percheacute ha il poten-ziale minore Si puograve anche costruire un diagramma di questo tipo
Al3+Al Ni2+Ni H+H2
ndash166 ndash026 00000 Edeg(V rif a SHE)
Quindi la fem della pila in condizioni standard egrave
Ecella= Ec ndash Ea= Emaggiore ndash Eminore= ndash026 ndash (ndash166)= +140 V
La reazione di ossidoriduzione che genera la pila si ottiene formalmente combi-nando le due semireazioni bilanciate quella di riduzione al catodo e quella di os-sidazione allrsquoanodo Ciascuna semireazione deve essere moltiplicata per un fattorenumerico tale che il numero di elettroni ceduti dalla specie che si ossida sia uguale aquello degli elettroni acquistati dalla specie che si riduce Quindi nel caso dellrsquoesem-pio proposto si moltiplica la semireazione della coppia Al3+Al per 2 e quella dellacoppia Ni2+Ni per 3
2 middot (Al Al3+ + 3endash) Edeg= ndash(ndash166 V) (ndash)
3 middot (Ni2+ + 2endash Ni) Edeg= ndash026 V (+)
2Al + 3Ni2+ 2Al3+ + 3Ni Edeg= +140 V
Attenzione per ottenere il bilancio della reazione di cella si moltiplica per un coeffi-ciente opportuno ciascuna semireazione ma non il rispettivo potenziale Infatti i po-tenziali di elettrodo (e quindi anche il potenziale di cella) esprimono un lavoro elettricoper unitagrave di carica e perciograve sono proprietagrave intensive che non dipendono dalla quantitagravedi materia contenuta nel sistema ovvero dal numero di cariche elettriche trasportate
Se le attivitagrave non sono unitarie per calcolare il potenziale di elettrodo occorreapplicare lrsquoequazione di Nernst
Egrave ovvio comunque che il lavoro complessivo che puograve essere fornito da una piladipende anche dalla massa e dalla geometria degli elettrodi Per questo motivo unapila o un insieme di pile (cioegrave una batteria) che viene utilizzata per esempio permuovere un veicolo puograve avere dimensioni ingombranti Questo accadeva fino anon molti anni fa per le vecchie batterie al piombo ora sempre piugrave sostituite dabatterie come quelle al litio decisamente piugrave compatte e che infatti stanno rendendopossibile il progressivo passaggio allrsquoauto parzialmente o completamente elettrica
UNA IPOTETICA PILA Egrave COSTITUITA DALLE COPPIE REDOX Al3+Al E Ni2+NiQUAL Egrave LA FEM DELLA PILA SE LE ATTIVITAgrave DI TUTTE LE SPECIE IONICHE SONOUNITARIE
Nella pila la reazionedella coppiadella coppia Ni2+Ni(Ni2+ si riduce) avvienenel senso conforme allaconvenzione adottata per ipotenziali (elettroni asinistra) invece lareazione della coppiaAl3+Al (Al si ossida)avviene nel senso oppostoa quello convenzionalePerciograve il potenziale Edegdella coppia Al3+Al vieneconsiderato con segnoopposto a quello tabulato(+166 V) Se si sommaalgebricamente ilpotenziale dellrsquoelettrodoche si riduce (Ec) conquello dellrsquoelettrodo che siossida cambiato di segno(Ea) la tensione della pilarisulta positiva
17
CELLE GALVANICHE O PILE
ESEMPIO 2UNA IPOTETICA PILA Egrave COSTITUITA DALLE COPPIE REDOX Al3+Al E Ni2+NiQUAL Egrave LA FEM DELLA PILA A 25 degC SE LE CONCENTRAZIONI DELLE SPECIEIONICHE SONO RISPETTIVAMENTE [Al3+] = 2 10ndash2 M E [Ni2+] = 10ndash2 M
Approssimando le attivitagrave con le concentrazioni si ottiene
La situazione non egrave sostanzialmente cambiata rispetto alle condizioni standardpercheacute anche in questo caso la reazione di cella comporta lrsquoossidazione dellrsquoallumi-nio e la riduzione del nichel La fem della pila quindi egrave
Ecella= Ec ndash Ea= ndash032 ndash (ndash167)= +135 V
24 Alcuni tipi di pile
Pila DaniellUna semicella egrave costituita da una lamina di rame immersa in una soluzione diCuSO4 lrsquoaltra semicella da una lamina di zinco immersa in una soluzione di ZnSO4
(fig 25) Le due semicelle sono separate da un setto poroso (in pratica una mem-brana di vetro sinterizzato o analogo materiale inerte) oppure si trovano in duediversi recipienti collegati da un ponte salino
Le reazioni di elettrodo sono
Zn2+ + 2endash Zn Edeg= ndash0762 V
Cu2+ + 2endash Cu Edeg= 0342 V
Le concentrazioni dei sali nelle rispettive semicelle sono in genere tali da renderenegativo il semielemento di zinco che perciograve tende a cedere elettroni al rame (ossi-dandosi) La lamina di zinco egrave dunque il polo negativo (anodo) della pila e il rameegrave il polo positivo (catodo)
La rappresentazione della catena galvanica di questa pila secondo le convenzioniIUPAC egrave
(ndash) Zn(s)|ZnSO4(aq)||CuSO4(aq)|Cu(s) (+)
UNA IPOTETICA PILA Egrave COSTITUITA DALLE COPPIE REDOX Al3+Al E Ni2+NiQUAL Egrave LA FEM DELLA PILA A 25 degC SE LE CONCENTRAZIONI DELLE SPECIEIONICHE SONO RISPETTIVAMENTE [Al3+] = 2 10ndash2 M E [Ni2+] = 10ndash2 M
Si noti che se i duescomparti non fosseroscomparti non fosseroben separati dal settoben separati dal settoporoso ben presto gli ioniporoso ben presto gli ionirame disponibilirame disponibiliraggiungerebbero lrsquoraggiungerebbero lrsquoanododi zinco ossidandolo eandando a depositarsi sudi esso come Cumetallico nondiversamente da quanto sipuograve osservareimmergendo una barrettadi zinco in una soluzionedi solfato di rameesaurendo quindirapidamente la pila esviluppando calore
Figura 25Pila Daniell (a) con settoporoso e (b) con pontesalino
a b
18
2 Potenziometria
La coppia di barrette verticali (||) al centro rappresenta il setto poroso o il pontesalino che separano le due semicelle lrsquoanodo egrave scritto a sinistra e per ciascun elet-trodo la forma ridotta della coppia redox egrave scritta verso lrsquoesterno Le lettere scrittefra parentesi indicano lo stato fisico di ogni specie chimica
La reazione di cella egrave
Zn + Cu2+ Zn2+ + Cu
Per calcolare la fem teorica di questa pila che puograve anche trovarsi in condizionidiverse da quelle standard si applica la legge di Nernst a ciascuna semicella
(28)
(29)
I potenziali standard delle due semicelle sono cosigrave diversi fra loro che nelle normalicondizioni operative di una pila Daniell il rame rappresenta il polo positivo e lozinco il polo negativo
Sottraendo il potenziale minore da quello maggiore si ottiene il potenziale dicella
Ecella = ECu2+Cu - EZn2+Zn
Ponendo Edegcella = EdegCu2+Cu ndash EdegZn2+Zn (= 0342 V + 0762 V) e quindi sottraendo la(28 dalla 29) si ricava infine
Questa equazione consente dunque di calcolare il potenziale di Nernst se egrave notoil valore effettivo dellrsquoattivitagrave degli ioni Zn2+ e Cu2+ Tuttavia il calcolo si presta aerrori anche significativi lrsquoattivitagrave degli ioni per esempio varia in funzione dellaforza ionica della soluzione e non puograve essere calcolata Perciograve la fem reale piugraveesattamente la ddp che si misura si discosta dal valore calcolato sostanzialmenteper due motivi
a il sistema non si comporta in maniera ideale (per esempio gli elettrodi possonopolarizzarsi)
b il contributo della caduta ohmica (gtequazione 25) puograve essere praticamente an-nullato se nel circuito viene fatta circolare una corrente trascurabile invece ilpotenziale di giunzione liquida per quanto piccolo non puograve essere soppresso enon egrave prevedibile in base a equazioni teoriche
Pile a concentrazioneIn questo tipo di pila le due semicelle contengono due soluzioni di una stessa cop-pia redox ma a diversa concentrazione gli elettrodi sono inerti oppure dello stes-so metallo e le semicelle sono collegate da un setto poroso o da un ponte salino(fig 26)
In questo calcolotrascuriamo i contributidei termini E1 E2 E3 dellaequazione (25)
Lrsquoequazione rappresentain pratica la legge diNernst applicata allareazione redox globalescritta nel verso dellaspontaneitagrave tenendoconto degli elettroniscambiati (2) e inserendonellrsquoargomento dellogaritmo lrsquoinverso delquoziente di reazione
+
19
CELLE GALVANICHE O PILE
Le due soluzioni si scambiano elettroni attraverso il circuito esterno mentre ilsetto poroso (o il ponte salino) che le collega consente il passaggio di ioni e quin-di chiude il circuito Il sistema raggiunge lrsquoequilibrio quando le attivitagrave degli ioninelle due semicelle diventano uguali perciograve egrave prevedibile che nella soluzione piugravediluita avvenga lrsquoossidazione il rame metallico si dissolve e si formano ioni Cu2+ insoluzione questo dunque egrave lrsquoanodo Contemporaneamente gli elettroni passanonellrsquoaltro comparto (a destra in figura 26) attraverso il circuito esterno e riduconogli ioni Cu2+ che si depositano sullrsquoelettrodo come rame metallico questo dunqueegrave il catodo
In pratica egrave come se gli ioni Cu2+ si trasferissero dalla soluzione piugrave concentrataalla soluzione piugrave diluita Queste pile dunque trasformano in lavoro elettrico lrsquoe-nergia che si libera nel processo spontaneo con cui due soluzioni a diretto contattotendono a raggiungere lrsquoequilibrio di concentrazione
La rappresentazione convenzionale della catena elettrodica di questa pila a con-centrazione egrave la seguente
(-) Cu(s) |Cu2+(001 M)||Cu2+(1 M)|Cu(s) (+)
Per calcolare la tensione teorica della pila si applica la legge di Nernst a ciascun elet-trodo Approssimando le attivitagrave con le concentrazioni (a 25 degC) si ottiene
(soluzione piugrave diluita anodo)
(soluzione piugrave concentrata catodo)
Quindi
Ecella= Emaggiore ndash Eminore= 0342- 0283= 0059 V
ALTRI TIPI DI CELLE GALVANICHE O PILEAPPROFONDIMENTO
Figura 26Pila a concentrazione il compartoanodico (a sinistra) contiene ioni Cu2+
in concentrazione 001 M e il com-parto catodico (a destra) contieneioni Cu2+ in concentrazione 1 M Ilcollegamento fra le due semicelle egraverealizzato con un ponte salino
20
2 Potenziometria
STRUMENTAZIONEIn potenziometria si misura la differenza di potenziale che si stabilisce fra due semi-celle allo scopo di determinare la concentrazione di uno ione o per seguire lrsquoanda-mento di una titolazione
Il dispositivo completo per una misura potenziometrica (fig 27) consiste es-senzialmente di
bull un potenziometro o meglio un millivoltmetro elettronicobull un elettrodo di riferimentobull un elettrodo di misura
Il potenziometro serve per misurare la ddp fra i due elettrodi senza alterare il lorostato di equilibrio perciograve si lavora a corrente praticamente nulla
Gli elettrodi collegati al potenziometro sono immersi nella soluzione su cui sieffettuano le misure Lrsquoelettrodo di riferimento egrave costruito in modo tale da mante-nere costante il suo potenziale di conseguenza ogni variazione di ddp misurata egraveimputabile esclusivamente allrsquoelettrodo di misura (piugrave precisamente alla soluzioneanalizzata)
ELETTRODI DI RIFERIMENTOLrsquoelettrodo standard a idrogeno (SHE gtparagrafo 21) egrave lrsquoelettrodo di riferimentoprimario Tuttavia nella pratica quotidiana di laboratorio si usano elettrodi di ri-ferimento secondari piugrave semplici e maneggevoli che hanno comunque la proprie-tagrave di mantenere il proprio potenziale costante a temperatura costante Tratteremoora in maggior dettaglio gli elettrodi di uso piugrave comune
31 Elettrodo ad argentocloruro drsquoargento
Si tratta senzrsquoaltro dellrsquoelettrodo piugrave diffuso Il dispositivo egrave costituito da un sem-plice filo drsquoargento rivestito di AgCl e immerso in una soluzione di KCl (egrave dunqueun elettrodo di seconda specie) Il tutto egrave contenuto in un tubicino di vetro dotatodi setto poroso per assicurare il contatto elettrico con lrsquoesterno ovvero con la so-luzione in cui viene immerso lrsquooggetto dellrsquoanalisi
Figura 27Rappresentazione schematica deldispositivo completo per misurepotenziometriche
3
21
ELETTRODI DI RIFERIMENTO
La rappresentazione convenzionale dellrsquoelettrodo (fig 28) egrave
Ag(s)|AgCl(aq)|KCl(aq)
La reazione di elettrodo egrave
AgCl + endash Ag + Clndash
E il potenziale di elettrodo
E= EdegAgClAg
Considerando unitarie le attivitagrave dei solidi puri si ottiene
E= EdegAgClAg ndash 01984 10ndash3 T log[Clndash] (210)
Se lrsquoattivitagrave degli ioni cloruro egrave costante (a temperatura costante) il potenziale dielettrodo rimane costante Gli elettrodi piugrave comuni contengono soluzioni sature diKCl (circa 42 M) e perciograve sono detti saturi (SSC Saturated Silver-Silver ChlorideElectrode) A 25 degC il potenziale di SSC vale 0197 V Questo elettrodo puograve essereusato fino a 105 degC Nella tabella 1 ndash lab 1 (gtpag 39) sono riportati i potenziali alvariare della temperatura per lrsquoelettrodo saturo e 3 M
Gli anioni (come il solfuro) che formano con Ag+ sali meno solubili di AgClpossono danneggiare questo tipo di elettrodo Anche gli ossidanti e i riducenti fortie gli agenti complessanti possono interferire con la reazione di elettrodo per proteg-gere lrsquoelettrodo da queste sostanze si usa un elettrolita intermedio come nel casodellrsquoelettrodo a calomelano saturo (SCE gtparagrafo 32)
Gli elettrodi ad argentocloruro di argento sono usati come riferimento internonegli elettrodi a vetro (gtparagrafo 41)
32 Elettrodo a calomelano
laquoCalomelanoraquo egrave il nome comune del cloruro mercuroso (I) Hg2Cl2 che fa parteappunto di questo elettrodo (fig 29a) La rappresentazione convenzionale dellrsquoe-lettrodo egrave
Hg(l)|Hg2Cl2(s)|KCl(aq)
La reazione di elettrodo egrave
Hg2Cl2 + 2endash 2Hg + 2Clndash
e il potenziale di elettrodo in base alla legge di Nernst
In condizioni standard lrsquoattivitagrave di solidi e liquidi puri egrave considerata uguale a 1quindi
da cui
ndash 01984 10ndash3 T log|Clndash| (211)
Sono anche molto diffusigli elettrodi contenentiKCl 3 M cioegrave quasisaturi Il vantaggio egrave chein queste soluzioni non siformano cristalli di KClche possono danneggiarelrsquoelettrodo ostruendoil setto poroso che sta sulfondo
Figura 28Elettrodo ad AgAgCILa soluzione tamponeinterna contiene ioni K+
e CIndash ad attivitagrave costante
22
2 Potenziometria
Il potenziale dellrsquoelettrodo a calomelano dunque dipende solo dallrsquoattivitagrave delloione cloruro e dalla temperatura Se la temperatura egrave costante e lrsquoattivitagrave dello ionecloruro nella soluzione interna allrsquoelettrodo non varia il potenziale rimane costante
Gli elettrodi a calomelano piugrave comuni contengono soluzioni sature di KCl (circa42 M) e perciograve sono detti saturi (SCE Saturated Calomel Electrode) Si usano ancheelettrodi a KCl 1 M e 01 M la tabella 22 riporta il potenziale assunto da questielettrodi secondo la concentrazione di KCl
TABELLA 22 | Potenziale (mV) di alcuni elettrodi di riferimento a 25 degC
AgAgCl Calomelano HgHgO HgHgSO4 Thalamid
KCl 01 M 288 KCl 01 M 334 NaOH 01 M 165 H2SO4 05 M 682 KCl 3 M -567
KCl 1 M 235 KCl 1 M 280 NaOH 1 M 140 K2SO4 sat 650 KCl sat -577
KCl 3 M 210 KCl 35 M 250
KCl 35 M 205 KCl sat 241
KCl sat 199 NaCl sat 236
NaCl 3 M 209
NaCl sat 197
Lrsquoelettrodo a calomelano puograve essere usato fino a circa 70 degC a temperature piugrave alteil calomelano si dismuta (Hg2Cl2 Hg + HgCl2)
I solfuri gli ossidanti i forti riducenti e gli agenti complessanti che formanoamalgami con gli ioni Hg2
2+ possono danneggiare questo tipo di elettrodo Perciogravequando si lavora in presenza di queste sostanze si usano elettrodi a doppia giun-zione (fig 29b) in cui fra lrsquoelettrodo e la soluzione egrave interposto un contenitoreriempito con un elettrolita intermedio (per esempio KNO3)
Va infine segnalata la tendenza a non usare il mercurio per motivi tossicologicie questo spiega il progressivo abbandono nella pratica comune di questo tipo dielettrodo con grande rammarico dagli elettrochimici percheacute lrsquoelettrodo a calomela-no egrave il piugrave stabile
bullELETTRODI DI PRIMA E DI SECONDA SPECIE bullALTRI ELETTRODI DI RIFERIMENTO
APPROFONDIMENTI
Figura 29(a) Elettrodo a calomelano (b) Nella versione adoppia giunzione egrave presente una seconda cameraper lrsquoelettrolita intermedio che viene immessoattraverso la bocchetta laterale il setto porosoassicura il contatto elettrico con la soluzioneesterna
a b

3
CLASSIFICAZIONE
a in generale indica il conduttore di prima specie (un filo o una lamina metallicama anche una goccia di mercurio) immerso nella soluzione in esame
b nelle tecniche potenziometriche (gtCapitolo 2) indica invece lrsquointero sistema for-mato dal conduttore metallico e dalla soluzione in cui egrave immerso
Lrsquoinsieme degli elettrodi e della soluzione costituisce la cella elettrochimica I parametrisu cui si opera o che vengono misurati durante unrsquoanalisi di tipo elettrochimico sono
bull potenziale e differenza di potenziale (simbolo V oppure E)
bull intensitagrave di corrente (i)
bull quantitagrave di carica elettrica (q)
bull resistenza (R) oppure conduttanza (L lettera greca laquolambdaraquo maiuscola)
Il preciso significato e lrsquouso di queste grandezze in sede analitica sono trattati nellepagine che seguono per il momento stabiliremo una classificazione dei diversi me-todi di analisi elettrochimica facendo riferimento a questi parametri
CLASSIFICAZIONEIn linea del tutto generale i metodi elettrochimici possono essere classificati in baseallrsquoentitagrave della corrente che fluisce nel sistema nel corso della misura
21 Metodi a corrente zero potenziometriaSi tratta di metodi in cui la misura viene effettuata raccogliendo il segnale prove-niente dalla soluzione mediante gli elettrodi si opera cioegrave in modo laquopassivoraquo ein condizioni di equilibrio turbando il meno possibile lo stato della soluzione inesame
In questo ambito rientra essenzialmente la potenziometria (gtCapitolo 2) ov-vero una serie di tecniche mediante le quali viene misurata la differenza di po-tenziale che si stabilisce tra due elettrodi immersi nella soluzione in analisi I dueelettrodi svolgono diverse funzioni uno (elettrodo di riferimento) mantiene unpotenziale costante lrsquoaltro (elettrodo di misura) si pone in equilibrio con la solu-zione Il potenziale del sistema formato dai due elettrodi dipende dalle concentra-zioni e piugrave rigorosamente dalle attivitagrave delle specie in soluzione e puograve essere ri-cavato in base alla legge di Nernst di cui ci occuperemo in dettaglio nel prossimocapitolo In linea generale per un generico sistema redox
ox + ne red
la legge di Nernst assume la forma seguente
(13)
I simboli V ed E sonotalvolta usatiindifferentemente ma ilsecondo indica a rigorela forza elettromotrice( fem) cioegrave la differenzadi potenziale della cellamisurata a corrente zeroIn alcuni casi egrave preferibileusare i simboliΔV eΔEdove la lettera greca deltamaiuscola (Δ) indica ladifferenza fra due diversivalori di V o Erispettivamente
2
4
1 Metodi elettrochimici
dove bull E egrave il potenziale assunto dallrsquoelettrodo di misura bull Edeg il potenziale standardassunto dallrsquoelettrodo (a 25 degC e 1 bar) quando le forme ossidata e ridotta han-no attivitagrave unitaria e la misura di potenziale viene effettuata rispetto allrsquoelettro-do standard a idrogeno (abbreviato SHE) bull R la costante termodinamica dei gasbull T la temperatura (in kelvin) bull F la costante di Faraday bull n il numero di elettroni(endash) scambiati nella reazione redox bull frac12oxfrac12 e frac12redfrac12 indicano le attivitagrave delle speciescritte fra le due barrette
La misura in genere viene eseguita con un millivoltmetro (o voltmetro elettronico)uno strumento in grado di misurare la differenza di potenziale fra gli elettrodi incondizioni di corrente praticamente nulla
Il valore di E o la sua variazione ΔE sono utili per determinare importanti pa-rametri chimico-fisici (come il pH) o per stabilire il punto di equivalenza nelle ti-tolazioni
22 Metodi a corrente diversa da zeroelettrogravimetria coulombometria voltammetriae conduttimetria
Nellrsquoambito di questi metodi si misura lrsquoentitagrave della corrente che attraversa la cellaquando a essa viene applicata attraverso gli elettrodi una differenza di potenzialefissa o fatta variare in maniera opportuna Si tratta insomma di operare inmodo laquoattivoraquo sul campione turbandone le condizioni di equilibrio in modo daraccogliere la laquorisposta elettricaraquo proveniente da esso
Il fenomeno principale che sta alla base di tutti questi metodi egrave quello dellrsquoelet-trolisi e per questo si parla anche di metodi elettrolitici Ce ne occuperemo ampia-mente nel Capitolo 3
Di seguito riassumiamo i principali metodi elettrolitici
ElettrogravimetriaLrsquoelettrogravimetria (gtCapitolo 4) egrave la piugrave antica tecnica elettrochimica che si basasul fenomeno dellrsquoelettrolisi Due elettrodi opportunamente conformati sono im-mersi nella soluzione in esame a determinati potenziali assunti dagli elettrodi siverifica la scarica (cioegrave lrsquoossidazione su un elettrodo e la riduzione sullrsquoaltro) dellespecie chimiche in analisi che se si depositano sugli elettrodi possono essere poideterminate per via gravimetrica
CoulombometriaIl termine laquocoulombometriaraquo (gtCapitolo 4) deriva da coulomb lrsquounitagrave di misuradella quantitagrave di carica elettrica In questa tecnica si impone unrsquoopportuna diffe-
Ricordiamo che nelSistema Internazionale ilbar (= 105 Pa) hasostituito lrsquoatmosfera(atm)
ATTIVITAgrave DELLE SPECIE IN SOLUZIONEAPPROFONDIMENTO
5
CLASSIFICAZIONE
renza di potenziale fra due elettrodi e si misura la corrente che circola in un deter-minato intervallo di tempo in seguito ai fenomeni di elettrolisi che si verificanoagli elettrodi
La coulombometria si basa sulla legge di Faraday
(14)
dove bull m egrave la massa bull MM la massa molare della specie chimica che si scaricaallrsquoelettrodo bull F la costante di Faraday bull n il numero di elettroni scambiati nellareazione di scarica bull i lrsquointensitagrave di corrente bull t il tempo
VoltammetriaIn voltammetria (gtCapitolo 5) si misura la variazione della corrente (Δi) che passafra gli elettrodi immersi nella soluzione in analisi al variare del potenziale applicatoa uno di essi (elettrodo di lavoro) Lrsquoelettrodo di lavoro puograve essere allo stato solidooppure egrave costituito da una singola goccia di mercurio pendente da un capillare Se lagoccia di mercurio cade ritmicamente dal capillare e quindi viene continuamenterinnovata durante la scansione si parla piugrave propriamente di polarografia
Lrsquoamperometria egrave una variante della tecnica voltammetrica che consente di ef-fettuare titolazioni Il potenziale dellrsquoelettrodo di lavoro viene mantenuto a un va-lore costante tale da garantire il passaggio di corrente la variazione dellrsquointensitagravedi corrente che si ha durante lrsquoaggiunta di titolante consente di individuare il puntodi equivalenza
ConduttimetriaIn conduttimetria (gtCapitolo 6) si misura la conducibilitagrave elettrica (lrsquoinverso dellaresistenza elettrica) della soluzione in analisi Si possono effettuare misure diret-te mediante elettrodi di conformazione adatta che consentono di determinare peresempio il contenuto salino di una soluzione oppure si possono eseguire titola-zioni registrando la variazione di conducibilitagrave dovuta allrsquoaggiunta del titolante Laconduttimetria sfrutta a fini analitici la seconda legge di Ohm che per soluzionielettrolitiche assume la forma
L = cK (15)
dove bull L egrave la conduttanza della soluzione bull c (lettera greca laquochiraquo) la conducibilitagravespecifica della soluzione bull K la costante di cella
mMM
nF= int i t
0
t
d
La massa molare (MM)di un elementomonoatomico di unamolecola di uno ione oradicale corrisponde allamassa di un numero diAvogadro delle particellein questione Essacoincide con la massaatomica o molecolareespressa in gmol
Con questa tecnica sipossono raccogliereinformazioni siaqualitative siaquantitative sulle speciechimiche presenti insoluzione secondo lamodalitagrave con cui queste siscaricano allrsquoelettrodo
Di solito la misura vieneeffettuata in correntealternata per evitarefenomeni indesiderati dielettrolisi Usandocorrente alternata ad altafrequenza si possonodeterminare anche lecostanti dielettriche disistemi liquidi
6
Potenziometria2
TEORIA
ELETTRODI E POTENZIALE DI ELETTRODOConsideriamo un sistema relativamente semplice (fig 21a) costituito da una lami-na metallica (per esempio di rame Cu) immersa in acqua pura o in una soluzionemolto diluita di un suo sale (per esempio il solfato) Un sistema di questo tipo costi-tuisce una semicella (o semielemento o semplicemente elettrodo)
Allrsquoinizio sia il metallo sia la soluzione sono elettricamente neutri quasi imme-diatamente dopo il contatto perograve si verifica uno scambio spontaneo di materia frail metallo e la soluzione piugrave precisamente si verifica un passaggio di ioni Cu2+ insoluzione
1
Se si usa una lamina dirame laquomarcataraquo cioegravecontenente isotopiradioattivi del rame in uncerto tempo anche lasoluzione manifesta unaleggera radioattivitagravequesto dimostra che unaquantitagrave sia pure minimadi rame egrave passata insoluzione sia in formaionica sia elementare Egravestato infatti dimostratoche in soluzione sonopresenti anche cluster diatomi neutri
Figura 21(a) Semplice semicella elettrochi-mica (b) Rappresentazione sem-plificata del doppio strato elettricoche si forma quando il metalloossidandosi cede ioni positivi allasoluzione Le molecole dipolaridellrsquoacqua sono laquoorientateraquo sianella sfera di solvatazione degliioni sia vicino alla superficie delmetallo che ha carica negativa
Si crea cosigrave uno squilibrio elettrico la soluzione assume carica positiva percheacute gliioni solfato non compensano la carica degli ioni Cu2+ passati in soluzione mentrela lamina di rame che ha trattenuto due elettroni per ogni nuovo ione Cu2+ assumecarica elettrica negativa
Si forma perciograve un doppio strato elettrico (fig 21b) cioegrave una separazione dicarica allrsquointerfaccia metallosoluzione che viene descritta come una differenza di
Caricanegativa
Interfacciametallosoluzione
7
ELETTRODI E POTENZIALE DI ELETTRODO
potenziale (abbreviata ddp) fra la lamina di metallo e la soluzione questa ddp egravedetta potenziale di semicella (o potenziale di elettrodo) Nel nostro esempio lalamina di rame assume carica negativa e quindi ha potenziale negativo mentre lasoluzione assume potenziale positivo
Il potenziale di semicella puograve essere espresso indifferentemente come la diffe-renza di potenziale fra il metallo e la soluzione oppure fra la soluzione e il metallosi tratta di una pura convenzione In questo libro seguiremo la convenzione euro-pea adottata a livello internazionale dalla IUPAC (International Union of Pure andApplied Chemistry) nel 1953 in base alla quale
a se si indica con ye il potenziale del metallo (fase solida) e con ys quello dellasoluzione (fase liquida) la ddp egrave uguale a ye ndash ys Quindi nel nostro esempio ilpotenziale di elettrodo egrave negativo
b le reazioni redox associate a una semicella devono essere scritte nel senso dellariduzione
Quindi per lrsquoelettrodo di rame la reazione di semicella egrave scritta nella forma seguente
Cu2+ + 2endash Cu
Il significato chimico-fisico del potenziale (Ve) assunto dallrsquoelettrodo di rame in se-guito al passaggio spontaneo di ioni Cu2+ in soluzione (per effetto di una ossidazione)egrave il seguente esso rappresenta il lavoro (Le) per unitagrave di carica (q) che bisogna com-piere per realizzare il processo non spontaneo opposto cioegrave il deposito di rame sullalamina (per effetto di una riduzione) Poicheacute i fenomeni in gioco sono sia di naturachimica sia elettrica si parla piugrave correttamente di potenziale elettrochimico dellrsquoe-lettrodo
I potenziali elettrochimici dipendono da un insieme di condizioni standard di tem-peratura pressione e concentrazione fissate inizialmente da coloro che per primi se nesono occupati per esempio 298K per la temperatura e 1 bar per la pressione
Lo stato standard egrave
bull per i solidi il solido purobull per i solventi il solvente purobull per i soluti una soluzione 1 Mbull per i gas il gas puro alla pressione di 1 bar
Il tutto assumendo un comportamento ideale per ogni sistema
In linguaggio matematico
VL
qe
e=
Ovviamente queste considerazioni sono valide anche per il caso in cui la reazionedi riduzione egrave il processo che avviene spontaneamente Ciograve si verifica per esempioquando la soluzione ha una concentrazione di ioni Cu2+ cosigrave elevata che lrsquoeffetto nettodegli scambi metallosoluzione consiste nel trasferimento di ioni sul metallo che per-ciograve acquista una carica positiva e quindi un potenziale positivo rispetto alla soluzioneEsiste anche unrsquounica concentrazione di ioni Cu2+ per la quale non si verifica scam-
Il termine elettrodo chein potenziometria siriferisce allrsquointero sistemametallosoluzione spessoviene riferito alla sola fasesolida (la laminametallica) seguendo cosigravela consuetudine in usonelle tecnicheelettrolitiche
Il lavoro necessario perdepositare uno ione sullalamina riducendolo egrave ditipo sia elettrico (neiconfronti delle forze delcampo elettrostaticogenerato dallrsquoelettrodo)sia elettrico di superficie(per superare il doppiostrato di cariche) siachimico (percheacute nelprocesso di riduzione delloione sul metallointervengono forze dinatura chimica)
8
2 Potenziometria
bio apparente di materia fra il metallo e la soluzione a questa concentrazione le duereazioni opposte (riduzione e ossidazione) procedono alla stessa velocitagrave e il sistemasi trova in uno stato di equilibrio termodinamico fin dallrsquoistante in cui il metalloviene immerso in soluzione
LA FISICA DEI SISTEMI ELETTROCHIMICIAPPROFONDIMENTO
11 Classificazione degli elettrodiUn metallo immerso in una soluzione dei suoi ioni costituisce un elettrodo di pri-ma specie il cui potenziale dipende dalla concentrazione (piugrave precisamente dallrsquoat-tivitagrave) degli ioni in soluzione
Quando invece il metallo si trova in equilibrio con la soluzione di un suo salepoco solubile si ha un elettrodo di seconda specie un filo drsquoargento immerso inuna soluzione satura di AgCl tutto ricoperto dal sale egrave un tipico elettrodo di secon-da specie La reazione di elettrodo egrave
AgCl + endash Ag + Clndash
Un elettrodo di terza specie egrave costituito da un metallo inerte immerso in una solu-zione contenente una coppia redox Un tipico esempio egrave costituito da un filo di pla-tino (un metallo nobile e quindi inerte nelle normali condizioni di lavoro) immersoin una soluzione di ioni Fe2+ e Fe3+ Il metallo si pone in equilibrio con la soluzionedi cui assume il potenziale Infatti la superficie di platino diventa sede dello scam-bio di elettroni fra le due specie ioniche che danno luogo alla reazione
Fe3+ + endash Fe2+
Infine gli elettrodi di quarta specie (che possono essere considerati come una va-riante dei precedenti) sono i cosiddetti elettrodi a gas in cui il metallo inerte e poro-so viene saturato da un gas (per esempio idrogeno) e posto a contatto con una solu-zione contenente la forma ionica del gas (nellrsquoesempio H+) Nel caso dellrsquoidrogeno
2H+ + 2endash H2
12 Calcolo dei potenziali di elettrodo legge di Nernst
Il potenziale di elettrodo egrave tanto maggiore in valore assoluto quanto maggiore egravela differenza di carica nel doppio strato (per esempio quella che si instaura allrsquoe-quilibrio fra i due lati dellrsquointerfaccia metallosoluzione) e dipende sia dalla naturachimica della coppia redox sia dalla concentrazione attiva ovvero dallrsquoattivitagrave degliioni in soluzione
Consideriamo lrsquoequilibrio per una generica semireazione di elettrodo
aox + bB + nendash cred + dD
Allrsquoequilibrio il potenziale di elettrodo che in realtagrave egrave una differenza di potenzialefra il metallo e la soluzione egrave espresso dalla legge di Nernst
+ (21)
Questa legge che prende ilnome dal chimico tedescoWalther H Nernst puograveessere ricavata in base aconsiderazionitermodinamiche edelettrochimiche su cui nonci soffermeremo Si notiin particolare chelrsquoargomento dellogaritmo egrave lrsquoinverso delquoziente di reazione
9
ELETTRODI E POTENZIALE DI ELETTRODO
dove bull E egrave il potenziale di elettrodo (in volt V) bull R la costante dei gas (che vale831451 Jmol times K) bull T la temperatura assoluta (in kelvin K) bull F la costante diFaraday (che vale 96 485 coulombmol) bull n il numero di elettroni scambiati nellasemireazione bull frac12 frac12 indica lrsquoattivitagrave di ciascuna specie scritta fra le due barrette
Edeg egrave il potenziale standard della coppia redox cioegrave il potenziale che la semicellaassume alla temperatura di 25 degC (29815 K) quando tutte le specie hanno attivitagraveunitaria e i gas si trovano alla pressione parziale di 1 bar (100 kPa) o piugrave precisa-mente hanno fugacitagrave unitaria
Lrsquoattivitagrave di ogni specie egrave uguale al prodotto g ∙ C dove g egrave il coefficiente di atti-vitagrave e C la concentrazione analitica espressa in moli su litro (molL)
Se si tiene conto dei coefficienti di attivitagrave e si inseriscono le parentesi quadre [ ]che indicano le concentrazioni in molL (gtpag 33) si ottiene
E ERT
nF
a b
c d= +deg ln
[ox] [B]
[red] [D]acute (22)
dove al posto di Eo compare il cosiddetto potenziale formale (Eoacute) della coppia redoxin oggetto
Il potenziale formale puograve differire in modo significativo dal potenziale standarde si rivela piugrave utile di esso per una valutazione anche solo orientativa del compor-tamento della coppia redox in quanto tiene meglio conto delle reali condizioni incui si opera per esempio il pH della soluzione Ricordiamo infatti che il pH allrsquointer-no di una cellula vale circa 7 (a parte pochissime eccezioni) per cui il potenziale re-dox standard che fa riferimento a pH 0 non risulta molto adatto a descriverne de-terminate caratteristiche Inoltre il potenziale standard delle coppie O2H2O vale123 V ma scende a 081 V a pH 7 Analogamente il potenziale della coppia deidro-ascorbicoascorbico passa da +390 V a +0058 V diventando nettamente riducentecome si addice alle ben note proprietagrave antiossidanti della vitamina C
Quando si lavora con soluzioni molto diluite (al di sotto di 10ndash3 M) si puograveassumere con buona approssimazione che il coefficiente di attivitagrave di tutte lespecie sia uguale a 1 In tali condizioni se si inserisce il valore numerico di RF e ilfattore numerico per la conversione ai logaritmi decimali si ottiene
(23)
Alla temperatura di 25 degC (29815 K) la legge di Nernst assume la sua forma piugravenota e usata
+ (24)
Per esempio per la semireazione
Cu2+ + 2endash Cu
la legge di Nernst (a 25 degC) assume la forma
+
La costante di Faradayequivale alla caricaelettrica di un numerodi Avogadro (cioegrave diuna mole) di elettroniUna mole contiene602214076 times 1023
entitagrave elementari(gtpag 457)
La fugacitagrave egrave la grandezzafisica adottata per i gas alposto della pressione alloscopo di tener conto delloro comportamento nonideale
ln = 23026 log
10
2 Potenziometria
In questa equazione non compare la concentrazione della forma ridotta percheacutelrsquoattivitagrave di una specie chimica pura nelle condizioni standard viene convenzio-nalmente assunta uguale a 1
In effetti spesso si lavora con soluzioni non particolarmente diluite quindi neicalcoli bisogna fare riferimento alle attivitagrave invece che alle concentrazioni di con-seguenza lrsquoequazione (24) diventa
+ log
IL POTENZIALE FORMALEAPPROFONDIMENTO
13 Polarizzazione degli elettrodiIn tutti i casi in cui il sistema dellrsquoelettrodo si discosti dalle condizioni di equilibriotermodinamico la legge di Nernst diventa inadeguata a descrivere il sistema stessoCiograve accade per esempio quando allrsquoelettrodo viene imposto un potenziale arbitra-rio eo la corrente che lo attraversa egrave molto intensa in questi casi il potenziale dielettrodo risulta diverso da quello previsto in base alla legge di Nernst e si dice chelrsquoelettrodo egrave polarizzato
In particolare quando la concentrazione degli ioni alla superficie di un elettrodoegrave diversa da quella nel resto della soluzione si verifica una polarizzazione di con-centrazione in quanto il sistema non si trova nelle condizioni di equilibrio cui fariferimento il modello di Nernst
La polarizzazione puograve derivare anche dal cambiamento dello stato chimico eofisico della superficie di elettrodo oppure dal verificarsi di reazioni chimiche colla-terali alla reazione di elettrodo
LEGGE DI NERNST E GRANDEZZE TERMODINAMICHE COLLEGATEAPPROFONDIMENTO
CELLE GALVANICHE O PILESe si collegano elettricamente fra loro due semicelle (elettrodi) si realizza un dispo-sitivo che puograve erogare corrente si tratta di una cella galvanica (o pila fig 22)
In una pila le due semicelle sono separate da un setto poroso o da un ponte salinoche hanno il solo compito di assicurare il contatto elettrico evitando il rapido me-scolamento delle soluzioni Secondo le caratteristiche dei singoli elettrodi ai duecapi della pila si crea una differenza di potenziale (ddp) detta anche tensione (opotenziale) di cella che quando raggiunge il suo valore massimo egrave detta forzaelettromotrice (abbreviata fem e indicata con il simbolo E) tutti questi terminiindicano che la pila puograve compiere un lavoro (elettrico)
Dal punto di vista fisico la fem di una pila corrisponde al lavoro massimo cheessa puograve fornire In altri termini la fem equivale al lavoro per unitagrave di carica ne-cessario per mantenere costante la ddp fra i due elettrodi
La fem coincide con la ddp solo nel caso in cui il sistema lavori in condizionidi reversibilitagrave termodinamica (ovvero a corrente nulla) In un circuito chiuso in-
Il termine polarizzazionesoprattutto nelleapplicazioni viene spessousato in modo fin troppogenerico per definiresituazioni poco chiare peresempio nellrsquoindustriagalvanica si parla spesso dipolarizzazione quando ilprocesso produttivo nonsegue lrsquoandamento previstoanche se le vere cause sonotutte da definire
2
La fem viene misurata acircuito aperto (ossia incondizioni di equilibrio acorrente nulla) e conterminali di platinomediante un potenziometroo un voltmetro elettronico
Se le soluzioni simescolassero ben prestosi verificherebberoreazioni chimiche direttelaquoindesiderateraquo (peresempio fra elettrodi esoluzione) con rapidoesaurimento del sistema(pila Daniell gtparagrafo24) e sviluppo di calore
11
CELLE GALVANICHE O PILE
vece dove la corrente circola (e non egrave nulla) la ddp in uscita dalla pila egrave sempreminore della fem a causa della laquocaduta di tensioneraquo provocata dal passaggio dicorrente Vale infatti con buona approssimazione la relazione
ddp= fem ndash Ri
dove bull R egrave la resistenza del circuito bull i lrsquointensitagrave di corrente
Per esempio se si collegauna comune pila da 45 Va una lampadina e simisura la ddp ai capi delcircuito si ottiene unvalore piugrave basso (peresempio 33 V)Il valore nominale ditensione sullrsquoinvolucrodella pila infatti indica lafem non la ddp inuscita (che dipende dallaquocaricoraquo effettivo delcircuito)
Figura 22Cella galvanica (pila) Il setto poroso divide (pur mantenen-doli in contatto elettrico fra loro) i due comparti del recipien-te che costituiscono le due semicelle Queste possono con-tenere due diversi elettroliti oppure lo stesso elettrolita maa diversa concentrazione in modo che allrsquoinizio i potenzialisiano diversi Nel primo caso le due lamine sono in generedi metalli differenti nel secondo caso sono uguali fra loroIl circuito esterno egrave formato da conduttori di prima specie ecomprende il dispositivo per la misura della tensione dellapila la corrente (i) e gli elettroni (e-) percorrono il circuito indirezioni opposte
Lrsquoelettrodo piugrave ricco di elettroni cioegrave a potenziale minore egrave detto anodo e costitu-isce il polo negativo della pila mentre lrsquoelettrodo piugrave povero di elettroni cioegrave a po-tenziale maggiore egrave detto catodo e costituisce il polo positivo Attraverso il circuitoesterno lrsquoanodo tende a cedere elettroni al catodo sotto la laquospintaraquo della spontaneatendenza del sistema a eguagliare i potenziali delle due semicelle
Il flusso di elettroni dallrsquoanodo al catodo altera quindi lo stato drsquoequilibrio ini-ziale di ciascuna semicella esso puograve venire ripristinato mediante reazioni di ossida-zione allrsquoanodo e contemporaneamente mediante reazioni di riduzione al catodoInfatti in base alla legge di Nernst (gtparagrafo 12) le reazioni di ossidazione tendo-no a innalzare il potenziale di elettrodo percheacute aumenta la concentrazione dellaforma ossidata (al numeratore dellrsquoargomento logaritmico) viceversa le reazioni diriduzione tendono ad abbassarlo La corrente che si stabilisce nel circuito egrave dovutaalla tendenza spontanea del sistema a raggiungere lrsquoequilibrio termodinamico per-ciograve quando i potenziali dei due elettrodi diventano uguali il flusso di elettronicessa e si dice che la pila egrave laquoscaricaraquo
La pila quindi egrave un dispositivo mediante il quale gli elettroni in gioco in unareazione redox passano attraverso un circuito da una specie chimica a unrsquoaltraOssidante e riducente infatti non vengono posti direttamente a contatto cosiccheacute glielettroni che si scambierebbero sono laquocostrettiraquo a passare attraverso il circuitoesterno Ciograve consente di convertire in energia elettrica e quindi in lavoro lrsquoenergiache si libera in un processo redox spontaneo che genererebbe calore il flusso di
12
2 Potenziometria
corrente si arresta quando egrave soddisfatta la costante di equilibrio della reazione chegenera la pila
Per ragioni storiche il funzionamento delle pile egrave stato spiegato in termini di unflusso di corrente elettrica dovuto a inesistenti cariche elettriche positive che migra-no dal polo a potenziale maggiore (catodo) verso il polo a potenziale minore (ano-do) Per questo motivo il verso convenzionale della corrente elettrica egrave opposto aquello in cui effettivamente circolano gli elettroni
21 Potenziali standard di ossidoriduzioneIn linea di principio per misurare la ddp fra una lamina di metallo e la soluzionein cui egrave immersa (si veda la figura 21a) occorre inserire il dispositivo di misura inmodo che un terminale sia collegato al metallo e lrsquoaltro alla soluzione In questomodo tuttavia si crea un nuovo contatto metallosoluzione e lo strumento finiscecol misurare la ddp fra i due metalli senza dare informazioni sul valore del poten-ziale di ciascuno di essi Quindi il potenziale assoluto di un singolo elettrodo o diuna coppia redox (che egrave la stessa cosa) non puograve essere misurato Si egrave costretti perciogravea effettuare una misura relativa dei potenziali ponendo a confronto due semicellela semicella di cui si vuole misurare il potenziale e una semicella di riferimento co-struita in modo da assumere un potenziale costante
In pratica lrsquoelettrodo di cui si vuole misurare il potenziale viene accoppiato a unelettrodo di riferimento e si misura la ddp di questa pila in condizioni precisamentedefinite
In base a criteri di opportunitagrave pratica e a considerazioni termodinamiche si egravescelto come elettrodo di riferimento il cosiddetto elettrodo standard a idrogeno(SHE Standard Hydrogen Electrode) A tale elettrodo (fig 23) viene assegnato perconvenzione un potenziale di semicella di 00000 V valido a tutte le temperatureper una soluzione che contiene ioni idrogeno ad attivitagrave unitaria e idrogeno gassosoa fugacitagrave unitaria (in pratica alla pressione parziale di 1 bar)
Nella prima fasedi sviluppodellrsquoelettrochimica siparlava anche di elettrodonormale a idrogeno(NHE Normal HydrogenElectrode) riferendosi a unelettrodo di platinoimmerso in una soluzione1 N di un acido forte inquesta soluzione perogravelrsquoattivitagrave del protone egravecirca 08 e quindi ilpotenziale realedellrsquoelettrodo egrave ben diversoda zero Per questo motivonon egrave corretto usare lasigla NHE per indicare ilriferimento standard[Fonte RW RametteJ Chem Ed vol 64 10(ott 1987)]
Figura 23Elettrodo a idrogeno secondo la realizzazione ideata da SPLSoslashrensen Nel gorgogliatore entra idrogeno gassoso purissi-mo che attraversa la soluzione acida e lambisce la lamina diplatino platinato prima di uscire dal secondo gorgogliatore Idue gorgogliatori e lrsquoampolla centrale contengono la stessasoluzione acida La lamina di platino egrave saldata a un filo di plati-no che fuoriesce dal tappo e assicura il collegamento elettricocon lo strumento di misura Il rubinetto e il sifone mettono incontatto la soluzione acida con lrsquoaltro elettrodo formando cosigraveuna pila Quando lrsquoattivitagrave di H+ e la fugacitagrave di H2 sono unitarielrsquoelettrodo egrave in condizioni standard
13
CELLE GALVANICHE O PILE
Le tabelle dei potenziali standard di ossidoriduzione riportano appunto i po-tenziali di coppie redox ad attivitagrave unitaria misurati rispetto allo SHE (a 25 degC) Sele reazioni sono scritte secondo le convenzioni IUPAC cioegrave nel senso della ridu-zione (elettroni a sinistra) egrave piugrave preciso parlare di potenziali standard di riduzione(tab 21) Nelle tabelle le coppie con potenziale positivo sono tendenzialmentepiugrave ossidanti della coppia H+H2 mentre le coppie con potenziale negativo sono piugraveriducenti
In generale per due coppie qualsiasi quella con potenziale standard maggiore egraveossidante (nelle condizioni imposte) nei confronti della coppia con potenziale stan-dard minore Per esempio se si immerge un foglio di alluminio in una soluzionecontenente solfato di rame e solfato di alluminio (ad attivitagrave unitaria) il foglio di
TABELLA 21 | Alcuni potenziali standard di riduzione (Edeg) misurati a 25 degC
Semireazione Edeg(V) Semireazione Edeg(V)
O H e O H O3 2 22 2+ + ++ minus 2076 Cu e Cu s2
2+ minus+ ( ) 0342
S O e SO2 82
422 2minus minus minus+ 2010 Hg Cl s e Hg Cl2 2 2 2 2( )+ +minus minus
0268
H O H e H O2 2 22 2 2+ ++ minus 1776 AgCl s e Ag Cl( )+ +minus minus
0222
MnO H e MnO s H O4 2 24 3 2minus + minus+ + + ( ) 1679 Cu e Cu2+ minus ++ 0153
Ce e Ce4 3+ minus ++ 172 Sn e Sn in HCl M4 22 1+ minus ++ ( ) 0151
MnO H e Mn H O42
28 5 4minus + minus ++ + + 1507 S H e H S g+ ++ minus2 2 2 ( ) 0142
PbO H e Pb H O22
24 2 2+ + ++ minus + 1455 S O e S O4 6
22 3
22 2minus minus minus+ 008
Cl e Cl2 2 2+ minus minus 1358 AgBr s e Ag Br( )+ +minus minus
0071
Cr O H e Cr H O2 72 3
214 6 2 7minus + minus ++ + + 1350 2H ++ 2e-H2 00000
O g H e H O2 24 4 2( )+ ++ minus 1229 Pb e Pb2
2+ minus+ ndash0126
2 12 10 63 2 2IO H e I H Ominus + minus+ + + 1195 Sn e Sn22
+ minus+ ndash0137
Br l e Br2 2 2( )+ minus minus 1066 Ni e Ni2
2+ minus+ ndash0257
NO H e HNO H O3 2 23 2minus + minus+ + + 0934 Co e Co22
+ minus+ ndash0282
2 22
2
2Hg e Hg+ minus ++ 0920 Fe e Fe22
+ minus+ ndash0447
Cu I e CuI2+ minus minus+ + 086 Zn e Zn22
+ minus+ ndash0762
Ag e Ag+ minus+ 0799 Mn e Mn22
+ minus+ ndash1185
Hg e Hg2
22 2
+ minus+ 0797 Al e Al33
+ minus+ ndash1662
Fe e Fe3 2+ minus ++ 0771 Mg e Mg22
+ minus+ ndash2372
O g H e H O2 2 22 2( )+ ++ minus 0695 Na e Na+ minus+ ndash2710
I e I3 2 3minus minus minus+ 0536 Ca e Ca22
+ minus+ ndash2868
I e I2 2 2+ minus minus 0535 K e K+ minus+ ndash2931
Cu e Cu+ minus+ 0521 Li e Li+ minus+ ndash3040
Fe CN e Fe CN( ) ( )63
64minus minus minus+ 0358
14
2 Potenziometria
alluminio si dissolve mentre si deposita rame metallico Infatti i potenziali stan-dard delle due coppie redox sono
Cu2+ + 2endash Cu Edeg= +034 V
Al3+ + 3endash Al Edeg= ndash166 V
Nella soluzione quindi lo ione Cu2+ (forma ossidata della coppia con potenzialemaggiore) tende a ossidare Al (forma ridotta della coppia con potenziale minore)
TABELLA DEI POTENZIALI STANDARD DI RIDUZIONEAPPROFONDIMENTO
22 Tensione pratica (ddp) di una pila
Lrsquoinsieme dei conduttori di prima e di seconda specie che in sequenza opportunaformano una pila (o in generale un sistema elettrochimico) costituisce una catenagalvanica La differenza di potenziale (Ecella) che si misura ai capi di una pila durantelrsquoerogazione di corrente egrave dovuta a diversi contributi piugrave precisamente egrave uguale allasomma algebrica di tutte le cadute di tensione che si verificano lungo lrsquointero circuito
Ecella= E1 + E2 + E3 + E4 + E5 (25)
dove bull E1 egrave la ddp dovuta allrsquoeventuale passaggio di corrente nel circuito (cadutaohmica) bull E2 la ddp di contatto metallometallo (tensione di Volta) bull E3 la ddpdi contatto soluzionesoluzione (tensione o potenziale di giunzione liquida) bull E4 edE5 le ddp di contatto metallosoluzione (tensione di Nernst) per ciascun elettrodo
Esaminiamo ora il significato dei singoli contributi
Caduta ohmica Quando la cella egrave attraversata da corrente inevitabilmente si ve-rifica una caduta di tensione E = R times i (prima legge di Ohm) Ovviamente se lamisura del potenziale di cella viene effettuata in condizioni tali da minimizzareo eliminare il passaggio di corrente (cioegrave a circuito aperto) la caduta ohmica siannulla (cioegrave E1= 0)
Tensione di Volta Quando due diversi metalli vengono posti a contatto si generasempre una ddp Questo fenomeno detto effetto Volta egrave dovuto al fatto che glielettroni di conduzione sono trattenuti con diversa energia dai diversi metalli Per-ciograve il contatto fra due metalli provoca un trasferimento di elettroni istantaneo daparte del metallo che li trattiene con minore energia Il processo perograve non prose-gue indefinitamente il trasferimento di elettroni infatti prosegue fino allrsquoequili-brio quando insorge una ddp (in genere di pochi millivolt) sufficiente a bloccarlo
Si puograve verificare sperimentalmente (e dimostrare) che la ddp agli estremi diuna catena di conduttori di prima specie egrave uguale a quella che si stabilisce se i duemetalli che ne costituiscono gli estremi vengono posti a diretto contatto (fig 24)Di conseguenza se gli ingressi del misuratore di tensione sono costituiti dallo stessometallo lrsquoeffetto Volta complessivo egrave nullo (E2= 0)
In altri termini la formaossidata della coppia conpotenziale piugrave alto egraveossidante nei confrontidella forma ridotta dellacoppia con potenzialepiugrave basso
A rigore si dovrebbe usareil simbolo V (o ∆V)percheacute si tratta di unaddp misurata in una pilain funzione e dunquenon di una fem Il pedicelaquocellaraquo puntualizza che sitratta in generale di unacella elettrochimica
R egrave la resistenza delconduttore e i lrsquointensitagravedi corrente
15
CELLE GALVANICHE O PILE
Potenziale di giunzione liquida In una pila le due semicelle sono separate matenute in contatto elettrico mediante un setto poroso o un ponte salino che con-sente un mescolamento lentissimo (praticamente nullo) delle soluzioni Questidispositivi (si veda la figura 25) perograve creano unrsquoulteriore caduta di tensione fragli elettrodi detta potenziale di giunzione liquida (Eg) o anche potenziale dicontatto (o di diffusione) Il potenziale di giunzione liquida puograve essere sia po-sitivo sia negativo e quindi fa aumentare o viceversa diminuire la ddp fra glielettrodi
Lrsquoinsorgere di un potenziale di giunzione egrave causato dal fatto che gli ioni si dif-fondono con diversa mobilitagrave attraverso le superfici di contatto di due mezzi di-versi un setto poroso per esempio egrave diversamente permeabile agli ioni propriosecondo la loro mobilitagrave
Tensione di Nernst I potenziali di contatto metallosoluzione (E4 E5) si calco-lano in teoria mediante la legge di Nernst e perciograve sono detti potenziali nern-stiani
LA MOBILITAgrave DEGLI IONI IN SOLUZIONEAPPROFONDIMENTO
23 Calcolo della tensione teorica (fem) di una pilaSe si opera in modo da rendere trascurabili i primi tre termini dellrsquoequazione (22)la ddp ai capi della pila coincide in pratica con la sua fem che puograve essere cal-colata semplicemente in base agli ultimi due termini cioegrave ai potenziali di elettrodoNei calcoli occorre tenere presente che
a la fem di una pila in quanto strettamente collegata al lavoro da essa compiutodeve necessariamente avere segno positivo
b lrsquoelettrodo a potenziale maggiore su cui avviene la riduzione egrave il catodo lrsquoelet-trodo a potenziale minore su cui avviene lrsquoossidazione egrave lrsquoanodo
Di conseguenza la fem di una pila cioegrave di una cella elettrochimica ottenuta colle-gando due semicelle (catodica e anodica) egrave espressa dalla seguente relazione
Ecella = Ec ndash Ea (26)
ovvero
Ecella = Emaggiore ndash Eminore (27)
Questa seconda scrittura mostra chiaramente che la fem della pila egrave sempre posi-tiva anche nel caso in cui i potenziali delle due semicelle siano entrambi negativi
Indichiamo con Ec ilpotenziale del catodo (opotenziale catodico) econ Ea il potenzialedellrsquoanodo (o potenzialeanodico)
Figura 24Nonostante ogni superficie di contatto fra due metallisia sede di una ddp dovuta allrsquoeffetto Volta la ddpche si instaura fra rame e zinco egrave la stessa sia nel caso(a) sia nel caso (b) Infatti se cosigrave non fosse chiudendola catena aperta (a) si dovrebbe osservare un passaggiodi corrente e questo in realtagrave non avviene
a b
16
2 Potenziometria
ESEMPIO 1UNA IPOTETICA PILA Egrave COSTITUITA DALLE COPPIE REDOX Al3+Al E Ni2+NiQUAL Egrave LA FEM DELLA PILA SE LE ATTIVITAgrave DI TUTTE LE SPECIE IONICHE SONOUNITARIE
Dal momento che le attivitagrave sono unitarie il calcolo fornisce la tensione (o forzaelettromotrice) standard della pila
Innanzitutto dalla tabella dei potenziali standard si ricavano i potenziali stan-dard per ciascuna coppia redox
Al3+ + 3endash Al Eo
= ndash166 V
Ni2+ + 2endash Ni Eo
= ndash026 V
Lrsquoelettrodo della coppia Ni2+Ni costituisce il catodo percheacute ha il potenziale mag-giore mentre lrsquoelettrodo della coppia Al3+Al costituisce lrsquoanodo percheacute ha il poten-ziale minore Si puograve anche costruire un diagramma di questo tipo
Al3+Al Ni2+Ni H+H2
ndash166 ndash026 00000 Edeg(V rif a SHE)
Quindi la fem della pila in condizioni standard egrave
Ecella= Ec ndash Ea= Emaggiore ndash Eminore= ndash026 ndash (ndash166)= +140 V
La reazione di ossidoriduzione che genera la pila si ottiene formalmente combi-nando le due semireazioni bilanciate quella di riduzione al catodo e quella di os-sidazione allrsquoanodo Ciascuna semireazione deve essere moltiplicata per un fattorenumerico tale che il numero di elettroni ceduti dalla specie che si ossida sia uguale aquello degli elettroni acquistati dalla specie che si riduce Quindi nel caso dellrsquoesem-pio proposto si moltiplica la semireazione della coppia Al3+Al per 2 e quella dellacoppia Ni2+Ni per 3
2 middot (Al Al3+ + 3endash) Edeg= ndash(ndash166 V) (ndash)
3 middot (Ni2+ + 2endash Ni) Edeg= ndash026 V (+)
2Al + 3Ni2+ 2Al3+ + 3Ni Edeg= +140 V
Attenzione per ottenere il bilancio della reazione di cella si moltiplica per un coeffi-ciente opportuno ciascuna semireazione ma non il rispettivo potenziale Infatti i po-tenziali di elettrodo (e quindi anche il potenziale di cella) esprimono un lavoro elettricoper unitagrave di carica e perciograve sono proprietagrave intensive che non dipendono dalla quantitagravedi materia contenuta nel sistema ovvero dal numero di cariche elettriche trasportate
Se le attivitagrave non sono unitarie per calcolare il potenziale di elettrodo occorreapplicare lrsquoequazione di Nernst
Egrave ovvio comunque che il lavoro complessivo che puograve essere fornito da una piladipende anche dalla massa e dalla geometria degli elettrodi Per questo motivo unapila o un insieme di pile (cioegrave una batteria) che viene utilizzata per esempio permuovere un veicolo puograve avere dimensioni ingombranti Questo accadeva fino anon molti anni fa per le vecchie batterie al piombo ora sempre piugrave sostituite dabatterie come quelle al litio decisamente piugrave compatte e che infatti stanno rendendopossibile il progressivo passaggio allrsquoauto parzialmente o completamente elettrica
UNA IPOTETICA PILA Egrave COSTITUITA DALLE COPPIE REDOX Al3+Al E Ni2+NiQUAL Egrave LA FEM DELLA PILA SE LE ATTIVITAgrave DI TUTTE LE SPECIE IONICHE SONOUNITARIE
Nella pila la reazionedella coppiadella coppia Ni2+Ni(Ni2+ si riduce) avvienenel senso conforme allaconvenzione adottata per ipotenziali (elettroni asinistra) invece lareazione della coppiaAl3+Al (Al si ossida)avviene nel senso oppostoa quello convenzionalePerciograve il potenziale Edegdella coppia Al3+Al vieneconsiderato con segnoopposto a quello tabulato(+166 V) Se si sommaalgebricamente ilpotenziale dellrsquoelettrodoche si riduce (Ec) conquello dellrsquoelettrodo che siossida cambiato di segno(Ea) la tensione della pilarisulta positiva
17
CELLE GALVANICHE O PILE
ESEMPIO 2UNA IPOTETICA PILA Egrave COSTITUITA DALLE COPPIE REDOX Al3+Al E Ni2+NiQUAL Egrave LA FEM DELLA PILA A 25 degC SE LE CONCENTRAZIONI DELLE SPECIEIONICHE SONO RISPETTIVAMENTE [Al3+] = 2 10ndash2 M E [Ni2+] = 10ndash2 M
Approssimando le attivitagrave con le concentrazioni si ottiene
La situazione non egrave sostanzialmente cambiata rispetto alle condizioni standardpercheacute anche in questo caso la reazione di cella comporta lrsquoossidazione dellrsquoallumi-nio e la riduzione del nichel La fem della pila quindi egrave
Ecella= Ec ndash Ea= ndash032 ndash (ndash167)= +135 V
24 Alcuni tipi di pile
Pila DaniellUna semicella egrave costituita da una lamina di rame immersa in una soluzione diCuSO4 lrsquoaltra semicella da una lamina di zinco immersa in una soluzione di ZnSO4
(fig 25) Le due semicelle sono separate da un setto poroso (in pratica una mem-brana di vetro sinterizzato o analogo materiale inerte) oppure si trovano in duediversi recipienti collegati da un ponte salino
Le reazioni di elettrodo sono
Zn2+ + 2endash Zn Edeg= ndash0762 V
Cu2+ + 2endash Cu Edeg= 0342 V
Le concentrazioni dei sali nelle rispettive semicelle sono in genere tali da renderenegativo il semielemento di zinco che perciograve tende a cedere elettroni al rame (ossi-dandosi) La lamina di zinco egrave dunque il polo negativo (anodo) della pila e il rameegrave il polo positivo (catodo)
La rappresentazione della catena galvanica di questa pila secondo le convenzioniIUPAC egrave
(ndash) Zn(s)|ZnSO4(aq)||CuSO4(aq)|Cu(s) (+)
UNA IPOTETICA PILA Egrave COSTITUITA DALLE COPPIE REDOX Al3+Al E Ni2+NiQUAL Egrave LA FEM DELLA PILA A 25 degC SE LE CONCENTRAZIONI DELLE SPECIEIONICHE SONO RISPETTIVAMENTE [Al3+] = 2 10ndash2 M E [Ni2+] = 10ndash2 M
Si noti che se i duescomparti non fosseroscomparti non fosseroben separati dal settoben separati dal settoporoso ben presto gli ioniporoso ben presto gli ionirame disponibilirame disponibiliraggiungerebbero lrsquoraggiungerebbero lrsquoanododi zinco ossidandolo eandando a depositarsi sudi esso come Cumetallico nondiversamente da quanto sipuograve osservareimmergendo una barrettadi zinco in una soluzionedi solfato di rameesaurendo quindirapidamente la pila esviluppando calore
Figura 25Pila Daniell (a) con settoporoso e (b) con pontesalino
a b
18
2 Potenziometria
La coppia di barrette verticali (||) al centro rappresenta il setto poroso o il pontesalino che separano le due semicelle lrsquoanodo egrave scritto a sinistra e per ciascun elet-trodo la forma ridotta della coppia redox egrave scritta verso lrsquoesterno Le lettere scrittefra parentesi indicano lo stato fisico di ogni specie chimica
La reazione di cella egrave
Zn + Cu2+ Zn2+ + Cu
Per calcolare la fem teorica di questa pila che puograve anche trovarsi in condizionidiverse da quelle standard si applica la legge di Nernst a ciascuna semicella
(28)
(29)
I potenziali standard delle due semicelle sono cosigrave diversi fra loro che nelle normalicondizioni operative di una pila Daniell il rame rappresenta il polo positivo e lozinco il polo negativo
Sottraendo il potenziale minore da quello maggiore si ottiene il potenziale dicella
Ecella = ECu2+Cu - EZn2+Zn
Ponendo Edegcella = EdegCu2+Cu ndash EdegZn2+Zn (= 0342 V + 0762 V) e quindi sottraendo la(28 dalla 29) si ricava infine
Questa equazione consente dunque di calcolare il potenziale di Nernst se egrave notoil valore effettivo dellrsquoattivitagrave degli ioni Zn2+ e Cu2+ Tuttavia il calcolo si presta aerrori anche significativi lrsquoattivitagrave degli ioni per esempio varia in funzione dellaforza ionica della soluzione e non puograve essere calcolata Perciograve la fem reale piugraveesattamente la ddp che si misura si discosta dal valore calcolato sostanzialmenteper due motivi
a il sistema non si comporta in maniera ideale (per esempio gli elettrodi possonopolarizzarsi)
b il contributo della caduta ohmica (gtequazione 25) puograve essere praticamente an-nullato se nel circuito viene fatta circolare una corrente trascurabile invece ilpotenziale di giunzione liquida per quanto piccolo non puograve essere soppresso enon egrave prevedibile in base a equazioni teoriche
Pile a concentrazioneIn questo tipo di pila le due semicelle contengono due soluzioni di una stessa cop-pia redox ma a diversa concentrazione gli elettrodi sono inerti oppure dello stes-so metallo e le semicelle sono collegate da un setto poroso o da un ponte salino(fig 26)
In questo calcolotrascuriamo i contributidei termini E1 E2 E3 dellaequazione (25)
Lrsquoequazione rappresentain pratica la legge diNernst applicata allareazione redox globalescritta nel verso dellaspontaneitagrave tenendoconto degli elettroniscambiati (2) e inserendonellrsquoargomento dellogaritmo lrsquoinverso delquoziente di reazione
+
19
CELLE GALVANICHE O PILE
Le due soluzioni si scambiano elettroni attraverso il circuito esterno mentre ilsetto poroso (o il ponte salino) che le collega consente il passaggio di ioni e quin-di chiude il circuito Il sistema raggiunge lrsquoequilibrio quando le attivitagrave degli ioninelle due semicelle diventano uguali perciograve egrave prevedibile che nella soluzione piugravediluita avvenga lrsquoossidazione il rame metallico si dissolve e si formano ioni Cu2+ insoluzione questo dunque egrave lrsquoanodo Contemporaneamente gli elettroni passanonellrsquoaltro comparto (a destra in figura 26) attraverso il circuito esterno e riduconogli ioni Cu2+ che si depositano sullrsquoelettrodo come rame metallico questo dunqueegrave il catodo
In pratica egrave come se gli ioni Cu2+ si trasferissero dalla soluzione piugrave concentrataalla soluzione piugrave diluita Queste pile dunque trasformano in lavoro elettrico lrsquoe-nergia che si libera nel processo spontaneo con cui due soluzioni a diretto contattotendono a raggiungere lrsquoequilibrio di concentrazione
La rappresentazione convenzionale della catena elettrodica di questa pila a con-centrazione egrave la seguente
(-) Cu(s) |Cu2+(001 M)||Cu2+(1 M)|Cu(s) (+)
Per calcolare la tensione teorica della pila si applica la legge di Nernst a ciascun elet-trodo Approssimando le attivitagrave con le concentrazioni (a 25 degC) si ottiene
(soluzione piugrave diluita anodo)
(soluzione piugrave concentrata catodo)
Quindi
Ecella= Emaggiore ndash Eminore= 0342- 0283= 0059 V
ALTRI TIPI DI CELLE GALVANICHE O PILEAPPROFONDIMENTO
Figura 26Pila a concentrazione il compartoanodico (a sinistra) contiene ioni Cu2+
in concentrazione 001 M e il com-parto catodico (a destra) contieneioni Cu2+ in concentrazione 1 M Ilcollegamento fra le due semicelle egraverealizzato con un ponte salino
20
2 Potenziometria
STRUMENTAZIONEIn potenziometria si misura la differenza di potenziale che si stabilisce fra due semi-celle allo scopo di determinare la concentrazione di uno ione o per seguire lrsquoanda-mento di una titolazione
Il dispositivo completo per una misura potenziometrica (fig 27) consiste es-senzialmente di
bull un potenziometro o meglio un millivoltmetro elettronicobull un elettrodo di riferimentobull un elettrodo di misura
Il potenziometro serve per misurare la ddp fra i due elettrodi senza alterare il lorostato di equilibrio perciograve si lavora a corrente praticamente nulla
Gli elettrodi collegati al potenziometro sono immersi nella soluzione su cui sieffettuano le misure Lrsquoelettrodo di riferimento egrave costruito in modo tale da mante-nere costante il suo potenziale di conseguenza ogni variazione di ddp misurata egraveimputabile esclusivamente allrsquoelettrodo di misura (piugrave precisamente alla soluzioneanalizzata)
ELETTRODI DI RIFERIMENTOLrsquoelettrodo standard a idrogeno (SHE gtparagrafo 21) egrave lrsquoelettrodo di riferimentoprimario Tuttavia nella pratica quotidiana di laboratorio si usano elettrodi di ri-ferimento secondari piugrave semplici e maneggevoli che hanno comunque la proprie-tagrave di mantenere il proprio potenziale costante a temperatura costante Tratteremoora in maggior dettaglio gli elettrodi di uso piugrave comune
31 Elettrodo ad argentocloruro drsquoargento
Si tratta senzrsquoaltro dellrsquoelettrodo piugrave diffuso Il dispositivo egrave costituito da un sem-plice filo drsquoargento rivestito di AgCl e immerso in una soluzione di KCl (egrave dunqueun elettrodo di seconda specie) Il tutto egrave contenuto in un tubicino di vetro dotatodi setto poroso per assicurare il contatto elettrico con lrsquoesterno ovvero con la so-luzione in cui viene immerso lrsquooggetto dellrsquoanalisi
Figura 27Rappresentazione schematica deldispositivo completo per misurepotenziometriche
3
21
ELETTRODI DI RIFERIMENTO
La rappresentazione convenzionale dellrsquoelettrodo (fig 28) egrave
Ag(s)|AgCl(aq)|KCl(aq)
La reazione di elettrodo egrave
AgCl + endash Ag + Clndash
E il potenziale di elettrodo
E= EdegAgClAg
Considerando unitarie le attivitagrave dei solidi puri si ottiene
E= EdegAgClAg ndash 01984 10ndash3 T log[Clndash] (210)
Se lrsquoattivitagrave degli ioni cloruro egrave costante (a temperatura costante) il potenziale dielettrodo rimane costante Gli elettrodi piugrave comuni contengono soluzioni sature diKCl (circa 42 M) e perciograve sono detti saturi (SSC Saturated Silver-Silver ChlorideElectrode) A 25 degC il potenziale di SSC vale 0197 V Questo elettrodo puograve essereusato fino a 105 degC Nella tabella 1 ndash lab 1 (gtpag 39) sono riportati i potenziali alvariare della temperatura per lrsquoelettrodo saturo e 3 M
Gli anioni (come il solfuro) che formano con Ag+ sali meno solubili di AgClpossono danneggiare questo tipo di elettrodo Anche gli ossidanti e i riducenti fortie gli agenti complessanti possono interferire con la reazione di elettrodo per proteg-gere lrsquoelettrodo da queste sostanze si usa un elettrolita intermedio come nel casodellrsquoelettrodo a calomelano saturo (SCE gtparagrafo 32)
Gli elettrodi ad argentocloruro di argento sono usati come riferimento internonegli elettrodi a vetro (gtparagrafo 41)
32 Elettrodo a calomelano
laquoCalomelanoraquo egrave il nome comune del cloruro mercuroso (I) Hg2Cl2 che fa parteappunto di questo elettrodo (fig 29a) La rappresentazione convenzionale dellrsquoe-lettrodo egrave
Hg(l)|Hg2Cl2(s)|KCl(aq)
La reazione di elettrodo egrave
Hg2Cl2 + 2endash 2Hg + 2Clndash
e il potenziale di elettrodo in base alla legge di Nernst
In condizioni standard lrsquoattivitagrave di solidi e liquidi puri egrave considerata uguale a 1quindi
da cui
ndash 01984 10ndash3 T log|Clndash| (211)
Sono anche molto diffusigli elettrodi contenentiKCl 3 M cioegrave quasisaturi Il vantaggio egrave chein queste soluzioni non siformano cristalli di KClche possono danneggiarelrsquoelettrodo ostruendoil setto poroso che sta sulfondo
Figura 28Elettrodo ad AgAgCILa soluzione tamponeinterna contiene ioni K+
e CIndash ad attivitagrave costante
22
2 Potenziometria
Il potenziale dellrsquoelettrodo a calomelano dunque dipende solo dallrsquoattivitagrave delloione cloruro e dalla temperatura Se la temperatura egrave costante e lrsquoattivitagrave dello ionecloruro nella soluzione interna allrsquoelettrodo non varia il potenziale rimane costante
Gli elettrodi a calomelano piugrave comuni contengono soluzioni sature di KCl (circa42 M) e perciograve sono detti saturi (SCE Saturated Calomel Electrode) Si usano ancheelettrodi a KCl 1 M e 01 M la tabella 22 riporta il potenziale assunto da questielettrodi secondo la concentrazione di KCl
TABELLA 22 | Potenziale (mV) di alcuni elettrodi di riferimento a 25 degC
AgAgCl Calomelano HgHgO HgHgSO4 Thalamid
KCl 01 M 288 KCl 01 M 334 NaOH 01 M 165 H2SO4 05 M 682 KCl 3 M -567
KCl 1 M 235 KCl 1 M 280 NaOH 1 M 140 K2SO4 sat 650 KCl sat -577
KCl 3 M 210 KCl 35 M 250
KCl 35 M 205 KCl sat 241
KCl sat 199 NaCl sat 236
NaCl 3 M 209
NaCl sat 197
Lrsquoelettrodo a calomelano puograve essere usato fino a circa 70 degC a temperature piugrave alteil calomelano si dismuta (Hg2Cl2 Hg + HgCl2)
I solfuri gli ossidanti i forti riducenti e gli agenti complessanti che formanoamalgami con gli ioni Hg2
2+ possono danneggiare questo tipo di elettrodo Perciogravequando si lavora in presenza di queste sostanze si usano elettrodi a doppia giun-zione (fig 29b) in cui fra lrsquoelettrodo e la soluzione egrave interposto un contenitoreriempito con un elettrolita intermedio (per esempio KNO3)
Va infine segnalata la tendenza a non usare il mercurio per motivi tossicologicie questo spiega il progressivo abbandono nella pratica comune di questo tipo dielettrodo con grande rammarico dagli elettrochimici percheacute lrsquoelettrodo a calomela-no egrave il piugrave stabile
bullELETTRODI DI PRIMA E DI SECONDA SPECIE bullALTRI ELETTRODI DI RIFERIMENTO
APPROFONDIMENTI
Figura 29(a) Elettrodo a calomelano (b) Nella versione adoppia giunzione egrave presente una seconda cameraper lrsquoelettrolita intermedio che viene immessoattraverso la bocchetta laterale il setto porosoassicura il contatto elettrico con la soluzioneesterna
a b

4
1 Metodi elettrochimici
dove bull E egrave il potenziale assunto dallrsquoelettrodo di misura bull Edeg il potenziale standardassunto dallrsquoelettrodo (a 25 degC e 1 bar) quando le forme ossidata e ridotta han-no attivitagrave unitaria e la misura di potenziale viene effettuata rispetto allrsquoelettro-do standard a idrogeno (abbreviato SHE) bull R la costante termodinamica dei gasbull T la temperatura (in kelvin) bull F la costante di Faraday bull n il numero di elettroni(endash) scambiati nella reazione redox bull frac12oxfrac12 e frac12redfrac12 indicano le attivitagrave delle speciescritte fra le due barrette
La misura in genere viene eseguita con un millivoltmetro (o voltmetro elettronico)uno strumento in grado di misurare la differenza di potenziale fra gli elettrodi incondizioni di corrente praticamente nulla
Il valore di E o la sua variazione ΔE sono utili per determinare importanti pa-rametri chimico-fisici (come il pH) o per stabilire il punto di equivalenza nelle ti-tolazioni
22 Metodi a corrente diversa da zeroelettrogravimetria coulombometria voltammetriae conduttimetria
Nellrsquoambito di questi metodi si misura lrsquoentitagrave della corrente che attraversa la cellaquando a essa viene applicata attraverso gli elettrodi una differenza di potenzialefissa o fatta variare in maniera opportuna Si tratta insomma di operare inmodo laquoattivoraquo sul campione turbandone le condizioni di equilibrio in modo daraccogliere la laquorisposta elettricaraquo proveniente da esso
Il fenomeno principale che sta alla base di tutti questi metodi egrave quello dellrsquoelet-trolisi e per questo si parla anche di metodi elettrolitici Ce ne occuperemo ampia-mente nel Capitolo 3
Di seguito riassumiamo i principali metodi elettrolitici
ElettrogravimetriaLrsquoelettrogravimetria (gtCapitolo 4) egrave la piugrave antica tecnica elettrochimica che si basasul fenomeno dellrsquoelettrolisi Due elettrodi opportunamente conformati sono im-mersi nella soluzione in esame a determinati potenziali assunti dagli elettrodi siverifica la scarica (cioegrave lrsquoossidazione su un elettrodo e la riduzione sullrsquoaltro) dellespecie chimiche in analisi che se si depositano sugli elettrodi possono essere poideterminate per via gravimetrica
CoulombometriaIl termine laquocoulombometriaraquo (gtCapitolo 4) deriva da coulomb lrsquounitagrave di misuradella quantitagrave di carica elettrica In questa tecnica si impone unrsquoopportuna diffe-
Ricordiamo che nelSistema Internazionale ilbar (= 105 Pa) hasostituito lrsquoatmosfera(atm)
ATTIVITAgrave DELLE SPECIE IN SOLUZIONEAPPROFONDIMENTO
5
CLASSIFICAZIONE
renza di potenziale fra due elettrodi e si misura la corrente che circola in un deter-minato intervallo di tempo in seguito ai fenomeni di elettrolisi che si verificanoagli elettrodi
La coulombometria si basa sulla legge di Faraday
(14)
dove bull m egrave la massa bull MM la massa molare della specie chimica che si scaricaallrsquoelettrodo bull F la costante di Faraday bull n il numero di elettroni scambiati nellareazione di scarica bull i lrsquointensitagrave di corrente bull t il tempo
VoltammetriaIn voltammetria (gtCapitolo 5) si misura la variazione della corrente (Δi) che passafra gli elettrodi immersi nella soluzione in analisi al variare del potenziale applicatoa uno di essi (elettrodo di lavoro) Lrsquoelettrodo di lavoro puograve essere allo stato solidooppure egrave costituito da una singola goccia di mercurio pendente da un capillare Se lagoccia di mercurio cade ritmicamente dal capillare e quindi viene continuamenterinnovata durante la scansione si parla piugrave propriamente di polarografia
Lrsquoamperometria egrave una variante della tecnica voltammetrica che consente di ef-fettuare titolazioni Il potenziale dellrsquoelettrodo di lavoro viene mantenuto a un va-lore costante tale da garantire il passaggio di corrente la variazione dellrsquointensitagravedi corrente che si ha durante lrsquoaggiunta di titolante consente di individuare il puntodi equivalenza
ConduttimetriaIn conduttimetria (gtCapitolo 6) si misura la conducibilitagrave elettrica (lrsquoinverso dellaresistenza elettrica) della soluzione in analisi Si possono effettuare misure diret-te mediante elettrodi di conformazione adatta che consentono di determinare peresempio il contenuto salino di una soluzione oppure si possono eseguire titola-zioni registrando la variazione di conducibilitagrave dovuta allrsquoaggiunta del titolante Laconduttimetria sfrutta a fini analitici la seconda legge di Ohm che per soluzionielettrolitiche assume la forma
L = cK (15)
dove bull L egrave la conduttanza della soluzione bull c (lettera greca laquochiraquo) la conducibilitagravespecifica della soluzione bull K la costante di cella
mMM
nF= int i t
0
t
d
La massa molare (MM)di un elementomonoatomico di unamolecola di uno ione oradicale corrisponde allamassa di un numero diAvogadro delle particellein questione Essacoincide con la massaatomica o molecolareespressa in gmol
Con questa tecnica sipossono raccogliereinformazioni siaqualitative siaquantitative sulle speciechimiche presenti insoluzione secondo lamodalitagrave con cui queste siscaricano allrsquoelettrodo
Di solito la misura vieneeffettuata in correntealternata per evitarefenomeni indesiderati dielettrolisi Usandocorrente alternata ad altafrequenza si possonodeterminare anche lecostanti dielettriche disistemi liquidi
6
Potenziometria2
TEORIA
ELETTRODI E POTENZIALE DI ELETTRODOConsideriamo un sistema relativamente semplice (fig 21a) costituito da una lami-na metallica (per esempio di rame Cu) immersa in acqua pura o in una soluzionemolto diluita di un suo sale (per esempio il solfato) Un sistema di questo tipo costi-tuisce una semicella (o semielemento o semplicemente elettrodo)
Allrsquoinizio sia il metallo sia la soluzione sono elettricamente neutri quasi imme-diatamente dopo il contatto perograve si verifica uno scambio spontaneo di materia frail metallo e la soluzione piugrave precisamente si verifica un passaggio di ioni Cu2+ insoluzione
1
Se si usa una lamina dirame laquomarcataraquo cioegravecontenente isotopiradioattivi del rame in uncerto tempo anche lasoluzione manifesta unaleggera radioattivitagravequesto dimostra che unaquantitagrave sia pure minimadi rame egrave passata insoluzione sia in formaionica sia elementare Egravestato infatti dimostratoche in soluzione sonopresenti anche cluster diatomi neutri
Figura 21(a) Semplice semicella elettrochi-mica (b) Rappresentazione sem-plificata del doppio strato elettricoche si forma quando il metalloossidandosi cede ioni positivi allasoluzione Le molecole dipolaridellrsquoacqua sono laquoorientateraquo sianella sfera di solvatazione degliioni sia vicino alla superficie delmetallo che ha carica negativa
Si crea cosigrave uno squilibrio elettrico la soluzione assume carica positiva percheacute gliioni solfato non compensano la carica degli ioni Cu2+ passati in soluzione mentrela lamina di rame che ha trattenuto due elettroni per ogni nuovo ione Cu2+ assumecarica elettrica negativa
Si forma perciograve un doppio strato elettrico (fig 21b) cioegrave una separazione dicarica allrsquointerfaccia metallosoluzione che viene descritta come una differenza di
Caricanegativa
Interfacciametallosoluzione
7
ELETTRODI E POTENZIALE DI ELETTRODO
potenziale (abbreviata ddp) fra la lamina di metallo e la soluzione questa ddp egravedetta potenziale di semicella (o potenziale di elettrodo) Nel nostro esempio lalamina di rame assume carica negativa e quindi ha potenziale negativo mentre lasoluzione assume potenziale positivo
Il potenziale di semicella puograve essere espresso indifferentemente come la diffe-renza di potenziale fra il metallo e la soluzione oppure fra la soluzione e il metallosi tratta di una pura convenzione In questo libro seguiremo la convenzione euro-pea adottata a livello internazionale dalla IUPAC (International Union of Pure andApplied Chemistry) nel 1953 in base alla quale
a se si indica con ye il potenziale del metallo (fase solida) e con ys quello dellasoluzione (fase liquida) la ddp egrave uguale a ye ndash ys Quindi nel nostro esempio ilpotenziale di elettrodo egrave negativo
b le reazioni redox associate a una semicella devono essere scritte nel senso dellariduzione
Quindi per lrsquoelettrodo di rame la reazione di semicella egrave scritta nella forma seguente
Cu2+ + 2endash Cu
Il significato chimico-fisico del potenziale (Ve) assunto dallrsquoelettrodo di rame in se-guito al passaggio spontaneo di ioni Cu2+ in soluzione (per effetto di una ossidazione)egrave il seguente esso rappresenta il lavoro (Le) per unitagrave di carica (q) che bisogna com-piere per realizzare il processo non spontaneo opposto cioegrave il deposito di rame sullalamina (per effetto di una riduzione) Poicheacute i fenomeni in gioco sono sia di naturachimica sia elettrica si parla piugrave correttamente di potenziale elettrochimico dellrsquoe-lettrodo
I potenziali elettrochimici dipendono da un insieme di condizioni standard di tem-peratura pressione e concentrazione fissate inizialmente da coloro che per primi se nesono occupati per esempio 298K per la temperatura e 1 bar per la pressione
Lo stato standard egrave
bull per i solidi il solido purobull per i solventi il solvente purobull per i soluti una soluzione 1 Mbull per i gas il gas puro alla pressione di 1 bar
Il tutto assumendo un comportamento ideale per ogni sistema
In linguaggio matematico
VL
qe
e=
Ovviamente queste considerazioni sono valide anche per il caso in cui la reazionedi riduzione egrave il processo che avviene spontaneamente Ciograve si verifica per esempioquando la soluzione ha una concentrazione di ioni Cu2+ cosigrave elevata che lrsquoeffetto nettodegli scambi metallosoluzione consiste nel trasferimento di ioni sul metallo che per-ciograve acquista una carica positiva e quindi un potenziale positivo rispetto alla soluzioneEsiste anche unrsquounica concentrazione di ioni Cu2+ per la quale non si verifica scam-
Il termine elettrodo chein potenziometria siriferisce allrsquointero sistemametallosoluzione spessoviene riferito alla sola fasesolida (la laminametallica) seguendo cosigravela consuetudine in usonelle tecnicheelettrolitiche
Il lavoro necessario perdepositare uno ione sullalamina riducendolo egrave ditipo sia elettrico (neiconfronti delle forze delcampo elettrostaticogenerato dallrsquoelettrodo)sia elettrico di superficie(per superare il doppiostrato di cariche) siachimico (percheacute nelprocesso di riduzione delloione sul metallointervengono forze dinatura chimica)
8
2 Potenziometria
bio apparente di materia fra il metallo e la soluzione a questa concentrazione le duereazioni opposte (riduzione e ossidazione) procedono alla stessa velocitagrave e il sistemasi trova in uno stato di equilibrio termodinamico fin dallrsquoistante in cui il metalloviene immerso in soluzione
LA FISICA DEI SISTEMI ELETTROCHIMICIAPPROFONDIMENTO
11 Classificazione degli elettrodiUn metallo immerso in una soluzione dei suoi ioni costituisce un elettrodo di pri-ma specie il cui potenziale dipende dalla concentrazione (piugrave precisamente dallrsquoat-tivitagrave) degli ioni in soluzione
Quando invece il metallo si trova in equilibrio con la soluzione di un suo salepoco solubile si ha un elettrodo di seconda specie un filo drsquoargento immerso inuna soluzione satura di AgCl tutto ricoperto dal sale egrave un tipico elettrodo di secon-da specie La reazione di elettrodo egrave
AgCl + endash Ag + Clndash
Un elettrodo di terza specie egrave costituito da un metallo inerte immerso in una solu-zione contenente una coppia redox Un tipico esempio egrave costituito da un filo di pla-tino (un metallo nobile e quindi inerte nelle normali condizioni di lavoro) immersoin una soluzione di ioni Fe2+ e Fe3+ Il metallo si pone in equilibrio con la soluzionedi cui assume il potenziale Infatti la superficie di platino diventa sede dello scam-bio di elettroni fra le due specie ioniche che danno luogo alla reazione
Fe3+ + endash Fe2+
Infine gli elettrodi di quarta specie (che possono essere considerati come una va-riante dei precedenti) sono i cosiddetti elettrodi a gas in cui il metallo inerte e poro-so viene saturato da un gas (per esempio idrogeno) e posto a contatto con una solu-zione contenente la forma ionica del gas (nellrsquoesempio H+) Nel caso dellrsquoidrogeno
2H+ + 2endash H2
12 Calcolo dei potenziali di elettrodo legge di Nernst
Il potenziale di elettrodo egrave tanto maggiore in valore assoluto quanto maggiore egravela differenza di carica nel doppio strato (per esempio quella che si instaura allrsquoe-quilibrio fra i due lati dellrsquointerfaccia metallosoluzione) e dipende sia dalla naturachimica della coppia redox sia dalla concentrazione attiva ovvero dallrsquoattivitagrave degliioni in soluzione
Consideriamo lrsquoequilibrio per una generica semireazione di elettrodo
aox + bB + nendash cred + dD
Allrsquoequilibrio il potenziale di elettrodo che in realtagrave egrave una differenza di potenzialefra il metallo e la soluzione egrave espresso dalla legge di Nernst
+ (21)
Questa legge che prende ilnome dal chimico tedescoWalther H Nernst puograveessere ricavata in base aconsiderazionitermodinamiche edelettrochimiche su cui nonci soffermeremo Si notiin particolare chelrsquoargomento dellogaritmo egrave lrsquoinverso delquoziente di reazione
9
ELETTRODI E POTENZIALE DI ELETTRODO
dove bull E egrave il potenziale di elettrodo (in volt V) bull R la costante dei gas (che vale831451 Jmol times K) bull T la temperatura assoluta (in kelvin K) bull F la costante diFaraday (che vale 96 485 coulombmol) bull n il numero di elettroni scambiati nellasemireazione bull frac12 frac12 indica lrsquoattivitagrave di ciascuna specie scritta fra le due barrette
Edeg egrave il potenziale standard della coppia redox cioegrave il potenziale che la semicellaassume alla temperatura di 25 degC (29815 K) quando tutte le specie hanno attivitagraveunitaria e i gas si trovano alla pressione parziale di 1 bar (100 kPa) o piugrave precisa-mente hanno fugacitagrave unitaria
Lrsquoattivitagrave di ogni specie egrave uguale al prodotto g ∙ C dove g egrave il coefficiente di atti-vitagrave e C la concentrazione analitica espressa in moli su litro (molL)
Se si tiene conto dei coefficienti di attivitagrave e si inseriscono le parentesi quadre [ ]che indicano le concentrazioni in molL (gtpag 33) si ottiene
E ERT
nF
a b
c d= +deg ln
[ox] [B]
[red] [D]acute (22)
dove al posto di Eo compare il cosiddetto potenziale formale (Eoacute) della coppia redoxin oggetto
Il potenziale formale puograve differire in modo significativo dal potenziale standarde si rivela piugrave utile di esso per una valutazione anche solo orientativa del compor-tamento della coppia redox in quanto tiene meglio conto delle reali condizioni incui si opera per esempio il pH della soluzione Ricordiamo infatti che il pH allrsquointer-no di una cellula vale circa 7 (a parte pochissime eccezioni) per cui il potenziale re-dox standard che fa riferimento a pH 0 non risulta molto adatto a descriverne de-terminate caratteristiche Inoltre il potenziale standard delle coppie O2H2O vale123 V ma scende a 081 V a pH 7 Analogamente il potenziale della coppia deidro-ascorbicoascorbico passa da +390 V a +0058 V diventando nettamente riducentecome si addice alle ben note proprietagrave antiossidanti della vitamina C
Quando si lavora con soluzioni molto diluite (al di sotto di 10ndash3 M) si puograveassumere con buona approssimazione che il coefficiente di attivitagrave di tutte lespecie sia uguale a 1 In tali condizioni se si inserisce il valore numerico di RF e ilfattore numerico per la conversione ai logaritmi decimali si ottiene
(23)
Alla temperatura di 25 degC (29815 K) la legge di Nernst assume la sua forma piugravenota e usata
+ (24)
Per esempio per la semireazione
Cu2+ + 2endash Cu
la legge di Nernst (a 25 degC) assume la forma
+
La costante di Faradayequivale alla caricaelettrica di un numerodi Avogadro (cioegrave diuna mole) di elettroniUna mole contiene602214076 times 1023
entitagrave elementari(gtpag 457)
La fugacitagrave egrave la grandezzafisica adottata per i gas alposto della pressione alloscopo di tener conto delloro comportamento nonideale
ln = 23026 log
10
2 Potenziometria
In questa equazione non compare la concentrazione della forma ridotta percheacutelrsquoattivitagrave di una specie chimica pura nelle condizioni standard viene convenzio-nalmente assunta uguale a 1
In effetti spesso si lavora con soluzioni non particolarmente diluite quindi neicalcoli bisogna fare riferimento alle attivitagrave invece che alle concentrazioni di con-seguenza lrsquoequazione (24) diventa
+ log
IL POTENZIALE FORMALEAPPROFONDIMENTO
13 Polarizzazione degli elettrodiIn tutti i casi in cui il sistema dellrsquoelettrodo si discosti dalle condizioni di equilibriotermodinamico la legge di Nernst diventa inadeguata a descrivere il sistema stessoCiograve accade per esempio quando allrsquoelettrodo viene imposto un potenziale arbitra-rio eo la corrente che lo attraversa egrave molto intensa in questi casi il potenziale dielettrodo risulta diverso da quello previsto in base alla legge di Nernst e si dice chelrsquoelettrodo egrave polarizzato
In particolare quando la concentrazione degli ioni alla superficie di un elettrodoegrave diversa da quella nel resto della soluzione si verifica una polarizzazione di con-centrazione in quanto il sistema non si trova nelle condizioni di equilibrio cui fariferimento il modello di Nernst
La polarizzazione puograve derivare anche dal cambiamento dello stato chimico eofisico della superficie di elettrodo oppure dal verificarsi di reazioni chimiche colla-terali alla reazione di elettrodo
LEGGE DI NERNST E GRANDEZZE TERMODINAMICHE COLLEGATEAPPROFONDIMENTO
CELLE GALVANICHE O PILESe si collegano elettricamente fra loro due semicelle (elettrodi) si realizza un dispo-sitivo che puograve erogare corrente si tratta di una cella galvanica (o pila fig 22)
In una pila le due semicelle sono separate da un setto poroso o da un ponte salinoche hanno il solo compito di assicurare il contatto elettrico evitando il rapido me-scolamento delle soluzioni Secondo le caratteristiche dei singoli elettrodi ai duecapi della pila si crea una differenza di potenziale (ddp) detta anche tensione (opotenziale) di cella che quando raggiunge il suo valore massimo egrave detta forzaelettromotrice (abbreviata fem e indicata con il simbolo E) tutti questi terminiindicano che la pila puograve compiere un lavoro (elettrico)
Dal punto di vista fisico la fem di una pila corrisponde al lavoro massimo cheessa puograve fornire In altri termini la fem equivale al lavoro per unitagrave di carica ne-cessario per mantenere costante la ddp fra i due elettrodi
La fem coincide con la ddp solo nel caso in cui il sistema lavori in condizionidi reversibilitagrave termodinamica (ovvero a corrente nulla) In un circuito chiuso in-
Il termine polarizzazionesoprattutto nelleapplicazioni viene spessousato in modo fin troppogenerico per definiresituazioni poco chiare peresempio nellrsquoindustriagalvanica si parla spesso dipolarizzazione quando ilprocesso produttivo nonsegue lrsquoandamento previstoanche se le vere cause sonotutte da definire
2
La fem viene misurata acircuito aperto (ossia incondizioni di equilibrio acorrente nulla) e conterminali di platinomediante un potenziometroo un voltmetro elettronico
Se le soluzioni simescolassero ben prestosi verificherebberoreazioni chimiche direttelaquoindesiderateraquo (peresempio fra elettrodi esoluzione) con rapidoesaurimento del sistema(pila Daniell gtparagrafo24) e sviluppo di calore
11
CELLE GALVANICHE O PILE
vece dove la corrente circola (e non egrave nulla) la ddp in uscita dalla pila egrave sempreminore della fem a causa della laquocaduta di tensioneraquo provocata dal passaggio dicorrente Vale infatti con buona approssimazione la relazione
ddp= fem ndash Ri
dove bull R egrave la resistenza del circuito bull i lrsquointensitagrave di corrente
Per esempio se si collegauna comune pila da 45 Va una lampadina e simisura la ddp ai capi delcircuito si ottiene unvalore piugrave basso (peresempio 33 V)Il valore nominale ditensione sullrsquoinvolucrodella pila infatti indica lafem non la ddp inuscita (che dipende dallaquocaricoraquo effettivo delcircuito)
Figura 22Cella galvanica (pila) Il setto poroso divide (pur mantenen-doli in contatto elettrico fra loro) i due comparti del recipien-te che costituiscono le due semicelle Queste possono con-tenere due diversi elettroliti oppure lo stesso elettrolita maa diversa concentrazione in modo che allrsquoinizio i potenzialisiano diversi Nel primo caso le due lamine sono in generedi metalli differenti nel secondo caso sono uguali fra loroIl circuito esterno egrave formato da conduttori di prima specie ecomprende il dispositivo per la misura della tensione dellapila la corrente (i) e gli elettroni (e-) percorrono il circuito indirezioni opposte
Lrsquoelettrodo piugrave ricco di elettroni cioegrave a potenziale minore egrave detto anodo e costitu-isce il polo negativo della pila mentre lrsquoelettrodo piugrave povero di elettroni cioegrave a po-tenziale maggiore egrave detto catodo e costituisce il polo positivo Attraverso il circuitoesterno lrsquoanodo tende a cedere elettroni al catodo sotto la laquospintaraquo della spontaneatendenza del sistema a eguagliare i potenziali delle due semicelle
Il flusso di elettroni dallrsquoanodo al catodo altera quindi lo stato drsquoequilibrio ini-ziale di ciascuna semicella esso puograve venire ripristinato mediante reazioni di ossida-zione allrsquoanodo e contemporaneamente mediante reazioni di riduzione al catodoInfatti in base alla legge di Nernst (gtparagrafo 12) le reazioni di ossidazione tendo-no a innalzare il potenziale di elettrodo percheacute aumenta la concentrazione dellaforma ossidata (al numeratore dellrsquoargomento logaritmico) viceversa le reazioni diriduzione tendono ad abbassarlo La corrente che si stabilisce nel circuito egrave dovutaalla tendenza spontanea del sistema a raggiungere lrsquoequilibrio termodinamico per-ciograve quando i potenziali dei due elettrodi diventano uguali il flusso di elettronicessa e si dice che la pila egrave laquoscaricaraquo
La pila quindi egrave un dispositivo mediante il quale gli elettroni in gioco in unareazione redox passano attraverso un circuito da una specie chimica a unrsquoaltraOssidante e riducente infatti non vengono posti direttamente a contatto cosiccheacute glielettroni che si scambierebbero sono laquocostrettiraquo a passare attraverso il circuitoesterno Ciograve consente di convertire in energia elettrica e quindi in lavoro lrsquoenergiache si libera in un processo redox spontaneo che genererebbe calore il flusso di
12
2 Potenziometria
corrente si arresta quando egrave soddisfatta la costante di equilibrio della reazione chegenera la pila
Per ragioni storiche il funzionamento delle pile egrave stato spiegato in termini di unflusso di corrente elettrica dovuto a inesistenti cariche elettriche positive che migra-no dal polo a potenziale maggiore (catodo) verso il polo a potenziale minore (ano-do) Per questo motivo il verso convenzionale della corrente elettrica egrave opposto aquello in cui effettivamente circolano gli elettroni
21 Potenziali standard di ossidoriduzioneIn linea di principio per misurare la ddp fra una lamina di metallo e la soluzionein cui egrave immersa (si veda la figura 21a) occorre inserire il dispositivo di misura inmodo che un terminale sia collegato al metallo e lrsquoaltro alla soluzione In questomodo tuttavia si crea un nuovo contatto metallosoluzione e lo strumento finiscecol misurare la ddp fra i due metalli senza dare informazioni sul valore del poten-ziale di ciascuno di essi Quindi il potenziale assoluto di un singolo elettrodo o diuna coppia redox (che egrave la stessa cosa) non puograve essere misurato Si egrave costretti perciogravea effettuare una misura relativa dei potenziali ponendo a confronto due semicellela semicella di cui si vuole misurare il potenziale e una semicella di riferimento co-struita in modo da assumere un potenziale costante
In pratica lrsquoelettrodo di cui si vuole misurare il potenziale viene accoppiato a unelettrodo di riferimento e si misura la ddp di questa pila in condizioni precisamentedefinite
In base a criteri di opportunitagrave pratica e a considerazioni termodinamiche si egravescelto come elettrodo di riferimento il cosiddetto elettrodo standard a idrogeno(SHE Standard Hydrogen Electrode) A tale elettrodo (fig 23) viene assegnato perconvenzione un potenziale di semicella di 00000 V valido a tutte le temperatureper una soluzione che contiene ioni idrogeno ad attivitagrave unitaria e idrogeno gassosoa fugacitagrave unitaria (in pratica alla pressione parziale di 1 bar)
Nella prima fasedi sviluppodellrsquoelettrochimica siparlava anche di elettrodonormale a idrogeno(NHE Normal HydrogenElectrode) riferendosi a unelettrodo di platinoimmerso in una soluzione1 N di un acido forte inquesta soluzione perogravelrsquoattivitagrave del protone egravecirca 08 e quindi ilpotenziale realedellrsquoelettrodo egrave ben diversoda zero Per questo motivonon egrave corretto usare lasigla NHE per indicare ilriferimento standard[Fonte RW RametteJ Chem Ed vol 64 10(ott 1987)]
Figura 23Elettrodo a idrogeno secondo la realizzazione ideata da SPLSoslashrensen Nel gorgogliatore entra idrogeno gassoso purissi-mo che attraversa la soluzione acida e lambisce la lamina diplatino platinato prima di uscire dal secondo gorgogliatore Idue gorgogliatori e lrsquoampolla centrale contengono la stessasoluzione acida La lamina di platino egrave saldata a un filo di plati-no che fuoriesce dal tappo e assicura il collegamento elettricocon lo strumento di misura Il rubinetto e il sifone mettono incontatto la soluzione acida con lrsquoaltro elettrodo formando cosigraveuna pila Quando lrsquoattivitagrave di H+ e la fugacitagrave di H2 sono unitarielrsquoelettrodo egrave in condizioni standard
13
CELLE GALVANICHE O PILE
Le tabelle dei potenziali standard di ossidoriduzione riportano appunto i po-tenziali di coppie redox ad attivitagrave unitaria misurati rispetto allo SHE (a 25 degC) Sele reazioni sono scritte secondo le convenzioni IUPAC cioegrave nel senso della ridu-zione (elettroni a sinistra) egrave piugrave preciso parlare di potenziali standard di riduzione(tab 21) Nelle tabelle le coppie con potenziale positivo sono tendenzialmentepiugrave ossidanti della coppia H+H2 mentre le coppie con potenziale negativo sono piugraveriducenti
In generale per due coppie qualsiasi quella con potenziale standard maggiore egraveossidante (nelle condizioni imposte) nei confronti della coppia con potenziale stan-dard minore Per esempio se si immerge un foglio di alluminio in una soluzionecontenente solfato di rame e solfato di alluminio (ad attivitagrave unitaria) il foglio di
TABELLA 21 | Alcuni potenziali standard di riduzione (Edeg) misurati a 25 degC
Semireazione Edeg(V) Semireazione Edeg(V)
O H e O H O3 2 22 2+ + ++ minus 2076 Cu e Cu s2
2+ minus+ ( ) 0342
S O e SO2 82
422 2minus minus minus+ 2010 Hg Cl s e Hg Cl2 2 2 2 2( )+ +minus minus
0268
H O H e H O2 2 22 2 2+ ++ minus 1776 AgCl s e Ag Cl( )+ +minus minus
0222
MnO H e MnO s H O4 2 24 3 2minus + minus+ + + ( ) 1679 Cu e Cu2+ minus ++ 0153
Ce e Ce4 3+ minus ++ 172 Sn e Sn in HCl M4 22 1+ minus ++ ( ) 0151
MnO H e Mn H O42
28 5 4minus + minus ++ + + 1507 S H e H S g+ ++ minus2 2 2 ( ) 0142
PbO H e Pb H O22
24 2 2+ + ++ minus + 1455 S O e S O4 6
22 3
22 2minus minus minus+ 008
Cl e Cl2 2 2+ minus minus 1358 AgBr s e Ag Br( )+ +minus minus
0071
Cr O H e Cr H O2 72 3
214 6 2 7minus + minus ++ + + 1350 2H ++ 2e-H2 00000
O g H e H O2 24 4 2( )+ ++ minus 1229 Pb e Pb2
2+ minus+ ndash0126
2 12 10 63 2 2IO H e I H Ominus + minus+ + + 1195 Sn e Sn22
+ minus+ ndash0137
Br l e Br2 2 2( )+ minus minus 1066 Ni e Ni2
2+ minus+ ndash0257
NO H e HNO H O3 2 23 2minus + minus+ + + 0934 Co e Co22
+ minus+ ndash0282
2 22
2
2Hg e Hg+ minus ++ 0920 Fe e Fe22
+ minus+ ndash0447
Cu I e CuI2+ minus minus+ + 086 Zn e Zn22
+ minus+ ndash0762
Ag e Ag+ minus+ 0799 Mn e Mn22
+ minus+ ndash1185
Hg e Hg2
22 2
+ minus+ 0797 Al e Al33
+ minus+ ndash1662
Fe e Fe3 2+ minus ++ 0771 Mg e Mg22
+ minus+ ndash2372
O g H e H O2 2 22 2( )+ ++ minus 0695 Na e Na+ minus+ ndash2710
I e I3 2 3minus minus minus+ 0536 Ca e Ca22
+ minus+ ndash2868
I e I2 2 2+ minus minus 0535 K e K+ minus+ ndash2931
Cu e Cu+ minus+ 0521 Li e Li+ minus+ ndash3040
Fe CN e Fe CN( ) ( )63
64minus minus minus+ 0358
14
2 Potenziometria
alluminio si dissolve mentre si deposita rame metallico Infatti i potenziali stan-dard delle due coppie redox sono
Cu2+ + 2endash Cu Edeg= +034 V
Al3+ + 3endash Al Edeg= ndash166 V
Nella soluzione quindi lo ione Cu2+ (forma ossidata della coppia con potenzialemaggiore) tende a ossidare Al (forma ridotta della coppia con potenziale minore)
TABELLA DEI POTENZIALI STANDARD DI RIDUZIONEAPPROFONDIMENTO
22 Tensione pratica (ddp) di una pila
Lrsquoinsieme dei conduttori di prima e di seconda specie che in sequenza opportunaformano una pila (o in generale un sistema elettrochimico) costituisce una catenagalvanica La differenza di potenziale (Ecella) che si misura ai capi di una pila durantelrsquoerogazione di corrente egrave dovuta a diversi contributi piugrave precisamente egrave uguale allasomma algebrica di tutte le cadute di tensione che si verificano lungo lrsquointero circuito
Ecella= E1 + E2 + E3 + E4 + E5 (25)
dove bull E1 egrave la ddp dovuta allrsquoeventuale passaggio di corrente nel circuito (cadutaohmica) bull E2 la ddp di contatto metallometallo (tensione di Volta) bull E3 la ddpdi contatto soluzionesoluzione (tensione o potenziale di giunzione liquida) bull E4 edE5 le ddp di contatto metallosoluzione (tensione di Nernst) per ciascun elettrodo
Esaminiamo ora il significato dei singoli contributi
Caduta ohmica Quando la cella egrave attraversata da corrente inevitabilmente si ve-rifica una caduta di tensione E = R times i (prima legge di Ohm) Ovviamente se lamisura del potenziale di cella viene effettuata in condizioni tali da minimizzareo eliminare il passaggio di corrente (cioegrave a circuito aperto) la caduta ohmica siannulla (cioegrave E1= 0)
Tensione di Volta Quando due diversi metalli vengono posti a contatto si generasempre una ddp Questo fenomeno detto effetto Volta egrave dovuto al fatto che glielettroni di conduzione sono trattenuti con diversa energia dai diversi metalli Per-ciograve il contatto fra due metalli provoca un trasferimento di elettroni istantaneo daparte del metallo che li trattiene con minore energia Il processo perograve non prose-gue indefinitamente il trasferimento di elettroni infatti prosegue fino allrsquoequili-brio quando insorge una ddp (in genere di pochi millivolt) sufficiente a bloccarlo
Si puograve verificare sperimentalmente (e dimostrare) che la ddp agli estremi diuna catena di conduttori di prima specie egrave uguale a quella che si stabilisce se i duemetalli che ne costituiscono gli estremi vengono posti a diretto contatto (fig 24)Di conseguenza se gli ingressi del misuratore di tensione sono costituiti dallo stessometallo lrsquoeffetto Volta complessivo egrave nullo (E2= 0)
In altri termini la formaossidata della coppia conpotenziale piugrave alto egraveossidante nei confrontidella forma ridotta dellacoppia con potenzialepiugrave basso
A rigore si dovrebbe usareil simbolo V (o ∆V)percheacute si tratta di unaddp misurata in una pilain funzione e dunquenon di una fem Il pedicelaquocellaraquo puntualizza che sitratta in generale di unacella elettrochimica
R egrave la resistenza delconduttore e i lrsquointensitagravedi corrente
15
CELLE GALVANICHE O PILE
Potenziale di giunzione liquida In una pila le due semicelle sono separate matenute in contatto elettrico mediante un setto poroso o un ponte salino che con-sente un mescolamento lentissimo (praticamente nullo) delle soluzioni Questidispositivi (si veda la figura 25) perograve creano unrsquoulteriore caduta di tensione fragli elettrodi detta potenziale di giunzione liquida (Eg) o anche potenziale dicontatto (o di diffusione) Il potenziale di giunzione liquida puograve essere sia po-sitivo sia negativo e quindi fa aumentare o viceversa diminuire la ddp fra glielettrodi
Lrsquoinsorgere di un potenziale di giunzione egrave causato dal fatto che gli ioni si dif-fondono con diversa mobilitagrave attraverso le superfici di contatto di due mezzi di-versi un setto poroso per esempio egrave diversamente permeabile agli ioni propriosecondo la loro mobilitagrave
Tensione di Nernst I potenziali di contatto metallosoluzione (E4 E5) si calco-lano in teoria mediante la legge di Nernst e perciograve sono detti potenziali nern-stiani
LA MOBILITAgrave DEGLI IONI IN SOLUZIONEAPPROFONDIMENTO
23 Calcolo della tensione teorica (fem) di una pilaSe si opera in modo da rendere trascurabili i primi tre termini dellrsquoequazione (22)la ddp ai capi della pila coincide in pratica con la sua fem che puograve essere cal-colata semplicemente in base agli ultimi due termini cioegrave ai potenziali di elettrodoNei calcoli occorre tenere presente che
a la fem di una pila in quanto strettamente collegata al lavoro da essa compiutodeve necessariamente avere segno positivo
b lrsquoelettrodo a potenziale maggiore su cui avviene la riduzione egrave il catodo lrsquoelet-trodo a potenziale minore su cui avviene lrsquoossidazione egrave lrsquoanodo
Di conseguenza la fem di una pila cioegrave di una cella elettrochimica ottenuta colle-gando due semicelle (catodica e anodica) egrave espressa dalla seguente relazione
Ecella = Ec ndash Ea (26)
ovvero
Ecella = Emaggiore ndash Eminore (27)
Questa seconda scrittura mostra chiaramente che la fem della pila egrave sempre posi-tiva anche nel caso in cui i potenziali delle due semicelle siano entrambi negativi
Indichiamo con Ec ilpotenziale del catodo (opotenziale catodico) econ Ea il potenzialedellrsquoanodo (o potenzialeanodico)
Figura 24Nonostante ogni superficie di contatto fra due metallisia sede di una ddp dovuta allrsquoeffetto Volta la ddpche si instaura fra rame e zinco egrave la stessa sia nel caso(a) sia nel caso (b) Infatti se cosigrave non fosse chiudendola catena aperta (a) si dovrebbe osservare un passaggiodi corrente e questo in realtagrave non avviene
a b
16
2 Potenziometria
ESEMPIO 1UNA IPOTETICA PILA Egrave COSTITUITA DALLE COPPIE REDOX Al3+Al E Ni2+NiQUAL Egrave LA FEM DELLA PILA SE LE ATTIVITAgrave DI TUTTE LE SPECIE IONICHE SONOUNITARIE
Dal momento che le attivitagrave sono unitarie il calcolo fornisce la tensione (o forzaelettromotrice) standard della pila
Innanzitutto dalla tabella dei potenziali standard si ricavano i potenziali stan-dard per ciascuna coppia redox
Al3+ + 3endash Al Eo
= ndash166 V
Ni2+ + 2endash Ni Eo
= ndash026 V
Lrsquoelettrodo della coppia Ni2+Ni costituisce il catodo percheacute ha il potenziale mag-giore mentre lrsquoelettrodo della coppia Al3+Al costituisce lrsquoanodo percheacute ha il poten-ziale minore Si puograve anche costruire un diagramma di questo tipo
Al3+Al Ni2+Ni H+H2
ndash166 ndash026 00000 Edeg(V rif a SHE)
Quindi la fem della pila in condizioni standard egrave
Ecella= Ec ndash Ea= Emaggiore ndash Eminore= ndash026 ndash (ndash166)= +140 V
La reazione di ossidoriduzione che genera la pila si ottiene formalmente combi-nando le due semireazioni bilanciate quella di riduzione al catodo e quella di os-sidazione allrsquoanodo Ciascuna semireazione deve essere moltiplicata per un fattorenumerico tale che il numero di elettroni ceduti dalla specie che si ossida sia uguale aquello degli elettroni acquistati dalla specie che si riduce Quindi nel caso dellrsquoesem-pio proposto si moltiplica la semireazione della coppia Al3+Al per 2 e quella dellacoppia Ni2+Ni per 3
2 middot (Al Al3+ + 3endash) Edeg= ndash(ndash166 V) (ndash)
3 middot (Ni2+ + 2endash Ni) Edeg= ndash026 V (+)
2Al + 3Ni2+ 2Al3+ + 3Ni Edeg= +140 V
Attenzione per ottenere il bilancio della reazione di cella si moltiplica per un coeffi-ciente opportuno ciascuna semireazione ma non il rispettivo potenziale Infatti i po-tenziali di elettrodo (e quindi anche il potenziale di cella) esprimono un lavoro elettricoper unitagrave di carica e perciograve sono proprietagrave intensive che non dipendono dalla quantitagravedi materia contenuta nel sistema ovvero dal numero di cariche elettriche trasportate
Se le attivitagrave non sono unitarie per calcolare il potenziale di elettrodo occorreapplicare lrsquoequazione di Nernst
Egrave ovvio comunque che il lavoro complessivo che puograve essere fornito da una piladipende anche dalla massa e dalla geometria degli elettrodi Per questo motivo unapila o un insieme di pile (cioegrave una batteria) che viene utilizzata per esempio permuovere un veicolo puograve avere dimensioni ingombranti Questo accadeva fino anon molti anni fa per le vecchie batterie al piombo ora sempre piugrave sostituite dabatterie come quelle al litio decisamente piugrave compatte e che infatti stanno rendendopossibile il progressivo passaggio allrsquoauto parzialmente o completamente elettrica
UNA IPOTETICA PILA Egrave COSTITUITA DALLE COPPIE REDOX Al3+Al E Ni2+NiQUAL Egrave LA FEM DELLA PILA SE LE ATTIVITAgrave DI TUTTE LE SPECIE IONICHE SONOUNITARIE
Nella pila la reazionedella coppiadella coppia Ni2+Ni(Ni2+ si riduce) avvienenel senso conforme allaconvenzione adottata per ipotenziali (elettroni asinistra) invece lareazione della coppiaAl3+Al (Al si ossida)avviene nel senso oppostoa quello convenzionalePerciograve il potenziale Edegdella coppia Al3+Al vieneconsiderato con segnoopposto a quello tabulato(+166 V) Se si sommaalgebricamente ilpotenziale dellrsquoelettrodoche si riduce (Ec) conquello dellrsquoelettrodo che siossida cambiato di segno(Ea) la tensione della pilarisulta positiva
17
CELLE GALVANICHE O PILE
ESEMPIO 2UNA IPOTETICA PILA Egrave COSTITUITA DALLE COPPIE REDOX Al3+Al E Ni2+NiQUAL Egrave LA FEM DELLA PILA A 25 degC SE LE CONCENTRAZIONI DELLE SPECIEIONICHE SONO RISPETTIVAMENTE [Al3+] = 2 10ndash2 M E [Ni2+] = 10ndash2 M
Approssimando le attivitagrave con le concentrazioni si ottiene
La situazione non egrave sostanzialmente cambiata rispetto alle condizioni standardpercheacute anche in questo caso la reazione di cella comporta lrsquoossidazione dellrsquoallumi-nio e la riduzione del nichel La fem della pila quindi egrave
Ecella= Ec ndash Ea= ndash032 ndash (ndash167)= +135 V
24 Alcuni tipi di pile
Pila DaniellUna semicella egrave costituita da una lamina di rame immersa in una soluzione diCuSO4 lrsquoaltra semicella da una lamina di zinco immersa in una soluzione di ZnSO4
(fig 25) Le due semicelle sono separate da un setto poroso (in pratica una mem-brana di vetro sinterizzato o analogo materiale inerte) oppure si trovano in duediversi recipienti collegati da un ponte salino
Le reazioni di elettrodo sono
Zn2+ + 2endash Zn Edeg= ndash0762 V
Cu2+ + 2endash Cu Edeg= 0342 V
Le concentrazioni dei sali nelle rispettive semicelle sono in genere tali da renderenegativo il semielemento di zinco che perciograve tende a cedere elettroni al rame (ossi-dandosi) La lamina di zinco egrave dunque il polo negativo (anodo) della pila e il rameegrave il polo positivo (catodo)
La rappresentazione della catena galvanica di questa pila secondo le convenzioniIUPAC egrave
(ndash) Zn(s)|ZnSO4(aq)||CuSO4(aq)|Cu(s) (+)
UNA IPOTETICA PILA Egrave COSTITUITA DALLE COPPIE REDOX Al3+Al E Ni2+NiQUAL Egrave LA FEM DELLA PILA A 25 degC SE LE CONCENTRAZIONI DELLE SPECIEIONICHE SONO RISPETTIVAMENTE [Al3+] = 2 10ndash2 M E [Ni2+] = 10ndash2 M
Si noti che se i duescomparti non fosseroscomparti non fosseroben separati dal settoben separati dal settoporoso ben presto gli ioniporoso ben presto gli ionirame disponibilirame disponibiliraggiungerebbero lrsquoraggiungerebbero lrsquoanododi zinco ossidandolo eandando a depositarsi sudi esso come Cumetallico nondiversamente da quanto sipuograve osservareimmergendo una barrettadi zinco in una soluzionedi solfato di rameesaurendo quindirapidamente la pila esviluppando calore
Figura 25Pila Daniell (a) con settoporoso e (b) con pontesalino
a b
18
2 Potenziometria
La coppia di barrette verticali (||) al centro rappresenta il setto poroso o il pontesalino che separano le due semicelle lrsquoanodo egrave scritto a sinistra e per ciascun elet-trodo la forma ridotta della coppia redox egrave scritta verso lrsquoesterno Le lettere scrittefra parentesi indicano lo stato fisico di ogni specie chimica
La reazione di cella egrave
Zn + Cu2+ Zn2+ + Cu
Per calcolare la fem teorica di questa pila che puograve anche trovarsi in condizionidiverse da quelle standard si applica la legge di Nernst a ciascuna semicella
(28)
(29)
I potenziali standard delle due semicelle sono cosigrave diversi fra loro che nelle normalicondizioni operative di una pila Daniell il rame rappresenta il polo positivo e lozinco il polo negativo
Sottraendo il potenziale minore da quello maggiore si ottiene il potenziale dicella
Ecella = ECu2+Cu - EZn2+Zn
Ponendo Edegcella = EdegCu2+Cu ndash EdegZn2+Zn (= 0342 V + 0762 V) e quindi sottraendo la(28 dalla 29) si ricava infine
Questa equazione consente dunque di calcolare il potenziale di Nernst se egrave notoil valore effettivo dellrsquoattivitagrave degli ioni Zn2+ e Cu2+ Tuttavia il calcolo si presta aerrori anche significativi lrsquoattivitagrave degli ioni per esempio varia in funzione dellaforza ionica della soluzione e non puograve essere calcolata Perciograve la fem reale piugraveesattamente la ddp che si misura si discosta dal valore calcolato sostanzialmenteper due motivi
a il sistema non si comporta in maniera ideale (per esempio gli elettrodi possonopolarizzarsi)
b il contributo della caduta ohmica (gtequazione 25) puograve essere praticamente an-nullato se nel circuito viene fatta circolare una corrente trascurabile invece ilpotenziale di giunzione liquida per quanto piccolo non puograve essere soppresso enon egrave prevedibile in base a equazioni teoriche
Pile a concentrazioneIn questo tipo di pila le due semicelle contengono due soluzioni di una stessa cop-pia redox ma a diversa concentrazione gli elettrodi sono inerti oppure dello stes-so metallo e le semicelle sono collegate da un setto poroso o da un ponte salino(fig 26)
In questo calcolotrascuriamo i contributidei termini E1 E2 E3 dellaequazione (25)
Lrsquoequazione rappresentain pratica la legge diNernst applicata allareazione redox globalescritta nel verso dellaspontaneitagrave tenendoconto degli elettroniscambiati (2) e inserendonellrsquoargomento dellogaritmo lrsquoinverso delquoziente di reazione
+
19
CELLE GALVANICHE O PILE
Le due soluzioni si scambiano elettroni attraverso il circuito esterno mentre ilsetto poroso (o il ponte salino) che le collega consente il passaggio di ioni e quin-di chiude il circuito Il sistema raggiunge lrsquoequilibrio quando le attivitagrave degli ioninelle due semicelle diventano uguali perciograve egrave prevedibile che nella soluzione piugravediluita avvenga lrsquoossidazione il rame metallico si dissolve e si formano ioni Cu2+ insoluzione questo dunque egrave lrsquoanodo Contemporaneamente gli elettroni passanonellrsquoaltro comparto (a destra in figura 26) attraverso il circuito esterno e riduconogli ioni Cu2+ che si depositano sullrsquoelettrodo come rame metallico questo dunqueegrave il catodo
In pratica egrave come se gli ioni Cu2+ si trasferissero dalla soluzione piugrave concentrataalla soluzione piugrave diluita Queste pile dunque trasformano in lavoro elettrico lrsquoe-nergia che si libera nel processo spontaneo con cui due soluzioni a diretto contattotendono a raggiungere lrsquoequilibrio di concentrazione
La rappresentazione convenzionale della catena elettrodica di questa pila a con-centrazione egrave la seguente
(-) Cu(s) |Cu2+(001 M)||Cu2+(1 M)|Cu(s) (+)
Per calcolare la tensione teorica della pila si applica la legge di Nernst a ciascun elet-trodo Approssimando le attivitagrave con le concentrazioni (a 25 degC) si ottiene
(soluzione piugrave diluita anodo)
(soluzione piugrave concentrata catodo)
Quindi
Ecella= Emaggiore ndash Eminore= 0342- 0283= 0059 V
ALTRI TIPI DI CELLE GALVANICHE O PILEAPPROFONDIMENTO
Figura 26Pila a concentrazione il compartoanodico (a sinistra) contiene ioni Cu2+
in concentrazione 001 M e il com-parto catodico (a destra) contieneioni Cu2+ in concentrazione 1 M Ilcollegamento fra le due semicelle egraverealizzato con un ponte salino
20
2 Potenziometria
STRUMENTAZIONEIn potenziometria si misura la differenza di potenziale che si stabilisce fra due semi-celle allo scopo di determinare la concentrazione di uno ione o per seguire lrsquoanda-mento di una titolazione
Il dispositivo completo per una misura potenziometrica (fig 27) consiste es-senzialmente di
bull un potenziometro o meglio un millivoltmetro elettronicobull un elettrodo di riferimentobull un elettrodo di misura
Il potenziometro serve per misurare la ddp fra i due elettrodi senza alterare il lorostato di equilibrio perciograve si lavora a corrente praticamente nulla
Gli elettrodi collegati al potenziometro sono immersi nella soluzione su cui sieffettuano le misure Lrsquoelettrodo di riferimento egrave costruito in modo tale da mante-nere costante il suo potenziale di conseguenza ogni variazione di ddp misurata egraveimputabile esclusivamente allrsquoelettrodo di misura (piugrave precisamente alla soluzioneanalizzata)
ELETTRODI DI RIFERIMENTOLrsquoelettrodo standard a idrogeno (SHE gtparagrafo 21) egrave lrsquoelettrodo di riferimentoprimario Tuttavia nella pratica quotidiana di laboratorio si usano elettrodi di ri-ferimento secondari piugrave semplici e maneggevoli che hanno comunque la proprie-tagrave di mantenere il proprio potenziale costante a temperatura costante Tratteremoora in maggior dettaglio gli elettrodi di uso piugrave comune
31 Elettrodo ad argentocloruro drsquoargento
Si tratta senzrsquoaltro dellrsquoelettrodo piugrave diffuso Il dispositivo egrave costituito da un sem-plice filo drsquoargento rivestito di AgCl e immerso in una soluzione di KCl (egrave dunqueun elettrodo di seconda specie) Il tutto egrave contenuto in un tubicino di vetro dotatodi setto poroso per assicurare il contatto elettrico con lrsquoesterno ovvero con la so-luzione in cui viene immerso lrsquooggetto dellrsquoanalisi
Figura 27Rappresentazione schematica deldispositivo completo per misurepotenziometriche
3
21
ELETTRODI DI RIFERIMENTO
La rappresentazione convenzionale dellrsquoelettrodo (fig 28) egrave
Ag(s)|AgCl(aq)|KCl(aq)
La reazione di elettrodo egrave
AgCl + endash Ag + Clndash
E il potenziale di elettrodo
E= EdegAgClAg
Considerando unitarie le attivitagrave dei solidi puri si ottiene
E= EdegAgClAg ndash 01984 10ndash3 T log[Clndash] (210)
Se lrsquoattivitagrave degli ioni cloruro egrave costante (a temperatura costante) il potenziale dielettrodo rimane costante Gli elettrodi piugrave comuni contengono soluzioni sature diKCl (circa 42 M) e perciograve sono detti saturi (SSC Saturated Silver-Silver ChlorideElectrode) A 25 degC il potenziale di SSC vale 0197 V Questo elettrodo puograve essereusato fino a 105 degC Nella tabella 1 ndash lab 1 (gtpag 39) sono riportati i potenziali alvariare della temperatura per lrsquoelettrodo saturo e 3 M
Gli anioni (come il solfuro) che formano con Ag+ sali meno solubili di AgClpossono danneggiare questo tipo di elettrodo Anche gli ossidanti e i riducenti fortie gli agenti complessanti possono interferire con la reazione di elettrodo per proteg-gere lrsquoelettrodo da queste sostanze si usa un elettrolita intermedio come nel casodellrsquoelettrodo a calomelano saturo (SCE gtparagrafo 32)
Gli elettrodi ad argentocloruro di argento sono usati come riferimento internonegli elettrodi a vetro (gtparagrafo 41)
32 Elettrodo a calomelano
laquoCalomelanoraquo egrave il nome comune del cloruro mercuroso (I) Hg2Cl2 che fa parteappunto di questo elettrodo (fig 29a) La rappresentazione convenzionale dellrsquoe-lettrodo egrave
Hg(l)|Hg2Cl2(s)|KCl(aq)
La reazione di elettrodo egrave
Hg2Cl2 + 2endash 2Hg + 2Clndash
e il potenziale di elettrodo in base alla legge di Nernst
In condizioni standard lrsquoattivitagrave di solidi e liquidi puri egrave considerata uguale a 1quindi
da cui
ndash 01984 10ndash3 T log|Clndash| (211)
Sono anche molto diffusigli elettrodi contenentiKCl 3 M cioegrave quasisaturi Il vantaggio egrave chein queste soluzioni non siformano cristalli di KClche possono danneggiarelrsquoelettrodo ostruendoil setto poroso che sta sulfondo
Figura 28Elettrodo ad AgAgCILa soluzione tamponeinterna contiene ioni K+
e CIndash ad attivitagrave costante
22
2 Potenziometria
Il potenziale dellrsquoelettrodo a calomelano dunque dipende solo dallrsquoattivitagrave delloione cloruro e dalla temperatura Se la temperatura egrave costante e lrsquoattivitagrave dello ionecloruro nella soluzione interna allrsquoelettrodo non varia il potenziale rimane costante
Gli elettrodi a calomelano piugrave comuni contengono soluzioni sature di KCl (circa42 M) e perciograve sono detti saturi (SCE Saturated Calomel Electrode) Si usano ancheelettrodi a KCl 1 M e 01 M la tabella 22 riporta il potenziale assunto da questielettrodi secondo la concentrazione di KCl
TABELLA 22 | Potenziale (mV) di alcuni elettrodi di riferimento a 25 degC
AgAgCl Calomelano HgHgO HgHgSO4 Thalamid
KCl 01 M 288 KCl 01 M 334 NaOH 01 M 165 H2SO4 05 M 682 KCl 3 M -567
KCl 1 M 235 KCl 1 M 280 NaOH 1 M 140 K2SO4 sat 650 KCl sat -577
KCl 3 M 210 KCl 35 M 250
KCl 35 M 205 KCl sat 241
KCl sat 199 NaCl sat 236
NaCl 3 M 209
NaCl sat 197
Lrsquoelettrodo a calomelano puograve essere usato fino a circa 70 degC a temperature piugrave alteil calomelano si dismuta (Hg2Cl2 Hg + HgCl2)
I solfuri gli ossidanti i forti riducenti e gli agenti complessanti che formanoamalgami con gli ioni Hg2
2+ possono danneggiare questo tipo di elettrodo Perciogravequando si lavora in presenza di queste sostanze si usano elettrodi a doppia giun-zione (fig 29b) in cui fra lrsquoelettrodo e la soluzione egrave interposto un contenitoreriempito con un elettrolita intermedio (per esempio KNO3)
Va infine segnalata la tendenza a non usare il mercurio per motivi tossicologicie questo spiega il progressivo abbandono nella pratica comune di questo tipo dielettrodo con grande rammarico dagli elettrochimici percheacute lrsquoelettrodo a calomela-no egrave il piugrave stabile
bullELETTRODI DI PRIMA E DI SECONDA SPECIE bullALTRI ELETTRODI DI RIFERIMENTO
APPROFONDIMENTI
Figura 29(a) Elettrodo a calomelano (b) Nella versione adoppia giunzione egrave presente una seconda cameraper lrsquoelettrolita intermedio che viene immessoattraverso la bocchetta laterale il setto porosoassicura il contatto elettrico con la soluzioneesterna
a b

5
CLASSIFICAZIONE
renza di potenziale fra due elettrodi e si misura la corrente che circola in un deter-minato intervallo di tempo in seguito ai fenomeni di elettrolisi che si verificanoagli elettrodi
La coulombometria si basa sulla legge di Faraday
(14)
dove bull m egrave la massa bull MM la massa molare della specie chimica che si scaricaallrsquoelettrodo bull F la costante di Faraday bull n il numero di elettroni scambiati nellareazione di scarica bull i lrsquointensitagrave di corrente bull t il tempo
VoltammetriaIn voltammetria (gtCapitolo 5) si misura la variazione della corrente (Δi) che passafra gli elettrodi immersi nella soluzione in analisi al variare del potenziale applicatoa uno di essi (elettrodo di lavoro) Lrsquoelettrodo di lavoro puograve essere allo stato solidooppure egrave costituito da una singola goccia di mercurio pendente da un capillare Se lagoccia di mercurio cade ritmicamente dal capillare e quindi viene continuamenterinnovata durante la scansione si parla piugrave propriamente di polarografia
Lrsquoamperometria egrave una variante della tecnica voltammetrica che consente di ef-fettuare titolazioni Il potenziale dellrsquoelettrodo di lavoro viene mantenuto a un va-lore costante tale da garantire il passaggio di corrente la variazione dellrsquointensitagravedi corrente che si ha durante lrsquoaggiunta di titolante consente di individuare il puntodi equivalenza
ConduttimetriaIn conduttimetria (gtCapitolo 6) si misura la conducibilitagrave elettrica (lrsquoinverso dellaresistenza elettrica) della soluzione in analisi Si possono effettuare misure diret-te mediante elettrodi di conformazione adatta che consentono di determinare peresempio il contenuto salino di una soluzione oppure si possono eseguire titola-zioni registrando la variazione di conducibilitagrave dovuta allrsquoaggiunta del titolante Laconduttimetria sfrutta a fini analitici la seconda legge di Ohm che per soluzionielettrolitiche assume la forma
L = cK (15)
dove bull L egrave la conduttanza della soluzione bull c (lettera greca laquochiraquo) la conducibilitagravespecifica della soluzione bull K la costante di cella
mMM
nF= int i t
0
t
d
La massa molare (MM)di un elementomonoatomico di unamolecola di uno ione oradicale corrisponde allamassa di un numero diAvogadro delle particellein questione Essacoincide con la massaatomica o molecolareespressa in gmol
Con questa tecnica sipossono raccogliereinformazioni siaqualitative siaquantitative sulle speciechimiche presenti insoluzione secondo lamodalitagrave con cui queste siscaricano allrsquoelettrodo
Di solito la misura vieneeffettuata in correntealternata per evitarefenomeni indesiderati dielettrolisi Usandocorrente alternata ad altafrequenza si possonodeterminare anche lecostanti dielettriche disistemi liquidi
6
Potenziometria2
TEORIA
ELETTRODI E POTENZIALE DI ELETTRODOConsideriamo un sistema relativamente semplice (fig 21a) costituito da una lami-na metallica (per esempio di rame Cu) immersa in acqua pura o in una soluzionemolto diluita di un suo sale (per esempio il solfato) Un sistema di questo tipo costi-tuisce una semicella (o semielemento o semplicemente elettrodo)
Allrsquoinizio sia il metallo sia la soluzione sono elettricamente neutri quasi imme-diatamente dopo il contatto perograve si verifica uno scambio spontaneo di materia frail metallo e la soluzione piugrave precisamente si verifica un passaggio di ioni Cu2+ insoluzione
1
Se si usa una lamina dirame laquomarcataraquo cioegravecontenente isotopiradioattivi del rame in uncerto tempo anche lasoluzione manifesta unaleggera radioattivitagravequesto dimostra che unaquantitagrave sia pure minimadi rame egrave passata insoluzione sia in formaionica sia elementare Egravestato infatti dimostratoche in soluzione sonopresenti anche cluster diatomi neutri
Figura 21(a) Semplice semicella elettrochi-mica (b) Rappresentazione sem-plificata del doppio strato elettricoche si forma quando il metalloossidandosi cede ioni positivi allasoluzione Le molecole dipolaridellrsquoacqua sono laquoorientateraquo sianella sfera di solvatazione degliioni sia vicino alla superficie delmetallo che ha carica negativa
Si crea cosigrave uno squilibrio elettrico la soluzione assume carica positiva percheacute gliioni solfato non compensano la carica degli ioni Cu2+ passati in soluzione mentrela lamina di rame che ha trattenuto due elettroni per ogni nuovo ione Cu2+ assumecarica elettrica negativa
Si forma perciograve un doppio strato elettrico (fig 21b) cioegrave una separazione dicarica allrsquointerfaccia metallosoluzione che viene descritta come una differenza di
Caricanegativa
Interfacciametallosoluzione
7
ELETTRODI E POTENZIALE DI ELETTRODO
potenziale (abbreviata ddp) fra la lamina di metallo e la soluzione questa ddp egravedetta potenziale di semicella (o potenziale di elettrodo) Nel nostro esempio lalamina di rame assume carica negativa e quindi ha potenziale negativo mentre lasoluzione assume potenziale positivo
Il potenziale di semicella puograve essere espresso indifferentemente come la diffe-renza di potenziale fra il metallo e la soluzione oppure fra la soluzione e il metallosi tratta di una pura convenzione In questo libro seguiremo la convenzione euro-pea adottata a livello internazionale dalla IUPAC (International Union of Pure andApplied Chemistry) nel 1953 in base alla quale
a se si indica con ye il potenziale del metallo (fase solida) e con ys quello dellasoluzione (fase liquida) la ddp egrave uguale a ye ndash ys Quindi nel nostro esempio ilpotenziale di elettrodo egrave negativo
b le reazioni redox associate a una semicella devono essere scritte nel senso dellariduzione
Quindi per lrsquoelettrodo di rame la reazione di semicella egrave scritta nella forma seguente
Cu2+ + 2endash Cu
Il significato chimico-fisico del potenziale (Ve) assunto dallrsquoelettrodo di rame in se-guito al passaggio spontaneo di ioni Cu2+ in soluzione (per effetto di una ossidazione)egrave il seguente esso rappresenta il lavoro (Le) per unitagrave di carica (q) che bisogna com-piere per realizzare il processo non spontaneo opposto cioegrave il deposito di rame sullalamina (per effetto di una riduzione) Poicheacute i fenomeni in gioco sono sia di naturachimica sia elettrica si parla piugrave correttamente di potenziale elettrochimico dellrsquoe-lettrodo
I potenziali elettrochimici dipendono da un insieme di condizioni standard di tem-peratura pressione e concentrazione fissate inizialmente da coloro che per primi se nesono occupati per esempio 298K per la temperatura e 1 bar per la pressione
Lo stato standard egrave
bull per i solidi il solido purobull per i solventi il solvente purobull per i soluti una soluzione 1 Mbull per i gas il gas puro alla pressione di 1 bar
Il tutto assumendo un comportamento ideale per ogni sistema
In linguaggio matematico
VL
qe
e=
Ovviamente queste considerazioni sono valide anche per il caso in cui la reazionedi riduzione egrave il processo che avviene spontaneamente Ciograve si verifica per esempioquando la soluzione ha una concentrazione di ioni Cu2+ cosigrave elevata che lrsquoeffetto nettodegli scambi metallosoluzione consiste nel trasferimento di ioni sul metallo che per-ciograve acquista una carica positiva e quindi un potenziale positivo rispetto alla soluzioneEsiste anche unrsquounica concentrazione di ioni Cu2+ per la quale non si verifica scam-
Il termine elettrodo chein potenziometria siriferisce allrsquointero sistemametallosoluzione spessoviene riferito alla sola fasesolida (la laminametallica) seguendo cosigravela consuetudine in usonelle tecnicheelettrolitiche
Il lavoro necessario perdepositare uno ione sullalamina riducendolo egrave ditipo sia elettrico (neiconfronti delle forze delcampo elettrostaticogenerato dallrsquoelettrodo)sia elettrico di superficie(per superare il doppiostrato di cariche) siachimico (percheacute nelprocesso di riduzione delloione sul metallointervengono forze dinatura chimica)
8
2 Potenziometria
bio apparente di materia fra il metallo e la soluzione a questa concentrazione le duereazioni opposte (riduzione e ossidazione) procedono alla stessa velocitagrave e il sistemasi trova in uno stato di equilibrio termodinamico fin dallrsquoistante in cui il metalloviene immerso in soluzione
LA FISICA DEI SISTEMI ELETTROCHIMICIAPPROFONDIMENTO
11 Classificazione degli elettrodiUn metallo immerso in una soluzione dei suoi ioni costituisce un elettrodo di pri-ma specie il cui potenziale dipende dalla concentrazione (piugrave precisamente dallrsquoat-tivitagrave) degli ioni in soluzione
Quando invece il metallo si trova in equilibrio con la soluzione di un suo salepoco solubile si ha un elettrodo di seconda specie un filo drsquoargento immerso inuna soluzione satura di AgCl tutto ricoperto dal sale egrave un tipico elettrodo di secon-da specie La reazione di elettrodo egrave
AgCl + endash Ag + Clndash
Un elettrodo di terza specie egrave costituito da un metallo inerte immerso in una solu-zione contenente una coppia redox Un tipico esempio egrave costituito da un filo di pla-tino (un metallo nobile e quindi inerte nelle normali condizioni di lavoro) immersoin una soluzione di ioni Fe2+ e Fe3+ Il metallo si pone in equilibrio con la soluzionedi cui assume il potenziale Infatti la superficie di platino diventa sede dello scam-bio di elettroni fra le due specie ioniche che danno luogo alla reazione
Fe3+ + endash Fe2+
Infine gli elettrodi di quarta specie (che possono essere considerati come una va-riante dei precedenti) sono i cosiddetti elettrodi a gas in cui il metallo inerte e poro-so viene saturato da un gas (per esempio idrogeno) e posto a contatto con una solu-zione contenente la forma ionica del gas (nellrsquoesempio H+) Nel caso dellrsquoidrogeno
2H+ + 2endash H2
12 Calcolo dei potenziali di elettrodo legge di Nernst
Il potenziale di elettrodo egrave tanto maggiore in valore assoluto quanto maggiore egravela differenza di carica nel doppio strato (per esempio quella che si instaura allrsquoe-quilibrio fra i due lati dellrsquointerfaccia metallosoluzione) e dipende sia dalla naturachimica della coppia redox sia dalla concentrazione attiva ovvero dallrsquoattivitagrave degliioni in soluzione
Consideriamo lrsquoequilibrio per una generica semireazione di elettrodo
aox + bB + nendash cred + dD
Allrsquoequilibrio il potenziale di elettrodo che in realtagrave egrave una differenza di potenzialefra il metallo e la soluzione egrave espresso dalla legge di Nernst
+ (21)
Questa legge che prende ilnome dal chimico tedescoWalther H Nernst puograveessere ricavata in base aconsiderazionitermodinamiche edelettrochimiche su cui nonci soffermeremo Si notiin particolare chelrsquoargomento dellogaritmo egrave lrsquoinverso delquoziente di reazione
9
ELETTRODI E POTENZIALE DI ELETTRODO
dove bull E egrave il potenziale di elettrodo (in volt V) bull R la costante dei gas (che vale831451 Jmol times K) bull T la temperatura assoluta (in kelvin K) bull F la costante diFaraday (che vale 96 485 coulombmol) bull n il numero di elettroni scambiati nellasemireazione bull frac12 frac12 indica lrsquoattivitagrave di ciascuna specie scritta fra le due barrette
Edeg egrave il potenziale standard della coppia redox cioegrave il potenziale che la semicellaassume alla temperatura di 25 degC (29815 K) quando tutte le specie hanno attivitagraveunitaria e i gas si trovano alla pressione parziale di 1 bar (100 kPa) o piugrave precisa-mente hanno fugacitagrave unitaria
Lrsquoattivitagrave di ogni specie egrave uguale al prodotto g ∙ C dove g egrave il coefficiente di atti-vitagrave e C la concentrazione analitica espressa in moli su litro (molL)
Se si tiene conto dei coefficienti di attivitagrave e si inseriscono le parentesi quadre [ ]che indicano le concentrazioni in molL (gtpag 33) si ottiene
E ERT
nF
a b
c d= +deg ln
[ox] [B]
[red] [D]acute (22)
dove al posto di Eo compare il cosiddetto potenziale formale (Eoacute) della coppia redoxin oggetto
Il potenziale formale puograve differire in modo significativo dal potenziale standarde si rivela piugrave utile di esso per una valutazione anche solo orientativa del compor-tamento della coppia redox in quanto tiene meglio conto delle reali condizioni incui si opera per esempio il pH della soluzione Ricordiamo infatti che il pH allrsquointer-no di una cellula vale circa 7 (a parte pochissime eccezioni) per cui il potenziale re-dox standard che fa riferimento a pH 0 non risulta molto adatto a descriverne de-terminate caratteristiche Inoltre il potenziale standard delle coppie O2H2O vale123 V ma scende a 081 V a pH 7 Analogamente il potenziale della coppia deidro-ascorbicoascorbico passa da +390 V a +0058 V diventando nettamente riducentecome si addice alle ben note proprietagrave antiossidanti della vitamina C
Quando si lavora con soluzioni molto diluite (al di sotto di 10ndash3 M) si puograveassumere con buona approssimazione che il coefficiente di attivitagrave di tutte lespecie sia uguale a 1 In tali condizioni se si inserisce il valore numerico di RF e ilfattore numerico per la conversione ai logaritmi decimali si ottiene
(23)
Alla temperatura di 25 degC (29815 K) la legge di Nernst assume la sua forma piugravenota e usata
+ (24)
Per esempio per la semireazione
Cu2+ + 2endash Cu
la legge di Nernst (a 25 degC) assume la forma
+
La costante di Faradayequivale alla caricaelettrica di un numerodi Avogadro (cioegrave diuna mole) di elettroniUna mole contiene602214076 times 1023
entitagrave elementari(gtpag 457)
La fugacitagrave egrave la grandezzafisica adottata per i gas alposto della pressione alloscopo di tener conto delloro comportamento nonideale
ln = 23026 log
10
2 Potenziometria
In questa equazione non compare la concentrazione della forma ridotta percheacutelrsquoattivitagrave di una specie chimica pura nelle condizioni standard viene convenzio-nalmente assunta uguale a 1
In effetti spesso si lavora con soluzioni non particolarmente diluite quindi neicalcoli bisogna fare riferimento alle attivitagrave invece che alle concentrazioni di con-seguenza lrsquoequazione (24) diventa
+ log
IL POTENZIALE FORMALEAPPROFONDIMENTO
13 Polarizzazione degli elettrodiIn tutti i casi in cui il sistema dellrsquoelettrodo si discosti dalle condizioni di equilibriotermodinamico la legge di Nernst diventa inadeguata a descrivere il sistema stessoCiograve accade per esempio quando allrsquoelettrodo viene imposto un potenziale arbitra-rio eo la corrente che lo attraversa egrave molto intensa in questi casi il potenziale dielettrodo risulta diverso da quello previsto in base alla legge di Nernst e si dice chelrsquoelettrodo egrave polarizzato
In particolare quando la concentrazione degli ioni alla superficie di un elettrodoegrave diversa da quella nel resto della soluzione si verifica una polarizzazione di con-centrazione in quanto il sistema non si trova nelle condizioni di equilibrio cui fariferimento il modello di Nernst
La polarizzazione puograve derivare anche dal cambiamento dello stato chimico eofisico della superficie di elettrodo oppure dal verificarsi di reazioni chimiche colla-terali alla reazione di elettrodo
LEGGE DI NERNST E GRANDEZZE TERMODINAMICHE COLLEGATEAPPROFONDIMENTO
CELLE GALVANICHE O PILESe si collegano elettricamente fra loro due semicelle (elettrodi) si realizza un dispo-sitivo che puograve erogare corrente si tratta di una cella galvanica (o pila fig 22)
In una pila le due semicelle sono separate da un setto poroso o da un ponte salinoche hanno il solo compito di assicurare il contatto elettrico evitando il rapido me-scolamento delle soluzioni Secondo le caratteristiche dei singoli elettrodi ai duecapi della pila si crea una differenza di potenziale (ddp) detta anche tensione (opotenziale) di cella che quando raggiunge il suo valore massimo egrave detta forzaelettromotrice (abbreviata fem e indicata con il simbolo E) tutti questi terminiindicano che la pila puograve compiere un lavoro (elettrico)
Dal punto di vista fisico la fem di una pila corrisponde al lavoro massimo cheessa puograve fornire In altri termini la fem equivale al lavoro per unitagrave di carica ne-cessario per mantenere costante la ddp fra i due elettrodi
La fem coincide con la ddp solo nel caso in cui il sistema lavori in condizionidi reversibilitagrave termodinamica (ovvero a corrente nulla) In un circuito chiuso in-
Il termine polarizzazionesoprattutto nelleapplicazioni viene spessousato in modo fin troppogenerico per definiresituazioni poco chiare peresempio nellrsquoindustriagalvanica si parla spesso dipolarizzazione quando ilprocesso produttivo nonsegue lrsquoandamento previstoanche se le vere cause sonotutte da definire
2
La fem viene misurata acircuito aperto (ossia incondizioni di equilibrio acorrente nulla) e conterminali di platinomediante un potenziometroo un voltmetro elettronico
Se le soluzioni simescolassero ben prestosi verificherebberoreazioni chimiche direttelaquoindesiderateraquo (peresempio fra elettrodi esoluzione) con rapidoesaurimento del sistema(pila Daniell gtparagrafo24) e sviluppo di calore
11
CELLE GALVANICHE O PILE
vece dove la corrente circola (e non egrave nulla) la ddp in uscita dalla pila egrave sempreminore della fem a causa della laquocaduta di tensioneraquo provocata dal passaggio dicorrente Vale infatti con buona approssimazione la relazione
ddp= fem ndash Ri
dove bull R egrave la resistenza del circuito bull i lrsquointensitagrave di corrente
Per esempio se si collegauna comune pila da 45 Va una lampadina e simisura la ddp ai capi delcircuito si ottiene unvalore piugrave basso (peresempio 33 V)Il valore nominale ditensione sullrsquoinvolucrodella pila infatti indica lafem non la ddp inuscita (che dipende dallaquocaricoraquo effettivo delcircuito)
Figura 22Cella galvanica (pila) Il setto poroso divide (pur mantenen-doli in contatto elettrico fra loro) i due comparti del recipien-te che costituiscono le due semicelle Queste possono con-tenere due diversi elettroliti oppure lo stesso elettrolita maa diversa concentrazione in modo che allrsquoinizio i potenzialisiano diversi Nel primo caso le due lamine sono in generedi metalli differenti nel secondo caso sono uguali fra loroIl circuito esterno egrave formato da conduttori di prima specie ecomprende il dispositivo per la misura della tensione dellapila la corrente (i) e gli elettroni (e-) percorrono il circuito indirezioni opposte
Lrsquoelettrodo piugrave ricco di elettroni cioegrave a potenziale minore egrave detto anodo e costitu-isce il polo negativo della pila mentre lrsquoelettrodo piugrave povero di elettroni cioegrave a po-tenziale maggiore egrave detto catodo e costituisce il polo positivo Attraverso il circuitoesterno lrsquoanodo tende a cedere elettroni al catodo sotto la laquospintaraquo della spontaneatendenza del sistema a eguagliare i potenziali delle due semicelle
Il flusso di elettroni dallrsquoanodo al catodo altera quindi lo stato drsquoequilibrio ini-ziale di ciascuna semicella esso puograve venire ripristinato mediante reazioni di ossida-zione allrsquoanodo e contemporaneamente mediante reazioni di riduzione al catodoInfatti in base alla legge di Nernst (gtparagrafo 12) le reazioni di ossidazione tendo-no a innalzare il potenziale di elettrodo percheacute aumenta la concentrazione dellaforma ossidata (al numeratore dellrsquoargomento logaritmico) viceversa le reazioni diriduzione tendono ad abbassarlo La corrente che si stabilisce nel circuito egrave dovutaalla tendenza spontanea del sistema a raggiungere lrsquoequilibrio termodinamico per-ciograve quando i potenziali dei due elettrodi diventano uguali il flusso di elettronicessa e si dice che la pila egrave laquoscaricaraquo
La pila quindi egrave un dispositivo mediante il quale gli elettroni in gioco in unareazione redox passano attraverso un circuito da una specie chimica a unrsquoaltraOssidante e riducente infatti non vengono posti direttamente a contatto cosiccheacute glielettroni che si scambierebbero sono laquocostrettiraquo a passare attraverso il circuitoesterno Ciograve consente di convertire in energia elettrica e quindi in lavoro lrsquoenergiache si libera in un processo redox spontaneo che genererebbe calore il flusso di
12
2 Potenziometria
corrente si arresta quando egrave soddisfatta la costante di equilibrio della reazione chegenera la pila
Per ragioni storiche il funzionamento delle pile egrave stato spiegato in termini di unflusso di corrente elettrica dovuto a inesistenti cariche elettriche positive che migra-no dal polo a potenziale maggiore (catodo) verso il polo a potenziale minore (ano-do) Per questo motivo il verso convenzionale della corrente elettrica egrave opposto aquello in cui effettivamente circolano gli elettroni
21 Potenziali standard di ossidoriduzioneIn linea di principio per misurare la ddp fra una lamina di metallo e la soluzionein cui egrave immersa (si veda la figura 21a) occorre inserire il dispositivo di misura inmodo che un terminale sia collegato al metallo e lrsquoaltro alla soluzione In questomodo tuttavia si crea un nuovo contatto metallosoluzione e lo strumento finiscecol misurare la ddp fra i due metalli senza dare informazioni sul valore del poten-ziale di ciascuno di essi Quindi il potenziale assoluto di un singolo elettrodo o diuna coppia redox (che egrave la stessa cosa) non puograve essere misurato Si egrave costretti perciogravea effettuare una misura relativa dei potenziali ponendo a confronto due semicellela semicella di cui si vuole misurare il potenziale e una semicella di riferimento co-struita in modo da assumere un potenziale costante
In pratica lrsquoelettrodo di cui si vuole misurare il potenziale viene accoppiato a unelettrodo di riferimento e si misura la ddp di questa pila in condizioni precisamentedefinite
In base a criteri di opportunitagrave pratica e a considerazioni termodinamiche si egravescelto come elettrodo di riferimento il cosiddetto elettrodo standard a idrogeno(SHE Standard Hydrogen Electrode) A tale elettrodo (fig 23) viene assegnato perconvenzione un potenziale di semicella di 00000 V valido a tutte le temperatureper una soluzione che contiene ioni idrogeno ad attivitagrave unitaria e idrogeno gassosoa fugacitagrave unitaria (in pratica alla pressione parziale di 1 bar)
Nella prima fasedi sviluppodellrsquoelettrochimica siparlava anche di elettrodonormale a idrogeno(NHE Normal HydrogenElectrode) riferendosi a unelettrodo di platinoimmerso in una soluzione1 N di un acido forte inquesta soluzione perogravelrsquoattivitagrave del protone egravecirca 08 e quindi ilpotenziale realedellrsquoelettrodo egrave ben diversoda zero Per questo motivonon egrave corretto usare lasigla NHE per indicare ilriferimento standard[Fonte RW RametteJ Chem Ed vol 64 10(ott 1987)]
Figura 23Elettrodo a idrogeno secondo la realizzazione ideata da SPLSoslashrensen Nel gorgogliatore entra idrogeno gassoso purissi-mo che attraversa la soluzione acida e lambisce la lamina diplatino platinato prima di uscire dal secondo gorgogliatore Idue gorgogliatori e lrsquoampolla centrale contengono la stessasoluzione acida La lamina di platino egrave saldata a un filo di plati-no che fuoriesce dal tappo e assicura il collegamento elettricocon lo strumento di misura Il rubinetto e il sifone mettono incontatto la soluzione acida con lrsquoaltro elettrodo formando cosigraveuna pila Quando lrsquoattivitagrave di H+ e la fugacitagrave di H2 sono unitarielrsquoelettrodo egrave in condizioni standard
13
CELLE GALVANICHE O PILE
Le tabelle dei potenziali standard di ossidoriduzione riportano appunto i po-tenziali di coppie redox ad attivitagrave unitaria misurati rispetto allo SHE (a 25 degC) Sele reazioni sono scritte secondo le convenzioni IUPAC cioegrave nel senso della ridu-zione (elettroni a sinistra) egrave piugrave preciso parlare di potenziali standard di riduzione(tab 21) Nelle tabelle le coppie con potenziale positivo sono tendenzialmentepiugrave ossidanti della coppia H+H2 mentre le coppie con potenziale negativo sono piugraveriducenti
In generale per due coppie qualsiasi quella con potenziale standard maggiore egraveossidante (nelle condizioni imposte) nei confronti della coppia con potenziale stan-dard minore Per esempio se si immerge un foglio di alluminio in una soluzionecontenente solfato di rame e solfato di alluminio (ad attivitagrave unitaria) il foglio di
TABELLA 21 | Alcuni potenziali standard di riduzione (Edeg) misurati a 25 degC
Semireazione Edeg(V) Semireazione Edeg(V)
O H e O H O3 2 22 2+ + ++ minus 2076 Cu e Cu s2
2+ minus+ ( ) 0342
S O e SO2 82
422 2minus minus minus+ 2010 Hg Cl s e Hg Cl2 2 2 2 2( )+ +minus minus
0268
H O H e H O2 2 22 2 2+ ++ minus 1776 AgCl s e Ag Cl( )+ +minus minus
0222
MnO H e MnO s H O4 2 24 3 2minus + minus+ + + ( ) 1679 Cu e Cu2+ minus ++ 0153
Ce e Ce4 3+ minus ++ 172 Sn e Sn in HCl M4 22 1+ minus ++ ( ) 0151
MnO H e Mn H O42
28 5 4minus + minus ++ + + 1507 S H e H S g+ ++ minus2 2 2 ( ) 0142
PbO H e Pb H O22
24 2 2+ + ++ minus + 1455 S O e S O4 6
22 3
22 2minus minus minus+ 008
Cl e Cl2 2 2+ minus minus 1358 AgBr s e Ag Br( )+ +minus minus
0071
Cr O H e Cr H O2 72 3
214 6 2 7minus + minus ++ + + 1350 2H ++ 2e-H2 00000
O g H e H O2 24 4 2( )+ ++ minus 1229 Pb e Pb2
2+ minus+ ndash0126
2 12 10 63 2 2IO H e I H Ominus + minus+ + + 1195 Sn e Sn22
+ minus+ ndash0137
Br l e Br2 2 2( )+ minus minus 1066 Ni e Ni2
2+ minus+ ndash0257
NO H e HNO H O3 2 23 2minus + minus+ + + 0934 Co e Co22
+ minus+ ndash0282
2 22
2
2Hg e Hg+ minus ++ 0920 Fe e Fe22
+ minus+ ndash0447
Cu I e CuI2+ minus minus+ + 086 Zn e Zn22
+ minus+ ndash0762
Ag e Ag+ minus+ 0799 Mn e Mn22
+ minus+ ndash1185
Hg e Hg2
22 2
+ minus+ 0797 Al e Al33
+ minus+ ndash1662
Fe e Fe3 2+ minus ++ 0771 Mg e Mg22
+ minus+ ndash2372
O g H e H O2 2 22 2( )+ ++ minus 0695 Na e Na+ minus+ ndash2710
I e I3 2 3minus minus minus+ 0536 Ca e Ca22
+ minus+ ndash2868
I e I2 2 2+ minus minus 0535 K e K+ minus+ ndash2931
Cu e Cu+ minus+ 0521 Li e Li+ minus+ ndash3040
Fe CN e Fe CN( ) ( )63
64minus minus minus+ 0358
14
2 Potenziometria
alluminio si dissolve mentre si deposita rame metallico Infatti i potenziali stan-dard delle due coppie redox sono
Cu2+ + 2endash Cu Edeg= +034 V
Al3+ + 3endash Al Edeg= ndash166 V
Nella soluzione quindi lo ione Cu2+ (forma ossidata della coppia con potenzialemaggiore) tende a ossidare Al (forma ridotta della coppia con potenziale minore)
TABELLA DEI POTENZIALI STANDARD DI RIDUZIONEAPPROFONDIMENTO
22 Tensione pratica (ddp) di una pila
Lrsquoinsieme dei conduttori di prima e di seconda specie che in sequenza opportunaformano una pila (o in generale un sistema elettrochimico) costituisce una catenagalvanica La differenza di potenziale (Ecella) che si misura ai capi di una pila durantelrsquoerogazione di corrente egrave dovuta a diversi contributi piugrave precisamente egrave uguale allasomma algebrica di tutte le cadute di tensione che si verificano lungo lrsquointero circuito
Ecella= E1 + E2 + E3 + E4 + E5 (25)
dove bull E1 egrave la ddp dovuta allrsquoeventuale passaggio di corrente nel circuito (cadutaohmica) bull E2 la ddp di contatto metallometallo (tensione di Volta) bull E3 la ddpdi contatto soluzionesoluzione (tensione o potenziale di giunzione liquida) bull E4 edE5 le ddp di contatto metallosoluzione (tensione di Nernst) per ciascun elettrodo
Esaminiamo ora il significato dei singoli contributi
Caduta ohmica Quando la cella egrave attraversata da corrente inevitabilmente si ve-rifica una caduta di tensione E = R times i (prima legge di Ohm) Ovviamente se lamisura del potenziale di cella viene effettuata in condizioni tali da minimizzareo eliminare il passaggio di corrente (cioegrave a circuito aperto) la caduta ohmica siannulla (cioegrave E1= 0)
Tensione di Volta Quando due diversi metalli vengono posti a contatto si generasempre una ddp Questo fenomeno detto effetto Volta egrave dovuto al fatto che glielettroni di conduzione sono trattenuti con diversa energia dai diversi metalli Per-ciograve il contatto fra due metalli provoca un trasferimento di elettroni istantaneo daparte del metallo che li trattiene con minore energia Il processo perograve non prose-gue indefinitamente il trasferimento di elettroni infatti prosegue fino allrsquoequili-brio quando insorge una ddp (in genere di pochi millivolt) sufficiente a bloccarlo
Si puograve verificare sperimentalmente (e dimostrare) che la ddp agli estremi diuna catena di conduttori di prima specie egrave uguale a quella che si stabilisce se i duemetalli che ne costituiscono gli estremi vengono posti a diretto contatto (fig 24)Di conseguenza se gli ingressi del misuratore di tensione sono costituiti dallo stessometallo lrsquoeffetto Volta complessivo egrave nullo (E2= 0)
In altri termini la formaossidata della coppia conpotenziale piugrave alto egraveossidante nei confrontidella forma ridotta dellacoppia con potenzialepiugrave basso
A rigore si dovrebbe usareil simbolo V (o ∆V)percheacute si tratta di unaddp misurata in una pilain funzione e dunquenon di una fem Il pedicelaquocellaraquo puntualizza che sitratta in generale di unacella elettrochimica
R egrave la resistenza delconduttore e i lrsquointensitagravedi corrente
15
CELLE GALVANICHE O PILE
Potenziale di giunzione liquida In una pila le due semicelle sono separate matenute in contatto elettrico mediante un setto poroso o un ponte salino che con-sente un mescolamento lentissimo (praticamente nullo) delle soluzioni Questidispositivi (si veda la figura 25) perograve creano unrsquoulteriore caduta di tensione fragli elettrodi detta potenziale di giunzione liquida (Eg) o anche potenziale dicontatto (o di diffusione) Il potenziale di giunzione liquida puograve essere sia po-sitivo sia negativo e quindi fa aumentare o viceversa diminuire la ddp fra glielettrodi
Lrsquoinsorgere di un potenziale di giunzione egrave causato dal fatto che gli ioni si dif-fondono con diversa mobilitagrave attraverso le superfici di contatto di due mezzi di-versi un setto poroso per esempio egrave diversamente permeabile agli ioni propriosecondo la loro mobilitagrave
Tensione di Nernst I potenziali di contatto metallosoluzione (E4 E5) si calco-lano in teoria mediante la legge di Nernst e perciograve sono detti potenziali nern-stiani
LA MOBILITAgrave DEGLI IONI IN SOLUZIONEAPPROFONDIMENTO
23 Calcolo della tensione teorica (fem) di una pilaSe si opera in modo da rendere trascurabili i primi tre termini dellrsquoequazione (22)la ddp ai capi della pila coincide in pratica con la sua fem che puograve essere cal-colata semplicemente in base agli ultimi due termini cioegrave ai potenziali di elettrodoNei calcoli occorre tenere presente che
a la fem di una pila in quanto strettamente collegata al lavoro da essa compiutodeve necessariamente avere segno positivo
b lrsquoelettrodo a potenziale maggiore su cui avviene la riduzione egrave il catodo lrsquoelet-trodo a potenziale minore su cui avviene lrsquoossidazione egrave lrsquoanodo
Di conseguenza la fem di una pila cioegrave di una cella elettrochimica ottenuta colle-gando due semicelle (catodica e anodica) egrave espressa dalla seguente relazione
Ecella = Ec ndash Ea (26)
ovvero
Ecella = Emaggiore ndash Eminore (27)
Questa seconda scrittura mostra chiaramente che la fem della pila egrave sempre posi-tiva anche nel caso in cui i potenziali delle due semicelle siano entrambi negativi
Indichiamo con Ec ilpotenziale del catodo (opotenziale catodico) econ Ea il potenzialedellrsquoanodo (o potenzialeanodico)
Figura 24Nonostante ogni superficie di contatto fra due metallisia sede di una ddp dovuta allrsquoeffetto Volta la ddpche si instaura fra rame e zinco egrave la stessa sia nel caso(a) sia nel caso (b) Infatti se cosigrave non fosse chiudendola catena aperta (a) si dovrebbe osservare un passaggiodi corrente e questo in realtagrave non avviene
a b
16
2 Potenziometria
ESEMPIO 1UNA IPOTETICA PILA Egrave COSTITUITA DALLE COPPIE REDOX Al3+Al E Ni2+NiQUAL Egrave LA FEM DELLA PILA SE LE ATTIVITAgrave DI TUTTE LE SPECIE IONICHE SONOUNITARIE
Dal momento che le attivitagrave sono unitarie il calcolo fornisce la tensione (o forzaelettromotrice) standard della pila
Innanzitutto dalla tabella dei potenziali standard si ricavano i potenziali stan-dard per ciascuna coppia redox
Al3+ + 3endash Al Eo
= ndash166 V
Ni2+ + 2endash Ni Eo
= ndash026 V
Lrsquoelettrodo della coppia Ni2+Ni costituisce il catodo percheacute ha il potenziale mag-giore mentre lrsquoelettrodo della coppia Al3+Al costituisce lrsquoanodo percheacute ha il poten-ziale minore Si puograve anche costruire un diagramma di questo tipo
Al3+Al Ni2+Ni H+H2
ndash166 ndash026 00000 Edeg(V rif a SHE)
Quindi la fem della pila in condizioni standard egrave
Ecella= Ec ndash Ea= Emaggiore ndash Eminore= ndash026 ndash (ndash166)= +140 V
La reazione di ossidoriduzione che genera la pila si ottiene formalmente combi-nando le due semireazioni bilanciate quella di riduzione al catodo e quella di os-sidazione allrsquoanodo Ciascuna semireazione deve essere moltiplicata per un fattorenumerico tale che il numero di elettroni ceduti dalla specie che si ossida sia uguale aquello degli elettroni acquistati dalla specie che si riduce Quindi nel caso dellrsquoesem-pio proposto si moltiplica la semireazione della coppia Al3+Al per 2 e quella dellacoppia Ni2+Ni per 3
2 middot (Al Al3+ + 3endash) Edeg= ndash(ndash166 V) (ndash)
3 middot (Ni2+ + 2endash Ni) Edeg= ndash026 V (+)
2Al + 3Ni2+ 2Al3+ + 3Ni Edeg= +140 V
Attenzione per ottenere il bilancio della reazione di cella si moltiplica per un coeffi-ciente opportuno ciascuna semireazione ma non il rispettivo potenziale Infatti i po-tenziali di elettrodo (e quindi anche il potenziale di cella) esprimono un lavoro elettricoper unitagrave di carica e perciograve sono proprietagrave intensive che non dipendono dalla quantitagravedi materia contenuta nel sistema ovvero dal numero di cariche elettriche trasportate
Se le attivitagrave non sono unitarie per calcolare il potenziale di elettrodo occorreapplicare lrsquoequazione di Nernst
Egrave ovvio comunque che il lavoro complessivo che puograve essere fornito da una piladipende anche dalla massa e dalla geometria degli elettrodi Per questo motivo unapila o un insieme di pile (cioegrave una batteria) che viene utilizzata per esempio permuovere un veicolo puograve avere dimensioni ingombranti Questo accadeva fino anon molti anni fa per le vecchie batterie al piombo ora sempre piugrave sostituite dabatterie come quelle al litio decisamente piugrave compatte e che infatti stanno rendendopossibile il progressivo passaggio allrsquoauto parzialmente o completamente elettrica
UNA IPOTETICA PILA Egrave COSTITUITA DALLE COPPIE REDOX Al3+Al E Ni2+NiQUAL Egrave LA FEM DELLA PILA SE LE ATTIVITAgrave DI TUTTE LE SPECIE IONICHE SONOUNITARIE
Nella pila la reazionedella coppiadella coppia Ni2+Ni(Ni2+ si riduce) avvienenel senso conforme allaconvenzione adottata per ipotenziali (elettroni asinistra) invece lareazione della coppiaAl3+Al (Al si ossida)avviene nel senso oppostoa quello convenzionalePerciograve il potenziale Edegdella coppia Al3+Al vieneconsiderato con segnoopposto a quello tabulato(+166 V) Se si sommaalgebricamente ilpotenziale dellrsquoelettrodoche si riduce (Ec) conquello dellrsquoelettrodo che siossida cambiato di segno(Ea) la tensione della pilarisulta positiva
17
CELLE GALVANICHE O PILE
ESEMPIO 2UNA IPOTETICA PILA Egrave COSTITUITA DALLE COPPIE REDOX Al3+Al E Ni2+NiQUAL Egrave LA FEM DELLA PILA A 25 degC SE LE CONCENTRAZIONI DELLE SPECIEIONICHE SONO RISPETTIVAMENTE [Al3+] = 2 10ndash2 M E [Ni2+] = 10ndash2 M
Approssimando le attivitagrave con le concentrazioni si ottiene
La situazione non egrave sostanzialmente cambiata rispetto alle condizioni standardpercheacute anche in questo caso la reazione di cella comporta lrsquoossidazione dellrsquoallumi-nio e la riduzione del nichel La fem della pila quindi egrave
Ecella= Ec ndash Ea= ndash032 ndash (ndash167)= +135 V
24 Alcuni tipi di pile
Pila DaniellUna semicella egrave costituita da una lamina di rame immersa in una soluzione diCuSO4 lrsquoaltra semicella da una lamina di zinco immersa in una soluzione di ZnSO4
(fig 25) Le due semicelle sono separate da un setto poroso (in pratica una mem-brana di vetro sinterizzato o analogo materiale inerte) oppure si trovano in duediversi recipienti collegati da un ponte salino
Le reazioni di elettrodo sono
Zn2+ + 2endash Zn Edeg= ndash0762 V
Cu2+ + 2endash Cu Edeg= 0342 V
Le concentrazioni dei sali nelle rispettive semicelle sono in genere tali da renderenegativo il semielemento di zinco che perciograve tende a cedere elettroni al rame (ossi-dandosi) La lamina di zinco egrave dunque il polo negativo (anodo) della pila e il rameegrave il polo positivo (catodo)
La rappresentazione della catena galvanica di questa pila secondo le convenzioniIUPAC egrave
(ndash) Zn(s)|ZnSO4(aq)||CuSO4(aq)|Cu(s) (+)
UNA IPOTETICA PILA Egrave COSTITUITA DALLE COPPIE REDOX Al3+Al E Ni2+NiQUAL Egrave LA FEM DELLA PILA A 25 degC SE LE CONCENTRAZIONI DELLE SPECIEIONICHE SONO RISPETTIVAMENTE [Al3+] = 2 10ndash2 M E [Ni2+] = 10ndash2 M
Si noti che se i duescomparti non fosseroscomparti non fosseroben separati dal settoben separati dal settoporoso ben presto gli ioniporoso ben presto gli ionirame disponibilirame disponibiliraggiungerebbero lrsquoraggiungerebbero lrsquoanododi zinco ossidandolo eandando a depositarsi sudi esso come Cumetallico nondiversamente da quanto sipuograve osservareimmergendo una barrettadi zinco in una soluzionedi solfato di rameesaurendo quindirapidamente la pila esviluppando calore
Figura 25Pila Daniell (a) con settoporoso e (b) con pontesalino
a b
18
2 Potenziometria
La coppia di barrette verticali (||) al centro rappresenta il setto poroso o il pontesalino che separano le due semicelle lrsquoanodo egrave scritto a sinistra e per ciascun elet-trodo la forma ridotta della coppia redox egrave scritta verso lrsquoesterno Le lettere scrittefra parentesi indicano lo stato fisico di ogni specie chimica
La reazione di cella egrave
Zn + Cu2+ Zn2+ + Cu
Per calcolare la fem teorica di questa pila che puograve anche trovarsi in condizionidiverse da quelle standard si applica la legge di Nernst a ciascuna semicella
(28)
(29)
I potenziali standard delle due semicelle sono cosigrave diversi fra loro che nelle normalicondizioni operative di una pila Daniell il rame rappresenta il polo positivo e lozinco il polo negativo
Sottraendo il potenziale minore da quello maggiore si ottiene il potenziale dicella
Ecella = ECu2+Cu - EZn2+Zn
Ponendo Edegcella = EdegCu2+Cu ndash EdegZn2+Zn (= 0342 V + 0762 V) e quindi sottraendo la(28 dalla 29) si ricava infine
Questa equazione consente dunque di calcolare il potenziale di Nernst se egrave notoil valore effettivo dellrsquoattivitagrave degli ioni Zn2+ e Cu2+ Tuttavia il calcolo si presta aerrori anche significativi lrsquoattivitagrave degli ioni per esempio varia in funzione dellaforza ionica della soluzione e non puograve essere calcolata Perciograve la fem reale piugraveesattamente la ddp che si misura si discosta dal valore calcolato sostanzialmenteper due motivi
a il sistema non si comporta in maniera ideale (per esempio gli elettrodi possonopolarizzarsi)
b il contributo della caduta ohmica (gtequazione 25) puograve essere praticamente an-nullato se nel circuito viene fatta circolare una corrente trascurabile invece ilpotenziale di giunzione liquida per quanto piccolo non puograve essere soppresso enon egrave prevedibile in base a equazioni teoriche
Pile a concentrazioneIn questo tipo di pila le due semicelle contengono due soluzioni di una stessa cop-pia redox ma a diversa concentrazione gli elettrodi sono inerti oppure dello stes-so metallo e le semicelle sono collegate da un setto poroso o da un ponte salino(fig 26)
In questo calcolotrascuriamo i contributidei termini E1 E2 E3 dellaequazione (25)
Lrsquoequazione rappresentain pratica la legge diNernst applicata allareazione redox globalescritta nel verso dellaspontaneitagrave tenendoconto degli elettroniscambiati (2) e inserendonellrsquoargomento dellogaritmo lrsquoinverso delquoziente di reazione
+
19
CELLE GALVANICHE O PILE
Le due soluzioni si scambiano elettroni attraverso il circuito esterno mentre ilsetto poroso (o il ponte salino) che le collega consente il passaggio di ioni e quin-di chiude il circuito Il sistema raggiunge lrsquoequilibrio quando le attivitagrave degli ioninelle due semicelle diventano uguali perciograve egrave prevedibile che nella soluzione piugravediluita avvenga lrsquoossidazione il rame metallico si dissolve e si formano ioni Cu2+ insoluzione questo dunque egrave lrsquoanodo Contemporaneamente gli elettroni passanonellrsquoaltro comparto (a destra in figura 26) attraverso il circuito esterno e riduconogli ioni Cu2+ che si depositano sullrsquoelettrodo come rame metallico questo dunqueegrave il catodo
In pratica egrave come se gli ioni Cu2+ si trasferissero dalla soluzione piugrave concentrataalla soluzione piugrave diluita Queste pile dunque trasformano in lavoro elettrico lrsquoe-nergia che si libera nel processo spontaneo con cui due soluzioni a diretto contattotendono a raggiungere lrsquoequilibrio di concentrazione
La rappresentazione convenzionale della catena elettrodica di questa pila a con-centrazione egrave la seguente
(-) Cu(s) |Cu2+(001 M)||Cu2+(1 M)|Cu(s) (+)
Per calcolare la tensione teorica della pila si applica la legge di Nernst a ciascun elet-trodo Approssimando le attivitagrave con le concentrazioni (a 25 degC) si ottiene
(soluzione piugrave diluita anodo)
(soluzione piugrave concentrata catodo)
Quindi
Ecella= Emaggiore ndash Eminore= 0342- 0283= 0059 V
ALTRI TIPI DI CELLE GALVANICHE O PILEAPPROFONDIMENTO
Figura 26Pila a concentrazione il compartoanodico (a sinistra) contiene ioni Cu2+
in concentrazione 001 M e il com-parto catodico (a destra) contieneioni Cu2+ in concentrazione 1 M Ilcollegamento fra le due semicelle egraverealizzato con un ponte salino
20
2 Potenziometria
STRUMENTAZIONEIn potenziometria si misura la differenza di potenziale che si stabilisce fra due semi-celle allo scopo di determinare la concentrazione di uno ione o per seguire lrsquoanda-mento di una titolazione
Il dispositivo completo per una misura potenziometrica (fig 27) consiste es-senzialmente di
bull un potenziometro o meglio un millivoltmetro elettronicobull un elettrodo di riferimentobull un elettrodo di misura
Il potenziometro serve per misurare la ddp fra i due elettrodi senza alterare il lorostato di equilibrio perciograve si lavora a corrente praticamente nulla
Gli elettrodi collegati al potenziometro sono immersi nella soluzione su cui sieffettuano le misure Lrsquoelettrodo di riferimento egrave costruito in modo tale da mante-nere costante il suo potenziale di conseguenza ogni variazione di ddp misurata egraveimputabile esclusivamente allrsquoelettrodo di misura (piugrave precisamente alla soluzioneanalizzata)
ELETTRODI DI RIFERIMENTOLrsquoelettrodo standard a idrogeno (SHE gtparagrafo 21) egrave lrsquoelettrodo di riferimentoprimario Tuttavia nella pratica quotidiana di laboratorio si usano elettrodi di ri-ferimento secondari piugrave semplici e maneggevoli che hanno comunque la proprie-tagrave di mantenere il proprio potenziale costante a temperatura costante Tratteremoora in maggior dettaglio gli elettrodi di uso piugrave comune
31 Elettrodo ad argentocloruro drsquoargento
Si tratta senzrsquoaltro dellrsquoelettrodo piugrave diffuso Il dispositivo egrave costituito da un sem-plice filo drsquoargento rivestito di AgCl e immerso in una soluzione di KCl (egrave dunqueun elettrodo di seconda specie) Il tutto egrave contenuto in un tubicino di vetro dotatodi setto poroso per assicurare il contatto elettrico con lrsquoesterno ovvero con la so-luzione in cui viene immerso lrsquooggetto dellrsquoanalisi
Figura 27Rappresentazione schematica deldispositivo completo per misurepotenziometriche
3
21
ELETTRODI DI RIFERIMENTO
La rappresentazione convenzionale dellrsquoelettrodo (fig 28) egrave
Ag(s)|AgCl(aq)|KCl(aq)
La reazione di elettrodo egrave
AgCl + endash Ag + Clndash
E il potenziale di elettrodo
E= EdegAgClAg
Considerando unitarie le attivitagrave dei solidi puri si ottiene
E= EdegAgClAg ndash 01984 10ndash3 T log[Clndash] (210)
Se lrsquoattivitagrave degli ioni cloruro egrave costante (a temperatura costante) il potenziale dielettrodo rimane costante Gli elettrodi piugrave comuni contengono soluzioni sature diKCl (circa 42 M) e perciograve sono detti saturi (SSC Saturated Silver-Silver ChlorideElectrode) A 25 degC il potenziale di SSC vale 0197 V Questo elettrodo puograve essereusato fino a 105 degC Nella tabella 1 ndash lab 1 (gtpag 39) sono riportati i potenziali alvariare della temperatura per lrsquoelettrodo saturo e 3 M
Gli anioni (come il solfuro) che formano con Ag+ sali meno solubili di AgClpossono danneggiare questo tipo di elettrodo Anche gli ossidanti e i riducenti fortie gli agenti complessanti possono interferire con la reazione di elettrodo per proteg-gere lrsquoelettrodo da queste sostanze si usa un elettrolita intermedio come nel casodellrsquoelettrodo a calomelano saturo (SCE gtparagrafo 32)
Gli elettrodi ad argentocloruro di argento sono usati come riferimento internonegli elettrodi a vetro (gtparagrafo 41)
32 Elettrodo a calomelano
laquoCalomelanoraquo egrave il nome comune del cloruro mercuroso (I) Hg2Cl2 che fa parteappunto di questo elettrodo (fig 29a) La rappresentazione convenzionale dellrsquoe-lettrodo egrave
Hg(l)|Hg2Cl2(s)|KCl(aq)
La reazione di elettrodo egrave
Hg2Cl2 + 2endash 2Hg + 2Clndash
e il potenziale di elettrodo in base alla legge di Nernst
In condizioni standard lrsquoattivitagrave di solidi e liquidi puri egrave considerata uguale a 1quindi
da cui
ndash 01984 10ndash3 T log|Clndash| (211)
Sono anche molto diffusigli elettrodi contenentiKCl 3 M cioegrave quasisaturi Il vantaggio egrave chein queste soluzioni non siformano cristalli di KClche possono danneggiarelrsquoelettrodo ostruendoil setto poroso che sta sulfondo
Figura 28Elettrodo ad AgAgCILa soluzione tamponeinterna contiene ioni K+
e CIndash ad attivitagrave costante
22
2 Potenziometria
Il potenziale dellrsquoelettrodo a calomelano dunque dipende solo dallrsquoattivitagrave delloione cloruro e dalla temperatura Se la temperatura egrave costante e lrsquoattivitagrave dello ionecloruro nella soluzione interna allrsquoelettrodo non varia il potenziale rimane costante
Gli elettrodi a calomelano piugrave comuni contengono soluzioni sature di KCl (circa42 M) e perciograve sono detti saturi (SCE Saturated Calomel Electrode) Si usano ancheelettrodi a KCl 1 M e 01 M la tabella 22 riporta il potenziale assunto da questielettrodi secondo la concentrazione di KCl
TABELLA 22 | Potenziale (mV) di alcuni elettrodi di riferimento a 25 degC
AgAgCl Calomelano HgHgO HgHgSO4 Thalamid
KCl 01 M 288 KCl 01 M 334 NaOH 01 M 165 H2SO4 05 M 682 KCl 3 M -567
KCl 1 M 235 KCl 1 M 280 NaOH 1 M 140 K2SO4 sat 650 KCl sat -577
KCl 3 M 210 KCl 35 M 250
KCl 35 M 205 KCl sat 241
KCl sat 199 NaCl sat 236
NaCl 3 M 209
NaCl sat 197
Lrsquoelettrodo a calomelano puograve essere usato fino a circa 70 degC a temperature piugrave alteil calomelano si dismuta (Hg2Cl2 Hg + HgCl2)
I solfuri gli ossidanti i forti riducenti e gli agenti complessanti che formanoamalgami con gli ioni Hg2
2+ possono danneggiare questo tipo di elettrodo Perciogravequando si lavora in presenza di queste sostanze si usano elettrodi a doppia giun-zione (fig 29b) in cui fra lrsquoelettrodo e la soluzione egrave interposto un contenitoreriempito con un elettrolita intermedio (per esempio KNO3)
Va infine segnalata la tendenza a non usare il mercurio per motivi tossicologicie questo spiega il progressivo abbandono nella pratica comune di questo tipo dielettrodo con grande rammarico dagli elettrochimici percheacute lrsquoelettrodo a calomela-no egrave il piugrave stabile
bullELETTRODI DI PRIMA E DI SECONDA SPECIE bullALTRI ELETTRODI DI RIFERIMENTO
APPROFONDIMENTI
Figura 29(a) Elettrodo a calomelano (b) Nella versione adoppia giunzione egrave presente una seconda cameraper lrsquoelettrolita intermedio che viene immessoattraverso la bocchetta laterale il setto porosoassicura il contatto elettrico con la soluzioneesterna
a b

6
Potenziometria2
TEORIA
ELETTRODI E POTENZIALE DI ELETTRODOConsideriamo un sistema relativamente semplice (fig 21a) costituito da una lami-na metallica (per esempio di rame Cu) immersa in acqua pura o in una soluzionemolto diluita di un suo sale (per esempio il solfato) Un sistema di questo tipo costi-tuisce una semicella (o semielemento o semplicemente elettrodo)
Allrsquoinizio sia il metallo sia la soluzione sono elettricamente neutri quasi imme-diatamente dopo il contatto perograve si verifica uno scambio spontaneo di materia frail metallo e la soluzione piugrave precisamente si verifica un passaggio di ioni Cu2+ insoluzione
1
Se si usa una lamina dirame laquomarcataraquo cioegravecontenente isotopiradioattivi del rame in uncerto tempo anche lasoluzione manifesta unaleggera radioattivitagravequesto dimostra che unaquantitagrave sia pure minimadi rame egrave passata insoluzione sia in formaionica sia elementare Egravestato infatti dimostratoche in soluzione sonopresenti anche cluster diatomi neutri
Figura 21(a) Semplice semicella elettrochi-mica (b) Rappresentazione sem-plificata del doppio strato elettricoche si forma quando il metalloossidandosi cede ioni positivi allasoluzione Le molecole dipolaridellrsquoacqua sono laquoorientateraquo sianella sfera di solvatazione degliioni sia vicino alla superficie delmetallo che ha carica negativa
Si crea cosigrave uno squilibrio elettrico la soluzione assume carica positiva percheacute gliioni solfato non compensano la carica degli ioni Cu2+ passati in soluzione mentrela lamina di rame che ha trattenuto due elettroni per ogni nuovo ione Cu2+ assumecarica elettrica negativa
Si forma perciograve un doppio strato elettrico (fig 21b) cioegrave una separazione dicarica allrsquointerfaccia metallosoluzione che viene descritta come una differenza di
Caricanegativa
Interfacciametallosoluzione
7
ELETTRODI E POTENZIALE DI ELETTRODO
potenziale (abbreviata ddp) fra la lamina di metallo e la soluzione questa ddp egravedetta potenziale di semicella (o potenziale di elettrodo) Nel nostro esempio lalamina di rame assume carica negativa e quindi ha potenziale negativo mentre lasoluzione assume potenziale positivo
Il potenziale di semicella puograve essere espresso indifferentemente come la diffe-renza di potenziale fra il metallo e la soluzione oppure fra la soluzione e il metallosi tratta di una pura convenzione In questo libro seguiremo la convenzione euro-pea adottata a livello internazionale dalla IUPAC (International Union of Pure andApplied Chemistry) nel 1953 in base alla quale
a se si indica con ye il potenziale del metallo (fase solida) e con ys quello dellasoluzione (fase liquida) la ddp egrave uguale a ye ndash ys Quindi nel nostro esempio ilpotenziale di elettrodo egrave negativo
b le reazioni redox associate a una semicella devono essere scritte nel senso dellariduzione
Quindi per lrsquoelettrodo di rame la reazione di semicella egrave scritta nella forma seguente
Cu2+ + 2endash Cu
Il significato chimico-fisico del potenziale (Ve) assunto dallrsquoelettrodo di rame in se-guito al passaggio spontaneo di ioni Cu2+ in soluzione (per effetto di una ossidazione)egrave il seguente esso rappresenta il lavoro (Le) per unitagrave di carica (q) che bisogna com-piere per realizzare il processo non spontaneo opposto cioegrave il deposito di rame sullalamina (per effetto di una riduzione) Poicheacute i fenomeni in gioco sono sia di naturachimica sia elettrica si parla piugrave correttamente di potenziale elettrochimico dellrsquoe-lettrodo
I potenziali elettrochimici dipendono da un insieme di condizioni standard di tem-peratura pressione e concentrazione fissate inizialmente da coloro che per primi se nesono occupati per esempio 298K per la temperatura e 1 bar per la pressione
Lo stato standard egrave
bull per i solidi il solido purobull per i solventi il solvente purobull per i soluti una soluzione 1 Mbull per i gas il gas puro alla pressione di 1 bar
Il tutto assumendo un comportamento ideale per ogni sistema
In linguaggio matematico
VL
qe
e=
Ovviamente queste considerazioni sono valide anche per il caso in cui la reazionedi riduzione egrave il processo che avviene spontaneamente Ciograve si verifica per esempioquando la soluzione ha una concentrazione di ioni Cu2+ cosigrave elevata che lrsquoeffetto nettodegli scambi metallosoluzione consiste nel trasferimento di ioni sul metallo che per-ciograve acquista una carica positiva e quindi un potenziale positivo rispetto alla soluzioneEsiste anche unrsquounica concentrazione di ioni Cu2+ per la quale non si verifica scam-
Il termine elettrodo chein potenziometria siriferisce allrsquointero sistemametallosoluzione spessoviene riferito alla sola fasesolida (la laminametallica) seguendo cosigravela consuetudine in usonelle tecnicheelettrolitiche
Il lavoro necessario perdepositare uno ione sullalamina riducendolo egrave ditipo sia elettrico (neiconfronti delle forze delcampo elettrostaticogenerato dallrsquoelettrodo)sia elettrico di superficie(per superare il doppiostrato di cariche) siachimico (percheacute nelprocesso di riduzione delloione sul metallointervengono forze dinatura chimica)
8
2 Potenziometria
bio apparente di materia fra il metallo e la soluzione a questa concentrazione le duereazioni opposte (riduzione e ossidazione) procedono alla stessa velocitagrave e il sistemasi trova in uno stato di equilibrio termodinamico fin dallrsquoistante in cui il metalloviene immerso in soluzione
LA FISICA DEI SISTEMI ELETTROCHIMICIAPPROFONDIMENTO
11 Classificazione degli elettrodiUn metallo immerso in una soluzione dei suoi ioni costituisce un elettrodo di pri-ma specie il cui potenziale dipende dalla concentrazione (piugrave precisamente dallrsquoat-tivitagrave) degli ioni in soluzione
Quando invece il metallo si trova in equilibrio con la soluzione di un suo salepoco solubile si ha un elettrodo di seconda specie un filo drsquoargento immerso inuna soluzione satura di AgCl tutto ricoperto dal sale egrave un tipico elettrodo di secon-da specie La reazione di elettrodo egrave
AgCl + endash Ag + Clndash
Un elettrodo di terza specie egrave costituito da un metallo inerte immerso in una solu-zione contenente una coppia redox Un tipico esempio egrave costituito da un filo di pla-tino (un metallo nobile e quindi inerte nelle normali condizioni di lavoro) immersoin una soluzione di ioni Fe2+ e Fe3+ Il metallo si pone in equilibrio con la soluzionedi cui assume il potenziale Infatti la superficie di platino diventa sede dello scam-bio di elettroni fra le due specie ioniche che danno luogo alla reazione
Fe3+ + endash Fe2+
Infine gli elettrodi di quarta specie (che possono essere considerati come una va-riante dei precedenti) sono i cosiddetti elettrodi a gas in cui il metallo inerte e poro-so viene saturato da un gas (per esempio idrogeno) e posto a contatto con una solu-zione contenente la forma ionica del gas (nellrsquoesempio H+) Nel caso dellrsquoidrogeno
2H+ + 2endash H2
12 Calcolo dei potenziali di elettrodo legge di Nernst
Il potenziale di elettrodo egrave tanto maggiore in valore assoluto quanto maggiore egravela differenza di carica nel doppio strato (per esempio quella che si instaura allrsquoe-quilibrio fra i due lati dellrsquointerfaccia metallosoluzione) e dipende sia dalla naturachimica della coppia redox sia dalla concentrazione attiva ovvero dallrsquoattivitagrave degliioni in soluzione
Consideriamo lrsquoequilibrio per una generica semireazione di elettrodo
aox + bB + nendash cred + dD
Allrsquoequilibrio il potenziale di elettrodo che in realtagrave egrave una differenza di potenzialefra il metallo e la soluzione egrave espresso dalla legge di Nernst
+ (21)
Questa legge che prende ilnome dal chimico tedescoWalther H Nernst puograveessere ricavata in base aconsiderazionitermodinamiche edelettrochimiche su cui nonci soffermeremo Si notiin particolare chelrsquoargomento dellogaritmo egrave lrsquoinverso delquoziente di reazione
9
ELETTRODI E POTENZIALE DI ELETTRODO
dove bull E egrave il potenziale di elettrodo (in volt V) bull R la costante dei gas (che vale831451 Jmol times K) bull T la temperatura assoluta (in kelvin K) bull F la costante diFaraday (che vale 96 485 coulombmol) bull n il numero di elettroni scambiati nellasemireazione bull frac12 frac12 indica lrsquoattivitagrave di ciascuna specie scritta fra le due barrette
Edeg egrave il potenziale standard della coppia redox cioegrave il potenziale che la semicellaassume alla temperatura di 25 degC (29815 K) quando tutte le specie hanno attivitagraveunitaria e i gas si trovano alla pressione parziale di 1 bar (100 kPa) o piugrave precisa-mente hanno fugacitagrave unitaria
Lrsquoattivitagrave di ogni specie egrave uguale al prodotto g ∙ C dove g egrave il coefficiente di atti-vitagrave e C la concentrazione analitica espressa in moli su litro (molL)
Se si tiene conto dei coefficienti di attivitagrave e si inseriscono le parentesi quadre [ ]che indicano le concentrazioni in molL (gtpag 33) si ottiene
E ERT
nF
a b
c d= +deg ln
[ox] [B]
[red] [D]acute (22)
dove al posto di Eo compare il cosiddetto potenziale formale (Eoacute) della coppia redoxin oggetto
Il potenziale formale puograve differire in modo significativo dal potenziale standarde si rivela piugrave utile di esso per una valutazione anche solo orientativa del compor-tamento della coppia redox in quanto tiene meglio conto delle reali condizioni incui si opera per esempio il pH della soluzione Ricordiamo infatti che il pH allrsquointer-no di una cellula vale circa 7 (a parte pochissime eccezioni) per cui il potenziale re-dox standard che fa riferimento a pH 0 non risulta molto adatto a descriverne de-terminate caratteristiche Inoltre il potenziale standard delle coppie O2H2O vale123 V ma scende a 081 V a pH 7 Analogamente il potenziale della coppia deidro-ascorbicoascorbico passa da +390 V a +0058 V diventando nettamente riducentecome si addice alle ben note proprietagrave antiossidanti della vitamina C
Quando si lavora con soluzioni molto diluite (al di sotto di 10ndash3 M) si puograveassumere con buona approssimazione che il coefficiente di attivitagrave di tutte lespecie sia uguale a 1 In tali condizioni se si inserisce il valore numerico di RF e ilfattore numerico per la conversione ai logaritmi decimali si ottiene
(23)
Alla temperatura di 25 degC (29815 K) la legge di Nernst assume la sua forma piugravenota e usata
+ (24)
Per esempio per la semireazione
Cu2+ + 2endash Cu
la legge di Nernst (a 25 degC) assume la forma
+
La costante di Faradayequivale alla caricaelettrica di un numerodi Avogadro (cioegrave diuna mole) di elettroniUna mole contiene602214076 times 1023
entitagrave elementari(gtpag 457)
La fugacitagrave egrave la grandezzafisica adottata per i gas alposto della pressione alloscopo di tener conto delloro comportamento nonideale
ln = 23026 log
10
2 Potenziometria
In questa equazione non compare la concentrazione della forma ridotta percheacutelrsquoattivitagrave di una specie chimica pura nelle condizioni standard viene convenzio-nalmente assunta uguale a 1
In effetti spesso si lavora con soluzioni non particolarmente diluite quindi neicalcoli bisogna fare riferimento alle attivitagrave invece che alle concentrazioni di con-seguenza lrsquoequazione (24) diventa
+ log
IL POTENZIALE FORMALEAPPROFONDIMENTO
13 Polarizzazione degli elettrodiIn tutti i casi in cui il sistema dellrsquoelettrodo si discosti dalle condizioni di equilibriotermodinamico la legge di Nernst diventa inadeguata a descrivere il sistema stessoCiograve accade per esempio quando allrsquoelettrodo viene imposto un potenziale arbitra-rio eo la corrente che lo attraversa egrave molto intensa in questi casi il potenziale dielettrodo risulta diverso da quello previsto in base alla legge di Nernst e si dice chelrsquoelettrodo egrave polarizzato
In particolare quando la concentrazione degli ioni alla superficie di un elettrodoegrave diversa da quella nel resto della soluzione si verifica una polarizzazione di con-centrazione in quanto il sistema non si trova nelle condizioni di equilibrio cui fariferimento il modello di Nernst
La polarizzazione puograve derivare anche dal cambiamento dello stato chimico eofisico della superficie di elettrodo oppure dal verificarsi di reazioni chimiche colla-terali alla reazione di elettrodo
LEGGE DI NERNST E GRANDEZZE TERMODINAMICHE COLLEGATEAPPROFONDIMENTO
CELLE GALVANICHE O PILESe si collegano elettricamente fra loro due semicelle (elettrodi) si realizza un dispo-sitivo che puograve erogare corrente si tratta di una cella galvanica (o pila fig 22)
In una pila le due semicelle sono separate da un setto poroso o da un ponte salinoche hanno il solo compito di assicurare il contatto elettrico evitando il rapido me-scolamento delle soluzioni Secondo le caratteristiche dei singoli elettrodi ai duecapi della pila si crea una differenza di potenziale (ddp) detta anche tensione (opotenziale) di cella che quando raggiunge il suo valore massimo egrave detta forzaelettromotrice (abbreviata fem e indicata con il simbolo E) tutti questi terminiindicano che la pila puograve compiere un lavoro (elettrico)
Dal punto di vista fisico la fem di una pila corrisponde al lavoro massimo cheessa puograve fornire In altri termini la fem equivale al lavoro per unitagrave di carica ne-cessario per mantenere costante la ddp fra i due elettrodi
La fem coincide con la ddp solo nel caso in cui il sistema lavori in condizionidi reversibilitagrave termodinamica (ovvero a corrente nulla) In un circuito chiuso in-
Il termine polarizzazionesoprattutto nelleapplicazioni viene spessousato in modo fin troppogenerico per definiresituazioni poco chiare peresempio nellrsquoindustriagalvanica si parla spesso dipolarizzazione quando ilprocesso produttivo nonsegue lrsquoandamento previstoanche se le vere cause sonotutte da definire
2
La fem viene misurata acircuito aperto (ossia incondizioni di equilibrio acorrente nulla) e conterminali di platinomediante un potenziometroo un voltmetro elettronico
Se le soluzioni simescolassero ben prestosi verificherebberoreazioni chimiche direttelaquoindesiderateraquo (peresempio fra elettrodi esoluzione) con rapidoesaurimento del sistema(pila Daniell gtparagrafo24) e sviluppo di calore
11
CELLE GALVANICHE O PILE
vece dove la corrente circola (e non egrave nulla) la ddp in uscita dalla pila egrave sempreminore della fem a causa della laquocaduta di tensioneraquo provocata dal passaggio dicorrente Vale infatti con buona approssimazione la relazione
ddp= fem ndash Ri
dove bull R egrave la resistenza del circuito bull i lrsquointensitagrave di corrente
Per esempio se si collegauna comune pila da 45 Va una lampadina e simisura la ddp ai capi delcircuito si ottiene unvalore piugrave basso (peresempio 33 V)Il valore nominale ditensione sullrsquoinvolucrodella pila infatti indica lafem non la ddp inuscita (che dipende dallaquocaricoraquo effettivo delcircuito)
Figura 22Cella galvanica (pila) Il setto poroso divide (pur mantenen-doli in contatto elettrico fra loro) i due comparti del recipien-te che costituiscono le due semicelle Queste possono con-tenere due diversi elettroliti oppure lo stesso elettrolita maa diversa concentrazione in modo che allrsquoinizio i potenzialisiano diversi Nel primo caso le due lamine sono in generedi metalli differenti nel secondo caso sono uguali fra loroIl circuito esterno egrave formato da conduttori di prima specie ecomprende il dispositivo per la misura della tensione dellapila la corrente (i) e gli elettroni (e-) percorrono il circuito indirezioni opposte
Lrsquoelettrodo piugrave ricco di elettroni cioegrave a potenziale minore egrave detto anodo e costitu-isce il polo negativo della pila mentre lrsquoelettrodo piugrave povero di elettroni cioegrave a po-tenziale maggiore egrave detto catodo e costituisce il polo positivo Attraverso il circuitoesterno lrsquoanodo tende a cedere elettroni al catodo sotto la laquospintaraquo della spontaneatendenza del sistema a eguagliare i potenziali delle due semicelle
Il flusso di elettroni dallrsquoanodo al catodo altera quindi lo stato drsquoequilibrio ini-ziale di ciascuna semicella esso puograve venire ripristinato mediante reazioni di ossida-zione allrsquoanodo e contemporaneamente mediante reazioni di riduzione al catodoInfatti in base alla legge di Nernst (gtparagrafo 12) le reazioni di ossidazione tendo-no a innalzare il potenziale di elettrodo percheacute aumenta la concentrazione dellaforma ossidata (al numeratore dellrsquoargomento logaritmico) viceversa le reazioni diriduzione tendono ad abbassarlo La corrente che si stabilisce nel circuito egrave dovutaalla tendenza spontanea del sistema a raggiungere lrsquoequilibrio termodinamico per-ciograve quando i potenziali dei due elettrodi diventano uguali il flusso di elettronicessa e si dice che la pila egrave laquoscaricaraquo
La pila quindi egrave un dispositivo mediante il quale gli elettroni in gioco in unareazione redox passano attraverso un circuito da una specie chimica a unrsquoaltraOssidante e riducente infatti non vengono posti direttamente a contatto cosiccheacute glielettroni che si scambierebbero sono laquocostrettiraquo a passare attraverso il circuitoesterno Ciograve consente di convertire in energia elettrica e quindi in lavoro lrsquoenergiache si libera in un processo redox spontaneo che genererebbe calore il flusso di
12
2 Potenziometria
corrente si arresta quando egrave soddisfatta la costante di equilibrio della reazione chegenera la pila
Per ragioni storiche il funzionamento delle pile egrave stato spiegato in termini di unflusso di corrente elettrica dovuto a inesistenti cariche elettriche positive che migra-no dal polo a potenziale maggiore (catodo) verso il polo a potenziale minore (ano-do) Per questo motivo il verso convenzionale della corrente elettrica egrave opposto aquello in cui effettivamente circolano gli elettroni
21 Potenziali standard di ossidoriduzioneIn linea di principio per misurare la ddp fra una lamina di metallo e la soluzionein cui egrave immersa (si veda la figura 21a) occorre inserire il dispositivo di misura inmodo che un terminale sia collegato al metallo e lrsquoaltro alla soluzione In questomodo tuttavia si crea un nuovo contatto metallosoluzione e lo strumento finiscecol misurare la ddp fra i due metalli senza dare informazioni sul valore del poten-ziale di ciascuno di essi Quindi il potenziale assoluto di un singolo elettrodo o diuna coppia redox (che egrave la stessa cosa) non puograve essere misurato Si egrave costretti perciogravea effettuare una misura relativa dei potenziali ponendo a confronto due semicellela semicella di cui si vuole misurare il potenziale e una semicella di riferimento co-struita in modo da assumere un potenziale costante
In pratica lrsquoelettrodo di cui si vuole misurare il potenziale viene accoppiato a unelettrodo di riferimento e si misura la ddp di questa pila in condizioni precisamentedefinite
In base a criteri di opportunitagrave pratica e a considerazioni termodinamiche si egravescelto come elettrodo di riferimento il cosiddetto elettrodo standard a idrogeno(SHE Standard Hydrogen Electrode) A tale elettrodo (fig 23) viene assegnato perconvenzione un potenziale di semicella di 00000 V valido a tutte le temperatureper una soluzione che contiene ioni idrogeno ad attivitagrave unitaria e idrogeno gassosoa fugacitagrave unitaria (in pratica alla pressione parziale di 1 bar)
Nella prima fasedi sviluppodellrsquoelettrochimica siparlava anche di elettrodonormale a idrogeno(NHE Normal HydrogenElectrode) riferendosi a unelettrodo di platinoimmerso in una soluzione1 N di un acido forte inquesta soluzione perogravelrsquoattivitagrave del protone egravecirca 08 e quindi ilpotenziale realedellrsquoelettrodo egrave ben diversoda zero Per questo motivonon egrave corretto usare lasigla NHE per indicare ilriferimento standard[Fonte RW RametteJ Chem Ed vol 64 10(ott 1987)]
Figura 23Elettrodo a idrogeno secondo la realizzazione ideata da SPLSoslashrensen Nel gorgogliatore entra idrogeno gassoso purissi-mo che attraversa la soluzione acida e lambisce la lamina diplatino platinato prima di uscire dal secondo gorgogliatore Idue gorgogliatori e lrsquoampolla centrale contengono la stessasoluzione acida La lamina di platino egrave saldata a un filo di plati-no che fuoriesce dal tappo e assicura il collegamento elettricocon lo strumento di misura Il rubinetto e il sifone mettono incontatto la soluzione acida con lrsquoaltro elettrodo formando cosigraveuna pila Quando lrsquoattivitagrave di H+ e la fugacitagrave di H2 sono unitarielrsquoelettrodo egrave in condizioni standard
13
CELLE GALVANICHE O PILE
Le tabelle dei potenziali standard di ossidoriduzione riportano appunto i po-tenziali di coppie redox ad attivitagrave unitaria misurati rispetto allo SHE (a 25 degC) Sele reazioni sono scritte secondo le convenzioni IUPAC cioegrave nel senso della ridu-zione (elettroni a sinistra) egrave piugrave preciso parlare di potenziali standard di riduzione(tab 21) Nelle tabelle le coppie con potenziale positivo sono tendenzialmentepiugrave ossidanti della coppia H+H2 mentre le coppie con potenziale negativo sono piugraveriducenti
In generale per due coppie qualsiasi quella con potenziale standard maggiore egraveossidante (nelle condizioni imposte) nei confronti della coppia con potenziale stan-dard minore Per esempio se si immerge un foglio di alluminio in una soluzionecontenente solfato di rame e solfato di alluminio (ad attivitagrave unitaria) il foglio di
TABELLA 21 | Alcuni potenziali standard di riduzione (Edeg) misurati a 25 degC
Semireazione Edeg(V) Semireazione Edeg(V)
O H e O H O3 2 22 2+ + ++ minus 2076 Cu e Cu s2
2+ minus+ ( ) 0342
S O e SO2 82
422 2minus minus minus+ 2010 Hg Cl s e Hg Cl2 2 2 2 2( )+ +minus minus
0268
H O H e H O2 2 22 2 2+ ++ minus 1776 AgCl s e Ag Cl( )+ +minus minus
0222
MnO H e MnO s H O4 2 24 3 2minus + minus+ + + ( ) 1679 Cu e Cu2+ minus ++ 0153
Ce e Ce4 3+ minus ++ 172 Sn e Sn in HCl M4 22 1+ minus ++ ( ) 0151
MnO H e Mn H O42
28 5 4minus + minus ++ + + 1507 S H e H S g+ ++ minus2 2 2 ( ) 0142
PbO H e Pb H O22
24 2 2+ + ++ minus + 1455 S O e S O4 6
22 3
22 2minus minus minus+ 008
Cl e Cl2 2 2+ minus minus 1358 AgBr s e Ag Br( )+ +minus minus
0071
Cr O H e Cr H O2 72 3
214 6 2 7minus + minus ++ + + 1350 2H ++ 2e-H2 00000
O g H e H O2 24 4 2( )+ ++ minus 1229 Pb e Pb2
2+ minus+ ndash0126
2 12 10 63 2 2IO H e I H Ominus + minus+ + + 1195 Sn e Sn22
+ minus+ ndash0137
Br l e Br2 2 2( )+ minus minus 1066 Ni e Ni2
2+ minus+ ndash0257
NO H e HNO H O3 2 23 2minus + minus+ + + 0934 Co e Co22
+ minus+ ndash0282
2 22
2
2Hg e Hg+ minus ++ 0920 Fe e Fe22
+ minus+ ndash0447
Cu I e CuI2+ minus minus+ + 086 Zn e Zn22
+ minus+ ndash0762
Ag e Ag+ minus+ 0799 Mn e Mn22
+ minus+ ndash1185
Hg e Hg2
22 2
+ minus+ 0797 Al e Al33
+ minus+ ndash1662
Fe e Fe3 2+ minus ++ 0771 Mg e Mg22
+ minus+ ndash2372
O g H e H O2 2 22 2( )+ ++ minus 0695 Na e Na+ minus+ ndash2710
I e I3 2 3minus minus minus+ 0536 Ca e Ca22
+ minus+ ndash2868
I e I2 2 2+ minus minus 0535 K e K+ minus+ ndash2931
Cu e Cu+ minus+ 0521 Li e Li+ minus+ ndash3040
Fe CN e Fe CN( ) ( )63
64minus minus minus+ 0358
14
2 Potenziometria
alluminio si dissolve mentre si deposita rame metallico Infatti i potenziali stan-dard delle due coppie redox sono
Cu2+ + 2endash Cu Edeg= +034 V
Al3+ + 3endash Al Edeg= ndash166 V
Nella soluzione quindi lo ione Cu2+ (forma ossidata della coppia con potenzialemaggiore) tende a ossidare Al (forma ridotta della coppia con potenziale minore)
TABELLA DEI POTENZIALI STANDARD DI RIDUZIONEAPPROFONDIMENTO
22 Tensione pratica (ddp) di una pila
Lrsquoinsieme dei conduttori di prima e di seconda specie che in sequenza opportunaformano una pila (o in generale un sistema elettrochimico) costituisce una catenagalvanica La differenza di potenziale (Ecella) che si misura ai capi di una pila durantelrsquoerogazione di corrente egrave dovuta a diversi contributi piugrave precisamente egrave uguale allasomma algebrica di tutte le cadute di tensione che si verificano lungo lrsquointero circuito
Ecella= E1 + E2 + E3 + E4 + E5 (25)
dove bull E1 egrave la ddp dovuta allrsquoeventuale passaggio di corrente nel circuito (cadutaohmica) bull E2 la ddp di contatto metallometallo (tensione di Volta) bull E3 la ddpdi contatto soluzionesoluzione (tensione o potenziale di giunzione liquida) bull E4 edE5 le ddp di contatto metallosoluzione (tensione di Nernst) per ciascun elettrodo
Esaminiamo ora il significato dei singoli contributi
Caduta ohmica Quando la cella egrave attraversata da corrente inevitabilmente si ve-rifica una caduta di tensione E = R times i (prima legge di Ohm) Ovviamente se lamisura del potenziale di cella viene effettuata in condizioni tali da minimizzareo eliminare il passaggio di corrente (cioegrave a circuito aperto) la caduta ohmica siannulla (cioegrave E1= 0)
Tensione di Volta Quando due diversi metalli vengono posti a contatto si generasempre una ddp Questo fenomeno detto effetto Volta egrave dovuto al fatto che glielettroni di conduzione sono trattenuti con diversa energia dai diversi metalli Per-ciograve il contatto fra due metalli provoca un trasferimento di elettroni istantaneo daparte del metallo che li trattiene con minore energia Il processo perograve non prose-gue indefinitamente il trasferimento di elettroni infatti prosegue fino allrsquoequili-brio quando insorge una ddp (in genere di pochi millivolt) sufficiente a bloccarlo
Si puograve verificare sperimentalmente (e dimostrare) che la ddp agli estremi diuna catena di conduttori di prima specie egrave uguale a quella che si stabilisce se i duemetalli che ne costituiscono gli estremi vengono posti a diretto contatto (fig 24)Di conseguenza se gli ingressi del misuratore di tensione sono costituiti dallo stessometallo lrsquoeffetto Volta complessivo egrave nullo (E2= 0)
In altri termini la formaossidata della coppia conpotenziale piugrave alto egraveossidante nei confrontidella forma ridotta dellacoppia con potenzialepiugrave basso
A rigore si dovrebbe usareil simbolo V (o ∆V)percheacute si tratta di unaddp misurata in una pilain funzione e dunquenon di una fem Il pedicelaquocellaraquo puntualizza che sitratta in generale di unacella elettrochimica
R egrave la resistenza delconduttore e i lrsquointensitagravedi corrente
15
CELLE GALVANICHE O PILE
Potenziale di giunzione liquida In una pila le due semicelle sono separate matenute in contatto elettrico mediante un setto poroso o un ponte salino che con-sente un mescolamento lentissimo (praticamente nullo) delle soluzioni Questidispositivi (si veda la figura 25) perograve creano unrsquoulteriore caduta di tensione fragli elettrodi detta potenziale di giunzione liquida (Eg) o anche potenziale dicontatto (o di diffusione) Il potenziale di giunzione liquida puograve essere sia po-sitivo sia negativo e quindi fa aumentare o viceversa diminuire la ddp fra glielettrodi
Lrsquoinsorgere di un potenziale di giunzione egrave causato dal fatto che gli ioni si dif-fondono con diversa mobilitagrave attraverso le superfici di contatto di due mezzi di-versi un setto poroso per esempio egrave diversamente permeabile agli ioni propriosecondo la loro mobilitagrave
Tensione di Nernst I potenziali di contatto metallosoluzione (E4 E5) si calco-lano in teoria mediante la legge di Nernst e perciograve sono detti potenziali nern-stiani
LA MOBILITAgrave DEGLI IONI IN SOLUZIONEAPPROFONDIMENTO
23 Calcolo della tensione teorica (fem) di una pilaSe si opera in modo da rendere trascurabili i primi tre termini dellrsquoequazione (22)la ddp ai capi della pila coincide in pratica con la sua fem che puograve essere cal-colata semplicemente in base agli ultimi due termini cioegrave ai potenziali di elettrodoNei calcoli occorre tenere presente che
a la fem di una pila in quanto strettamente collegata al lavoro da essa compiutodeve necessariamente avere segno positivo
b lrsquoelettrodo a potenziale maggiore su cui avviene la riduzione egrave il catodo lrsquoelet-trodo a potenziale minore su cui avviene lrsquoossidazione egrave lrsquoanodo
Di conseguenza la fem di una pila cioegrave di una cella elettrochimica ottenuta colle-gando due semicelle (catodica e anodica) egrave espressa dalla seguente relazione
Ecella = Ec ndash Ea (26)
ovvero
Ecella = Emaggiore ndash Eminore (27)
Questa seconda scrittura mostra chiaramente che la fem della pila egrave sempre posi-tiva anche nel caso in cui i potenziali delle due semicelle siano entrambi negativi
Indichiamo con Ec ilpotenziale del catodo (opotenziale catodico) econ Ea il potenzialedellrsquoanodo (o potenzialeanodico)
Figura 24Nonostante ogni superficie di contatto fra due metallisia sede di una ddp dovuta allrsquoeffetto Volta la ddpche si instaura fra rame e zinco egrave la stessa sia nel caso(a) sia nel caso (b) Infatti se cosigrave non fosse chiudendola catena aperta (a) si dovrebbe osservare un passaggiodi corrente e questo in realtagrave non avviene
a b
16
2 Potenziometria
ESEMPIO 1UNA IPOTETICA PILA Egrave COSTITUITA DALLE COPPIE REDOX Al3+Al E Ni2+NiQUAL Egrave LA FEM DELLA PILA SE LE ATTIVITAgrave DI TUTTE LE SPECIE IONICHE SONOUNITARIE
Dal momento che le attivitagrave sono unitarie il calcolo fornisce la tensione (o forzaelettromotrice) standard della pila
Innanzitutto dalla tabella dei potenziali standard si ricavano i potenziali stan-dard per ciascuna coppia redox
Al3+ + 3endash Al Eo
= ndash166 V
Ni2+ + 2endash Ni Eo
= ndash026 V
Lrsquoelettrodo della coppia Ni2+Ni costituisce il catodo percheacute ha il potenziale mag-giore mentre lrsquoelettrodo della coppia Al3+Al costituisce lrsquoanodo percheacute ha il poten-ziale minore Si puograve anche costruire un diagramma di questo tipo
Al3+Al Ni2+Ni H+H2
ndash166 ndash026 00000 Edeg(V rif a SHE)
Quindi la fem della pila in condizioni standard egrave
Ecella= Ec ndash Ea= Emaggiore ndash Eminore= ndash026 ndash (ndash166)= +140 V
La reazione di ossidoriduzione che genera la pila si ottiene formalmente combi-nando le due semireazioni bilanciate quella di riduzione al catodo e quella di os-sidazione allrsquoanodo Ciascuna semireazione deve essere moltiplicata per un fattorenumerico tale che il numero di elettroni ceduti dalla specie che si ossida sia uguale aquello degli elettroni acquistati dalla specie che si riduce Quindi nel caso dellrsquoesem-pio proposto si moltiplica la semireazione della coppia Al3+Al per 2 e quella dellacoppia Ni2+Ni per 3
2 middot (Al Al3+ + 3endash) Edeg= ndash(ndash166 V) (ndash)
3 middot (Ni2+ + 2endash Ni) Edeg= ndash026 V (+)
2Al + 3Ni2+ 2Al3+ + 3Ni Edeg= +140 V
Attenzione per ottenere il bilancio della reazione di cella si moltiplica per un coeffi-ciente opportuno ciascuna semireazione ma non il rispettivo potenziale Infatti i po-tenziali di elettrodo (e quindi anche il potenziale di cella) esprimono un lavoro elettricoper unitagrave di carica e perciograve sono proprietagrave intensive che non dipendono dalla quantitagravedi materia contenuta nel sistema ovvero dal numero di cariche elettriche trasportate
Se le attivitagrave non sono unitarie per calcolare il potenziale di elettrodo occorreapplicare lrsquoequazione di Nernst
Egrave ovvio comunque che il lavoro complessivo che puograve essere fornito da una piladipende anche dalla massa e dalla geometria degli elettrodi Per questo motivo unapila o un insieme di pile (cioegrave una batteria) che viene utilizzata per esempio permuovere un veicolo puograve avere dimensioni ingombranti Questo accadeva fino anon molti anni fa per le vecchie batterie al piombo ora sempre piugrave sostituite dabatterie come quelle al litio decisamente piugrave compatte e che infatti stanno rendendopossibile il progressivo passaggio allrsquoauto parzialmente o completamente elettrica
UNA IPOTETICA PILA Egrave COSTITUITA DALLE COPPIE REDOX Al3+Al E Ni2+NiQUAL Egrave LA FEM DELLA PILA SE LE ATTIVITAgrave DI TUTTE LE SPECIE IONICHE SONOUNITARIE
Nella pila la reazionedella coppiadella coppia Ni2+Ni(Ni2+ si riduce) avvienenel senso conforme allaconvenzione adottata per ipotenziali (elettroni asinistra) invece lareazione della coppiaAl3+Al (Al si ossida)avviene nel senso oppostoa quello convenzionalePerciograve il potenziale Edegdella coppia Al3+Al vieneconsiderato con segnoopposto a quello tabulato(+166 V) Se si sommaalgebricamente ilpotenziale dellrsquoelettrodoche si riduce (Ec) conquello dellrsquoelettrodo che siossida cambiato di segno(Ea) la tensione della pilarisulta positiva
17
CELLE GALVANICHE O PILE
ESEMPIO 2UNA IPOTETICA PILA Egrave COSTITUITA DALLE COPPIE REDOX Al3+Al E Ni2+NiQUAL Egrave LA FEM DELLA PILA A 25 degC SE LE CONCENTRAZIONI DELLE SPECIEIONICHE SONO RISPETTIVAMENTE [Al3+] = 2 10ndash2 M E [Ni2+] = 10ndash2 M
Approssimando le attivitagrave con le concentrazioni si ottiene
La situazione non egrave sostanzialmente cambiata rispetto alle condizioni standardpercheacute anche in questo caso la reazione di cella comporta lrsquoossidazione dellrsquoallumi-nio e la riduzione del nichel La fem della pila quindi egrave
Ecella= Ec ndash Ea= ndash032 ndash (ndash167)= +135 V
24 Alcuni tipi di pile
Pila DaniellUna semicella egrave costituita da una lamina di rame immersa in una soluzione diCuSO4 lrsquoaltra semicella da una lamina di zinco immersa in una soluzione di ZnSO4
(fig 25) Le due semicelle sono separate da un setto poroso (in pratica una mem-brana di vetro sinterizzato o analogo materiale inerte) oppure si trovano in duediversi recipienti collegati da un ponte salino
Le reazioni di elettrodo sono
Zn2+ + 2endash Zn Edeg= ndash0762 V
Cu2+ + 2endash Cu Edeg= 0342 V
Le concentrazioni dei sali nelle rispettive semicelle sono in genere tali da renderenegativo il semielemento di zinco che perciograve tende a cedere elettroni al rame (ossi-dandosi) La lamina di zinco egrave dunque il polo negativo (anodo) della pila e il rameegrave il polo positivo (catodo)
La rappresentazione della catena galvanica di questa pila secondo le convenzioniIUPAC egrave
(ndash) Zn(s)|ZnSO4(aq)||CuSO4(aq)|Cu(s) (+)
UNA IPOTETICA PILA Egrave COSTITUITA DALLE COPPIE REDOX Al3+Al E Ni2+NiQUAL Egrave LA FEM DELLA PILA A 25 degC SE LE CONCENTRAZIONI DELLE SPECIEIONICHE SONO RISPETTIVAMENTE [Al3+] = 2 10ndash2 M E [Ni2+] = 10ndash2 M
Si noti che se i duescomparti non fosseroscomparti non fosseroben separati dal settoben separati dal settoporoso ben presto gli ioniporoso ben presto gli ionirame disponibilirame disponibiliraggiungerebbero lrsquoraggiungerebbero lrsquoanododi zinco ossidandolo eandando a depositarsi sudi esso come Cumetallico nondiversamente da quanto sipuograve osservareimmergendo una barrettadi zinco in una soluzionedi solfato di rameesaurendo quindirapidamente la pila esviluppando calore
Figura 25Pila Daniell (a) con settoporoso e (b) con pontesalino
a b
18
2 Potenziometria
La coppia di barrette verticali (||) al centro rappresenta il setto poroso o il pontesalino che separano le due semicelle lrsquoanodo egrave scritto a sinistra e per ciascun elet-trodo la forma ridotta della coppia redox egrave scritta verso lrsquoesterno Le lettere scrittefra parentesi indicano lo stato fisico di ogni specie chimica
La reazione di cella egrave
Zn + Cu2+ Zn2+ + Cu
Per calcolare la fem teorica di questa pila che puograve anche trovarsi in condizionidiverse da quelle standard si applica la legge di Nernst a ciascuna semicella
(28)
(29)
I potenziali standard delle due semicelle sono cosigrave diversi fra loro che nelle normalicondizioni operative di una pila Daniell il rame rappresenta il polo positivo e lozinco il polo negativo
Sottraendo il potenziale minore da quello maggiore si ottiene il potenziale dicella
Ecella = ECu2+Cu - EZn2+Zn
Ponendo Edegcella = EdegCu2+Cu ndash EdegZn2+Zn (= 0342 V + 0762 V) e quindi sottraendo la(28 dalla 29) si ricava infine
Questa equazione consente dunque di calcolare il potenziale di Nernst se egrave notoil valore effettivo dellrsquoattivitagrave degli ioni Zn2+ e Cu2+ Tuttavia il calcolo si presta aerrori anche significativi lrsquoattivitagrave degli ioni per esempio varia in funzione dellaforza ionica della soluzione e non puograve essere calcolata Perciograve la fem reale piugraveesattamente la ddp che si misura si discosta dal valore calcolato sostanzialmenteper due motivi
a il sistema non si comporta in maniera ideale (per esempio gli elettrodi possonopolarizzarsi)
b il contributo della caduta ohmica (gtequazione 25) puograve essere praticamente an-nullato se nel circuito viene fatta circolare una corrente trascurabile invece ilpotenziale di giunzione liquida per quanto piccolo non puograve essere soppresso enon egrave prevedibile in base a equazioni teoriche
Pile a concentrazioneIn questo tipo di pila le due semicelle contengono due soluzioni di una stessa cop-pia redox ma a diversa concentrazione gli elettrodi sono inerti oppure dello stes-so metallo e le semicelle sono collegate da un setto poroso o da un ponte salino(fig 26)
In questo calcolotrascuriamo i contributidei termini E1 E2 E3 dellaequazione (25)
Lrsquoequazione rappresentain pratica la legge diNernst applicata allareazione redox globalescritta nel verso dellaspontaneitagrave tenendoconto degli elettroniscambiati (2) e inserendonellrsquoargomento dellogaritmo lrsquoinverso delquoziente di reazione
+
19
CELLE GALVANICHE O PILE
Le due soluzioni si scambiano elettroni attraverso il circuito esterno mentre ilsetto poroso (o il ponte salino) che le collega consente il passaggio di ioni e quin-di chiude il circuito Il sistema raggiunge lrsquoequilibrio quando le attivitagrave degli ioninelle due semicelle diventano uguali perciograve egrave prevedibile che nella soluzione piugravediluita avvenga lrsquoossidazione il rame metallico si dissolve e si formano ioni Cu2+ insoluzione questo dunque egrave lrsquoanodo Contemporaneamente gli elettroni passanonellrsquoaltro comparto (a destra in figura 26) attraverso il circuito esterno e riduconogli ioni Cu2+ che si depositano sullrsquoelettrodo come rame metallico questo dunqueegrave il catodo
In pratica egrave come se gli ioni Cu2+ si trasferissero dalla soluzione piugrave concentrataalla soluzione piugrave diluita Queste pile dunque trasformano in lavoro elettrico lrsquoe-nergia che si libera nel processo spontaneo con cui due soluzioni a diretto contattotendono a raggiungere lrsquoequilibrio di concentrazione
La rappresentazione convenzionale della catena elettrodica di questa pila a con-centrazione egrave la seguente
(-) Cu(s) |Cu2+(001 M)||Cu2+(1 M)|Cu(s) (+)
Per calcolare la tensione teorica della pila si applica la legge di Nernst a ciascun elet-trodo Approssimando le attivitagrave con le concentrazioni (a 25 degC) si ottiene
(soluzione piugrave diluita anodo)
(soluzione piugrave concentrata catodo)
Quindi
Ecella= Emaggiore ndash Eminore= 0342- 0283= 0059 V
ALTRI TIPI DI CELLE GALVANICHE O PILEAPPROFONDIMENTO
Figura 26Pila a concentrazione il compartoanodico (a sinistra) contiene ioni Cu2+
in concentrazione 001 M e il com-parto catodico (a destra) contieneioni Cu2+ in concentrazione 1 M Ilcollegamento fra le due semicelle egraverealizzato con un ponte salino
20
2 Potenziometria
STRUMENTAZIONEIn potenziometria si misura la differenza di potenziale che si stabilisce fra due semi-celle allo scopo di determinare la concentrazione di uno ione o per seguire lrsquoanda-mento di una titolazione
Il dispositivo completo per una misura potenziometrica (fig 27) consiste es-senzialmente di
bull un potenziometro o meglio un millivoltmetro elettronicobull un elettrodo di riferimentobull un elettrodo di misura
Il potenziometro serve per misurare la ddp fra i due elettrodi senza alterare il lorostato di equilibrio perciograve si lavora a corrente praticamente nulla
Gli elettrodi collegati al potenziometro sono immersi nella soluzione su cui sieffettuano le misure Lrsquoelettrodo di riferimento egrave costruito in modo tale da mante-nere costante il suo potenziale di conseguenza ogni variazione di ddp misurata egraveimputabile esclusivamente allrsquoelettrodo di misura (piugrave precisamente alla soluzioneanalizzata)
ELETTRODI DI RIFERIMENTOLrsquoelettrodo standard a idrogeno (SHE gtparagrafo 21) egrave lrsquoelettrodo di riferimentoprimario Tuttavia nella pratica quotidiana di laboratorio si usano elettrodi di ri-ferimento secondari piugrave semplici e maneggevoli che hanno comunque la proprie-tagrave di mantenere il proprio potenziale costante a temperatura costante Tratteremoora in maggior dettaglio gli elettrodi di uso piugrave comune
31 Elettrodo ad argentocloruro drsquoargento
Si tratta senzrsquoaltro dellrsquoelettrodo piugrave diffuso Il dispositivo egrave costituito da un sem-plice filo drsquoargento rivestito di AgCl e immerso in una soluzione di KCl (egrave dunqueun elettrodo di seconda specie) Il tutto egrave contenuto in un tubicino di vetro dotatodi setto poroso per assicurare il contatto elettrico con lrsquoesterno ovvero con la so-luzione in cui viene immerso lrsquooggetto dellrsquoanalisi
Figura 27Rappresentazione schematica deldispositivo completo per misurepotenziometriche
3
21
ELETTRODI DI RIFERIMENTO
La rappresentazione convenzionale dellrsquoelettrodo (fig 28) egrave
Ag(s)|AgCl(aq)|KCl(aq)
La reazione di elettrodo egrave
AgCl + endash Ag + Clndash
E il potenziale di elettrodo
E= EdegAgClAg
Considerando unitarie le attivitagrave dei solidi puri si ottiene
E= EdegAgClAg ndash 01984 10ndash3 T log[Clndash] (210)
Se lrsquoattivitagrave degli ioni cloruro egrave costante (a temperatura costante) il potenziale dielettrodo rimane costante Gli elettrodi piugrave comuni contengono soluzioni sature diKCl (circa 42 M) e perciograve sono detti saturi (SSC Saturated Silver-Silver ChlorideElectrode) A 25 degC il potenziale di SSC vale 0197 V Questo elettrodo puograve essereusato fino a 105 degC Nella tabella 1 ndash lab 1 (gtpag 39) sono riportati i potenziali alvariare della temperatura per lrsquoelettrodo saturo e 3 M
Gli anioni (come il solfuro) che formano con Ag+ sali meno solubili di AgClpossono danneggiare questo tipo di elettrodo Anche gli ossidanti e i riducenti fortie gli agenti complessanti possono interferire con la reazione di elettrodo per proteg-gere lrsquoelettrodo da queste sostanze si usa un elettrolita intermedio come nel casodellrsquoelettrodo a calomelano saturo (SCE gtparagrafo 32)
Gli elettrodi ad argentocloruro di argento sono usati come riferimento internonegli elettrodi a vetro (gtparagrafo 41)
32 Elettrodo a calomelano
laquoCalomelanoraquo egrave il nome comune del cloruro mercuroso (I) Hg2Cl2 che fa parteappunto di questo elettrodo (fig 29a) La rappresentazione convenzionale dellrsquoe-lettrodo egrave
Hg(l)|Hg2Cl2(s)|KCl(aq)
La reazione di elettrodo egrave
Hg2Cl2 + 2endash 2Hg + 2Clndash
e il potenziale di elettrodo in base alla legge di Nernst
In condizioni standard lrsquoattivitagrave di solidi e liquidi puri egrave considerata uguale a 1quindi
da cui
ndash 01984 10ndash3 T log|Clndash| (211)
Sono anche molto diffusigli elettrodi contenentiKCl 3 M cioegrave quasisaturi Il vantaggio egrave chein queste soluzioni non siformano cristalli di KClche possono danneggiarelrsquoelettrodo ostruendoil setto poroso che sta sulfondo
Figura 28Elettrodo ad AgAgCILa soluzione tamponeinterna contiene ioni K+
e CIndash ad attivitagrave costante
22
2 Potenziometria
Il potenziale dellrsquoelettrodo a calomelano dunque dipende solo dallrsquoattivitagrave delloione cloruro e dalla temperatura Se la temperatura egrave costante e lrsquoattivitagrave dello ionecloruro nella soluzione interna allrsquoelettrodo non varia il potenziale rimane costante
Gli elettrodi a calomelano piugrave comuni contengono soluzioni sature di KCl (circa42 M) e perciograve sono detti saturi (SCE Saturated Calomel Electrode) Si usano ancheelettrodi a KCl 1 M e 01 M la tabella 22 riporta il potenziale assunto da questielettrodi secondo la concentrazione di KCl
TABELLA 22 | Potenziale (mV) di alcuni elettrodi di riferimento a 25 degC
AgAgCl Calomelano HgHgO HgHgSO4 Thalamid
KCl 01 M 288 KCl 01 M 334 NaOH 01 M 165 H2SO4 05 M 682 KCl 3 M -567
KCl 1 M 235 KCl 1 M 280 NaOH 1 M 140 K2SO4 sat 650 KCl sat -577
KCl 3 M 210 KCl 35 M 250
KCl 35 M 205 KCl sat 241
KCl sat 199 NaCl sat 236
NaCl 3 M 209
NaCl sat 197
Lrsquoelettrodo a calomelano puograve essere usato fino a circa 70 degC a temperature piugrave alteil calomelano si dismuta (Hg2Cl2 Hg + HgCl2)
I solfuri gli ossidanti i forti riducenti e gli agenti complessanti che formanoamalgami con gli ioni Hg2
2+ possono danneggiare questo tipo di elettrodo Perciogravequando si lavora in presenza di queste sostanze si usano elettrodi a doppia giun-zione (fig 29b) in cui fra lrsquoelettrodo e la soluzione egrave interposto un contenitoreriempito con un elettrolita intermedio (per esempio KNO3)
Va infine segnalata la tendenza a non usare il mercurio per motivi tossicologicie questo spiega il progressivo abbandono nella pratica comune di questo tipo dielettrodo con grande rammarico dagli elettrochimici percheacute lrsquoelettrodo a calomela-no egrave il piugrave stabile
bullELETTRODI DI PRIMA E DI SECONDA SPECIE bullALTRI ELETTRODI DI RIFERIMENTO
APPROFONDIMENTI
Figura 29(a) Elettrodo a calomelano (b) Nella versione adoppia giunzione egrave presente una seconda cameraper lrsquoelettrolita intermedio che viene immessoattraverso la bocchetta laterale il setto porosoassicura il contatto elettrico con la soluzioneesterna
a b

7
ELETTRODI E POTENZIALE DI ELETTRODO
potenziale (abbreviata ddp) fra la lamina di metallo e la soluzione questa ddp egravedetta potenziale di semicella (o potenziale di elettrodo) Nel nostro esempio lalamina di rame assume carica negativa e quindi ha potenziale negativo mentre lasoluzione assume potenziale positivo
Il potenziale di semicella puograve essere espresso indifferentemente come la diffe-renza di potenziale fra il metallo e la soluzione oppure fra la soluzione e il metallosi tratta di una pura convenzione In questo libro seguiremo la convenzione euro-pea adottata a livello internazionale dalla IUPAC (International Union of Pure andApplied Chemistry) nel 1953 in base alla quale
a se si indica con ye il potenziale del metallo (fase solida) e con ys quello dellasoluzione (fase liquida) la ddp egrave uguale a ye ndash ys Quindi nel nostro esempio ilpotenziale di elettrodo egrave negativo
b le reazioni redox associate a una semicella devono essere scritte nel senso dellariduzione
Quindi per lrsquoelettrodo di rame la reazione di semicella egrave scritta nella forma seguente
Cu2+ + 2endash Cu
Il significato chimico-fisico del potenziale (Ve) assunto dallrsquoelettrodo di rame in se-guito al passaggio spontaneo di ioni Cu2+ in soluzione (per effetto di una ossidazione)egrave il seguente esso rappresenta il lavoro (Le) per unitagrave di carica (q) che bisogna com-piere per realizzare il processo non spontaneo opposto cioegrave il deposito di rame sullalamina (per effetto di una riduzione) Poicheacute i fenomeni in gioco sono sia di naturachimica sia elettrica si parla piugrave correttamente di potenziale elettrochimico dellrsquoe-lettrodo
I potenziali elettrochimici dipendono da un insieme di condizioni standard di tem-peratura pressione e concentrazione fissate inizialmente da coloro che per primi se nesono occupati per esempio 298K per la temperatura e 1 bar per la pressione
Lo stato standard egrave
bull per i solidi il solido purobull per i solventi il solvente purobull per i soluti una soluzione 1 Mbull per i gas il gas puro alla pressione di 1 bar
Il tutto assumendo un comportamento ideale per ogni sistema
In linguaggio matematico
VL
qe
e=
Ovviamente queste considerazioni sono valide anche per il caso in cui la reazionedi riduzione egrave il processo che avviene spontaneamente Ciograve si verifica per esempioquando la soluzione ha una concentrazione di ioni Cu2+ cosigrave elevata che lrsquoeffetto nettodegli scambi metallosoluzione consiste nel trasferimento di ioni sul metallo che per-ciograve acquista una carica positiva e quindi un potenziale positivo rispetto alla soluzioneEsiste anche unrsquounica concentrazione di ioni Cu2+ per la quale non si verifica scam-
Il termine elettrodo chein potenziometria siriferisce allrsquointero sistemametallosoluzione spessoviene riferito alla sola fasesolida (la laminametallica) seguendo cosigravela consuetudine in usonelle tecnicheelettrolitiche
Il lavoro necessario perdepositare uno ione sullalamina riducendolo egrave ditipo sia elettrico (neiconfronti delle forze delcampo elettrostaticogenerato dallrsquoelettrodo)sia elettrico di superficie(per superare il doppiostrato di cariche) siachimico (percheacute nelprocesso di riduzione delloione sul metallointervengono forze dinatura chimica)
8
2 Potenziometria
bio apparente di materia fra il metallo e la soluzione a questa concentrazione le duereazioni opposte (riduzione e ossidazione) procedono alla stessa velocitagrave e il sistemasi trova in uno stato di equilibrio termodinamico fin dallrsquoistante in cui il metalloviene immerso in soluzione
LA FISICA DEI SISTEMI ELETTROCHIMICIAPPROFONDIMENTO
11 Classificazione degli elettrodiUn metallo immerso in una soluzione dei suoi ioni costituisce un elettrodo di pri-ma specie il cui potenziale dipende dalla concentrazione (piugrave precisamente dallrsquoat-tivitagrave) degli ioni in soluzione
Quando invece il metallo si trova in equilibrio con la soluzione di un suo salepoco solubile si ha un elettrodo di seconda specie un filo drsquoargento immerso inuna soluzione satura di AgCl tutto ricoperto dal sale egrave un tipico elettrodo di secon-da specie La reazione di elettrodo egrave
AgCl + endash Ag + Clndash
Un elettrodo di terza specie egrave costituito da un metallo inerte immerso in una solu-zione contenente una coppia redox Un tipico esempio egrave costituito da un filo di pla-tino (un metallo nobile e quindi inerte nelle normali condizioni di lavoro) immersoin una soluzione di ioni Fe2+ e Fe3+ Il metallo si pone in equilibrio con la soluzionedi cui assume il potenziale Infatti la superficie di platino diventa sede dello scam-bio di elettroni fra le due specie ioniche che danno luogo alla reazione
Fe3+ + endash Fe2+
Infine gli elettrodi di quarta specie (che possono essere considerati come una va-riante dei precedenti) sono i cosiddetti elettrodi a gas in cui il metallo inerte e poro-so viene saturato da un gas (per esempio idrogeno) e posto a contatto con una solu-zione contenente la forma ionica del gas (nellrsquoesempio H+) Nel caso dellrsquoidrogeno
2H+ + 2endash H2
12 Calcolo dei potenziali di elettrodo legge di Nernst
Il potenziale di elettrodo egrave tanto maggiore in valore assoluto quanto maggiore egravela differenza di carica nel doppio strato (per esempio quella che si instaura allrsquoe-quilibrio fra i due lati dellrsquointerfaccia metallosoluzione) e dipende sia dalla naturachimica della coppia redox sia dalla concentrazione attiva ovvero dallrsquoattivitagrave degliioni in soluzione
Consideriamo lrsquoequilibrio per una generica semireazione di elettrodo
aox + bB + nendash cred + dD
Allrsquoequilibrio il potenziale di elettrodo che in realtagrave egrave una differenza di potenzialefra il metallo e la soluzione egrave espresso dalla legge di Nernst
+ (21)
Questa legge che prende ilnome dal chimico tedescoWalther H Nernst puograveessere ricavata in base aconsiderazionitermodinamiche edelettrochimiche su cui nonci soffermeremo Si notiin particolare chelrsquoargomento dellogaritmo egrave lrsquoinverso delquoziente di reazione
9
ELETTRODI E POTENZIALE DI ELETTRODO
dove bull E egrave il potenziale di elettrodo (in volt V) bull R la costante dei gas (che vale831451 Jmol times K) bull T la temperatura assoluta (in kelvin K) bull F la costante diFaraday (che vale 96 485 coulombmol) bull n il numero di elettroni scambiati nellasemireazione bull frac12 frac12 indica lrsquoattivitagrave di ciascuna specie scritta fra le due barrette
Edeg egrave il potenziale standard della coppia redox cioegrave il potenziale che la semicellaassume alla temperatura di 25 degC (29815 K) quando tutte le specie hanno attivitagraveunitaria e i gas si trovano alla pressione parziale di 1 bar (100 kPa) o piugrave precisa-mente hanno fugacitagrave unitaria
Lrsquoattivitagrave di ogni specie egrave uguale al prodotto g ∙ C dove g egrave il coefficiente di atti-vitagrave e C la concentrazione analitica espressa in moli su litro (molL)
Se si tiene conto dei coefficienti di attivitagrave e si inseriscono le parentesi quadre [ ]che indicano le concentrazioni in molL (gtpag 33) si ottiene
E ERT
nF
a b
c d= +deg ln
[ox] [B]
[red] [D]acute (22)
dove al posto di Eo compare il cosiddetto potenziale formale (Eoacute) della coppia redoxin oggetto
Il potenziale formale puograve differire in modo significativo dal potenziale standarde si rivela piugrave utile di esso per una valutazione anche solo orientativa del compor-tamento della coppia redox in quanto tiene meglio conto delle reali condizioni incui si opera per esempio il pH della soluzione Ricordiamo infatti che il pH allrsquointer-no di una cellula vale circa 7 (a parte pochissime eccezioni) per cui il potenziale re-dox standard che fa riferimento a pH 0 non risulta molto adatto a descriverne de-terminate caratteristiche Inoltre il potenziale standard delle coppie O2H2O vale123 V ma scende a 081 V a pH 7 Analogamente il potenziale della coppia deidro-ascorbicoascorbico passa da +390 V a +0058 V diventando nettamente riducentecome si addice alle ben note proprietagrave antiossidanti della vitamina C
Quando si lavora con soluzioni molto diluite (al di sotto di 10ndash3 M) si puograveassumere con buona approssimazione che il coefficiente di attivitagrave di tutte lespecie sia uguale a 1 In tali condizioni se si inserisce il valore numerico di RF e ilfattore numerico per la conversione ai logaritmi decimali si ottiene
(23)
Alla temperatura di 25 degC (29815 K) la legge di Nernst assume la sua forma piugravenota e usata
+ (24)
Per esempio per la semireazione
Cu2+ + 2endash Cu
la legge di Nernst (a 25 degC) assume la forma
+
La costante di Faradayequivale alla caricaelettrica di un numerodi Avogadro (cioegrave diuna mole) di elettroniUna mole contiene602214076 times 1023
entitagrave elementari(gtpag 457)
La fugacitagrave egrave la grandezzafisica adottata per i gas alposto della pressione alloscopo di tener conto delloro comportamento nonideale
ln = 23026 log
10
2 Potenziometria
In questa equazione non compare la concentrazione della forma ridotta percheacutelrsquoattivitagrave di una specie chimica pura nelle condizioni standard viene convenzio-nalmente assunta uguale a 1
In effetti spesso si lavora con soluzioni non particolarmente diluite quindi neicalcoli bisogna fare riferimento alle attivitagrave invece che alle concentrazioni di con-seguenza lrsquoequazione (24) diventa
+ log
IL POTENZIALE FORMALEAPPROFONDIMENTO
13 Polarizzazione degli elettrodiIn tutti i casi in cui il sistema dellrsquoelettrodo si discosti dalle condizioni di equilibriotermodinamico la legge di Nernst diventa inadeguata a descrivere il sistema stessoCiograve accade per esempio quando allrsquoelettrodo viene imposto un potenziale arbitra-rio eo la corrente che lo attraversa egrave molto intensa in questi casi il potenziale dielettrodo risulta diverso da quello previsto in base alla legge di Nernst e si dice chelrsquoelettrodo egrave polarizzato
In particolare quando la concentrazione degli ioni alla superficie di un elettrodoegrave diversa da quella nel resto della soluzione si verifica una polarizzazione di con-centrazione in quanto il sistema non si trova nelle condizioni di equilibrio cui fariferimento il modello di Nernst
La polarizzazione puograve derivare anche dal cambiamento dello stato chimico eofisico della superficie di elettrodo oppure dal verificarsi di reazioni chimiche colla-terali alla reazione di elettrodo
LEGGE DI NERNST E GRANDEZZE TERMODINAMICHE COLLEGATEAPPROFONDIMENTO
CELLE GALVANICHE O PILESe si collegano elettricamente fra loro due semicelle (elettrodi) si realizza un dispo-sitivo che puograve erogare corrente si tratta di una cella galvanica (o pila fig 22)
In una pila le due semicelle sono separate da un setto poroso o da un ponte salinoche hanno il solo compito di assicurare il contatto elettrico evitando il rapido me-scolamento delle soluzioni Secondo le caratteristiche dei singoli elettrodi ai duecapi della pila si crea una differenza di potenziale (ddp) detta anche tensione (opotenziale) di cella che quando raggiunge il suo valore massimo egrave detta forzaelettromotrice (abbreviata fem e indicata con il simbolo E) tutti questi terminiindicano che la pila puograve compiere un lavoro (elettrico)
Dal punto di vista fisico la fem di una pila corrisponde al lavoro massimo cheessa puograve fornire In altri termini la fem equivale al lavoro per unitagrave di carica ne-cessario per mantenere costante la ddp fra i due elettrodi
La fem coincide con la ddp solo nel caso in cui il sistema lavori in condizionidi reversibilitagrave termodinamica (ovvero a corrente nulla) In un circuito chiuso in-
Il termine polarizzazionesoprattutto nelleapplicazioni viene spessousato in modo fin troppogenerico per definiresituazioni poco chiare peresempio nellrsquoindustriagalvanica si parla spesso dipolarizzazione quando ilprocesso produttivo nonsegue lrsquoandamento previstoanche se le vere cause sonotutte da definire
2
La fem viene misurata acircuito aperto (ossia incondizioni di equilibrio acorrente nulla) e conterminali di platinomediante un potenziometroo un voltmetro elettronico
Se le soluzioni simescolassero ben prestosi verificherebberoreazioni chimiche direttelaquoindesiderateraquo (peresempio fra elettrodi esoluzione) con rapidoesaurimento del sistema(pila Daniell gtparagrafo24) e sviluppo di calore
11
CELLE GALVANICHE O PILE
vece dove la corrente circola (e non egrave nulla) la ddp in uscita dalla pila egrave sempreminore della fem a causa della laquocaduta di tensioneraquo provocata dal passaggio dicorrente Vale infatti con buona approssimazione la relazione
ddp= fem ndash Ri
dove bull R egrave la resistenza del circuito bull i lrsquointensitagrave di corrente
Per esempio se si collegauna comune pila da 45 Va una lampadina e simisura la ddp ai capi delcircuito si ottiene unvalore piugrave basso (peresempio 33 V)Il valore nominale ditensione sullrsquoinvolucrodella pila infatti indica lafem non la ddp inuscita (che dipende dallaquocaricoraquo effettivo delcircuito)
Figura 22Cella galvanica (pila) Il setto poroso divide (pur mantenen-doli in contatto elettrico fra loro) i due comparti del recipien-te che costituiscono le due semicelle Queste possono con-tenere due diversi elettroliti oppure lo stesso elettrolita maa diversa concentrazione in modo che allrsquoinizio i potenzialisiano diversi Nel primo caso le due lamine sono in generedi metalli differenti nel secondo caso sono uguali fra loroIl circuito esterno egrave formato da conduttori di prima specie ecomprende il dispositivo per la misura della tensione dellapila la corrente (i) e gli elettroni (e-) percorrono il circuito indirezioni opposte
Lrsquoelettrodo piugrave ricco di elettroni cioegrave a potenziale minore egrave detto anodo e costitu-isce il polo negativo della pila mentre lrsquoelettrodo piugrave povero di elettroni cioegrave a po-tenziale maggiore egrave detto catodo e costituisce il polo positivo Attraverso il circuitoesterno lrsquoanodo tende a cedere elettroni al catodo sotto la laquospintaraquo della spontaneatendenza del sistema a eguagliare i potenziali delle due semicelle
Il flusso di elettroni dallrsquoanodo al catodo altera quindi lo stato drsquoequilibrio ini-ziale di ciascuna semicella esso puograve venire ripristinato mediante reazioni di ossida-zione allrsquoanodo e contemporaneamente mediante reazioni di riduzione al catodoInfatti in base alla legge di Nernst (gtparagrafo 12) le reazioni di ossidazione tendo-no a innalzare il potenziale di elettrodo percheacute aumenta la concentrazione dellaforma ossidata (al numeratore dellrsquoargomento logaritmico) viceversa le reazioni diriduzione tendono ad abbassarlo La corrente che si stabilisce nel circuito egrave dovutaalla tendenza spontanea del sistema a raggiungere lrsquoequilibrio termodinamico per-ciograve quando i potenziali dei due elettrodi diventano uguali il flusso di elettronicessa e si dice che la pila egrave laquoscaricaraquo
La pila quindi egrave un dispositivo mediante il quale gli elettroni in gioco in unareazione redox passano attraverso un circuito da una specie chimica a unrsquoaltraOssidante e riducente infatti non vengono posti direttamente a contatto cosiccheacute glielettroni che si scambierebbero sono laquocostrettiraquo a passare attraverso il circuitoesterno Ciograve consente di convertire in energia elettrica e quindi in lavoro lrsquoenergiache si libera in un processo redox spontaneo che genererebbe calore il flusso di
12
2 Potenziometria
corrente si arresta quando egrave soddisfatta la costante di equilibrio della reazione chegenera la pila
Per ragioni storiche il funzionamento delle pile egrave stato spiegato in termini di unflusso di corrente elettrica dovuto a inesistenti cariche elettriche positive che migra-no dal polo a potenziale maggiore (catodo) verso il polo a potenziale minore (ano-do) Per questo motivo il verso convenzionale della corrente elettrica egrave opposto aquello in cui effettivamente circolano gli elettroni
21 Potenziali standard di ossidoriduzioneIn linea di principio per misurare la ddp fra una lamina di metallo e la soluzionein cui egrave immersa (si veda la figura 21a) occorre inserire il dispositivo di misura inmodo che un terminale sia collegato al metallo e lrsquoaltro alla soluzione In questomodo tuttavia si crea un nuovo contatto metallosoluzione e lo strumento finiscecol misurare la ddp fra i due metalli senza dare informazioni sul valore del poten-ziale di ciascuno di essi Quindi il potenziale assoluto di un singolo elettrodo o diuna coppia redox (che egrave la stessa cosa) non puograve essere misurato Si egrave costretti perciogravea effettuare una misura relativa dei potenziali ponendo a confronto due semicellela semicella di cui si vuole misurare il potenziale e una semicella di riferimento co-struita in modo da assumere un potenziale costante
In pratica lrsquoelettrodo di cui si vuole misurare il potenziale viene accoppiato a unelettrodo di riferimento e si misura la ddp di questa pila in condizioni precisamentedefinite
In base a criteri di opportunitagrave pratica e a considerazioni termodinamiche si egravescelto come elettrodo di riferimento il cosiddetto elettrodo standard a idrogeno(SHE Standard Hydrogen Electrode) A tale elettrodo (fig 23) viene assegnato perconvenzione un potenziale di semicella di 00000 V valido a tutte le temperatureper una soluzione che contiene ioni idrogeno ad attivitagrave unitaria e idrogeno gassosoa fugacitagrave unitaria (in pratica alla pressione parziale di 1 bar)
Nella prima fasedi sviluppodellrsquoelettrochimica siparlava anche di elettrodonormale a idrogeno(NHE Normal HydrogenElectrode) riferendosi a unelettrodo di platinoimmerso in una soluzione1 N di un acido forte inquesta soluzione perogravelrsquoattivitagrave del protone egravecirca 08 e quindi ilpotenziale realedellrsquoelettrodo egrave ben diversoda zero Per questo motivonon egrave corretto usare lasigla NHE per indicare ilriferimento standard[Fonte RW RametteJ Chem Ed vol 64 10(ott 1987)]
Figura 23Elettrodo a idrogeno secondo la realizzazione ideata da SPLSoslashrensen Nel gorgogliatore entra idrogeno gassoso purissi-mo che attraversa la soluzione acida e lambisce la lamina diplatino platinato prima di uscire dal secondo gorgogliatore Idue gorgogliatori e lrsquoampolla centrale contengono la stessasoluzione acida La lamina di platino egrave saldata a un filo di plati-no che fuoriesce dal tappo e assicura il collegamento elettricocon lo strumento di misura Il rubinetto e il sifone mettono incontatto la soluzione acida con lrsquoaltro elettrodo formando cosigraveuna pila Quando lrsquoattivitagrave di H+ e la fugacitagrave di H2 sono unitarielrsquoelettrodo egrave in condizioni standard
13
CELLE GALVANICHE O PILE
Le tabelle dei potenziali standard di ossidoriduzione riportano appunto i po-tenziali di coppie redox ad attivitagrave unitaria misurati rispetto allo SHE (a 25 degC) Sele reazioni sono scritte secondo le convenzioni IUPAC cioegrave nel senso della ridu-zione (elettroni a sinistra) egrave piugrave preciso parlare di potenziali standard di riduzione(tab 21) Nelle tabelle le coppie con potenziale positivo sono tendenzialmentepiugrave ossidanti della coppia H+H2 mentre le coppie con potenziale negativo sono piugraveriducenti
In generale per due coppie qualsiasi quella con potenziale standard maggiore egraveossidante (nelle condizioni imposte) nei confronti della coppia con potenziale stan-dard minore Per esempio se si immerge un foglio di alluminio in una soluzionecontenente solfato di rame e solfato di alluminio (ad attivitagrave unitaria) il foglio di
TABELLA 21 | Alcuni potenziali standard di riduzione (Edeg) misurati a 25 degC
Semireazione Edeg(V) Semireazione Edeg(V)
O H e O H O3 2 22 2+ + ++ minus 2076 Cu e Cu s2
2+ minus+ ( ) 0342
S O e SO2 82
422 2minus minus minus+ 2010 Hg Cl s e Hg Cl2 2 2 2 2( )+ +minus minus
0268
H O H e H O2 2 22 2 2+ ++ minus 1776 AgCl s e Ag Cl( )+ +minus minus
0222
MnO H e MnO s H O4 2 24 3 2minus + minus+ + + ( ) 1679 Cu e Cu2+ minus ++ 0153
Ce e Ce4 3+ minus ++ 172 Sn e Sn in HCl M4 22 1+ minus ++ ( ) 0151
MnO H e Mn H O42
28 5 4minus + minus ++ + + 1507 S H e H S g+ ++ minus2 2 2 ( ) 0142
PbO H e Pb H O22
24 2 2+ + ++ minus + 1455 S O e S O4 6
22 3
22 2minus minus minus+ 008
Cl e Cl2 2 2+ minus minus 1358 AgBr s e Ag Br( )+ +minus minus
0071
Cr O H e Cr H O2 72 3
214 6 2 7minus + minus ++ + + 1350 2H ++ 2e-H2 00000
O g H e H O2 24 4 2( )+ ++ minus 1229 Pb e Pb2
2+ minus+ ndash0126
2 12 10 63 2 2IO H e I H Ominus + minus+ + + 1195 Sn e Sn22
+ minus+ ndash0137
Br l e Br2 2 2( )+ minus minus 1066 Ni e Ni2
2+ minus+ ndash0257
NO H e HNO H O3 2 23 2minus + minus+ + + 0934 Co e Co22
+ minus+ ndash0282
2 22
2
2Hg e Hg+ minus ++ 0920 Fe e Fe22
+ minus+ ndash0447
Cu I e CuI2+ minus minus+ + 086 Zn e Zn22
+ minus+ ndash0762
Ag e Ag+ minus+ 0799 Mn e Mn22
+ minus+ ndash1185
Hg e Hg2
22 2
+ minus+ 0797 Al e Al33
+ minus+ ndash1662
Fe e Fe3 2+ minus ++ 0771 Mg e Mg22
+ minus+ ndash2372
O g H e H O2 2 22 2( )+ ++ minus 0695 Na e Na+ minus+ ndash2710
I e I3 2 3minus minus minus+ 0536 Ca e Ca22
+ minus+ ndash2868
I e I2 2 2+ minus minus 0535 K e K+ minus+ ndash2931
Cu e Cu+ minus+ 0521 Li e Li+ minus+ ndash3040
Fe CN e Fe CN( ) ( )63
64minus minus minus+ 0358
14
2 Potenziometria
alluminio si dissolve mentre si deposita rame metallico Infatti i potenziali stan-dard delle due coppie redox sono
Cu2+ + 2endash Cu Edeg= +034 V
Al3+ + 3endash Al Edeg= ndash166 V
Nella soluzione quindi lo ione Cu2+ (forma ossidata della coppia con potenzialemaggiore) tende a ossidare Al (forma ridotta della coppia con potenziale minore)
TABELLA DEI POTENZIALI STANDARD DI RIDUZIONEAPPROFONDIMENTO
22 Tensione pratica (ddp) di una pila
Lrsquoinsieme dei conduttori di prima e di seconda specie che in sequenza opportunaformano una pila (o in generale un sistema elettrochimico) costituisce una catenagalvanica La differenza di potenziale (Ecella) che si misura ai capi di una pila durantelrsquoerogazione di corrente egrave dovuta a diversi contributi piugrave precisamente egrave uguale allasomma algebrica di tutte le cadute di tensione che si verificano lungo lrsquointero circuito
Ecella= E1 + E2 + E3 + E4 + E5 (25)
dove bull E1 egrave la ddp dovuta allrsquoeventuale passaggio di corrente nel circuito (cadutaohmica) bull E2 la ddp di contatto metallometallo (tensione di Volta) bull E3 la ddpdi contatto soluzionesoluzione (tensione o potenziale di giunzione liquida) bull E4 edE5 le ddp di contatto metallosoluzione (tensione di Nernst) per ciascun elettrodo
Esaminiamo ora il significato dei singoli contributi
Caduta ohmica Quando la cella egrave attraversata da corrente inevitabilmente si ve-rifica una caduta di tensione E = R times i (prima legge di Ohm) Ovviamente se lamisura del potenziale di cella viene effettuata in condizioni tali da minimizzareo eliminare il passaggio di corrente (cioegrave a circuito aperto) la caduta ohmica siannulla (cioegrave E1= 0)
Tensione di Volta Quando due diversi metalli vengono posti a contatto si generasempre una ddp Questo fenomeno detto effetto Volta egrave dovuto al fatto che glielettroni di conduzione sono trattenuti con diversa energia dai diversi metalli Per-ciograve il contatto fra due metalli provoca un trasferimento di elettroni istantaneo daparte del metallo che li trattiene con minore energia Il processo perograve non prose-gue indefinitamente il trasferimento di elettroni infatti prosegue fino allrsquoequili-brio quando insorge una ddp (in genere di pochi millivolt) sufficiente a bloccarlo
Si puograve verificare sperimentalmente (e dimostrare) che la ddp agli estremi diuna catena di conduttori di prima specie egrave uguale a quella che si stabilisce se i duemetalli che ne costituiscono gli estremi vengono posti a diretto contatto (fig 24)Di conseguenza se gli ingressi del misuratore di tensione sono costituiti dallo stessometallo lrsquoeffetto Volta complessivo egrave nullo (E2= 0)
In altri termini la formaossidata della coppia conpotenziale piugrave alto egraveossidante nei confrontidella forma ridotta dellacoppia con potenzialepiugrave basso
A rigore si dovrebbe usareil simbolo V (o ∆V)percheacute si tratta di unaddp misurata in una pilain funzione e dunquenon di una fem Il pedicelaquocellaraquo puntualizza che sitratta in generale di unacella elettrochimica
R egrave la resistenza delconduttore e i lrsquointensitagravedi corrente
15
CELLE GALVANICHE O PILE
Potenziale di giunzione liquida In una pila le due semicelle sono separate matenute in contatto elettrico mediante un setto poroso o un ponte salino che con-sente un mescolamento lentissimo (praticamente nullo) delle soluzioni Questidispositivi (si veda la figura 25) perograve creano unrsquoulteriore caduta di tensione fragli elettrodi detta potenziale di giunzione liquida (Eg) o anche potenziale dicontatto (o di diffusione) Il potenziale di giunzione liquida puograve essere sia po-sitivo sia negativo e quindi fa aumentare o viceversa diminuire la ddp fra glielettrodi
Lrsquoinsorgere di un potenziale di giunzione egrave causato dal fatto che gli ioni si dif-fondono con diversa mobilitagrave attraverso le superfici di contatto di due mezzi di-versi un setto poroso per esempio egrave diversamente permeabile agli ioni propriosecondo la loro mobilitagrave
Tensione di Nernst I potenziali di contatto metallosoluzione (E4 E5) si calco-lano in teoria mediante la legge di Nernst e perciograve sono detti potenziali nern-stiani
LA MOBILITAgrave DEGLI IONI IN SOLUZIONEAPPROFONDIMENTO
23 Calcolo della tensione teorica (fem) di una pilaSe si opera in modo da rendere trascurabili i primi tre termini dellrsquoequazione (22)la ddp ai capi della pila coincide in pratica con la sua fem che puograve essere cal-colata semplicemente in base agli ultimi due termini cioegrave ai potenziali di elettrodoNei calcoli occorre tenere presente che
a la fem di una pila in quanto strettamente collegata al lavoro da essa compiutodeve necessariamente avere segno positivo
b lrsquoelettrodo a potenziale maggiore su cui avviene la riduzione egrave il catodo lrsquoelet-trodo a potenziale minore su cui avviene lrsquoossidazione egrave lrsquoanodo
Di conseguenza la fem di una pila cioegrave di una cella elettrochimica ottenuta colle-gando due semicelle (catodica e anodica) egrave espressa dalla seguente relazione
Ecella = Ec ndash Ea (26)
ovvero
Ecella = Emaggiore ndash Eminore (27)
Questa seconda scrittura mostra chiaramente che la fem della pila egrave sempre posi-tiva anche nel caso in cui i potenziali delle due semicelle siano entrambi negativi
Indichiamo con Ec ilpotenziale del catodo (opotenziale catodico) econ Ea il potenzialedellrsquoanodo (o potenzialeanodico)
Figura 24Nonostante ogni superficie di contatto fra due metallisia sede di una ddp dovuta allrsquoeffetto Volta la ddpche si instaura fra rame e zinco egrave la stessa sia nel caso(a) sia nel caso (b) Infatti se cosigrave non fosse chiudendola catena aperta (a) si dovrebbe osservare un passaggiodi corrente e questo in realtagrave non avviene
a b
16
2 Potenziometria
ESEMPIO 1UNA IPOTETICA PILA Egrave COSTITUITA DALLE COPPIE REDOX Al3+Al E Ni2+NiQUAL Egrave LA FEM DELLA PILA SE LE ATTIVITAgrave DI TUTTE LE SPECIE IONICHE SONOUNITARIE
Dal momento che le attivitagrave sono unitarie il calcolo fornisce la tensione (o forzaelettromotrice) standard della pila
Innanzitutto dalla tabella dei potenziali standard si ricavano i potenziali stan-dard per ciascuna coppia redox
Al3+ + 3endash Al Eo
= ndash166 V
Ni2+ + 2endash Ni Eo
= ndash026 V
Lrsquoelettrodo della coppia Ni2+Ni costituisce il catodo percheacute ha il potenziale mag-giore mentre lrsquoelettrodo della coppia Al3+Al costituisce lrsquoanodo percheacute ha il poten-ziale minore Si puograve anche costruire un diagramma di questo tipo
Al3+Al Ni2+Ni H+H2
ndash166 ndash026 00000 Edeg(V rif a SHE)
Quindi la fem della pila in condizioni standard egrave
Ecella= Ec ndash Ea= Emaggiore ndash Eminore= ndash026 ndash (ndash166)= +140 V
La reazione di ossidoriduzione che genera la pila si ottiene formalmente combi-nando le due semireazioni bilanciate quella di riduzione al catodo e quella di os-sidazione allrsquoanodo Ciascuna semireazione deve essere moltiplicata per un fattorenumerico tale che il numero di elettroni ceduti dalla specie che si ossida sia uguale aquello degli elettroni acquistati dalla specie che si riduce Quindi nel caso dellrsquoesem-pio proposto si moltiplica la semireazione della coppia Al3+Al per 2 e quella dellacoppia Ni2+Ni per 3
2 middot (Al Al3+ + 3endash) Edeg= ndash(ndash166 V) (ndash)
3 middot (Ni2+ + 2endash Ni) Edeg= ndash026 V (+)
2Al + 3Ni2+ 2Al3+ + 3Ni Edeg= +140 V
Attenzione per ottenere il bilancio della reazione di cella si moltiplica per un coeffi-ciente opportuno ciascuna semireazione ma non il rispettivo potenziale Infatti i po-tenziali di elettrodo (e quindi anche il potenziale di cella) esprimono un lavoro elettricoper unitagrave di carica e perciograve sono proprietagrave intensive che non dipendono dalla quantitagravedi materia contenuta nel sistema ovvero dal numero di cariche elettriche trasportate
Se le attivitagrave non sono unitarie per calcolare il potenziale di elettrodo occorreapplicare lrsquoequazione di Nernst
Egrave ovvio comunque che il lavoro complessivo che puograve essere fornito da una piladipende anche dalla massa e dalla geometria degli elettrodi Per questo motivo unapila o un insieme di pile (cioegrave una batteria) che viene utilizzata per esempio permuovere un veicolo puograve avere dimensioni ingombranti Questo accadeva fino anon molti anni fa per le vecchie batterie al piombo ora sempre piugrave sostituite dabatterie come quelle al litio decisamente piugrave compatte e che infatti stanno rendendopossibile il progressivo passaggio allrsquoauto parzialmente o completamente elettrica
UNA IPOTETICA PILA Egrave COSTITUITA DALLE COPPIE REDOX Al3+Al E Ni2+NiQUAL Egrave LA FEM DELLA PILA SE LE ATTIVITAgrave DI TUTTE LE SPECIE IONICHE SONOUNITARIE
Nella pila la reazionedella coppiadella coppia Ni2+Ni(Ni2+ si riduce) avvienenel senso conforme allaconvenzione adottata per ipotenziali (elettroni asinistra) invece lareazione della coppiaAl3+Al (Al si ossida)avviene nel senso oppostoa quello convenzionalePerciograve il potenziale Edegdella coppia Al3+Al vieneconsiderato con segnoopposto a quello tabulato(+166 V) Se si sommaalgebricamente ilpotenziale dellrsquoelettrodoche si riduce (Ec) conquello dellrsquoelettrodo che siossida cambiato di segno(Ea) la tensione della pilarisulta positiva
17
CELLE GALVANICHE O PILE
ESEMPIO 2UNA IPOTETICA PILA Egrave COSTITUITA DALLE COPPIE REDOX Al3+Al E Ni2+NiQUAL Egrave LA FEM DELLA PILA A 25 degC SE LE CONCENTRAZIONI DELLE SPECIEIONICHE SONO RISPETTIVAMENTE [Al3+] = 2 10ndash2 M E [Ni2+] = 10ndash2 M
Approssimando le attivitagrave con le concentrazioni si ottiene
La situazione non egrave sostanzialmente cambiata rispetto alle condizioni standardpercheacute anche in questo caso la reazione di cella comporta lrsquoossidazione dellrsquoallumi-nio e la riduzione del nichel La fem della pila quindi egrave
Ecella= Ec ndash Ea= ndash032 ndash (ndash167)= +135 V
24 Alcuni tipi di pile
Pila DaniellUna semicella egrave costituita da una lamina di rame immersa in una soluzione diCuSO4 lrsquoaltra semicella da una lamina di zinco immersa in una soluzione di ZnSO4
(fig 25) Le due semicelle sono separate da un setto poroso (in pratica una mem-brana di vetro sinterizzato o analogo materiale inerte) oppure si trovano in duediversi recipienti collegati da un ponte salino
Le reazioni di elettrodo sono
Zn2+ + 2endash Zn Edeg= ndash0762 V
Cu2+ + 2endash Cu Edeg= 0342 V
Le concentrazioni dei sali nelle rispettive semicelle sono in genere tali da renderenegativo il semielemento di zinco che perciograve tende a cedere elettroni al rame (ossi-dandosi) La lamina di zinco egrave dunque il polo negativo (anodo) della pila e il rameegrave il polo positivo (catodo)
La rappresentazione della catena galvanica di questa pila secondo le convenzioniIUPAC egrave
(ndash) Zn(s)|ZnSO4(aq)||CuSO4(aq)|Cu(s) (+)
UNA IPOTETICA PILA Egrave COSTITUITA DALLE COPPIE REDOX Al3+Al E Ni2+NiQUAL Egrave LA FEM DELLA PILA A 25 degC SE LE CONCENTRAZIONI DELLE SPECIEIONICHE SONO RISPETTIVAMENTE [Al3+] = 2 10ndash2 M E [Ni2+] = 10ndash2 M
Si noti che se i duescomparti non fosseroscomparti non fosseroben separati dal settoben separati dal settoporoso ben presto gli ioniporoso ben presto gli ionirame disponibilirame disponibiliraggiungerebbero lrsquoraggiungerebbero lrsquoanododi zinco ossidandolo eandando a depositarsi sudi esso come Cumetallico nondiversamente da quanto sipuograve osservareimmergendo una barrettadi zinco in una soluzionedi solfato di rameesaurendo quindirapidamente la pila esviluppando calore
Figura 25Pila Daniell (a) con settoporoso e (b) con pontesalino
a b
18
2 Potenziometria
La coppia di barrette verticali (||) al centro rappresenta il setto poroso o il pontesalino che separano le due semicelle lrsquoanodo egrave scritto a sinistra e per ciascun elet-trodo la forma ridotta della coppia redox egrave scritta verso lrsquoesterno Le lettere scrittefra parentesi indicano lo stato fisico di ogni specie chimica
La reazione di cella egrave
Zn + Cu2+ Zn2+ + Cu
Per calcolare la fem teorica di questa pila che puograve anche trovarsi in condizionidiverse da quelle standard si applica la legge di Nernst a ciascuna semicella
(28)
(29)
I potenziali standard delle due semicelle sono cosigrave diversi fra loro che nelle normalicondizioni operative di una pila Daniell il rame rappresenta il polo positivo e lozinco il polo negativo
Sottraendo il potenziale minore da quello maggiore si ottiene il potenziale dicella
Ecella = ECu2+Cu - EZn2+Zn
Ponendo Edegcella = EdegCu2+Cu ndash EdegZn2+Zn (= 0342 V + 0762 V) e quindi sottraendo la(28 dalla 29) si ricava infine
Questa equazione consente dunque di calcolare il potenziale di Nernst se egrave notoil valore effettivo dellrsquoattivitagrave degli ioni Zn2+ e Cu2+ Tuttavia il calcolo si presta aerrori anche significativi lrsquoattivitagrave degli ioni per esempio varia in funzione dellaforza ionica della soluzione e non puograve essere calcolata Perciograve la fem reale piugraveesattamente la ddp che si misura si discosta dal valore calcolato sostanzialmenteper due motivi
a il sistema non si comporta in maniera ideale (per esempio gli elettrodi possonopolarizzarsi)
b il contributo della caduta ohmica (gtequazione 25) puograve essere praticamente an-nullato se nel circuito viene fatta circolare una corrente trascurabile invece ilpotenziale di giunzione liquida per quanto piccolo non puograve essere soppresso enon egrave prevedibile in base a equazioni teoriche
Pile a concentrazioneIn questo tipo di pila le due semicelle contengono due soluzioni di una stessa cop-pia redox ma a diversa concentrazione gli elettrodi sono inerti oppure dello stes-so metallo e le semicelle sono collegate da un setto poroso o da un ponte salino(fig 26)
In questo calcolotrascuriamo i contributidei termini E1 E2 E3 dellaequazione (25)
Lrsquoequazione rappresentain pratica la legge diNernst applicata allareazione redox globalescritta nel verso dellaspontaneitagrave tenendoconto degli elettroniscambiati (2) e inserendonellrsquoargomento dellogaritmo lrsquoinverso delquoziente di reazione
+
19
CELLE GALVANICHE O PILE
Le due soluzioni si scambiano elettroni attraverso il circuito esterno mentre ilsetto poroso (o il ponte salino) che le collega consente il passaggio di ioni e quin-di chiude il circuito Il sistema raggiunge lrsquoequilibrio quando le attivitagrave degli ioninelle due semicelle diventano uguali perciograve egrave prevedibile che nella soluzione piugravediluita avvenga lrsquoossidazione il rame metallico si dissolve e si formano ioni Cu2+ insoluzione questo dunque egrave lrsquoanodo Contemporaneamente gli elettroni passanonellrsquoaltro comparto (a destra in figura 26) attraverso il circuito esterno e riduconogli ioni Cu2+ che si depositano sullrsquoelettrodo come rame metallico questo dunqueegrave il catodo
In pratica egrave come se gli ioni Cu2+ si trasferissero dalla soluzione piugrave concentrataalla soluzione piugrave diluita Queste pile dunque trasformano in lavoro elettrico lrsquoe-nergia che si libera nel processo spontaneo con cui due soluzioni a diretto contattotendono a raggiungere lrsquoequilibrio di concentrazione
La rappresentazione convenzionale della catena elettrodica di questa pila a con-centrazione egrave la seguente
(-) Cu(s) |Cu2+(001 M)||Cu2+(1 M)|Cu(s) (+)
Per calcolare la tensione teorica della pila si applica la legge di Nernst a ciascun elet-trodo Approssimando le attivitagrave con le concentrazioni (a 25 degC) si ottiene
(soluzione piugrave diluita anodo)
(soluzione piugrave concentrata catodo)
Quindi
Ecella= Emaggiore ndash Eminore= 0342- 0283= 0059 V
ALTRI TIPI DI CELLE GALVANICHE O PILEAPPROFONDIMENTO
Figura 26Pila a concentrazione il compartoanodico (a sinistra) contiene ioni Cu2+
in concentrazione 001 M e il com-parto catodico (a destra) contieneioni Cu2+ in concentrazione 1 M Ilcollegamento fra le due semicelle egraverealizzato con un ponte salino
20
2 Potenziometria
STRUMENTAZIONEIn potenziometria si misura la differenza di potenziale che si stabilisce fra due semi-celle allo scopo di determinare la concentrazione di uno ione o per seguire lrsquoanda-mento di una titolazione
Il dispositivo completo per una misura potenziometrica (fig 27) consiste es-senzialmente di
bull un potenziometro o meglio un millivoltmetro elettronicobull un elettrodo di riferimentobull un elettrodo di misura
Il potenziometro serve per misurare la ddp fra i due elettrodi senza alterare il lorostato di equilibrio perciograve si lavora a corrente praticamente nulla
Gli elettrodi collegati al potenziometro sono immersi nella soluzione su cui sieffettuano le misure Lrsquoelettrodo di riferimento egrave costruito in modo tale da mante-nere costante il suo potenziale di conseguenza ogni variazione di ddp misurata egraveimputabile esclusivamente allrsquoelettrodo di misura (piugrave precisamente alla soluzioneanalizzata)
ELETTRODI DI RIFERIMENTOLrsquoelettrodo standard a idrogeno (SHE gtparagrafo 21) egrave lrsquoelettrodo di riferimentoprimario Tuttavia nella pratica quotidiana di laboratorio si usano elettrodi di ri-ferimento secondari piugrave semplici e maneggevoli che hanno comunque la proprie-tagrave di mantenere il proprio potenziale costante a temperatura costante Tratteremoora in maggior dettaglio gli elettrodi di uso piugrave comune
31 Elettrodo ad argentocloruro drsquoargento
Si tratta senzrsquoaltro dellrsquoelettrodo piugrave diffuso Il dispositivo egrave costituito da un sem-plice filo drsquoargento rivestito di AgCl e immerso in una soluzione di KCl (egrave dunqueun elettrodo di seconda specie) Il tutto egrave contenuto in un tubicino di vetro dotatodi setto poroso per assicurare il contatto elettrico con lrsquoesterno ovvero con la so-luzione in cui viene immerso lrsquooggetto dellrsquoanalisi
Figura 27Rappresentazione schematica deldispositivo completo per misurepotenziometriche
3
21
ELETTRODI DI RIFERIMENTO
La rappresentazione convenzionale dellrsquoelettrodo (fig 28) egrave
Ag(s)|AgCl(aq)|KCl(aq)
La reazione di elettrodo egrave
AgCl + endash Ag + Clndash
E il potenziale di elettrodo
E= EdegAgClAg
Considerando unitarie le attivitagrave dei solidi puri si ottiene
E= EdegAgClAg ndash 01984 10ndash3 T log[Clndash] (210)
Se lrsquoattivitagrave degli ioni cloruro egrave costante (a temperatura costante) il potenziale dielettrodo rimane costante Gli elettrodi piugrave comuni contengono soluzioni sature diKCl (circa 42 M) e perciograve sono detti saturi (SSC Saturated Silver-Silver ChlorideElectrode) A 25 degC il potenziale di SSC vale 0197 V Questo elettrodo puograve essereusato fino a 105 degC Nella tabella 1 ndash lab 1 (gtpag 39) sono riportati i potenziali alvariare della temperatura per lrsquoelettrodo saturo e 3 M
Gli anioni (come il solfuro) che formano con Ag+ sali meno solubili di AgClpossono danneggiare questo tipo di elettrodo Anche gli ossidanti e i riducenti fortie gli agenti complessanti possono interferire con la reazione di elettrodo per proteg-gere lrsquoelettrodo da queste sostanze si usa un elettrolita intermedio come nel casodellrsquoelettrodo a calomelano saturo (SCE gtparagrafo 32)
Gli elettrodi ad argentocloruro di argento sono usati come riferimento internonegli elettrodi a vetro (gtparagrafo 41)
32 Elettrodo a calomelano
laquoCalomelanoraquo egrave il nome comune del cloruro mercuroso (I) Hg2Cl2 che fa parteappunto di questo elettrodo (fig 29a) La rappresentazione convenzionale dellrsquoe-lettrodo egrave
Hg(l)|Hg2Cl2(s)|KCl(aq)
La reazione di elettrodo egrave
Hg2Cl2 + 2endash 2Hg + 2Clndash
e il potenziale di elettrodo in base alla legge di Nernst
In condizioni standard lrsquoattivitagrave di solidi e liquidi puri egrave considerata uguale a 1quindi
da cui
ndash 01984 10ndash3 T log|Clndash| (211)
Sono anche molto diffusigli elettrodi contenentiKCl 3 M cioegrave quasisaturi Il vantaggio egrave chein queste soluzioni non siformano cristalli di KClche possono danneggiarelrsquoelettrodo ostruendoil setto poroso che sta sulfondo
Figura 28Elettrodo ad AgAgCILa soluzione tamponeinterna contiene ioni K+
e CIndash ad attivitagrave costante
22
2 Potenziometria
Il potenziale dellrsquoelettrodo a calomelano dunque dipende solo dallrsquoattivitagrave delloione cloruro e dalla temperatura Se la temperatura egrave costante e lrsquoattivitagrave dello ionecloruro nella soluzione interna allrsquoelettrodo non varia il potenziale rimane costante
Gli elettrodi a calomelano piugrave comuni contengono soluzioni sature di KCl (circa42 M) e perciograve sono detti saturi (SCE Saturated Calomel Electrode) Si usano ancheelettrodi a KCl 1 M e 01 M la tabella 22 riporta il potenziale assunto da questielettrodi secondo la concentrazione di KCl
TABELLA 22 | Potenziale (mV) di alcuni elettrodi di riferimento a 25 degC
AgAgCl Calomelano HgHgO HgHgSO4 Thalamid
KCl 01 M 288 KCl 01 M 334 NaOH 01 M 165 H2SO4 05 M 682 KCl 3 M -567
KCl 1 M 235 KCl 1 M 280 NaOH 1 M 140 K2SO4 sat 650 KCl sat -577
KCl 3 M 210 KCl 35 M 250
KCl 35 M 205 KCl sat 241
KCl sat 199 NaCl sat 236
NaCl 3 M 209
NaCl sat 197
Lrsquoelettrodo a calomelano puograve essere usato fino a circa 70 degC a temperature piugrave alteil calomelano si dismuta (Hg2Cl2 Hg + HgCl2)
I solfuri gli ossidanti i forti riducenti e gli agenti complessanti che formanoamalgami con gli ioni Hg2
2+ possono danneggiare questo tipo di elettrodo Perciogravequando si lavora in presenza di queste sostanze si usano elettrodi a doppia giun-zione (fig 29b) in cui fra lrsquoelettrodo e la soluzione egrave interposto un contenitoreriempito con un elettrolita intermedio (per esempio KNO3)
Va infine segnalata la tendenza a non usare il mercurio per motivi tossicologicie questo spiega il progressivo abbandono nella pratica comune di questo tipo dielettrodo con grande rammarico dagli elettrochimici percheacute lrsquoelettrodo a calomela-no egrave il piugrave stabile
bullELETTRODI DI PRIMA E DI SECONDA SPECIE bullALTRI ELETTRODI DI RIFERIMENTO
APPROFONDIMENTI
Figura 29(a) Elettrodo a calomelano (b) Nella versione adoppia giunzione egrave presente una seconda cameraper lrsquoelettrolita intermedio che viene immessoattraverso la bocchetta laterale il setto porosoassicura il contatto elettrico con la soluzioneesterna
a b

8
2 Potenziometria
bio apparente di materia fra il metallo e la soluzione a questa concentrazione le duereazioni opposte (riduzione e ossidazione) procedono alla stessa velocitagrave e il sistemasi trova in uno stato di equilibrio termodinamico fin dallrsquoistante in cui il metalloviene immerso in soluzione
LA FISICA DEI SISTEMI ELETTROCHIMICIAPPROFONDIMENTO
11 Classificazione degli elettrodiUn metallo immerso in una soluzione dei suoi ioni costituisce un elettrodo di pri-ma specie il cui potenziale dipende dalla concentrazione (piugrave precisamente dallrsquoat-tivitagrave) degli ioni in soluzione
Quando invece il metallo si trova in equilibrio con la soluzione di un suo salepoco solubile si ha un elettrodo di seconda specie un filo drsquoargento immerso inuna soluzione satura di AgCl tutto ricoperto dal sale egrave un tipico elettrodo di secon-da specie La reazione di elettrodo egrave
AgCl + endash Ag + Clndash
Un elettrodo di terza specie egrave costituito da un metallo inerte immerso in una solu-zione contenente una coppia redox Un tipico esempio egrave costituito da un filo di pla-tino (un metallo nobile e quindi inerte nelle normali condizioni di lavoro) immersoin una soluzione di ioni Fe2+ e Fe3+ Il metallo si pone in equilibrio con la soluzionedi cui assume il potenziale Infatti la superficie di platino diventa sede dello scam-bio di elettroni fra le due specie ioniche che danno luogo alla reazione
Fe3+ + endash Fe2+
Infine gli elettrodi di quarta specie (che possono essere considerati come una va-riante dei precedenti) sono i cosiddetti elettrodi a gas in cui il metallo inerte e poro-so viene saturato da un gas (per esempio idrogeno) e posto a contatto con una solu-zione contenente la forma ionica del gas (nellrsquoesempio H+) Nel caso dellrsquoidrogeno
2H+ + 2endash H2
12 Calcolo dei potenziali di elettrodo legge di Nernst
Il potenziale di elettrodo egrave tanto maggiore in valore assoluto quanto maggiore egravela differenza di carica nel doppio strato (per esempio quella che si instaura allrsquoe-quilibrio fra i due lati dellrsquointerfaccia metallosoluzione) e dipende sia dalla naturachimica della coppia redox sia dalla concentrazione attiva ovvero dallrsquoattivitagrave degliioni in soluzione
Consideriamo lrsquoequilibrio per una generica semireazione di elettrodo
aox + bB + nendash cred + dD
Allrsquoequilibrio il potenziale di elettrodo che in realtagrave egrave una differenza di potenzialefra il metallo e la soluzione egrave espresso dalla legge di Nernst
+ (21)
Questa legge che prende ilnome dal chimico tedescoWalther H Nernst puograveessere ricavata in base aconsiderazionitermodinamiche edelettrochimiche su cui nonci soffermeremo Si notiin particolare chelrsquoargomento dellogaritmo egrave lrsquoinverso delquoziente di reazione
9
ELETTRODI E POTENZIALE DI ELETTRODO
dove bull E egrave il potenziale di elettrodo (in volt V) bull R la costante dei gas (che vale831451 Jmol times K) bull T la temperatura assoluta (in kelvin K) bull F la costante diFaraday (che vale 96 485 coulombmol) bull n il numero di elettroni scambiati nellasemireazione bull frac12 frac12 indica lrsquoattivitagrave di ciascuna specie scritta fra le due barrette
Edeg egrave il potenziale standard della coppia redox cioegrave il potenziale che la semicellaassume alla temperatura di 25 degC (29815 K) quando tutte le specie hanno attivitagraveunitaria e i gas si trovano alla pressione parziale di 1 bar (100 kPa) o piugrave precisa-mente hanno fugacitagrave unitaria
Lrsquoattivitagrave di ogni specie egrave uguale al prodotto g ∙ C dove g egrave il coefficiente di atti-vitagrave e C la concentrazione analitica espressa in moli su litro (molL)
Se si tiene conto dei coefficienti di attivitagrave e si inseriscono le parentesi quadre [ ]che indicano le concentrazioni in molL (gtpag 33) si ottiene
E ERT
nF
a b
c d= +deg ln
[ox] [B]
[red] [D]acute (22)
dove al posto di Eo compare il cosiddetto potenziale formale (Eoacute) della coppia redoxin oggetto
Il potenziale formale puograve differire in modo significativo dal potenziale standarde si rivela piugrave utile di esso per una valutazione anche solo orientativa del compor-tamento della coppia redox in quanto tiene meglio conto delle reali condizioni incui si opera per esempio il pH della soluzione Ricordiamo infatti che il pH allrsquointer-no di una cellula vale circa 7 (a parte pochissime eccezioni) per cui il potenziale re-dox standard che fa riferimento a pH 0 non risulta molto adatto a descriverne de-terminate caratteristiche Inoltre il potenziale standard delle coppie O2H2O vale123 V ma scende a 081 V a pH 7 Analogamente il potenziale della coppia deidro-ascorbicoascorbico passa da +390 V a +0058 V diventando nettamente riducentecome si addice alle ben note proprietagrave antiossidanti della vitamina C
Quando si lavora con soluzioni molto diluite (al di sotto di 10ndash3 M) si puograveassumere con buona approssimazione che il coefficiente di attivitagrave di tutte lespecie sia uguale a 1 In tali condizioni se si inserisce il valore numerico di RF e ilfattore numerico per la conversione ai logaritmi decimali si ottiene
(23)
Alla temperatura di 25 degC (29815 K) la legge di Nernst assume la sua forma piugravenota e usata
+ (24)
Per esempio per la semireazione
Cu2+ + 2endash Cu
la legge di Nernst (a 25 degC) assume la forma
+
La costante di Faradayequivale alla caricaelettrica di un numerodi Avogadro (cioegrave diuna mole) di elettroniUna mole contiene602214076 times 1023
entitagrave elementari(gtpag 457)
La fugacitagrave egrave la grandezzafisica adottata per i gas alposto della pressione alloscopo di tener conto delloro comportamento nonideale
ln = 23026 log
10
2 Potenziometria
In questa equazione non compare la concentrazione della forma ridotta percheacutelrsquoattivitagrave di una specie chimica pura nelle condizioni standard viene convenzio-nalmente assunta uguale a 1
In effetti spesso si lavora con soluzioni non particolarmente diluite quindi neicalcoli bisogna fare riferimento alle attivitagrave invece che alle concentrazioni di con-seguenza lrsquoequazione (24) diventa
+ log
IL POTENZIALE FORMALEAPPROFONDIMENTO
13 Polarizzazione degli elettrodiIn tutti i casi in cui il sistema dellrsquoelettrodo si discosti dalle condizioni di equilibriotermodinamico la legge di Nernst diventa inadeguata a descrivere il sistema stessoCiograve accade per esempio quando allrsquoelettrodo viene imposto un potenziale arbitra-rio eo la corrente che lo attraversa egrave molto intensa in questi casi il potenziale dielettrodo risulta diverso da quello previsto in base alla legge di Nernst e si dice chelrsquoelettrodo egrave polarizzato
In particolare quando la concentrazione degli ioni alla superficie di un elettrodoegrave diversa da quella nel resto della soluzione si verifica una polarizzazione di con-centrazione in quanto il sistema non si trova nelle condizioni di equilibrio cui fariferimento il modello di Nernst
La polarizzazione puograve derivare anche dal cambiamento dello stato chimico eofisico della superficie di elettrodo oppure dal verificarsi di reazioni chimiche colla-terali alla reazione di elettrodo
LEGGE DI NERNST E GRANDEZZE TERMODINAMICHE COLLEGATEAPPROFONDIMENTO
CELLE GALVANICHE O PILESe si collegano elettricamente fra loro due semicelle (elettrodi) si realizza un dispo-sitivo che puograve erogare corrente si tratta di una cella galvanica (o pila fig 22)
In una pila le due semicelle sono separate da un setto poroso o da un ponte salinoche hanno il solo compito di assicurare il contatto elettrico evitando il rapido me-scolamento delle soluzioni Secondo le caratteristiche dei singoli elettrodi ai duecapi della pila si crea una differenza di potenziale (ddp) detta anche tensione (opotenziale) di cella che quando raggiunge il suo valore massimo egrave detta forzaelettromotrice (abbreviata fem e indicata con il simbolo E) tutti questi terminiindicano che la pila puograve compiere un lavoro (elettrico)
Dal punto di vista fisico la fem di una pila corrisponde al lavoro massimo cheessa puograve fornire In altri termini la fem equivale al lavoro per unitagrave di carica ne-cessario per mantenere costante la ddp fra i due elettrodi
La fem coincide con la ddp solo nel caso in cui il sistema lavori in condizionidi reversibilitagrave termodinamica (ovvero a corrente nulla) In un circuito chiuso in-
Il termine polarizzazionesoprattutto nelleapplicazioni viene spessousato in modo fin troppogenerico per definiresituazioni poco chiare peresempio nellrsquoindustriagalvanica si parla spesso dipolarizzazione quando ilprocesso produttivo nonsegue lrsquoandamento previstoanche se le vere cause sonotutte da definire
2
La fem viene misurata acircuito aperto (ossia incondizioni di equilibrio acorrente nulla) e conterminali di platinomediante un potenziometroo un voltmetro elettronico
Se le soluzioni simescolassero ben prestosi verificherebberoreazioni chimiche direttelaquoindesiderateraquo (peresempio fra elettrodi esoluzione) con rapidoesaurimento del sistema(pila Daniell gtparagrafo24) e sviluppo di calore
11
CELLE GALVANICHE O PILE
vece dove la corrente circola (e non egrave nulla) la ddp in uscita dalla pila egrave sempreminore della fem a causa della laquocaduta di tensioneraquo provocata dal passaggio dicorrente Vale infatti con buona approssimazione la relazione
ddp= fem ndash Ri
dove bull R egrave la resistenza del circuito bull i lrsquointensitagrave di corrente
Per esempio se si collegauna comune pila da 45 Va una lampadina e simisura la ddp ai capi delcircuito si ottiene unvalore piugrave basso (peresempio 33 V)Il valore nominale ditensione sullrsquoinvolucrodella pila infatti indica lafem non la ddp inuscita (che dipende dallaquocaricoraquo effettivo delcircuito)
Figura 22Cella galvanica (pila) Il setto poroso divide (pur mantenen-doli in contatto elettrico fra loro) i due comparti del recipien-te che costituiscono le due semicelle Queste possono con-tenere due diversi elettroliti oppure lo stesso elettrolita maa diversa concentrazione in modo che allrsquoinizio i potenzialisiano diversi Nel primo caso le due lamine sono in generedi metalli differenti nel secondo caso sono uguali fra loroIl circuito esterno egrave formato da conduttori di prima specie ecomprende il dispositivo per la misura della tensione dellapila la corrente (i) e gli elettroni (e-) percorrono il circuito indirezioni opposte
Lrsquoelettrodo piugrave ricco di elettroni cioegrave a potenziale minore egrave detto anodo e costitu-isce il polo negativo della pila mentre lrsquoelettrodo piugrave povero di elettroni cioegrave a po-tenziale maggiore egrave detto catodo e costituisce il polo positivo Attraverso il circuitoesterno lrsquoanodo tende a cedere elettroni al catodo sotto la laquospintaraquo della spontaneatendenza del sistema a eguagliare i potenziali delle due semicelle
Il flusso di elettroni dallrsquoanodo al catodo altera quindi lo stato drsquoequilibrio ini-ziale di ciascuna semicella esso puograve venire ripristinato mediante reazioni di ossida-zione allrsquoanodo e contemporaneamente mediante reazioni di riduzione al catodoInfatti in base alla legge di Nernst (gtparagrafo 12) le reazioni di ossidazione tendo-no a innalzare il potenziale di elettrodo percheacute aumenta la concentrazione dellaforma ossidata (al numeratore dellrsquoargomento logaritmico) viceversa le reazioni diriduzione tendono ad abbassarlo La corrente che si stabilisce nel circuito egrave dovutaalla tendenza spontanea del sistema a raggiungere lrsquoequilibrio termodinamico per-ciograve quando i potenziali dei due elettrodi diventano uguali il flusso di elettronicessa e si dice che la pila egrave laquoscaricaraquo
La pila quindi egrave un dispositivo mediante il quale gli elettroni in gioco in unareazione redox passano attraverso un circuito da una specie chimica a unrsquoaltraOssidante e riducente infatti non vengono posti direttamente a contatto cosiccheacute glielettroni che si scambierebbero sono laquocostrettiraquo a passare attraverso il circuitoesterno Ciograve consente di convertire in energia elettrica e quindi in lavoro lrsquoenergiache si libera in un processo redox spontaneo che genererebbe calore il flusso di
12
2 Potenziometria
corrente si arresta quando egrave soddisfatta la costante di equilibrio della reazione chegenera la pila
Per ragioni storiche il funzionamento delle pile egrave stato spiegato in termini di unflusso di corrente elettrica dovuto a inesistenti cariche elettriche positive che migra-no dal polo a potenziale maggiore (catodo) verso il polo a potenziale minore (ano-do) Per questo motivo il verso convenzionale della corrente elettrica egrave opposto aquello in cui effettivamente circolano gli elettroni
21 Potenziali standard di ossidoriduzioneIn linea di principio per misurare la ddp fra una lamina di metallo e la soluzionein cui egrave immersa (si veda la figura 21a) occorre inserire il dispositivo di misura inmodo che un terminale sia collegato al metallo e lrsquoaltro alla soluzione In questomodo tuttavia si crea un nuovo contatto metallosoluzione e lo strumento finiscecol misurare la ddp fra i due metalli senza dare informazioni sul valore del poten-ziale di ciascuno di essi Quindi il potenziale assoluto di un singolo elettrodo o diuna coppia redox (che egrave la stessa cosa) non puograve essere misurato Si egrave costretti perciogravea effettuare una misura relativa dei potenziali ponendo a confronto due semicellela semicella di cui si vuole misurare il potenziale e una semicella di riferimento co-struita in modo da assumere un potenziale costante
In pratica lrsquoelettrodo di cui si vuole misurare il potenziale viene accoppiato a unelettrodo di riferimento e si misura la ddp di questa pila in condizioni precisamentedefinite
In base a criteri di opportunitagrave pratica e a considerazioni termodinamiche si egravescelto come elettrodo di riferimento il cosiddetto elettrodo standard a idrogeno(SHE Standard Hydrogen Electrode) A tale elettrodo (fig 23) viene assegnato perconvenzione un potenziale di semicella di 00000 V valido a tutte le temperatureper una soluzione che contiene ioni idrogeno ad attivitagrave unitaria e idrogeno gassosoa fugacitagrave unitaria (in pratica alla pressione parziale di 1 bar)
Nella prima fasedi sviluppodellrsquoelettrochimica siparlava anche di elettrodonormale a idrogeno(NHE Normal HydrogenElectrode) riferendosi a unelettrodo di platinoimmerso in una soluzione1 N di un acido forte inquesta soluzione perogravelrsquoattivitagrave del protone egravecirca 08 e quindi ilpotenziale realedellrsquoelettrodo egrave ben diversoda zero Per questo motivonon egrave corretto usare lasigla NHE per indicare ilriferimento standard[Fonte RW RametteJ Chem Ed vol 64 10(ott 1987)]
Figura 23Elettrodo a idrogeno secondo la realizzazione ideata da SPLSoslashrensen Nel gorgogliatore entra idrogeno gassoso purissi-mo che attraversa la soluzione acida e lambisce la lamina diplatino platinato prima di uscire dal secondo gorgogliatore Idue gorgogliatori e lrsquoampolla centrale contengono la stessasoluzione acida La lamina di platino egrave saldata a un filo di plati-no che fuoriesce dal tappo e assicura il collegamento elettricocon lo strumento di misura Il rubinetto e il sifone mettono incontatto la soluzione acida con lrsquoaltro elettrodo formando cosigraveuna pila Quando lrsquoattivitagrave di H+ e la fugacitagrave di H2 sono unitarielrsquoelettrodo egrave in condizioni standard
13
CELLE GALVANICHE O PILE
Le tabelle dei potenziali standard di ossidoriduzione riportano appunto i po-tenziali di coppie redox ad attivitagrave unitaria misurati rispetto allo SHE (a 25 degC) Sele reazioni sono scritte secondo le convenzioni IUPAC cioegrave nel senso della ridu-zione (elettroni a sinistra) egrave piugrave preciso parlare di potenziali standard di riduzione(tab 21) Nelle tabelle le coppie con potenziale positivo sono tendenzialmentepiugrave ossidanti della coppia H+H2 mentre le coppie con potenziale negativo sono piugraveriducenti
In generale per due coppie qualsiasi quella con potenziale standard maggiore egraveossidante (nelle condizioni imposte) nei confronti della coppia con potenziale stan-dard minore Per esempio se si immerge un foglio di alluminio in una soluzionecontenente solfato di rame e solfato di alluminio (ad attivitagrave unitaria) il foglio di
TABELLA 21 | Alcuni potenziali standard di riduzione (Edeg) misurati a 25 degC
Semireazione Edeg(V) Semireazione Edeg(V)
O H e O H O3 2 22 2+ + ++ minus 2076 Cu e Cu s2
2+ minus+ ( ) 0342
S O e SO2 82
422 2minus minus minus+ 2010 Hg Cl s e Hg Cl2 2 2 2 2( )+ +minus minus
0268
H O H e H O2 2 22 2 2+ ++ minus 1776 AgCl s e Ag Cl( )+ +minus minus
0222
MnO H e MnO s H O4 2 24 3 2minus + minus+ + + ( ) 1679 Cu e Cu2+ minus ++ 0153
Ce e Ce4 3+ minus ++ 172 Sn e Sn in HCl M4 22 1+ minus ++ ( ) 0151
MnO H e Mn H O42
28 5 4minus + minus ++ + + 1507 S H e H S g+ ++ minus2 2 2 ( ) 0142
PbO H e Pb H O22
24 2 2+ + ++ minus + 1455 S O e S O4 6
22 3
22 2minus minus minus+ 008
Cl e Cl2 2 2+ minus minus 1358 AgBr s e Ag Br( )+ +minus minus
0071
Cr O H e Cr H O2 72 3
214 6 2 7minus + minus ++ + + 1350 2H ++ 2e-H2 00000
O g H e H O2 24 4 2( )+ ++ minus 1229 Pb e Pb2
2+ minus+ ndash0126
2 12 10 63 2 2IO H e I H Ominus + minus+ + + 1195 Sn e Sn22
+ minus+ ndash0137
Br l e Br2 2 2( )+ minus minus 1066 Ni e Ni2
2+ minus+ ndash0257
NO H e HNO H O3 2 23 2minus + minus+ + + 0934 Co e Co22
+ minus+ ndash0282
2 22
2
2Hg e Hg+ minus ++ 0920 Fe e Fe22
+ minus+ ndash0447
Cu I e CuI2+ minus minus+ + 086 Zn e Zn22
+ minus+ ndash0762
Ag e Ag+ minus+ 0799 Mn e Mn22
+ minus+ ndash1185
Hg e Hg2
22 2
+ minus+ 0797 Al e Al33
+ minus+ ndash1662
Fe e Fe3 2+ minus ++ 0771 Mg e Mg22
+ minus+ ndash2372
O g H e H O2 2 22 2( )+ ++ minus 0695 Na e Na+ minus+ ndash2710
I e I3 2 3minus minus minus+ 0536 Ca e Ca22
+ minus+ ndash2868
I e I2 2 2+ minus minus 0535 K e K+ minus+ ndash2931
Cu e Cu+ minus+ 0521 Li e Li+ minus+ ndash3040
Fe CN e Fe CN( ) ( )63
64minus minus minus+ 0358
14
2 Potenziometria
alluminio si dissolve mentre si deposita rame metallico Infatti i potenziali stan-dard delle due coppie redox sono
Cu2+ + 2endash Cu Edeg= +034 V
Al3+ + 3endash Al Edeg= ndash166 V
Nella soluzione quindi lo ione Cu2+ (forma ossidata della coppia con potenzialemaggiore) tende a ossidare Al (forma ridotta della coppia con potenziale minore)
TABELLA DEI POTENZIALI STANDARD DI RIDUZIONEAPPROFONDIMENTO
22 Tensione pratica (ddp) di una pila
Lrsquoinsieme dei conduttori di prima e di seconda specie che in sequenza opportunaformano una pila (o in generale un sistema elettrochimico) costituisce una catenagalvanica La differenza di potenziale (Ecella) che si misura ai capi di una pila durantelrsquoerogazione di corrente egrave dovuta a diversi contributi piugrave precisamente egrave uguale allasomma algebrica di tutte le cadute di tensione che si verificano lungo lrsquointero circuito
Ecella= E1 + E2 + E3 + E4 + E5 (25)
dove bull E1 egrave la ddp dovuta allrsquoeventuale passaggio di corrente nel circuito (cadutaohmica) bull E2 la ddp di contatto metallometallo (tensione di Volta) bull E3 la ddpdi contatto soluzionesoluzione (tensione o potenziale di giunzione liquida) bull E4 edE5 le ddp di contatto metallosoluzione (tensione di Nernst) per ciascun elettrodo
Esaminiamo ora il significato dei singoli contributi
Caduta ohmica Quando la cella egrave attraversata da corrente inevitabilmente si ve-rifica una caduta di tensione E = R times i (prima legge di Ohm) Ovviamente se lamisura del potenziale di cella viene effettuata in condizioni tali da minimizzareo eliminare il passaggio di corrente (cioegrave a circuito aperto) la caduta ohmica siannulla (cioegrave E1= 0)
Tensione di Volta Quando due diversi metalli vengono posti a contatto si generasempre una ddp Questo fenomeno detto effetto Volta egrave dovuto al fatto che glielettroni di conduzione sono trattenuti con diversa energia dai diversi metalli Per-ciograve il contatto fra due metalli provoca un trasferimento di elettroni istantaneo daparte del metallo che li trattiene con minore energia Il processo perograve non prose-gue indefinitamente il trasferimento di elettroni infatti prosegue fino allrsquoequili-brio quando insorge una ddp (in genere di pochi millivolt) sufficiente a bloccarlo
Si puograve verificare sperimentalmente (e dimostrare) che la ddp agli estremi diuna catena di conduttori di prima specie egrave uguale a quella che si stabilisce se i duemetalli che ne costituiscono gli estremi vengono posti a diretto contatto (fig 24)Di conseguenza se gli ingressi del misuratore di tensione sono costituiti dallo stessometallo lrsquoeffetto Volta complessivo egrave nullo (E2= 0)
In altri termini la formaossidata della coppia conpotenziale piugrave alto egraveossidante nei confrontidella forma ridotta dellacoppia con potenzialepiugrave basso
A rigore si dovrebbe usareil simbolo V (o ∆V)percheacute si tratta di unaddp misurata in una pilain funzione e dunquenon di una fem Il pedicelaquocellaraquo puntualizza che sitratta in generale di unacella elettrochimica
R egrave la resistenza delconduttore e i lrsquointensitagravedi corrente
15
CELLE GALVANICHE O PILE
Potenziale di giunzione liquida In una pila le due semicelle sono separate matenute in contatto elettrico mediante un setto poroso o un ponte salino che con-sente un mescolamento lentissimo (praticamente nullo) delle soluzioni Questidispositivi (si veda la figura 25) perograve creano unrsquoulteriore caduta di tensione fragli elettrodi detta potenziale di giunzione liquida (Eg) o anche potenziale dicontatto (o di diffusione) Il potenziale di giunzione liquida puograve essere sia po-sitivo sia negativo e quindi fa aumentare o viceversa diminuire la ddp fra glielettrodi
Lrsquoinsorgere di un potenziale di giunzione egrave causato dal fatto che gli ioni si dif-fondono con diversa mobilitagrave attraverso le superfici di contatto di due mezzi di-versi un setto poroso per esempio egrave diversamente permeabile agli ioni propriosecondo la loro mobilitagrave
Tensione di Nernst I potenziali di contatto metallosoluzione (E4 E5) si calco-lano in teoria mediante la legge di Nernst e perciograve sono detti potenziali nern-stiani
LA MOBILITAgrave DEGLI IONI IN SOLUZIONEAPPROFONDIMENTO
23 Calcolo della tensione teorica (fem) di una pilaSe si opera in modo da rendere trascurabili i primi tre termini dellrsquoequazione (22)la ddp ai capi della pila coincide in pratica con la sua fem che puograve essere cal-colata semplicemente in base agli ultimi due termini cioegrave ai potenziali di elettrodoNei calcoli occorre tenere presente che
a la fem di una pila in quanto strettamente collegata al lavoro da essa compiutodeve necessariamente avere segno positivo
b lrsquoelettrodo a potenziale maggiore su cui avviene la riduzione egrave il catodo lrsquoelet-trodo a potenziale minore su cui avviene lrsquoossidazione egrave lrsquoanodo
Di conseguenza la fem di una pila cioegrave di una cella elettrochimica ottenuta colle-gando due semicelle (catodica e anodica) egrave espressa dalla seguente relazione
Ecella = Ec ndash Ea (26)
ovvero
Ecella = Emaggiore ndash Eminore (27)
Questa seconda scrittura mostra chiaramente che la fem della pila egrave sempre posi-tiva anche nel caso in cui i potenziali delle due semicelle siano entrambi negativi
Indichiamo con Ec ilpotenziale del catodo (opotenziale catodico) econ Ea il potenzialedellrsquoanodo (o potenzialeanodico)
Figura 24Nonostante ogni superficie di contatto fra due metallisia sede di una ddp dovuta allrsquoeffetto Volta la ddpche si instaura fra rame e zinco egrave la stessa sia nel caso(a) sia nel caso (b) Infatti se cosigrave non fosse chiudendola catena aperta (a) si dovrebbe osservare un passaggiodi corrente e questo in realtagrave non avviene
a b
16
2 Potenziometria
ESEMPIO 1UNA IPOTETICA PILA Egrave COSTITUITA DALLE COPPIE REDOX Al3+Al E Ni2+NiQUAL Egrave LA FEM DELLA PILA SE LE ATTIVITAgrave DI TUTTE LE SPECIE IONICHE SONOUNITARIE
Dal momento che le attivitagrave sono unitarie il calcolo fornisce la tensione (o forzaelettromotrice) standard della pila
Innanzitutto dalla tabella dei potenziali standard si ricavano i potenziali stan-dard per ciascuna coppia redox
Al3+ + 3endash Al Eo
= ndash166 V
Ni2+ + 2endash Ni Eo
= ndash026 V
Lrsquoelettrodo della coppia Ni2+Ni costituisce il catodo percheacute ha il potenziale mag-giore mentre lrsquoelettrodo della coppia Al3+Al costituisce lrsquoanodo percheacute ha il poten-ziale minore Si puograve anche costruire un diagramma di questo tipo
Al3+Al Ni2+Ni H+H2
ndash166 ndash026 00000 Edeg(V rif a SHE)
Quindi la fem della pila in condizioni standard egrave
Ecella= Ec ndash Ea= Emaggiore ndash Eminore= ndash026 ndash (ndash166)= +140 V
La reazione di ossidoriduzione che genera la pila si ottiene formalmente combi-nando le due semireazioni bilanciate quella di riduzione al catodo e quella di os-sidazione allrsquoanodo Ciascuna semireazione deve essere moltiplicata per un fattorenumerico tale che il numero di elettroni ceduti dalla specie che si ossida sia uguale aquello degli elettroni acquistati dalla specie che si riduce Quindi nel caso dellrsquoesem-pio proposto si moltiplica la semireazione della coppia Al3+Al per 2 e quella dellacoppia Ni2+Ni per 3
2 middot (Al Al3+ + 3endash) Edeg= ndash(ndash166 V) (ndash)
3 middot (Ni2+ + 2endash Ni) Edeg= ndash026 V (+)
2Al + 3Ni2+ 2Al3+ + 3Ni Edeg= +140 V
Attenzione per ottenere il bilancio della reazione di cella si moltiplica per un coeffi-ciente opportuno ciascuna semireazione ma non il rispettivo potenziale Infatti i po-tenziali di elettrodo (e quindi anche il potenziale di cella) esprimono un lavoro elettricoper unitagrave di carica e perciograve sono proprietagrave intensive che non dipendono dalla quantitagravedi materia contenuta nel sistema ovvero dal numero di cariche elettriche trasportate
Se le attivitagrave non sono unitarie per calcolare il potenziale di elettrodo occorreapplicare lrsquoequazione di Nernst
Egrave ovvio comunque che il lavoro complessivo che puograve essere fornito da una piladipende anche dalla massa e dalla geometria degli elettrodi Per questo motivo unapila o un insieme di pile (cioegrave una batteria) che viene utilizzata per esempio permuovere un veicolo puograve avere dimensioni ingombranti Questo accadeva fino anon molti anni fa per le vecchie batterie al piombo ora sempre piugrave sostituite dabatterie come quelle al litio decisamente piugrave compatte e che infatti stanno rendendopossibile il progressivo passaggio allrsquoauto parzialmente o completamente elettrica
UNA IPOTETICA PILA Egrave COSTITUITA DALLE COPPIE REDOX Al3+Al E Ni2+NiQUAL Egrave LA FEM DELLA PILA SE LE ATTIVITAgrave DI TUTTE LE SPECIE IONICHE SONOUNITARIE
Nella pila la reazionedella coppiadella coppia Ni2+Ni(Ni2+ si riduce) avvienenel senso conforme allaconvenzione adottata per ipotenziali (elettroni asinistra) invece lareazione della coppiaAl3+Al (Al si ossida)avviene nel senso oppostoa quello convenzionalePerciograve il potenziale Edegdella coppia Al3+Al vieneconsiderato con segnoopposto a quello tabulato(+166 V) Se si sommaalgebricamente ilpotenziale dellrsquoelettrodoche si riduce (Ec) conquello dellrsquoelettrodo che siossida cambiato di segno(Ea) la tensione della pilarisulta positiva
17
CELLE GALVANICHE O PILE
ESEMPIO 2UNA IPOTETICA PILA Egrave COSTITUITA DALLE COPPIE REDOX Al3+Al E Ni2+NiQUAL Egrave LA FEM DELLA PILA A 25 degC SE LE CONCENTRAZIONI DELLE SPECIEIONICHE SONO RISPETTIVAMENTE [Al3+] = 2 10ndash2 M E [Ni2+] = 10ndash2 M
Approssimando le attivitagrave con le concentrazioni si ottiene
La situazione non egrave sostanzialmente cambiata rispetto alle condizioni standardpercheacute anche in questo caso la reazione di cella comporta lrsquoossidazione dellrsquoallumi-nio e la riduzione del nichel La fem della pila quindi egrave
Ecella= Ec ndash Ea= ndash032 ndash (ndash167)= +135 V
24 Alcuni tipi di pile
Pila DaniellUna semicella egrave costituita da una lamina di rame immersa in una soluzione diCuSO4 lrsquoaltra semicella da una lamina di zinco immersa in una soluzione di ZnSO4
(fig 25) Le due semicelle sono separate da un setto poroso (in pratica una mem-brana di vetro sinterizzato o analogo materiale inerte) oppure si trovano in duediversi recipienti collegati da un ponte salino
Le reazioni di elettrodo sono
Zn2+ + 2endash Zn Edeg= ndash0762 V
Cu2+ + 2endash Cu Edeg= 0342 V
Le concentrazioni dei sali nelle rispettive semicelle sono in genere tali da renderenegativo il semielemento di zinco che perciograve tende a cedere elettroni al rame (ossi-dandosi) La lamina di zinco egrave dunque il polo negativo (anodo) della pila e il rameegrave il polo positivo (catodo)
La rappresentazione della catena galvanica di questa pila secondo le convenzioniIUPAC egrave
(ndash) Zn(s)|ZnSO4(aq)||CuSO4(aq)|Cu(s) (+)
UNA IPOTETICA PILA Egrave COSTITUITA DALLE COPPIE REDOX Al3+Al E Ni2+NiQUAL Egrave LA FEM DELLA PILA A 25 degC SE LE CONCENTRAZIONI DELLE SPECIEIONICHE SONO RISPETTIVAMENTE [Al3+] = 2 10ndash2 M E [Ni2+] = 10ndash2 M
Si noti che se i duescomparti non fosseroscomparti non fosseroben separati dal settoben separati dal settoporoso ben presto gli ioniporoso ben presto gli ionirame disponibilirame disponibiliraggiungerebbero lrsquoraggiungerebbero lrsquoanododi zinco ossidandolo eandando a depositarsi sudi esso come Cumetallico nondiversamente da quanto sipuograve osservareimmergendo una barrettadi zinco in una soluzionedi solfato di rameesaurendo quindirapidamente la pila esviluppando calore
Figura 25Pila Daniell (a) con settoporoso e (b) con pontesalino
a b
18
2 Potenziometria
La coppia di barrette verticali (||) al centro rappresenta il setto poroso o il pontesalino che separano le due semicelle lrsquoanodo egrave scritto a sinistra e per ciascun elet-trodo la forma ridotta della coppia redox egrave scritta verso lrsquoesterno Le lettere scrittefra parentesi indicano lo stato fisico di ogni specie chimica
La reazione di cella egrave
Zn + Cu2+ Zn2+ + Cu
Per calcolare la fem teorica di questa pila che puograve anche trovarsi in condizionidiverse da quelle standard si applica la legge di Nernst a ciascuna semicella
(28)
(29)
I potenziali standard delle due semicelle sono cosigrave diversi fra loro che nelle normalicondizioni operative di una pila Daniell il rame rappresenta il polo positivo e lozinco il polo negativo
Sottraendo il potenziale minore da quello maggiore si ottiene il potenziale dicella
Ecella = ECu2+Cu - EZn2+Zn
Ponendo Edegcella = EdegCu2+Cu ndash EdegZn2+Zn (= 0342 V + 0762 V) e quindi sottraendo la(28 dalla 29) si ricava infine
Questa equazione consente dunque di calcolare il potenziale di Nernst se egrave notoil valore effettivo dellrsquoattivitagrave degli ioni Zn2+ e Cu2+ Tuttavia il calcolo si presta aerrori anche significativi lrsquoattivitagrave degli ioni per esempio varia in funzione dellaforza ionica della soluzione e non puograve essere calcolata Perciograve la fem reale piugraveesattamente la ddp che si misura si discosta dal valore calcolato sostanzialmenteper due motivi
a il sistema non si comporta in maniera ideale (per esempio gli elettrodi possonopolarizzarsi)
b il contributo della caduta ohmica (gtequazione 25) puograve essere praticamente an-nullato se nel circuito viene fatta circolare una corrente trascurabile invece ilpotenziale di giunzione liquida per quanto piccolo non puograve essere soppresso enon egrave prevedibile in base a equazioni teoriche
Pile a concentrazioneIn questo tipo di pila le due semicelle contengono due soluzioni di una stessa cop-pia redox ma a diversa concentrazione gli elettrodi sono inerti oppure dello stes-so metallo e le semicelle sono collegate da un setto poroso o da un ponte salino(fig 26)
In questo calcolotrascuriamo i contributidei termini E1 E2 E3 dellaequazione (25)
Lrsquoequazione rappresentain pratica la legge diNernst applicata allareazione redox globalescritta nel verso dellaspontaneitagrave tenendoconto degli elettroniscambiati (2) e inserendonellrsquoargomento dellogaritmo lrsquoinverso delquoziente di reazione
+
19
CELLE GALVANICHE O PILE
Le due soluzioni si scambiano elettroni attraverso il circuito esterno mentre ilsetto poroso (o il ponte salino) che le collega consente il passaggio di ioni e quin-di chiude il circuito Il sistema raggiunge lrsquoequilibrio quando le attivitagrave degli ioninelle due semicelle diventano uguali perciograve egrave prevedibile che nella soluzione piugravediluita avvenga lrsquoossidazione il rame metallico si dissolve e si formano ioni Cu2+ insoluzione questo dunque egrave lrsquoanodo Contemporaneamente gli elettroni passanonellrsquoaltro comparto (a destra in figura 26) attraverso il circuito esterno e riduconogli ioni Cu2+ che si depositano sullrsquoelettrodo come rame metallico questo dunqueegrave il catodo
In pratica egrave come se gli ioni Cu2+ si trasferissero dalla soluzione piugrave concentrataalla soluzione piugrave diluita Queste pile dunque trasformano in lavoro elettrico lrsquoe-nergia che si libera nel processo spontaneo con cui due soluzioni a diretto contattotendono a raggiungere lrsquoequilibrio di concentrazione
La rappresentazione convenzionale della catena elettrodica di questa pila a con-centrazione egrave la seguente
(-) Cu(s) |Cu2+(001 M)||Cu2+(1 M)|Cu(s) (+)
Per calcolare la tensione teorica della pila si applica la legge di Nernst a ciascun elet-trodo Approssimando le attivitagrave con le concentrazioni (a 25 degC) si ottiene
(soluzione piugrave diluita anodo)
(soluzione piugrave concentrata catodo)
Quindi
Ecella= Emaggiore ndash Eminore= 0342- 0283= 0059 V
ALTRI TIPI DI CELLE GALVANICHE O PILEAPPROFONDIMENTO
Figura 26Pila a concentrazione il compartoanodico (a sinistra) contiene ioni Cu2+
in concentrazione 001 M e il com-parto catodico (a destra) contieneioni Cu2+ in concentrazione 1 M Ilcollegamento fra le due semicelle egraverealizzato con un ponte salino
20
2 Potenziometria
STRUMENTAZIONEIn potenziometria si misura la differenza di potenziale che si stabilisce fra due semi-celle allo scopo di determinare la concentrazione di uno ione o per seguire lrsquoanda-mento di una titolazione
Il dispositivo completo per una misura potenziometrica (fig 27) consiste es-senzialmente di
bull un potenziometro o meglio un millivoltmetro elettronicobull un elettrodo di riferimentobull un elettrodo di misura
Il potenziometro serve per misurare la ddp fra i due elettrodi senza alterare il lorostato di equilibrio perciograve si lavora a corrente praticamente nulla
Gli elettrodi collegati al potenziometro sono immersi nella soluzione su cui sieffettuano le misure Lrsquoelettrodo di riferimento egrave costruito in modo tale da mante-nere costante il suo potenziale di conseguenza ogni variazione di ddp misurata egraveimputabile esclusivamente allrsquoelettrodo di misura (piugrave precisamente alla soluzioneanalizzata)
ELETTRODI DI RIFERIMENTOLrsquoelettrodo standard a idrogeno (SHE gtparagrafo 21) egrave lrsquoelettrodo di riferimentoprimario Tuttavia nella pratica quotidiana di laboratorio si usano elettrodi di ri-ferimento secondari piugrave semplici e maneggevoli che hanno comunque la proprie-tagrave di mantenere il proprio potenziale costante a temperatura costante Tratteremoora in maggior dettaglio gli elettrodi di uso piugrave comune
31 Elettrodo ad argentocloruro drsquoargento
Si tratta senzrsquoaltro dellrsquoelettrodo piugrave diffuso Il dispositivo egrave costituito da un sem-plice filo drsquoargento rivestito di AgCl e immerso in una soluzione di KCl (egrave dunqueun elettrodo di seconda specie) Il tutto egrave contenuto in un tubicino di vetro dotatodi setto poroso per assicurare il contatto elettrico con lrsquoesterno ovvero con la so-luzione in cui viene immerso lrsquooggetto dellrsquoanalisi
Figura 27Rappresentazione schematica deldispositivo completo per misurepotenziometriche
3
21
ELETTRODI DI RIFERIMENTO
La rappresentazione convenzionale dellrsquoelettrodo (fig 28) egrave
Ag(s)|AgCl(aq)|KCl(aq)
La reazione di elettrodo egrave
AgCl + endash Ag + Clndash
E il potenziale di elettrodo
E= EdegAgClAg
Considerando unitarie le attivitagrave dei solidi puri si ottiene
E= EdegAgClAg ndash 01984 10ndash3 T log[Clndash] (210)
Se lrsquoattivitagrave degli ioni cloruro egrave costante (a temperatura costante) il potenziale dielettrodo rimane costante Gli elettrodi piugrave comuni contengono soluzioni sature diKCl (circa 42 M) e perciograve sono detti saturi (SSC Saturated Silver-Silver ChlorideElectrode) A 25 degC il potenziale di SSC vale 0197 V Questo elettrodo puograve essereusato fino a 105 degC Nella tabella 1 ndash lab 1 (gtpag 39) sono riportati i potenziali alvariare della temperatura per lrsquoelettrodo saturo e 3 M
Gli anioni (come il solfuro) che formano con Ag+ sali meno solubili di AgClpossono danneggiare questo tipo di elettrodo Anche gli ossidanti e i riducenti fortie gli agenti complessanti possono interferire con la reazione di elettrodo per proteg-gere lrsquoelettrodo da queste sostanze si usa un elettrolita intermedio come nel casodellrsquoelettrodo a calomelano saturo (SCE gtparagrafo 32)
Gli elettrodi ad argentocloruro di argento sono usati come riferimento internonegli elettrodi a vetro (gtparagrafo 41)
32 Elettrodo a calomelano
laquoCalomelanoraquo egrave il nome comune del cloruro mercuroso (I) Hg2Cl2 che fa parteappunto di questo elettrodo (fig 29a) La rappresentazione convenzionale dellrsquoe-lettrodo egrave
Hg(l)|Hg2Cl2(s)|KCl(aq)
La reazione di elettrodo egrave
Hg2Cl2 + 2endash 2Hg + 2Clndash
e il potenziale di elettrodo in base alla legge di Nernst
In condizioni standard lrsquoattivitagrave di solidi e liquidi puri egrave considerata uguale a 1quindi
da cui
ndash 01984 10ndash3 T log|Clndash| (211)
Sono anche molto diffusigli elettrodi contenentiKCl 3 M cioegrave quasisaturi Il vantaggio egrave chein queste soluzioni non siformano cristalli di KClche possono danneggiarelrsquoelettrodo ostruendoil setto poroso che sta sulfondo
Figura 28Elettrodo ad AgAgCILa soluzione tamponeinterna contiene ioni K+
e CIndash ad attivitagrave costante
22
2 Potenziometria
Il potenziale dellrsquoelettrodo a calomelano dunque dipende solo dallrsquoattivitagrave delloione cloruro e dalla temperatura Se la temperatura egrave costante e lrsquoattivitagrave dello ionecloruro nella soluzione interna allrsquoelettrodo non varia il potenziale rimane costante
Gli elettrodi a calomelano piugrave comuni contengono soluzioni sature di KCl (circa42 M) e perciograve sono detti saturi (SCE Saturated Calomel Electrode) Si usano ancheelettrodi a KCl 1 M e 01 M la tabella 22 riporta il potenziale assunto da questielettrodi secondo la concentrazione di KCl
TABELLA 22 | Potenziale (mV) di alcuni elettrodi di riferimento a 25 degC
AgAgCl Calomelano HgHgO HgHgSO4 Thalamid
KCl 01 M 288 KCl 01 M 334 NaOH 01 M 165 H2SO4 05 M 682 KCl 3 M -567
KCl 1 M 235 KCl 1 M 280 NaOH 1 M 140 K2SO4 sat 650 KCl sat -577
KCl 3 M 210 KCl 35 M 250
KCl 35 M 205 KCl sat 241
KCl sat 199 NaCl sat 236
NaCl 3 M 209
NaCl sat 197
Lrsquoelettrodo a calomelano puograve essere usato fino a circa 70 degC a temperature piugrave alteil calomelano si dismuta (Hg2Cl2 Hg + HgCl2)
I solfuri gli ossidanti i forti riducenti e gli agenti complessanti che formanoamalgami con gli ioni Hg2
2+ possono danneggiare questo tipo di elettrodo Perciogravequando si lavora in presenza di queste sostanze si usano elettrodi a doppia giun-zione (fig 29b) in cui fra lrsquoelettrodo e la soluzione egrave interposto un contenitoreriempito con un elettrolita intermedio (per esempio KNO3)
Va infine segnalata la tendenza a non usare il mercurio per motivi tossicologicie questo spiega il progressivo abbandono nella pratica comune di questo tipo dielettrodo con grande rammarico dagli elettrochimici percheacute lrsquoelettrodo a calomela-no egrave il piugrave stabile
bullELETTRODI DI PRIMA E DI SECONDA SPECIE bullALTRI ELETTRODI DI RIFERIMENTO
APPROFONDIMENTI
Figura 29(a) Elettrodo a calomelano (b) Nella versione adoppia giunzione egrave presente una seconda cameraper lrsquoelettrolita intermedio che viene immessoattraverso la bocchetta laterale il setto porosoassicura il contatto elettrico con la soluzioneesterna
a b

9
ELETTRODI E POTENZIALE DI ELETTRODO
dove bull E egrave il potenziale di elettrodo (in volt V) bull R la costante dei gas (che vale831451 Jmol times K) bull T la temperatura assoluta (in kelvin K) bull F la costante diFaraday (che vale 96 485 coulombmol) bull n il numero di elettroni scambiati nellasemireazione bull frac12 frac12 indica lrsquoattivitagrave di ciascuna specie scritta fra le due barrette
Edeg egrave il potenziale standard della coppia redox cioegrave il potenziale che la semicellaassume alla temperatura di 25 degC (29815 K) quando tutte le specie hanno attivitagraveunitaria e i gas si trovano alla pressione parziale di 1 bar (100 kPa) o piugrave precisa-mente hanno fugacitagrave unitaria
Lrsquoattivitagrave di ogni specie egrave uguale al prodotto g ∙ C dove g egrave il coefficiente di atti-vitagrave e C la concentrazione analitica espressa in moli su litro (molL)
Se si tiene conto dei coefficienti di attivitagrave e si inseriscono le parentesi quadre [ ]che indicano le concentrazioni in molL (gtpag 33) si ottiene
E ERT
nF
a b
c d= +deg ln
[ox] [B]
[red] [D]acute (22)
dove al posto di Eo compare il cosiddetto potenziale formale (Eoacute) della coppia redoxin oggetto
Il potenziale formale puograve differire in modo significativo dal potenziale standarde si rivela piugrave utile di esso per una valutazione anche solo orientativa del compor-tamento della coppia redox in quanto tiene meglio conto delle reali condizioni incui si opera per esempio il pH della soluzione Ricordiamo infatti che il pH allrsquointer-no di una cellula vale circa 7 (a parte pochissime eccezioni) per cui il potenziale re-dox standard che fa riferimento a pH 0 non risulta molto adatto a descriverne de-terminate caratteristiche Inoltre il potenziale standard delle coppie O2H2O vale123 V ma scende a 081 V a pH 7 Analogamente il potenziale della coppia deidro-ascorbicoascorbico passa da +390 V a +0058 V diventando nettamente riducentecome si addice alle ben note proprietagrave antiossidanti della vitamina C
Quando si lavora con soluzioni molto diluite (al di sotto di 10ndash3 M) si puograveassumere con buona approssimazione che il coefficiente di attivitagrave di tutte lespecie sia uguale a 1 In tali condizioni se si inserisce il valore numerico di RF e ilfattore numerico per la conversione ai logaritmi decimali si ottiene
(23)
Alla temperatura di 25 degC (29815 K) la legge di Nernst assume la sua forma piugravenota e usata
+ (24)
Per esempio per la semireazione
Cu2+ + 2endash Cu
la legge di Nernst (a 25 degC) assume la forma
+
La costante di Faradayequivale alla caricaelettrica di un numerodi Avogadro (cioegrave diuna mole) di elettroniUna mole contiene602214076 times 1023
entitagrave elementari(gtpag 457)
La fugacitagrave egrave la grandezzafisica adottata per i gas alposto della pressione alloscopo di tener conto delloro comportamento nonideale
ln = 23026 log
10
2 Potenziometria
In questa equazione non compare la concentrazione della forma ridotta percheacutelrsquoattivitagrave di una specie chimica pura nelle condizioni standard viene convenzio-nalmente assunta uguale a 1
In effetti spesso si lavora con soluzioni non particolarmente diluite quindi neicalcoli bisogna fare riferimento alle attivitagrave invece che alle concentrazioni di con-seguenza lrsquoequazione (24) diventa
+ log
IL POTENZIALE FORMALEAPPROFONDIMENTO
13 Polarizzazione degli elettrodiIn tutti i casi in cui il sistema dellrsquoelettrodo si discosti dalle condizioni di equilibriotermodinamico la legge di Nernst diventa inadeguata a descrivere il sistema stessoCiograve accade per esempio quando allrsquoelettrodo viene imposto un potenziale arbitra-rio eo la corrente che lo attraversa egrave molto intensa in questi casi il potenziale dielettrodo risulta diverso da quello previsto in base alla legge di Nernst e si dice chelrsquoelettrodo egrave polarizzato
In particolare quando la concentrazione degli ioni alla superficie di un elettrodoegrave diversa da quella nel resto della soluzione si verifica una polarizzazione di con-centrazione in quanto il sistema non si trova nelle condizioni di equilibrio cui fariferimento il modello di Nernst
La polarizzazione puograve derivare anche dal cambiamento dello stato chimico eofisico della superficie di elettrodo oppure dal verificarsi di reazioni chimiche colla-terali alla reazione di elettrodo
LEGGE DI NERNST E GRANDEZZE TERMODINAMICHE COLLEGATEAPPROFONDIMENTO
CELLE GALVANICHE O PILESe si collegano elettricamente fra loro due semicelle (elettrodi) si realizza un dispo-sitivo che puograve erogare corrente si tratta di una cella galvanica (o pila fig 22)
In una pila le due semicelle sono separate da un setto poroso o da un ponte salinoche hanno il solo compito di assicurare il contatto elettrico evitando il rapido me-scolamento delle soluzioni Secondo le caratteristiche dei singoli elettrodi ai duecapi della pila si crea una differenza di potenziale (ddp) detta anche tensione (opotenziale) di cella che quando raggiunge il suo valore massimo egrave detta forzaelettromotrice (abbreviata fem e indicata con il simbolo E) tutti questi terminiindicano che la pila puograve compiere un lavoro (elettrico)
Dal punto di vista fisico la fem di una pila corrisponde al lavoro massimo cheessa puograve fornire In altri termini la fem equivale al lavoro per unitagrave di carica ne-cessario per mantenere costante la ddp fra i due elettrodi
La fem coincide con la ddp solo nel caso in cui il sistema lavori in condizionidi reversibilitagrave termodinamica (ovvero a corrente nulla) In un circuito chiuso in-
Il termine polarizzazionesoprattutto nelleapplicazioni viene spessousato in modo fin troppogenerico per definiresituazioni poco chiare peresempio nellrsquoindustriagalvanica si parla spesso dipolarizzazione quando ilprocesso produttivo nonsegue lrsquoandamento previstoanche se le vere cause sonotutte da definire
2
La fem viene misurata acircuito aperto (ossia incondizioni di equilibrio acorrente nulla) e conterminali di platinomediante un potenziometroo un voltmetro elettronico
Se le soluzioni simescolassero ben prestosi verificherebberoreazioni chimiche direttelaquoindesiderateraquo (peresempio fra elettrodi esoluzione) con rapidoesaurimento del sistema(pila Daniell gtparagrafo24) e sviluppo di calore
11
CELLE GALVANICHE O PILE
vece dove la corrente circola (e non egrave nulla) la ddp in uscita dalla pila egrave sempreminore della fem a causa della laquocaduta di tensioneraquo provocata dal passaggio dicorrente Vale infatti con buona approssimazione la relazione
ddp= fem ndash Ri
dove bull R egrave la resistenza del circuito bull i lrsquointensitagrave di corrente
Per esempio se si collegauna comune pila da 45 Va una lampadina e simisura la ddp ai capi delcircuito si ottiene unvalore piugrave basso (peresempio 33 V)Il valore nominale ditensione sullrsquoinvolucrodella pila infatti indica lafem non la ddp inuscita (che dipende dallaquocaricoraquo effettivo delcircuito)
Figura 22Cella galvanica (pila) Il setto poroso divide (pur mantenen-doli in contatto elettrico fra loro) i due comparti del recipien-te che costituiscono le due semicelle Queste possono con-tenere due diversi elettroliti oppure lo stesso elettrolita maa diversa concentrazione in modo che allrsquoinizio i potenzialisiano diversi Nel primo caso le due lamine sono in generedi metalli differenti nel secondo caso sono uguali fra loroIl circuito esterno egrave formato da conduttori di prima specie ecomprende il dispositivo per la misura della tensione dellapila la corrente (i) e gli elettroni (e-) percorrono il circuito indirezioni opposte
Lrsquoelettrodo piugrave ricco di elettroni cioegrave a potenziale minore egrave detto anodo e costitu-isce il polo negativo della pila mentre lrsquoelettrodo piugrave povero di elettroni cioegrave a po-tenziale maggiore egrave detto catodo e costituisce il polo positivo Attraverso il circuitoesterno lrsquoanodo tende a cedere elettroni al catodo sotto la laquospintaraquo della spontaneatendenza del sistema a eguagliare i potenziali delle due semicelle
Il flusso di elettroni dallrsquoanodo al catodo altera quindi lo stato drsquoequilibrio ini-ziale di ciascuna semicella esso puograve venire ripristinato mediante reazioni di ossida-zione allrsquoanodo e contemporaneamente mediante reazioni di riduzione al catodoInfatti in base alla legge di Nernst (gtparagrafo 12) le reazioni di ossidazione tendo-no a innalzare il potenziale di elettrodo percheacute aumenta la concentrazione dellaforma ossidata (al numeratore dellrsquoargomento logaritmico) viceversa le reazioni diriduzione tendono ad abbassarlo La corrente che si stabilisce nel circuito egrave dovutaalla tendenza spontanea del sistema a raggiungere lrsquoequilibrio termodinamico per-ciograve quando i potenziali dei due elettrodi diventano uguali il flusso di elettronicessa e si dice che la pila egrave laquoscaricaraquo
La pila quindi egrave un dispositivo mediante il quale gli elettroni in gioco in unareazione redox passano attraverso un circuito da una specie chimica a unrsquoaltraOssidante e riducente infatti non vengono posti direttamente a contatto cosiccheacute glielettroni che si scambierebbero sono laquocostrettiraquo a passare attraverso il circuitoesterno Ciograve consente di convertire in energia elettrica e quindi in lavoro lrsquoenergiache si libera in un processo redox spontaneo che genererebbe calore il flusso di
12
2 Potenziometria
corrente si arresta quando egrave soddisfatta la costante di equilibrio della reazione chegenera la pila
Per ragioni storiche il funzionamento delle pile egrave stato spiegato in termini di unflusso di corrente elettrica dovuto a inesistenti cariche elettriche positive che migra-no dal polo a potenziale maggiore (catodo) verso il polo a potenziale minore (ano-do) Per questo motivo il verso convenzionale della corrente elettrica egrave opposto aquello in cui effettivamente circolano gli elettroni
21 Potenziali standard di ossidoriduzioneIn linea di principio per misurare la ddp fra una lamina di metallo e la soluzionein cui egrave immersa (si veda la figura 21a) occorre inserire il dispositivo di misura inmodo che un terminale sia collegato al metallo e lrsquoaltro alla soluzione In questomodo tuttavia si crea un nuovo contatto metallosoluzione e lo strumento finiscecol misurare la ddp fra i due metalli senza dare informazioni sul valore del poten-ziale di ciascuno di essi Quindi il potenziale assoluto di un singolo elettrodo o diuna coppia redox (che egrave la stessa cosa) non puograve essere misurato Si egrave costretti perciogravea effettuare una misura relativa dei potenziali ponendo a confronto due semicellela semicella di cui si vuole misurare il potenziale e una semicella di riferimento co-struita in modo da assumere un potenziale costante
In pratica lrsquoelettrodo di cui si vuole misurare il potenziale viene accoppiato a unelettrodo di riferimento e si misura la ddp di questa pila in condizioni precisamentedefinite
In base a criteri di opportunitagrave pratica e a considerazioni termodinamiche si egravescelto come elettrodo di riferimento il cosiddetto elettrodo standard a idrogeno(SHE Standard Hydrogen Electrode) A tale elettrodo (fig 23) viene assegnato perconvenzione un potenziale di semicella di 00000 V valido a tutte le temperatureper una soluzione che contiene ioni idrogeno ad attivitagrave unitaria e idrogeno gassosoa fugacitagrave unitaria (in pratica alla pressione parziale di 1 bar)
Nella prima fasedi sviluppodellrsquoelettrochimica siparlava anche di elettrodonormale a idrogeno(NHE Normal HydrogenElectrode) riferendosi a unelettrodo di platinoimmerso in una soluzione1 N di un acido forte inquesta soluzione perogravelrsquoattivitagrave del protone egravecirca 08 e quindi ilpotenziale realedellrsquoelettrodo egrave ben diversoda zero Per questo motivonon egrave corretto usare lasigla NHE per indicare ilriferimento standard[Fonte RW RametteJ Chem Ed vol 64 10(ott 1987)]
Figura 23Elettrodo a idrogeno secondo la realizzazione ideata da SPLSoslashrensen Nel gorgogliatore entra idrogeno gassoso purissi-mo che attraversa la soluzione acida e lambisce la lamina diplatino platinato prima di uscire dal secondo gorgogliatore Idue gorgogliatori e lrsquoampolla centrale contengono la stessasoluzione acida La lamina di platino egrave saldata a un filo di plati-no che fuoriesce dal tappo e assicura il collegamento elettricocon lo strumento di misura Il rubinetto e il sifone mettono incontatto la soluzione acida con lrsquoaltro elettrodo formando cosigraveuna pila Quando lrsquoattivitagrave di H+ e la fugacitagrave di H2 sono unitarielrsquoelettrodo egrave in condizioni standard
13
CELLE GALVANICHE O PILE
Le tabelle dei potenziali standard di ossidoriduzione riportano appunto i po-tenziali di coppie redox ad attivitagrave unitaria misurati rispetto allo SHE (a 25 degC) Sele reazioni sono scritte secondo le convenzioni IUPAC cioegrave nel senso della ridu-zione (elettroni a sinistra) egrave piugrave preciso parlare di potenziali standard di riduzione(tab 21) Nelle tabelle le coppie con potenziale positivo sono tendenzialmentepiugrave ossidanti della coppia H+H2 mentre le coppie con potenziale negativo sono piugraveriducenti
In generale per due coppie qualsiasi quella con potenziale standard maggiore egraveossidante (nelle condizioni imposte) nei confronti della coppia con potenziale stan-dard minore Per esempio se si immerge un foglio di alluminio in una soluzionecontenente solfato di rame e solfato di alluminio (ad attivitagrave unitaria) il foglio di
TABELLA 21 | Alcuni potenziali standard di riduzione (Edeg) misurati a 25 degC
Semireazione Edeg(V) Semireazione Edeg(V)
O H e O H O3 2 22 2+ + ++ minus 2076 Cu e Cu s2
2+ minus+ ( ) 0342
S O e SO2 82
422 2minus minus minus+ 2010 Hg Cl s e Hg Cl2 2 2 2 2( )+ +minus minus
0268
H O H e H O2 2 22 2 2+ ++ minus 1776 AgCl s e Ag Cl( )+ +minus minus
0222
MnO H e MnO s H O4 2 24 3 2minus + minus+ + + ( ) 1679 Cu e Cu2+ minus ++ 0153
Ce e Ce4 3+ minus ++ 172 Sn e Sn in HCl M4 22 1+ minus ++ ( ) 0151
MnO H e Mn H O42
28 5 4minus + minus ++ + + 1507 S H e H S g+ ++ minus2 2 2 ( ) 0142
PbO H e Pb H O22
24 2 2+ + ++ minus + 1455 S O e S O4 6
22 3
22 2minus minus minus+ 008
Cl e Cl2 2 2+ minus minus 1358 AgBr s e Ag Br( )+ +minus minus
0071
Cr O H e Cr H O2 72 3
214 6 2 7minus + minus ++ + + 1350 2H ++ 2e-H2 00000
O g H e H O2 24 4 2( )+ ++ minus 1229 Pb e Pb2
2+ minus+ ndash0126
2 12 10 63 2 2IO H e I H Ominus + minus+ + + 1195 Sn e Sn22
+ minus+ ndash0137
Br l e Br2 2 2( )+ minus minus 1066 Ni e Ni2
2+ minus+ ndash0257
NO H e HNO H O3 2 23 2minus + minus+ + + 0934 Co e Co22
+ minus+ ndash0282
2 22
2
2Hg e Hg+ minus ++ 0920 Fe e Fe22
+ minus+ ndash0447
Cu I e CuI2+ minus minus+ + 086 Zn e Zn22
+ minus+ ndash0762
Ag e Ag+ minus+ 0799 Mn e Mn22
+ minus+ ndash1185
Hg e Hg2
22 2
+ minus+ 0797 Al e Al33
+ minus+ ndash1662
Fe e Fe3 2+ minus ++ 0771 Mg e Mg22
+ minus+ ndash2372
O g H e H O2 2 22 2( )+ ++ minus 0695 Na e Na+ minus+ ndash2710
I e I3 2 3minus minus minus+ 0536 Ca e Ca22
+ minus+ ndash2868
I e I2 2 2+ minus minus 0535 K e K+ minus+ ndash2931
Cu e Cu+ minus+ 0521 Li e Li+ minus+ ndash3040
Fe CN e Fe CN( ) ( )63
64minus minus minus+ 0358
14
2 Potenziometria
alluminio si dissolve mentre si deposita rame metallico Infatti i potenziali stan-dard delle due coppie redox sono
Cu2+ + 2endash Cu Edeg= +034 V
Al3+ + 3endash Al Edeg= ndash166 V
Nella soluzione quindi lo ione Cu2+ (forma ossidata della coppia con potenzialemaggiore) tende a ossidare Al (forma ridotta della coppia con potenziale minore)
TABELLA DEI POTENZIALI STANDARD DI RIDUZIONEAPPROFONDIMENTO
22 Tensione pratica (ddp) di una pila
Lrsquoinsieme dei conduttori di prima e di seconda specie che in sequenza opportunaformano una pila (o in generale un sistema elettrochimico) costituisce una catenagalvanica La differenza di potenziale (Ecella) che si misura ai capi di una pila durantelrsquoerogazione di corrente egrave dovuta a diversi contributi piugrave precisamente egrave uguale allasomma algebrica di tutte le cadute di tensione che si verificano lungo lrsquointero circuito
Ecella= E1 + E2 + E3 + E4 + E5 (25)
dove bull E1 egrave la ddp dovuta allrsquoeventuale passaggio di corrente nel circuito (cadutaohmica) bull E2 la ddp di contatto metallometallo (tensione di Volta) bull E3 la ddpdi contatto soluzionesoluzione (tensione o potenziale di giunzione liquida) bull E4 edE5 le ddp di contatto metallosoluzione (tensione di Nernst) per ciascun elettrodo
Esaminiamo ora il significato dei singoli contributi
Caduta ohmica Quando la cella egrave attraversata da corrente inevitabilmente si ve-rifica una caduta di tensione E = R times i (prima legge di Ohm) Ovviamente se lamisura del potenziale di cella viene effettuata in condizioni tali da minimizzareo eliminare il passaggio di corrente (cioegrave a circuito aperto) la caduta ohmica siannulla (cioegrave E1= 0)
Tensione di Volta Quando due diversi metalli vengono posti a contatto si generasempre una ddp Questo fenomeno detto effetto Volta egrave dovuto al fatto che glielettroni di conduzione sono trattenuti con diversa energia dai diversi metalli Per-ciograve il contatto fra due metalli provoca un trasferimento di elettroni istantaneo daparte del metallo che li trattiene con minore energia Il processo perograve non prose-gue indefinitamente il trasferimento di elettroni infatti prosegue fino allrsquoequili-brio quando insorge una ddp (in genere di pochi millivolt) sufficiente a bloccarlo
Si puograve verificare sperimentalmente (e dimostrare) che la ddp agli estremi diuna catena di conduttori di prima specie egrave uguale a quella che si stabilisce se i duemetalli che ne costituiscono gli estremi vengono posti a diretto contatto (fig 24)Di conseguenza se gli ingressi del misuratore di tensione sono costituiti dallo stessometallo lrsquoeffetto Volta complessivo egrave nullo (E2= 0)
In altri termini la formaossidata della coppia conpotenziale piugrave alto egraveossidante nei confrontidella forma ridotta dellacoppia con potenzialepiugrave basso
A rigore si dovrebbe usareil simbolo V (o ∆V)percheacute si tratta di unaddp misurata in una pilain funzione e dunquenon di una fem Il pedicelaquocellaraquo puntualizza che sitratta in generale di unacella elettrochimica
R egrave la resistenza delconduttore e i lrsquointensitagravedi corrente
15
CELLE GALVANICHE O PILE
Potenziale di giunzione liquida In una pila le due semicelle sono separate matenute in contatto elettrico mediante un setto poroso o un ponte salino che con-sente un mescolamento lentissimo (praticamente nullo) delle soluzioni Questidispositivi (si veda la figura 25) perograve creano unrsquoulteriore caduta di tensione fragli elettrodi detta potenziale di giunzione liquida (Eg) o anche potenziale dicontatto (o di diffusione) Il potenziale di giunzione liquida puograve essere sia po-sitivo sia negativo e quindi fa aumentare o viceversa diminuire la ddp fra glielettrodi
Lrsquoinsorgere di un potenziale di giunzione egrave causato dal fatto che gli ioni si dif-fondono con diversa mobilitagrave attraverso le superfici di contatto di due mezzi di-versi un setto poroso per esempio egrave diversamente permeabile agli ioni propriosecondo la loro mobilitagrave
Tensione di Nernst I potenziali di contatto metallosoluzione (E4 E5) si calco-lano in teoria mediante la legge di Nernst e perciograve sono detti potenziali nern-stiani
LA MOBILITAgrave DEGLI IONI IN SOLUZIONEAPPROFONDIMENTO
23 Calcolo della tensione teorica (fem) di una pilaSe si opera in modo da rendere trascurabili i primi tre termini dellrsquoequazione (22)la ddp ai capi della pila coincide in pratica con la sua fem che puograve essere cal-colata semplicemente in base agli ultimi due termini cioegrave ai potenziali di elettrodoNei calcoli occorre tenere presente che
a la fem di una pila in quanto strettamente collegata al lavoro da essa compiutodeve necessariamente avere segno positivo
b lrsquoelettrodo a potenziale maggiore su cui avviene la riduzione egrave il catodo lrsquoelet-trodo a potenziale minore su cui avviene lrsquoossidazione egrave lrsquoanodo
Di conseguenza la fem di una pila cioegrave di una cella elettrochimica ottenuta colle-gando due semicelle (catodica e anodica) egrave espressa dalla seguente relazione
Ecella = Ec ndash Ea (26)
ovvero
Ecella = Emaggiore ndash Eminore (27)
Questa seconda scrittura mostra chiaramente che la fem della pila egrave sempre posi-tiva anche nel caso in cui i potenziali delle due semicelle siano entrambi negativi
Indichiamo con Ec ilpotenziale del catodo (opotenziale catodico) econ Ea il potenzialedellrsquoanodo (o potenzialeanodico)
Figura 24Nonostante ogni superficie di contatto fra due metallisia sede di una ddp dovuta allrsquoeffetto Volta la ddpche si instaura fra rame e zinco egrave la stessa sia nel caso(a) sia nel caso (b) Infatti se cosigrave non fosse chiudendola catena aperta (a) si dovrebbe osservare un passaggiodi corrente e questo in realtagrave non avviene
a b
16
2 Potenziometria
ESEMPIO 1UNA IPOTETICA PILA Egrave COSTITUITA DALLE COPPIE REDOX Al3+Al E Ni2+NiQUAL Egrave LA FEM DELLA PILA SE LE ATTIVITAgrave DI TUTTE LE SPECIE IONICHE SONOUNITARIE
Dal momento che le attivitagrave sono unitarie il calcolo fornisce la tensione (o forzaelettromotrice) standard della pila
Innanzitutto dalla tabella dei potenziali standard si ricavano i potenziali stan-dard per ciascuna coppia redox
Al3+ + 3endash Al Eo
= ndash166 V
Ni2+ + 2endash Ni Eo
= ndash026 V
Lrsquoelettrodo della coppia Ni2+Ni costituisce il catodo percheacute ha il potenziale mag-giore mentre lrsquoelettrodo della coppia Al3+Al costituisce lrsquoanodo percheacute ha il poten-ziale minore Si puograve anche costruire un diagramma di questo tipo
Al3+Al Ni2+Ni H+H2
ndash166 ndash026 00000 Edeg(V rif a SHE)
Quindi la fem della pila in condizioni standard egrave
Ecella= Ec ndash Ea= Emaggiore ndash Eminore= ndash026 ndash (ndash166)= +140 V
La reazione di ossidoriduzione che genera la pila si ottiene formalmente combi-nando le due semireazioni bilanciate quella di riduzione al catodo e quella di os-sidazione allrsquoanodo Ciascuna semireazione deve essere moltiplicata per un fattorenumerico tale che il numero di elettroni ceduti dalla specie che si ossida sia uguale aquello degli elettroni acquistati dalla specie che si riduce Quindi nel caso dellrsquoesem-pio proposto si moltiplica la semireazione della coppia Al3+Al per 2 e quella dellacoppia Ni2+Ni per 3
2 middot (Al Al3+ + 3endash) Edeg= ndash(ndash166 V) (ndash)
3 middot (Ni2+ + 2endash Ni) Edeg= ndash026 V (+)
2Al + 3Ni2+ 2Al3+ + 3Ni Edeg= +140 V
Attenzione per ottenere il bilancio della reazione di cella si moltiplica per un coeffi-ciente opportuno ciascuna semireazione ma non il rispettivo potenziale Infatti i po-tenziali di elettrodo (e quindi anche il potenziale di cella) esprimono un lavoro elettricoper unitagrave di carica e perciograve sono proprietagrave intensive che non dipendono dalla quantitagravedi materia contenuta nel sistema ovvero dal numero di cariche elettriche trasportate
Se le attivitagrave non sono unitarie per calcolare il potenziale di elettrodo occorreapplicare lrsquoequazione di Nernst
Egrave ovvio comunque che il lavoro complessivo che puograve essere fornito da una piladipende anche dalla massa e dalla geometria degli elettrodi Per questo motivo unapila o un insieme di pile (cioegrave una batteria) che viene utilizzata per esempio permuovere un veicolo puograve avere dimensioni ingombranti Questo accadeva fino anon molti anni fa per le vecchie batterie al piombo ora sempre piugrave sostituite dabatterie come quelle al litio decisamente piugrave compatte e che infatti stanno rendendopossibile il progressivo passaggio allrsquoauto parzialmente o completamente elettrica
UNA IPOTETICA PILA Egrave COSTITUITA DALLE COPPIE REDOX Al3+Al E Ni2+NiQUAL Egrave LA FEM DELLA PILA SE LE ATTIVITAgrave DI TUTTE LE SPECIE IONICHE SONOUNITARIE
Nella pila la reazionedella coppiadella coppia Ni2+Ni(Ni2+ si riduce) avvienenel senso conforme allaconvenzione adottata per ipotenziali (elettroni asinistra) invece lareazione della coppiaAl3+Al (Al si ossida)avviene nel senso oppostoa quello convenzionalePerciograve il potenziale Edegdella coppia Al3+Al vieneconsiderato con segnoopposto a quello tabulato(+166 V) Se si sommaalgebricamente ilpotenziale dellrsquoelettrodoche si riduce (Ec) conquello dellrsquoelettrodo che siossida cambiato di segno(Ea) la tensione della pilarisulta positiva
17
CELLE GALVANICHE O PILE
ESEMPIO 2UNA IPOTETICA PILA Egrave COSTITUITA DALLE COPPIE REDOX Al3+Al E Ni2+NiQUAL Egrave LA FEM DELLA PILA A 25 degC SE LE CONCENTRAZIONI DELLE SPECIEIONICHE SONO RISPETTIVAMENTE [Al3+] = 2 10ndash2 M E [Ni2+] = 10ndash2 M
Approssimando le attivitagrave con le concentrazioni si ottiene
La situazione non egrave sostanzialmente cambiata rispetto alle condizioni standardpercheacute anche in questo caso la reazione di cella comporta lrsquoossidazione dellrsquoallumi-nio e la riduzione del nichel La fem della pila quindi egrave
Ecella= Ec ndash Ea= ndash032 ndash (ndash167)= +135 V
24 Alcuni tipi di pile
Pila DaniellUna semicella egrave costituita da una lamina di rame immersa in una soluzione diCuSO4 lrsquoaltra semicella da una lamina di zinco immersa in una soluzione di ZnSO4
(fig 25) Le due semicelle sono separate da un setto poroso (in pratica una mem-brana di vetro sinterizzato o analogo materiale inerte) oppure si trovano in duediversi recipienti collegati da un ponte salino
Le reazioni di elettrodo sono
Zn2+ + 2endash Zn Edeg= ndash0762 V
Cu2+ + 2endash Cu Edeg= 0342 V
Le concentrazioni dei sali nelle rispettive semicelle sono in genere tali da renderenegativo il semielemento di zinco che perciograve tende a cedere elettroni al rame (ossi-dandosi) La lamina di zinco egrave dunque il polo negativo (anodo) della pila e il rameegrave il polo positivo (catodo)
La rappresentazione della catena galvanica di questa pila secondo le convenzioniIUPAC egrave
(ndash) Zn(s)|ZnSO4(aq)||CuSO4(aq)|Cu(s) (+)
UNA IPOTETICA PILA Egrave COSTITUITA DALLE COPPIE REDOX Al3+Al E Ni2+NiQUAL Egrave LA FEM DELLA PILA A 25 degC SE LE CONCENTRAZIONI DELLE SPECIEIONICHE SONO RISPETTIVAMENTE [Al3+] = 2 10ndash2 M E [Ni2+] = 10ndash2 M
Si noti che se i duescomparti non fosseroscomparti non fosseroben separati dal settoben separati dal settoporoso ben presto gli ioniporoso ben presto gli ionirame disponibilirame disponibiliraggiungerebbero lrsquoraggiungerebbero lrsquoanododi zinco ossidandolo eandando a depositarsi sudi esso come Cumetallico nondiversamente da quanto sipuograve osservareimmergendo una barrettadi zinco in una soluzionedi solfato di rameesaurendo quindirapidamente la pila esviluppando calore
Figura 25Pila Daniell (a) con settoporoso e (b) con pontesalino
a b
18
2 Potenziometria
La coppia di barrette verticali (||) al centro rappresenta il setto poroso o il pontesalino che separano le due semicelle lrsquoanodo egrave scritto a sinistra e per ciascun elet-trodo la forma ridotta della coppia redox egrave scritta verso lrsquoesterno Le lettere scrittefra parentesi indicano lo stato fisico di ogni specie chimica
La reazione di cella egrave
Zn + Cu2+ Zn2+ + Cu
Per calcolare la fem teorica di questa pila che puograve anche trovarsi in condizionidiverse da quelle standard si applica la legge di Nernst a ciascuna semicella
(28)
(29)
I potenziali standard delle due semicelle sono cosigrave diversi fra loro che nelle normalicondizioni operative di una pila Daniell il rame rappresenta il polo positivo e lozinco il polo negativo
Sottraendo il potenziale minore da quello maggiore si ottiene il potenziale dicella
Ecella = ECu2+Cu - EZn2+Zn
Ponendo Edegcella = EdegCu2+Cu ndash EdegZn2+Zn (= 0342 V + 0762 V) e quindi sottraendo la(28 dalla 29) si ricava infine
Questa equazione consente dunque di calcolare il potenziale di Nernst se egrave notoil valore effettivo dellrsquoattivitagrave degli ioni Zn2+ e Cu2+ Tuttavia il calcolo si presta aerrori anche significativi lrsquoattivitagrave degli ioni per esempio varia in funzione dellaforza ionica della soluzione e non puograve essere calcolata Perciograve la fem reale piugraveesattamente la ddp che si misura si discosta dal valore calcolato sostanzialmenteper due motivi
a il sistema non si comporta in maniera ideale (per esempio gli elettrodi possonopolarizzarsi)
b il contributo della caduta ohmica (gtequazione 25) puograve essere praticamente an-nullato se nel circuito viene fatta circolare una corrente trascurabile invece ilpotenziale di giunzione liquida per quanto piccolo non puograve essere soppresso enon egrave prevedibile in base a equazioni teoriche
Pile a concentrazioneIn questo tipo di pila le due semicelle contengono due soluzioni di una stessa cop-pia redox ma a diversa concentrazione gli elettrodi sono inerti oppure dello stes-so metallo e le semicelle sono collegate da un setto poroso o da un ponte salino(fig 26)
In questo calcolotrascuriamo i contributidei termini E1 E2 E3 dellaequazione (25)
Lrsquoequazione rappresentain pratica la legge diNernst applicata allareazione redox globalescritta nel verso dellaspontaneitagrave tenendoconto degli elettroniscambiati (2) e inserendonellrsquoargomento dellogaritmo lrsquoinverso delquoziente di reazione
+
19
CELLE GALVANICHE O PILE
Le due soluzioni si scambiano elettroni attraverso il circuito esterno mentre ilsetto poroso (o il ponte salino) che le collega consente il passaggio di ioni e quin-di chiude il circuito Il sistema raggiunge lrsquoequilibrio quando le attivitagrave degli ioninelle due semicelle diventano uguali perciograve egrave prevedibile che nella soluzione piugravediluita avvenga lrsquoossidazione il rame metallico si dissolve e si formano ioni Cu2+ insoluzione questo dunque egrave lrsquoanodo Contemporaneamente gli elettroni passanonellrsquoaltro comparto (a destra in figura 26) attraverso il circuito esterno e riduconogli ioni Cu2+ che si depositano sullrsquoelettrodo come rame metallico questo dunqueegrave il catodo
In pratica egrave come se gli ioni Cu2+ si trasferissero dalla soluzione piugrave concentrataalla soluzione piugrave diluita Queste pile dunque trasformano in lavoro elettrico lrsquoe-nergia che si libera nel processo spontaneo con cui due soluzioni a diretto contattotendono a raggiungere lrsquoequilibrio di concentrazione
La rappresentazione convenzionale della catena elettrodica di questa pila a con-centrazione egrave la seguente
(-) Cu(s) |Cu2+(001 M)||Cu2+(1 M)|Cu(s) (+)
Per calcolare la tensione teorica della pila si applica la legge di Nernst a ciascun elet-trodo Approssimando le attivitagrave con le concentrazioni (a 25 degC) si ottiene
(soluzione piugrave diluita anodo)
(soluzione piugrave concentrata catodo)
Quindi
Ecella= Emaggiore ndash Eminore= 0342- 0283= 0059 V
ALTRI TIPI DI CELLE GALVANICHE O PILEAPPROFONDIMENTO
Figura 26Pila a concentrazione il compartoanodico (a sinistra) contiene ioni Cu2+
in concentrazione 001 M e il com-parto catodico (a destra) contieneioni Cu2+ in concentrazione 1 M Ilcollegamento fra le due semicelle egraverealizzato con un ponte salino
20
2 Potenziometria
STRUMENTAZIONEIn potenziometria si misura la differenza di potenziale che si stabilisce fra due semi-celle allo scopo di determinare la concentrazione di uno ione o per seguire lrsquoanda-mento di una titolazione
Il dispositivo completo per una misura potenziometrica (fig 27) consiste es-senzialmente di
bull un potenziometro o meglio un millivoltmetro elettronicobull un elettrodo di riferimentobull un elettrodo di misura
Il potenziometro serve per misurare la ddp fra i due elettrodi senza alterare il lorostato di equilibrio perciograve si lavora a corrente praticamente nulla
Gli elettrodi collegati al potenziometro sono immersi nella soluzione su cui sieffettuano le misure Lrsquoelettrodo di riferimento egrave costruito in modo tale da mante-nere costante il suo potenziale di conseguenza ogni variazione di ddp misurata egraveimputabile esclusivamente allrsquoelettrodo di misura (piugrave precisamente alla soluzioneanalizzata)
ELETTRODI DI RIFERIMENTOLrsquoelettrodo standard a idrogeno (SHE gtparagrafo 21) egrave lrsquoelettrodo di riferimentoprimario Tuttavia nella pratica quotidiana di laboratorio si usano elettrodi di ri-ferimento secondari piugrave semplici e maneggevoli che hanno comunque la proprie-tagrave di mantenere il proprio potenziale costante a temperatura costante Tratteremoora in maggior dettaglio gli elettrodi di uso piugrave comune
31 Elettrodo ad argentocloruro drsquoargento
Si tratta senzrsquoaltro dellrsquoelettrodo piugrave diffuso Il dispositivo egrave costituito da un sem-plice filo drsquoargento rivestito di AgCl e immerso in una soluzione di KCl (egrave dunqueun elettrodo di seconda specie) Il tutto egrave contenuto in un tubicino di vetro dotatodi setto poroso per assicurare il contatto elettrico con lrsquoesterno ovvero con la so-luzione in cui viene immerso lrsquooggetto dellrsquoanalisi
Figura 27Rappresentazione schematica deldispositivo completo per misurepotenziometriche
3
21
ELETTRODI DI RIFERIMENTO
La rappresentazione convenzionale dellrsquoelettrodo (fig 28) egrave
Ag(s)|AgCl(aq)|KCl(aq)
La reazione di elettrodo egrave
AgCl + endash Ag + Clndash
E il potenziale di elettrodo
E= EdegAgClAg
Considerando unitarie le attivitagrave dei solidi puri si ottiene
E= EdegAgClAg ndash 01984 10ndash3 T log[Clndash] (210)
Se lrsquoattivitagrave degli ioni cloruro egrave costante (a temperatura costante) il potenziale dielettrodo rimane costante Gli elettrodi piugrave comuni contengono soluzioni sature diKCl (circa 42 M) e perciograve sono detti saturi (SSC Saturated Silver-Silver ChlorideElectrode) A 25 degC il potenziale di SSC vale 0197 V Questo elettrodo puograve essereusato fino a 105 degC Nella tabella 1 ndash lab 1 (gtpag 39) sono riportati i potenziali alvariare della temperatura per lrsquoelettrodo saturo e 3 M
Gli anioni (come il solfuro) che formano con Ag+ sali meno solubili di AgClpossono danneggiare questo tipo di elettrodo Anche gli ossidanti e i riducenti fortie gli agenti complessanti possono interferire con la reazione di elettrodo per proteg-gere lrsquoelettrodo da queste sostanze si usa un elettrolita intermedio come nel casodellrsquoelettrodo a calomelano saturo (SCE gtparagrafo 32)
Gli elettrodi ad argentocloruro di argento sono usati come riferimento internonegli elettrodi a vetro (gtparagrafo 41)
32 Elettrodo a calomelano
laquoCalomelanoraquo egrave il nome comune del cloruro mercuroso (I) Hg2Cl2 che fa parteappunto di questo elettrodo (fig 29a) La rappresentazione convenzionale dellrsquoe-lettrodo egrave
Hg(l)|Hg2Cl2(s)|KCl(aq)
La reazione di elettrodo egrave
Hg2Cl2 + 2endash 2Hg + 2Clndash
e il potenziale di elettrodo in base alla legge di Nernst
In condizioni standard lrsquoattivitagrave di solidi e liquidi puri egrave considerata uguale a 1quindi
da cui
ndash 01984 10ndash3 T log|Clndash| (211)
Sono anche molto diffusigli elettrodi contenentiKCl 3 M cioegrave quasisaturi Il vantaggio egrave chein queste soluzioni non siformano cristalli di KClche possono danneggiarelrsquoelettrodo ostruendoil setto poroso che sta sulfondo
Figura 28Elettrodo ad AgAgCILa soluzione tamponeinterna contiene ioni K+
e CIndash ad attivitagrave costante
22
2 Potenziometria
Il potenziale dellrsquoelettrodo a calomelano dunque dipende solo dallrsquoattivitagrave delloione cloruro e dalla temperatura Se la temperatura egrave costante e lrsquoattivitagrave dello ionecloruro nella soluzione interna allrsquoelettrodo non varia il potenziale rimane costante
Gli elettrodi a calomelano piugrave comuni contengono soluzioni sature di KCl (circa42 M) e perciograve sono detti saturi (SCE Saturated Calomel Electrode) Si usano ancheelettrodi a KCl 1 M e 01 M la tabella 22 riporta il potenziale assunto da questielettrodi secondo la concentrazione di KCl
TABELLA 22 | Potenziale (mV) di alcuni elettrodi di riferimento a 25 degC
AgAgCl Calomelano HgHgO HgHgSO4 Thalamid
KCl 01 M 288 KCl 01 M 334 NaOH 01 M 165 H2SO4 05 M 682 KCl 3 M -567
KCl 1 M 235 KCl 1 M 280 NaOH 1 M 140 K2SO4 sat 650 KCl sat -577
KCl 3 M 210 KCl 35 M 250
KCl 35 M 205 KCl sat 241
KCl sat 199 NaCl sat 236
NaCl 3 M 209
NaCl sat 197
Lrsquoelettrodo a calomelano puograve essere usato fino a circa 70 degC a temperature piugrave alteil calomelano si dismuta (Hg2Cl2 Hg + HgCl2)
I solfuri gli ossidanti i forti riducenti e gli agenti complessanti che formanoamalgami con gli ioni Hg2
2+ possono danneggiare questo tipo di elettrodo Perciogravequando si lavora in presenza di queste sostanze si usano elettrodi a doppia giun-zione (fig 29b) in cui fra lrsquoelettrodo e la soluzione egrave interposto un contenitoreriempito con un elettrolita intermedio (per esempio KNO3)
Va infine segnalata la tendenza a non usare il mercurio per motivi tossicologicie questo spiega il progressivo abbandono nella pratica comune di questo tipo dielettrodo con grande rammarico dagli elettrochimici percheacute lrsquoelettrodo a calomela-no egrave il piugrave stabile
bullELETTRODI DI PRIMA E DI SECONDA SPECIE bullALTRI ELETTRODI DI RIFERIMENTO
APPROFONDIMENTI
Figura 29(a) Elettrodo a calomelano (b) Nella versione adoppia giunzione egrave presente una seconda cameraper lrsquoelettrolita intermedio che viene immessoattraverso la bocchetta laterale il setto porosoassicura il contatto elettrico con la soluzioneesterna
a b

10
2 Potenziometria
In questa equazione non compare la concentrazione della forma ridotta percheacutelrsquoattivitagrave di una specie chimica pura nelle condizioni standard viene convenzio-nalmente assunta uguale a 1
In effetti spesso si lavora con soluzioni non particolarmente diluite quindi neicalcoli bisogna fare riferimento alle attivitagrave invece che alle concentrazioni di con-seguenza lrsquoequazione (24) diventa
+ log
IL POTENZIALE FORMALEAPPROFONDIMENTO
13 Polarizzazione degli elettrodiIn tutti i casi in cui il sistema dellrsquoelettrodo si discosti dalle condizioni di equilibriotermodinamico la legge di Nernst diventa inadeguata a descrivere il sistema stessoCiograve accade per esempio quando allrsquoelettrodo viene imposto un potenziale arbitra-rio eo la corrente che lo attraversa egrave molto intensa in questi casi il potenziale dielettrodo risulta diverso da quello previsto in base alla legge di Nernst e si dice chelrsquoelettrodo egrave polarizzato
In particolare quando la concentrazione degli ioni alla superficie di un elettrodoegrave diversa da quella nel resto della soluzione si verifica una polarizzazione di con-centrazione in quanto il sistema non si trova nelle condizioni di equilibrio cui fariferimento il modello di Nernst
La polarizzazione puograve derivare anche dal cambiamento dello stato chimico eofisico della superficie di elettrodo oppure dal verificarsi di reazioni chimiche colla-terali alla reazione di elettrodo
LEGGE DI NERNST E GRANDEZZE TERMODINAMICHE COLLEGATEAPPROFONDIMENTO
CELLE GALVANICHE O PILESe si collegano elettricamente fra loro due semicelle (elettrodi) si realizza un dispo-sitivo che puograve erogare corrente si tratta di una cella galvanica (o pila fig 22)
In una pila le due semicelle sono separate da un setto poroso o da un ponte salinoche hanno il solo compito di assicurare il contatto elettrico evitando il rapido me-scolamento delle soluzioni Secondo le caratteristiche dei singoli elettrodi ai duecapi della pila si crea una differenza di potenziale (ddp) detta anche tensione (opotenziale) di cella che quando raggiunge il suo valore massimo egrave detta forzaelettromotrice (abbreviata fem e indicata con il simbolo E) tutti questi terminiindicano che la pila puograve compiere un lavoro (elettrico)
Dal punto di vista fisico la fem di una pila corrisponde al lavoro massimo cheessa puograve fornire In altri termini la fem equivale al lavoro per unitagrave di carica ne-cessario per mantenere costante la ddp fra i due elettrodi
La fem coincide con la ddp solo nel caso in cui il sistema lavori in condizionidi reversibilitagrave termodinamica (ovvero a corrente nulla) In un circuito chiuso in-
Il termine polarizzazionesoprattutto nelleapplicazioni viene spessousato in modo fin troppogenerico per definiresituazioni poco chiare peresempio nellrsquoindustriagalvanica si parla spesso dipolarizzazione quando ilprocesso produttivo nonsegue lrsquoandamento previstoanche se le vere cause sonotutte da definire
2
La fem viene misurata acircuito aperto (ossia incondizioni di equilibrio acorrente nulla) e conterminali di platinomediante un potenziometroo un voltmetro elettronico
Se le soluzioni simescolassero ben prestosi verificherebberoreazioni chimiche direttelaquoindesiderateraquo (peresempio fra elettrodi esoluzione) con rapidoesaurimento del sistema(pila Daniell gtparagrafo24) e sviluppo di calore
11
CELLE GALVANICHE O PILE
vece dove la corrente circola (e non egrave nulla) la ddp in uscita dalla pila egrave sempreminore della fem a causa della laquocaduta di tensioneraquo provocata dal passaggio dicorrente Vale infatti con buona approssimazione la relazione
ddp= fem ndash Ri
dove bull R egrave la resistenza del circuito bull i lrsquointensitagrave di corrente
Per esempio se si collegauna comune pila da 45 Va una lampadina e simisura la ddp ai capi delcircuito si ottiene unvalore piugrave basso (peresempio 33 V)Il valore nominale ditensione sullrsquoinvolucrodella pila infatti indica lafem non la ddp inuscita (che dipende dallaquocaricoraquo effettivo delcircuito)
Figura 22Cella galvanica (pila) Il setto poroso divide (pur mantenen-doli in contatto elettrico fra loro) i due comparti del recipien-te che costituiscono le due semicelle Queste possono con-tenere due diversi elettroliti oppure lo stesso elettrolita maa diversa concentrazione in modo che allrsquoinizio i potenzialisiano diversi Nel primo caso le due lamine sono in generedi metalli differenti nel secondo caso sono uguali fra loroIl circuito esterno egrave formato da conduttori di prima specie ecomprende il dispositivo per la misura della tensione dellapila la corrente (i) e gli elettroni (e-) percorrono il circuito indirezioni opposte
Lrsquoelettrodo piugrave ricco di elettroni cioegrave a potenziale minore egrave detto anodo e costitu-isce il polo negativo della pila mentre lrsquoelettrodo piugrave povero di elettroni cioegrave a po-tenziale maggiore egrave detto catodo e costituisce il polo positivo Attraverso il circuitoesterno lrsquoanodo tende a cedere elettroni al catodo sotto la laquospintaraquo della spontaneatendenza del sistema a eguagliare i potenziali delle due semicelle
Il flusso di elettroni dallrsquoanodo al catodo altera quindi lo stato drsquoequilibrio ini-ziale di ciascuna semicella esso puograve venire ripristinato mediante reazioni di ossida-zione allrsquoanodo e contemporaneamente mediante reazioni di riduzione al catodoInfatti in base alla legge di Nernst (gtparagrafo 12) le reazioni di ossidazione tendo-no a innalzare il potenziale di elettrodo percheacute aumenta la concentrazione dellaforma ossidata (al numeratore dellrsquoargomento logaritmico) viceversa le reazioni diriduzione tendono ad abbassarlo La corrente che si stabilisce nel circuito egrave dovutaalla tendenza spontanea del sistema a raggiungere lrsquoequilibrio termodinamico per-ciograve quando i potenziali dei due elettrodi diventano uguali il flusso di elettronicessa e si dice che la pila egrave laquoscaricaraquo
La pila quindi egrave un dispositivo mediante il quale gli elettroni in gioco in unareazione redox passano attraverso un circuito da una specie chimica a unrsquoaltraOssidante e riducente infatti non vengono posti direttamente a contatto cosiccheacute glielettroni che si scambierebbero sono laquocostrettiraquo a passare attraverso il circuitoesterno Ciograve consente di convertire in energia elettrica e quindi in lavoro lrsquoenergiache si libera in un processo redox spontaneo che genererebbe calore il flusso di
12
2 Potenziometria
corrente si arresta quando egrave soddisfatta la costante di equilibrio della reazione chegenera la pila
Per ragioni storiche il funzionamento delle pile egrave stato spiegato in termini di unflusso di corrente elettrica dovuto a inesistenti cariche elettriche positive che migra-no dal polo a potenziale maggiore (catodo) verso il polo a potenziale minore (ano-do) Per questo motivo il verso convenzionale della corrente elettrica egrave opposto aquello in cui effettivamente circolano gli elettroni
21 Potenziali standard di ossidoriduzioneIn linea di principio per misurare la ddp fra una lamina di metallo e la soluzionein cui egrave immersa (si veda la figura 21a) occorre inserire il dispositivo di misura inmodo che un terminale sia collegato al metallo e lrsquoaltro alla soluzione In questomodo tuttavia si crea un nuovo contatto metallosoluzione e lo strumento finiscecol misurare la ddp fra i due metalli senza dare informazioni sul valore del poten-ziale di ciascuno di essi Quindi il potenziale assoluto di un singolo elettrodo o diuna coppia redox (che egrave la stessa cosa) non puograve essere misurato Si egrave costretti perciogravea effettuare una misura relativa dei potenziali ponendo a confronto due semicellela semicella di cui si vuole misurare il potenziale e una semicella di riferimento co-struita in modo da assumere un potenziale costante
In pratica lrsquoelettrodo di cui si vuole misurare il potenziale viene accoppiato a unelettrodo di riferimento e si misura la ddp di questa pila in condizioni precisamentedefinite
In base a criteri di opportunitagrave pratica e a considerazioni termodinamiche si egravescelto come elettrodo di riferimento il cosiddetto elettrodo standard a idrogeno(SHE Standard Hydrogen Electrode) A tale elettrodo (fig 23) viene assegnato perconvenzione un potenziale di semicella di 00000 V valido a tutte le temperatureper una soluzione che contiene ioni idrogeno ad attivitagrave unitaria e idrogeno gassosoa fugacitagrave unitaria (in pratica alla pressione parziale di 1 bar)
Nella prima fasedi sviluppodellrsquoelettrochimica siparlava anche di elettrodonormale a idrogeno(NHE Normal HydrogenElectrode) riferendosi a unelettrodo di platinoimmerso in una soluzione1 N di un acido forte inquesta soluzione perogravelrsquoattivitagrave del protone egravecirca 08 e quindi ilpotenziale realedellrsquoelettrodo egrave ben diversoda zero Per questo motivonon egrave corretto usare lasigla NHE per indicare ilriferimento standard[Fonte RW RametteJ Chem Ed vol 64 10(ott 1987)]
Figura 23Elettrodo a idrogeno secondo la realizzazione ideata da SPLSoslashrensen Nel gorgogliatore entra idrogeno gassoso purissi-mo che attraversa la soluzione acida e lambisce la lamina diplatino platinato prima di uscire dal secondo gorgogliatore Idue gorgogliatori e lrsquoampolla centrale contengono la stessasoluzione acida La lamina di platino egrave saldata a un filo di plati-no che fuoriesce dal tappo e assicura il collegamento elettricocon lo strumento di misura Il rubinetto e il sifone mettono incontatto la soluzione acida con lrsquoaltro elettrodo formando cosigraveuna pila Quando lrsquoattivitagrave di H+ e la fugacitagrave di H2 sono unitarielrsquoelettrodo egrave in condizioni standard
13
CELLE GALVANICHE O PILE
Le tabelle dei potenziali standard di ossidoriduzione riportano appunto i po-tenziali di coppie redox ad attivitagrave unitaria misurati rispetto allo SHE (a 25 degC) Sele reazioni sono scritte secondo le convenzioni IUPAC cioegrave nel senso della ridu-zione (elettroni a sinistra) egrave piugrave preciso parlare di potenziali standard di riduzione(tab 21) Nelle tabelle le coppie con potenziale positivo sono tendenzialmentepiugrave ossidanti della coppia H+H2 mentre le coppie con potenziale negativo sono piugraveriducenti
In generale per due coppie qualsiasi quella con potenziale standard maggiore egraveossidante (nelle condizioni imposte) nei confronti della coppia con potenziale stan-dard minore Per esempio se si immerge un foglio di alluminio in una soluzionecontenente solfato di rame e solfato di alluminio (ad attivitagrave unitaria) il foglio di
TABELLA 21 | Alcuni potenziali standard di riduzione (Edeg) misurati a 25 degC
Semireazione Edeg(V) Semireazione Edeg(V)
O H e O H O3 2 22 2+ + ++ minus 2076 Cu e Cu s2
2+ minus+ ( ) 0342
S O e SO2 82
422 2minus minus minus+ 2010 Hg Cl s e Hg Cl2 2 2 2 2( )+ +minus minus
0268
H O H e H O2 2 22 2 2+ ++ minus 1776 AgCl s e Ag Cl( )+ +minus minus
0222
MnO H e MnO s H O4 2 24 3 2minus + minus+ + + ( ) 1679 Cu e Cu2+ minus ++ 0153
Ce e Ce4 3+ minus ++ 172 Sn e Sn in HCl M4 22 1+ minus ++ ( ) 0151
MnO H e Mn H O42
28 5 4minus + minus ++ + + 1507 S H e H S g+ ++ minus2 2 2 ( ) 0142
PbO H e Pb H O22
24 2 2+ + ++ minus + 1455 S O e S O4 6
22 3
22 2minus minus minus+ 008
Cl e Cl2 2 2+ minus minus 1358 AgBr s e Ag Br( )+ +minus minus
0071
Cr O H e Cr H O2 72 3
214 6 2 7minus + minus ++ + + 1350 2H ++ 2e-H2 00000
O g H e H O2 24 4 2( )+ ++ minus 1229 Pb e Pb2
2+ minus+ ndash0126
2 12 10 63 2 2IO H e I H Ominus + minus+ + + 1195 Sn e Sn22
+ minus+ ndash0137
Br l e Br2 2 2( )+ minus minus 1066 Ni e Ni2
2+ minus+ ndash0257
NO H e HNO H O3 2 23 2minus + minus+ + + 0934 Co e Co22
+ minus+ ndash0282
2 22
2
2Hg e Hg+ minus ++ 0920 Fe e Fe22
+ minus+ ndash0447
Cu I e CuI2+ minus minus+ + 086 Zn e Zn22
+ minus+ ndash0762
Ag e Ag+ minus+ 0799 Mn e Mn22
+ minus+ ndash1185
Hg e Hg2
22 2
+ minus+ 0797 Al e Al33
+ minus+ ndash1662
Fe e Fe3 2+ minus ++ 0771 Mg e Mg22
+ minus+ ndash2372
O g H e H O2 2 22 2( )+ ++ minus 0695 Na e Na+ minus+ ndash2710
I e I3 2 3minus minus minus+ 0536 Ca e Ca22
+ minus+ ndash2868
I e I2 2 2+ minus minus 0535 K e K+ minus+ ndash2931
Cu e Cu+ minus+ 0521 Li e Li+ minus+ ndash3040
Fe CN e Fe CN( ) ( )63
64minus minus minus+ 0358
14
2 Potenziometria
alluminio si dissolve mentre si deposita rame metallico Infatti i potenziali stan-dard delle due coppie redox sono
Cu2+ + 2endash Cu Edeg= +034 V
Al3+ + 3endash Al Edeg= ndash166 V
Nella soluzione quindi lo ione Cu2+ (forma ossidata della coppia con potenzialemaggiore) tende a ossidare Al (forma ridotta della coppia con potenziale minore)
TABELLA DEI POTENZIALI STANDARD DI RIDUZIONEAPPROFONDIMENTO
22 Tensione pratica (ddp) di una pila
Lrsquoinsieme dei conduttori di prima e di seconda specie che in sequenza opportunaformano una pila (o in generale un sistema elettrochimico) costituisce una catenagalvanica La differenza di potenziale (Ecella) che si misura ai capi di una pila durantelrsquoerogazione di corrente egrave dovuta a diversi contributi piugrave precisamente egrave uguale allasomma algebrica di tutte le cadute di tensione che si verificano lungo lrsquointero circuito
Ecella= E1 + E2 + E3 + E4 + E5 (25)
dove bull E1 egrave la ddp dovuta allrsquoeventuale passaggio di corrente nel circuito (cadutaohmica) bull E2 la ddp di contatto metallometallo (tensione di Volta) bull E3 la ddpdi contatto soluzionesoluzione (tensione o potenziale di giunzione liquida) bull E4 edE5 le ddp di contatto metallosoluzione (tensione di Nernst) per ciascun elettrodo
Esaminiamo ora il significato dei singoli contributi
Caduta ohmica Quando la cella egrave attraversata da corrente inevitabilmente si ve-rifica una caduta di tensione E = R times i (prima legge di Ohm) Ovviamente se lamisura del potenziale di cella viene effettuata in condizioni tali da minimizzareo eliminare il passaggio di corrente (cioegrave a circuito aperto) la caduta ohmica siannulla (cioegrave E1= 0)
Tensione di Volta Quando due diversi metalli vengono posti a contatto si generasempre una ddp Questo fenomeno detto effetto Volta egrave dovuto al fatto che glielettroni di conduzione sono trattenuti con diversa energia dai diversi metalli Per-ciograve il contatto fra due metalli provoca un trasferimento di elettroni istantaneo daparte del metallo che li trattiene con minore energia Il processo perograve non prose-gue indefinitamente il trasferimento di elettroni infatti prosegue fino allrsquoequili-brio quando insorge una ddp (in genere di pochi millivolt) sufficiente a bloccarlo
Si puograve verificare sperimentalmente (e dimostrare) che la ddp agli estremi diuna catena di conduttori di prima specie egrave uguale a quella che si stabilisce se i duemetalli che ne costituiscono gli estremi vengono posti a diretto contatto (fig 24)Di conseguenza se gli ingressi del misuratore di tensione sono costituiti dallo stessometallo lrsquoeffetto Volta complessivo egrave nullo (E2= 0)
In altri termini la formaossidata della coppia conpotenziale piugrave alto egraveossidante nei confrontidella forma ridotta dellacoppia con potenzialepiugrave basso
A rigore si dovrebbe usareil simbolo V (o ∆V)percheacute si tratta di unaddp misurata in una pilain funzione e dunquenon di una fem Il pedicelaquocellaraquo puntualizza che sitratta in generale di unacella elettrochimica
R egrave la resistenza delconduttore e i lrsquointensitagravedi corrente
15
CELLE GALVANICHE O PILE
Potenziale di giunzione liquida In una pila le due semicelle sono separate matenute in contatto elettrico mediante un setto poroso o un ponte salino che con-sente un mescolamento lentissimo (praticamente nullo) delle soluzioni Questidispositivi (si veda la figura 25) perograve creano unrsquoulteriore caduta di tensione fragli elettrodi detta potenziale di giunzione liquida (Eg) o anche potenziale dicontatto (o di diffusione) Il potenziale di giunzione liquida puograve essere sia po-sitivo sia negativo e quindi fa aumentare o viceversa diminuire la ddp fra glielettrodi
Lrsquoinsorgere di un potenziale di giunzione egrave causato dal fatto che gli ioni si dif-fondono con diversa mobilitagrave attraverso le superfici di contatto di due mezzi di-versi un setto poroso per esempio egrave diversamente permeabile agli ioni propriosecondo la loro mobilitagrave
Tensione di Nernst I potenziali di contatto metallosoluzione (E4 E5) si calco-lano in teoria mediante la legge di Nernst e perciograve sono detti potenziali nern-stiani
LA MOBILITAgrave DEGLI IONI IN SOLUZIONEAPPROFONDIMENTO
23 Calcolo della tensione teorica (fem) di una pilaSe si opera in modo da rendere trascurabili i primi tre termini dellrsquoequazione (22)la ddp ai capi della pila coincide in pratica con la sua fem che puograve essere cal-colata semplicemente in base agli ultimi due termini cioegrave ai potenziali di elettrodoNei calcoli occorre tenere presente che
a la fem di una pila in quanto strettamente collegata al lavoro da essa compiutodeve necessariamente avere segno positivo
b lrsquoelettrodo a potenziale maggiore su cui avviene la riduzione egrave il catodo lrsquoelet-trodo a potenziale minore su cui avviene lrsquoossidazione egrave lrsquoanodo
Di conseguenza la fem di una pila cioegrave di una cella elettrochimica ottenuta colle-gando due semicelle (catodica e anodica) egrave espressa dalla seguente relazione
Ecella = Ec ndash Ea (26)
ovvero
Ecella = Emaggiore ndash Eminore (27)
Questa seconda scrittura mostra chiaramente che la fem della pila egrave sempre posi-tiva anche nel caso in cui i potenziali delle due semicelle siano entrambi negativi
Indichiamo con Ec ilpotenziale del catodo (opotenziale catodico) econ Ea il potenzialedellrsquoanodo (o potenzialeanodico)
Figura 24Nonostante ogni superficie di contatto fra due metallisia sede di una ddp dovuta allrsquoeffetto Volta la ddpche si instaura fra rame e zinco egrave la stessa sia nel caso(a) sia nel caso (b) Infatti se cosigrave non fosse chiudendola catena aperta (a) si dovrebbe osservare un passaggiodi corrente e questo in realtagrave non avviene
a b
16
2 Potenziometria
ESEMPIO 1UNA IPOTETICA PILA Egrave COSTITUITA DALLE COPPIE REDOX Al3+Al E Ni2+NiQUAL Egrave LA FEM DELLA PILA SE LE ATTIVITAgrave DI TUTTE LE SPECIE IONICHE SONOUNITARIE
Dal momento che le attivitagrave sono unitarie il calcolo fornisce la tensione (o forzaelettromotrice) standard della pila
Innanzitutto dalla tabella dei potenziali standard si ricavano i potenziali stan-dard per ciascuna coppia redox
Al3+ + 3endash Al Eo
= ndash166 V
Ni2+ + 2endash Ni Eo
= ndash026 V
Lrsquoelettrodo della coppia Ni2+Ni costituisce il catodo percheacute ha il potenziale mag-giore mentre lrsquoelettrodo della coppia Al3+Al costituisce lrsquoanodo percheacute ha il poten-ziale minore Si puograve anche costruire un diagramma di questo tipo
Al3+Al Ni2+Ni H+H2
ndash166 ndash026 00000 Edeg(V rif a SHE)
Quindi la fem della pila in condizioni standard egrave
Ecella= Ec ndash Ea= Emaggiore ndash Eminore= ndash026 ndash (ndash166)= +140 V
La reazione di ossidoriduzione che genera la pila si ottiene formalmente combi-nando le due semireazioni bilanciate quella di riduzione al catodo e quella di os-sidazione allrsquoanodo Ciascuna semireazione deve essere moltiplicata per un fattorenumerico tale che il numero di elettroni ceduti dalla specie che si ossida sia uguale aquello degli elettroni acquistati dalla specie che si riduce Quindi nel caso dellrsquoesem-pio proposto si moltiplica la semireazione della coppia Al3+Al per 2 e quella dellacoppia Ni2+Ni per 3
2 middot (Al Al3+ + 3endash) Edeg= ndash(ndash166 V) (ndash)
3 middot (Ni2+ + 2endash Ni) Edeg= ndash026 V (+)
2Al + 3Ni2+ 2Al3+ + 3Ni Edeg= +140 V
Attenzione per ottenere il bilancio della reazione di cella si moltiplica per un coeffi-ciente opportuno ciascuna semireazione ma non il rispettivo potenziale Infatti i po-tenziali di elettrodo (e quindi anche il potenziale di cella) esprimono un lavoro elettricoper unitagrave di carica e perciograve sono proprietagrave intensive che non dipendono dalla quantitagravedi materia contenuta nel sistema ovvero dal numero di cariche elettriche trasportate
Se le attivitagrave non sono unitarie per calcolare il potenziale di elettrodo occorreapplicare lrsquoequazione di Nernst
Egrave ovvio comunque che il lavoro complessivo che puograve essere fornito da una piladipende anche dalla massa e dalla geometria degli elettrodi Per questo motivo unapila o un insieme di pile (cioegrave una batteria) che viene utilizzata per esempio permuovere un veicolo puograve avere dimensioni ingombranti Questo accadeva fino anon molti anni fa per le vecchie batterie al piombo ora sempre piugrave sostituite dabatterie come quelle al litio decisamente piugrave compatte e che infatti stanno rendendopossibile il progressivo passaggio allrsquoauto parzialmente o completamente elettrica
UNA IPOTETICA PILA Egrave COSTITUITA DALLE COPPIE REDOX Al3+Al E Ni2+NiQUAL Egrave LA FEM DELLA PILA SE LE ATTIVITAgrave DI TUTTE LE SPECIE IONICHE SONOUNITARIE
Nella pila la reazionedella coppiadella coppia Ni2+Ni(Ni2+ si riduce) avvienenel senso conforme allaconvenzione adottata per ipotenziali (elettroni asinistra) invece lareazione della coppiaAl3+Al (Al si ossida)avviene nel senso oppostoa quello convenzionalePerciograve il potenziale Edegdella coppia Al3+Al vieneconsiderato con segnoopposto a quello tabulato(+166 V) Se si sommaalgebricamente ilpotenziale dellrsquoelettrodoche si riduce (Ec) conquello dellrsquoelettrodo che siossida cambiato di segno(Ea) la tensione della pilarisulta positiva
17
CELLE GALVANICHE O PILE
ESEMPIO 2UNA IPOTETICA PILA Egrave COSTITUITA DALLE COPPIE REDOX Al3+Al E Ni2+NiQUAL Egrave LA FEM DELLA PILA A 25 degC SE LE CONCENTRAZIONI DELLE SPECIEIONICHE SONO RISPETTIVAMENTE [Al3+] = 2 10ndash2 M E [Ni2+] = 10ndash2 M
Approssimando le attivitagrave con le concentrazioni si ottiene
La situazione non egrave sostanzialmente cambiata rispetto alle condizioni standardpercheacute anche in questo caso la reazione di cella comporta lrsquoossidazione dellrsquoallumi-nio e la riduzione del nichel La fem della pila quindi egrave
Ecella= Ec ndash Ea= ndash032 ndash (ndash167)= +135 V
24 Alcuni tipi di pile
Pila DaniellUna semicella egrave costituita da una lamina di rame immersa in una soluzione diCuSO4 lrsquoaltra semicella da una lamina di zinco immersa in una soluzione di ZnSO4
(fig 25) Le due semicelle sono separate da un setto poroso (in pratica una mem-brana di vetro sinterizzato o analogo materiale inerte) oppure si trovano in duediversi recipienti collegati da un ponte salino
Le reazioni di elettrodo sono
Zn2+ + 2endash Zn Edeg= ndash0762 V
Cu2+ + 2endash Cu Edeg= 0342 V
Le concentrazioni dei sali nelle rispettive semicelle sono in genere tali da renderenegativo il semielemento di zinco che perciograve tende a cedere elettroni al rame (ossi-dandosi) La lamina di zinco egrave dunque il polo negativo (anodo) della pila e il rameegrave il polo positivo (catodo)
La rappresentazione della catena galvanica di questa pila secondo le convenzioniIUPAC egrave
(ndash) Zn(s)|ZnSO4(aq)||CuSO4(aq)|Cu(s) (+)
UNA IPOTETICA PILA Egrave COSTITUITA DALLE COPPIE REDOX Al3+Al E Ni2+NiQUAL Egrave LA FEM DELLA PILA A 25 degC SE LE CONCENTRAZIONI DELLE SPECIEIONICHE SONO RISPETTIVAMENTE [Al3+] = 2 10ndash2 M E [Ni2+] = 10ndash2 M
Si noti che se i duescomparti non fosseroscomparti non fosseroben separati dal settoben separati dal settoporoso ben presto gli ioniporoso ben presto gli ionirame disponibilirame disponibiliraggiungerebbero lrsquoraggiungerebbero lrsquoanododi zinco ossidandolo eandando a depositarsi sudi esso come Cumetallico nondiversamente da quanto sipuograve osservareimmergendo una barrettadi zinco in una soluzionedi solfato di rameesaurendo quindirapidamente la pila esviluppando calore
Figura 25Pila Daniell (a) con settoporoso e (b) con pontesalino
a b
18
2 Potenziometria
La coppia di barrette verticali (||) al centro rappresenta il setto poroso o il pontesalino che separano le due semicelle lrsquoanodo egrave scritto a sinistra e per ciascun elet-trodo la forma ridotta della coppia redox egrave scritta verso lrsquoesterno Le lettere scrittefra parentesi indicano lo stato fisico di ogni specie chimica
La reazione di cella egrave
Zn + Cu2+ Zn2+ + Cu
Per calcolare la fem teorica di questa pila che puograve anche trovarsi in condizionidiverse da quelle standard si applica la legge di Nernst a ciascuna semicella
(28)
(29)
I potenziali standard delle due semicelle sono cosigrave diversi fra loro che nelle normalicondizioni operative di una pila Daniell il rame rappresenta il polo positivo e lozinco il polo negativo
Sottraendo il potenziale minore da quello maggiore si ottiene il potenziale dicella
Ecella = ECu2+Cu - EZn2+Zn
Ponendo Edegcella = EdegCu2+Cu ndash EdegZn2+Zn (= 0342 V + 0762 V) e quindi sottraendo la(28 dalla 29) si ricava infine
Questa equazione consente dunque di calcolare il potenziale di Nernst se egrave notoil valore effettivo dellrsquoattivitagrave degli ioni Zn2+ e Cu2+ Tuttavia il calcolo si presta aerrori anche significativi lrsquoattivitagrave degli ioni per esempio varia in funzione dellaforza ionica della soluzione e non puograve essere calcolata Perciograve la fem reale piugraveesattamente la ddp che si misura si discosta dal valore calcolato sostanzialmenteper due motivi
a il sistema non si comporta in maniera ideale (per esempio gli elettrodi possonopolarizzarsi)
b il contributo della caduta ohmica (gtequazione 25) puograve essere praticamente an-nullato se nel circuito viene fatta circolare una corrente trascurabile invece ilpotenziale di giunzione liquida per quanto piccolo non puograve essere soppresso enon egrave prevedibile in base a equazioni teoriche
Pile a concentrazioneIn questo tipo di pila le due semicelle contengono due soluzioni di una stessa cop-pia redox ma a diversa concentrazione gli elettrodi sono inerti oppure dello stes-so metallo e le semicelle sono collegate da un setto poroso o da un ponte salino(fig 26)
In questo calcolotrascuriamo i contributidei termini E1 E2 E3 dellaequazione (25)
Lrsquoequazione rappresentain pratica la legge diNernst applicata allareazione redox globalescritta nel verso dellaspontaneitagrave tenendoconto degli elettroniscambiati (2) e inserendonellrsquoargomento dellogaritmo lrsquoinverso delquoziente di reazione
+
19
CELLE GALVANICHE O PILE
Le due soluzioni si scambiano elettroni attraverso il circuito esterno mentre ilsetto poroso (o il ponte salino) che le collega consente il passaggio di ioni e quin-di chiude il circuito Il sistema raggiunge lrsquoequilibrio quando le attivitagrave degli ioninelle due semicelle diventano uguali perciograve egrave prevedibile che nella soluzione piugravediluita avvenga lrsquoossidazione il rame metallico si dissolve e si formano ioni Cu2+ insoluzione questo dunque egrave lrsquoanodo Contemporaneamente gli elettroni passanonellrsquoaltro comparto (a destra in figura 26) attraverso il circuito esterno e riduconogli ioni Cu2+ che si depositano sullrsquoelettrodo come rame metallico questo dunqueegrave il catodo
In pratica egrave come se gli ioni Cu2+ si trasferissero dalla soluzione piugrave concentrataalla soluzione piugrave diluita Queste pile dunque trasformano in lavoro elettrico lrsquoe-nergia che si libera nel processo spontaneo con cui due soluzioni a diretto contattotendono a raggiungere lrsquoequilibrio di concentrazione
La rappresentazione convenzionale della catena elettrodica di questa pila a con-centrazione egrave la seguente
(-) Cu(s) |Cu2+(001 M)||Cu2+(1 M)|Cu(s) (+)
Per calcolare la tensione teorica della pila si applica la legge di Nernst a ciascun elet-trodo Approssimando le attivitagrave con le concentrazioni (a 25 degC) si ottiene
(soluzione piugrave diluita anodo)
(soluzione piugrave concentrata catodo)
Quindi
Ecella= Emaggiore ndash Eminore= 0342- 0283= 0059 V
ALTRI TIPI DI CELLE GALVANICHE O PILEAPPROFONDIMENTO
Figura 26Pila a concentrazione il compartoanodico (a sinistra) contiene ioni Cu2+
in concentrazione 001 M e il com-parto catodico (a destra) contieneioni Cu2+ in concentrazione 1 M Ilcollegamento fra le due semicelle egraverealizzato con un ponte salino
20
2 Potenziometria
STRUMENTAZIONEIn potenziometria si misura la differenza di potenziale che si stabilisce fra due semi-celle allo scopo di determinare la concentrazione di uno ione o per seguire lrsquoanda-mento di una titolazione
Il dispositivo completo per una misura potenziometrica (fig 27) consiste es-senzialmente di
bull un potenziometro o meglio un millivoltmetro elettronicobull un elettrodo di riferimentobull un elettrodo di misura
Il potenziometro serve per misurare la ddp fra i due elettrodi senza alterare il lorostato di equilibrio perciograve si lavora a corrente praticamente nulla
Gli elettrodi collegati al potenziometro sono immersi nella soluzione su cui sieffettuano le misure Lrsquoelettrodo di riferimento egrave costruito in modo tale da mante-nere costante il suo potenziale di conseguenza ogni variazione di ddp misurata egraveimputabile esclusivamente allrsquoelettrodo di misura (piugrave precisamente alla soluzioneanalizzata)
ELETTRODI DI RIFERIMENTOLrsquoelettrodo standard a idrogeno (SHE gtparagrafo 21) egrave lrsquoelettrodo di riferimentoprimario Tuttavia nella pratica quotidiana di laboratorio si usano elettrodi di ri-ferimento secondari piugrave semplici e maneggevoli che hanno comunque la proprie-tagrave di mantenere il proprio potenziale costante a temperatura costante Tratteremoora in maggior dettaglio gli elettrodi di uso piugrave comune
31 Elettrodo ad argentocloruro drsquoargento
Si tratta senzrsquoaltro dellrsquoelettrodo piugrave diffuso Il dispositivo egrave costituito da un sem-plice filo drsquoargento rivestito di AgCl e immerso in una soluzione di KCl (egrave dunqueun elettrodo di seconda specie) Il tutto egrave contenuto in un tubicino di vetro dotatodi setto poroso per assicurare il contatto elettrico con lrsquoesterno ovvero con la so-luzione in cui viene immerso lrsquooggetto dellrsquoanalisi
Figura 27Rappresentazione schematica deldispositivo completo per misurepotenziometriche
3
21
ELETTRODI DI RIFERIMENTO
La rappresentazione convenzionale dellrsquoelettrodo (fig 28) egrave
Ag(s)|AgCl(aq)|KCl(aq)
La reazione di elettrodo egrave
AgCl + endash Ag + Clndash
E il potenziale di elettrodo
E= EdegAgClAg
Considerando unitarie le attivitagrave dei solidi puri si ottiene
E= EdegAgClAg ndash 01984 10ndash3 T log[Clndash] (210)
Se lrsquoattivitagrave degli ioni cloruro egrave costante (a temperatura costante) il potenziale dielettrodo rimane costante Gli elettrodi piugrave comuni contengono soluzioni sature diKCl (circa 42 M) e perciograve sono detti saturi (SSC Saturated Silver-Silver ChlorideElectrode) A 25 degC il potenziale di SSC vale 0197 V Questo elettrodo puograve essereusato fino a 105 degC Nella tabella 1 ndash lab 1 (gtpag 39) sono riportati i potenziali alvariare della temperatura per lrsquoelettrodo saturo e 3 M
Gli anioni (come il solfuro) che formano con Ag+ sali meno solubili di AgClpossono danneggiare questo tipo di elettrodo Anche gli ossidanti e i riducenti fortie gli agenti complessanti possono interferire con la reazione di elettrodo per proteg-gere lrsquoelettrodo da queste sostanze si usa un elettrolita intermedio come nel casodellrsquoelettrodo a calomelano saturo (SCE gtparagrafo 32)
Gli elettrodi ad argentocloruro di argento sono usati come riferimento internonegli elettrodi a vetro (gtparagrafo 41)
32 Elettrodo a calomelano
laquoCalomelanoraquo egrave il nome comune del cloruro mercuroso (I) Hg2Cl2 che fa parteappunto di questo elettrodo (fig 29a) La rappresentazione convenzionale dellrsquoe-lettrodo egrave
Hg(l)|Hg2Cl2(s)|KCl(aq)
La reazione di elettrodo egrave
Hg2Cl2 + 2endash 2Hg + 2Clndash
e il potenziale di elettrodo in base alla legge di Nernst
In condizioni standard lrsquoattivitagrave di solidi e liquidi puri egrave considerata uguale a 1quindi
da cui
ndash 01984 10ndash3 T log|Clndash| (211)
Sono anche molto diffusigli elettrodi contenentiKCl 3 M cioegrave quasisaturi Il vantaggio egrave chein queste soluzioni non siformano cristalli di KClche possono danneggiarelrsquoelettrodo ostruendoil setto poroso che sta sulfondo
Figura 28Elettrodo ad AgAgCILa soluzione tamponeinterna contiene ioni K+
e CIndash ad attivitagrave costante
22
2 Potenziometria
Il potenziale dellrsquoelettrodo a calomelano dunque dipende solo dallrsquoattivitagrave delloione cloruro e dalla temperatura Se la temperatura egrave costante e lrsquoattivitagrave dello ionecloruro nella soluzione interna allrsquoelettrodo non varia il potenziale rimane costante
Gli elettrodi a calomelano piugrave comuni contengono soluzioni sature di KCl (circa42 M) e perciograve sono detti saturi (SCE Saturated Calomel Electrode) Si usano ancheelettrodi a KCl 1 M e 01 M la tabella 22 riporta il potenziale assunto da questielettrodi secondo la concentrazione di KCl
TABELLA 22 | Potenziale (mV) di alcuni elettrodi di riferimento a 25 degC
AgAgCl Calomelano HgHgO HgHgSO4 Thalamid
KCl 01 M 288 KCl 01 M 334 NaOH 01 M 165 H2SO4 05 M 682 KCl 3 M -567
KCl 1 M 235 KCl 1 M 280 NaOH 1 M 140 K2SO4 sat 650 KCl sat -577
KCl 3 M 210 KCl 35 M 250
KCl 35 M 205 KCl sat 241
KCl sat 199 NaCl sat 236
NaCl 3 M 209
NaCl sat 197
Lrsquoelettrodo a calomelano puograve essere usato fino a circa 70 degC a temperature piugrave alteil calomelano si dismuta (Hg2Cl2 Hg + HgCl2)
I solfuri gli ossidanti i forti riducenti e gli agenti complessanti che formanoamalgami con gli ioni Hg2
2+ possono danneggiare questo tipo di elettrodo Perciogravequando si lavora in presenza di queste sostanze si usano elettrodi a doppia giun-zione (fig 29b) in cui fra lrsquoelettrodo e la soluzione egrave interposto un contenitoreriempito con un elettrolita intermedio (per esempio KNO3)
Va infine segnalata la tendenza a non usare il mercurio per motivi tossicologicie questo spiega il progressivo abbandono nella pratica comune di questo tipo dielettrodo con grande rammarico dagli elettrochimici percheacute lrsquoelettrodo a calomela-no egrave il piugrave stabile
bullELETTRODI DI PRIMA E DI SECONDA SPECIE bullALTRI ELETTRODI DI RIFERIMENTO
APPROFONDIMENTI
Figura 29(a) Elettrodo a calomelano (b) Nella versione adoppia giunzione egrave presente una seconda cameraper lrsquoelettrolita intermedio che viene immessoattraverso la bocchetta laterale il setto porosoassicura il contatto elettrico con la soluzioneesterna
a b

11
CELLE GALVANICHE O PILE
vece dove la corrente circola (e non egrave nulla) la ddp in uscita dalla pila egrave sempreminore della fem a causa della laquocaduta di tensioneraquo provocata dal passaggio dicorrente Vale infatti con buona approssimazione la relazione
ddp= fem ndash Ri
dove bull R egrave la resistenza del circuito bull i lrsquointensitagrave di corrente
Per esempio se si collegauna comune pila da 45 Va una lampadina e simisura la ddp ai capi delcircuito si ottiene unvalore piugrave basso (peresempio 33 V)Il valore nominale ditensione sullrsquoinvolucrodella pila infatti indica lafem non la ddp inuscita (che dipende dallaquocaricoraquo effettivo delcircuito)
Figura 22Cella galvanica (pila) Il setto poroso divide (pur mantenen-doli in contatto elettrico fra loro) i due comparti del recipien-te che costituiscono le due semicelle Queste possono con-tenere due diversi elettroliti oppure lo stesso elettrolita maa diversa concentrazione in modo che allrsquoinizio i potenzialisiano diversi Nel primo caso le due lamine sono in generedi metalli differenti nel secondo caso sono uguali fra loroIl circuito esterno egrave formato da conduttori di prima specie ecomprende il dispositivo per la misura della tensione dellapila la corrente (i) e gli elettroni (e-) percorrono il circuito indirezioni opposte
Lrsquoelettrodo piugrave ricco di elettroni cioegrave a potenziale minore egrave detto anodo e costitu-isce il polo negativo della pila mentre lrsquoelettrodo piugrave povero di elettroni cioegrave a po-tenziale maggiore egrave detto catodo e costituisce il polo positivo Attraverso il circuitoesterno lrsquoanodo tende a cedere elettroni al catodo sotto la laquospintaraquo della spontaneatendenza del sistema a eguagliare i potenziali delle due semicelle
Il flusso di elettroni dallrsquoanodo al catodo altera quindi lo stato drsquoequilibrio ini-ziale di ciascuna semicella esso puograve venire ripristinato mediante reazioni di ossida-zione allrsquoanodo e contemporaneamente mediante reazioni di riduzione al catodoInfatti in base alla legge di Nernst (gtparagrafo 12) le reazioni di ossidazione tendo-no a innalzare il potenziale di elettrodo percheacute aumenta la concentrazione dellaforma ossidata (al numeratore dellrsquoargomento logaritmico) viceversa le reazioni diriduzione tendono ad abbassarlo La corrente che si stabilisce nel circuito egrave dovutaalla tendenza spontanea del sistema a raggiungere lrsquoequilibrio termodinamico per-ciograve quando i potenziali dei due elettrodi diventano uguali il flusso di elettronicessa e si dice che la pila egrave laquoscaricaraquo
La pila quindi egrave un dispositivo mediante il quale gli elettroni in gioco in unareazione redox passano attraverso un circuito da una specie chimica a unrsquoaltraOssidante e riducente infatti non vengono posti direttamente a contatto cosiccheacute glielettroni che si scambierebbero sono laquocostrettiraquo a passare attraverso il circuitoesterno Ciograve consente di convertire in energia elettrica e quindi in lavoro lrsquoenergiache si libera in un processo redox spontaneo che genererebbe calore il flusso di
12
2 Potenziometria
corrente si arresta quando egrave soddisfatta la costante di equilibrio della reazione chegenera la pila
Per ragioni storiche il funzionamento delle pile egrave stato spiegato in termini di unflusso di corrente elettrica dovuto a inesistenti cariche elettriche positive che migra-no dal polo a potenziale maggiore (catodo) verso il polo a potenziale minore (ano-do) Per questo motivo il verso convenzionale della corrente elettrica egrave opposto aquello in cui effettivamente circolano gli elettroni
21 Potenziali standard di ossidoriduzioneIn linea di principio per misurare la ddp fra una lamina di metallo e la soluzionein cui egrave immersa (si veda la figura 21a) occorre inserire il dispositivo di misura inmodo che un terminale sia collegato al metallo e lrsquoaltro alla soluzione In questomodo tuttavia si crea un nuovo contatto metallosoluzione e lo strumento finiscecol misurare la ddp fra i due metalli senza dare informazioni sul valore del poten-ziale di ciascuno di essi Quindi il potenziale assoluto di un singolo elettrodo o diuna coppia redox (che egrave la stessa cosa) non puograve essere misurato Si egrave costretti perciogravea effettuare una misura relativa dei potenziali ponendo a confronto due semicellela semicella di cui si vuole misurare il potenziale e una semicella di riferimento co-struita in modo da assumere un potenziale costante
In pratica lrsquoelettrodo di cui si vuole misurare il potenziale viene accoppiato a unelettrodo di riferimento e si misura la ddp di questa pila in condizioni precisamentedefinite
In base a criteri di opportunitagrave pratica e a considerazioni termodinamiche si egravescelto come elettrodo di riferimento il cosiddetto elettrodo standard a idrogeno(SHE Standard Hydrogen Electrode) A tale elettrodo (fig 23) viene assegnato perconvenzione un potenziale di semicella di 00000 V valido a tutte le temperatureper una soluzione che contiene ioni idrogeno ad attivitagrave unitaria e idrogeno gassosoa fugacitagrave unitaria (in pratica alla pressione parziale di 1 bar)
Nella prima fasedi sviluppodellrsquoelettrochimica siparlava anche di elettrodonormale a idrogeno(NHE Normal HydrogenElectrode) riferendosi a unelettrodo di platinoimmerso in una soluzione1 N di un acido forte inquesta soluzione perogravelrsquoattivitagrave del protone egravecirca 08 e quindi ilpotenziale realedellrsquoelettrodo egrave ben diversoda zero Per questo motivonon egrave corretto usare lasigla NHE per indicare ilriferimento standard[Fonte RW RametteJ Chem Ed vol 64 10(ott 1987)]
Figura 23Elettrodo a idrogeno secondo la realizzazione ideata da SPLSoslashrensen Nel gorgogliatore entra idrogeno gassoso purissi-mo che attraversa la soluzione acida e lambisce la lamina diplatino platinato prima di uscire dal secondo gorgogliatore Idue gorgogliatori e lrsquoampolla centrale contengono la stessasoluzione acida La lamina di platino egrave saldata a un filo di plati-no che fuoriesce dal tappo e assicura il collegamento elettricocon lo strumento di misura Il rubinetto e il sifone mettono incontatto la soluzione acida con lrsquoaltro elettrodo formando cosigraveuna pila Quando lrsquoattivitagrave di H+ e la fugacitagrave di H2 sono unitarielrsquoelettrodo egrave in condizioni standard
13
CELLE GALVANICHE O PILE
Le tabelle dei potenziali standard di ossidoriduzione riportano appunto i po-tenziali di coppie redox ad attivitagrave unitaria misurati rispetto allo SHE (a 25 degC) Sele reazioni sono scritte secondo le convenzioni IUPAC cioegrave nel senso della ridu-zione (elettroni a sinistra) egrave piugrave preciso parlare di potenziali standard di riduzione(tab 21) Nelle tabelle le coppie con potenziale positivo sono tendenzialmentepiugrave ossidanti della coppia H+H2 mentre le coppie con potenziale negativo sono piugraveriducenti
In generale per due coppie qualsiasi quella con potenziale standard maggiore egraveossidante (nelle condizioni imposte) nei confronti della coppia con potenziale stan-dard minore Per esempio se si immerge un foglio di alluminio in una soluzionecontenente solfato di rame e solfato di alluminio (ad attivitagrave unitaria) il foglio di
TABELLA 21 | Alcuni potenziali standard di riduzione (Edeg) misurati a 25 degC
Semireazione Edeg(V) Semireazione Edeg(V)
O H e O H O3 2 22 2+ + ++ minus 2076 Cu e Cu s2
2+ minus+ ( ) 0342
S O e SO2 82
422 2minus minus minus+ 2010 Hg Cl s e Hg Cl2 2 2 2 2( )+ +minus minus
0268
H O H e H O2 2 22 2 2+ ++ minus 1776 AgCl s e Ag Cl( )+ +minus minus
0222
MnO H e MnO s H O4 2 24 3 2minus + minus+ + + ( ) 1679 Cu e Cu2+ minus ++ 0153
Ce e Ce4 3+ minus ++ 172 Sn e Sn in HCl M4 22 1+ minus ++ ( ) 0151
MnO H e Mn H O42
28 5 4minus + minus ++ + + 1507 S H e H S g+ ++ minus2 2 2 ( ) 0142
PbO H e Pb H O22
24 2 2+ + ++ minus + 1455 S O e S O4 6
22 3
22 2minus minus minus+ 008
Cl e Cl2 2 2+ minus minus 1358 AgBr s e Ag Br( )+ +minus minus
0071
Cr O H e Cr H O2 72 3
214 6 2 7minus + minus ++ + + 1350 2H ++ 2e-H2 00000
O g H e H O2 24 4 2( )+ ++ minus 1229 Pb e Pb2
2+ minus+ ndash0126
2 12 10 63 2 2IO H e I H Ominus + minus+ + + 1195 Sn e Sn22
+ minus+ ndash0137
Br l e Br2 2 2( )+ minus minus 1066 Ni e Ni2
2+ minus+ ndash0257
NO H e HNO H O3 2 23 2minus + minus+ + + 0934 Co e Co22
+ minus+ ndash0282
2 22
2
2Hg e Hg+ minus ++ 0920 Fe e Fe22
+ minus+ ndash0447
Cu I e CuI2+ minus minus+ + 086 Zn e Zn22
+ minus+ ndash0762
Ag e Ag+ minus+ 0799 Mn e Mn22
+ minus+ ndash1185
Hg e Hg2
22 2
+ minus+ 0797 Al e Al33
+ minus+ ndash1662
Fe e Fe3 2+ minus ++ 0771 Mg e Mg22
+ minus+ ndash2372
O g H e H O2 2 22 2( )+ ++ minus 0695 Na e Na+ minus+ ndash2710
I e I3 2 3minus minus minus+ 0536 Ca e Ca22
+ minus+ ndash2868
I e I2 2 2+ minus minus 0535 K e K+ minus+ ndash2931
Cu e Cu+ minus+ 0521 Li e Li+ minus+ ndash3040
Fe CN e Fe CN( ) ( )63
64minus minus minus+ 0358
14
2 Potenziometria
alluminio si dissolve mentre si deposita rame metallico Infatti i potenziali stan-dard delle due coppie redox sono
Cu2+ + 2endash Cu Edeg= +034 V
Al3+ + 3endash Al Edeg= ndash166 V
Nella soluzione quindi lo ione Cu2+ (forma ossidata della coppia con potenzialemaggiore) tende a ossidare Al (forma ridotta della coppia con potenziale minore)
TABELLA DEI POTENZIALI STANDARD DI RIDUZIONEAPPROFONDIMENTO
22 Tensione pratica (ddp) di una pila
Lrsquoinsieme dei conduttori di prima e di seconda specie che in sequenza opportunaformano una pila (o in generale un sistema elettrochimico) costituisce una catenagalvanica La differenza di potenziale (Ecella) che si misura ai capi di una pila durantelrsquoerogazione di corrente egrave dovuta a diversi contributi piugrave precisamente egrave uguale allasomma algebrica di tutte le cadute di tensione che si verificano lungo lrsquointero circuito
Ecella= E1 + E2 + E3 + E4 + E5 (25)
dove bull E1 egrave la ddp dovuta allrsquoeventuale passaggio di corrente nel circuito (cadutaohmica) bull E2 la ddp di contatto metallometallo (tensione di Volta) bull E3 la ddpdi contatto soluzionesoluzione (tensione o potenziale di giunzione liquida) bull E4 edE5 le ddp di contatto metallosoluzione (tensione di Nernst) per ciascun elettrodo
Esaminiamo ora il significato dei singoli contributi
Caduta ohmica Quando la cella egrave attraversata da corrente inevitabilmente si ve-rifica una caduta di tensione E = R times i (prima legge di Ohm) Ovviamente se lamisura del potenziale di cella viene effettuata in condizioni tali da minimizzareo eliminare il passaggio di corrente (cioegrave a circuito aperto) la caduta ohmica siannulla (cioegrave E1= 0)
Tensione di Volta Quando due diversi metalli vengono posti a contatto si generasempre una ddp Questo fenomeno detto effetto Volta egrave dovuto al fatto che glielettroni di conduzione sono trattenuti con diversa energia dai diversi metalli Per-ciograve il contatto fra due metalli provoca un trasferimento di elettroni istantaneo daparte del metallo che li trattiene con minore energia Il processo perograve non prose-gue indefinitamente il trasferimento di elettroni infatti prosegue fino allrsquoequili-brio quando insorge una ddp (in genere di pochi millivolt) sufficiente a bloccarlo
Si puograve verificare sperimentalmente (e dimostrare) che la ddp agli estremi diuna catena di conduttori di prima specie egrave uguale a quella che si stabilisce se i duemetalli che ne costituiscono gli estremi vengono posti a diretto contatto (fig 24)Di conseguenza se gli ingressi del misuratore di tensione sono costituiti dallo stessometallo lrsquoeffetto Volta complessivo egrave nullo (E2= 0)
In altri termini la formaossidata della coppia conpotenziale piugrave alto egraveossidante nei confrontidella forma ridotta dellacoppia con potenzialepiugrave basso
A rigore si dovrebbe usareil simbolo V (o ∆V)percheacute si tratta di unaddp misurata in una pilain funzione e dunquenon di una fem Il pedicelaquocellaraquo puntualizza che sitratta in generale di unacella elettrochimica
R egrave la resistenza delconduttore e i lrsquointensitagravedi corrente
15
CELLE GALVANICHE O PILE
Potenziale di giunzione liquida In una pila le due semicelle sono separate matenute in contatto elettrico mediante un setto poroso o un ponte salino che con-sente un mescolamento lentissimo (praticamente nullo) delle soluzioni Questidispositivi (si veda la figura 25) perograve creano unrsquoulteriore caduta di tensione fragli elettrodi detta potenziale di giunzione liquida (Eg) o anche potenziale dicontatto (o di diffusione) Il potenziale di giunzione liquida puograve essere sia po-sitivo sia negativo e quindi fa aumentare o viceversa diminuire la ddp fra glielettrodi
Lrsquoinsorgere di un potenziale di giunzione egrave causato dal fatto che gli ioni si dif-fondono con diversa mobilitagrave attraverso le superfici di contatto di due mezzi di-versi un setto poroso per esempio egrave diversamente permeabile agli ioni propriosecondo la loro mobilitagrave
Tensione di Nernst I potenziali di contatto metallosoluzione (E4 E5) si calco-lano in teoria mediante la legge di Nernst e perciograve sono detti potenziali nern-stiani
LA MOBILITAgrave DEGLI IONI IN SOLUZIONEAPPROFONDIMENTO
23 Calcolo della tensione teorica (fem) di una pilaSe si opera in modo da rendere trascurabili i primi tre termini dellrsquoequazione (22)la ddp ai capi della pila coincide in pratica con la sua fem che puograve essere cal-colata semplicemente in base agli ultimi due termini cioegrave ai potenziali di elettrodoNei calcoli occorre tenere presente che
a la fem di una pila in quanto strettamente collegata al lavoro da essa compiutodeve necessariamente avere segno positivo
b lrsquoelettrodo a potenziale maggiore su cui avviene la riduzione egrave il catodo lrsquoelet-trodo a potenziale minore su cui avviene lrsquoossidazione egrave lrsquoanodo
Di conseguenza la fem di una pila cioegrave di una cella elettrochimica ottenuta colle-gando due semicelle (catodica e anodica) egrave espressa dalla seguente relazione
Ecella = Ec ndash Ea (26)
ovvero
Ecella = Emaggiore ndash Eminore (27)
Questa seconda scrittura mostra chiaramente che la fem della pila egrave sempre posi-tiva anche nel caso in cui i potenziali delle due semicelle siano entrambi negativi
Indichiamo con Ec ilpotenziale del catodo (opotenziale catodico) econ Ea il potenzialedellrsquoanodo (o potenzialeanodico)
Figura 24Nonostante ogni superficie di contatto fra due metallisia sede di una ddp dovuta allrsquoeffetto Volta la ddpche si instaura fra rame e zinco egrave la stessa sia nel caso(a) sia nel caso (b) Infatti se cosigrave non fosse chiudendola catena aperta (a) si dovrebbe osservare un passaggiodi corrente e questo in realtagrave non avviene
a b
16
2 Potenziometria
ESEMPIO 1UNA IPOTETICA PILA Egrave COSTITUITA DALLE COPPIE REDOX Al3+Al E Ni2+NiQUAL Egrave LA FEM DELLA PILA SE LE ATTIVITAgrave DI TUTTE LE SPECIE IONICHE SONOUNITARIE
Dal momento che le attivitagrave sono unitarie il calcolo fornisce la tensione (o forzaelettromotrice) standard della pila
Innanzitutto dalla tabella dei potenziali standard si ricavano i potenziali stan-dard per ciascuna coppia redox
Al3+ + 3endash Al Eo
= ndash166 V
Ni2+ + 2endash Ni Eo
= ndash026 V
Lrsquoelettrodo della coppia Ni2+Ni costituisce il catodo percheacute ha il potenziale mag-giore mentre lrsquoelettrodo della coppia Al3+Al costituisce lrsquoanodo percheacute ha il poten-ziale minore Si puograve anche costruire un diagramma di questo tipo
Al3+Al Ni2+Ni H+H2
ndash166 ndash026 00000 Edeg(V rif a SHE)
Quindi la fem della pila in condizioni standard egrave
Ecella= Ec ndash Ea= Emaggiore ndash Eminore= ndash026 ndash (ndash166)= +140 V
La reazione di ossidoriduzione che genera la pila si ottiene formalmente combi-nando le due semireazioni bilanciate quella di riduzione al catodo e quella di os-sidazione allrsquoanodo Ciascuna semireazione deve essere moltiplicata per un fattorenumerico tale che il numero di elettroni ceduti dalla specie che si ossida sia uguale aquello degli elettroni acquistati dalla specie che si riduce Quindi nel caso dellrsquoesem-pio proposto si moltiplica la semireazione della coppia Al3+Al per 2 e quella dellacoppia Ni2+Ni per 3
2 middot (Al Al3+ + 3endash) Edeg= ndash(ndash166 V) (ndash)
3 middot (Ni2+ + 2endash Ni) Edeg= ndash026 V (+)
2Al + 3Ni2+ 2Al3+ + 3Ni Edeg= +140 V
Attenzione per ottenere il bilancio della reazione di cella si moltiplica per un coeffi-ciente opportuno ciascuna semireazione ma non il rispettivo potenziale Infatti i po-tenziali di elettrodo (e quindi anche il potenziale di cella) esprimono un lavoro elettricoper unitagrave di carica e perciograve sono proprietagrave intensive che non dipendono dalla quantitagravedi materia contenuta nel sistema ovvero dal numero di cariche elettriche trasportate
Se le attivitagrave non sono unitarie per calcolare il potenziale di elettrodo occorreapplicare lrsquoequazione di Nernst
Egrave ovvio comunque che il lavoro complessivo che puograve essere fornito da una piladipende anche dalla massa e dalla geometria degli elettrodi Per questo motivo unapila o un insieme di pile (cioegrave una batteria) che viene utilizzata per esempio permuovere un veicolo puograve avere dimensioni ingombranti Questo accadeva fino anon molti anni fa per le vecchie batterie al piombo ora sempre piugrave sostituite dabatterie come quelle al litio decisamente piugrave compatte e che infatti stanno rendendopossibile il progressivo passaggio allrsquoauto parzialmente o completamente elettrica
UNA IPOTETICA PILA Egrave COSTITUITA DALLE COPPIE REDOX Al3+Al E Ni2+NiQUAL Egrave LA FEM DELLA PILA SE LE ATTIVITAgrave DI TUTTE LE SPECIE IONICHE SONOUNITARIE
Nella pila la reazionedella coppiadella coppia Ni2+Ni(Ni2+ si riduce) avvienenel senso conforme allaconvenzione adottata per ipotenziali (elettroni asinistra) invece lareazione della coppiaAl3+Al (Al si ossida)avviene nel senso oppostoa quello convenzionalePerciograve il potenziale Edegdella coppia Al3+Al vieneconsiderato con segnoopposto a quello tabulato(+166 V) Se si sommaalgebricamente ilpotenziale dellrsquoelettrodoche si riduce (Ec) conquello dellrsquoelettrodo che siossida cambiato di segno(Ea) la tensione della pilarisulta positiva
17
CELLE GALVANICHE O PILE
ESEMPIO 2UNA IPOTETICA PILA Egrave COSTITUITA DALLE COPPIE REDOX Al3+Al E Ni2+NiQUAL Egrave LA FEM DELLA PILA A 25 degC SE LE CONCENTRAZIONI DELLE SPECIEIONICHE SONO RISPETTIVAMENTE [Al3+] = 2 10ndash2 M E [Ni2+] = 10ndash2 M
Approssimando le attivitagrave con le concentrazioni si ottiene
La situazione non egrave sostanzialmente cambiata rispetto alle condizioni standardpercheacute anche in questo caso la reazione di cella comporta lrsquoossidazione dellrsquoallumi-nio e la riduzione del nichel La fem della pila quindi egrave
Ecella= Ec ndash Ea= ndash032 ndash (ndash167)= +135 V
24 Alcuni tipi di pile
Pila DaniellUna semicella egrave costituita da una lamina di rame immersa in una soluzione diCuSO4 lrsquoaltra semicella da una lamina di zinco immersa in una soluzione di ZnSO4
(fig 25) Le due semicelle sono separate da un setto poroso (in pratica una mem-brana di vetro sinterizzato o analogo materiale inerte) oppure si trovano in duediversi recipienti collegati da un ponte salino
Le reazioni di elettrodo sono
Zn2+ + 2endash Zn Edeg= ndash0762 V
Cu2+ + 2endash Cu Edeg= 0342 V
Le concentrazioni dei sali nelle rispettive semicelle sono in genere tali da renderenegativo il semielemento di zinco che perciograve tende a cedere elettroni al rame (ossi-dandosi) La lamina di zinco egrave dunque il polo negativo (anodo) della pila e il rameegrave il polo positivo (catodo)
La rappresentazione della catena galvanica di questa pila secondo le convenzioniIUPAC egrave
(ndash) Zn(s)|ZnSO4(aq)||CuSO4(aq)|Cu(s) (+)
UNA IPOTETICA PILA Egrave COSTITUITA DALLE COPPIE REDOX Al3+Al E Ni2+NiQUAL Egrave LA FEM DELLA PILA A 25 degC SE LE CONCENTRAZIONI DELLE SPECIEIONICHE SONO RISPETTIVAMENTE [Al3+] = 2 10ndash2 M E [Ni2+] = 10ndash2 M
Si noti che se i duescomparti non fosseroscomparti non fosseroben separati dal settoben separati dal settoporoso ben presto gli ioniporoso ben presto gli ionirame disponibilirame disponibiliraggiungerebbero lrsquoraggiungerebbero lrsquoanododi zinco ossidandolo eandando a depositarsi sudi esso come Cumetallico nondiversamente da quanto sipuograve osservareimmergendo una barrettadi zinco in una soluzionedi solfato di rameesaurendo quindirapidamente la pila esviluppando calore
Figura 25Pila Daniell (a) con settoporoso e (b) con pontesalino
a b
18
2 Potenziometria
La coppia di barrette verticali (||) al centro rappresenta il setto poroso o il pontesalino che separano le due semicelle lrsquoanodo egrave scritto a sinistra e per ciascun elet-trodo la forma ridotta della coppia redox egrave scritta verso lrsquoesterno Le lettere scrittefra parentesi indicano lo stato fisico di ogni specie chimica
La reazione di cella egrave
Zn + Cu2+ Zn2+ + Cu
Per calcolare la fem teorica di questa pila che puograve anche trovarsi in condizionidiverse da quelle standard si applica la legge di Nernst a ciascuna semicella
(28)
(29)
I potenziali standard delle due semicelle sono cosigrave diversi fra loro che nelle normalicondizioni operative di una pila Daniell il rame rappresenta il polo positivo e lozinco il polo negativo
Sottraendo il potenziale minore da quello maggiore si ottiene il potenziale dicella
Ecella = ECu2+Cu - EZn2+Zn
Ponendo Edegcella = EdegCu2+Cu ndash EdegZn2+Zn (= 0342 V + 0762 V) e quindi sottraendo la(28 dalla 29) si ricava infine
Questa equazione consente dunque di calcolare il potenziale di Nernst se egrave notoil valore effettivo dellrsquoattivitagrave degli ioni Zn2+ e Cu2+ Tuttavia il calcolo si presta aerrori anche significativi lrsquoattivitagrave degli ioni per esempio varia in funzione dellaforza ionica della soluzione e non puograve essere calcolata Perciograve la fem reale piugraveesattamente la ddp che si misura si discosta dal valore calcolato sostanzialmenteper due motivi
a il sistema non si comporta in maniera ideale (per esempio gli elettrodi possonopolarizzarsi)
b il contributo della caduta ohmica (gtequazione 25) puograve essere praticamente an-nullato se nel circuito viene fatta circolare una corrente trascurabile invece ilpotenziale di giunzione liquida per quanto piccolo non puograve essere soppresso enon egrave prevedibile in base a equazioni teoriche
Pile a concentrazioneIn questo tipo di pila le due semicelle contengono due soluzioni di una stessa cop-pia redox ma a diversa concentrazione gli elettrodi sono inerti oppure dello stes-so metallo e le semicelle sono collegate da un setto poroso o da un ponte salino(fig 26)
In questo calcolotrascuriamo i contributidei termini E1 E2 E3 dellaequazione (25)
Lrsquoequazione rappresentain pratica la legge diNernst applicata allareazione redox globalescritta nel verso dellaspontaneitagrave tenendoconto degli elettroniscambiati (2) e inserendonellrsquoargomento dellogaritmo lrsquoinverso delquoziente di reazione
+
19
CELLE GALVANICHE O PILE
Le due soluzioni si scambiano elettroni attraverso il circuito esterno mentre ilsetto poroso (o il ponte salino) che le collega consente il passaggio di ioni e quin-di chiude il circuito Il sistema raggiunge lrsquoequilibrio quando le attivitagrave degli ioninelle due semicelle diventano uguali perciograve egrave prevedibile che nella soluzione piugravediluita avvenga lrsquoossidazione il rame metallico si dissolve e si formano ioni Cu2+ insoluzione questo dunque egrave lrsquoanodo Contemporaneamente gli elettroni passanonellrsquoaltro comparto (a destra in figura 26) attraverso il circuito esterno e riduconogli ioni Cu2+ che si depositano sullrsquoelettrodo come rame metallico questo dunqueegrave il catodo
In pratica egrave come se gli ioni Cu2+ si trasferissero dalla soluzione piugrave concentrataalla soluzione piugrave diluita Queste pile dunque trasformano in lavoro elettrico lrsquoe-nergia che si libera nel processo spontaneo con cui due soluzioni a diretto contattotendono a raggiungere lrsquoequilibrio di concentrazione
La rappresentazione convenzionale della catena elettrodica di questa pila a con-centrazione egrave la seguente
(-) Cu(s) |Cu2+(001 M)||Cu2+(1 M)|Cu(s) (+)
Per calcolare la tensione teorica della pila si applica la legge di Nernst a ciascun elet-trodo Approssimando le attivitagrave con le concentrazioni (a 25 degC) si ottiene
(soluzione piugrave diluita anodo)
(soluzione piugrave concentrata catodo)
Quindi
Ecella= Emaggiore ndash Eminore= 0342- 0283= 0059 V
ALTRI TIPI DI CELLE GALVANICHE O PILEAPPROFONDIMENTO
Figura 26Pila a concentrazione il compartoanodico (a sinistra) contiene ioni Cu2+
in concentrazione 001 M e il com-parto catodico (a destra) contieneioni Cu2+ in concentrazione 1 M Ilcollegamento fra le due semicelle egraverealizzato con un ponte salino
20
2 Potenziometria
STRUMENTAZIONEIn potenziometria si misura la differenza di potenziale che si stabilisce fra due semi-celle allo scopo di determinare la concentrazione di uno ione o per seguire lrsquoanda-mento di una titolazione
Il dispositivo completo per una misura potenziometrica (fig 27) consiste es-senzialmente di
bull un potenziometro o meglio un millivoltmetro elettronicobull un elettrodo di riferimentobull un elettrodo di misura
Il potenziometro serve per misurare la ddp fra i due elettrodi senza alterare il lorostato di equilibrio perciograve si lavora a corrente praticamente nulla
Gli elettrodi collegati al potenziometro sono immersi nella soluzione su cui sieffettuano le misure Lrsquoelettrodo di riferimento egrave costruito in modo tale da mante-nere costante il suo potenziale di conseguenza ogni variazione di ddp misurata egraveimputabile esclusivamente allrsquoelettrodo di misura (piugrave precisamente alla soluzioneanalizzata)
ELETTRODI DI RIFERIMENTOLrsquoelettrodo standard a idrogeno (SHE gtparagrafo 21) egrave lrsquoelettrodo di riferimentoprimario Tuttavia nella pratica quotidiana di laboratorio si usano elettrodi di ri-ferimento secondari piugrave semplici e maneggevoli che hanno comunque la proprie-tagrave di mantenere il proprio potenziale costante a temperatura costante Tratteremoora in maggior dettaglio gli elettrodi di uso piugrave comune
31 Elettrodo ad argentocloruro drsquoargento
Si tratta senzrsquoaltro dellrsquoelettrodo piugrave diffuso Il dispositivo egrave costituito da un sem-plice filo drsquoargento rivestito di AgCl e immerso in una soluzione di KCl (egrave dunqueun elettrodo di seconda specie) Il tutto egrave contenuto in un tubicino di vetro dotatodi setto poroso per assicurare il contatto elettrico con lrsquoesterno ovvero con la so-luzione in cui viene immerso lrsquooggetto dellrsquoanalisi
Figura 27Rappresentazione schematica deldispositivo completo per misurepotenziometriche
3
21
ELETTRODI DI RIFERIMENTO
La rappresentazione convenzionale dellrsquoelettrodo (fig 28) egrave
Ag(s)|AgCl(aq)|KCl(aq)
La reazione di elettrodo egrave
AgCl + endash Ag + Clndash
E il potenziale di elettrodo
E= EdegAgClAg
Considerando unitarie le attivitagrave dei solidi puri si ottiene
E= EdegAgClAg ndash 01984 10ndash3 T log[Clndash] (210)
Se lrsquoattivitagrave degli ioni cloruro egrave costante (a temperatura costante) il potenziale dielettrodo rimane costante Gli elettrodi piugrave comuni contengono soluzioni sature diKCl (circa 42 M) e perciograve sono detti saturi (SSC Saturated Silver-Silver ChlorideElectrode) A 25 degC il potenziale di SSC vale 0197 V Questo elettrodo puograve essereusato fino a 105 degC Nella tabella 1 ndash lab 1 (gtpag 39) sono riportati i potenziali alvariare della temperatura per lrsquoelettrodo saturo e 3 M
Gli anioni (come il solfuro) che formano con Ag+ sali meno solubili di AgClpossono danneggiare questo tipo di elettrodo Anche gli ossidanti e i riducenti fortie gli agenti complessanti possono interferire con la reazione di elettrodo per proteg-gere lrsquoelettrodo da queste sostanze si usa un elettrolita intermedio come nel casodellrsquoelettrodo a calomelano saturo (SCE gtparagrafo 32)
Gli elettrodi ad argentocloruro di argento sono usati come riferimento internonegli elettrodi a vetro (gtparagrafo 41)
32 Elettrodo a calomelano
laquoCalomelanoraquo egrave il nome comune del cloruro mercuroso (I) Hg2Cl2 che fa parteappunto di questo elettrodo (fig 29a) La rappresentazione convenzionale dellrsquoe-lettrodo egrave
Hg(l)|Hg2Cl2(s)|KCl(aq)
La reazione di elettrodo egrave
Hg2Cl2 + 2endash 2Hg + 2Clndash
e il potenziale di elettrodo in base alla legge di Nernst
In condizioni standard lrsquoattivitagrave di solidi e liquidi puri egrave considerata uguale a 1quindi
da cui
ndash 01984 10ndash3 T log|Clndash| (211)
Sono anche molto diffusigli elettrodi contenentiKCl 3 M cioegrave quasisaturi Il vantaggio egrave chein queste soluzioni non siformano cristalli di KClche possono danneggiarelrsquoelettrodo ostruendoil setto poroso che sta sulfondo
Figura 28Elettrodo ad AgAgCILa soluzione tamponeinterna contiene ioni K+
e CIndash ad attivitagrave costante
22
2 Potenziometria
Il potenziale dellrsquoelettrodo a calomelano dunque dipende solo dallrsquoattivitagrave delloione cloruro e dalla temperatura Se la temperatura egrave costante e lrsquoattivitagrave dello ionecloruro nella soluzione interna allrsquoelettrodo non varia il potenziale rimane costante
Gli elettrodi a calomelano piugrave comuni contengono soluzioni sature di KCl (circa42 M) e perciograve sono detti saturi (SCE Saturated Calomel Electrode) Si usano ancheelettrodi a KCl 1 M e 01 M la tabella 22 riporta il potenziale assunto da questielettrodi secondo la concentrazione di KCl
TABELLA 22 | Potenziale (mV) di alcuni elettrodi di riferimento a 25 degC
AgAgCl Calomelano HgHgO HgHgSO4 Thalamid
KCl 01 M 288 KCl 01 M 334 NaOH 01 M 165 H2SO4 05 M 682 KCl 3 M -567
KCl 1 M 235 KCl 1 M 280 NaOH 1 M 140 K2SO4 sat 650 KCl sat -577
KCl 3 M 210 KCl 35 M 250
KCl 35 M 205 KCl sat 241
KCl sat 199 NaCl sat 236
NaCl 3 M 209
NaCl sat 197
Lrsquoelettrodo a calomelano puograve essere usato fino a circa 70 degC a temperature piugrave alteil calomelano si dismuta (Hg2Cl2 Hg + HgCl2)
I solfuri gli ossidanti i forti riducenti e gli agenti complessanti che formanoamalgami con gli ioni Hg2
2+ possono danneggiare questo tipo di elettrodo Perciogravequando si lavora in presenza di queste sostanze si usano elettrodi a doppia giun-zione (fig 29b) in cui fra lrsquoelettrodo e la soluzione egrave interposto un contenitoreriempito con un elettrolita intermedio (per esempio KNO3)
Va infine segnalata la tendenza a non usare il mercurio per motivi tossicologicie questo spiega il progressivo abbandono nella pratica comune di questo tipo dielettrodo con grande rammarico dagli elettrochimici percheacute lrsquoelettrodo a calomela-no egrave il piugrave stabile
bullELETTRODI DI PRIMA E DI SECONDA SPECIE bullALTRI ELETTRODI DI RIFERIMENTO
APPROFONDIMENTI
Figura 29(a) Elettrodo a calomelano (b) Nella versione adoppia giunzione egrave presente una seconda cameraper lrsquoelettrolita intermedio che viene immessoattraverso la bocchetta laterale il setto porosoassicura il contatto elettrico con la soluzioneesterna
a b

12
2 Potenziometria
corrente si arresta quando egrave soddisfatta la costante di equilibrio della reazione chegenera la pila
Per ragioni storiche il funzionamento delle pile egrave stato spiegato in termini di unflusso di corrente elettrica dovuto a inesistenti cariche elettriche positive che migra-no dal polo a potenziale maggiore (catodo) verso il polo a potenziale minore (ano-do) Per questo motivo il verso convenzionale della corrente elettrica egrave opposto aquello in cui effettivamente circolano gli elettroni
21 Potenziali standard di ossidoriduzioneIn linea di principio per misurare la ddp fra una lamina di metallo e la soluzionein cui egrave immersa (si veda la figura 21a) occorre inserire il dispositivo di misura inmodo che un terminale sia collegato al metallo e lrsquoaltro alla soluzione In questomodo tuttavia si crea un nuovo contatto metallosoluzione e lo strumento finiscecol misurare la ddp fra i due metalli senza dare informazioni sul valore del poten-ziale di ciascuno di essi Quindi il potenziale assoluto di un singolo elettrodo o diuna coppia redox (che egrave la stessa cosa) non puograve essere misurato Si egrave costretti perciogravea effettuare una misura relativa dei potenziali ponendo a confronto due semicellela semicella di cui si vuole misurare il potenziale e una semicella di riferimento co-struita in modo da assumere un potenziale costante
In pratica lrsquoelettrodo di cui si vuole misurare il potenziale viene accoppiato a unelettrodo di riferimento e si misura la ddp di questa pila in condizioni precisamentedefinite
In base a criteri di opportunitagrave pratica e a considerazioni termodinamiche si egravescelto come elettrodo di riferimento il cosiddetto elettrodo standard a idrogeno(SHE Standard Hydrogen Electrode) A tale elettrodo (fig 23) viene assegnato perconvenzione un potenziale di semicella di 00000 V valido a tutte le temperatureper una soluzione che contiene ioni idrogeno ad attivitagrave unitaria e idrogeno gassosoa fugacitagrave unitaria (in pratica alla pressione parziale di 1 bar)
Nella prima fasedi sviluppodellrsquoelettrochimica siparlava anche di elettrodonormale a idrogeno(NHE Normal HydrogenElectrode) riferendosi a unelettrodo di platinoimmerso in una soluzione1 N di un acido forte inquesta soluzione perogravelrsquoattivitagrave del protone egravecirca 08 e quindi ilpotenziale realedellrsquoelettrodo egrave ben diversoda zero Per questo motivonon egrave corretto usare lasigla NHE per indicare ilriferimento standard[Fonte RW RametteJ Chem Ed vol 64 10(ott 1987)]
Figura 23Elettrodo a idrogeno secondo la realizzazione ideata da SPLSoslashrensen Nel gorgogliatore entra idrogeno gassoso purissi-mo che attraversa la soluzione acida e lambisce la lamina diplatino platinato prima di uscire dal secondo gorgogliatore Idue gorgogliatori e lrsquoampolla centrale contengono la stessasoluzione acida La lamina di platino egrave saldata a un filo di plati-no che fuoriesce dal tappo e assicura il collegamento elettricocon lo strumento di misura Il rubinetto e il sifone mettono incontatto la soluzione acida con lrsquoaltro elettrodo formando cosigraveuna pila Quando lrsquoattivitagrave di H+ e la fugacitagrave di H2 sono unitarielrsquoelettrodo egrave in condizioni standard
13
CELLE GALVANICHE O PILE
Le tabelle dei potenziali standard di ossidoriduzione riportano appunto i po-tenziali di coppie redox ad attivitagrave unitaria misurati rispetto allo SHE (a 25 degC) Sele reazioni sono scritte secondo le convenzioni IUPAC cioegrave nel senso della ridu-zione (elettroni a sinistra) egrave piugrave preciso parlare di potenziali standard di riduzione(tab 21) Nelle tabelle le coppie con potenziale positivo sono tendenzialmentepiugrave ossidanti della coppia H+H2 mentre le coppie con potenziale negativo sono piugraveriducenti
In generale per due coppie qualsiasi quella con potenziale standard maggiore egraveossidante (nelle condizioni imposte) nei confronti della coppia con potenziale stan-dard minore Per esempio se si immerge un foglio di alluminio in una soluzionecontenente solfato di rame e solfato di alluminio (ad attivitagrave unitaria) il foglio di
TABELLA 21 | Alcuni potenziali standard di riduzione (Edeg) misurati a 25 degC
Semireazione Edeg(V) Semireazione Edeg(V)
O H e O H O3 2 22 2+ + ++ minus 2076 Cu e Cu s2
2+ minus+ ( ) 0342
S O e SO2 82
422 2minus minus minus+ 2010 Hg Cl s e Hg Cl2 2 2 2 2( )+ +minus minus
0268
H O H e H O2 2 22 2 2+ ++ minus 1776 AgCl s e Ag Cl( )+ +minus minus
0222
MnO H e MnO s H O4 2 24 3 2minus + minus+ + + ( ) 1679 Cu e Cu2+ minus ++ 0153
Ce e Ce4 3+ minus ++ 172 Sn e Sn in HCl M4 22 1+ minus ++ ( ) 0151
MnO H e Mn H O42
28 5 4minus + minus ++ + + 1507 S H e H S g+ ++ minus2 2 2 ( ) 0142
PbO H e Pb H O22
24 2 2+ + ++ minus + 1455 S O e S O4 6
22 3
22 2minus minus minus+ 008
Cl e Cl2 2 2+ minus minus 1358 AgBr s e Ag Br( )+ +minus minus
0071
Cr O H e Cr H O2 72 3
214 6 2 7minus + minus ++ + + 1350 2H ++ 2e-H2 00000
O g H e H O2 24 4 2( )+ ++ minus 1229 Pb e Pb2
2+ minus+ ndash0126
2 12 10 63 2 2IO H e I H Ominus + minus+ + + 1195 Sn e Sn22
+ minus+ ndash0137
Br l e Br2 2 2( )+ minus minus 1066 Ni e Ni2
2+ minus+ ndash0257
NO H e HNO H O3 2 23 2minus + minus+ + + 0934 Co e Co22
+ minus+ ndash0282
2 22
2
2Hg e Hg+ minus ++ 0920 Fe e Fe22
+ minus+ ndash0447
Cu I e CuI2+ minus minus+ + 086 Zn e Zn22
+ minus+ ndash0762
Ag e Ag+ minus+ 0799 Mn e Mn22
+ minus+ ndash1185
Hg e Hg2
22 2
+ minus+ 0797 Al e Al33
+ minus+ ndash1662
Fe e Fe3 2+ minus ++ 0771 Mg e Mg22
+ minus+ ndash2372
O g H e H O2 2 22 2( )+ ++ minus 0695 Na e Na+ minus+ ndash2710
I e I3 2 3minus minus minus+ 0536 Ca e Ca22
+ minus+ ndash2868
I e I2 2 2+ minus minus 0535 K e K+ minus+ ndash2931
Cu e Cu+ minus+ 0521 Li e Li+ minus+ ndash3040
Fe CN e Fe CN( ) ( )63
64minus minus minus+ 0358
14
2 Potenziometria
alluminio si dissolve mentre si deposita rame metallico Infatti i potenziali stan-dard delle due coppie redox sono
Cu2+ + 2endash Cu Edeg= +034 V
Al3+ + 3endash Al Edeg= ndash166 V
Nella soluzione quindi lo ione Cu2+ (forma ossidata della coppia con potenzialemaggiore) tende a ossidare Al (forma ridotta della coppia con potenziale minore)
TABELLA DEI POTENZIALI STANDARD DI RIDUZIONEAPPROFONDIMENTO
22 Tensione pratica (ddp) di una pila
Lrsquoinsieme dei conduttori di prima e di seconda specie che in sequenza opportunaformano una pila (o in generale un sistema elettrochimico) costituisce una catenagalvanica La differenza di potenziale (Ecella) che si misura ai capi di una pila durantelrsquoerogazione di corrente egrave dovuta a diversi contributi piugrave precisamente egrave uguale allasomma algebrica di tutte le cadute di tensione che si verificano lungo lrsquointero circuito
Ecella= E1 + E2 + E3 + E4 + E5 (25)
dove bull E1 egrave la ddp dovuta allrsquoeventuale passaggio di corrente nel circuito (cadutaohmica) bull E2 la ddp di contatto metallometallo (tensione di Volta) bull E3 la ddpdi contatto soluzionesoluzione (tensione o potenziale di giunzione liquida) bull E4 edE5 le ddp di contatto metallosoluzione (tensione di Nernst) per ciascun elettrodo
Esaminiamo ora il significato dei singoli contributi
Caduta ohmica Quando la cella egrave attraversata da corrente inevitabilmente si ve-rifica una caduta di tensione E = R times i (prima legge di Ohm) Ovviamente se lamisura del potenziale di cella viene effettuata in condizioni tali da minimizzareo eliminare il passaggio di corrente (cioegrave a circuito aperto) la caduta ohmica siannulla (cioegrave E1= 0)
Tensione di Volta Quando due diversi metalli vengono posti a contatto si generasempre una ddp Questo fenomeno detto effetto Volta egrave dovuto al fatto che glielettroni di conduzione sono trattenuti con diversa energia dai diversi metalli Per-ciograve il contatto fra due metalli provoca un trasferimento di elettroni istantaneo daparte del metallo che li trattiene con minore energia Il processo perograve non prose-gue indefinitamente il trasferimento di elettroni infatti prosegue fino allrsquoequili-brio quando insorge una ddp (in genere di pochi millivolt) sufficiente a bloccarlo
Si puograve verificare sperimentalmente (e dimostrare) che la ddp agli estremi diuna catena di conduttori di prima specie egrave uguale a quella che si stabilisce se i duemetalli che ne costituiscono gli estremi vengono posti a diretto contatto (fig 24)Di conseguenza se gli ingressi del misuratore di tensione sono costituiti dallo stessometallo lrsquoeffetto Volta complessivo egrave nullo (E2= 0)
In altri termini la formaossidata della coppia conpotenziale piugrave alto egraveossidante nei confrontidella forma ridotta dellacoppia con potenzialepiugrave basso
A rigore si dovrebbe usareil simbolo V (o ∆V)percheacute si tratta di unaddp misurata in una pilain funzione e dunquenon di una fem Il pedicelaquocellaraquo puntualizza che sitratta in generale di unacella elettrochimica
R egrave la resistenza delconduttore e i lrsquointensitagravedi corrente
15
CELLE GALVANICHE O PILE
Potenziale di giunzione liquida In una pila le due semicelle sono separate matenute in contatto elettrico mediante un setto poroso o un ponte salino che con-sente un mescolamento lentissimo (praticamente nullo) delle soluzioni Questidispositivi (si veda la figura 25) perograve creano unrsquoulteriore caduta di tensione fragli elettrodi detta potenziale di giunzione liquida (Eg) o anche potenziale dicontatto (o di diffusione) Il potenziale di giunzione liquida puograve essere sia po-sitivo sia negativo e quindi fa aumentare o viceversa diminuire la ddp fra glielettrodi
Lrsquoinsorgere di un potenziale di giunzione egrave causato dal fatto che gli ioni si dif-fondono con diversa mobilitagrave attraverso le superfici di contatto di due mezzi di-versi un setto poroso per esempio egrave diversamente permeabile agli ioni propriosecondo la loro mobilitagrave
Tensione di Nernst I potenziali di contatto metallosoluzione (E4 E5) si calco-lano in teoria mediante la legge di Nernst e perciograve sono detti potenziali nern-stiani
LA MOBILITAgrave DEGLI IONI IN SOLUZIONEAPPROFONDIMENTO
23 Calcolo della tensione teorica (fem) di una pilaSe si opera in modo da rendere trascurabili i primi tre termini dellrsquoequazione (22)la ddp ai capi della pila coincide in pratica con la sua fem che puograve essere cal-colata semplicemente in base agli ultimi due termini cioegrave ai potenziali di elettrodoNei calcoli occorre tenere presente che
a la fem di una pila in quanto strettamente collegata al lavoro da essa compiutodeve necessariamente avere segno positivo
b lrsquoelettrodo a potenziale maggiore su cui avviene la riduzione egrave il catodo lrsquoelet-trodo a potenziale minore su cui avviene lrsquoossidazione egrave lrsquoanodo
Di conseguenza la fem di una pila cioegrave di una cella elettrochimica ottenuta colle-gando due semicelle (catodica e anodica) egrave espressa dalla seguente relazione
Ecella = Ec ndash Ea (26)
ovvero
Ecella = Emaggiore ndash Eminore (27)
Questa seconda scrittura mostra chiaramente che la fem della pila egrave sempre posi-tiva anche nel caso in cui i potenziali delle due semicelle siano entrambi negativi
Indichiamo con Ec ilpotenziale del catodo (opotenziale catodico) econ Ea il potenzialedellrsquoanodo (o potenzialeanodico)
Figura 24Nonostante ogni superficie di contatto fra due metallisia sede di una ddp dovuta allrsquoeffetto Volta la ddpche si instaura fra rame e zinco egrave la stessa sia nel caso(a) sia nel caso (b) Infatti se cosigrave non fosse chiudendola catena aperta (a) si dovrebbe osservare un passaggiodi corrente e questo in realtagrave non avviene
a b
16
2 Potenziometria
ESEMPIO 1UNA IPOTETICA PILA Egrave COSTITUITA DALLE COPPIE REDOX Al3+Al E Ni2+NiQUAL Egrave LA FEM DELLA PILA SE LE ATTIVITAgrave DI TUTTE LE SPECIE IONICHE SONOUNITARIE
Dal momento che le attivitagrave sono unitarie il calcolo fornisce la tensione (o forzaelettromotrice) standard della pila
Innanzitutto dalla tabella dei potenziali standard si ricavano i potenziali stan-dard per ciascuna coppia redox
Al3+ + 3endash Al Eo
= ndash166 V
Ni2+ + 2endash Ni Eo
= ndash026 V
Lrsquoelettrodo della coppia Ni2+Ni costituisce il catodo percheacute ha il potenziale mag-giore mentre lrsquoelettrodo della coppia Al3+Al costituisce lrsquoanodo percheacute ha il poten-ziale minore Si puograve anche costruire un diagramma di questo tipo
Al3+Al Ni2+Ni H+H2
ndash166 ndash026 00000 Edeg(V rif a SHE)
Quindi la fem della pila in condizioni standard egrave
Ecella= Ec ndash Ea= Emaggiore ndash Eminore= ndash026 ndash (ndash166)= +140 V
La reazione di ossidoriduzione che genera la pila si ottiene formalmente combi-nando le due semireazioni bilanciate quella di riduzione al catodo e quella di os-sidazione allrsquoanodo Ciascuna semireazione deve essere moltiplicata per un fattorenumerico tale che il numero di elettroni ceduti dalla specie che si ossida sia uguale aquello degli elettroni acquistati dalla specie che si riduce Quindi nel caso dellrsquoesem-pio proposto si moltiplica la semireazione della coppia Al3+Al per 2 e quella dellacoppia Ni2+Ni per 3
2 middot (Al Al3+ + 3endash) Edeg= ndash(ndash166 V) (ndash)
3 middot (Ni2+ + 2endash Ni) Edeg= ndash026 V (+)
2Al + 3Ni2+ 2Al3+ + 3Ni Edeg= +140 V
Attenzione per ottenere il bilancio della reazione di cella si moltiplica per un coeffi-ciente opportuno ciascuna semireazione ma non il rispettivo potenziale Infatti i po-tenziali di elettrodo (e quindi anche il potenziale di cella) esprimono un lavoro elettricoper unitagrave di carica e perciograve sono proprietagrave intensive che non dipendono dalla quantitagravedi materia contenuta nel sistema ovvero dal numero di cariche elettriche trasportate
Se le attivitagrave non sono unitarie per calcolare il potenziale di elettrodo occorreapplicare lrsquoequazione di Nernst
Egrave ovvio comunque che il lavoro complessivo che puograve essere fornito da una piladipende anche dalla massa e dalla geometria degli elettrodi Per questo motivo unapila o un insieme di pile (cioegrave una batteria) che viene utilizzata per esempio permuovere un veicolo puograve avere dimensioni ingombranti Questo accadeva fino anon molti anni fa per le vecchie batterie al piombo ora sempre piugrave sostituite dabatterie come quelle al litio decisamente piugrave compatte e che infatti stanno rendendopossibile il progressivo passaggio allrsquoauto parzialmente o completamente elettrica
UNA IPOTETICA PILA Egrave COSTITUITA DALLE COPPIE REDOX Al3+Al E Ni2+NiQUAL Egrave LA FEM DELLA PILA SE LE ATTIVITAgrave DI TUTTE LE SPECIE IONICHE SONOUNITARIE
Nella pila la reazionedella coppiadella coppia Ni2+Ni(Ni2+ si riduce) avvienenel senso conforme allaconvenzione adottata per ipotenziali (elettroni asinistra) invece lareazione della coppiaAl3+Al (Al si ossida)avviene nel senso oppostoa quello convenzionalePerciograve il potenziale Edegdella coppia Al3+Al vieneconsiderato con segnoopposto a quello tabulato(+166 V) Se si sommaalgebricamente ilpotenziale dellrsquoelettrodoche si riduce (Ec) conquello dellrsquoelettrodo che siossida cambiato di segno(Ea) la tensione della pilarisulta positiva
17
CELLE GALVANICHE O PILE
ESEMPIO 2UNA IPOTETICA PILA Egrave COSTITUITA DALLE COPPIE REDOX Al3+Al E Ni2+NiQUAL Egrave LA FEM DELLA PILA A 25 degC SE LE CONCENTRAZIONI DELLE SPECIEIONICHE SONO RISPETTIVAMENTE [Al3+] = 2 10ndash2 M E [Ni2+] = 10ndash2 M
Approssimando le attivitagrave con le concentrazioni si ottiene
La situazione non egrave sostanzialmente cambiata rispetto alle condizioni standardpercheacute anche in questo caso la reazione di cella comporta lrsquoossidazione dellrsquoallumi-nio e la riduzione del nichel La fem della pila quindi egrave
Ecella= Ec ndash Ea= ndash032 ndash (ndash167)= +135 V
24 Alcuni tipi di pile
Pila DaniellUna semicella egrave costituita da una lamina di rame immersa in una soluzione diCuSO4 lrsquoaltra semicella da una lamina di zinco immersa in una soluzione di ZnSO4
(fig 25) Le due semicelle sono separate da un setto poroso (in pratica una mem-brana di vetro sinterizzato o analogo materiale inerte) oppure si trovano in duediversi recipienti collegati da un ponte salino
Le reazioni di elettrodo sono
Zn2+ + 2endash Zn Edeg= ndash0762 V
Cu2+ + 2endash Cu Edeg= 0342 V
Le concentrazioni dei sali nelle rispettive semicelle sono in genere tali da renderenegativo il semielemento di zinco che perciograve tende a cedere elettroni al rame (ossi-dandosi) La lamina di zinco egrave dunque il polo negativo (anodo) della pila e il rameegrave il polo positivo (catodo)
La rappresentazione della catena galvanica di questa pila secondo le convenzioniIUPAC egrave
(ndash) Zn(s)|ZnSO4(aq)||CuSO4(aq)|Cu(s) (+)
UNA IPOTETICA PILA Egrave COSTITUITA DALLE COPPIE REDOX Al3+Al E Ni2+NiQUAL Egrave LA FEM DELLA PILA A 25 degC SE LE CONCENTRAZIONI DELLE SPECIEIONICHE SONO RISPETTIVAMENTE [Al3+] = 2 10ndash2 M E [Ni2+] = 10ndash2 M
Si noti che se i duescomparti non fosseroscomparti non fosseroben separati dal settoben separati dal settoporoso ben presto gli ioniporoso ben presto gli ionirame disponibilirame disponibiliraggiungerebbero lrsquoraggiungerebbero lrsquoanododi zinco ossidandolo eandando a depositarsi sudi esso come Cumetallico nondiversamente da quanto sipuograve osservareimmergendo una barrettadi zinco in una soluzionedi solfato di rameesaurendo quindirapidamente la pila esviluppando calore
Figura 25Pila Daniell (a) con settoporoso e (b) con pontesalino
a b
18
2 Potenziometria
La coppia di barrette verticali (||) al centro rappresenta il setto poroso o il pontesalino che separano le due semicelle lrsquoanodo egrave scritto a sinistra e per ciascun elet-trodo la forma ridotta della coppia redox egrave scritta verso lrsquoesterno Le lettere scrittefra parentesi indicano lo stato fisico di ogni specie chimica
La reazione di cella egrave
Zn + Cu2+ Zn2+ + Cu
Per calcolare la fem teorica di questa pila che puograve anche trovarsi in condizionidiverse da quelle standard si applica la legge di Nernst a ciascuna semicella
(28)
(29)
I potenziali standard delle due semicelle sono cosigrave diversi fra loro che nelle normalicondizioni operative di una pila Daniell il rame rappresenta il polo positivo e lozinco il polo negativo
Sottraendo il potenziale minore da quello maggiore si ottiene il potenziale dicella
Ecella = ECu2+Cu - EZn2+Zn
Ponendo Edegcella = EdegCu2+Cu ndash EdegZn2+Zn (= 0342 V + 0762 V) e quindi sottraendo la(28 dalla 29) si ricava infine
Questa equazione consente dunque di calcolare il potenziale di Nernst se egrave notoil valore effettivo dellrsquoattivitagrave degli ioni Zn2+ e Cu2+ Tuttavia il calcolo si presta aerrori anche significativi lrsquoattivitagrave degli ioni per esempio varia in funzione dellaforza ionica della soluzione e non puograve essere calcolata Perciograve la fem reale piugraveesattamente la ddp che si misura si discosta dal valore calcolato sostanzialmenteper due motivi
a il sistema non si comporta in maniera ideale (per esempio gli elettrodi possonopolarizzarsi)
b il contributo della caduta ohmica (gtequazione 25) puograve essere praticamente an-nullato se nel circuito viene fatta circolare una corrente trascurabile invece ilpotenziale di giunzione liquida per quanto piccolo non puograve essere soppresso enon egrave prevedibile in base a equazioni teoriche
Pile a concentrazioneIn questo tipo di pila le due semicelle contengono due soluzioni di una stessa cop-pia redox ma a diversa concentrazione gli elettrodi sono inerti oppure dello stes-so metallo e le semicelle sono collegate da un setto poroso o da un ponte salino(fig 26)
In questo calcolotrascuriamo i contributidei termini E1 E2 E3 dellaequazione (25)
Lrsquoequazione rappresentain pratica la legge diNernst applicata allareazione redox globalescritta nel verso dellaspontaneitagrave tenendoconto degli elettroniscambiati (2) e inserendonellrsquoargomento dellogaritmo lrsquoinverso delquoziente di reazione
+
19
CELLE GALVANICHE O PILE
Le due soluzioni si scambiano elettroni attraverso il circuito esterno mentre ilsetto poroso (o il ponte salino) che le collega consente il passaggio di ioni e quin-di chiude il circuito Il sistema raggiunge lrsquoequilibrio quando le attivitagrave degli ioninelle due semicelle diventano uguali perciograve egrave prevedibile che nella soluzione piugravediluita avvenga lrsquoossidazione il rame metallico si dissolve e si formano ioni Cu2+ insoluzione questo dunque egrave lrsquoanodo Contemporaneamente gli elettroni passanonellrsquoaltro comparto (a destra in figura 26) attraverso il circuito esterno e riduconogli ioni Cu2+ che si depositano sullrsquoelettrodo come rame metallico questo dunqueegrave il catodo
In pratica egrave come se gli ioni Cu2+ si trasferissero dalla soluzione piugrave concentrataalla soluzione piugrave diluita Queste pile dunque trasformano in lavoro elettrico lrsquoe-nergia che si libera nel processo spontaneo con cui due soluzioni a diretto contattotendono a raggiungere lrsquoequilibrio di concentrazione
La rappresentazione convenzionale della catena elettrodica di questa pila a con-centrazione egrave la seguente
(-) Cu(s) |Cu2+(001 M)||Cu2+(1 M)|Cu(s) (+)
Per calcolare la tensione teorica della pila si applica la legge di Nernst a ciascun elet-trodo Approssimando le attivitagrave con le concentrazioni (a 25 degC) si ottiene
(soluzione piugrave diluita anodo)
(soluzione piugrave concentrata catodo)
Quindi
Ecella= Emaggiore ndash Eminore= 0342- 0283= 0059 V
ALTRI TIPI DI CELLE GALVANICHE O PILEAPPROFONDIMENTO
Figura 26Pila a concentrazione il compartoanodico (a sinistra) contiene ioni Cu2+
in concentrazione 001 M e il com-parto catodico (a destra) contieneioni Cu2+ in concentrazione 1 M Ilcollegamento fra le due semicelle egraverealizzato con un ponte salino
20
2 Potenziometria
STRUMENTAZIONEIn potenziometria si misura la differenza di potenziale che si stabilisce fra due semi-celle allo scopo di determinare la concentrazione di uno ione o per seguire lrsquoanda-mento di una titolazione
Il dispositivo completo per una misura potenziometrica (fig 27) consiste es-senzialmente di
bull un potenziometro o meglio un millivoltmetro elettronicobull un elettrodo di riferimentobull un elettrodo di misura
Il potenziometro serve per misurare la ddp fra i due elettrodi senza alterare il lorostato di equilibrio perciograve si lavora a corrente praticamente nulla
Gli elettrodi collegati al potenziometro sono immersi nella soluzione su cui sieffettuano le misure Lrsquoelettrodo di riferimento egrave costruito in modo tale da mante-nere costante il suo potenziale di conseguenza ogni variazione di ddp misurata egraveimputabile esclusivamente allrsquoelettrodo di misura (piugrave precisamente alla soluzioneanalizzata)
ELETTRODI DI RIFERIMENTOLrsquoelettrodo standard a idrogeno (SHE gtparagrafo 21) egrave lrsquoelettrodo di riferimentoprimario Tuttavia nella pratica quotidiana di laboratorio si usano elettrodi di ri-ferimento secondari piugrave semplici e maneggevoli che hanno comunque la proprie-tagrave di mantenere il proprio potenziale costante a temperatura costante Tratteremoora in maggior dettaglio gli elettrodi di uso piugrave comune
31 Elettrodo ad argentocloruro drsquoargento
Si tratta senzrsquoaltro dellrsquoelettrodo piugrave diffuso Il dispositivo egrave costituito da un sem-plice filo drsquoargento rivestito di AgCl e immerso in una soluzione di KCl (egrave dunqueun elettrodo di seconda specie) Il tutto egrave contenuto in un tubicino di vetro dotatodi setto poroso per assicurare il contatto elettrico con lrsquoesterno ovvero con la so-luzione in cui viene immerso lrsquooggetto dellrsquoanalisi
Figura 27Rappresentazione schematica deldispositivo completo per misurepotenziometriche
3
21
ELETTRODI DI RIFERIMENTO
La rappresentazione convenzionale dellrsquoelettrodo (fig 28) egrave
Ag(s)|AgCl(aq)|KCl(aq)
La reazione di elettrodo egrave
AgCl + endash Ag + Clndash
E il potenziale di elettrodo
E= EdegAgClAg
Considerando unitarie le attivitagrave dei solidi puri si ottiene
E= EdegAgClAg ndash 01984 10ndash3 T log[Clndash] (210)
Se lrsquoattivitagrave degli ioni cloruro egrave costante (a temperatura costante) il potenziale dielettrodo rimane costante Gli elettrodi piugrave comuni contengono soluzioni sature diKCl (circa 42 M) e perciograve sono detti saturi (SSC Saturated Silver-Silver ChlorideElectrode) A 25 degC il potenziale di SSC vale 0197 V Questo elettrodo puograve essereusato fino a 105 degC Nella tabella 1 ndash lab 1 (gtpag 39) sono riportati i potenziali alvariare della temperatura per lrsquoelettrodo saturo e 3 M
Gli anioni (come il solfuro) che formano con Ag+ sali meno solubili di AgClpossono danneggiare questo tipo di elettrodo Anche gli ossidanti e i riducenti fortie gli agenti complessanti possono interferire con la reazione di elettrodo per proteg-gere lrsquoelettrodo da queste sostanze si usa un elettrolita intermedio come nel casodellrsquoelettrodo a calomelano saturo (SCE gtparagrafo 32)
Gli elettrodi ad argentocloruro di argento sono usati come riferimento internonegli elettrodi a vetro (gtparagrafo 41)
32 Elettrodo a calomelano
laquoCalomelanoraquo egrave il nome comune del cloruro mercuroso (I) Hg2Cl2 che fa parteappunto di questo elettrodo (fig 29a) La rappresentazione convenzionale dellrsquoe-lettrodo egrave
Hg(l)|Hg2Cl2(s)|KCl(aq)
La reazione di elettrodo egrave
Hg2Cl2 + 2endash 2Hg + 2Clndash
e il potenziale di elettrodo in base alla legge di Nernst
In condizioni standard lrsquoattivitagrave di solidi e liquidi puri egrave considerata uguale a 1quindi
da cui
ndash 01984 10ndash3 T log|Clndash| (211)
Sono anche molto diffusigli elettrodi contenentiKCl 3 M cioegrave quasisaturi Il vantaggio egrave chein queste soluzioni non siformano cristalli di KClche possono danneggiarelrsquoelettrodo ostruendoil setto poroso che sta sulfondo
Figura 28Elettrodo ad AgAgCILa soluzione tamponeinterna contiene ioni K+
e CIndash ad attivitagrave costante
22
2 Potenziometria
Il potenziale dellrsquoelettrodo a calomelano dunque dipende solo dallrsquoattivitagrave delloione cloruro e dalla temperatura Se la temperatura egrave costante e lrsquoattivitagrave dello ionecloruro nella soluzione interna allrsquoelettrodo non varia il potenziale rimane costante
Gli elettrodi a calomelano piugrave comuni contengono soluzioni sature di KCl (circa42 M) e perciograve sono detti saturi (SCE Saturated Calomel Electrode) Si usano ancheelettrodi a KCl 1 M e 01 M la tabella 22 riporta il potenziale assunto da questielettrodi secondo la concentrazione di KCl
TABELLA 22 | Potenziale (mV) di alcuni elettrodi di riferimento a 25 degC
AgAgCl Calomelano HgHgO HgHgSO4 Thalamid
KCl 01 M 288 KCl 01 M 334 NaOH 01 M 165 H2SO4 05 M 682 KCl 3 M -567
KCl 1 M 235 KCl 1 M 280 NaOH 1 M 140 K2SO4 sat 650 KCl sat -577
KCl 3 M 210 KCl 35 M 250
KCl 35 M 205 KCl sat 241
KCl sat 199 NaCl sat 236
NaCl 3 M 209
NaCl sat 197
Lrsquoelettrodo a calomelano puograve essere usato fino a circa 70 degC a temperature piugrave alteil calomelano si dismuta (Hg2Cl2 Hg + HgCl2)
I solfuri gli ossidanti i forti riducenti e gli agenti complessanti che formanoamalgami con gli ioni Hg2
2+ possono danneggiare questo tipo di elettrodo Perciogravequando si lavora in presenza di queste sostanze si usano elettrodi a doppia giun-zione (fig 29b) in cui fra lrsquoelettrodo e la soluzione egrave interposto un contenitoreriempito con un elettrolita intermedio (per esempio KNO3)
Va infine segnalata la tendenza a non usare il mercurio per motivi tossicologicie questo spiega il progressivo abbandono nella pratica comune di questo tipo dielettrodo con grande rammarico dagli elettrochimici percheacute lrsquoelettrodo a calomela-no egrave il piugrave stabile
bullELETTRODI DI PRIMA E DI SECONDA SPECIE bullALTRI ELETTRODI DI RIFERIMENTO
APPROFONDIMENTI
Figura 29(a) Elettrodo a calomelano (b) Nella versione adoppia giunzione egrave presente una seconda cameraper lrsquoelettrolita intermedio che viene immessoattraverso la bocchetta laterale il setto porosoassicura il contatto elettrico con la soluzioneesterna
a b

13
CELLE GALVANICHE O PILE
Le tabelle dei potenziali standard di ossidoriduzione riportano appunto i po-tenziali di coppie redox ad attivitagrave unitaria misurati rispetto allo SHE (a 25 degC) Sele reazioni sono scritte secondo le convenzioni IUPAC cioegrave nel senso della ridu-zione (elettroni a sinistra) egrave piugrave preciso parlare di potenziali standard di riduzione(tab 21) Nelle tabelle le coppie con potenziale positivo sono tendenzialmentepiugrave ossidanti della coppia H+H2 mentre le coppie con potenziale negativo sono piugraveriducenti
In generale per due coppie qualsiasi quella con potenziale standard maggiore egraveossidante (nelle condizioni imposte) nei confronti della coppia con potenziale stan-dard minore Per esempio se si immerge un foglio di alluminio in una soluzionecontenente solfato di rame e solfato di alluminio (ad attivitagrave unitaria) il foglio di
TABELLA 21 | Alcuni potenziali standard di riduzione (Edeg) misurati a 25 degC
Semireazione Edeg(V) Semireazione Edeg(V)
O H e O H O3 2 22 2+ + ++ minus 2076 Cu e Cu s2
2+ minus+ ( ) 0342
S O e SO2 82
422 2minus minus minus+ 2010 Hg Cl s e Hg Cl2 2 2 2 2( )+ +minus minus
0268
H O H e H O2 2 22 2 2+ ++ minus 1776 AgCl s e Ag Cl( )+ +minus minus
0222
MnO H e MnO s H O4 2 24 3 2minus + minus+ + + ( ) 1679 Cu e Cu2+ minus ++ 0153
Ce e Ce4 3+ minus ++ 172 Sn e Sn in HCl M4 22 1+ minus ++ ( ) 0151
MnO H e Mn H O42
28 5 4minus + minus ++ + + 1507 S H e H S g+ ++ minus2 2 2 ( ) 0142
PbO H e Pb H O22
24 2 2+ + ++ minus + 1455 S O e S O4 6
22 3
22 2minus minus minus+ 008
Cl e Cl2 2 2+ minus minus 1358 AgBr s e Ag Br( )+ +minus minus
0071
Cr O H e Cr H O2 72 3
214 6 2 7minus + minus ++ + + 1350 2H ++ 2e-H2 00000
O g H e H O2 24 4 2( )+ ++ minus 1229 Pb e Pb2
2+ minus+ ndash0126
2 12 10 63 2 2IO H e I H Ominus + minus+ + + 1195 Sn e Sn22
+ minus+ ndash0137
Br l e Br2 2 2( )+ minus minus 1066 Ni e Ni2
2+ minus+ ndash0257
NO H e HNO H O3 2 23 2minus + minus+ + + 0934 Co e Co22
+ minus+ ndash0282
2 22
2
2Hg e Hg+ minus ++ 0920 Fe e Fe22
+ minus+ ndash0447
Cu I e CuI2+ minus minus+ + 086 Zn e Zn22
+ minus+ ndash0762
Ag e Ag+ minus+ 0799 Mn e Mn22
+ minus+ ndash1185
Hg e Hg2
22 2
+ minus+ 0797 Al e Al33
+ minus+ ndash1662
Fe e Fe3 2+ minus ++ 0771 Mg e Mg22
+ minus+ ndash2372
O g H e H O2 2 22 2( )+ ++ minus 0695 Na e Na+ minus+ ndash2710
I e I3 2 3minus minus minus+ 0536 Ca e Ca22
+ minus+ ndash2868
I e I2 2 2+ minus minus 0535 K e K+ minus+ ndash2931
Cu e Cu+ minus+ 0521 Li e Li+ minus+ ndash3040
Fe CN e Fe CN( ) ( )63
64minus minus minus+ 0358
14
2 Potenziometria
alluminio si dissolve mentre si deposita rame metallico Infatti i potenziali stan-dard delle due coppie redox sono
Cu2+ + 2endash Cu Edeg= +034 V
Al3+ + 3endash Al Edeg= ndash166 V
Nella soluzione quindi lo ione Cu2+ (forma ossidata della coppia con potenzialemaggiore) tende a ossidare Al (forma ridotta della coppia con potenziale minore)
TABELLA DEI POTENZIALI STANDARD DI RIDUZIONEAPPROFONDIMENTO
22 Tensione pratica (ddp) di una pila
Lrsquoinsieme dei conduttori di prima e di seconda specie che in sequenza opportunaformano una pila (o in generale un sistema elettrochimico) costituisce una catenagalvanica La differenza di potenziale (Ecella) che si misura ai capi di una pila durantelrsquoerogazione di corrente egrave dovuta a diversi contributi piugrave precisamente egrave uguale allasomma algebrica di tutte le cadute di tensione che si verificano lungo lrsquointero circuito
Ecella= E1 + E2 + E3 + E4 + E5 (25)
dove bull E1 egrave la ddp dovuta allrsquoeventuale passaggio di corrente nel circuito (cadutaohmica) bull E2 la ddp di contatto metallometallo (tensione di Volta) bull E3 la ddpdi contatto soluzionesoluzione (tensione o potenziale di giunzione liquida) bull E4 edE5 le ddp di contatto metallosoluzione (tensione di Nernst) per ciascun elettrodo
Esaminiamo ora il significato dei singoli contributi
Caduta ohmica Quando la cella egrave attraversata da corrente inevitabilmente si ve-rifica una caduta di tensione E = R times i (prima legge di Ohm) Ovviamente se lamisura del potenziale di cella viene effettuata in condizioni tali da minimizzareo eliminare il passaggio di corrente (cioegrave a circuito aperto) la caduta ohmica siannulla (cioegrave E1= 0)
Tensione di Volta Quando due diversi metalli vengono posti a contatto si generasempre una ddp Questo fenomeno detto effetto Volta egrave dovuto al fatto che glielettroni di conduzione sono trattenuti con diversa energia dai diversi metalli Per-ciograve il contatto fra due metalli provoca un trasferimento di elettroni istantaneo daparte del metallo che li trattiene con minore energia Il processo perograve non prose-gue indefinitamente il trasferimento di elettroni infatti prosegue fino allrsquoequili-brio quando insorge una ddp (in genere di pochi millivolt) sufficiente a bloccarlo
Si puograve verificare sperimentalmente (e dimostrare) che la ddp agli estremi diuna catena di conduttori di prima specie egrave uguale a quella che si stabilisce se i duemetalli che ne costituiscono gli estremi vengono posti a diretto contatto (fig 24)Di conseguenza se gli ingressi del misuratore di tensione sono costituiti dallo stessometallo lrsquoeffetto Volta complessivo egrave nullo (E2= 0)
In altri termini la formaossidata della coppia conpotenziale piugrave alto egraveossidante nei confrontidella forma ridotta dellacoppia con potenzialepiugrave basso
A rigore si dovrebbe usareil simbolo V (o ∆V)percheacute si tratta di unaddp misurata in una pilain funzione e dunquenon di una fem Il pedicelaquocellaraquo puntualizza che sitratta in generale di unacella elettrochimica
R egrave la resistenza delconduttore e i lrsquointensitagravedi corrente
15
CELLE GALVANICHE O PILE
Potenziale di giunzione liquida In una pila le due semicelle sono separate matenute in contatto elettrico mediante un setto poroso o un ponte salino che con-sente un mescolamento lentissimo (praticamente nullo) delle soluzioni Questidispositivi (si veda la figura 25) perograve creano unrsquoulteriore caduta di tensione fragli elettrodi detta potenziale di giunzione liquida (Eg) o anche potenziale dicontatto (o di diffusione) Il potenziale di giunzione liquida puograve essere sia po-sitivo sia negativo e quindi fa aumentare o viceversa diminuire la ddp fra glielettrodi
Lrsquoinsorgere di un potenziale di giunzione egrave causato dal fatto che gli ioni si dif-fondono con diversa mobilitagrave attraverso le superfici di contatto di due mezzi di-versi un setto poroso per esempio egrave diversamente permeabile agli ioni propriosecondo la loro mobilitagrave
Tensione di Nernst I potenziali di contatto metallosoluzione (E4 E5) si calco-lano in teoria mediante la legge di Nernst e perciograve sono detti potenziali nern-stiani
LA MOBILITAgrave DEGLI IONI IN SOLUZIONEAPPROFONDIMENTO
23 Calcolo della tensione teorica (fem) di una pilaSe si opera in modo da rendere trascurabili i primi tre termini dellrsquoequazione (22)la ddp ai capi della pila coincide in pratica con la sua fem che puograve essere cal-colata semplicemente in base agli ultimi due termini cioegrave ai potenziali di elettrodoNei calcoli occorre tenere presente che
a la fem di una pila in quanto strettamente collegata al lavoro da essa compiutodeve necessariamente avere segno positivo
b lrsquoelettrodo a potenziale maggiore su cui avviene la riduzione egrave il catodo lrsquoelet-trodo a potenziale minore su cui avviene lrsquoossidazione egrave lrsquoanodo
Di conseguenza la fem di una pila cioegrave di una cella elettrochimica ottenuta colle-gando due semicelle (catodica e anodica) egrave espressa dalla seguente relazione
Ecella = Ec ndash Ea (26)
ovvero
Ecella = Emaggiore ndash Eminore (27)
Questa seconda scrittura mostra chiaramente che la fem della pila egrave sempre posi-tiva anche nel caso in cui i potenziali delle due semicelle siano entrambi negativi
Indichiamo con Ec ilpotenziale del catodo (opotenziale catodico) econ Ea il potenzialedellrsquoanodo (o potenzialeanodico)
Figura 24Nonostante ogni superficie di contatto fra due metallisia sede di una ddp dovuta allrsquoeffetto Volta la ddpche si instaura fra rame e zinco egrave la stessa sia nel caso(a) sia nel caso (b) Infatti se cosigrave non fosse chiudendola catena aperta (a) si dovrebbe osservare un passaggiodi corrente e questo in realtagrave non avviene
a b
16
2 Potenziometria
ESEMPIO 1UNA IPOTETICA PILA Egrave COSTITUITA DALLE COPPIE REDOX Al3+Al E Ni2+NiQUAL Egrave LA FEM DELLA PILA SE LE ATTIVITAgrave DI TUTTE LE SPECIE IONICHE SONOUNITARIE
Dal momento che le attivitagrave sono unitarie il calcolo fornisce la tensione (o forzaelettromotrice) standard della pila
Innanzitutto dalla tabella dei potenziali standard si ricavano i potenziali stan-dard per ciascuna coppia redox
Al3+ + 3endash Al Eo
= ndash166 V
Ni2+ + 2endash Ni Eo
= ndash026 V
Lrsquoelettrodo della coppia Ni2+Ni costituisce il catodo percheacute ha il potenziale mag-giore mentre lrsquoelettrodo della coppia Al3+Al costituisce lrsquoanodo percheacute ha il poten-ziale minore Si puograve anche costruire un diagramma di questo tipo
Al3+Al Ni2+Ni H+H2
ndash166 ndash026 00000 Edeg(V rif a SHE)
Quindi la fem della pila in condizioni standard egrave
Ecella= Ec ndash Ea= Emaggiore ndash Eminore= ndash026 ndash (ndash166)= +140 V
La reazione di ossidoriduzione che genera la pila si ottiene formalmente combi-nando le due semireazioni bilanciate quella di riduzione al catodo e quella di os-sidazione allrsquoanodo Ciascuna semireazione deve essere moltiplicata per un fattorenumerico tale che il numero di elettroni ceduti dalla specie che si ossida sia uguale aquello degli elettroni acquistati dalla specie che si riduce Quindi nel caso dellrsquoesem-pio proposto si moltiplica la semireazione della coppia Al3+Al per 2 e quella dellacoppia Ni2+Ni per 3
2 middot (Al Al3+ + 3endash) Edeg= ndash(ndash166 V) (ndash)
3 middot (Ni2+ + 2endash Ni) Edeg= ndash026 V (+)
2Al + 3Ni2+ 2Al3+ + 3Ni Edeg= +140 V
Attenzione per ottenere il bilancio della reazione di cella si moltiplica per un coeffi-ciente opportuno ciascuna semireazione ma non il rispettivo potenziale Infatti i po-tenziali di elettrodo (e quindi anche il potenziale di cella) esprimono un lavoro elettricoper unitagrave di carica e perciograve sono proprietagrave intensive che non dipendono dalla quantitagravedi materia contenuta nel sistema ovvero dal numero di cariche elettriche trasportate
Se le attivitagrave non sono unitarie per calcolare il potenziale di elettrodo occorreapplicare lrsquoequazione di Nernst
Egrave ovvio comunque che il lavoro complessivo che puograve essere fornito da una piladipende anche dalla massa e dalla geometria degli elettrodi Per questo motivo unapila o un insieme di pile (cioegrave una batteria) che viene utilizzata per esempio permuovere un veicolo puograve avere dimensioni ingombranti Questo accadeva fino anon molti anni fa per le vecchie batterie al piombo ora sempre piugrave sostituite dabatterie come quelle al litio decisamente piugrave compatte e che infatti stanno rendendopossibile il progressivo passaggio allrsquoauto parzialmente o completamente elettrica
UNA IPOTETICA PILA Egrave COSTITUITA DALLE COPPIE REDOX Al3+Al E Ni2+NiQUAL Egrave LA FEM DELLA PILA SE LE ATTIVITAgrave DI TUTTE LE SPECIE IONICHE SONOUNITARIE
Nella pila la reazionedella coppiadella coppia Ni2+Ni(Ni2+ si riduce) avvienenel senso conforme allaconvenzione adottata per ipotenziali (elettroni asinistra) invece lareazione della coppiaAl3+Al (Al si ossida)avviene nel senso oppostoa quello convenzionalePerciograve il potenziale Edegdella coppia Al3+Al vieneconsiderato con segnoopposto a quello tabulato(+166 V) Se si sommaalgebricamente ilpotenziale dellrsquoelettrodoche si riduce (Ec) conquello dellrsquoelettrodo che siossida cambiato di segno(Ea) la tensione della pilarisulta positiva
17
CELLE GALVANICHE O PILE
ESEMPIO 2UNA IPOTETICA PILA Egrave COSTITUITA DALLE COPPIE REDOX Al3+Al E Ni2+NiQUAL Egrave LA FEM DELLA PILA A 25 degC SE LE CONCENTRAZIONI DELLE SPECIEIONICHE SONO RISPETTIVAMENTE [Al3+] = 2 10ndash2 M E [Ni2+] = 10ndash2 M
Approssimando le attivitagrave con le concentrazioni si ottiene
La situazione non egrave sostanzialmente cambiata rispetto alle condizioni standardpercheacute anche in questo caso la reazione di cella comporta lrsquoossidazione dellrsquoallumi-nio e la riduzione del nichel La fem della pila quindi egrave
Ecella= Ec ndash Ea= ndash032 ndash (ndash167)= +135 V
24 Alcuni tipi di pile
Pila DaniellUna semicella egrave costituita da una lamina di rame immersa in una soluzione diCuSO4 lrsquoaltra semicella da una lamina di zinco immersa in una soluzione di ZnSO4
(fig 25) Le due semicelle sono separate da un setto poroso (in pratica una mem-brana di vetro sinterizzato o analogo materiale inerte) oppure si trovano in duediversi recipienti collegati da un ponte salino
Le reazioni di elettrodo sono
Zn2+ + 2endash Zn Edeg= ndash0762 V
Cu2+ + 2endash Cu Edeg= 0342 V
Le concentrazioni dei sali nelle rispettive semicelle sono in genere tali da renderenegativo il semielemento di zinco che perciograve tende a cedere elettroni al rame (ossi-dandosi) La lamina di zinco egrave dunque il polo negativo (anodo) della pila e il rameegrave il polo positivo (catodo)
La rappresentazione della catena galvanica di questa pila secondo le convenzioniIUPAC egrave
(ndash) Zn(s)|ZnSO4(aq)||CuSO4(aq)|Cu(s) (+)
UNA IPOTETICA PILA Egrave COSTITUITA DALLE COPPIE REDOX Al3+Al E Ni2+NiQUAL Egrave LA FEM DELLA PILA A 25 degC SE LE CONCENTRAZIONI DELLE SPECIEIONICHE SONO RISPETTIVAMENTE [Al3+] = 2 10ndash2 M E [Ni2+] = 10ndash2 M
Si noti che se i duescomparti non fosseroscomparti non fosseroben separati dal settoben separati dal settoporoso ben presto gli ioniporoso ben presto gli ionirame disponibilirame disponibiliraggiungerebbero lrsquoraggiungerebbero lrsquoanododi zinco ossidandolo eandando a depositarsi sudi esso come Cumetallico nondiversamente da quanto sipuograve osservareimmergendo una barrettadi zinco in una soluzionedi solfato di rameesaurendo quindirapidamente la pila esviluppando calore
Figura 25Pila Daniell (a) con settoporoso e (b) con pontesalino
a b
18
2 Potenziometria
La coppia di barrette verticali (||) al centro rappresenta il setto poroso o il pontesalino che separano le due semicelle lrsquoanodo egrave scritto a sinistra e per ciascun elet-trodo la forma ridotta della coppia redox egrave scritta verso lrsquoesterno Le lettere scrittefra parentesi indicano lo stato fisico di ogni specie chimica
La reazione di cella egrave
Zn + Cu2+ Zn2+ + Cu
Per calcolare la fem teorica di questa pila che puograve anche trovarsi in condizionidiverse da quelle standard si applica la legge di Nernst a ciascuna semicella
(28)
(29)
I potenziali standard delle due semicelle sono cosigrave diversi fra loro che nelle normalicondizioni operative di una pila Daniell il rame rappresenta il polo positivo e lozinco il polo negativo
Sottraendo il potenziale minore da quello maggiore si ottiene il potenziale dicella
Ecella = ECu2+Cu - EZn2+Zn
Ponendo Edegcella = EdegCu2+Cu ndash EdegZn2+Zn (= 0342 V + 0762 V) e quindi sottraendo la(28 dalla 29) si ricava infine
Questa equazione consente dunque di calcolare il potenziale di Nernst se egrave notoil valore effettivo dellrsquoattivitagrave degli ioni Zn2+ e Cu2+ Tuttavia il calcolo si presta aerrori anche significativi lrsquoattivitagrave degli ioni per esempio varia in funzione dellaforza ionica della soluzione e non puograve essere calcolata Perciograve la fem reale piugraveesattamente la ddp che si misura si discosta dal valore calcolato sostanzialmenteper due motivi
a il sistema non si comporta in maniera ideale (per esempio gli elettrodi possonopolarizzarsi)
b il contributo della caduta ohmica (gtequazione 25) puograve essere praticamente an-nullato se nel circuito viene fatta circolare una corrente trascurabile invece ilpotenziale di giunzione liquida per quanto piccolo non puograve essere soppresso enon egrave prevedibile in base a equazioni teoriche
Pile a concentrazioneIn questo tipo di pila le due semicelle contengono due soluzioni di una stessa cop-pia redox ma a diversa concentrazione gli elettrodi sono inerti oppure dello stes-so metallo e le semicelle sono collegate da un setto poroso o da un ponte salino(fig 26)
In questo calcolotrascuriamo i contributidei termini E1 E2 E3 dellaequazione (25)
Lrsquoequazione rappresentain pratica la legge diNernst applicata allareazione redox globalescritta nel verso dellaspontaneitagrave tenendoconto degli elettroniscambiati (2) e inserendonellrsquoargomento dellogaritmo lrsquoinverso delquoziente di reazione
+
19
CELLE GALVANICHE O PILE
Le due soluzioni si scambiano elettroni attraverso il circuito esterno mentre ilsetto poroso (o il ponte salino) che le collega consente il passaggio di ioni e quin-di chiude il circuito Il sistema raggiunge lrsquoequilibrio quando le attivitagrave degli ioninelle due semicelle diventano uguali perciograve egrave prevedibile che nella soluzione piugravediluita avvenga lrsquoossidazione il rame metallico si dissolve e si formano ioni Cu2+ insoluzione questo dunque egrave lrsquoanodo Contemporaneamente gli elettroni passanonellrsquoaltro comparto (a destra in figura 26) attraverso il circuito esterno e riduconogli ioni Cu2+ che si depositano sullrsquoelettrodo come rame metallico questo dunqueegrave il catodo
In pratica egrave come se gli ioni Cu2+ si trasferissero dalla soluzione piugrave concentrataalla soluzione piugrave diluita Queste pile dunque trasformano in lavoro elettrico lrsquoe-nergia che si libera nel processo spontaneo con cui due soluzioni a diretto contattotendono a raggiungere lrsquoequilibrio di concentrazione
La rappresentazione convenzionale della catena elettrodica di questa pila a con-centrazione egrave la seguente
(-) Cu(s) |Cu2+(001 M)||Cu2+(1 M)|Cu(s) (+)
Per calcolare la tensione teorica della pila si applica la legge di Nernst a ciascun elet-trodo Approssimando le attivitagrave con le concentrazioni (a 25 degC) si ottiene
(soluzione piugrave diluita anodo)
(soluzione piugrave concentrata catodo)
Quindi
Ecella= Emaggiore ndash Eminore= 0342- 0283= 0059 V
ALTRI TIPI DI CELLE GALVANICHE O PILEAPPROFONDIMENTO
Figura 26Pila a concentrazione il compartoanodico (a sinistra) contiene ioni Cu2+
in concentrazione 001 M e il com-parto catodico (a destra) contieneioni Cu2+ in concentrazione 1 M Ilcollegamento fra le due semicelle egraverealizzato con un ponte salino
20
2 Potenziometria
STRUMENTAZIONEIn potenziometria si misura la differenza di potenziale che si stabilisce fra due semi-celle allo scopo di determinare la concentrazione di uno ione o per seguire lrsquoanda-mento di una titolazione
Il dispositivo completo per una misura potenziometrica (fig 27) consiste es-senzialmente di
bull un potenziometro o meglio un millivoltmetro elettronicobull un elettrodo di riferimentobull un elettrodo di misura
Il potenziometro serve per misurare la ddp fra i due elettrodi senza alterare il lorostato di equilibrio perciograve si lavora a corrente praticamente nulla
Gli elettrodi collegati al potenziometro sono immersi nella soluzione su cui sieffettuano le misure Lrsquoelettrodo di riferimento egrave costruito in modo tale da mante-nere costante il suo potenziale di conseguenza ogni variazione di ddp misurata egraveimputabile esclusivamente allrsquoelettrodo di misura (piugrave precisamente alla soluzioneanalizzata)
ELETTRODI DI RIFERIMENTOLrsquoelettrodo standard a idrogeno (SHE gtparagrafo 21) egrave lrsquoelettrodo di riferimentoprimario Tuttavia nella pratica quotidiana di laboratorio si usano elettrodi di ri-ferimento secondari piugrave semplici e maneggevoli che hanno comunque la proprie-tagrave di mantenere il proprio potenziale costante a temperatura costante Tratteremoora in maggior dettaglio gli elettrodi di uso piugrave comune
31 Elettrodo ad argentocloruro drsquoargento
Si tratta senzrsquoaltro dellrsquoelettrodo piugrave diffuso Il dispositivo egrave costituito da un sem-plice filo drsquoargento rivestito di AgCl e immerso in una soluzione di KCl (egrave dunqueun elettrodo di seconda specie) Il tutto egrave contenuto in un tubicino di vetro dotatodi setto poroso per assicurare il contatto elettrico con lrsquoesterno ovvero con la so-luzione in cui viene immerso lrsquooggetto dellrsquoanalisi
Figura 27Rappresentazione schematica deldispositivo completo per misurepotenziometriche
3
21
ELETTRODI DI RIFERIMENTO
La rappresentazione convenzionale dellrsquoelettrodo (fig 28) egrave
Ag(s)|AgCl(aq)|KCl(aq)
La reazione di elettrodo egrave
AgCl + endash Ag + Clndash
E il potenziale di elettrodo
E= EdegAgClAg
Considerando unitarie le attivitagrave dei solidi puri si ottiene
E= EdegAgClAg ndash 01984 10ndash3 T log[Clndash] (210)
Se lrsquoattivitagrave degli ioni cloruro egrave costante (a temperatura costante) il potenziale dielettrodo rimane costante Gli elettrodi piugrave comuni contengono soluzioni sature diKCl (circa 42 M) e perciograve sono detti saturi (SSC Saturated Silver-Silver ChlorideElectrode) A 25 degC il potenziale di SSC vale 0197 V Questo elettrodo puograve essereusato fino a 105 degC Nella tabella 1 ndash lab 1 (gtpag 39) sono riportati i potenziali alvariare della temperatura per lrsquoelettrodo saturo e 3 M
Gli anioni (come il solfuro) che formano con Ag+ sali meno solubili di AgClpossono danneggiare questo tipo di elettrodo Anche gli ossidanti e i riducenti fortie gli agenti complessanti possono interferire con la reazione di elettrodo per proteg-gere lrsquoelettrodo da queste sostanze si usa un elettrolita intermedio come nel casodellrsquoelettrodo a calomelano saturo (SCE gtparagrafo 32)
Gli elettrodi ad argentocloruro di argento sono usati come riferimento internonegli elettrodi a vetro (gtparagrafo 41)
32 Elettrodo a calomelano
laquoCalomelanoraquo egrave il nome comune del cloruro mercuroso (I) Hg2Cl2 che fa parteappunto di questo elettrodo (fig 29a) La rappresentazione convenzionale dellrsquoe-lettrodo egrave
Hg(l)|Hg2Cl2(s)|KCl(aq)
La reazione di elettrodo egrave
Hg2Cl2 + 2endash 2Hg + 2Clndash
e il potenziale di elettrodo in base alla legge di Nernst
In condizioni standard lrsquoattivitagrave di solidi e liquidi puri egrave considerata uguale a 1quindi
da cui
ndash 01984 10ndash3 T log|Clndash| (211)
Sono anche molto diffusigli elettrodi contenentiKCl 3 M cioegrave quasisaturi Il vantaggio egrave chein queste soluzioni non siformano cristalli di KClche possono danneggiarelrsquoelettrodo ostruendoil setto poroso che sta sulfondo
Figura 28Elettrodo ad AgAgCILa soluzione tamponeinterna contiene ioni K+
e CIndash ad attivitagrave costante
22
2 Potenziometria
Il potenziale dellrsquoelettrodo a calomelano dunque dipende solo dallrsquoattivitagrave delloione cloruro e dalla temperatura Se la temperatura egrave costante e lrsquoattivitagrave dello ionecloruro nella soluzione interna allrsquoelettrodo non varia il potenziale rimane costante
Gli elettrodi a calomelano piugrave comuni contengono soluzioni sature di KCl (circa42 M) e perciograve sono detti saturi (SCE Saturated Calomel Electrode) Si usano ancheelettrodi a KCl 1 M e 01 M la tabella 22 riporta il potenziale assunto da questielettrodi secondo la concentrazione di KCl
TABELLA 22 | Potenziale (mV) di alcuni elettrodi di riferimento a 25 degC
AgAgCl Calomelano HgHgO HgHgSO4 Thalamid
KCl 01 M 288 KCl 01 M 334 NaOH 01 M 165 H2SO4 05 M 682 KCl 3 M -567
KCl 1 M 235 KCl 1 M 280 NaOH 1 M 140 K2SO4 sat 650 KCl sat -577
KCl 3 M 210 KCl 35 M 250
KCl 35 M 205 KCl sat 241
KCl sat 199 NaCl sat 236
NaCl 3 M 209
NaCl sat 197
Lrsquoelettrodo a calomelano puograve essere usato fino a circa 70 degC a temperature piugrave alteil calomelano si dismuta (Hg2Cl2 Hg + HgCl2)
I solfuri gli ossidanti i forti riducenti e gli agenti complessanti che formanoamalgami con gli ioni Hg2
2+ possono danneggiare questo tipo di elettrodo Perciogravequando si lavora in presenza di queste sostanze si usano elettrodi a doppia giun-zione (fig 29b) in cui fra lrsquoelettrodo e la soluzione egrave interposto un contenitoreriempito con un elettrolita intermedio (per esempio KNO3)
Va infine segnalata la tendenza a non usare il mercurio per motivi tossicologicie questo spiega il progressivo abbandono nella pratica comune di questo tipo dielettrodo con grande rammarico dagli elettrochimici percheacute lrsquoelettrodo a calomela-no egrave il piugrave stabile
bullELETTRODI DI PRIMA E DI SECONDA SPECIE bullALTRI ELETTRODI DI RIFERIMENTO
APPROFONDIMENTI
Figura 29(a) Elettrodo a calomelano (b) Nella versione adoppia giunzione egrave presente una seconda cameraper lrsquoelettrolita intermedio che viene immessoattraverso la bocchetta laterale il setto porosoassicura il contatto elettrico con la soluzioneesterna
a b

14
2 Potenziometria
alluminio si dissolve mentre si deposita rame metallico Infatti i potenziali stan-dard delle due coppie redox sono
Cu2+ + 2endash Cu Edeg= +034 V
Al3+ + 3endash Al Edeg= ndash166 V
Nella soluzione quindi lo ione Cu2+ (forma ossidata della coppia con potenzialemaggiore) tende a ossidare Al (forma ridotta della coppia con potenziale minore)
TABELLA DEI POTENZIALI STANDARD DI RIDUZIONEAPPROFONDIMENTO
22 Tensione pratica (ddp) di una pila
Lrsquoinsieme dei conduttori di prima e di seconda specie che in sequenza opportunaformano una pila (o in generale un sistema elettrochimico) costituisce una catenagalvanica La differenza di potenziale (Ecella) che si misura ai capi di una pila durantelrsquoerogazione di corrente egrave dovuta a diversi contributi piugrave precisamente egrave uguale allasomma algebrica di tutte le cadute di tensione che si verificano lungo lrsquointero circuito
Ecella= E1 + E2 + E3 + E4 + E5 (25)
dove bull E1 egrave la ddp dovuta allrsquoeventuale passaggio di corrente nel circuito (cadutaohmica) bull E2 la ddp di contatto metallometallo (tensione di Volta) bull E3 la ddpdi contatto soluzionesoluzione (tensione o potenziale di giunzione liquida) bull E4 edE5 le ddp di contatto metallosoluzione (tensione di Nernst) per ciascun elettrodo
Esaminiamo ora il significato dei singoli contributi
Caduta ohmica Quando la cella egrave attraversata da corrente inevitabilmente si ve-rifica una caduta di tensione E = R times i (prima legge di Ohm) Ovviamente se lamisura del potenziale di cella viene effettuata in condizioni tali da minimizzareo eliminare il passaggio di corrente (cioegrave a circuito aperto) la caduta ohmica siannulla (cioegrave E1= 0)
Tensione di Volta Quando due diversi metalli vengono posti a contatto si generasempre una ddp Questo fenomeno detto effetto Volta egrave dovuto al fatto che glielettroni di conduzione sono trattenuti con diversa energia dai diversi metalli Per-ciograve il contatto fra due metalli provoca un trasferimento di elettroni istantaneo daparte del metallo che li trattiene con minore energia Il processo perograve non prose-gue indefinitamente il trasferimento di elettroni infatti prosegue fino allrsquoequili-brio quando insorge una ddp (in genere di pochi millivolt) sufficiente a bloccarlo
Si puograve verificare sperimentalmente (e dimostrare) che la ddp agli estremi diuna catena di conduttori di prima specie egrave uguale a quella che si stabilisce se i duemetalli che ne costituiscono gli estremi vengono posti a diretto contatto (fig 24)Di conseguenza se gli ingressi del misuratore di tensione sono costituiti dallo stessometallo lrsquoeffetto Volta complessivo egrave nullo (E2= 0)
In altri termini la formaossidata della coppia conpotenziale piugrave alto egraveossidante nei confrontidella forma ridotta dellacoppia con potenzialepiugrave basso
A rigore si dovrebbe usareil simbolo V (o ∆V)percheacute si tratta di unaddp misurata in una pilain funzione e dunquenon di una fem Il pedicelaquocellaraquo puntualizza che sitratta in generale di unacella elettrochimica
R egrave la resistenza delconduttore e i lrsquointensitagravedi corrente
15
CELLE GALVANICHE O PILE
Potenziale di giunzione liquida In una pila le due semicelle sono separate matenute in contatto elettrico mediante un setto poroso o un ponte salino che con-sente un mescolamento lentissimo (praticamente nullo) delle soluzioni Questidispositivi (si veda la figura 25) perograve creano unrsquoulteriore caduta di tensione fragli elettrodi detta potenziale di giunzione liquida (Eg) o anche potenziale dicontatto (o di diffusione) Il potenziale di giunzione liquida puograve essere sia po-sitivo sia negativo e quindi fa aumentare o viceversa diminuire la ddp fra glielettrodi
Lrsquoinsorgere di un potenziale di giunzione egrave causato dal fatto che gli ioni si dif-fondono con diversa mobilitagrave attraverso le superfici di contatto di due mezzi di-versi un setto poroso per esempio egrave diversamente permeabile agli ioni propriosecondo la loro mobilitagrave
Tensione di Nernst I potenziali di contatto metallosoluzione (E4 E5) si calco-lano in teoria mediante la legge di Nernst e perciograve sono detti potenziali nern-stiani
LA MOBILITAgrave DEGLI IONI IN SOLUZIONEAPPROFONDIMENTO
23 Calcolo della tensione teorica (fem) di una pilaSe si opera in modo da rendere trascurabili i primi tre termini dellrsquoequazione (22)la ddp ai capi della pila coincide in pratica con la sua fem che puograve essere cal-colata semplicemente in base agli ultimi due termini cioegrave ai potenziali di elettrodoNei calcoli occorre tenere presente che
a la fem di una pila in quanto strettamente collegata al lavoro da essa compiutodeve necessariamente avere segno positivo
b lrsquoelettrodo a potenziale maggiore su cui avviene la riduzione egrave il catodo lrsquoelet-trodo a potenziale minore su cui avviene lrsquoossidazione egrave lrsquoanodo
Di conseguenza la fem di una pila cioegrave di una cella elettrochimica ottenuta colle-gando due semicelle (catodica e anodica) egrave espressa dalla seguente relazione
Ecella = Ec ndash Ea (26)
ovvero
Ecella = Emaggiore ndash Eminore (27)
Questa seconda scrittura mostra chiaramente che la fem della pila egrave sempre posi-tiva anche nel caso in cui i potenziali delle due semicelle siano entrambi negativi
Indichiamo con Ec ilpotenziale del catodo (opotenziale catodico) econ Ea il potenzialedellrsquoanodo (o potenzialeanodico)
Figura 24Nonostante ogni superficie di contatto fra due metallisia sede di una ddp dovuta allrsquoeffetto Volta la ddpche si instaura fra rame e zinco egrave la stessa sia nel caso(a) sia nel caso (b) Infatti se cosigrave non fosse chiudendola catena aperta (a) si dovrebbe osservare un passaggiodi corrente e questo in realtagrave non avviene
a b
16
2 Potenziometria
ESEMPIO 1UNA IPOTETICA PILA Egrave COSTITUITA DALLE COPPIE REDOX Al3+Al E Ni2+NiQUAL Egrave LA FEM DELLA PILA SE LE ATTIVITAgrave DI TUTTE LE SPECIE IONICHE SONOUNITARIE
Dal momento che le attivitagrave sono unitarie il calcolo fornisce la tensione (o forzaelettromotrice) standard della pila
Innanzitutto dalla tabella dei potenziali standard si ricavano i potenziali stan-dard per ciascuna coppia redox
Al3+ + 3endash Al Eo
= ndash166 V
Ni2+ + 2endash Ni Eo
= ndash026 V
Lrsquoelettrodo della coppia Ni2+Ni costituisce il catodo percheacute ha il potenziale mag-giore mentre lrsquoelettrodo della coppia Al3+Al costituisce lrsquoanodo percheacute ha il poten-ziale minore Si puograve anche costruire un diagramma di questo tipo
Al3+Al Ni2+Ni H+H2
ndash166 ndash026 00000 Edeg(V rif a SHE)
Quindi la fem della pila in condizioni standard egrave
Ecella= Ec ndash Ea= Emaggiore ndash Eminore= ndash026 ndash (ndash166)= +140 V
La reazione di ossidoriduzione che genera la pila si ottiene formalmente combi-nando le due semireazioni bilanciate quella di riduzione al catodo e quella di os-sidazione allrsquoanodo Ciascuna semireazione deve essere moltiplicata per un fattorenumerico tale che il numero di elettroni ceduti dalla specie che si ossida sia uguale aquello degli elettroni acquistati dalla specie che si riduce Quindi nel caso dellrsquoesem-pio proposto si moltiplica la semireazione della coppia Al3+Al per 2 e quella dellacoppia Ni2+Ni per 3
2 middot (Al Al3+ + 3endash) Edeg= ndash(ndash166 V) (ndash)
3 middot (Ni2+ + 2endash Ni) Edeg= ndash026 V (+)
2Al + 3Ni2+ 2Al3+ + 3Ni Edeg= +140 V
Attenzione per ottenere il bilancio della reazione di cella si moltiplica per un coeffi-ciente opportuno ciascuna semireazione ma non il rispettivo potenziale Infatti i po-tenziali di elettrodo (e quindi anche il potenziale di cella) esprimono un lavoro elettricoper unitagrave di carica e perciograve sono proprietagrave intensive che non dipendono dalla quantitagravedi materia contenuta nel sistema ovvero dal numero di cariche elettriche trasportate
Se le attivitagrave non sono unitarie per calcolare il potenziale di elettrodo occorreapplicare lrsquoequazione di Nernst
Egrave ovvio comunque che il lavoro complessivo che puograve essere fornito da una piladipende anche dalla massa e dalla geometria degli elettrodi Per questo motivo unapila o un insieme di pile (cioegrave una batteria) che viene utilizzata per esempio permuovere un veicolo puograve avere dimensioni ingombranti Questo accadeva fino anon molti anni fa per le vecchie batterie al piombo ora sempre piugrave sostituite dabatterie come quelle al litio decisamente piugrave compatte e che infatti stanno rendendopossibile il progressivo passaggio allrsquoauto parzialmente o completamente elettrica
UNA IPOTETICA PILA Egrave COSTITUITA DALLE COPPIE REDOX Al3+Al E Ni2+NiQUAL Egrave LA FEM DELLA PILA SE LE ATTIVITAgrave DI TUTTE LE SPECIE IONICHE SONOUNITARIE
Nella pila la reazionedella coppiadella coppia Ni2+Ni(Ni2+ si riduce) avvienenel senso conforme allaconvenzione adottata per ipotenziali (elettroni asinistra) invece lareazione della coppiaAl3+Al (Al si ossida)avviene nel senso oppostoa quello convenzionalePerciograve il potenziale Edegdella coppia Al3+Al vieneconsiderato con segnoopposto a quello tabulato(+166 V) Se si sommaalgebricamente ilpotenziale dellrsquoelettrodoche si riduce (Ec) conquello dellrsquoelettrodo che siossida cambiato di segno(Ea) la tensione della pilarisulta positiva
17
CELLE GALVANICHE O PILE
ESEMPIO 2UNA IPOTETICA PILA Egrave COSTITUITA DALLE COPPIE REDOX Al3+Al E Ni2+NiQUAL Egrave LA FEM DELLA PILA A 25 degC SE LE CONCENTRAZIONI DELLE SPECIEIONICHE SONO RISPETTIVAMENTE [Al3+] = 2 10ndash2 M E [Ni2+] = 10ndash2 M
Approssimando le attivitagrave con le concentrazioni si ottiene
La situazione non egrave sostanzialmente cambiata rispetto alle condizioni standardpercheacute anche in questo caso la reazione di cella comporta lrsquoossidazione dellrsquoallumi-nio e la riduzione del nichel La fem della pila quindi egrave
Ecella= Ec ndash Ea= ndash032 ndash (ndash167)= +135 V
24 Alcuni tipi di pile
Pila DaniellUna semicella egrave costituita da una lamina di rame immersa in una soluzione diCuSO4 lrsquoaltra semicella da una lamina di zinco immersa in una soluzione di ZnSO4
(fig 25) Le due semicelle sono separate da un setto poroso (in pratica una mem-brana di vetro sinterizzato o analogo materiale inerte) oppure si trovano in duediversi recipienti collegati da un ponte salino
Le reazioni di elettrodo sono
Zn2+ + 2endash Zn Edeg= ndash0762 V
Cu2+ + 2endash Cu Edeg= 0342 V
Le concentrazioni dei sali nelle rispettive semicelle sono in genere tali da renderenegativo il semielemento di zinco che perciograve tende a cedere elettroni al rame (ossi-dandosi) La lamina di zinco egrave dunque il polo negativo (anodo) della pila e il rameegrave il polo positivo (catodo)
La rappresentazione della catena galvanica di questa pila secondo le convenzioniIUPAC egrave
(ndash) Zn(s)|ZnSO4(aq)||CuSO4(aq)|Cu(s) (+)
UNA IPOTETICA PILA Egrave COSTITUITA DALLE COPPIE REDOX Al3+Al E Ni2+NiQUAL Egrave LA FEM DELLA PILA A 25 degC SE LE CONCENTRAZIONI DELLE SPECIEIONICHE SONO RISPETTIVAMENTE [Al3+] = 2 10ndash2 M E [Ni2+] = 10ndash2 M
Si noti che se i duescomparti non fosseroscomparti non fosseroben separati dal settoben separati dal settoporoso ben presto gli ioniporoso ben presto gli ionirame disponibilirame disponibiliraggiungerebbero lrsquoraggiungerebbero lrsquoanododi zinco ossidandolo eandando a depositarsi sudi esso come Cumetallico nondiversamente da quanto sipuograve osservareimmergendo una barrettadi zinco in una soluzionedi solfato di rameesaurendo quindirapidamente la pila esviluppando calore
Figura 25Pila Daniell (a) con settoporoso e (b) con pontesalino
a b
18
2 Potenziometria
La coppia di barrette verticali (||) al centro rappresenta il setto poroso o il pontesalino che separano le due semicelle lrsquoanodo egrave scritto a sinistra e per ciascun elet-trodo la forma ridotta della coppia redox egrave scritta verso lrsquoesterno Le lettere scrittefra parentesi indicano lo stato fisico di ogni specie chimica
La reazione di cella egrave
Zn + Cu2+ Zn2+ + Cu
Per calcolare la fem teorica di questa pila che puograve anche trovarsi in condizionidiverse da quelle standard si applica la legge di Nernst a ciascuna semicella
(28)
(29)
I potenziali standard delle due semicelle sono cosigrave diversi fra loro che nelle normalicondizioni operative di una pila Daniell il rame rappresenta il polo positivo e lozinco il polo negativo
Sottraendo il potenziale minore da quello maggiore si ottiene il potenziale dicella
Ecella = ECu2+Cu - EZn2+Zn
Ponendo Edegcella = EdegCu2+Cu ndash EdegZn2+Zn (= 0342 V + 0762 V) e quindi sottraendo la(28 dalla 29) si ricava infine
Questa equazione consente dunque di calcolare il potenziale di Nernst se egrave notoil valore effettivo dellrsquoattivitagrave degli ioni Zn2+ e Cu2+ Tuttavia il calcolo si presta aerrori anche significativi lrsquoattivitagrave degli ioni per esempio varia in funzione dellaforza ionica della soluzione e non puograve essere calcolata Perciograve la fem reale piugraveesattamente la ddp che si misura si discosta dal valore calcolato sostanzialmenteper due motivi
a il sistema non si comporta in maniera ideale (per esempio gli elettrodi possonopolarizzarsi)
b il contributo della caduta ohmica (gtequazione 25) puograve essere praticamente an-nullato se nel circuito viene fatta circolare una corrente trascurabile invece ilpotenziale di giunzione liquida per quanto piccolo non puograve essere soppresso enon egrave prevedibile in base a equazioni teoriche
Pile a concentrazioneIn questo tipo di pila le due semicelle contengono due soluzioni di una stessa cop-pia redox ma a diversa concentrazione gli elettrodi sono inerti oppure dello stes-so metallo e le semicelle sono collegate da un setto poroso o da un ponte salino(fig 26)
In questo calcolotrascuriamo i contributidei termini E1 E2 E3 dellaequazione (25)
Lrsquoequazione rappresentain pratica la legge diNernst applicata allareazione redox globalescritta nel verso dellaspontaneitagrave tenendoconto degli elettroniscambiati (2) e inserendonellrsquoargomento dellogaritmo lrsquoinverso delquoziente di reazione
+
19
CELLE GALVANICHE O PILE
Le due soluzioni si scambiano elettroni attraverso il circuito esterno mentre ilsetto poroso (o il ponte salino) che le collega consente il passaggio di ioni e quin-di chiude il circuito Il sistema raggiunge lrsquoequilibrio quando le attivitagrave degli ioninelle due semicelle diventano uguali perciograve egrave prevedibile che nella soluzione piugravediluita avvenga lrsquoossidazione il rame metallico si dissolve e si formano ioni Cu2+ insoluzione questo dunque egrave lrsquoanodo Contemporaneamente gli elettroni passanonellrsquoaltro comparto (a destra in figura 26) attraverso il circuito esterno e riduconogli ioni Cu2+ che si depositano sullrsquoelettrodo come rame metallico questo dunqueegrave il catodo
In pratica egrave come se gli ioni Cu2+ si trasferissero dalla soluzione piugrave concentrataalla soluzione piugrave diluita Queste pile dunque trasformano in lavoro elettrico lrsquoe-nergia che si libera nel processo spontaneo con cui due soluzioni a diretto contattotendono a raggiungere lrsquoequilibrio di concentrazione
La rappresentazione convenzionale della catena elettrodica di questa pila a con-centrazione egrave la seguente
(-) Cu(s) |Cu2+(001 M)||Cu2+(1 M)|Cu(s) (+)
Per calcolare la tensione teorica della pila si applica la legge di Nernst a ciascun elet-trodo Approssimando le attivitagrave con le concentrazioni (a 25 degC) si ottiene
(soluzione piugrave diluita anodo)
(soluzione piugrave concentrata catodo)
Quindi
Ecella= Emaggiore ndash Eminore= 0342- 0283= 0059 V
ALTRI TIPI DI CELLE GALVANICHE O PILEAPPROFONDIMENTO
Figura 26Pila a concentrazione il compartoanodico (a sinistra) contiene ioni Cu2+
in concentrazione 001 M e il com-parto catodico (a destra) contieneioni Cu2+ in concentrazione 1 M Ilcollegamento fra le due semicelle egraverealizzato con un ponte salino
20
2 Potenziometria
STRUMENTAZIONEIn potenziometria si misura la differenza di potenziale che si stabilisce fra due semi-celle allo scopo di determinare la concentrazione di uno ione o per seguire lrsquoanda-mento di una titolazione
Il dispositivo completo per una misura potenziometrica (fig 27) consiste es-senzialmente di
bull un potenziometro o meglio un millivoltmetro elettronicobull un elettrodo di riferimentobull un elettrodo di misura
Il potenziometro serve per misurare la ddp fra i due elettrodi senza alterare il lorostato di equilibrio perciograve si lavora a corrente praticamente nulla
Gli elettrodi collegati al potenziometro sono immersi nella soluzione su cui sieffettuano le misure Lrsquoelettrodo di riferimento egrave costruito in modo tale da mante-nere costante il suo potenziale di conseguenza ogni variazione di ddp misurata egraveimputabile esclusivamente allrsquoelettrodo di misura (piugrave precisamente alla soluzioneanalizzata)
ELETTRODI DI RIFERIMENTOLrsquoelettrodo standard a idrogeno (SHE gtparagrafo 21) egrave lrsquoelettrodo di riferimentoprimario Tuttavia nella pratica quotidiana di laboratorio si usano elettrodi di ri-ferimento secondari piugrave semplici e maneggevoli che hanno comunque la proprie-tagrave di mantenere il proprio potenziale costante a temperatura costante Tratteremoora in maggior dettaglio gli elettrodi di uso piugrave comune
31 Elettrodo ad argentocloruro drsquoargento
Si tratta senzrsquoaltro dellrsquoelettrodo piugrave diffuso Il dispositivo egrave costituito da un sem-plice filo drsquoargento rivestito di AgCl e immerso in una soluzione di KCl (egrave dunqueun elettrodo di seconda specie) Il tutto egrave contenuto in un tubicino di vetro dotatodi setto poroso per assicurare il contatto elettrico con lrsquoesterno ovvero con la so-luzione in cui viene immerso lrsquooggetto dellrsquoanalisi
Figura 27Rappresentazione schematica deldispositivo completo per misurepotenziometriche
3
21
ELETTRODI DI RIFERIMENTO
La rappresentazione convenzionale dellrsquoelettrodo (fig 28) egrave
Ag(s)|AgCl(aq)|KCl(aq)
La reazione di elettrodo egrave
AgCl + endash Ag + Clndash
E il potenziale di elettrodo
E= EdegAgClAg
Considerando unitarie le attivitagrave dei solidi puri si ottiene
E= EdegAgClAg ndash 01984 10ndash3 T log[Clndash] (210)
Se lrsquoattivitagrave degli ioni cloruro egrave costante (a temperatura costante) il potenziale dielettrodo rimane costante Gli elettrodi piugrave comuni contengono soluzioni sature diKCl (circa 42 M) e perciograve sono detti saturi (SSC Saturated Silver-Silver ChlorideElectrode) A 25 degC il potenziale di SSC vale 0197 V Questo elettrodo puograve essereusato fino a 105 degC Nella tabella 1 ndash lab 1 (gtpag 39) sono riportati i potenziali alvariare della temperatura per lrsquoelettrodo saturo e 3 M
Gli anioni (come il solfuro) che formano con Ag+ sali meno solubili di AgClpossono danneggiare questo tipo di elettrodo Anche gli ossidanti e i riducenti fortie gli agenti complessanti possono interferire con la reazione di elettrodo per proteg-gere lrsquoelettrodo da queste sostanze si usa un elettrolita intermedio come nel casodellrsquoelettrodo a calomelano saturo (SCE gtparagrafo 32)
Gli elettrodi ad argentocloruro di argento sono usati come riferimento internonegli elettrodi a vetro (gtparagrafo 41)
32 Elettrodo a calomelano
laquoCalomelanoraquo egrave il nome comune del cloruro mercuroso (I) Hg2Cl2 che fa parteappunto di questo elettrodo (fig 29a) La rappresentazione convenzionale dellrsquoe-lettrodo egrave
Hg(l)|Hg2Cl2(s)|KCl(aq)
La reazione di elettrodo egrave
Hg2Cl2 + 2endash 2Hg + 2Clndash
e il potenziale di elettrodo in base alla legge di Nernst
In condizioni standard lrsquoattivitagrave di solidi e liquidi puri egrave considerata uguale a 1quindi
da cui
ndash 01984 10ndash3 T log|Clndash| (211)
Sono anche molto diffusigli elettrodi contenentiKCl 3 M cioegrave quasisaturi Il vantaggio egrave chein queste soluzioni non siformano cristalli di KClche possono danneggiarelrsquoelettrodo ostruendoil setto poroso che sta sulfondo
Figura 28Elettrodo ad AgAgCILa soluzione tamponeinterna contiene ioni K+
e CIndash ad attivitagrave costante
22
2 Potenziometria
Il potenziale dellrsquoelettrodo a calomelano dunque dipende solo dallrsquoattivitagrave delloione cloruro e dalla temperatura Se la temperatura egrave costante e lrsquoattivitagrave dello ionecloruro nella soluzione interna allrsquoelettrodo non varia il potenziale rimane costante
Gli elettrodi a calomelano piugrave comuni contengono soluzioni sature di KCl (circa42 M) e perciograve sono detti saturi (SCE Saturated Calomel Electrode) Si usano ancheelettrodi a KCl 1 M e 01 M la tabella 22 riporta il potenziale assunto da questielettrodi secondo la concentrazione di KCl
TABELLA 22 | Potenziale (mV) di alcuni elettrodi di riferimento a 25 degC
AgAgCl Calomelano HgHgO HgHgSO4 Thalamid
KCl 01 M 288 KCl 01 M 334 NaOH 01 M 165 H2SO4 05 M 682 KCl 3 M -567
KCl 1 M 235 KCl 1 M 280 NaOH 1 M 140 K2SO4 sat 650 KCl sat -577
KCl 3 M 210 KCl 35 M 250
KCl 35 M 205 KCl sat 241
KCl sat 199 NaCl sat 236
NaCl 3 M 209
NaCl sat 197
Lrsquoelettrodo a calomelano puograve essere usato fino a circa 70 degC a temperature piugrave alteil calomelano si dismuta (Hg2Cl2 Hg + HgCl2)
I solfuri gli ossidanti i forti riducenti e gli agenti complessanti che formanoamalgami con gli ioni Hg2
2+ possono danneggiare questo tipo di elettrodo Perciogravequando si lavora in presenza di queste sostanze si usano elettrodi a doppia giun-zione (fig 29b) in cui fra lrsquoelettrodo e la soluzione egrave interposto un contenitoreriempito con un elettrolita intermedio (per esempio KNO3)
Va infine segnalata la tendenza a non usare il mercurio per motivi tossicologicie questo spiega il progressivo abbandono nella pratica comune di questo tipo dielettrodo con grande rammarico dagli elettrochimici percheacute lrsquoelettrodo a calomela-no egrave il piugrave stabile
bullELETTRODI DI PRIMA E DI SECONDA SPECIE bullALTRI ELETTRODI DI RIFERIMENTO
APPROFONDIMENTI
Figura 29(a) Elettrodo a calomelano (b) Nella versione adoppia giunzione egrave presente una seconda cameraper lrsquoelettrolita intermedio che viene immessoattraverso la bocchetta laterale il setto porosoassicura il contatto elettrico con la soluzioneesterna
a b

15
CELLE GALVANICHE O PILE
Potenziale di giunzione liquida In una pila le due semicelle sono separate matenute in contatto elettrico mediante un setto poroso o un ponte salino che con-sente un mescolamento lentissimo (praticamente nullo) delle soluzioni Questidispositivi (si veda la figura 25) perograve creano unrsquoulteriore caduta di tensione fragli elettrodi detta potenziale di giunzione liquida (Eg) o anche potenziale dicontatto (o di diffusione) Il potenziale di giunzione liquida puograve essere sia po-sitivo sia negativo e quindi fa aumentare o viceversa diminuire la ddp fra glielettrodi
Lrsquoinsorgere di un potenziale di giunzione egrave causato dal fatto che gli ioni si dif-fondono con diversa mobilitagrave attraverso le superfici di contatto di due mezzi di-versi un setto poroso per esempio egrave diversamente permeabile agli ioni propriosecondo la loro mobilitagrave
Tensione di Nernst I potenziali di contatto metallosoluzione (E4 E5) si calco-lano in teoria mediante la legge di Nernst e perciograve sono detti potenziali nern-stiani
LA MOBILITAgrave DEGLI IONI IN SOLUZIONEAPPROFONDIMENTO
23 Calcolo della tensione teorica (fem) di una pilaSe si opera in modo da rendere trascurabili i primi tre termini dellrsquoequazione (22)la ddp ai capi della pila coincide in pratica con la sua fem che puograve essere cal-colata semplicemente in base agli ultimi due termini cioegrave ai potenziali di elettrodoNei calcoli occorre tenere presente che
a la fem di una pila in quanto strettamente collegata al lavoro da essa compiutodeve necessariamente avere segno positivo
b lrsquoelettrodo a potenziale maggiore su cui avviene la riduzione egrave il catodo lrsquoelet-trodo a potenziale minore su cui avviene lrsquoossidazione egrave lrsquoanodo
Di conseguenza la fem di una pila cioegrave di una cella elettrochimica ottenuta colle-gando due semicelle (catodica e anodica) egrave espressa dalla seguente relazione
Ecella = Ec ndash Ea (26)
ovvero
Ecella = Emaggiore ndash Eminore (27)
Questa seconda scrittura mostra chiaramente che la fem della pila egrave sempre posi-tiva anche nel caso in cui i potenziali delle due semicelle siano entrambi negativi
Indichiamo con Ec ilpotenziale del catodo (opotenziale catodico) econ Ea il potenzialedellrsquoanodo (o potenzialeanodico)
Figura 24Nonostante ogni superficie di contatto fra due metallisia sede di una ddp dovuta allrsquoeffetto Volta la ddpche si instaura fra rame e zinco egrave la stessa sia nel caso(a) sia nel caso (b) Infatti se cosigrave non fosse chiudendola catena aperta (a) si dovrebbe osservare un passaggiodi corrente e questo in realtagrave non avviene
a b
16
2 Potenziometria
ESEMPIO 1UNA IPOTETICA PILA Egrave COSTITUITA DALLE COPPIE REDOX Al3+Al E Ni2+NiQUAL Egrave LA FEM DELLA PILA SE LE ATTIVITAgrave DI TUTTE LE SPECIE IONICHE SONOUNITARIE
Dal momento che le attivitagrave sono unitarie il calcolo fornisce la tensione (o forzaelettromotrice) standard della pila
Innanzitutto dalla tabella dei potenziali standard si ricavano i potenziali stan-dard per ciascuna coppia redox
Al3+ + 3endash Al Eo
= ndash166 V
Ni2+ + 2endash Ni Eo
= ndash026 V
Lrsquoelettrodo della coppia Ni2+Ni costituisce il catodo percheacute ha il potenziale mag-giore mentre lrsquoelettrodo della coppia Al3+Al costituisce lrsquoanodo percheacute ha il poten-ziale minore Si puograve anche costruire un diagramma di questo tipo
Al3+Al Ni2+Ni H+H2
ndash166 ndash026 00000 Edeg(V rif a SHE)
Quindi la fem della pila in condizioni standard egrave
Ecella= Ec ndash Ea= Emaggiore ndash Eminore= ndash026 ndash (ndash166)= +140 V
La reazione di ossidoriduzione che genera la pila si ottiene formalmente combi-nando le due semireazioni bilanciate quella di riduzione al catodo e quella di os-sidazione allrsquoanodo Ciascuna semireazione deve essere moltiplicata per un fattorenumerico tale che il numero di elettroni ceduti dalla specie che si ossida sia uguale aquello degli elettroni acquistati dalla specie che si riduce Quindi nel caso dellrsquoesem-pio proposto si moltiplica la semireazione della coppia Al3+Al per 2 e quella dellacoppia Ni2+Ni per 3
2 middot (Al Al3+ + 3endash) Edeg= ndash(ndash166 V) (ndash)
3 middot (Ni2+ + 2endash Ni) Edeg= ndash026 V (+)
2Al + 3Ni2+ 2Al3+ + 3Ni Edeg= +140 V
Attenzione per ottenere il bilancio della reazione di cella si moltiplica per un coeffi-ciente opportuno ciascuna semireazione ma non il rispettivo potenziale Infatti i po-tenziali di elettrodo (e quindi anche il potenziale di cella) esprimono un lavoro elettricoper unitagrave di carica e perciograve sono proprietagrave intensive che non dipendono dalla quantitagravedi materia contenuta nel sistema ovvero dal numero di cariche elettriche trasportate
Se le attivitagrave non sono unitarie per calcolare il potenziale di elettrodo occorreapplicare lrsquoequazione di Nernst
Egrave ovvio comunque che il lavoro complessivo che puograve essere fornito da una piladipende anche dalla massa e dalla geometria degli elettrodi Per questo motivo unapila o un insieme di pile (cioegrave una batteria) che viene utilizzata per esempio permuovere un veicolo puograve avere dimensioni ingombranti Questo accadeva fino anon molti anni fa per le vecchie batterie al piombo ora sempre piugrave sostituite dabatterie come quelle al litio decisamente piugrave compatte e che infatti stanno rendendopossibile il progressivo passaggio allrsquoauto parzialmente o completamente elettrica
UNA IPOTETICA PILA Egrave COSTITUITA DALLE COPPIE REDOX Al3+Al E Ni2+NiQUAL Egrave LA FEM DELLA PILA SE LE ATTIVITAgrave DI TUTTE LE SPECIE IONICHE SONOUNITARIE
Nella pila la reazionedella coppiadella coppia Ni2+Ni(Ni2+ si riduce) avvienenel senso conforme allaconvenzione adottata per ipotenziali (elettroni asinistra) invece lareazione della coppiaAl3+Al (Al si ossida)avviene nel senso oppostoa quello convenzionalePerciograve il potenziale Edegdella coppia Al3+Al vieneconsiderato con segnoopposto a quello tabulato(+166 V) Se si sommaalgebricamente ilpotenziale dellrsquoelettrodoche si riduce (Ec) conquello dellrsquoelettrodo che siossida cambiato di segno(Ea) la tensione della pilarisulta positiva
17
CELLE GALVANICHE O PILE
ESEMPIO 2UNA IPOTETICA PILA Egrave COSTITUITA DALLE COPPIE REDOX Al3+Al E Ni2+NiQUAL Egrave LA FEM DELLA PILA A 25 degC SE LE CONCENTRAZIONI DELLE SPECIEIONICHE SONO RISPETTIVAMENTE [Al3+] = 2 10ndash2 M E [Ni2+] = 10ndash2 M
Approssimando le attivitagrave con le concentrazioni si ottiene
La situazione non egrave sostanzialmente cambiata rispetto alle condizioni standardpercheacute anche in questo caso la reazione di cella comporta lrsquoossidazione dellrsquoallumi-nio e la riduzione del nichel La fem della pila quindi egrave
Ecella= Ec ndash Ea= ndash032 ndash (ndash167)= +135 V
24 Alcuni tipi di pile
Pila DaniellUna semicella egrave costituita da una lamina di rame immersa in una soluzione diCuSO4 lrsquoaltra semicella da una lamina di zinco immersa in una soluzione di ZnSO4
(fig 25) Le due semicelle sono separate da un setto poroso (in pratica una mem-brana di vetro sinterizzato o analogo materiale inerte) oppure si trovano in duediversi recipienti collegati da un ponte salino
Le reazioni di elettrodo sono
Zn2+ + 2endash Zn Edeg= ndash0762 V
Cu2+ + 2endash Cu Edeg= 0342 V
Le concentrazioni dei sali nelle rispettive semicelle sono in genere tali da renderenegativo il semielemento di zinco che perciograve tende a cedere elettroni al rame (ossi-dandosi) La lamina di zinco egrave dunque il polo negativo (anodo) della pila e il rameegrave il polo positivo (catodo)
La rappresentazione della catena galvanica di questa pila secondo le convenzioniIUPAC egrave
(ndash) Zn(s)|ZnSO4(aq)||CuSO4(aq)|Cu(s) (+)
UNA IPOTETICA PILA Egrave COSTITUITA DALLE COPPIE REDOX Al3+Al E Ni2+NiQUAL Egrave LA FEM DELLA PILA A 25 degC SE LE CONCENTRAZIONI DELLE SPECIEIONICHE SONO RISPETTIVAMENTE [Al3+] = 2 10ndash2 M E [Ni2+] = 10ndash2 M
Si noti che se i duescomparti non fosseroscomparti non fosseroben separati dal settoben separati dal settoporoso ben presto gli ioniporoso ben presto gli ionirame disponibilirame disponibiliraggiungerebbero lrsquoraggiungerebbero lrsquoanododi zinco ossidandolo eandando a depositarsi sudi esso come Cumetallico nondiversamente da quanto sipuograve osservareimmergendo una barrettadi zinco in una soluzionedi solfato di rameesaurendo quindirapidamente la pila esviluppando calore
Figura 25Pila Daniell (a) con settoporoso e (b) con pontesalino
a b
18
2 Potenziometria
La coppia di barrette verticali (||) al centro rappresenta il setto poroso o il pontesalino che separano le due semicelle lrsquoanodo egrave scritto a sinistra e per ciascun elet-trodo la forma ridotta della coppia redox egrave scritta verso lrsquoesterno Le lettere scrittefra parentesi indicano lo stato fisico di ogni specie chimica
La reazione di cella egrave
Zn + Cu2+ Zn2+ + Cu
Per calcolare la fem teorica di questa pila che puograve anche trovarsi in condizionidiverse da quelle standard si applica la legge di Nernst a ciascuna semicella
(28)
(29)
I potenziali standard delle due semicelle sono cosigrave diversi fra loro che nelle normalicondizioni operative di una pila Daniell il rame rappresenta il polo positivo e lozinco il polo negativo
Sottraendo il potenziale minore da quello maggiore si ottiene il potenziale dicella
Ecella = ECu2+Cu - EZn2+Zn
Ponendo Edegcella = EdegCu2+Cu ndash EdegZn2+Zn (= 0342 V + 0762 V) e quindi sottraendo la(28 dalla 29) si ricava infine
Questa equazione consente dunque di calcolare il potenziale di Nernst se egrave notoil valore effettivo dellrsquoattivitagrave degli ioni Zn2+ e Cu2+ Tuttavia il calcolo si presta aerrori anche significativi lrsquoattivitagrave degli ioni per esempio varia in funzione dellaforza ionica della soluzione e non puograve essere calcolata Perciograve la fem reale piugraveesattamente la ddp che si misura si discosta dal valore calcolato sostanzialmenteper due motivi
a il sistema non si comporta in maniera ideale (per esempio gli elettrodi possonopolarizzarsi)
b il contributo della caduta ohmica (gtequazione 25) puograve essere praticamente an-nullato se nel circuito viene fatta circolare una corrente trascurabile invece ilpotenziale di giunzione liquida per quanto piccolo non puograve essere soppresso enon egrave prevedibile in base a equazioni teoriche
Pile a concentrazioneIn questo tipo di pila le due semicelle contengono due soluzioni di una stessa cop-pia redox ma a diversa concentrazione gli elettrodi sono inerti oppure dello stes-so metallo e le semicelle sono collegate da un setto poroso o da un ponte salino(fig 26)
In questo calcolotrascuriamo i contributidei termini E1 E2 E3 dellaequazione (25)
Lrsquoequazione rappresentain pratica la legge diNernst applicata allareazione redox globalescritta nel verso dellaspontaneitagrave tenendoconto degli elettroniscambiati (2) e inserendonellrsquoargomento dellogaritmo lrsquoinverso delquoziente di reazione
+
19
CELLE GALVANICHE O PILE
Le due soluzioni si scambiano elettroni attraverso il circuito esterno mentre ilsetto poroso (o il ponte salino) che le collega consente il passaggio di ioni e quin-di chiude il circuito Il sistema raggiunge lrsquoequilibrio quando le attivitagrave degli ioninelle due semicelle diventano uguali perciograve egrave prevedibile che nella soluzione piugravediluita avvenga lrsquoossidazione il rame metallico si dissolve e si formano ioni Cu2+ insoluzione questo dunque egrave lrsquoanodo Contemporaneamente gli elettroni passanonellrsquoaltro comparto (a destra in figura 26) attraverso il circuito esterno e riduconogli ioni Cu2+ che si depositano sullrsquoelettrodo come rame metallico questo dunqueegrave il catodo
In pratica egrave come se gli ioni Cu2+ si trasferissero dalla soluzione piugrave concentrataalla soluzione piugrave diluita Queste pile dunque trasformano in lavoro elettrico lrsquoe-nergia che si libera nel processo spontaneo con cui due soluzioni a diretto contattotendono a raggiungere lrsquoequilibrio di concentrazione
La rappresentazione convenzionale della catena elettrodica di questa pila a con-centrazione egrave la seguente
(-) Cu(s) |Cu2+(001 M)||Cu2+(1 M)|Cu(s) (+)
Per calcolare la tensione teorica della pila si applica la legge di Nernst a ciascun elet-trodo Approssimando le attivitagrave con le concentrazioni (a 25 degC) si ottiene
(soluzione piugrave diluita anodo)
(soluzione piugrave concentrata catodo)
Quindi
Ecella= Emaggiore ndash Eminore= 0342- 0283= 0059 V
ALTRI TIPI DI CELLE GALVANICHE O PILEAPPROFONDIMENTO
Figura 26Pila a concentrazione il compartoanodico (a sinistra) contiene ioni Cu2+
in concentrazione 001 M e il com-parto catodico (a destra) contieneioni Cu2+ in concentrazione 1 M Ilcollegamento fra le due semicelle egraverealizzato con un ponte salino
20
2 Potenziometria
STRUMENTAZIONEIn potenziometria si misura la differenza di potenziale che si stabilisce fra due semi-celle allo scopo di determinare la concentrazione di uno ione o per seguire lrsquoanda-mento di una titolazione
Il dispositivo completo per una misura potenziometrica (fig 27) consiste es-senzialmente di
bull un potenziometro o meglio un millivoltmetro elettronicobull un elettrodo di riferimentobull un elettrodo di misura
Il potenziometro serve per misurare la ddp fra i due elettrodi senza alterare il lorostato di equilibrio perciograve si lavora a corrente praticamente nulla
Gli elettrodi collegati al potenziometro sono immersi nella soluzione su cui sieffettuano le misure Lrsquoelettrodo di riferimento egrave costruito in modo tale da mante-nere costante il suo potenziale di conseguenza ogni variazione di ddp misurata egraveimputabile esclusivamente allrsquoelettrodo di misura (piugrave precisamente alla soluzioneanalizzata)
ELETTRODI DI RIFERIMENTOLrsquoelettrodo standard a idrogeno (SHE gtparagrafo 21) egrave lrsquoelettrodo di riferimentoprimario Tuttavia nella pratica quotidiana di laboratorio si usano elettrodi di ri-ferimento secondari piugrave semplici e maneggevoli che hanno comunque la proprie-tagrave di mantenere il proprio potenziale costante a temperatura costante Tratteremoora in maggior dettaglio gli elettrodi di uso piugrave comune
31 Elettrodo ad argentocloruro drsquoargento
Si tratta senzrsquoaltro dellrsquoelettrodo piugrave diffuso Il dispositivo egrave costituito da un sem-plice filo drsquoargento rivestito di AgCl e immerso in una soluzione di KCl (egrave dunqueun elettrodo di seconda specie) Il tutto egrave contenuto in un tubicino di vetro dotatodi setto poroso per assicurare il contatto elettrico con lrsquoesterno ovvero con la so-luzione in cui viene immerso lrsquooggetto dellrsquoanalisi
Figura 27Rappresentazione schematica deldispositivo completo per misurepotenziometriche
3
21
ELETTRODI DI RIFERIMENTO
La rappresentazione convenzionale dellrsquoelettrodo (fig 28) egrave
Ag(s)|AgCl(aq)|KCl(aq)
La reazione di elettrodo egrave
AgCl + endash Ag + Clndash
E il potenziale di elettrodo
E= EdegAgClAg
Considerando unitarie le attivitagrave dei solidi puri si ottiene
E= EdegAgClAg ndash 01984 10ndash3 T log[Clndash] (210)
Se lrsquoattivitagrave degli ioni cloruro egrave costante (a temperatura costante) il potenziale dielettrodo rimane costante Gli elettrodi piugrave comuni contengono soluzioni sature diKCl (circa 42 M) e perciograve sono detti saturi (SSC Saturated Silver-Silver ChlorideElectrode) A 25 degC il potenziale di SSC vale 0197 V Questo elettrodo puograve essereusato fino a 105 degC Nella tabella 1 ndash lab 1 (gtpag 39) sono riportati i potenziali alvariare della temperatura per lrsquoelettrodo saturo e 3 M
Gli anioni (come il solfuro) che formano con Ag+ sali meno solubili di AgClpossono danneggiare questo tipo di elettrodo Anche gli ossidanti e i riducenti fortie gli agenti complessanti possono interferire con la reazione di elettrodo per proteg-gere lrsquoelettrodo da queste sostanze si usa un elettrolita intermedio come nel casodellrsquoelettrodo a calomelano saturo (SCE gtparagrafo 32)
Gli elettrodi ad argentocloruro di argento sono usati come riferimento internonegli elettrodi a vetro (gtparagrafo 41)
32 Elettrodo a calomelano
laquoCalomelanoraquo egrave il nome comune del cloruro mercuroso (I) Hg2Cl2 che fa parteappunto di questo elettrodo (fig 29a) La rappresentazione convenzionale dellrsquoe-lettrodo egrave
Hg(l)|Hg2Cl2(s)|KCl(aq)
La reazione di elettrodo egrave
Hg2Cl2 + 2endash 2Hg + 2Clndash
e il potenziale di elettrodo in base alla legge di Nernst
In condizioni standard lrsquoattivitagrave di solidi e liquidi puri egrave considerata uguale a 1quindi
da cui
ndash 01984 10ndash3 T log|Clndash| (211)
Sono anche molto diffusigli elettrodi contenentiKCl 3 M cioegrave quasisaturi Il vantaggio egrave chein queste soluzioni non siformano cristalli di KClche possono danneggiarelrsquoelettrodo ostruendoil setto poroso che sta sulfondo
Figura 28Elettrodo ad AgAgCILa soluzione tamponeinterna contiene ioni K+
e CIndash ad attivitagrave costante
22
2 Potenziometria
Il potenziale dellrsquoelettrodo a calomelano dunque dipende solo dallrsquoattivitagrave delloione cloruro e dalla temperatura Se la temperatura egrave costante e lrsquoattivitagrave dello ionecloruro nella soluzione interna allrsquoelettrodo non varia il potenziale rimane costante
Gli elettrodi a calomelano piugrave comuni contengono soluzioni sature di KCl (circa42 M) e perciograve sono detti saturi (SCE Saturated Calomel Electrode) Si usano ancheelettrodi a KCl 1 M e 01 M la tabella 22 riporta il potenziale assunto da questielettrodi secondo la concentrazione di KCl
TABELLA 22 | Potenziale (mV) di alcuni elettrodi di riferimento a 25 degC
AgAgCl Calomelano HgHgO HgHgSO4 Thalamid
KCl 01 M 288 KCl 01 M 334 NaOH 01 M 165 H2SO4 05 M 682 KCl 3 M -567
KCl 1 M 235 KCl 1 M 280 NaOH 1 M 140 K2SO4 sat 650 KCl sat -577
KCl 3 M 210 KCl 35 M 250
KCl 35 M 205 KCl sat 241
KCl sat 199 NaCl sat 236
NaCl 3 M 209
NaCl sat 197
Lrsquoelettrodo a calomelano puograve essere usato fino a circa 70 degC a temperature piugrave alteil calomelano si dismuta (Hg2Cl2 Hg + HgCl2)
I solfuri gli ossidanti i forti riducenti e gli agenti complessanti che formanoamalgami con gli ioni Hg2
2+ possono danneggiare questo tipo di elettrodo Perciogravequando si lavora in presenza di queste sostanze si usano elettrodi a doppia giun-zione (fig 29b) in cui fra lrsquoelettrodo e la soluzione egrave interposto un contenitoreriempito con un elettrolita intermedio (per esempio KNO3)
Va infine segnalata la tendenza a non usare il mercurio per motivi tossicologicie questo spiega il progressivo abbandono nella pratica comune di questo tipo dielettrodo con grande rammarico dagli elettrochimici percheacute lrsquoelettrodo a calomela-no egrave il piugrave stabile
bullELETTRODI DI PRIMA E DI SECONDA SPECIE bullALTRI ELETTRODI DI RIFERIMENTO
APPROFONDIMENTI
Figura 29(a) Elettrodo a calomelano (b) Nella versione adoppia giunzione egrave presente una seconda cameraper lrsquoelettrolita intermedio che viene immessoattraverso la bocchetta laterale il setto porosoassicura il contatto elettrico con la soluzioneesterna
a b

16
2 Potenziometria
ESEMPIO 1UNA IPOTETICA PILA Egrave COSTITUITA DALLE COPPIE REDOX Al3+Al E Ni2+NiQUAL Egrave LA FEM DELLA PILA SE LE ATTIVITAgrave DI TUTTE LE SPECIE IONICHE SONOUNITARIE
Dal momento che le attivitagrave sono unitarie il calcolo fornisce la tensione (o forzaelettromotrice) standard della pila
Innanzitutto dalla tabella dei potenziali standard si ricavano i potenziali stan-dard per ciascuna coppia redox
Al3+ + 3endash Al Eo
= ndash166 V
Ni2+ + 2endash Ni Eo
= ndash026 V
Lrsquoelettrodo della coppia Ni2+Ni costituisce il catodo percheacute ha il potenziale mag-giore mentre lrsquoelettrodo della coppia Al3+Al costituisce lrsquoanodo percheacute ha il poten-ziale minore Si puograve anche costruire un diagramma di questo tipo
Al3+Al Ni2+Ni H+H2
ndash166 ndash026 00000 Edeg(V rif a SHE)
Quindi la fem della pila in condizioni standard egrave
Ecella= Ec ndash Ea= Emaggiore ndash Eminore= ndash026 ndash (ndash166)= +140 V
La reazione di ossidoriduzione che genera la pila si ottiene formalmente combi-nando le due semireazioni bilanciate quella di riduzione al catodo e quella di os-sidazione allrsquoanodo Ciascuna semireazione deve essere moltiplicata per un fattorenumerico tale che il numero di elettroni ceduti dalla specie che si ossida sia uguale aquello degli elettroni acquistati dalla specie che si riduce Quindi nel caso dellrsquoesem-pio proposto si moltiplica la semireazione della coppia Al3+Al per 2 e quella dellacoppia Ni2+Ni per 3
2 middot (Al Al3+ + 3endash) Edeg= ndash(ndash166 V) (ndash)
3 middot (Ni2+ + 2endash Ni) Edeg= ndash026 V (+)
2Al + 3Ni2+ 2Al3+ + 3Ni Edeg= +140 V
Attenzione per ottenere il bilancio della reazione di cella si moltiplica per un coeffi-ciente opportuno ciascuna semireazione ma non il rispettivo potenziale Infatti i po-tenziali di elettrodo (e quindi anche il potenziale di cella) esprimono un lavoro elettricoper unitagrave di carica e perciograve sono proprietagrave intensive che non dipendono dalla quantitagravedi materia contenuta nel sistema ovvero dal numero di cariche elettriche trasportate
Se le attivitagrave non sono unitarie per calcolare il potenziale di elettrodo occorreapplicare lrsquoequazione di Nernst
Egrave ovvio comunque che il lavoro complessivo che puograve essere fornito da una piladipende anche dalla massa e dalla geometria degli elettrodi Per questo motivo unapila o un insieme di pile (cioegrave una batteria) che viene utilizzata per esempio permuovere un veicolo puograve avere dimensioni ingombranti Questo accadeva fino anon molti anni fa per le vecchie batterie al piombo ora sempre piugrave sostituite dabatterie come quelle al litio decisamente piugrave compatte e che infatti stanno rendendopossibile il progressivo passaggio allrsquoauto parzialmente o completamente elettrica
UNA IPOTETICA PILA Egrave COSTITUITA DALLE COPPIE REDOX Al3+Al E Ni2+NiQUAL Egrave LA FEM DELLA PILA SE LE ATTIVITAgrave DI TUTTE LE SPECIE IONICHE SONOUNITARIE
Nella pila la reazionedella coppiadella coppia Ni2+Ni(Ni2+ si riduce) avvienenel senso conforme allaconvenzione adottata per ipotenziali (elettroni asinistra) invece lareazione della coppiaAl3+Al (Al si ossida)avviene nel senso oppostoa quello convenzionalePerciograve il potenziale Edegdella coppia Al3+Al vieneconsiderato con segnoopposto a quello tabulato(+166 V) Se si sommaalgebricamente ilpotenziale dellrsquoelettrodoche si riduce (Ec) conquello dellrsquoelettrodo che siossida cambiato di segno(Ea) la tensione della pilarisulta positiva
17
CELLE GALVANICHE O PILE
ESEMPIO 2UNA IPOTETICA PILA Egrave COSTITUITA DALLE COPPIE REDOX Al3+Al E Ni2+NiQUAL Egrave LA FEM DELLA PILA A 25 degC SE LE CONCENTRAZIONI DELLE SPECIEIONICHE SONO RISPETTIVAMENTE [Al3+] = 2 10ndash2 M E [Ni2+] = 10ndash2 M
Approssimando le attivitagrave con le concentrazioni si ottiene
La situazione non egrave sostanzialmente cambiata rispetto alle condizioni standardpercheacute anche in questo caso la reazione di cella comporta lrsquoossidazione dellrsquoallumi-nio e la riduzione del nichel La fem della pila quindi egrave
Ecella= Ec ndash Ea= ndash032 ndash (ndash167)= +135 V
24 Alcuni tipi di pile
Pila DaniellUna semicella egrave costituita da una lamina di rame immersa in una soluzione diCuSO4 lrsquoaltra semicella da una lamina di zinco immersa in una soluzione di ZnSO4
(fig 25) Le due semicelle sono separate da un setto poroso (in pratica una mem-brana di vetro sinterizzato o analogo materiale inerte) oppure si trovano in duediversi recipienti collegati da un ponte salino
Le reazioni di elettrodo sono
Zn2+ + 2endash Zn Edeg= ndash0762 V
Cu2+ + 2endash Cu Edeg= 0342 V
Le concentrazioni dei sali nelle rispettive semicelle sono in genere tali da renderenegativo il semielemento di zinco che perciograve tende a cedere elettroni al rame (ossi-dandosi) La lamina di zinco egrave dunque il polo negativo (anodo) della pila e il rameegrave il polo positivo (catodo)
La rappresentazione della catena galvanica di questa pila secondo le convenzioniIUPAC egrave
(ndash) Zn(s)|ZnSO4(aq)||CuSO4(aq)|Cu(s) (+)
UNA IPOTETICA PILA Egrave COSTITUITA DALLE COPPIE REDOX Al3+Al E Ni2+NiQUAL Egrave LA FEM DELLA PILA A 25 degC SE LE CONCENTRAZIONI DELLE SPECIEIONICHE SONO RISPETTIVAMENTE [Al3+] = 2 10ndash2 M E [Ni2+] = 10ndash2 M
Si noti che se i duescomparti non fosseroscomparti non fosseroben separati dal settoben separati dal settoporoso ben presto gli ioniporoso ben presto gli ionirame disponibilirame disponibiliraggiungerebbero lrsquoraggiungerebbero lrsquoanododi zinco ossidandolo eandando a depositarsi sudi esso come Cumetallico nondiversamente da quanto sipuograve osservareimmergendo una barrettadi zinco in una soluzionedi solfato di rameesaurendo quindirapidamente la pila esviluppando calore
Figura 25Pila Daniell (a) con settoporoso e (b) con pontesalino
a b
18
2 Potenziometria
La coppia di barrette verticali (||) al centro rappresenta il setto poroso o il pontesalino che separano le due semicelle lrsquoanodo egrave scritto a sinistra e per ciascun elet-trodo la forma ridotta della coppia redox egrave scritta verso lrsquoesterno Le lettere scrittefra parentesi indicano lo stato fisico di ogni specie chimica
La reazione di cella egrave
Zn + Cu2+ Zn2+ + Cu
Per calcolare la fem teorica di questa pila che puograve anche trovarsi in condizionidiverse da quelle standard si applica la legge di Nernst a ciascuna semicella
(28)
(29)
I potenziali standard delle due semicelle sono cosigrave diversi fra loro che nelle normalicondizioni operative di una pila Daniell il rame rappresenta il polo positivo e lozinco il polo negativo
Sottraendo il potenziale minore da quello maggiore si ottiene il potenziale dicella
Ecella = ECu2+Cu - EZn2+Zn
Ponendo Edegcella = EdegCu2+Cu ndash EdegZn2+Zn (= 0342 V + 0762 V) e quindi sottraendo la(28 dalla 29) si ricava infine
Questa equazione consente dunque di calcolare il potenziale di Nernst se egrave notoil valore effettivo dellrsquoattivitagrave degli ioni Zn2+ e Cu2+ Tuttavia il calcolo si presta aerrori anche significativi lrsquoattivitagrave degli ioni per esempio varia in funzione dellaforza ionica della soluzione e non puograve essere calcolata Perciograve la fem reale piugraveesattamente la ddp che si misura si discosta dal valore calcolato sostanzialmenteper due motivi
a il sistema non si comporta in maniera ideale (per esempio gli elettrodi possonopolarizzarsi)
b il contributo della caduta ohmica (gtequazione 25) puograve essere praticamente an-nullato se nel circuito viene fatta circolare una corrente trascurabile invece ilpotenziale di giunzione liquida per quanto piccolo non puograve essere soppresso enon egrave prevedibile in base a equazioni teoriche
Pile a concentrazioneIn questo tipo di pila le due semicelle contengono due soluzioni di una stessa cop-pia redox ma a diversa concentrazione gli elettrodi sono inerti oppure dello stes-so metallo e le semicelle sono collegate da un setto poroso o da un ponte salino(fig 26)
In questo calcolotrascuriamo i contributidei termini E1 E2 E3 dellaequazione (25)
Lrsquoequazione rappresentain pratica la legge diNernst applicata allareazione redox globalescritta nel verso dellaspontaneitagrave tenendoconto degli elettroniscambiati (2) e inserendonellrsquoargomento dellogaritmo lrsquoinverso delquoziente di reazione
+
19
CELLE GALVANICHE O PILE
Le due soluzioni si scambiano elettroni attraverso il circuito esterno mentre ilsetto poroso (o il ponte salino) che le collega consente il passaggio di ioni e quin-di chiude il circuito Il sistema raggiunge lrsquoequilibrio quando le attivitagrave degli ioninelle due semicelle diventano uguali perciograve egrave prevedibile che nella soluzione piugravediluita avvenga lrsquoossidazione il rame metallico si dissolve e si formano ioni Cu2+ insoluzione questo dunque egrave lrsquoanodo Contemporaneamente gli elettroni passanonellrsquoaltro comparto (a destra in figura 26) attraverso il circuito esterno e riduconogli ioni Cu2+ che si depositano sullrsquoelettrodo come rame metallico questo dunqueegrave il catodo
In pratica egrave come se gli ioni Cu2+ si trasferissero dalla soluzione piugrave concentrataalla soluzione piugrave diluita Queste pile dunque trasformano in lavoro elettrico lrsquoe-nergia che si libera nel processo spontaneo con cui due soluzioni a diretto contattotendono a raggiungere lrsquoequilibrio di concentrazione
La rappresentazione convenzionale della catena elettrodica di questa pila a con-centrazione egrave la seguente
(-) Cu(s) |Cu2+(001 M)||Cu2+(1 M)|Cu(s) (+)
Per calcolare la tensione teorica della pila si applica la legge di Nernst a ciascun elet-trodo Approssimando le attivitagrave con le concentrazioni (a 25 degC) si ottiene
(soluzione piugrave diluita anodo)
(soluzione piugrave concentrata catodo)
Quindi
Ecella= Emaggiore ndash Eminore= 0342- 0283= 0059 V
ALTRI TIPI DI CELLE GALVANICHE O PILEAPPROFONDIMENTO
Figura 26Pila a concentrazione il compartoanodico (a sinistra) contiene ioni Cu2+
in concentrazione 001 M e il com-parto catodico (a destra) contieneioni Cu2+ in concentrazione 1 M Ilcollegamento fra le due semicelle egraverealizzato con un ponte salino
20
2 Potenziometria
STRUMENTAZIONEIn potenziometria si misura la differenza di potenziale che si stabilisce fra due semi-celle allo scopo di determinare la concentrazione di uno ione o per seguire lrsquoanda-mento di una titolazione
Il dispositivo completo per una misura potenziometrica (fig 27) consiste es-senzialmente di
bull un potenziometro o meglio un millivoltmetro elettronicobull un elettrodo di riferimentobull un elettrodo di misura
Il potenziometro serve per misurare la ddp fra i due elettrodi senza alterare il lorostato di equilibrio perciograve si lavora a corrente praticamente nulla
Gli elettrodi collegati al potenziometro sono immersi nella soluzione su cui sieffettuano le misure Lrsquoelettrodo di riferimento egrave costruito in modo tale da mante-nere costante il suo potenziale di conseguenza ogni variazione di ddp misurata egraveimputabile esclusivamente allrsquoelettrodo di misura (piugrave precisamente alla soluzioneanalizzata)
ELETTRODI DI RIFERIMENTOLrsquoelettrodo standard a idrogeno (SHE gtparagrafo 21) egrave lrsquoelettrodo di riferimentoprimario Tuttavia nella pratica quotidiana di laboratorio si usano elettrodi di ri-ferimento secondari piugrave semplici e maneggevoli che hanno comunque la proprie-tagrave di mantenere il proprio potenziale costante a temperatura costante Tratteremoora in maggior dettaglio gli elettrodi di uso piugrave comune
31 Elettrodo ad argentocloruro drsquoargento
Si tratta senzrsquoaltro dellrsquoelettrodo piugrave diffuso Il dispositivo egrave costituito da un sem-plice filo drsquoargento rivestito di AgCl e immerso in una soluzione di KCl (egrave dunqueun elettrodo di seconda specie) Il tutto egrave contenuto in un tubicino di vetro dotatodi setto poroso per assicurare il contatto elettrico con lrsquoesterno ovvero con la so-luzione in cui viene immerso lrsquooggetto dellrsquoanalisi
Figura 27Rappresentazione schematica deldispositivo completo per misurepotenziometriche
3
21
ELETTRODI DI RIFERIMENTO
La rappresentazione convenzionale dellrsquoelettrodo (fig 28) egrave
Ag(s)|AgCl(aq)|KCl(aq)
La reazione di elettrodo egrave
AgCl + endash Ag + Clndash
E il potenziale di elettrodo
E= EdegAgClAg
Considerando unitarie le attivitagrave dei solidi puri si ottiene
E= EdegAgClAg ndash 01984 10ndash3 T log[Clndash] (210)
Se lrsquoattivitagrave degli ioni cloruro egrave costante (a temperatura costante) il potenziale dielettrodo rimane costante Gli elettrodi piugrave comuni contengono soluzioni sature diKCl (circa 42 M) e perciograve sono detti saturi (SSC Saturated Silver-Silver ChlorideElectrode) A 25 degC il potenziale di SSC vale 0197 V Questo elettrodo puograve essereusato fino a 105 degC Nella tabella 1 ndash lab 1 (gtpag 39) sono riportati i potenziali alvariare della temperatura per lrsquoelettrodo saturo e 3 M
Gli anioni (come il solfuro) che formano con Ag+ sali meno solubili di AgClpossono danneggiare questo tipo di elettrodo Anche gli ossidanti e i riducenti fortie gli agenti complessanti possono interferire con la reazione di elettrodo per proteg-gere lrsquoelettrodo da queste sostanze si usa un elettrolita intermedio come nel casodellrsquoelettrodo a calomelano saturo (SCE gtparagrafo 32)
Gli elettrodi ad argentocloruro di argento sono usati come riferimento internonegli elettrodi a vetro (gtparagrafo 41)
32 Elettrodo a calomelano
laquoCalomelanoraquo egrave il nome comune del cloruro mercuroso (I) Hg2Cl2 che fa parteappunto di questo elettrodo (fig 29a) La rappresentazione convenzionale dellrsquoe-lettrodo egrave
Hg(l)|Hg2Cl2(s)|KCl(aq)
La reazione di elettrodo egrave
Hg2Cl2 + 2endash 2Hg + 2Clndash
e il potenziale di elettrodo in base alla legge di Nernst
In condizioni standard lrsquoattivitagrave di solidi e liquidi puri egrave considerata uguale a 1quindi
da cui
ndash 01984 10ndash3 T log|Clndash| (211)
Sono anche molto diffusigli elettrodi contenentiKCl 3 M cioegrave quasisaturi Il vantaggio egrave chein queste soluzioni non siformano cristalli di KClche possono danneggiarelrsquoelettrodo ostruendoil setto poroso che sta sulfondo
Figura 28Elettrodo ad AgAgCILa soluzione tamponeinterna contiene ioni K+
e CIndash ad attivitagrave costante
22
2 Potenziometria
Il potenziale dellrsquoelettrodo a calomelano dunque dipende solo dallrsquoattivitagrave delloione cloruro e dalla temperatura Se la temperatura egrave costante e lrsquoattivitagrave dello ionecloruro nella soluzione interna allrsquoelettrodo non varia il potenziale rimane costante
Gli elettrodi a calomelano piugrave comuni contengono soluzioni sature di KCl (circa42 M) e perciograve sono detti saturi (SCE Saturated Calomel Electrode) Si usano ancheelettrodi a KCl 1 M e 01 M la tabella 22 riporta il potenziale assunto da questielettrodi secondo la concentrazione di KCl
TABELLA 22 | Potenziale (mV) di alcuni elettrodi di riferimento a 25 degC
AgAgCl Calomelano HgHgO HgHgSO4 Thalamid
KCl 01 M 288 KCl 01 M 334 NaOH 01 M 165 H2SO4 05 M 682 KCl 3 M -567
KCl 1 M 235 KCl 1 M 280 NaOH 1 M 140 K2SO4 sat 650 KCl sat -577
KCl 3 M 210 KCl 35 M 250
KCl 35 M 205 KCl sat 241
KCl sat 199 NaCl sat 236
NaCl 3 M 209
NaCl sat 197
Lrsquoelettrodo a calomelano puograve essere usato fino a circa 70 degC a temperature piugrave alteil calomelano si dismuta (Hg2Cl2 Hg + HgCl2)
I solfuri gli ossidanti i forti riducenti e gli agenti complessanti che formanoamalgami con gli ioni Hg2
2+ possono danneggiare questo tipo di elettrodo Perciogravequando si lavora in presenza di queste sostanze si usano elettrodi a doppia giun-zione (fig 29b) in cui fra lrsquoelettrodo e la soluzione egrave interposto un contenitoreriempito con un elettrolita intermedio (per esempio KNO3)
Va infine segnalata la tendenza a non usare il mercurio per motivi tossicologicie questo spiega il progressivo abbandono nella pratica comune di questo tipo dielettrodo con grande rammarico dagli elettrochimici percheacute lrsquoelettrodo a calomela-no egrave il piugrave stabile
bullELETTRODI DI PRIMA E DI SECONDA SPECIE bullALTRI ELETTRODI DI RIFERIMENTO
APPROFONDIMENTI
Figura 29(a) Elettrodo a calomelano (b) Nella versione adoppia giunzione egrave presente una seconda cameraper lrsquoelettrolita intermedio che viene immessoattraverso la bocchetta laterale il setto porosoassicura il contatto elettrico con la soluzioneesterna
a b

17
CELLE GALVANICHE O PILE
ESEMPIO 2UNA IPOTETICA PILA Egrave COSTITUITA DALLE COPPIE REDOX Al3+Al E Ni2+NiQUAL Egrave LA FEM DELLA PILA A 25 degC SE LE CONCENTRAZIONI DELLE SPECIEIONICHE SONO RISPETTIVAMENTE [Al3+] = 2 10ndash2 M E [Ni2+] = 10ndash2 M
Approssimando le attivitagrave con le concentrazioni si ottiene
La situazione non egrave sostanzialmente cambiata rispetto alle condizioni standardpercheacute anche in questo caso la reazione di cella comporta lrsquoossidazione dellrsquoallumi-nio e la riduzione del nichel La fem della pila quindi egrave
Ecella= Ec ndash Ea= ndash032 ndash (ndash167)= +135 V
24 Alcuni tipi di pile
Pila DaniellUna semicella egrave costituita da una lamina di rame immersa in una soluzione diCuSO4 lrsquoaltra semicella da una lamina di zinco immersa in una soluzione di ZnSO4
(fig 25) Le due semicelle sono separate da un setto poroso (in pratica una mem-brana di vetro sinterizzato o analogo materiale inerte) oppure si trovano in duediversi recipienti collegati da un ponte salino
Le reazioni di elettrodo sono
Zn2+ + 2endash Zn Edeg= ndash0762 V
Cu2+ + 2endash Cu Edeg= 0342 V
Le concentrazioni dei sali nelle rispettive semicelle sono in genere tali da renderenegativo il semielemento di zinco che perciograve tende a cedere elettroni al rame (ossi-dandosi) La lamina di zinco egrave dunque il polo negativo (anodo) della pila e il rameegrave il polo positivo (catodo)
La rappresentazione della catena galvanica di questa pila secondo le convenzioniIUPAC egrave
(ndash) Zn(s)|ZnSO4(aq)||CuSO4(aq)|Cu(s) (+)
UNA IPOTETICA PILA Egrave COSTITUITA DALLE COPPIE REDOX Al3+Al E Ni2+NiQUAL Egrave LA FEM DELLA PILA A 25 degC SE LE CONCENTRAZIONI DELLE SPECIEIONICHE SONO RISPETTIVAMENTE [Al3+] = 2 10ndash2 M E [Ni2+] = 10ndash2 M
Si noti che se i duescomparti non fosseroscomparti non fosseroben separati dal settoben separati dal settoporoso ben presto gli ioniporoso ben presto gli ionirame disponibilirame disponibiliraggiungerebbero lrsquoraggiungerebbero lrsquoanododi zinco ossidandolo eandando a depositarsi sudi esso come Cumetallico nondiversamente da quanto sipuograve osservareimmergendo una barrettadi zinco in una soluzionedi solfato di rameesaurendo quindirapidamente la pila esviluppando calore
Figura 25Pila Daniell (a) con settoporoso e (b) con pontesalino
a b
18
2 Potenziometria
La coppia di barrette verticali (||) al centro rappresenta il setto poroso o il pontesalino che separano le due semicelle lrsquoanodo egrave scritto a sinistra e per ciascun elet-trodo la forma ridotta della coppia redox egrave scritta verso lrsquoesterno Le lettere scrittefra parentesi indicano lo stato fisico di ogni specie chimica
La reazione di cella egrave
Zn + Cu2+ Zn2+ + Cu
Per calcolare la fem teorica di questa pila che puograve anche trovarsi in condizionidiverse da quelle standard si applica la legge di Nernst a ciascuna semicella
(28)
(29)
I potenziali standard delle due semicelle sono cosigrave diversi fra loro che nelle normalicondizioni operative di una pila Daniell il rame rappresenta il polo positivo e lozinco il polo negativo
Sottraendo il potenziale minore da quello maggiore si ottiene il potenziale dicella
Ecella = ECu2+Cu - EZn2+Zn
Ponendo Edegcella = EdegCu2+Cu ndash EdegZn2+Zn (= 0342 V + 0762 V) e quindi sottraendo la(28 dalla 29) si ricava infine
Questa equazione consente dunque di calcolare il potenziale di Nernst se egrave notoil valore effettivo dellrsquoattivitagrave degli ioni Zn2+ e Cu2+ Tuttavia il calcolo si presta aerrori anche significativi lrsquoattivitagrave degli ioni per esempio varia in funzione dellaforza ionica della soluzione e non puograve essere calcolata Perciograve la fem reale piugraveesattamente la ddp che si misura si discosta dal valore calcolato sostanzialmenteper due motivi
a il sistema non si comporta in maniera ideale (per esempio gli elettrodi possonopolarizzarsi)
b il contributo della caduta ohmica (gtequazione 25) puograve essere praticamente an-nullato se nel circuito viene fatta circolare una corrente trascurabile invece ilpotenziale di giunzione liquida per quanto piccolo non puograve essere soppresso enon egrave prevedibile in base a equazioni teoriche
Pile a concentrazioneIn questo tipo di pila le due semicelle contengono due soluzioni di una stessa cop-pia redox ma a diversa concentrazione gli elettrodi sono inerti oppure dello stes-so metallo e le semicelle sono collegate da un setto poroso o da un ponte salino(fig 26)
In questo calcolotrascuriamo i contributidei termini E1 E2 E3 dellaequazione (25)
Lrsquoequazione rappresentain pratica la legge diNernst applicata allareazione redox globalescritta nel verso dellaspontaneitagrave tenendoconto degli elettroniscambiati (2) e inserendonellrsquoargomento dellogaritmo lrsquoinverso delquoziente di reazione
+
19
CELLE GALVANICHE O PILE
Le due soluzioni si scambiano elettroni attraverso il circuito esterno mentre ilsetto poroso (o il ponte salino) che le collega consente il passaggio di ioni e quin-di chiude il circuito Il sistema raggiunge lrsquoequilibrio quando le attivitagrave degli ioninelle due semicelle diventano uguali perciograve egrave prevedibile che nella soluzione piugravediluita avvenga lrsquoossidazione il rame metallico si dissolve e si formano ioni Cu2+ insoluzione questo dunque egrave lrsquoanodo Contemporaneamente gli elettroni passanonellrsquoaltro comparto (a destra in figura 26) attraverso il circuito esterno e riduconogli ioni Cu2+ che si depositano sullrsquoelettrodo come rame metallico questo dunqueegrave il catodo
In pratica egrave come se gli ioni Cu2+ si trasferissero dalla soluzione piugrave concentrataalla soluzione piugrave diluita Queste pile dunque trasformano in lavoro elettrico lrsquoe-nergia che si libera nel processo spontaneo con cui due soluzioni a diretto contattotendono a raggiungere lrsquoequilibrio di concentrazione
La rappresentazione convenzionale della catena elettrodica di questa pila a con-centrazione egrave la seguente
(-) Cu(s) |Cu2+(001 M)||Cu2+(1 M)|Cu(s) (+)
Per calcolare la tensione teorica della pila si applica la legge di Nernst a ciascun elet-trodo Approssimando le attivitagrave con le concentrazioni (a 25 degC) si ottiene
(soluzione piugrave diluita anodo)
(soluzione piugrave concentrata catodo)
Quindi
Ecella= Emaggiore ndash Eminore= 0342- 0283= 0059 V
ALTRI TIPI DI CELLE GALVANICHE O PILEAPPROFONDIMENTO
Figura 26Pila a concentrazione il compartoanodico (a sinistra) contiene ioni Cu2+
in concentrazione 001 M e il com-parto catodico (a destra) contieneioni Cu2+ in concentrazione 1 M Ilcollegamento fra le due semicelle egraverealizzato con un ponte salino
20
2 Potenziometria
STRUMENTAZIONEIn potenziometria si misura la differenza di potenziale che si stabilisce fra due semi-celle allo scopo di determinare la concentrazione di uno ione o per seguire lrsquoanda-mento di una titolazione
Il dispositivo completo per una misura potenziometrica (fig 27) consiste es-senzialmente di
bull un potenziometro o meglio un millivoltmetro elettronicobull un elettrodo di riferimentobull un elettrodo di misura
Il potenziometro serve per misurare la ddp fra i due elettrodi senza alterare il lorostato di equilibrio perciograve si lavora a corrente praticamente nulla
Gli elettrodi collegati al potenziometro sono immersi nella soluzione su cui sieffettuano le misure Lrsquoelettrodo di riferimento egrave costruito in modo tale da mante-nere costante il suo potenziale di conseguenza ogni variazione di ddp misurata egraveimputabile esclusivamente allrsquoelettrodo di misura (piugrave precisamente alla soluzioneanalizzata)
ELETTRODI DI RIFERIMENTOLrsquoelettrodo standard a idrogeno (SHE gtparagrafo 21) egrave lrsquoelettrodo di riferimentoprimario Tuttavia nella pratica quotidiana di laboratorio si usano elettrodi di ri-ferimento secondari piugrave semplici e maneggevoli che hanno comunque la proprie-tagrave di mantenere il proprio potenziale costante a temperatura costante Tratteremoora in maggior dettaglio gli elettrodi di uso piugrave comune
31 Elettrodo ad argentocloruro drsquoargento
Si tratta senzrsquoaltro dellrsquoelettrodo piugrave diffuso Il dispositivo egrave costituito da un sem-plice filo drsquoargento rivestito di AgCl e immerso in una soluzione di KCl (egrave dunqueun elettrodo di seconda specie) Il tutto egrave contenuto in un tubicino di vetro dotatodi setto poroso per assicurare il contatto elettrico con lrsquoesterno ovvero con la so-luzione in cui viene immerso lrsquooggetto dellrsquoanalisi
Figura 27Rappresentazione schematica deldispositivo completo per misurepotenziometriche
3
21
ELETTRODI DI RIFERIMENTO
La rappresentazione convenzionale dellrsquoelettrodo (fig 28) egrave
Ag(s)|AgCl(aq)|KCl(aq)
La reazione di elettrodo egrave
AgCl + endash Ag + Clndash
E il potenziale di elettrodo
E= EdegAgClAg
Considerando unitarie le attivitagrave dei solidi puri si ottiene
E= EdegAgClAg ndash 01984 10ndash3 T log[Clndash] (210)
Se lrsquoattivitagrave degli ioni cloruro egrave costante (a temperatura costante) il potenziale dielettrodo rimane costante Gli elettrodi piugrave comuni contengono soluzioni sature diKCl (circa 42 M) e perciograve sono detti saturi (SSC Saturated Silver-Silver ChlorideElectrode) A 25 degC il potenziale di SSC vale 0197 V Questo elettrodo puograve essereusato fino a 105 degC Nella tabella 1 ndash lab 1 (gtpag 39) sono riportati i potenziali alvariare della temperatura per lrsquoelettrodo saturo e 3 M
Gli anioni (come il solfuro) che formano con Ag+ sali meno solubili di AgClpossono danneggiare questo tipo di elettrodo Anche gli ossidanti e i riducenti fortie gli agenti complessanti possono interferire con la reazione di elettrodo per proteg-gere lrsquoelettrodo da queste sostanze si usa un elettrolita intermedio come nel casodellrsquoelettrodo a calomelano saturo (SCE gtparagrafo 32)
Gli elettrodi ad argentocloruro di argento sono usati come riferimento internonegli elettrodi a vetro (gtparagrafo 41)
32 Elettrodo a calomelano
laquoCalomelanoraquo egrave il nome comune del cloruro mercuroso (I) Hg2Cl2 che fa parteappunto di questo elettrodo (fig 29a) La rappresentazione convenzionale dellrsquoe-lettrodo egrave
Hg(l)|Hg2Cl2(s)|KCl(aq)
La reazione di elettrodo egrave
Hg2Cl2 + 2endash 2Hg + 2Clndash
e il potenziale di elettrodo in base alla legge di Nernst
In condizioni standard lrsquoattivitagrave di solidi e liquidi puri egrave considerata uguale a 1quindi
da cui
ndash 01984 10ndash3 T log|Clndash| (211)
Sono anche molto diffusigli elettrodi contenentiKCl 3 M cioegrave quasisaturi Il vantaggio egrave chein queste soluzioni non siformano cristalli di KClche possono danneggiarelrsquoelettrodo ostruendoil setto poroso che sta sulfondo
Figura 28Elettrodo ad AgAgCILa soluzione tamponeinterna contiene ioni K+
e CIndash ad attivitagrave costante
22
2 Potenziometria
Il potenziale dellrsquoelettrodo a calomelano dunque dipende solo dallrsquoattivitagrave delloione cloruro e dalla temperatura Se la temperatura egrave costante e lrsquoattivitagrave dello ionecloruro nella soluzione interna allrsquoelettrodo non varia il potenziale rimane costante
Gli elettrodi a calomelano piugrave comuni contengono soluzioni sature di KCl (circa42 M) e perciograve sono detti saturi (SCE Saturated Calomel Electrode) Si usano ancheelettrodi a KCl 1 M e 01 M la tabella 22 riporta il potenziale assunto da questielettrodi secondo la concentrazione di KCl
TABELLA 22 | Potenziale (mV) di alcuni elettrodi di riferimento a 25 degC
AgAgCl Calomelano HgHgO HgHgSO4 Thalamid
KCl 01 M 288 KCl 01 M 334 NaOH 01 M 165 H2SO4 05 M 682 KCl 3 M -567
KCl 1 M 235 KCl 1 M 280 NaOH 1 M 140 K2SO4 sat 650 KCl sat -577
KCl 3 M 210 KCl 35 M 250
KCl 35 M 205 KCl sat 241
KCl sat 199 NaCl sat 236
NaCl 3 M 209
NaCl sat 197
Lrsquoelettrodo a calomelano puograve essere usato fino a circa 70 degC a temperature piugrave alteil calomelano si dismuta (Hg2Cl2 Hg + HgCl2)
I solfuri gli ossidanti i forti riducenti e gli agenti complessanti che formanoamalgami con gli ioni Hg2
2+ possono danneggiare questo tipo di elettrodo Perciogravequando si lavora in presenza di queste sostanze si usano elettrodi a doppia giun-zione (fig 29b) in cui fra lrsquoelettrodo e la soluzione egrave interposto un contenitoreriempito con un elettrolita intermedio (per esempio KNO3)
Va infine segnalata la tendenza a non usare il mercurio per motivi tossicologicie questo spiega il progressivo abbandono nella pratica comune di questo tipo dielettrodo con grande rammarico dagli elettrochimici percheacute lrsquoelettrodo a calomela-no egrave il piugrave stabile
bullELETTRODI DI PRIMA E DI SECONDA SPECIE bullALTRI ELETTRODI DI RIFERIMENTO
APPROFONDIMENTI
Figura 29(a) Elettrodo a calomelano (b) Nella versione adoppia giunzione egrave presente una seconda cameraper lrsquoelettrolita intermedio che viene immessoattraverso la bocchetta laterale il setto porosoassicura il contatto elettrico con la soluzioneesterna
a b

18
2 Potenziometria
La coppia di barrette verticali (||) al centro rappresenta il setto poroso o il pontesalino che separano le due semicelle lrsquoanodo egrave scritto a sinistra e per ciascun elet-trodo la forma ridotta della coppia redox egrave scritta verso lrsquoesterno Le lettere scrittefra parentesi indicano lo stato fisico di ogni specie chimica
La reazione di cella egrave
Zn + Cu2+ Zn2+ + Cu
Per calcolare la fem teorica di questa pila che puograve anche trovarsi in condizionidiverse da quelle standard si applica la legge di Nernst a ciascuna semicella
(28)
(29)
I potenziali standard delle due semicelle sono cosigrave diversi fra loro che nelle normalicondizioni operative di una pila Daniell il rame rappresenta il polo positivo e lozinco il polo negativo
Sottraendo il potenziale minore da quello maggiore si ottiene il potenziale dicella
Ecella = ECu2+Cu - EZn2+Zn
Ponendo Edegcella = EdegCu2+Cu ndash EdegZn2+Zn (= 0342 V + 0762 V) e quindi sottraendo la(28 dalla 29) si ricava infine
Questa equazione consente dunque di calcolare il potenziale di Nernst se egrave notoil valore effettivo dellrsquoattivitagrave degli ioni Zn2+ e Cu2+ Tuttavia il calcolo si presta aerrori anche significativi lrsquoattivitagrave degli ioni per esempio varia in funzione dellaforza ionica della soluzione e non puograve essere calcolata Perciograve la fem reale piugraveesattamente la ddp che si misura si discosta dal valore calcolato sostanzialmenteper due motivi
a il sistema non si comporta in maniera ideale (per esempio gli elettrodi possonopolarizzarsi)
b il contributo della caduta ohmica (gtequazione 25) puograve essere praticamente an-nullato se nel circuito viene fatta circolare una corrente trascurabile invece ilpotenziale di giunzione liquida per quanto piccolo non puograve essere soppresso enon egrave prevedibile in base a equazioni teoriche
Pile a concentrazioneIn questo tipo di pila le due semicelle contengono due soluzioni di una stessa cop-pia redox ma a diversa concentrazione gli elettrodi sono inerti oppure dello stes-so metallo e le semicelle sono collegate da un setto poroso o da un ponte salino(fig 26)
In questo calcolotrascuriamo i contributidei termini E1 E2 E3 dellaequazione (25)
Lrsquoequazione rappresentain pratica la legge diNernst applicata allareazione redox globalescritta nel verso dellaspontaneitagrave tenendoconto degli elettroniscambiati (2) e inserendonellrsquoargomento dellogaritmo lrsquoinverso delquoziente di reazione
+
19
CELLE GALVANICHE O PILE
Le due soluzioni si scambiano elettroni attraverso il circuito esterno mentre ilsetto poroso (o il ponte salino) che le collega consente il passaggio di ioni e quin-di chiude il circuito Il sistema raggiunge lrsquoequilibrio quando le attivitagrave degli ioninelle due semicelle diventano uguali perciograve egrave prevedibile che nella soluzione piugravediluita avvenga lrsquoossidazione il rame metallico si dissolve e si formano ioni Cu2+ insoluzione questo dunque egrave lrsquoanodo Contemporaneamente gli elettroni passanonellrsquoaltro comparto (a destra in figura 26) attraverso il circuito esterno e riduconogli ioni Cu2+ che si depositano sullrsquoelettrodo come rame metallico questo dunqueegrave il catodo
In pratica egrave come se gli ioni Cu2+ si trasferissero dalla soluzione piugrave concentrataalla soluzione piugrave diluita Queste pile dunque trasformano in lavoro elettrico lrsquoe-nergia che si libera nel processo spontaneo con cui due soluzioni a diretto contattotendono a raggiungere lrsquoequilibrio di concentrazione
La rappresentazione convenzionale della catena elettrodica di questa pila a con-centrazione egrave la seguente
(-) Cu(s) |Cu2+(001 M)||Cu2+(1 M)|Cu(s) (+)
Per calcolare la tensione teorica della pila si applica la legge di Nernst a ciascun elet-trodo Approssimando le attivitagrave con le concentrazioni (a 25 degC) si ottiene
(soluzione piugrave diluita anodo)
(soluzione piugrave concentrata catodo)
Quindi
Ecella= Emaggiore ndash Eminore= 0342- 0283= 0059 V
ALTRI TIPI DI CELLE GALVANICHE O PILEAPPROFONDIMENTO
Figura 26Pila a concentrazione il compartoanodico (a sinistra) contiene ioni Cu2+
in concentrazione 001 M e il com-parto catodico (a destra) contieneioni Cu2+ in concentrazione 1 M Ilcollegamento fra le due semicelle egraverealizzato con un ponte salino
20
2 Potenziometria
STRUMENTAZIONEIn potenziometria si misura la differenza di potenziale che si stabilisce fra due semi-celle allo scopo di determinare la concentrazione di uno ione o per seguire lrsquoanda-mento di una titolazione
Il dispositivo completo per una misura potenziometrica (fig 27) consiste es-senzialmente di
bull un potenziometro o meglio un millivoltmetro elettronicobull un elettrodo di riferimentobull un elettrodo di misura
Il potenziometro serve per misurare la ddp fra i due elettrodi senza alterare il lorostato di equilibrio perciograve si lavora a corrente praticamente nulla
Gli elettrodi collegati al potenziometro sono immersi nella soluzione su cui sieffettuano le misure Lrsquoelettrodo di riferimento egrave costruito in modo tale da mante-nere costante il suo potenziale di conseguenza ogni variazione di ddp misurata egraveimputabile esclusivamente allrsquoelettrodo di misura (piugrave precisamente alla soluzioneanalizzata)
ELETTRODI DI RIFERIMENTOLrsquoelettrodo standard a idrogeno (SHE gtparagrafo 21) egrave lrsquoelettrodo di riferimentoprimario Tuttavia nella pratica quotidiana di laboratorio si usano elettrodi di ri-ferimento secondari piugrave semplici e maneggevoli che hanno comunque la proprie-tagrave di mantenere il proprio potenziale costante a temperatura costante Tratteremoora in maggior dettaglio gli elettrodi di uso piugrave comune
31 Elettrodo ad argentocloruro drsquoargento
Si tratta senzrsquoaltro dellrsquoelettrodo piugrave diffuso Il dispositivo egrave costituito da un sem-plice filo drsquoargento rivestito di AgCl e immerso in una soluzione di KCl (egrave dunqueun elettrodo di seconda specie) Il tutto egrave contenuto in un tubicino di vetro dotatodi setto poroso per assicurare il contatto elettrico con lrsquoesterno ovvero con la so-luzione in cui viene immerso lrsquooggetto dellrsquoanalisi
Figura 27Rappresentazione schematica deldispositivo completo per misurepotenziometriche
3
21
ELETTRODI DI RIFERIMENTO
La rappresentazione convenzionale dellrsquoelettrodo (fig 28) egrave
Ag(s)|AgCl(aq)|KCl(aq)
La reazione di elettrodo egrave
AgCl + endash Ag + Clndash
E il potenziale di elettrodo
E= EdegAgClAg
Considerando unitarie le attivitagrave dei solidi puri si ottiene
E= EdegAgClAg ndash 01984 10ndash3 T log[Clndash] (210)
Se lrsquoattivitagrave degli ioni cloruro egrave costante (a temperatura costante) il potenziale dielettrodo rimane costante Gli elettrodi piugrave comuni contengono soluzioni sature diKCl (circa 42 M) e perciograve sono detti saturi (SSC Saturated Silver-Silver ChlorideElectrode) A 25 degC il potenziale di SSC vale 0197 V Questo elettrodo puograve essereusato fino a 105 degC Nella tabella 1 ndash lab 1 (gtpag 39) sono riportati i potenziali alvariare della temperatura per lrsquoelettrodo saturo e 3 M
Gli anioni (come il solfuro) che formano con Ag+ sali meno solubili di AgClpossono danneggiare questo tipo di elettrodo Anche gli ossidanti e i riducenti fortie gli agenti complessanti possono interferire con la reazione di elettrodo per proteg-gere lrsquoelettrodo da queste sostanze si usa un elettrolita intermedio come nel casodellrsquoelettrodo a calomelano saturo (SCE gtparagrafo 32)
Gli elettrodi ad argentocloruro di argento sono usati come riferimento internonegli elettrodi a vetro (gtparagrafo 41)
32 Elettrodo a calomelano
laquoCalomelanoraquo egrave il nome comune del cloruro mercuroso (I) Hg2Cl2 che fa parteappunto di questo elettrodo (fig 29a) La rappresentazione convenzionale dellrsquoe-lettrodo egrave
Hg(l)|Hg2Cl2(s)|KCl(aq)
La reazione di elettrodo egrave
Hg2Cl2 + 2endash 2Hg + 2Clndash
e il potenziale di elettrodo in base alla legge di Nernst
In condizioni standard lrsquoattivitagrave di solidi e liquidi puri egrave considerata uguale a 1quindi
da cui
ndash 01984 10ndash3 T log|Clndash| (211)
Sono anche molto diffusigli elettrodi contenentiKCl 3 M cioegrave quasisaturi Il vantaggio egrave chein queste soluzioni non siformano cristalli di KClche possono danneggiarelrsquoelettrodo ostruendoil setto poroso che sta sulfondo
Figura 28Elettrodo ad AgAgCILa soluzione tamponeinterna contiene ioni K+
e CIndash ad attivitagrave costante
22
2 Potenziometria
Il potenziale dellrsquoelettrodo a calomelano dunque dipende solo dallrsquoattivitagrave delloione cloruro e dalla temperatura Se la temperatura egrave costante e lrsquoattivitagrave dello ionecloruro nella soluzione interna allrsquoelettrodo non varia il potenziale rimane costante
Gli elettrodi a calomelano piugrave comuni contengono soluzioni sature di KCl (circa42 M) e perciograve sono detti saturi (SCE Saturated Calomel Electrode) Si usano ancheelettrodi a KCl 1 M e 01 M la tabella 22 riporta il potenziale assunto da questielettrodi secondo la concentrazione di KCl
TABELLA 22 | Potenziale (mV) di alcuni elettrodi di riferimento a 25 degC
AgAgCl Calomelano HgHgO HgHgSO4 Thalamid
KCl 01 M 288 KCl 01 M 334 NaOH 01 M 165 H2SO4 05 M 682 KCl 3 M -567
KCl 1 M 235 KCl 1 M 280 NaOH 1 M 140 K2SO4 sat 650 KCl sat -577
KCl 3 M 210 KCl 35 M 250
KCl 35 M 205 KCl sat 241
KCl sat 199 NaCl sat 236
NaCl 3 M 209
NaCl sat 197
Lrsquoelettrodo a calomelano puograve essere usato fino a circa 70 degC a temperature piugrave alteil calomelano si dismuta (Hg2Cl2 Hg + HgCl2)
I solfuri gli ossidanti i forti riducenti e gli agenti complessanti che formanoamalgami con gli ioni Hg2
2+ possono danneggiare questo tipo di elettrodo Perciogravequando si lavora in presenza di queste sostanze si usano elettrodi a doppia giun-zione (fig 29b) in cui fra lrsquoelettrodo e la soluzione egrave interposto un contenitoreriempito con un elettrolita intermedio (per esempio KNO3)
Va infine segnalata la tendenza a non usare il mercurio per motivi tossicologicie questo spiega il progressivo abbandono nella pratica comune di questo tipo dielettrodo con grande rammarico dagli elettrochimici percheacute lrsquoelettrodo a calomela-no egrave il piugrave stabile
bullELETTRODI DI PRIMA E DI SECONDA SPECIE bullALTRI ELETTRODI DI RIFERIMENTO
APPROFONDIMENTI
Figura 29(a) Elettrodo a calomelano (b) Nella versione adoppia giunzione egrave presente una seconda cameraper lrsquoelettrolita intermedio che viene immessoattraverso la bocchetta laterale il setto porosoassicura il contatto elettrico con la soluzioneesterna
a b

19
CELLE GALVANICHE O PILE
Le due soluzioni si scambiano elettroni attraverso il circuito esterno mentre ilsetto poroso (o il ponte salino) che le collega consente il passaggio di ioni e quin-di chiude il circuito Il sistema raggiunge lrsquoequilibrio quando le attivitagrave degli ioninelle due semicelle diventano uguali perciograve egrave prevedibile che nella soluzione piugravediluita avvenga lrsquoossidazione il rame metallico si dissolve e si formano ioni Cu2+ insoluzione questo dunque egrave lrsquoanodo Contemporaneamente gli elettroni passanonellrsquoaltro comparto (a destra in figura 26) attraverso il circuito esterno e riduconogli ioni Cu2+ che si depositano sullrsquoelettrodo come rame metallico questo dunqueegrave il catodo
In pratica egrave come se gli ioni Cu2+ si trasferissero dalla soluzione piugrave concentrataalla soluzione piugrave diluita Queste pile dunque trasformano in lavoro elettrico lrsquoe-nergia che si libera nel processo spontaneo con cui due soluzioni a diretto contattotendono a raggiungere lrsquoequilibrio di concentrazione
La rappresentazione convenzionale della catena elettrodica di questa pila a con-centrazione egrave la seguente
(-) Cu(s) |Cu2+(001 M)||Cu2+(1 M)|Cu(s) (+)
Per calcolare la tensione teorica della pila si applica la legge di Nernst a ciascun elet-trodo Approssimando le attivitagrave con le concentrazioni (a 25 degC) si ottiene
(soluzione piugrave diluita anodo)
(soluzione piugrave concentrata catodo)
Quindi
Ecella= Emaggiore ndash Eminore= 0342- 0283= 0059 V
ALTRI TIPI DI CELLE GALVANICHE O PILEAPPROFONDIMENTO
Figura 26Pila a concentrazione il compartoanodico (a sinistra) contiene ioni Cu2+
in concentrazione 001 M e il com-parto catodico (a destra) contieneioni Cu2+ in concentrazione 1 M Ilcollegamento fra le due semicelle egraverealizzato con un ponte salino
20
2 Potenziometria
STRUMENTAZIONEIn potenziometria si misura la differenza di potenziale che si stabilisce fra due semi-celle allo scopo di determinare la concentrazione di uno ione o per seguire lrsquoanda-mento di una titolazione
Il dispositivo completo per una misura potenziometrica (fig 27) consiste es-senzialmente di
bull un potenziometro o meglio un millivoltmetro elettronicobull un elettrodo di riferimentobull un elettrodo di misura
Il potenziometro serve per misurare la ddp fra i due elettrodi senza alterare il lorostato di equilibrio perciograve si lavora a corrente praticamente nulla
Gli elettrodi collegati al potenziometro sono immersi nella soluzione su cui sieffettuano le misure Lrsquoelettrodo di riferimento egrave costruito in modo tale da mante-nere costante il suo potenziale di conseguenza ogni variazione di ddp misurata egraveimputabile esclusivamente allrsquoelettrodo di misura (piugrave precisamente alla soluzioneanalizzata)
ELETTRODI DI RIFERIMENTOLrsquoelettrodo standard a idrogeno (SHE gtparagrafo 21) egrave lrsquoelettrodo di riferimentoprimario Tuttavia nella pratica quotidiana di laboratorio si usano elettrodi di ri-ferimento secondari piugrave semplici e maneggevoli che hanno comunque la proprie-tagrave di mantenere il proprio potenziale costante a temperatura costante Tratteremoora in maggior dettaglio gli elettrodi di uso piugrave comune
31 Elettrodo ad argentocloruro drsquoargento
Si tratta senzrsquoaltro dellrsquoelettrodo piugrave diffuso Il dispositivo egrave costituito da un sem-plice filo drsquoargento rivestito di AgCl e immerso in una soluzione di KCl (egrave dunqueun elettrodo di seconda specie) Il tutto egrave contenuto in un tubicino di vetro dotatodi setto poroso per assicurare il contatto elettrico con lrsquoesterno ovvero con la so-luzione in cui viene immerso lrsquooggetto dellrsquoanalisi
Figura 27Rappresentazione schematica deldispositivo completo per misurepotenziometriche
3
21
ELETTRODI DI RIFERIMENTO
La rappresentazione convenzionale dellrsquoelettrodo (fig 28) egrave
Ag(s)|AgCl(aq)|KCl(aq)
La reazione di elettrodo egrave
AgCl + endash Ag + Clndash
E il potenziale di elettrodo
E= EdegAgClAg
Considerando unitarie le attivitagrave dei solidi puri si ottiene
E= EdegAgClAg ndash 01984 10ndash3 T log[Clndash] (210)
Se lrsquoattivitagrave degli ioni cloruro egrave costante (a temperatura costante) il potenziale dielettrodo rimane costante Gli elettrodi piugrave comuni contengono soluzioni sature diKCl (circa 42 M) e perciograve sono detti saturi (SSC Saturated Silver-Silver ChlorideElectrode) A 25 degC il potenziale di SSC vale 0197 V Questo elettrodo puograve essereusato fino a 105 degC Nella tabella 1 ndash lab 1 (gtpag 39) sono riportati i potenziali alvariare della temperatura per lrsquoelettrodo saturo e 3 M
Gli anioni (come il solfuro) che formano con Ag+ sali meno solubili di AgClpossono danneggiare questo tipo di elettrodo Anche gli ossidanti e i riducenti fortie gli agenti complessanti possono interferire con la reazione di elettrodo per proteg-gere lrsquoelettrodo da queste sostanze si usa un elettrolita intermedio come nel casodellrsquoelettrodo a calomelano saturo (SCE gtparagrafo 32)
Gli elettrodi ad argentocloruro di argento sono usati come riferimento internonegli elettrodi a vetro (gtparagrafo 41)
32 Elettrodo a calomelano
laquoCalomelanoraquo egrave il nome comune del cloruro mercuroso (I) Hg2Cl2 che fa parteappunto di questo elettrodo (fig 29a) La rappresentazione convenzionale dellrsquoe-lettrodo egrave
Hg(l)|Hg2Cl2(s)|KCl(aq)
La reazione di elettrodo egrave
Hg2Cl2 + 2endash 2Hg + 2Clndash
e il potenziale di elettrodo in base alla legge di Nernst
In condizioni standard lrsquoattivitagrave di solidi e liquidi puri egrave considerata uguale a 1quindi
da cui
ndash 01984 10ndash3 T log|Clndash| (211)
Sono anche molto diffusigli elettrodi contenentiKCl 3 M cioegrave quasisaturi Il vantaggio egrave chein queste soluzioni non siformano cristalli di KClche possono danneggiarelrsquoelettrodo ostruendoil setto poroso che sta sulfondo
Figura 28Elettrodo ad AgAgCILa soluzione tamponeinterna contiene ioni K+
e CIndash ad attivitagrave costante
22
2 Potenziometria
Il potenziale dellrsquoelettrodo a calomelano dunque dipende solo dallrsquoattivitagrave delloione cloruro e dalla temperatura Se la temperatura egrave costante e lrsquoattivitagrave dello ionecloruro nella soluzione interna allrsquoelettrodo non varia il potenziale rimane costante
Gli elettrodi a calomelano piugrave comuni contengono soluzioni sature di KCl (circa42 M) e perciograve sono detti saturi (SCE Saturated Calomel Electrode) Si usano ancheelettrodi a KCl 1 M e 01 M la tabella 22 riporta il potenziale assunto da questielettrodi secondo la concentrazione di KCl
TABELLA 22 | Potenziale (mV) di alcuni elettrodi di riferimento a 25 degC
AgAgCl Calomelano HgHgO HgHgSO4 Thalamid
KCl 01 M 288 KCl 01 M 334 NaOH 01 M 165 H2SO4 05 M 682 KCl 3 M -567
KCl 1 M 235 KCl 1 M 280 NaOH 1 M 140 K2SO4 sat 650 KCl sat -577
KCl 3 M 210 KCl 35 M 250
KCl 35 M 205 KCl sat 241
KCl sat 199 NaCl sat 236
NaCl 3 M 209
NaCl sat 197
Lrsquoelettrodo a calomelano puograve essere usato fino a circa 70 degC a temperature piugrave alteil calomelano si dismuta (Hg2Cl2 Hg + HgCl2)
I solfuri gli ossidanti i forti riducenti e gli agenti complessanti che formanoamalgami con gli ioni Hg2
2+ possono danneggiare questo tipo di elettrodo Perciogravequando si lavora in presenza di queste sostanze si usano elettrodi a doppia giun-zione (fig 29b) in cui fra lrsquoelettrodo e la soluzione egrave interposto un contenitoreriempito con un elettrolita intermedio (per esempio KNO3)
Va infine segnalata la tendenza a non usare il mercurio per motivi tossicologicie questo spiega il progressivo abbandono nella pratica comune di questo tipo dielettrodo con grande rammarico dagli elettrochimici percheacute lrsquoelettrodo a calomela-no egrave il piugrave stabile
bullELETTRODI DI PRIMA E DI SECONDA SPECIE bullALTRI ELETTRODI DI RIFERIMENTO
APPROFONDIMENTI
Figura 29(a) Elettrodo a calomelano (b) Nella versione adoppia giunzione egrave presente una seconda cameraper lrsquoelettrolita intermedio che viene immessoattraverso la bocchetta laterale il setto porosoassicura il contatto elettrico con la soluzioneesterna
a b

20
2 Potenziometria
STRUMENTAZIONEIn potenziometria si misura la differenza di potenziale che si stabilisce fra due semi-celle allo scopo di determinare la concentrazione di uno ione o per seguire lrsquoanda-mento di una titolazione
Il dispositivo completo per una misura potenziometrica (fig 27) consiste es-senzialmente di
bull un potenziometro o meglio un millivoltmetro elettronicobull un elettrodo di riferimentobull un elettrodo di misura
Il potenziometro serve per misurare la ddp fra i due elettrodi senza alterare il lorostato di equilibrio perciograve si lavora a corrente praticamente nulla
Gli elettrodi collegati al potenziometro sono immersi nella soluzione su cui sieffettuano le misure Lrsquoelettrodo di riferimento egrave costruito in modo tale da mante-nere costante il suo potenziale di conseguenza ogni variazione di ddp misurata egraveimputabile esclusivamente allrsquoelettrodo di misura (piugrave precisamente alla soluzioneanalizzata)
ELETTRODI DI RIFERIMENTOLrsquoelettrodo standard a idrogeno (SHE gtparagrafo 21) egrave lrsquoelettrodo di riferimentoprimario Tuttavia nella pratica quotidiana di laboratorio si usano elettrodi di ri-ferimento secondari piugrave semplici e maneggevoli che hanno comunque la proprie-tagrave di mantenere il proprio potenziale costante a temperatura costante Tratteremoora in maggior dettaglio gli elettrodi di uso piugrave comune
31 Elettrodo ad argentocloruro drsquoargento
Si tratta senzrsquoaltro dellrsquoelettrodo piugrave diffuso Il dispositivo egrave costituito da un sem-plice filo drsquoargento rivestito di AgCl e immerso in una soluzione di KCl (egrave dunqueun elettrodo di seconda specie) Il tutto egrave contenuto in un tubicino di vetro dotatodi setto poroso per assicurare il contatto elettrico con lrsquoesterno ovvero con la so-luzione in cui viene immerso lrsquooggetto dellrsquoanalisi
Figura 27Rappresentazione schematica deldispositivo completo per misurepotenziometriche
3
21
ELETTRODI DI RIFERIMENTO
La rappresentazione convenzionale dellrsquoelettrodo (fig 28) egrave
Ag(s)|AgCl(aq)|KCl(aq)
La reazione di elettrodo egrave
AgCl + endash Ag + Clndash
E il potenziale di elettrodo
E= EdegAgClAg
Considerando unitarie le attivitagrave dei solidi puri si ottiene
E= EdegAgClAg ndash 01984 10ndash3 T log[Clndash] (210)
Se lrsquoattivitagrave degli ioni cloruro egrave costante (a temperatura costante) il potenziale dielettrodo rimane costante Gli elettrodi piugrave comuni contengono soluzioni sature diKCl (circa 42 M) e perciograve sono detti saturi (SSC Saturated Silver-Silver ChlorideElectrode) A 25 degC il potenziale di SSC vale 0197 V Questo elettrodo puograve essereusato fino a 105 degC Nella tabella 1 ndash lab 1 (gtpag 39) sono riportati i potenziali alvariare della temperatura per lrsquoelettrodo saturo e 3 M
Gli anioni (come il solfuro) che formano con Ag+ sali meno solubili di AgClpossono danneggiare questo tipo di elettrodo Anche gli ossidanti e i riducenti fortie gli agenti complessanti possono interferire con la reazione di elettrodo per proteg-gere lrsquoelettrodo da queste sostanze si usa un elettrolita intermedio come nel casodellrsquoelettrodo a calomelano saturo (SCE gtparagrafo 32)
Gli elettrodi ad argentocloruro di argento sono usati come riferimento internonegli elettrodi a vetro (gtparagrafo 41)
32 Elettrodo a calomelano
laquoCalomelanoraquo egrave il nome comune del cloruro mercuroso (I) Hg2Cl2 che fa parteappunto di questo elettrodo (fig 29a) La rappresentazione convenzionale dellrsquoe-lettrodo egrave
Hg(l)|Hg2Cl2(s)|KCl(aq)
La reazione di elettrodo egrave
Hg2Cl2 + 2endash 2Hg + 2Clndash
e il potenziale di elettrodo in base alla legge di Nernst
In condizioni standard lrsquoattivitagrave di solidi e liquidi puri egrave considerata uguale a 1quindi
da cui
ndash 01984 10ndash3 T log|Clndash| (211)
Sono anche molto diffusigli elettrodi contenentiKCl 3 M cioegrave quasisaturi Il vantaggio egrave chein queste soluzioni non siformano cristalli di KClche possono danneggiarelrsquoelettrodo ostruendoil setto poroso che sta sulfondo
Figura 28Elettrodo ad AgAgCILa soluzione tamponeinterna contiene ioni K+
e CIndash ad attivitagrave costante
22
2 Potenziometria
Il potenziale dellrsquoelettrodo a calomelano dunque dipende solo dallrsquoattivitagrave delloione cloruro e dalla temperatura Se la temperatura egrave costante e lrsquoattivitagrave dello ionecloruro nella soluzione interna allrsquoelettrodo non varia il potenziale rimane costante
Gli elettrodi a calomelano piugrave comuni contengono soluzioni sature di KCl (circa42 M) e perciograve sono detti saturi (SCE Saturated Calomel Electrode) Si usano ancheelettrodi a KCl 1 M e 01 M la tabella 22 riporta il potenziale assunto da questielettrodi secondo la concentrazione di KCl
TABELLA 22 | Potenziale (mV) di alcuni elettrodi di riferimento a 25 degC
AgAgCl Calomelano HgHgO HgHgSO4 Thalamid
KCl 01 M 288 KCl 01 M 334 NaOH 01 M 165 H2SO4 05 M 682 KCl 3 M -567
KCl 1 M 235 KCl 1 M 280 NaOH 1 M 140 K2SO4 sat 650 KCl sat -577
KCl 3 M 210 KCl 35 M 250
KCl 35 M 205 KCl sat 241
KCl sat 199 NaCl sat 236
NaCl 3 M 209
NaCl sat 197
Lrsquoelettrodo a calomelano puograve essere usato fino a circa 70 degC a temperature piugrave alteil calomelano si dismuta (Hg2Cl2 Hg + HgCl2)
I solfuri gli ossidanti i forti riducenti e gli agenti complessanti che formanoamalgami con gli ioni Hg2
2+ possono danneggiare questo tipo di elettrodo Perciogravequando si lavora in presenza di queste sostanze si usano elettrodi a doppia giun-zione (fig 29b) in cui fra lrsquoelettrodo e la soluzione egrave interposto un contenitoreriempito con un elettrolita intermedio (per esempio KNO3)
Va infine segnalata la tendenza a non usare il mercurio per motivi tossicologicie questo spiega il progressivo abbandono nella pratica comune di questo tipo dielettrodo con grande rammarico dagli elettrochimici percheacute lrsquoelettrodo a calomela-no egrave il piugrave stabile
bullELETTRODI DI PRIMA E DI SECONDA SPECIE bullALTRI ELETTRODI DI RIFERIMENTO
APPROFONDIMENTI
Figura 29(a) Elettrodo a calomelano (b) Nella versione adoppia giunzione egrave presente una seconda cameraper lrsquoelettrolita intermedio che viene immessoattraverso la bocchetta laterale il setto porosoassicura il contatto elettrico con la soluzioneesterna
a b

21
ELETTRODI DI RIFERIMENTO
La rappresentazione convenzionale dellrsquoelettrodo (fig 28) egrave
Ag(s)|AgCl(aq)|KCl(aq)
La reazione di elettrodo egrave
AgCl + endash Ag + Clndash
E il potenziale di elettrodo
E= EdegAgClAg
Considerando unitarie le attivitagrave dei solidi puri si ottiene
E= EdegAgClAg ndash 01984 10ndash3 T log[Clndash] (210)
Se lrsquoattivitagrave degli ioni cloruro egrave costante (a temperatura costante) il potenziale dielettrodo rimane costante Gli elettrodi piugrave comuni contengono soluzioni sature diKCl (circa 42 M) e perciograve sono detti saturi (SSC Saturated Silver-Silver ChlorideElectrode) A 25 degC il potenziale di SSC vale 0197 V Questo elettrodo puograve essereusato fino a 105 degC Nella tabella 1 ndash lab 1 (gtpag 39) sono riportati i potenziali alvariare della temperatura per lrsquoelettrodo saturo e 3 M
Gli anioni (come il solfuro) che formano con Ag+ sali meno solubili di AgClpossono danneggiare questo tipo di elettrodo Anche gli ossidanti e i riducenti fortie gli agenti complessanti possono interferire con la reazione di elettrodo per proteg-gere lrsquoelettrodo da queste sostanze si usa un elettrolita intermedio come nel casodellrsquoelettrodo a calomelano saturo (SCE gtparagrafo 32)
Gli elettrodi ad argentocloruro di argento sono usati come riferimento internonegli elettrodi a vetro (gtparagrafo 41)
32 Elettrodo a calomelano
laquoCalomelanoraquo egrave il nome comune del cloruro mercuroso (I) Hg2Cl2 che fa parteappunto di questo elettrodo (fig 29a) La rappresentazione convenzionale dellrsquoe-lettrodo egrave
Hg(l)|Hg2Cl2(s)|KCl(aq)
La reazione di elettrodo egrave
Hg2Cl2 + 2endash 2Hg + 2Clndash
e il potenziale di elettrodo in base alla legge di Nernst
In condizioni standard lrsquoattivitagrave di solidi e liquidi puri egrave considerata uguale a 1quindi
da cui
ndash 01984 10ndash3 T log|Clndash| (211)
Sono anche molto diffusigli elettrodi contenentiKCl 3 M cioegrave quasisaturi Il vantaggio egrave chein queste soluzioni non siformano cristalli di KClche possono danneggiarelrsquoelettrodo ostruendoil setto poroso che sta sulfondo
Figura 28Elettrodo ad AgAgCILa soluzione tamponeinterna contiene ioni K+
e CIndash ad attivitagrave costante
22
2 Potenziometria
Il potenziale dellrsquoelettrodo a calomelano dunque dipende solo dallrsquoattivitagrave delloione cloruro e dalla temperatura Se la temperatura egrave costante e lrsquoattivitagrave dello ionecloruro nella soluzione interna allrsquoelettrodo non varia il potenziale rimane costante
Gli elettrodi a calomelano piugrave comuni contengono soluzioni sature di KCl (circa42 M) e perciograve sono detti saturi (SCE Saturated Calomel Electrode) Si usano ancheelettrodi a KCl 1 M e 01 M la tabella 22 riporta il potenziale assunto da questielettrodi secondo la concentrazione di KCl
TABELLA 22 | Potenziale (mV) di alcuni elettrodi di riferimento a 25 degC
AgAgCl Calomelano HgHgO HgHgSO4 Thalamid
KCl 01 M 288 KCl 01 M 334 NaOH 01 M 165 H2SO4 05 M 682 KCl 3 M -567
KCl 1 M 235 KCl 1 M 280 NaOH 1 M 140 K2SO4 sat 650 KCl sat -577
KCl 3 M 210 KCl 35 M 250
KCl 35 M 205 KCl sat 241
KCl sat 199 NaCl sat 236
NaCl 3 M 209
NaCl sat 197
Lrsquoelettrodo a calomelano puograve essere usato fino a circa 70 degC a temperature piugrave alteil calomelano si dismuta (Hg2Cl2 Hg + HgCl2)
I solfuri gli ossidanti i forti riducenti e gli agenti complessanti che formanoamalgami con gli ioni Hg2
2+ possono danneggiare questo tipo di elettrodo Perciogravequando si lavora in presenza di queste sostanze si usano elettrodi a doppia giun-zione (fig 29b) in cui fra lrsquoelettrodo e la soluzione egrave interposto un contenitoreriempito con un elettrolita intermedio (per esempio KNO3)
Va infine segnalata la tendenza a non usare il mercurio per motivi tossicologicie questo spiega il progressivo abbandono nella pratica comune di questo tipo dielettrodo con grande rammarico dagli elettrochimici percheacute lrsquoelettrodo a calomela-no egrave il piugrave stabile
bullELETTRODI DI PRIMA E DI SECONDA SPECIE bullALTRI ELETTRODI DI RIFERIMENTO
APPROFONDIMENTI
Figura 29(a) Elettrodo a calomelano (b) Nella versione adoppia giunzione egrave presente una seconda cameraper lrsquoelettrolita intermedio che viene immessoattraverso la bocchetta laterale il setto porosoassicura il contatto elettrico con la soluzioneesterna
a b

22
2 Potenziometria
Il potenziale dellrsquoelettrodo a calomelano dunque dipende solo dallrsquoattivitagrave delloione cloruro e dalla temperatura Se la temperatura egrave costante e lrsquoattivitagrave dello ionecloruro nella soluzione interna allrsquoelettrodo non varia il potenziale rimane costante
Gli elettrodi a calomelano piugrave comuni contengono soluzioni sature di KCl (circa42 M) e perciograve sono detti saturi (SCE Saturated Calomel Electrode) Si usano ancheelettrodi a KCl 1 M e 01 M la tabella 22 riporta il potenziale assunto da questielettrodi secondo la concentrazione di KCl
TABELLA 22 | Potenziale (mV) di alcuni elettrodi di riferimento a 25 degC
AgAgCl Calomelano HgHgO HgHgSO4 Thalamid
KCl 01 M 288 KCl 01 M 334 NaOH 01 M 165 H2SO4 05 M 682 KCl 3 M -567
KCl 1 M 235 KCl 1 M 280 NaOH 1 M 140 K2SO4 sat 650 KCl sat -577
KCl 3 M 210 KCl 35 M 250
KCl 35 M 205 KCl sat 241
KCl sat 199 NaCl sat 236
NaCl 3 M 209
NaCl sat 197
Lrsquoelettrodo a calomelano puograve essere usato fino a circa 70 degC a temperature piugrave alteil calomelano si dismuta (Hg2Cl2 Hg + HgCl2)
I solfuri gli ossidanti i forti riducenti e gli agenti complessanti che formanoamalgami con gli ioni Hg2
2+ possono danneggiare questo tipo di elettrodo Perciogravequando si lavora in presenza di queste sostanze si usano elettrodi a doppia giun-zione (fig 29b) in cui fra lrsquoelettrodo e la soluzione egrave interposto un contenitoreriempito con un elettrolita intermedio (per esempio KNO3)
Va infine segnalata la tendenza a non usare il mercurio per motivi tossicologicie questo spiega il progressivo abbandono nella pratica comune di questo tipo dielettrodo con grande rammarico dagli elettrochimici percheacute lrsquoelettrodo a calomela-no egrave il piugrave stabile
bullELETTRODI DI PRIMA E DI SECONDA SPECIE bullALTRI ELETTRODI DI RIFERIMENTO
APPROFONDIMENTI
Figura 29(a) Elettrodo a calomelano (b) Nella versione adoppia giunzione egrave presente una seconda cameraper lrsquoelettrolita intermedio che viene immessoattraverso la bocchetta laterale il setto porosoassicura il contatto elettrico con la soluzioneesterna
a b