Lezione 2 Il modello atomico-planetario di Bohr
-
Upload
jin-garrison -
Category
Documents
-
view
44 -
download
0
description
Transcript of Lezione 2 Il modello atomico-planetario di Bohr

Lezione 2 Il modello atomico-planetario di Bohr

1a ipotesi di Bohr
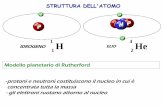
Esiste uno stato stazionario dell'atomo caratterizzato da particolari orbite circolari lungo le quali gli elettroni si muovono senza emettere radiazioni elettromagnetiche. Gli elettroni che percorrono tali orbite stazionarie possiedono una certa quantità ben definita di energia detta livello energetico dell'orbita

2
22
r
ek
r
mv
Forza centrifuga = attrazione elettrica
2
2
mv
ker







1 elettronvolt = 1eV =1,60·10-19 J
Energia di un quanto di luce (fotone), relazione di Plank : E = h·f
(nel vis. IR freq ~ 1·1015 hertz)E(J) = h·f = 6,626·10-34(J·s) · freq(Hz) E ~ 10-19
E(eV) = h·f = 4,141·10-15(eV·s) · freq(Hz) E ~ 1..10










22
1
2
11
mRH
22
111
mnRH

Nel 1855 J. Balmer, studiando le righe emesse dall'idrogeno, scoprì una relazione matematica che permetteva di ottenere il reciproco della lunghezza d'onda delle singole righe spettrali.con m = 3,4,5,6.... ed RH costante di Rydberg per l'idrogeno.
RH = 10973731,568
La relazione di Balmer può essere generalizzata sostituendo al numero 2 un intero n minore di m. In tal modo, è possibile prevedere per l'idrogeno l'esistenza, oltre alle 4 righe nel visibile ( una nel rosso, una nell'azzurro e due nel blu-violetto), anche altre serie, una nell'ultravioletto (serie di Lyman per n = 1) e 3 nell'infrarosso (serie di Paschen per n = 3; serie di Brackett per n = 4; serie di Pfund per n = 5), in seguito scoperte.
La spiegazione della relazione di Balmer venne dal modello planetario dell’atomo di Bohr e fu una delle sue principali apparenti conferme.
22
1
2
11
mRH
22
111
mnRH