LA MEMBRANA CELLULARE: IPOTESI DI DANIELLI E …users.unimi.it/monticy/dida/03.00 Membrane...
Transcript of LA MEMBRANA CELLULARE: IPOTESI DI DANIELLI E …users.unimi.it/monticy/dida/03.00 Membrane...
LA MEMBRANA CELLULARE: IPOTESI DI DANIELLI E DAVSON (1935)
poro polare
molecola lipidicamolecola proteica
PROTEINE DI MEMBRANA E TRASPORTI
diffusione trasporto attivotrasporto facilitato
proteina canale proteine trasportatrici
energia
UOVO DI ARBACIA
concentrazioni di Na e K intra- ed extracellulari
[Na+], [K +]; unità arbitrarie
acqua di mare
[K +] i
[K +]e
[Na+] i
[Na+]e
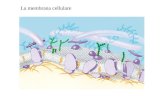
LA MEMBRANA CELLULARE COME BARRIERA
membrana
FASE 1composizione 1
FASE 2composizione 2
prodotti di rifiuto
materiale ossidabile
LIQUIDO INTERSTIZIALE
•pO2, pCO2
•concentrazione sostanze nutritizie•concentrazione prodotti di rifiuto•pH•pressione osmotica•concentrazione degli anioni•concentrazione dei cationi•volume dell’ambiente interno
Variano solo entrolimiti ristrettissimicompatibili con lavita.
“OMEOSTASI”
OSMOSI E PRESSIONE OSMOTICA
t0 t1 teq
h1
heq
H2O H2O H2O
H2O + saccarosio A
VP ⋅γ=eqhAV
1
⋅=
≅γ)(h
A
hA
AP
eqeq Π==
⋅⋅γ=⇒⇒⇒⇒
membrana
OSMOSI E FLUSSO OSMOTICO (H2O + soluto “s”; σs = 1)
membrana
capillare
capillare pistone
Cαααα >>>> Cββββ
Cαααα <<<< Cββββ
αααα ββββ
αααα ββββ
H2O
H2O
P V = n R T
nP = R T
Vn
c = V
= R T c
⋅ ⋅ ⋅
⋅ ⋅
Π ⋅ ⋅
LEGGE DI VAN’T HOFF
P: pressione,
V: volume,
n: numero di moli,
R: costante dei gas,
T: temperatura assoluta,
c: concentrazione,
Π: pressione osmotica.
OSMOLARITÀ
k = 1, 2……m
ck = c1, c2……cm
H2O
∑∑∑∑====
ΦΦΦΦ====m
kkkk cnOsmolarità
1
n = 1; saccarosio, glucosio etc.n = 2; NaCl, KCl, HCl etc.n = 3; MgCl2, Na2SO4 etc.
specie presenti
concentrazioni
OSMOLARITÀ DELLA SOLUZIONE FISIOLOGICA
H2O + NaCl
[NaCl] = 0,9% = 9 g/L
∑∑∑∑====
ΦΦΦΦ====m
kkkk cnOsmolarità
1
mOsm 45,28615493,02cnOsm NaClNaClNaClSF =⋅⋅=⋅Φ⋅=
mM 154]L[mol 154,0 ]mol[g 44,58
]L[g 9c
44,58PM
93,0
2n
1-1-
1-
NaCl
NaCl
NaCl
NaCl
=⋅=⋅⋅=
=
=Φ
=
METODI DI DETERMINAZIONE DELLA PRESSIONE OSMOTICA
1. metodo diretto,2. plasmolisi,3. abbassamento del punto di congelamento,4. tensione di vapore,5. composizione chimica.
ATTIVITÀ E COEFFICIENTI OSMOTICI
0,77930,77180,10
0,82200,81910,05
0,92830,92740,005
NaCl
f
KCl
fM⋅L-1
da R. Plonsey, D. G. Fleming “Bioelectric phenomena”
2
2i i
i
= R T a
a = f c
-log(f) = 0,509 z µ
µ = forza ionica della soluzione
1µ = c z
2
Π ⋅ ⋅⋅
⋅ ⋅
⋅ ⋅∑
dx
A
ααααctV
ββββc + dc
tV
IL CONCETTO DI FLUSSO
1 dnJ
A dt=
•flusso molare [M·h-1·cm-2]•flusso di calore•flusso di cariche = corrente
dx
A
ααααc
ββββc + dc
DIFFUSIONE – I legge di Fick
1 dnJ P c - P (c dc) -P dc
A dt= = ⋅ ⋅ + = ⋅
1 dn-
dcJ P dc
xA dt-D
d= ⋅ ⋅==
I legge di Fick
se dx↑↑↑↑ ⇒⇒⇒⇒ interazioni ↑↑↑↑ ⇒⇒⇒⇒ P ↓↓↓↓
DP
dx=
[P] = cm⋅s-1 [D] = cm2⋅s-1
Adolf Eugen Fickfisiologo tedesco, 1829 – 1901
DIFFUSIONE ATTRAVERSO LA MEMBRANA CELLULARE
α βc = c c∆ −
membrana cellulare
fase lipidica
fase αacquosa
fase βacquosa
∆x
cα
cβ
?
concentrazione del soluto nella fase lipidicaB =
concentrazione del soluto nella fase acquosa
α, βc = concentrazioni soluto nella membrana alle superfici limite∗
⇒⇒⇒⇒α α
β β
c = B c
c = B c
∗
∗
⋅
⋅ α β α βc = c c = B (c c )∗ ∗ ∗∆ − ⋅ −→→→→
αc∗
membrana cellulare
fase lipidica
fase αacquosa
fase βacquosa
α β α β
c D A BJ = -D A = - (c c ) = -k A (c c )
x x
∗∆ ⋅ ⋅⋅ ⋅ ⋅ − ⋅ ⋅ −∆ ∆
∆x
cα
cββc∗
D Bk = (costante di permeabilità)
x
⋅∆
cα, cβmisurabili
MISURA DEL COEFFICIENTE DI PERMEABILITÀ
EFFETTI DEL COEFFICIENTE DI RIPARTIZIONE
r < 1
r·(cα - cβ) < (cα – cβ)
r1 > 1
r1·(cα - cβ) > (cα – cβ)
ce
ci
FLUSSI UNIDIREZIONALI
e i e i e i i eJ = -k A (c c ) = -k A c k A c = J J→ →⋅ ⋅ − ⋅ ⋅ + ⋅ ⋅ +
m
ci
ce
Je→iJi→e
m
ce
ci
ce
ci
m m
= +
0
RAPPORTO SUPERFICIE/VOLUME
ie i
ii
ie i
ie i
dn=k A (c -c )
dtn
=cV1 dn A
=k (c -c )V dt Vdc A
=k (c -c )dt V
⋅ ⋅
⋅ ⋅ ⋅
⋅ ⋅
ce
ci = ni/V
V
A
la variazione di concentrazione all’interno della cellula dipende dal
rapporto superficie/volume⇒⇒⇒⇒
r = 1 cm A/V = 3 cm-1
r = 50 µm A/V = 600 cm-1⇒⇒⇒⇒ equilibrio raggiunto 200 volte prima
Lo scoiattolo artico assume la forma sfericaper ridurre “S/V” e quindi minimizzare ilflusso (la perdita) di calore.
Hannah Carey – Wisconsin University: in The Scientist 17(20): 27, 2003
tcorporea = 36÷÷÷÷37 °°°°C →→→→ tamb + 1÷÷÷÷2 °°°°C
fcardiaca = 200÷÷÷÷300/min →→→→ 3÷÷÷÷5/min
letargo
PERMEABILITÀ AGLI ZUCCHERI
Molecola glucidica:
1. grande importanza metabolica,
2. poco adatta ad attraversare le membrane lipidiche per
a) struttura,
b) numerosi gruppi –OH.
Esperimento:
eritrociti umani
cglucosio, e↑↑↑↑ →→→→ Pglucosio↓↓↓↓ ⇒⇒⇒⇒ trasporto legato al grado di saturazione del trasportatore
cglucosio, e↑↑↑↑
cglucosio, i
Jglucosio
cglucosio, e
Jglucosio
⇒⇒⇒⇒
CINETICA ENZIMATICA
PE ES SE31
2
KK
K+→⇔+
]ES[][E ]E[ o −=
K1, K2, K3: costanti di velocità di reazione
[Eo]: concentrazione totale dell’enzima,
[E]: concentrazione dell’enzima libero,
[ES]: concentrazione del complesso enzima – substrato.
[ES][S][E]
Km⋅=
Km: costante di dissociazione
(costante cinetica di pseudoequilibrio
di Michaelis)
Leonor Michaelis 1875 - 1949 Maud Menten 1879 - 1960
{ }]ES[
]S[]ES[][E
[ES][S][E]
K om
⋅−=⋅=
]S[K]S[][E
]ES[m
o
+⋅=
]ES[K v 3 ⋅=
]ES[][E ]E[ o −=
⇓⇓⇓⇓
La velocità della reazione che dà P è:
]S[K]S[][EK
vm
o3
+⋅⋅=⇒⇒⇒⇒
][EK V o3max ⋅=
]S[K]S[V
vm
max
+⋅=
Quando l’enzima è saturo: [ES] = [Eo]
]ES[K v 3 ⋅= ⇒⇒⇒⇒
]S[K]S[][EK
vm
o3
+⋅⋅= ⇒⇒⇒⇒
equazione di Michaelis-Menten
la velocità di una reazione enzimatica dipende solo da [S]
⇓⇓⇓⇓
v = f([S])
Vmax determinata sperimentalmente: ([S], v) ⇒ (calcolo) Km
Maud Menten 1879 - 1960
[S]
v
Vmax
]S[K]S[V
vm
max
+⋅=
maxmax
m
V1
]S[1
VK
v1 +⋅=
linearizzazione
⇓⇓⇓⇓
EQUAZIONE DI MICHAELIS-MENTEN
EQUAZIONE DEL TRASPORTO FACILITATO
PE ES SE31
2
KK
K+→⇔+
ES SE1
2
K
K⇔+ ES SE
1
2
K
K⇔+
CINETICA ENZIMATICA
+−
+⋅
∆⋅=
em
e
im
is ]S[K
]S[]S[K
]S[xCD
J
D: coefficiente di diffusione
del complesso ES
C: concentrazione dei
“siti attivi” (analogo di Eo)
x[ES]
D Js ∆∆⋅=
im
ie)(i s ]S[K
]S[Cx
D J
+⋅⋅
∆=→
em
ei)(e s ]S[K
]S[Cx
D- J
+⋅⋅
∆=→
{ }{ } { }emim
eimi)(e se)(i ss ]S[K]S[K
]S[]S[KxCD
JJ J+⋅+
−⋅∆⋅=+= →→
A B
BA [ES][ES] [ES] −=∆
im
ioA ]S[K
]S[][E ]ES[
+⋅=
em
eoB ]S[K
]S[][E ]ES[
+⋅=CINETICA ENZIMATICA
⇓⇓⇓⇓
+−
+⋅=
em
e
im
imaxs ]S[K
]S[]S[K
]S[J J
+−
+⋅
∆⋅=
em
e
im
is ]S[K
]S[]S[K
]S[xCD
J]ES[K v 3 ⋅=
Jmax
quando [ES] = [Eo] (enzima saturo)
v = Vmax
Jsv
P = D/∆xK3
TRASPORTO FACILITATOCINETICA ENZIMATICA
xCD
Jmax ∆⋅=
im
imaxs ]S[K
]S[J J
+⋅=
V = ∞t = 0, [S]e = 0
t ↑, [S]e = 0
Js
t = 0, [S]it ↑, [S]i ↓
⇓⇓⇓⇓
+−
+⋅=
em
e
im
imaxs ]S[K
]S[]S[K
]S[J J
]S[K]S[V
vm
max
+⋅=
eq. di Michaelis-Menten
equilibrio (Js = 0) solo quando [S]i = 0
⇓⇓⇓⇓
V = ∞[S]e = costante
Js t = 0, [S]i = 0
t ↑, [S]i ↑
⇓⇓⇓⇓
+−
+⋅=
em
e
im
imaxs ]S[K
]S[]S[K
]S[J J
equilibrio (Js = 0) solo quando [S]i = [S]e
tempo
[S]i[S]e
INIBITORI
competitivi non competitivi florentina (aglicone di florizina)
dinitrofluorobenzene
florizina composti a base di Hg vari narcotici
competitivi
⇓⇓⇓⇓Js ↓ o Js = 0
non competitivi
⇓⇓⇓⇓Js varia per interazioni
competizione fra molecole (S e inibitore) per il trasportatore
⇓
numero di siti attivi per S ↓ → Km varia
AUMENTO DI Js
l’inibitore può favorire il distacco
ES → E + S⇓⇓⇓⇓
Js ↑
• eritrociti umani: aumenta la fuoruscita di glucosio in presenza di mannosio
n. trasportatori ↑ (?)
• insulina → Jglucosio↑
affinità glucosio-trasportatore ↑ (?)
TRASPORTO FACILITATO - CONCLUSIONI
soluto trasportato barriera sede del trasporto K membrane lipidiche naturali membrane lipidiche artificiali glucosio membrana placentare barriera ematoencefalica membrana del globulo rosso Fe, vitamina B12 epitelio intestinale membrana del globulo rosso Ca orletto a spazzola delle cellule
• formazione e scissione del legame fra S ed E determinate da particolari caratteristiche:
chimiche, stereochimiche, fisiche;
• specifico (ma vi sono casi di trasportatori per più soluti);
effettiva traslocazione del complesso (se liposolubile); es. valinomicina + K+
• natura
trasportatore fisso → formazione di canale selettivo
∆∆∆∆P = Pαααα – Pββββ
faseαααα faseββββ
cαααα > cββββm
'OH 2
J
''OH 2
J
''OH
'OHOH 222
J-JJ =
filtrazione
osmosi
faseαααα faseββββ
cβ1β1β1β1
cβ2β2β2β2
….cββββn
m
i+AJ
i-BJ
cα1α1α1α1 ≠cα2α2α2α2 ≠….
cααααn ≠
++++ −−−−∆∆∆∆V
∆∆∆∆P
∆∆∆∆P
αααα ββββ
cαααα1……cααααm
M
cββββ1……cββββm
∆∆∆∆E
IL POTENZIALE ELETTROCHIMICO
j i
ii T,p,n
Gµ
n≠
∂= ∂ % ( ) ( )0
i i i i iµ µ T VP RTln c z FE= + + +% %
αi αii
i βi i βi
RT c A cE - ln ln
z F c z c= =
( )i i i∆µ RT∆ln c z F∆E= +%
IL POTENZIALE DI EQUILIBRIO
PINOCITOSI
vacuolo pinocitoticomembrana cellulare
fenditura
macromolecole disciolte 1
2
3
4
5
6
1 2
34
5 67 8