Immunità naturale Immunità acquisita (umorale, cellulare ... · IMMUNITA’ UMORALE Conta dei...
Transcript of Immunità naturale Immunità acquisita (umorale, cellulare ... · IMMUNITA’ UMORALE Conta dei...
La principale funzione del sistema immunitario è la protezione dell’organismo nei confronti di microrganismi patogeni.
L’attivazione del sistema immunitario avviene in 3 fasi:
- Riconoscimento
- Attivazione
- Effettrice
L’integrità del sistema è requisito essenziale per la stessa
sopravvivenza.
Alterazioni in una o più componenti di questo sistema
integrato di difesa possono portare a malattie gravi e spesso
fatali.
Tipi differenti di microrganismi stimolano risposte diverse e
differenti meccanismi effettori
Il danno tissutale e le malattie conseguenti possono essere causate
dalla risposta dell’ospite al microrganismo piuttosto che dal
microrganismo in sé.
Più in generale esistono malattie in cui il danno tissutale e le
alterazioni istopatologiche e funzionali sono causati da
meccanismi immunologici.
Malattie da deficit funzionale del sistema immunitario
Malattie da disregolazione del sistema immunitario
SISTEMA IMMUNITARIO
MALATTIE DA DEFICIT FUNZIONALE DEL SISTEMA IMMUNITARIO
Malattie da immunodeficienza
Congenite o primitive
Acquisite o secondarie
T linfociti B linfociti Combinate Frazioni complementari Deficit delle funzioni fagocitarie
IMMUNODEFICIENZE PRIMITIVE
IMMUNODEFICIENZE SECONDARIE A:
Malnutrizione
Malattie metaboliche
Endocrinopatie
Uremia
Malattie infettive
Perdita proteica e/o ipercatabolismo: Sindrome nefrosica Ustioni Enteropatie proteinodisperdenti Distrofia miotonica
Neoplasie maligne ed emopatie
Farmaci
Splenectomia anatomica e funzionale
MALATTIE DA DISREGOLAZIONE
Malattie allergiche (IgE mediate): Rinopatia Asma bronchiale Patologie allergiche gastroenterologiche Dermatite atopica Allergia al veleno di insetti Allergia a farmaci Orticaria-angioedema
Malattie del connettivo
Vasculiti
Crioglobulinemie
Malattie ematologiche
Malattie del sistema endocrino
Malattie del sistema nervoso
Malattie della cute
Malattie dell’occhio
Malattie cardiache
Malattie dell’apparato respiratorio
Malattie dell’apparato gastroenterico
Malattie del fegato
Malattie renali
Malattie degli organi della riproduzione
MALATTIE DA DISREGOLAZIONE
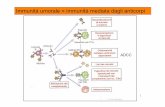
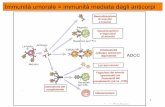
IMMUNITA’ UMORALE
Conta dei linfociti circolanti
Conta dei linfociti B circolanti ( CD19-CD20-Ig di membrana)
Dosaggio delle classi e sottoclassi delle Ig
Valutazione della produzione di anticorpi
Valutazione della produzione delle Ig sia spontanea che indotta
da attivatori policlonali (EBV, Proteina A stafilococco)
IgG1 IgG2 IgG3 IgG4
% IgG nel soggetto normale 64-70 23-28 4-7 3-4
Concentrazione sierica mg/dl 8,1 3,6 0,7 0,4
Peso molecolare delle catene γ 54.200 54.200 60.950 54.200
T ½ in giorni 21 21 7-8 21
Binding ai monociti si no si No
Reazione con proteina A stafilococco
si si no si
Fissazione del complemento si si si Via alternativa
Denominzione WHO
Catena pesante
Catena leggera Coefficiente sedimentazione
Peso molecolare
Concentrazione sierica
IgG1 gamma-1 Kappa o lambda 7S 150.000 2.0-10.0 g/l
IgG2 gamma-2 Kappa o lambda 7S 150.000 0.5-7.5 g/l
IgG3 gamma-3 Kappa o lambda 7S 170.000 0.05-0.9 g/l
IgG4 gamma-4 Kappa o lambda 7S 150.000 0.0-2.2 g/l
IgA1 alpha-1 Kappa o lambda 7S, 9S 160.000
IgA2 alpha-2 Kappa o lambda 7S, 9S 160.000 0,9-3,4 g/l
IgA secretorie alpha Kappa o lambda 11S 385.000
IgM mu Kappa o lambda !9S 970.000 0.5-2.0 g/l
IgD delta Kappa o lambda 7S 185.000 0.0-0.2 g/l
IgE epsilon Kappa o lambda (S 200.000 0.0-80 kU/l
Proprietà delle immunoglobuline
IgG IgA IgM Cordone 1112 (862-1434) Non dosabili 9 (5-14)
1-3 mesi 468 (231-947) 24 (8-74) 74 (26-210)
4-6 mesi 434 (222-846) 20 (6-60) 62 (28-139)
7-12 mesi 569 (351-919) 29 (10-85) 89 (38-204)
13-24 mesi 801 (264-1509) 54 (17-178) 128 (48-337)
2-3 anni 889 (462-1710) 68 (27-173) 126 (62-257)
4-5 anni 1117 (528-1959) 98 (37-257) 119 (49-292)
6-8 anni 1102 (633-1916) 113 (41-315) 121 (56-261)
9-11 anni 1164 (707-1919) 127 (60-270) 129 (61-276)
12-16 anni 1105 (640-1909) 136 (61-301) 132 (59-297)
Livelli di Immunoglobuline sieriche (mg/dl)
ALTERAZIONI QUANTITATIVE DELLE IMMUNOGLOBULINE SIERICHE IN ALCUNI QUADRI MORBOSI
N= valori normali
r= valori modicamente ridotti
R= valori marcatamente ridotti
i= lieve incremento
I= marcato incremento
A= completa assenza
La freccia indica l’ambito di variabilità per ogni malattia
Dosaggio quantitativo Immunoglobuline
1) Immunodiffusione radiale semplice: reazione di precipitazione tra antigene ed anticorpo nelle maglie di un mezzo gelificato (AGAR). Comparirà un anello di precipitazione il cui diametro è proporzionale alla concentrazione dell’antigene
2) Immunoprecipitazione (Nefelometria): la reazione di precipitazione avviene in mezzo fluido. L’intorbidamento conseguente può essere valutato mediante la dispersione o l’assorbimento di radiazioni luminose misurati su un dispositivo fotoelettrico di rilevamento. Le diverse intensità di reazione saranno funzione lineare della concentrazione dell’antigene.
3) Immunoenzimatica (ELISA): dosaggio Ig a bassa concentrazione (IgD, IgE)
4) Tests radioimmunologici (RIA): dosaggio Ig a bassa concentrazione (IgD, IgE)
IMMUNOGLOBULINE
Elettroforesi siero
Immunoelettroforesi
Immunofissazione
Caratterizzazione componenti monoclonali:
Elettroforesi urine: Proteinuria selettiva
Proteinuria non selettiva
Immunoelettroforei
Immunofissazione
Ricerca della proteinuria di Bence Jones
Immunità cellulo mediata
1) Conta dei linfociti circolanti
2) Conta dei linfociti T circolanti (CD3-CD4-CD8)
3) Studio ipersensibilità ritardata: • Tubercolina • Candida • Monilia • Trichophyton • Tetano • Difterite
4) Stimolazione in vitro: • Mitogeni • Antigeni • Superantigeni • Cellule allogeniche • Anticorpi verso strutture di membrana (CD3-CD2-CD43)
a) Espressione antigeni di attivazione (CD25-CD71-MHC II) b) Misurazione blastogenesi c) Rilascio mediatori (IL-2, IL-4, IL-5, γ-interferon)
ALTRE INDAGINI
Biopsia midollo (esclusione altre patologie)
Biopsia linfonodi
Biopsia rettale ed intestinale
Biopsia cutanea
Biopsia timo
Dosaggio ADA e/o PNP
α Feto proteina
Valutazione espressione MHC II
Autoimmunità: ANA, ENA, ANCA
Sviluppo del sistema immune
Immunoglobuline: alla nascita deficit di IgM-IgA
Immunità T cellulo mediata: normale alla nascita
Complemento: ridotto alla nascita. Normale a 6 mesi
Fagocitosi: ridotta nel periodo neonatale l’attività battericida dei
neutrofili
Immunodeficienze combinate
Immunodeficienze prevalentemente anticorpali
Sindromi ben definite con immunodeficeienza
Altre malattie da immunodeficienza primitiva
Malattie congenite o ereditarie associate con
immunodeficienza
Deficit delle frazioni complementari
Deficit delle funzioni fagocitarie
Differenziazione dei linfociti B in rapporto all’arresto maturativo osservato nelle diverse malattie.
IMMUNODEFICIENZE PRIMITIVE
IMMUNODEFICIENZE COMBINATE:
Immunodeficienza grave combinata legata al cromosoma X
Immunodeficienza grave combinata autosomica recessiva
Deficit di adenosin-deaminasi (ADA)
Deficit di purino-nucleoside fosforilasi (PNF)
Deficit degli antigeni MHC di classe II
Disgenesia reticolare
Immunodeficienza grave combinata da deficit di CD3γ o CD3ε
Immunodeficienza combinata da deficit di CD8
IMMUNODEFICIENZE CON DEFICIT PREVALENTEMENTE ANTICORPALE:
Agammaglobulinemia legata al sesso (sindrome di Bruton) Agammaglobulinemia autosomica recessiva Ipogammaglobulinemia legata al sesso con deficit di ormone somatotropo Deficit di immunoglobuline con IgM aumentate (sindrome iper.IgM) Delezioni dei geni delle catene pesanti Ig Deficit di catene κ Deficit selettivo di sottoclassi IgG (con o senza deficit di IgA) Deficit selettivo di anticorpi con immunoglobuline normali Immunodeficienza comune variabile Deficit di IgA Ipogammaglobulinemia transitoria dell’infanzia
SINDROME CON IMMUNODEFICIENZA BEN DEFINITA:
Sindrome di Wiskott-Aldrich
Atassia –teleangectasia (sindrome di Louis-Barr)
Sindrome di Di George
Sindrome di Nijmegen
Immunodeficienza con albinismo:
- Sindrome di Chediack-Higashi
- Sindrome di Griscelli
Sindrome proliferativa X-linked
ALTRE MALATTIE DA IMMUNODEFICIENZA PRIMITIVA:
Deficit primitivo di CD4
Deficit primitivo di CD7
Deficit di IL-2
Deficit di molteplici citochine
Deficit di trasduzione del segnale
ALTRE MALATTIE CONGENITE O EREDITARIE ASSOCIATE AD IMMUNODEFICIENZA
Instabilità cromosomica e deficit di riparazione del DNA: • Sindrome di Bloom • Anemia di Fanconi • Sindrome ICF ( immunodeficienza, instabilità centromerica, anomali facciali)
• Sindrome di Numegen • Sindrome di Seckel (nanismo a testa d’uccello)
• Xeloderma pigmentoso Difetti cromosomici:
• Sindrome di Down • Sindrome di Turner • Delezioni del cromosoma 18
Anomalie scheletriche: • Displasia scheletrica (nanismo) ad “arti corti” • Ipoplasia delle cartilagini e sistema pilifero (condrodisplasia metafisaria)
Immunodeficienze con ritardo della crescita generalizzato: • Displasia immunoossea di Schimke • Immunodeficienza con assenza di pollici, anosmia e ittiosi • Sindrome di Dubowitz • Progeria (sindrome di hutchinson-Gilford)
immunodeficienze associate ad alterazioni dermatologiche: • Immunodeficienza e albinismo parziale (sindrome di Griscelli) • Discheratosi congenita • Sindrome di Netherton • Sindrome di Papillon-Lefevre • Acrodermatite enteropatica
Deficitmetabolici ereditari: • Deficit di transcobalamina 2 • Metilmalonico acidemia • Oroticoaciduria ereditaria di tipo I • Deficit di carbossilasi biotino-dipendente • Mannosidosi •Glicogenosi • Sindrome di Chediak-Higashi
Ipercatabolismo delle immunoglobuline: • Ipercatabolismo familiare delle Ig • Linfangectasia intestinale
Altre forme: • Sindrome da iper-IgE • Candidosi mucocutanea cronica • Sindrome di Ivemark • Poliatresia intestinale familiare
DEFICIT DELLE FRAZIONI COMPLEMENTARI
DEFICIT DELLE FUNZIONI FAGOCITARIE
Malattia granulomatosa cronica
Deficit di adesione leucocitaria:
• Tipo I
• Tipo II
Deficit di glucosio-6-fosfato deidrogenasi dei neutrofili
Deficit di mieloperossidasi
Deficit della formazione dei granuli secondari
Sindrome di Schwachman
Gruppo eterogeneo di sindromi determinate da differenti lesioni genetiche che causano anomalie della differenziazione e/o della funzione siadei linfociti T che dei linfociti B. Sono note con la sigla inglese SCID o Severe Immune Deficiency Combined. Sono difetti monogenici, ognuno dei quali è causato dalla carenza totale o parziale di una fra le tante molecole che intervengono nella traduzione del segnale da recettori di membrana all’ambiente intracellulare. Fra le più note sono la X-SCID o SCID-XL, trasmessa come carattere legato al sesso; la SCID da deficit di Jak3 e quelle da deficit di ZAP-70; da deficit di Adenosina Deaminasi e Purin-Nucleoside Fosforilasi, la sindrome di Wiskott-Aldrich. Nonostante siano in gioco un numero elevato di lesini molecolari, le SCID si manifestano tutte con infezioni gravi e ricorrenti fina dalle prime settimane di vita, diarrea cronica, ritardo di accrescimento.
LE IMMUNODEFICIENZE PRIMITIVE COMBINATE
SEVERE COMBINED IMMUNODEFICIENCY (SCID)
È un acronimo usato per descrivere un insieme di
difetti genici sia dell’immunità umorale che cellulare
che hanno una presentazione clinica precoce e, se non
trattate, portano a morte sicura nei primi anni (se non
mesi) di vita.
SEVERE COMBINED IMMUNODEFICIENCY (SCID)
Almeno 20 geni difettivi sono stati associati con
SCIDs. I pazienti sono classificati secondo la
specifica mutazione presente, il fenotipo linfocitario
associato, i meccanismi ereditario.
Immunodeficienza grave combinata legata al
cromosoma X
Immunodeficienza grave combinata autosomica
recessiva
SEVERE COMBINED IMMUNODEFICIENCY (SCID)
SEVERE COMBINED IMMUNODEFICIENCY (SCID)
Quadro clinico assai severo di abnorme suscettibilità
a infezioni:
Virali
Batteriche
Protozoarie
Funginiche
SEVERE COMBINED IMMUNODEFICIENCY (SCID)
Grave difetto quantitativo e funzionale dei linfociti T
Deficit anticorpale associato
SEVERE COMBINED IMMUNODEFICIENCY (SCID)
Sintomatologia
Candidiasi orale
Diarrea intrattabile
Infezioni polmonari (pneumococco, CMV, morbillo)
Infezioni letali da Herpes virus
SEVERE COMBINED IMMUNODEFICIENCY (SCID)
La diarrea determina:
Malassorbimento
Arresto della crescita
Il trattamento prevede la nutrizione parenterale totale
SEVERE COMBINED IMMUNODEFICIENCY (SCID)
DIAGNOSI
Deve essere precocissima
Agammaglobulinemia
Deficit numerico dei linfociti T maturi (alcuni T immaturi)
PRENATALE
Assenza linfociti T nel sangue del cordone ombelicale
Assenza linfociti B nel sangue del cordone ombelicale
SEVERE COMBINED IMMUNODEFICIENCY (SCID)
TERAPIA
Camere sterili
Profilassi per Pneumocystis Carini
Trattamento vigoroso con antibiotici, antivirali, antifungini
Gammaglobuline a dosaggi elevati
Trapianto di midollo osseo (attenzione alla GVHD)
Trasfusioni: evitare se non irradiate
DEFICIT DI ADENOSIN-DEAMINASI (ADA)
Autosomica recessiva: 20q13
Deficit ADA
Adenosina Inosina ADA
Accumulo di metaboliti tossici per linfociti (maggiore per i T)
Blocco sintesi del DNA
DEFICIT DI ADENOSIN-DEAMINASI (ADA)
Esordio più tardivo
Linfociti T e B diminuiscono progressivamente
Sintomatologia clinica identica
Alterazioni osteocartilaginee a carico di coste, vertebre e pelvi
DEFICIT DI ADENOSIN-DEAMINASI (ADA)
DIAGNOSI
Anche prenatale (villi coriali)
Dosaggio ADA (linfociti e eritrociti)
Aumento urinario di adenosina desossiadenosina
DEFICIT DI PURINO-NUCLEOSIDE FOSFORILASI (PNF)
Autosomica recessiva: 14q13
INOSINA IPOXANTINA
GUANOSINA GUANINA
ACCUMULO METABOLITI TOSSICI
DIMINUZIONE PROGRESSIVA LINFOCITI T
DEFICIT DI PURINO-NUCLEOSIDE FOSFORILASI (PNF)
Esordio variabile: entro i 7 anni
SINTOMATOLOGIA
Infezioni respiratorie ricorrenti: CMV, Varicella
Anemie megaloblastiche
1/3 Anemie emolitiche autoimmuni
2/3 alterazioni neurologiche
AGAMMAGLOBULINEMIA CONGENITA X-
RECESSIVA (MALATTIA DI BRUTON)
X-recessiva: q21.3-q22
Maschi 1: 100.000
I anno di vita
Deficit di btk (Bruton tirosyne kinasi)
Assenza di Immunoglobuline: IgG< 200 mg/dl
Assenza di linfociti B circolanti
Assenza dei follicoli germinativi
Assenza di plasmacellule
normale numero di linfociti pre-B midollari
SINTOMATOLOGIA Infezioni respiratorie Otiti Meningiti Osteomieliti Sepsi: stafiloccocchi, pneumococchi, haemophilus influenza Accrescimento stentato Broncopatia cronica Assenza di linfoadenomegalia, splenomegalia, tonsille, adenoidi
Decorso regolare (agenti infettivi intracellulari: morbillo, varicella, parotite, rosolia)
DIAGNOSI
IgG< 200 mg/dl
IgM, IgA, IgE, IgD indosabili
Biopsia linfonodale dopo stimolazione
Midollo osseo: pro-B
Sangue periferico: assenza di linfociti B (CD 19+)
Compartimento T Normale
Identificazione della mutazione del gene btk
CRITERI DIAGNOSTICI
• Pazienti maschi con meno del 2% di linfociti B CD19
e
• almeno 1 dei seguenti criteri:
• mutazione del gene BTK
• assenza di m-RNA per BTK nei monociti e/o nei neutrofili
• assenza della proteina BTK nei monociti o nelle piastrine
• cugino, zio o nipote (materni) con meno del 2% dei linfociti B CD19+
COMPLICANZE DELL’AGAMMAGLOBULINEMIA X-LINKED
Encefalite da virus ECHO: convulsioni, atassia, decadimento mentale, riduzione visus e udito, contratture ed edema ligneo
Artriti settiche
Artriti asettiche
Giardiasi intestinale
Osteopatia ipertrofizzante pneumica
NO VACCINAZIONI
TERAPIA SOSTITUTIVA Somministrazione di Ig per via endovenosa
400-500 mg/Kg/mese
Dosaggio IgG sieriche deve essere superiore a 600 mg/dl
Soprattutto IgG1 e IgG2
Complicanze della somministrazione di Ig: • dispnea • collasso • dolori addominali • ipotensione • febbre • rash cutanei
In caso di reazione sospendere l’infusione e somministrare antistaminici e cortisonici per via e.v.
Più frequentemente per la presenza di aggregati che ad anticorpi anti IgA
La presentazione clinica è simile, ma le infezioni sono più severe e si presentano più precocemente
E’ dovuta a un difetto della catena μ (più frequente) o del surrogato della catena λ5
La mutazione del gene btk dà un arresto maturativo parziale, mentre il difetto della catena μ risulta in un completo blocco maturativo
AGAMMAGLOBULINEMIA AUTOSOMICA RECESSIVA
IPOGAMMAGLOBULINEMIA CON IgM AUMENTATE (SINDROME IPER IgM)
X-recessiva: deficit CD40 ligando (CD 154)
Autosomica recessiva: deficit CD40, deficit di citidina deaminasi
IPOGAMMAGLOBULINEMIA CON IgM AUMENTATE (SINDROME IPER IgM)
I-II anno di vita
Infezioni piogeniche ricorrenti: Orecchio medio
Polmone
Bocca (stomatiti ulcerativa se neutropenia)
Associazione con malattie immuno-mediate Anemia emolitica
Piastrinopenia
Artriti
Nefriti
IPOGAMMAGLOBULINEMIA CON IgM AUMENTATE (SINDROME IPER IgM)
IgM – IgD normali o elvate
IgG – IgA – IgE diminuite o assenti
Linfociti B normali per numero ma anomali (solo IgM – IgD di membrana)
Poche plasmacellule
IPOGAMMAGLOBULINEMIA CON IgM AUMENTATE (SINDROME IPER IgM)
Ipertrofia tonsillare
Linfoadenomegalia laterocervicale
Splenomegalia
Risposte anticorpali IgM ristrette
Mancato switch IgM IgG
IPOGAMMAGLOBULINEMIA CON IgM AUMENTATE (SINDROME IPER IgM)
TERAPIA
Sostitutiva
Sintomatica
Trapianto di midollo osseo: in caso di neutropenia
DEFICIT SELETTIVO DI IGA
1: 600-7000
Sporadico
Ereditarietà: autosomica recessiva, autosomica dominante
Delezione dei geni strutturali
Difetto di maurazione dei linfociti B, i linfocii T sono normali
SINTOMATOLOGIA NEL DEFICIT SELETTIVO DI IgA
Asintomatici
Esordio, frequenza e gravità delle infezioni sono variabili
Infezioni vie respiratorie superiori ed inferiori
Infezioni enteriche (giardia Lamblia)
Malattie associate: • Enteropatie non infettive: morbo celiaco, iperplasia intestinale nodulare, anemia perniciosa • Tiroiditi autoimmuni • Epatite cronica attiva • Diabete giovanile • Neoplasie (1-4%) • Allergopatie (asma) • Secondario a terapie anticonvulsivanti
DIAGNOSI DEL DEFICIT SELETTIVO DI IgA
Dosaggio delle IgA sieriche (<5 mg/dl)
Dosaggio delle IgA secretorie (<0,5 mg/dl)
Altre Ig normali
Autoanticorpi: anti IgA nel 40%
Prognosi buona se difetto isolato
Variabile se malattie associate
Malattie autoimmuni, neoplasie, enteropatie: normale risposta alla terapia
Allergopatie (asma): minore risposta
50% dei soggetti può normalizzarsi
TERAPIA
No terapia sostitutiva
No trasfusioni o infusione di emoderivati
Terapia antibiotica
Terapia delle malattie associate
Vaccinazioni:
• normale calendario
• antipolio (SALK)
• pertosse
• influenza
IMMUNODEFICIENZA COMUNE VARIABILE
Nota anche come ipogammaglobulinemia ad esordio tardivo
La più frequente dopo il deficit di IgA
Gruppo eterogeneo:
• Ereditarietà varia: sporadica, autosomica recessiva, autosomica dominante
• difetto: prevalentemente a carico dei B, prevalentemente a carico dei T
Esordio variabile: 15-40 anni
SINTOMATOLOGIA
Infezioni ricorrenti apparato respiratorio: Haemophilus infl, pneumococchi
Infezioni intestinali: Giardia Lamblia
Poliartriti settiche e non
Spesso malattie autoimmuni:
• anemia emolitica
• granulocitopenia autoimmune
• vitiligine
• artrite reumatoide
Presenti spesso: epatosplenomegalia e linfoadenomegalia
DIAGNOSI
IgG ridotte
IgA ridotte , a volte normali
IgM ridotte, a volte normali
IgA secretorie: presenti o assenti
Linfociti B circolanti sempre presenti
Linfonodi: ipoplasia aree B-dipendenti, iperplasia
Diagnosi differenziale con agammaglobulinemia
TERAPIA
Sostitutiva
Antibiotica
Ginnastica respiratoria
Rischio elevato di neoplasie:
• Carcinoma gastrico: + 50
• Linfomi non Hodgkin: + 20
IMMUNODEFICIENZA CON ATASSIA-TELEANGECTASIA (SINDROME DI LOUIS BARR)
Autosomica recessiva: 11 q23
Abnorme fragilità cromosomica: difetto degli enzimi di riparazione del DNA
2-3/100.000
Difetto di differenziazione T: timo atrofico, assenza o scarsa differenziazione cortico-midollare
Atassia, teleangectasie, abnorme suscettibilità alle infezioni
Esordisce con difficoltà alla deambulazione
Dopo atassia, disartria, assenza deambulazione entro i 10 anni
III-VI anno comparsa di teleangectasie
V-VI anno aumentata suscettibilità alle infezioni (virali e batteriche)
Atassia: degenerazione diffusa e progressiva della corteccia cerebellare, corna posteriore del midollo
Ritardo dell’accrescimento e della pubertà: lesioni degenerative dell’ipofisi, testicoli, ovaie
Neoplasie
Diagnosi: IgG diminuite, IgM aumentate
Linfopenia
Aumentata frequenza cromosoma 7-14
Progressivo deficit T
Elevati livelli di α Feto proteina
TRATTAMENTO
Nessun trattamento per arrestare il deficit del sistema nervoso centrale
Evitare esposizione a radiazioni
No vaccinazioni con virus vivi attenuati
Terapia sostitutiva con Ig (attenzione anti IgA)
terapia antibiotica
Fisioterapia respiratoria
Exitus 30-40 anni ma importanti handicap motori e mentali
SINDROME DI DI GEORGE ( SINDROME DELLA 3-4 TASCA BRANCHIALE)
22 q11
Ipoplasia o aplasia timica
Ipoplasia paratiroidi
Anomalie dei grandi vasi
Dismorfie facciali
V-VI settimana: Timo (III-IV tasca)
IV-VI settimana: paratiroidi (III tasca)
IV-VI settimana: Labbra, padiglioni auricolari (I-II tasca)
IV-VI settimana: arterie polmonari (VI tasca)
Alcolismo?
CATCH 22
Esordio: nelle prime ore di vita tetania
Neonati con aspetto caratteristico: micrognazia, padiglioni con attacco basso, taglio antimongolico, bocca di pesce, ipertelorismo
Anomalie Cardiovascolari: • destroversione arco aortico • stenosi polmonare • tetralogia di fallot • comunicazione interatriale • comunicazione interventricolare • atresia polmonare
Exitus prime settimane per tetania o malformazioni cardiovascolari
Infezioni in caso di sopravvivenza: broncopolmonite da P. carinii, candidiasi, diarrea ingravescente, etc
TERAPIA
Antitetanica: calcio, D3
Chirurgica
Trapianto di timo se assente
Ormoni timici se ipoplasico
No vaccinazioni con virus attenuati
Sangue ed emoderivati irradiati
SINDROME DI WISKOTT-ALDRICH
X-recessiva: X p11
Carenza di WASP: funzione ancora in parte sconosciuta. Sembra coinvolta nei segnali di trasduzione per la riorganizzazione del citoscheletro
Triade sintomatologica: • Trombocitopenia • Immunodeficienza • DA
Sintomi gastroenterici: melena, ematemesi
Ematuria
Infezioni: batteriche, virali, agenti opportunistici
Decadimento progressivo dei linfociti T
Prognosi infausta (circa 6 anni)
Exitus:
• Infezioni: 60%
• Emorragiee 5%
• Tumori 5%
Neoplasie e linfomi: 100 volte più frequenti
TERAPIE
Trapianto Di Midollo
Splenectomia
Trasfusione
Trattamento Infezioni
Somministrazione Di Ig
Trattamento Disordini Gastrointestinali
FUNZIONE DELLE CELLULE NK Difesa antineoplastica:
• Inibizione dello sviluppo dei tumori primitivi • Controllo delle metastasi
Controllo delle infezioni: • virali (CMV, Influenza, Herpes) • Parassitarie (intra ed extracellulari) • Fungine • Batteriche
Capacità immunoregolatorie: • regiolazione della risposta anticorpale • modulazione dell’immunita cellulo-mediata • funzione di cellule soppressorie naturali
Produzione di linfochine Regolazione della crescita e differenzizione delle cellule emopoietiche Coinvolgimento nel rigetto di allotrapianti: midollo osseo e organi Meccanismo patogenetico nello sviluppo di:
• GVHD • anemia aplastica/neutropeni • Malattie autoimmuni e neurologiche • alcune forme di diabete • malattie gastrointestinali
Valutazione numerica: CD 16, CD56, CD57 (10 % circa dei
linfociti circolanti)
Valutazione funzionale: citotossicità spontanea verso linea
cellulare K562
INDAGINI DI LABORATORIO PER VALUTARE NK
MALATTIA DI CHEDIAK-HIGASHI
- Autosomica Recessiva - Deficit Lyst - Albinismo oculo-cutaneo parziale - Fotofobia - Alterazione visus - Elevata incidenza di infezioni cutanee e respiratorie - Neutropenia - Alterata mobilità granulociti e monociti - Difetto di attività NK e CTL - Lisosomi giganti - Exitus entro 10 anni - Ig sieriche normali, Linfociti B e T normali - Terapia: trapianto di midollo
SINDROME DI GRISCELLI
- Autosomica recessiva
- Deficit miosina 5°
- Ig sieriche, linfociti T e B normali
- Albinismo
- Ridotta attività NK e CTL
- Progressiva encefalopatia nei casi più gravi
DEFICIT EREDITARI DEI FAGOCITI
Malattia Test diagnostici Principali caratteristiche cliniche
Malattia granulomatosa cronica (X p21)
NBT (nitroblu di tetrazolio) Esordio precoce, epatosplenomegalia, ascessi (polmonari, ossa, fegato,cute)
Deficit di mieloperossidasi NBT, citochimica dei PMN Uguale alla MGC
Deficit di G-6-PD NBT, dosaggio G-6-PD leucocitaria
Uguale alla MGC, esordio più tardivo, maschi e femmine, anemia emolitica
Sindrome di Chediak-Higashi
Difetto di killing e di attività NK, inclusioni leucocitarie
Albinismo parziale, anomalie del SN, linfomi, infez. batteriche
Deficit di LFA1 Assenza di CD18 sui linfociti, difetto di adesione
Anormalità dei linfociti, ritardata caduta del cordone ombelicale, infez. varie
COME AVVIENE L’ELIMINAZIONE (KILLING) DEI MICRORGANISMI?
Una volta raggiunto il focolaio infiammatorio i fagociti svolgono la loro azione antimicrobica attraverso l’ingestione (“fagocitosi”) e l’eliminazione intracellulare (“killing”) dei microrganismi responsabili dell’infezione. L’attività microbicida dei fagociti è essenzialmente legata alla capacità della cellula di produrre molecole - come lo ione superossido (02-), perossido di idrogeno (H202) ed ipoclorito (HOC1-) che danneggiano la membrana del battere fagocitato, provocandone la morte. Il processo metabolico che porta alla formazione di questi prodotti reattivi dell’ossigeno è definito “burst respiratorio”. Un ruolo essenziale nella produzione dello ione superossido è svolto da un particolare enzima, la nicotinamide-adenina-dinucleotide-fosfato- ossidasi (NADPH-ossidasi). Questo enzima serve al trasporto degli elettroni che, nel corso della attivazione metabolica del fagocita, porta alla riduzione dell’ossigeno molecolare (02) a ione superossido (02-).
Il complesso molecolare NADPH-ossidasi è costituito da 4 subunità proteiche:
- due molecole, la p22 e la gp91 phox, sono localizzate nella
membrana cellulare e insieme costituiscono il complesso
denominato citocromo b 558;
- le altre due molecole, la p47 e la p67, si trovano all’interno
della cellula, nel citoplasma. L’attivazione cellulare induce il
passaggio di queste molecole, dal citoplasma alla membrana, e il
loro assemblaggio a formare il complesso enzimatico capace di
svolgere la piena attività ossidasica.
MALATTIA GRANULOMATOSA CRONICA
X-linked:
Deficit della catena di 91KD del citocromo b
Primi mesi di vita
Autosomica recessiva:
Deficit della catena di 22 KD del citocromo b
Deficit delle proteine citosoliche p47 o p67
2 anni di vita
CLASSIFICAZIONE DELLA MALATTIA GRANULOMATOSA CRONICA
* La soprascritta indica che la proteina viene espressa in quantità normale (+), ridotta (-) o è assente (0) X: trasmissione X recessiva AR: trasmissione autosomico recessiva
MALATTIA GRANULOMATOSA CRONICA
Difetto di attività battericida
Cellule interessate: Neutrofili, monociti-macrofagi
Gravi infezioni da germi aerobi che portano a una progressiva
disseminazione cutanea, polmonare, linfonodale, epatica di lesioni
granulomatose multiple
La diffusione dell’infezione è facilitata dal fatto che i leucociti,
che hanno fagocitato ma non ucciso i microrganismi nella sede
dell’infezione primitiva, possono di fatto trasportarla a distanza.
MALATTIA GRANULOMATOSA CRONICA
Il difetto è nella diminuita attività di NADPH che è
responsabile della produzione di superossido e acqua
ossigenata che a loro volta attivano le elastasi e la catepsina
G veri effettori dell’attività battericida
MALATTIA GRANULOMATOSA CRONICA
SINTOMATOLOGIA
Infezioni cutanee
Epatosplenomegalia
Precoce compromissione polmonare
Diarrea persistente
Sepsi
Meningiti
Osteomieliti
CARATTERISTICHE PECULIARI DELLE INFEZIONI NEI PAZIENTI CON CGD
Infezioni recidivanti Evoluzione granulomatosa delle lesioni infiammatorie
I granulomi, costituiti da cellule giganti e macrofagi ripieni di
lipidi, provocano distruzione dei parenchimi e determinano
frequentemente ostruzione meccanica del tratto gastrointestinale
ed urinario con conseguente necessità di drenaggio o di
rimozione chirurgica.
I microrganismi patogeni più frequentemente in causa sono rappresentati da:
Funghi: Aspergillus fumigatus e Candida
Batteri catalasi positivi: Staphylococcus aureus, Salmonella,
Pseudomonas, etc. L’enzima catalasi, infatti, consente ai batteri
che lo producono di inattivare l’H202
I primi sintomi della malattia compaiono generalmente nei
primi due anni di vita; la CGD autosomica recessiva è spesso
meno grave rispetto alla forma X-recessiva e può restare
misconosciuta fino alla tarda infanzia o all’adolescenza.
Alcuni segnali di allarme dovrebbero essere ben conosciuti dal
pediatra curante e far sorgere il sospetto diagnostico di una
CGD
Campanelli d’allarme che devono far pensare ad una MGC Infezione da Aspergillo a qualsiasi età
Infezione da Serratia a qualsiasi età
Osteomielite
Linfadenite da Stafi lococco
Ascesso epatico
Colite granulomatosa
Ostruzione delle vie aeree e/o digestive e/o urinarie da flogosi
granulomatosa
Diagnosi
Deficit del burst respiratorio dei granulociti neutrofili mediante il test di colorazione con il nitroblu di tetrazolio (NBT test), che misura la produzione di superossido da partedei fagociti stimolati. Questo test è in grado di identifi care i soggetti affetti (sia nel caso della forma X-recessiva sia delle varianti autosomico recessive) e le portatrici della forma X-linked; non consente invece di individuare i portatori della CGD autosomica recessiva e i pazienti affetti dalla forma X 91- , avendo questi ultimi una attività NADPH-ossidasica residua sufficiente per una normale riduzione del NBT. In questi casi sono necessarie indagini di conferma mediante test quantitativi di misurazione dell’attività del burst respiratorio o di identificazione delle subunità proteiche dell’enzima.
L’analisi di mutazione del gene consente attualmente di porre diagnosi di certezza e di eseguire diagnosi prenatale fin dalla decima settimana di gestazione mediante l’analisi del DNA sui villi coriali, in quei casi in cui sia stata già identifi cata la mutazione in un altro membro affetto della famiglia.
LEUCOCYTE ADHESION DEFICIENCY (LAD)
L’adesione dei leucociti all’endotelio, ad altri leucociti, e ai batteri è critica per la funzione dei leucociti: muoversi, comunicare, combattere l’infezione.
Differenti famiglie di molecole di adesione mediano i processi di rotolamento (rolling), adesione, diapedesi. Le proteine più importanti in questi processi sono: integrine e selectine
Chemiotassi: migrazione dei neutrofili attraverso
membrane porose
Adesione: CD18
Fagocitosi: Latex, microrganismi, eritrociti opsonizzati
Killing: test al nitroblu di tetrazolio
LEUCOCYTE ADHESION DEFICIENCY TYPE 1 (LAD-1)
È un disordine AR causato da una mutazione della catena comune
β2 delle integrine (CD18) dell’LFA1, Mac 1, p150
Cellule interessate: Neutrofili, monociti-macrofagi, linfociti, NK
Funzioni alterate: chemiotassi, adesione, rolling
PAZIENTI CON FENOTIPO SEVERO
Ritardata caduta del cordone ombelicale (> 30 giorni)
Leucocitosi (> 15.000)
Severe gengiviti e periodontiti (riassorbimento osseo alveolare)
Infezioni severe: vie respiratorie, cute, perirettali
Scarsa risoluzione delle ferite con cicatrici sottili a “carta di sigaretta”
Infiammazione lieve
Assenza di neutrofili nel focolaio
Morte in circa 10 anni nei casi più gravi
Sopravvivenza fino a 40 anni nei casi con CD18
di circa il 10% della norma
LEUCOCYTE ADHESION DEFICIENCY TYPE 2 (LAD-2)
Deficit di focusilazione dei carboidrati: incapacità a convertire GDP mannosio in fucosio
Autosomica recessiva
Cellule interessate: neutrofili, monociti-macrofagi
Impossibilità di interazione con P-selectine e E-selectine sulle cellule endoteliali
Funzioni compromesse: chemiotassi, rolling
LEUCOCYTE ADHESION DEFICIENCY TYPE 2 (LAD-2)
Ritardo di crescita
Deficit neurologici
Leucocitosi
Ulcere croniche della cute
Periodontiti
COMPLEMENTO Costituito da almeno 25 proteine: componenti del complemento, proteine regolatrici, recettori di membrane cellulari
Via classica: studiata mediante CH50
Via alternativa: studiata mediante AH50
Via Lectine
Dosaggio emolitico del complemento totale e/o dei suoi componenti: si utilizza la capacità del complemento di lisare cellule e permette di valutare la più piccola quantità di siero in grado di lisare il 50% di una determinata quantità di emazie sensibilizzate
Dosaggio immunochimico: immunodiffusione radiale semplice, nefelometria
C3: 52-175 mg/dl
C4: 20,5-43,9 mg/dl
C1 INH: 15,4-33,8 mg/dl
FRAZIONI DEL COMPLEMENTO DOSATE DI ROUTINE
Deficienze complementari sono state documentate per quasi tutte le componenti conosciute inclusi i recettori e le proteine di controllo. I deficit del complemento si manifestano con :
- Infezioni lievi o severe ricorrenti
- Aumentata incidenza di disordini autoimmuni
- Edemi ricorrenti
- Orticaria
- Sindromi vasculitiche
DEFICIT EREDITARI DELLA CASCATA COMPLEMENTARE
Deficit di C1q, C1r, C1s C2, C4, C5:
- Sindrome lupus-like
- Glomerulonefrite (C1q e C2)
- Lupus discoide, artrite reumatoide (C2)
C6, C7, C8: Infezioni ricorrenti da Neisserie
Properdina, Fattore D, Fattore I: Infezioni piogeniche ricorrenti
Fattore H: Glomerulonefriti
C1 inibitore: Edema angioneurotico ereditario
Deficit Eredità Cromosoma Sintomatologia C1q AR 1 Lupus-like, infezioni, malattia reumatoide C1r AR 12 Lupus-like, infezioni, malattia reumatoide C4 AR 6 Lupus-like, infezioni, malattia reumatoide C2 AR 6 Lupus-like, vasculiti, infezioni da piogeni C3 AR 19 Infezioni ricorrenti da piogeni C5 AR 9 Infezioni da Neisserie, LES C6 AR 5 Infezioni da Neisserie, LES C7 AR 5 Infezioni da Neisserie, LES, vasculiti C8α AR 1 Infezioni da Neisserie, LES C8β AR 1 Infezioni da Neisserie, LES C9 AR 5 Infezioni da Neisserie C1 Inibitore AD 11 Angioedema ereditario Fattore I AR 4 Infezioni ricorrenti da piogeni Fattore H AR 1 Infezioni ricorrenti da piogeni Fattore D AR 19 Infezioni da Neisserie Properdina XL X Infezioni da Neisserie
IPOCOMPLEMENTEMIE ACQUISITE Via classica:
- Da immunocomplessi circolanti: • Malattia da siero • Glomerulonefrite post-streptococcica • Glomerulonefrite membranoproliferativa (tipo I) • LES • Crioglobulinemia mista • Shunts atrioventricolari infetti • Epatite virale (fase prodromica) • Endocarditi • Rigetto di trapianto
- Più raramente: • Artrite reumatoide • Sindrome di Sjogren • Miastenia grave • Tiroidite di Hashimoto • Mielomi, linfomi • Infezioni acute virali • Anemia emolitica autoimmune
- Ipocomplementemia da deficit di sintesi: • Denutrizione
• Malnutrizione
• Cachessia
• Insufficienza epatica
- Ipocomplementemia da perdita proteica: • Ustioni estese
• Diarrea profusa
• Sindrome nefrosica
1) Bambini di famiglie con ID ereditarie
2) Bambini con un fratello o una sorella con ID accertata o presunta
3) Bambini con sindromi o altre malattie associate con ID
4) Bambini con: • Difetti di sviluppo • Inusuali infezioni persistenti (agenti a bassa virulenza o opportunistici) • Rash cutanei inusuali • Diarrea persistente
5) Pazienti con infezioni persistenti che non rispondono come di norma alla antibiotico-terapia
6) Pazienti con: • Infezioni cutanee persistenti • Ascessi • Periodontiti • Piaghe cutanee inusuali non cicatrizzanti
7) Pazienti con: • Ricorrenti infezioni da neisserie • LES
IMMUNODEFICIENZE PRIMITIVE NEGLI ADULTI
a) Disordini nei quali è comune un inizio in età adulta: ICV: I decade, III decade Deficit di IgA Deficit sottoclassi IgG Deficit complementari (C2)
b) Ritardata presentazione di disordini tipici dei bambini: ADA WAPS Agammaglobulinemia (X-Linked)
c) Disordini con inizio infantile e sopravvivenza da adulti SCID Deficit di ADA Malattia granulomatosa cronica Agammaglobulinemia