Il ceppo influenzale più mortale della storia killer
Transcript of Il ceppo influenzale più mortale della storia killer

Il ceppo influenzale più mortale della storia
è stato resuscitato. Il virus della Snagnola può
rivelarci perché ha ucciso mil
e dove si nascondono altri kil
ioni di
er sim
persone
ili a lui?
Resuscitun virus
killerdi Jeffery K. Taubenberger,
Ann H. Reid e Thomas G. Fanning
VITTIME
DELL'INFLUENZA
ricoverate all'U.S.Army Camp Hospital
n. 45, a Aix-les-Bains,
in Francia, nel 1918.
L'epidemia uccise
43.000 militariamericani, vale a dire
quasi il 40 per centodelle perdite militari
degli Stati Uniti
d'America.

ST. LOUIS, 1918. INFERMIERE DELLA CROCE ROSSA trasportano un malato d'influenza. Il personale
sanitario, la polizia e molti comuni cittadini terrorizzati dalla malattia portavano mascherine
per proteggersi dal contagio. Nei soli Stati Uniti, la Spagnola ha provocato 675.000 vittime.
IN SINTESI
• La pandemia di influenza che colpì l'intero pianeta tra 111918 e il 1919 provocòun numero straordinario di vittime; particolarmente eccezionale fu l'altissimo numerodi giovani colpiti da un virus insolitamente virulento.• Le peculiarità che resero così letale quel ceppo virale sono rimaste un mistero finoa quando gli autori dell'articolo hanno ideato le tecniche giuste per recuperare i genidel virus del 1918 dai tessuti conservati delle vittime.• L'analisi di quei geni e delle proteine per cui codificano ha rivelato caratteristichevirali che potrebbero aver soppresso le difese immunitarie e contemporaneamenteprovocato una violenta reazione immunitaria nelle vittime, contribuendo così aglielevati tassi di mortalità.• Poiché è improbabile che i mammiferi e i volatili noti come ospiti di virus influenzalisiano stati alla base dell'epidemia del 1918, la sua origine è tuttora sconosciuta.
e
E
I
l 7 settembre 1918, al culmine dellaprima guerra mondiale, in un cam-po di addestramento militare allaperiferia di Boston un soldato mar-
cò visita accusando una febbre molto ele-vata. I medici gli diagnosticarono una me-ningite, ma il giorno seguente il ricoverodi un'altra dozzina di soldati con sintomirespiratori li costrinse a cambiare parere. 1116 settembre si manifestarono 36 nuovicasi di questa malattia sconosciuta. Maper il 23 settembre i casi registrati tra i45.000 soldati del campo avevano rag-giunto l'incredibile cifra di 12.604. Alla fi-ne dell'epidemia, la malattia aveva colpitoun terzo dei militari del campo, uccidendoquasi 800 uomini. Spesso la pelle dei sol-dati agonizzanti assumeva una colorazio-ne bluastra, e gli uomini soffrivano orri-bilmente prima di morire per soffocamen-to. Molti morirono meno di 48 ore dopo lacomparsa dei primi sintomi, e l'autopsiarivelò che i loro polmoni erano pieni difluido o di sangue.
Poiché questa insolita serie di sintominon corrispondeva ad alcuna malattia co-
nosciuta, William Henry Welch, insignepatologo dell'epoca, ipotizzò che si trat-tasse «di un nuovo tipo di infezione o dipeste». Ma non era né l'una né l'altra: erasoltanto influenza. Eppure, si ritiene chetra il 1918 e il 1919, questo ceppo di virusinfluenzale così virulento e infettivo ab-bia ucciso almeno 40 milioni di personein tutto il mondo.
La più letale epidemia influenzale dellastoria moderna sparì con la stessa velocitàcon cui era comparsa, e per molto temposi pensò che le cause fossero troppo remo-te per essere scoperte. Nel 1930 si scoprìche l'influenza è provocata da un virus,ma nessuno aveva conservato campionidi quell'agente patogeno per studi poste-riori. Grazie all'incredibile previdenza del-lo U.S. Army Medical Museum, alla tena-cia di un patologo di nome Johan Hultin,e ai progressi ottenuti nell'analisi geneticadi vecchi campioni di tessuto, siamo peròriusciti a recuperare porzioni del virus del1918 e a studiarne le caratteristiche. Oggi,a più di ottant'anni di distanza dall'orren-do disastro del 1918-1919, i tessuti recu-perati da un esiguo numero di vittimestanno fornendo la risposta a domandefondamentali sulla natura di questo ceppopandemico e in generale sulle modalitàd'azione dei virus influenzali.
Queste ricerche non sono motivate dasemplice curiosità storica. Poiché i virus
influenzali si evolvono di continuo, sonosempre nuovi i ceppi che minacciano l'u-manità Dopo il 1918 i virus influenzaliumani di tipo pandemico sono ricomparsiper ben due volte, nel 1957 e nel 1968, eceppi influenzali che di solito infettanosolo gli animali hanno periodicamenteprovocato la malattia anche negli esseriumani, come si è visto con l'epidemia diinfluenza aviaria scoppiata recentementein Asia. I due obiettivi principali del no-stro gruppo consistono nel determinareche cosa rese così virulenta l'influenza del1918, in modo da orientare lo sviluppo dicure antinfluenzali e di misure preventive,e nello stabilire l'origine del virus pande-mico, in modo individuare meglio le pos-sibili origini di ceppi pandemici futuri.
Caccia al virus della Spagnola
Sotto molti punti di vista, l'influenzadel 1918 fu simile ad altre che la precedet-tero e la seguirono. Ogni volta che com-pare tm nuovo ceppo influenzale dotato dicaratteristiche con cui il sistema immuni-
tario delle persone non è mai venuto incontatto, la probabilità che scoppino foco-lai infettivi diffusi aumenta. Ma alcunecaratteristiche della pandemia del 1918sono rimaste a lungo incomprensibili.
Per esempio, la diffusione e la violenzadel fenomeno furono eccezionali. I focolaidell'epidemia si diffusero rapidamente at-traverso l'Europa e il Nord America, rag-giungendo le lande desolate dell'Alaska ele isole più remote del Pacifico. Alla fine,rimase contagiato forse un terzo della po-polazione mondiale. La malattia si rivelòanche insolitamente grave, con tassi dimortalità che andavano dal 2,5 al 5 per
cento: fino a 50 volte più alti di quelli os-servati in altre epidemie influenzali.
Nell'autunno del 1918 l'Europa interachiamava questa influenza «la Spagnola»,probabilmente perché la Spagna, neutrale,non aveva imposto la censura sulle noti-zie relative all'epidemia che imperversavanei paesi belligeranti. 11 nome rimase, a di-spetto del fatto che i primi focolai, l'onda-ta primaverile, si fossero sviluppati all'in-terno e nei pressi degli accampamenti mi-litari negli Stati Uniti, nel marzo 1918. Laseconda ondata della pandemia si manife-stò tra il settembre e il novembre 1918, ein molte regioni un'altra grave ondata in-fluenzale si abbatte all'inizio del 1919.
Gli antibiotici non erano ancora statiscoperti, e la maggior parte delle vittimedella pandemia morì di polmonite, causa-ta da batteri opportunisti che infettavanocoloro che erano già stati indeboliti dal-l'influenza. Una parte delle vittime morìinvece pochi giorni dopo la comparsa deisintomi a causa di una forma più grave dipolmonite virale - provocata dall'influen-za stessa - che in alcuni soggetti produsse
estese emorragie polmonari, mentre in al-tri riempì i polmoni di siero. Inoltre, lamaggior parte delle vittime furono giova-ni fra i 15 e i 35 anni, una fascia di età cheraramente viene decimata dall'influenza.Sorprendentemente, più del 99 per centodi tutte le morti «in eccesso» (cioè al di so-pra delle medie annuali) causate dall'in-fluenza nel 1918-1919 si ebbe tra le per-sone con meno di 65 anni.
I tentativi di comprendere la causa del-la pandemia del 1918 e le sue insolite ca-ratteristiche incominciarono quasi subitodopo la fine del fenomeno, ma il virus re-sponsabile dell'epidemia continuò a na-
scondersi per ottant'anni. Nel 1951, ungruppo di scienziati dell'Università delloIowa, fra cui uno studente di nome JohanHultin, appena giunto dalla Svezia, si re-carono in Alaska, fino alla Seward Penin-sula, alla ricerca del ceppo della Spagnola(si veda il box a p. 55). Nel novembre1918, in un villaggio di pescatori inuit og-gi chiamato Brevig Mission, l'influenza siera propagata in cinque giorni, uccidendo72 persone: circa 1'85 per cento della po-polazione adulta. Da allora, i loro corpigiacevano sepolti nel permafrost e i com-ponenti della spedizione speravano di ri-trovare il virus conservato nei polmonidelle vittime. Sfortunatamente, tutti i ten-tativi di coltivare il virus dell'influenzaproveniente da quei campioni fallirono.
Nel 1995 il nostro gruppo iniziò a cer-care di ritrovare il virus del 1918 utiliz-zando tessuti provenienti dall'archivio direperti autoptici dell'Armed Forces Institu-te of Pathology (AFIE) a Washington. Cieravamo specializzati nell'estrazione ascopo diagnostico di materiale geneticovirale molto delicato da tessuti danneg-giati o putrefatti. Nel 1994, per esempio,eravamo riusciti a usare le nostre nuovetecniche per aiutare un patologo dell'AFIPspecializzato in mammiferi marini a inda-gare sul decesso di un gran numero didelfini provocato, in apparenza, da unamarea rossa. Sebbene i campioni di tessu-to di delfino a nostra disposizione fosseroin pessimo stato di conservazione, riu-scimmo a estrarre frammenti di RNA inquantità sufficiente a identificare un nuo-vo virus, simile a quello che provoca il ci-murro nei cani, che risultò essere la causa
della moria di delfini. Presto incomin-ciammo a chiederci se ci fosse qualche al-tro mistero più antico di natura medicache avremmo potuto risolvere utilizzandole risorse del nostro istituto.
L'AFIP, emanazione diretta dell'ArmyMedical Museum fondato nel 1862, hauna collezione di tre milioni di campioni.Quando capimmo che nell'archivio c'era-no anche campioni autoptici provenientidalle vittime dell'influenza del 1918, de-cidemmo di metterci alla ricerca del virusresponsabile della pandemia Inizialmen-te esaminammo 78 campioni di tessutoappartenuti alle vittime decedute durantel'ondata autunnale del 1918, concentran-doci su quelle che presentavano i gravidanni polmonari caratteristici dei pazien-ti che morivano in brevissimo tempo.Poiché il virus influenzale normalmenteabbandona i polmoni nel giro di pochigiorni dall'inizio dell'infezione, siamo sta-ti davvero fortunati a scoprire frammentivirali in queste vittime!
All'epoca, il protocollo standard per laconservazione dei reperti autoptici preve-deva una prima fissazione in formaldeidee una successiva inclusione in paraffina:ciò ha messo a dura prova le tecniche cheavevamo sviluppato, quando abbiamo i-niziato a estrarre minuscoli frammenti ge-netici del virus da questi tessuti «fissati»ottant'anni prima. Dopo un tormentatoanno di insuccessi, nel 1996 scoprimmo ilprimo campione positivo all'influenza: sitrattava del tessuto polmonare di un sol-dato morto nel settembre del 1918 a FortJackson, nel South Carolina. Da questocampione fummo in grado di determinare
la sequenza nucleotidica di cinque geniinfluenzali presenti in piccoli frammenti.
Ma per avere la conferma che le se-quenze appartenessero al virus letale del1918 continuammo a cercare ulteriori ri-sultati positivi e, nel 1997, riuscimmo aidentificarne un altro. Anche questo sol-dato era morto nel settembre del 1918: aCamp Upton, New York. Il secondo cam-pione ci permise di confermare le sequen-ze genetiche in nostro possesso, anche sedubitavamo che la minuscola quantità ditessuto rimasta da queste autopsie ci a-vrebbe consentito di produrre una se-quenza completa del virus.
La soluzione giunse nel 1997, da unafonte inaspettata: Johan Hultin, che ormaiera un patologo di 73 anni in pensione,lesse i nostri risultati e si offrì di ritornarea Brevig Mission per tentare una nuovaesumazione delle vittime della Spagnolasepolte nel permafrost. Quarantasei annidopo il suo primo tentativo, con l'autoriz-zazione del Brevig Mission Council, Hul-tin ottenne alcune biopsie polmonari con-gelate provenienti da quattro vittime del-l'influenza. In uno di questi campioni, ap-partenuto a una donna di età sconosciuta,trovammo l'RNA del virus influenzale chefornì la chiave di accesso per sequenziarel'intero genoma del virus del 1918.
Più recentemente il nostro gruppo, incollaborazione con colleghi britannici, haesaminato anche dei campioni di tessutiautoptici di vittime della Spagnola prove-nienti dal Royal London Hospital. Siamoriusciti ad analizzare i geni del virus del-l'influenza ritrovati in due dei casi esami-nati, e abbiamo scoperto che erano quasiidentici ai campioni del Nord America,confermando la rapida diffusione mon-diale di un virus uniforme. Ma che cosapossono raccontarci queste sequenze sul-l'origine e sulla virulenza del ceppo del1918? Per rispondere è necessario cono-scere almeno un po' come funzionano ivirus influenzali e come provocano la ma-lattia in ospiti diversi.
Le mutazionidei virus influenzali
Tutti e tre i nuovi ceppi che hannocausato pandemie nell'ultimo secolo ap-partenevano al sierotipo A dei virus in-fluenzali. L'influenza si manifesta in treforme principali: A, B e C. Le ultime dueinfettano solo gli esseri umani e non han-no mai provocato pandemie, mentre i vi-rus del sierotipo A contagiano una granvarietà di animali, incluso il pollame, isuini, i cavalli, gli esseri umani e altrimammiferi Gli uccelli acquatici, come leanatre, fungono da serbatoio naturale pertutti i sottotipi conosciuti di influenza A:il virus infetta l'intestino dell'uccello sen-
Trail1918 e il 1919 la Spagnola ha ucciso almeno
quaranta milioni di persone in tutto il mondo
LE SCIENZE 439/marzo 2005 www.lescienze.it

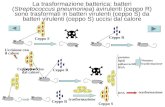
SFRUTTARE LA CELLULA OSPITEI 'virus dell'influenza è piccolo e semplice: una sfera lipidica
cava, sulla cui superficie sono inserite alcune proteine, che
contiene soltanto otto segmenti genomici (qui sotto). Ma tutto
questo è più che sufficiente per indurre le cellule degli ospiti
viventi a produrre nuovi virus (in basso]. Una proteina
particolarmente importante situata sulla superficie del virus
influenzale, l'emoagglutinina (HA), consente al virus di
penetrare nelle cellule viventi. La sua forma determina quale
ospite può essere infettato da un ceppo virale. Un'altra
IL VIRUS DELL'INFLUENZALe due principali proteinesulla superficie del virus,HA e NA, sporgono da undoppio strato lipidico.All'interno (in sezione)otto diversi segmenti di RNAcodificano per proteinedalle quali dipendonotutti i diversi aspettidelle attività virali.
a
Acido sialico
proteina, la neuraminidasi (NA), libera i virus neoformati da
una cellula infettata, determinando l'efficienza con cui il virus
si diffonde. Lievi cambiamenti in queste e in altre proteine
influenzali possono aiutare il virus a infettare nuovi tipi di
ospite e a eludere l'aggressione del sistema immunitario. Le
mutazioni possono aver origine da errori awenuti durante la
copiatura dei geni virali o essere acquisite mediante un
meccanismo di scambio quando i geni di due virus influenzali
di e si che infettano la stessa cellula si mescolano (a destra].
Virus riassunti
Doppiostratolipidico
Ceppo 2
CONTAGIO E REPLICAZIONELa proteina HA di un virus influenzale si lega all'acidosialico presente sulla superficie di una cellula dell'ospite(a), permettendo al virus di penetrare all'interno (b),dove rilascia il proprio RNA (c), che entra nel nucleo dellacellula (d). Qui l'RNAvirale viene copiato e le sueistruzioni genetiche «lette», inducendo l'apparatocellulare a sintetizzare nuove proteine virali (e). Il nuovoRNAvirale e le proteine si assemblano quindi in virus chegemmano dalla membrana cellulare W. Inizialmente leloro superfici sono ricoperte di acido sialico, che potrebbeindurle a legarsi con le reciproche emoagglutininee con la superficie della cellula ospite. Per impedirlo, laneuraminidasi elimina l'acido sialico dalla superficie deivirus (g), rendendole libere di infettare altre cellule.
RNAvirale
Nucleo
RIASSORTIMENTONuovi ceppi influenzali posso formarsiquando due virus diversi infettano la stessacellula (sopra). Copie del loro RNA possonomescolarsi e produrre una progenie concombinazioni di geni di entrambi i virus. Inquesto modo, un ceppo influenzale aviario oanimale può acquisire geni che gli daranno lacapacità di diffondersi più facilmente fra gliesseri umani.
e
•
Copie delPRNAvirale
za causare sintomi. Questi ceppi aviariselvatici, però, possono mutare nel tempoo scambiare materiale genetico con altriceppi influenzali, producendo nuovi virusche sono in grado di diffondersi fra imammiferi e il pollame domestico.
11 ciclo vitale e la struttura genomicadel virus dell'influenza A gli consentonodi evolvere e di scambiare facilmente ipropri geni. Il genoma virale è costituitoda otto frammenti separati di RNA avvoltida una membrana lipidica su cui sono an-corate molte proteine (si veda il box quisopra). Per riprodursi, il virus si lega a unacellula vivente e penetra al suo interno,dove prende il controllo degli apparati
metabolico-enzimatici cellulari, inducen-doli a produrre nuove proteine virali e ul-teriori copie di RNA virali. Queste parti,poi, vengono assemblate fra loro per dareorigine a nuovi virus, che escono dallacellula ospite e vanno a infettare altre cel-lule. Poiché nessun meccanismo assicurache le copie di RNA siano corrette, spessosi verificano errori che portano a nuovemutazioni. Per di più, nel caso in cui duediversi virus influenzali infettino la stessacellula, i loro frammenti di RNA sono ingrado di mescolarsi liberamente, dandoorigine a una progenie virale che contieneuna combinazione di geni provenienti daentrambi i virus originali. Questo «riassor-
timento» genico è un meccanismo sfrutta-to dai virus per generare nuovi ceppi.
I diversi virus influenzali di tipo A incircolazione vengono identificati facendoriferimento a due particolari proteine si-tuate sulla loro superficie. Una è l'emoag-glutinina (HA), di cui si conoscono alme-no 15 varianti o sottotipi, l'altra è la neu-raminidasi (NA), che ha nove sottotipi.L'esposizione a queste proteine determinain un ospite la produzione di anticorpi ca-ratteristici, così il ceppo del 1918 fu il pri-mo a essere classificato: sulla base deglianticorpi ritrovati nel sangue dei soprav-vissuti, gli venne attribuita la sigla H1N1.In realtà, i discendenti meno virulenti del-
l'H1N1 sono stati i ceppi influenzali pre-dominanti in circolazione fino al 1957,quando comparve un virus, H2N2, cheprovocò una nuova pandemia. Dal 1968 èdivenuto dominante il sottotipo H3N2,che provocò la pandemia di quell'anno.
I sottotipi proteici HA e NA presenti suun virus influenzale A sono molto di piùche semplici caratteri identificativi: essisono essenziali per la riproduzione virale ecostituiscono i bersagli principali del siste-ma immunitario di un ospite infettato. Lamolecola HA avvia l'infezione legandosiai recettori posti sulla superficie di alcunecellule ospiti, che in genere sono celluledell'endotelio respiratorio nei mammiferi
e cellule endoteliali intestinali negli uccel-li. La proteina NA consente alle nuove co-pie di virus di uscire dalla cellula ospite inmodo da andare a infettare altre cellule.
Dopo l'iniziale esposizione dell'ospite aun sottotipo HA, gli anticorpi impediran-no il futuro legame dei recettori e quindirisulteranno molto efficaci nel prevenirela reinfezione da parte dello stesso ceppo.Eppure, con una certa periodicità com-paiono virus influenzali dotati di sottotipiHA nuovi per gli esseri umani, molto pro-babilmente per un fenomeno di riassorti-mento con l'ampio serbatoio di virus in-fluenzali che infettano gli uccelli selvati-ci. Di solito, i sottotipi influenzali HA chesi sono adattati agli ospiti aviari mostra-no una debole affinità di legame nei con-fronti dei recettori cellulari di superficieche abbondano nel tratto respiratorio de-gli esseri umani; così, l'affinità di legamedi un sottotipo HA di un virus aviario de-ve essere in qualche modo modificata pri-ma che il virus possa replicarsi e diffon-dersi efficacemente nell'uomo. Fino a po-co tempo fa, i dati suggerivano che un vi-rus influenzale esclusivamente aviarioprobabilmente non sarebbe stato in gradodi infettare direttamente l'uomo: eppurenel 1997, a Hong Kong, 18 persone furo-no contagiate dal virus influenzale aviarioH5N1 e sei di esse morirono. Focolai diuna forma ancora più patogena di quelceppo si sono diffusi nel pollame asiaticotra il 2003 e il 2004, e in seguito al conta-gio con questo virus in Vietnam e in Thai-landia sono morte più di 30 persone.
Dopo che un virus influenzale ha infet-tato l'ospite, la sua virulenza è determina-ta da un complesso di fattori, tra cui la ra-pidità con cui il patogeno penetra nei di-versi tessuti, la velocità con cui si replica ela risposta del sistema immunitario dell'o-spite. Di conseguenza, capire esattamentequali fattori resero così infettiva e virulen-ta la pandemia influenzale del 1918 po-trebbe aiutarci a capire che cosa trasformaun qualsiasi ceppo influenzale in una mi-naccia più o meno grave.
Il volto del killer
Usando l'RNA del 1918 che abbiamorecuperato siamo stati in grado di utiliz-zare i geni del virus come ricetta per con-fezionare le sue componenti, ricreandosostanzialmente pezzi del virus killer. Ilprimo di questi pezzi che ci premeva esa-minare era la proteina emoagglutinina,dalla cui analisi speravamo di scoprirecaratteristiche che spiegassero l'eccezio-nale virulenza del ceppo del 1918.
Osservammo, per esempio, che la regio-ne dell'HA del 1918 che si lega con la cel-lula ospite è quasi identica al sito di lega-me di una HA influenzale esclusivamente
aviaria. In due dei campioni del 1918,questo sito di legame per i recettori differi-sce dalla forma aviaria soltanto per unamminoacido, mentre negli altri tre isolatirisulta alterato anche un secondo ammi-noacido. Queste mutazioni apparente-mente trascurabili possono rappresentareil cambiamento minimo di cui un'HA ditipo aviario ha bisogno per legarsi ai re-cettori caratteristici dei mammiferi.
Ma se è vero che l'acquisizione di unanuova affinità di legame è un passo criti-co che permette a un virus di infettare unnuovo tipo di ospite, è anche vero chequesto evento non spiega necessariamen-te la ragione per cui il ceppo del 1918 fucosì letale. Ci siamo quindi messi ad ana-lizzare le sequenze del gene per cercarecaratteristiche che potessero essere colle-gate direttamente alla virulenza, fra cuidue mutazioni note in altri virus influen-zali. Una di esse riguarda il gene HA: perattivarsi all'interno di una cellula, la pro-teina HA deve essere scissa in due fram-menti da uno specifico enzima intestinale,o proteasi, fornito dall'ospite. Alcuni sot-totipi virali aviari di H5 e H7 vanno sog-getti a una mutazione genica che aggiun-ge uno o due amminoacidi fondamentalial sito di taglio, consentendo all'HA di es-sere attivata anche da altre proteasi ubi-quitarie. Nei polli e in altri uccelli l'infe-zione da parte del virus si diffonde a nu-merosi organi diversi e anche al sistemanervoso centrale, determinando un tassodi mortalità molto elevato. Questa muta-zione è stata osservata nei virus H5N1 checircolano in Asia: ma non l'abbiamo ri-scontrata nel virus della Spagnola.
L'altra mutazione con un effetto signi-ficativo sulla virulenza è stata rilevata nelgene NA di due ceppi virali influenzaliche infettano i topi. Ancora una volta, lemutazioni di un singolo amminoacidosembrano consentire al virus di replicarsiin molti tessuti diversi del corpo, e nei topida laboratorio questi ceppi influenzali so-no solitamente letali. Ma nel virus del1918 non osservammo nemmeno la mu-tazione dell'NA. E poiché l'analisi geneticadel virus del 1918 non stava portando allaluce alcuna caratteristica in grado di spie-garne l'estrema virulenza, iniziammo acollaborare con altre istituzioni per ri-crearne alcune porzioni in modo da poterosservare i loro effetti sui tessuti viventi.
Una nuova tecnica, chiamata «geneticainversa basata sui plasmidi», permette dicopiare segmenti del virus e di combinar-li con i geni di un ceppo influenzale at-tualmente esistente, producendo un virusibrido. Così, possiamo prendere un ceppoinfluenzale adattato ai topi e dargli com-binazioni diverse di geni virali del 1918.In seguito, infettando un animale vivo oun tessuto umano in coltura con questo
50 LE SCIENZE 439 / marzo 2005
www.lescienze.it 51

Sierotipo adattato agli umani Sierotipo aviario Virus della Spagnola
H1
Sostituzione diun amminoacido
HS
Copiedel gene
.0.1/491.1nMAJNIOL.•%250:10,16,7".,
140;1.0%Y%
Plasmidi
Colturacellulare
Nuovo virusinfluenzale
La genetica inversa basata sui plasmidi
consente agli scienziati di produrre virus
influenzali su misura. Le copie delle
sequenze di DNA dei geni provenienti da
due diversi ceppi influenzali (in blu e inrosso) sono inserite in anelli di DNA detti
plasmidi. I plasmidi con i geni sono poi
iniettati in una coltura cellulare, che
produce i virus influenzali contenenti la
combinazione desiderata di geni.
Q
uando l'analisi dei geni del virus del 1918 non rivelò nulla
che giustificasse la virulenza del ceppo pandemico, il nostro
gruppo è ricorso alla genetica inversa, un metodo per
comprendere la funzione dei geni studiando le proteine per cui
codificano. Insieme a ricercatori della Mount Sinai School of
Medicine, dei Centers for Disease Control and Prevention, del
Department of Agriculture,
dell'Università di Washington e dello
Scripps Research Institute, abbiamo
«costruito» alcuni virus influenzali
contenenti due o più geni del virus del
1918, in modo da vedere come si
comportavano questi virus ricombinanti
in colture cellulari animali e umane.
Per costruire questi virus, abbiamo
utilizzato la genetica inversa basata sui
plasmidi, che parte dalla creazione di
copie a DNA dei geni influenzali
normalmente presenti sotto forma di
RNA. Ciascuna copia viene poi inserita in
un plasmide, un piccolo anello di DNA.
Combinazioni diverse di plasmidi
possono essere iniettate in cellule
viventi, dove il meccanismo cellulare ne
eseguirà le istruzioni genetiche
fabbricando solo virus dell'influenza con
la combinazione di geni desiderata.
Oltre a consentire lo studio del virus
del 1918, la genetica inversa
permetterà di indagare sulla reale
pericolosità del virus H5N1 per gli esseri
umani. Dal gennaio 2004, questo ceppo
— presente negli uccelli di 10 paesi
asiatici — ha infettato oltre 40 persone,
uccidendone più di 30. Una delle vittime
è una madre che si pensa abbia
contratto il virus dalla figlia, e non
direttamente da un uccello.
Il contagio uomo-uomo potrebbe
suggerire che il virus aviario si sia
adattato in modo da diffondersi più facilmente fra gli esseri
umani, sia per mutazione sia acquisendo nuovi geni mediante
riassortimento con un ceppo influenzale umano in circolazione.
Questo sviluppo potrebbe aumentare la probabilità di una
pandemia umana. Sperando di poter prevedere, e quindi
prevenire, un simile disastro, scienziati dei CDC e della Erasmus
University, in Olanda, intendono testare
alcune combinazioni dell'H5N1 con
ceppi influenzali umani, per valutarne la
virulenza e la probabilità che compaiano
spontaneamente. I risultati di questi
esperimenti saranno cruciali per capire
come hanno origine le pandemie
influenzali. Qualcuno si chiede se sia
prudente condurre esperimenti con
ceppi influenzali letali, ma tutte queste
ricerche sono condotte in laboratori
sicuri, progettati specificamente per
manipolare virus influenzali altamente
patogeni.
La ricostruzione delle proteine del
virus del 1918 ci ha consentito anche di
stabilire che i farmaci antivirali attuali,
come l'amantadina o gli inibitori della
neuraminidasi più recenti, come
l'oseltamivir, sarebbero efficaci
contro il ceppo del 1918 in caso di
infezione accidentale. Anche i virus
H5N1 sono sensibili agli inibitori della
neuraminidasi.
Recentemente, scienziati americani
e inglesi hanno usato la genetica
inversa basata sui plasmidi per creare
un ceppo di base per un vaccino contro
l'H5N1. È stata prodotta una versione
del virus H5N1 priva delle
caratteristiche più letali del ceppo
selvatico, in modo che i produttori
possano usarlo in totale sicurezza per
sintetizzare un vaccino.
COME SI RICOSTRUISCE UN VIRUS
L'EMOAGGLUTININA (HA) DEL VIRUS DEL 1918 è stata ricostruita a partire dalla sua sequenza
genetica, in modo da esaminare la regione che si lega all'acido sialico della cellula ospite,
consentendo l'ingresso al virus. In genere, i siti di legame dell'HA hanno una forma abbastanza
diversa da impedire le infezioni intraspecifiche. Per esempio, l'HA del sierotipo H3 adattato agli
esseri umani ha un'ampia cavità nella parte centrale del suo sito di legame (a sinistra), mentre
la cavità dell'H5 aviario (al centro) è stretta. L'HA del virus H1N1 del 1918 (a destra) ricorda più
da vicino la forma aviaria, con alcune piccole differenze nella sequenza amminoacidica. Una di
queste mutazioni (freccia) allarga leggermente la cavità centrale: quanto basta per permettere
a un virus influenzale con questo HA di tipo aviario di contagiare milioni di esseri umani.
HA e NA, Kawaoka ha scoperto che sol-tanto il gene HA del 1918 generava unarisposta immunitaria potente; ciò sembraindicare che, per ragioni ancora ignote,questa proteina avrebbe avuto un ruolo diprimo piano nella virulenza di quel ceppo.
Questi esperimenti stanno aprendo unafinestra sul passato, e aiutano gli scienzia-ti a comprendere le insolite caratteristichedella pandemia di Spagnola. Allo stessomodo, queste tecniche si usano per studia-re i cambiamenti del ceppo influenzale a-viario H5N1 diffusosi in Asia, e capirequali potrebbero provocare una pandemiafra gli esseri umani di questo virus estre-mamente letale (si veda il box nella paginaa fronte). Una domanda altrettanto urgen-te è in che modo un ceppo così virulentopossa, a un certo punto, comparire daqualche parte; perciò il nostro gruppo staanalizzando anche i geni del virus del1918 per ottenere degli indizi sul suo pro-babile luogo di origine.
11 nostro gruppo ha completato l'analisidi cinque degli otto segmenti di RNA delvirus del 1918, e finora il confronto fra igeni influenzali della Spagnola e quelli dinumerosi virus influenzali umani, suini eaviari colloca il virus del 1918 all'internodelle famiglie degli esseri umani e dei sui-ni, confermandone l'estraneità con la fa-miglia dei virus aviari. Comunque, i genidel virus del 1918 hanno anche alcunecaratteristiche aviarie, e quindi è probabi-le che il virus abbia avuto origine inizial-mente da un serbatoio aviario, in un'epo-
rivava direttamente da un virus aviario;un virus, però, notevolmente diverso dallesequenze aviarie note dell'H1.
Per verificare la possibilità che i geni a-viari dell'Hl fossero sostanzialmente cam-biati negli anni trascorsi dalla pandemiadi Spagnola, abbiamo iniziato a collabo-rare con scienziati dello Smithsonian In-stitution's Museum of Natural History edella Ohio State University. Dopo aver e-saminato molti reperti di uccelli dell'epo-ca, abbiamo isolato un ceppo influenzaleaviario di sottotipo H1 da un'oca colom-
Questi esperimenti stanno aprendo una finestra sul passato e ciaiutano a capire che cosa può provocare una nuova pandemia
virus ingegnerizzato, possiamo osservarequali componenti del ceppo pandemicopotrebbero spiegarne la patogenicità.
Per esempio, il fatto che il virus dellaSpagnola fosse in grado di produrre rapi-damente un danno esteso ai tessuti respi-ratori superiori e inferiori suggerisce chela sua replicazione era quantitativamenteelevatissima e la sua velocità di diffusioneda una cellula all'altra molto rapida. Sap-piamo che la proteina virale NS1 può im-pedire la produzione dell'interferone di ti-po I (IFN), un sistema di «allarme precoce»che la cellula utilizza per dare l'avvio allarisposta immunitaria contro un'infezione
virale. Quando testammo i virus ricombi-nanti in coltura utilizzando cellule pol-monari umane, scoprimmo che un viruscon il gene NS1 del 1918 era in effetti piùefficace nel bloccare il sistema di produ-zione dell'1FN di tipo I dell'ospite.
Finora abbiamo prodotto virus influen-zali ricombinanti che contenevano da unoa cinque geni del 1918. Fatto curioso, ab-biamo scoperto che i virus ricombinantiche possedevano entrambi i geni HA e NAdel 1918 erano letali nei topi: provocava-no danni polmonari simili a quelli osser-vati in alcune vittime della pandemia.Quando abbiamo analizzato questi tessuti
polmonari abbiamo trovato traccia del-l'attivazione di geni coinvolti nelle nor-mali risposte infiammatorie. Ma abbiamoanche scoperto un'attivazione maggioredel normale di geni associati con le arma-te offensive del sistema immunitario, ilinfociti T e i macrofagi, come pure di genicollegati a lesioni tissutali, a danni ossida-tivi e all'apoptosi, o suicidio cellulare.
Più di recente, Yoshihiro Kawaoka del-l'Università del Wisconsin a Madison hareso pubblici analoghi esperimenti effet-tuati nei topi con geni influenzali dellaSpagnola, nei quali ha ottenuto risultatisimili. Testando però separatamente i geni
Alla ricerca del luogo d'origine
Il modo migliore per analizzare le rela-zioni fra i diversi virus influenzali è quel-lo filogenetico, per mezzo del quale ven-gono costruiti ipotetici alberi genealogiciutilizzando le sequenze geniche virali e leconoscenze sulla frequenza tipica di mu-tazione dei geni. Poiché il genoma di unvirus influenzale è formato da otto distin-ti segmenti di RNA che possono spostarsiin maniera indipendente mediante rias-sortimento, è necessario condurre le ana-lisi evoluzionistiche separatamente, perciascun segmento genico.
ca non precisata prima del 1918. Tuttavia,in quell'anno il virus si era chiaramenteadattato a sufficienza ai mammiferi tantoda funzionare come un virus pandemicoper gli esseri umani. La domanda è: dove?
Analizzando il gene dell'emoaggluti-nina del 1918 abbiamo scoperto che lasua sequenza è molto più diversa dalle se-quenze aviarie di quanto lo siano il sotto-tipo H2 del 1957 e il sottotipo H3 del1968. Così, abbiamo concluso che o il ge-ne HA del 1918 aveva trascorso un certotempo in un ospite intermedio, dove ave-va accumulato molte mutazioni rispettoalla sequenza aviaria originale, oppure de-
baccio raccolta nel 1917 e conservata inetanolo allo Smithsonian. Analizzandol'animale è emerso che la sequenza aviariadell'Hl del 1917 era strettamente correlataai moderni ceppi aviari H1 del Nord Ame-rica, il che suggeriva che le sequenze avia-rie hanno subito pochissime mutazioninegli ultimi ottant'anni. 11 sequenziamen-to particolareggiato di altri ceppi H1 pro-venienti da uccelli selvatici potrebbe por-tare a identificarne uno più simile all'HAdel 1918, ma dato che l'HA non ha subitoun riassortimento diretto da un ceppo a-viario, può darsi che non si ritrovi nessunH1 aviario simile al ceppo del 1918.
52 LE SCIENZE 439 / marzo 2005
www.lescienze.it 53

HULTINde', in una tomba
, a Brevig,199?
OSTINAZIONE PREMIATA
Durante un viaggio in Alaska nel 1949, Johan Hultin,studente di medicina svedese, incontrò a Fairbanks alcuni
missionari luterani che gli raccontarono gli effetti dellapandemia influenzale del 1918 sui villaggi inuit. Nel novembredi quell'anno uno di essi, un piccolo insediamento della SewardPeninsula chiamato Teller Mission, fu letteralmente cancellato.Sopraffatti, i missionari dovettero chiedere l'aiuto dell'esercitoper seppellire i 72 corpi delle vittime in una fossa comune, chefu marcata con due croci.
Turbato dal racconto, Hultin si trasferì all'Università dell'Iowaper iniziare il dottorato in microbiologia ma continuò a rifletteresulla Spagnola, chiedendosi se il virus responsabile avrebbepotuto essere recuperato, e studiato, dai cadaveri conservatinel permafrost dell'Alaska. Nell'estate del 1951 convinse duecolleghi, un virologo e un patologo, a visitare il villaggio, che nelfrattempo era stato ribattezzato Brevig Mission. Con ilpermesso degli anziani della tribù, i tre ricercatori scavarononella fossa comune e recuperarono campioni di tessuto dairesti dei polmoni di varie vittime. Rientrati nell'Iowa, i tretentarono inutilmente di ottenere virus vivi dai campioni. Eprobabilmente fu una fortuna, visto che all'epoca non c'eranoattrezzature in grado di controllare patogeni pericolosi.
La delusione spinse Hultin a diventare un patologo. Nel 1997,quando - ormai in pensione -viveva a San Francisco, lesse laprima descrizione del recupero di geni del 1918 da campioniautoptici, e questo risvegliò la sua speranza di trovare un interovirus della Spagnola. Scrisse a Taubenberger, proponendogli dipartire per l'Alaska per procurare nuovi campioni di tessuto
polmonare a Brevig Mission, e lo scienziato accettò. Hultinchiese anche ai colleghi della spedizione del 1951 se avesseroconservato qualche campione, nell'ipotesi che, risalendo solo a33 anni dalla fine della pandemia, fossero in condizioni miglioridi quelli prelevati più tardi. Uno di loro aveva conservato ilmateriale per anni, ma ritenendolo privo di qualunque utilità,alla fine l'aveva buttato: l'ultimo campione era stato eliminatoesattamente un anno prima, nel 1996.
Per fortuna, nell'agosto del 1997 Hultin ottenne nuovamenteil permesso di scavare nella tomba di Brevig Mission. E questavolta trovò il corpo di una donna giovane e obesa. In seguito,Hultin disse di aver saputo subito che i suoi tessuti avrebberocontenuto il virus: insieme alla bassa temperatura, lo spessostrato di grasso aveva preservato perfettamente i polmoni delladonna. Aveva ragione: quei tessuti hanno fornito il genomacompleto del virus responsabile dell'epidemia del 1918.
—Yamagata 1989
__E sMtaoscroci mh uas1e9t t9s01990
Figi 1988
URSS 1977
Fort Monmouth 1947Leningrado 1954 Brasile 1978
Puerto Rico 1934
Cambridge 1939 Wilson Smith 1933
H—Wilson Smith N 1933
S. CAROLINA 1918NEW YORK 1918BREVIG 1918
Iowa 1930Iowa 1937
Illinois 1963 Nebraska 1992 Ehime 1980 St. Hyacinthe 1991 Iowa 1988—New Jersey 1976A-Hong Kong 1974
Italia 1981
Alberta 1976_j—Alberta 1980b
Wisconsin 1980a_I—Tennessee 1985___—Tennessee
1981 ALASKA 191?
[—Hong Kong 1976—I— Hong Kong /8/76
i—Germania 1987I—Australia/749/80
i—Germania 1991I Germania 1990 Bavaria 1977 Hong Kong 1976
Kong 1977
C
ercando indizi sull'origine dell'emoagglutinina del virus del 1918, gli autorihanno analizzato le sequenze geniche di numerosi ceppi influenzali e hanno
ricostruito un albero filogenetico che ne mostra le parentele evolutive. I campioni delceppo del 1918 rientrano nella famiglia dei virus influenzali adattati agli esseriumani. La distanza che separa il gene H1 del 1918 dalla famiglia aviaria conosciutaindica che potrebbe aver avuto origine negli uccelli, per poi evolversi in un ospiteignoto prima di fare la sua comparsa nell'uomo. Un ceppo aviario contemporaneoritrovato in un'oca colombaccio (Alaska 1917] si è infatti rivelato evolutivamentedistante da quello del 1918 e più simile ai virus influenzali aviari di oggi.
PER APPROFONDIRE
DAVI ES P., Devil's Flu: The World's Deadliest Influenza Epidemic and the Scientific Hunt forthe Virus That Caused lt, Henry Holt and Co., 2000.CROSBY A.W., America's Forgotten Pandemic: The Influenza of 1918, seconda edizione,Cambridge University Press, 2003.REID A.H. e TAUBENBERGERJ.K., The Origin of the 1918 Pandemic Influenza Virus: A Conti-nuing Enigma, in «Journal of Generai Virology», Vol. 84, pp. 2285-2292, settembre 2003.KASH J.C., BASLER C.F., GARCIA-SASTRE A. e altri, Global Host Immune Response: Pathoge-nesis and Transcriptional Profiling ofType A Influenza Viruses Expressing the Hemaggluti-nin and Neuraminidase Genes from the 1918 Pandemic Virus, in «Journal ofVirology», Vol.78,n. 17, pp. 9499-9511, settembre 2004.
L'ALBERO GENEALOGICO DELL'INFLUENZA
GLI AUTORI
JEFFERY K.TAUBENBERGER,ANN H. REID e THOMAS G. FANNING lavorano all'Armed For-ces Institute of Pathology di Rockville, in Maryland. Il primo, patologo molecolare, hacontribuito a creare un laboratorio per la diagnostica molecolare, la tecnica per indivi-duare malattie dalla loro firma genetica. La seconda, biologa molecolare, ha progettatole tecniche per estrarre DNA e RNA da tessuti danneggiati o decomposti che hanno per-messo di recuperare frammenti genetici del virus del 1918. Fanning, genetista specia-lizzato nell'evoluzione dei genomi, ha aiutato ad analizzare le relazioni genetiche tra i vi-rus dell'uomo e di altri animali. Le opinioni espresse in questo articolo sono personali enon rappresentative del punto di vista del Dipartimento della Difesa.
In questo caso, deve essere intervenutoqualche ospite intermedio. I maiali sonouna delle ipotesi favorite perché è nota laloro sensibilità a entrambi i virus, quelloumano e quello aviario. In effetti, durantela pandemia di Spagnola si assistette alloscoppio simultaneo di focolai influenzalinegli esseri umani e nei suini: noi però ri-teniamo che probabilmente l'infezione siastata trasmessa dagli esseri umani ai ma-iali. Ci sono numerosi esempi di ceppi delvirus influenzale umano A che risultanoinfettivi per i maiali a partire dal 1918,ma negli esseri umani sono stati isolatisolo sporadicamente ceppi influenzalisuini. Tuttavia, per verificare la possibilitàche l'HA del 1918 possa aver avuto un'o-rigine aviaria, abbiamo preso in esame unesempio attuale di evoluzione virale avia-ria nei maiali: un ceppo influenzale avia-rio H1N1 che è diventato endemico neisuini europei negli ultimi 25 anni. Ma an-che dopo vent'anni di evoluzione nei sui-ni, questo ceppo non raggiungeva il nu-mero di mutazioni rispetto alle sequenzeaviarie che presentava il ceppo pandemi-co del 1918.
Quando abbiamo applicato questo tipodi analisi ad altri quattro geni del virusdella Spagnola siamo giunti a conclusionisimili: il virus che ha innescato la pande-mia del 1918 potrebbe essere stato unceppo aviario rimasto evolutivamente iso-lato per un certo periodo dal pool di geniinfluenzali tipico degli uccelli acquatici;un virus che, come il coronavirus che cau-sa la SARS, ha iniziato a circolare fra gliesseri umani provenendo da un ospiteanimale ancora sconosciuto.
Progetti per il futuro
Le nostre analisi hanno aperto uno spi-raglio di luce sull'origine della Spagnola:suggeriscono che il virus responsabile del-la pandemia fosse un antenato comune dientrambi i ceppi successivi H1N1 umani esuini, confutandone un'ipotetica originesuina. Finora, l'analisi dei geni virali nonha fornito prove definitive in grado dispiegare l'eccezionale virulenza del ceppovirale. Tuttavia esperimenti effettuati convirus ingegnerizzati contenenti i geni del1918 indicano che alcune di quelle protei-ne virali erano in grado di stimolare la ra-pida replicazione del virus e di provocareuna risposta immunitaria altamente deva-stante da parte dell'ospite.
In futuro, speriamo di poter collocare ilceppo virale della Spagnola nel contestodei virus influenzali che lo hanno imme-diatamente preceduto e seguito. 11 direttoprecursore del virus responsabile dellapandemia, il ceppo virale dell'ondata pri-maverile, era privo dell'eccezionale viru-lenza che avrebbe caratterizzato l'ondata
autunnale e sembrava diffondersi menofacilmente. Attualmente stiamo cercandocampioni di RNA influenzale provenientida vittime della prima ondata per identifi-care qualsiasi differenza genetica fra i dueceppi che possa aiutarci a comprendereperché l'ondata autunnale fu molto piùgrave. Analogamente, il ritrovamento dicampioni di RNA virale influenzale uma-no antecedenti al 1918 dovrebbe chiarirequali segmenti genetici presenti nel virusdi quell'anno erano del tutto nuovi per gliesseri umani. L'insolita mortalità fra i gio-vani si potrebbe spiegare ipotizzando cheil virus avesse alcune caratteristiche in co-mune con i primi ceppi circolanti, verso iquali gli anziani avevano sviluppato unacerta immunità. Se riuscissimo a ritrovarecampioni dell'H1N1 del 1920 e di annisuccessivi potremmo forse comprenderecome mai il virus del 1918 si sia poi tra-sformato in forme meno virulente.
I meccanismi con cui si generano i cep-pi influenzali della pandemia non sonoancora del tutto chiari. Dal momento che iceppi pandemici del 1957 e del 1968 ave-vano proteine HA simili a quelle aviarie, èprobabile che se ne debba cercare l'originenel riassortimento diretto dei ceppi virali
aviari e umani. Comunque, poiché le cir-costanze di questi eventi di riassortimentonon sono mai state identificate, non si saquanto tempo fu necessario ai nuovi cep-pi per svilupparsi nella pandemia umana.
11 ceppo della pandemia del 1918 è ad-dirittura più sconcertante, perché le suesequenze geniche non sono compatibiliné con un riassortimento diretto da unceppo aviario noto, né con l'adattamentodi un ceppo aviario nei suini. Se riuscissi-mo a dimostrare che il virus del 1918 haacquisito geni insoliti per mezzo di unmeccanismo diverso da quello dei ceppipandemici successivi, ciò potrebbe avere
importanti implicazioni per la salute pub-blica. Un'origine alternativa potrebbe an-che aver contribuito all'eccezionale viru-lenza del ceppo del 1918. 11 sequenzia-mento di un maggior numero di virus in-fluenzali aviari e la ricerca, oltre che neisuini e in ospiti intermedi alternativi - co-me il pollame, gli uccelli selvatici o i ca-valli - potrebbe chiarire meglio l'originedella pandemia del 1918. Fino a quandonon comprenderemo meglio le origini diquei ceppi, è probabile che gli sforzi checompiamo per individuarli e prevenirne ladiffusione ci impediscano di individuarel'inizio della prossima pandemia. 33
5-4 LE SCIENZE 439 / marzo 2005
www.lescienze.it 55