5 C 2010 Acidi Carbossilici
-
Upload
leodolcevita -
Category
Technology
-
view
2.530 -
download
9
description
Transcript of 5 C 2010 Acidi Carbossilici


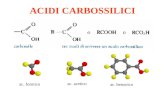
R COOH
ROH
OC sp2

R — C
O — H
O
=: :
:
:
R - COOH
R – CO2H
suffisso: -oico
FUNZIONE CARBOSSILICA
gruppo carbonilico
gruppo ossidrilico
Struttura di Lewis
Ptrefisso: acido-
gruppo carbossilico
Nei composti ciclici suffisso: - carbossilico

COOHH
CH3 COOH
CH3CH2 COOH
CH3(CH2)n COOH
Nomenclatura degli acidi carbossilici
acido metanoico
acido etanoico
acido propanoico

CH3CH2COH
O
123
Acido propanoico Acido - 4 -metilpentanoico
Acido - 3 - bromocicloesancarbossilico
Acido - 1 - ciclopentencarbossilico

H-COOH
Acido metanoico
Acido formico
CH3-COOH
Acido etanoico
Acido acetico
C6H5-COOH
Acido benzoico

(CH2)2
COOH
CH3acido butanoico
acido butirricoacido butanoico
acido butirrico
Esiste anche una nomenclatura tradizionale
Esiste anche una nomenclatura tradizionale

(CH2)4
COOH
CH3acido esanoicoacido capronicoacido esanoicoacido capronico

(CH2)6
COOH
CH3acido ottanoicoacido caprilico
acido ottanoicoacido caprilico

(CH2)8
COOH
CH3acido decanoico
acido caprinicoacido decanoico
acido caprinico

(CH2)14
COOH
CH3acido esadecanoico
acido palmiticoacido esadecanoico
acido palmitico

ac. metanoico
ac. pentanoicoac. esanoico
ac. ottanoico
ac. decanoicoac. tetradecanoico
ac. ottadecanoico
ac. etanoicoac. propanoico
ac. butanoico
123
4
56
8
1014
18
ac. capronicoac. valerianico
ac. butirricoac. propionicoac. aceticoac. formico
ac. miristico
ac. stearico
ac.caprinico
ac. caprilico
nome IUPAC nome correnteN. atomi C
ac. esadecanoico 16 ac. palmitico

COOH
CO
OH
acido cicloesancarbossilicoacido cicloesancarbossilico

HO
acido benzencarbossilico(acido benzoico)
acido benzencarbossilico(acido benzoico)
CO

COOHC
CCH3H
H
COOH
CH2
C
C
CH3
H
H
COOH
acido cis-2-butenoico
acido cis-3-pentenoico
acido 2-ciclopentencarbossilico
1
2
43
1
2
3
1
2
3

Cl
1
6
4
5 3
2
HO
acido 3-clorobenzencarbossilico(acido m-clorobenzoico)
acido 3-clorobenzencarbossilico(acido m-clorobenzoico)
CO

(CH2)nHOOC COOH
acidi bicarbossiliciacidi bicarbossilici
Acido - - dioico

COOH
COOH
ac. etan-dioicoac. ossalico COOH
COOH
CH2
ac. propan-dioicoac. malonico
COOH
COOH
CH2
CH2
ac. butan-dioicoac. succinico
COOH
COOH
CH2
CH2
CH2
ac. pentan-dioicoac. glutarico
acidi bicarbossiliciacidi bicarbossilici

2
COOH
COOH
CH
CH2
ac. cis-buten-dioico
ac. maleicoac. maleico
ossidazione (-2H)
riduzione (+2H)
ac. trans-buten-dioico
ac. fumaricoac. fumarico
COOH
COOH
H
H
C
C
HOOC
COOH
H
H
C
C

CH2
COOH
CH2COOH
CH2
COOH
CH2COOH
CH2
CoASH
CH3
O
C SCoA
CH2COOH
COOH COOH
C
CH2
COOH
COOH
HOH2 O
CH2
COOH
CCH
COOH
COOHH2O
CO2,[2H]
C
CH2
COOH
C
CH2
COOH
O
CH2
COOH
C
CH2
O
SCoACoASH
[2H]
CCOOH
CHOOC
H2O
[2H]C O
CoASH
CH2
COOH
C
COOH
COOH
HHO H
H
H
C
COOH
CH2
COOH
HO H
CH
CO2
acidi bicarbossiliciacidi bicarbossilici

compiti
• Pag. 254 n 10.1 e 10.2
• Pag. 255 n 10.3 e 10.4
• Pag. 256 n 10.5

idrossiacidiidrossiacidi

COOH
CHOOC H
HC HO
COOH
C
COOH
HC
H H
H2O
ac. L-malicoac. L-malicoac. fumaricoac. fumarico
ac. 2(S)-idrossi-butandioico

acido o-idrossi-benzoico
acido salicilicoacido salicilico
CH3
COOH
O C
O
aspirinaaspirina
acido acetil-salicilicoacido acetil-salicilico
COOH
OH

R
O
C
CH3
O
C
O
C
gruppo acilegruppo acile
benzoilebenzoile
etanoile(acetile)etanoile(acetile)
radicali aciliciradicali acilici

CH3CCl
O
Cloruro di acetile(da acido acetico)
C
O
Br
Bromuro di benzoile(da acido benzoico)
C
O
F
Fluoruro di cicloesancarbonile(da acido cicloesancarbossilico)
Nomenclatura degli alogenuri aciliciNomenclatura degli alogenuri acilici

R CH2OH
R
H
O
C
R
OC
OH
ossidazioneossidazione
riduzioneriduzione
riduzioneriduzione
ossidazioneossidazione
alcoolalcool
aldeidealdeide
acidoacido
ossidazione e riduzioneossidazione e riduzione

RO
OC
H....
....+
-
+
Polarità del carbossilePolarità del carbossile

Punti di Ebollizione
Composto FormulaPeso Mol.
Punto Eb.
dimetil etere CH3OCH3 46 -24 °C
etanolo CH3CH2OH 46 78 °C
propanolo CH3(CH2)2OH 60 98 °C
dietil etere (CH3CH2)2O 74 34 °C
glicole etilenico HOCH2CH2OH 62 197 °C
acido acetico CH3CO2H 60 118 °C
etilenediammina H2NCH2CH2NH2 60 118 °C

CO
OHH3C C
O
HO
CH3
gli acidi carbossilici a corta catena allo stato puro o in solventi non polari
formano dimeri
gli acidi carbossilici a corta catena allo stato puro o in solventi non polari
formano dimeri
legami ad idrogenolegami ad idrogeno
- +
-+

CO
OR
OH H
OH H
H
il gruppo carbossilico può formare legami H con l’acqua
il gruppo carbossilico può formare legami H con l’acqua
O
H
Hgli acidi carbossilici a corta catena
sono solubili in acquagli acidi carbossilici a corta catena
sono solubili in acqua
+
-
+
-
+

RO
OC
H....
..
..+
-
è elettrofiloè elettrofilo
è acidoè acido
+
può subire un attacco nucleofilopuò subire un attacco nucleofilo
Proprietà del carbossileProprietà del carbossile

Le proprietà chimiche del gruppo carbossilico possono essere dedotte dal profilo del potenziale elettrostatico
accumulo di carica positivaH relativamente acido
accumulo di carica negativaO relativamente basico
-
+

Acido carbossilico aldeide
Nu:
Rezione favoritaReazione sfavorita

R
OH
O
C H2O+ R
O-
O
C H3O++
aciditàacidità
Ka =[R COO-] [H3O+]
[R COOH]

CO
O -RC
O
OHR
C O
O
-R
COH
OHR
+
COH
OHR
+
H+ OH-
Comportamento acido-base del gruppo carbossilico

CO
O HH3C C
O HH3C
O+
L’acidità del gruppo carbossilico è dovutaall’effetto elettronattrattore esercitato
dal gruppo carbonilico sul gruppo ossidrilico
L’acidità del gruppo carbossilico è dovutaall’effetto elettronattrattore esercitato
dal gruppo carbonilico sul gruppo ossidrilico

l’anione carbossilato è stabilizzato da risonanzal’anione carbossilato è stabilizzato da risonanza
R
O
O
C R
O
O
C
R
O
O
C
1.27 Å1.27 Å
1.27 Å1.27 Å

acidità a confrontoacidità a confronto
OH H2O+ R O H3O++R
l’anione carbossilato è stabilizzato da risonanzal’anione carbossilato è stabilizzato da risonanza
l’anione alcossido non è stabilizzato da risonanzal’anione alcossido non è stabilizzato da risonanza
OH
OC H2O+ R
O
OC H3O
++R
In questo caso i due legami con l'O, che hanno lunghezza diversa (1.23 Å il legame doppio e 1.36 Å il singolo),
diventano di uguale lunghezza (1.27 Å).
1.23 Å
1.36 Å
1.27 Å.
1.27 Å.
— COO
:::
:
-H+

acidità: effetto induttivoacidità: effetto induttivo
COOHH
CH3 COOH
CH3CH2 COOH
CH2 COOHCl
C COOHCl
Cl
Cl
Ka = 2.1 • 10-4Ka = 2.1 • 10-4
Ka = 1.8 • 10-5Ka = 1.8 • 10-5
Ka = 1.4 • 10-5Ka = 1.4 • 10-5
Ka = 1.5 • 10-3Ka = 1.5 • 10-3
Ka = 2 • 10-1Ka = 2 • 10-1
CH2 COOHCl Ka = 0,7 • 10-4Ka = 0,7 • 10-4CH2

Gli ioni fenossido sono, analogamente agli ioni carbossilato, stabilizzati per risonanza, ma i fenoli sono molto meno acidi degli acidi carbossilici perché le forme limite dell’ibrido di risonanza dello ione fenossido non sono tutte equivalenti
R-CO
O
In alcune la carica negativa si trova sul carbonio anziché sull’ossigeno ed in queste si perde l’aromaticità del sistema.
Nello ione carbossilato, invece le forme di risonanza sono equivalenti.

acido benzoicoacido benzoico
HOC
O
Ka = 6.3 • 10-5Ka = 6.3 • 10-5acido p-nitrobenzoicoacido p-nitrobenzoico
Ka = 4 • 10-4Ka = 4 • 10-4
HOC
O
NO2

RO
OC
i gruppi elettronattrattorifanno aumentare l’acidità perchéstabilizzano l’anione carbossilato
i gruppi elettronattrattorifanno aumentare l’acidità perchéstabilizzano l’anione carbossilato

RO
OC
i gruppi elettronrepulsorifanno diminuire l’acidità perché
rendono meno stabile l’anione carbossilato
i gruppi elettronrepulsorifanno diminuire l’acidità perché
rendono meno stabile l’anione carbossilato

gli acidi bicarbossilici danno luogo a due equilibri di dissociazione acidagli acidi bicarbossilici danno luogo a due equilibri di dissociazione acida
COOH
COOH
(CH )n2
COOH
COO-
(CH )n2
COO-
COO-
(CH )n2
K1 K2
acidi bicarbossiliciacidi bicarbossilici
aciditàacidità

la presenza di un secondo gruppo carbossilico (elettron attrattore) stabilizza per risonanza l'anione carbossilato, determinando un aumento della acidità, tanto maggiore quanto più i due gruppi sono vicini
la presenza di un secondo gruppo carbossilico (elettron attrattore) stabilizza per risonanza l'anione carbossilato, determinando un aumento della acidità, tanto maggiore quanto più i due gruppi sono vicini
COOH
COOH
COOH
CO
O
acidi bicarbossilici - aciditàacidi bicarbossilici - acidità

Effetto dei Sostituenti sull'Acidità di vari Composti

R
OH
O
C NaOH+ R
O-
O
C
Na+
+
Trasformazione degli acidi in saliTrasformazione degli acidi in sali
H2O
-ico diventa - ato

CH3COO- Na+
(CH3CH2COO- )2 Ca++etanoato di sodio(acetato di sodio)
etanoato di sodio(acetato di sodio)
propanoato di calciopropanoato di calcio
Cl
1
6
4
5
3 2
O- K+
CO
OH
3-cloro-4-idrossiBenzencarbossilato (benzoato) di potassio3-cloro-4-idrossiBenzencarbossilato (benzoato) di potassio
i salii sali

I metodi di preparazione degli acidi1. Ossidazione degli alcoli primari e delle aldeidi
2. Ossidazione delle catene laterali alchiliche di anelli aromatici
3. Reazione di reattivi di Grignard con biossido di carbonio
4. Idrolisi dei cianuri alchilici

Reazioni di ossidazioneReazioni di ossidazione
Ossidazione degli alcoli primari e delle aldeidi
Agenti ossidanti
KMnO4 CrO3 HNO3
E solo per le aldeidi AgNO2
O2 Co(III) CH3COOH

etanoloetanolo etanaleetanale
Gli alcoli primari si ossidano ad aldeidi.Gli alcoli primari si ossidano ad aldeidi.
C
OH
H H
C HH
H
C
C H
H
H
HOCr2O7
-- (H+)
Cr+++
C
C H
H
H
OHOC
C H
H
H
HO
etanaleetanale ac. etanoicoac. etanoico
Per ulteriore azione degli ossidanti,le aldeidi si convertono in acidi carbossilici
Per ulteriore azione degli ossidanti,le aldeidi si convertono in acidi carbossilici
Giallo: la variazione di colore evidenzia la riduzione del cromo

Ossidazione delle catene laterali dei composti aromatici con KMnO4 e
calore

L’acido tereftalico uno dei prodotti di partenza per
preparare il Dacron (polietilene tereftalatoPET)
Si produce per ossidazione all’aria con il Co come catalizzatore dal:
p-xilene
O2 CoIII
CH3COOH
Il Dacron è una fibra che rimane inalterata
a contatto con l’umidità.

Ossidazione delle catene laterali dei
composti aromatici

Reazioni dei reattivi di Griganrd con CO2
• R-Mg-X + O C O → RCOOMgX
• RCOOMgX + HX RCOOH + MgX2
Idrolisi dei cianuri o nitrili
R –C N + H2OHCl
RCOOH + NH4+ +Cl-
I cianuri si preparano dagli alogenuri alchilici

Metodo di sintesi: carbonilazione con reattivo di Grignard
H3C — Mg — Br
H3C :– +Mg — Br
- +
carbanione
Attacco nucleofilo
La protonazione del carbossilato intermedio
può essere fatta con HCl
base e nucleofilo fortissimoCome si prepara?

Idrolisi acida dei cianuri o nitrili
tautomeria

Come si prepara un cianuro alchilico?
• Facendo reagire un alogenuro alchilico con cianuro di sodio.
•Descrivi la reazione.

C
O
R R+
-
Nu_ C
O
R NuR
_
H3O+
C
OH
R NuR
Come reagiscono gli acidi carbossilici con i nucleofili?
Le aldeidi e i chetoni danno reazioni di addizione
Gli acidi carbossilici danno reazioni di sostituzione dell’ossidrile

derivati degli acidi carbossiliciderivati degli acidi carbossilici
OH
O
CR
X
O
CR?
Sostituzione nucleofila dell’ossidrile
Sostituzione nucleofila dell’ossidrile

acidi carbossilici:sostituzione nucleofila
acidi carbossilici:sostituzione nucleofila
RO
OC
HNu..
RO
CNu
sp2
sp2
H+

I derivati degli acidi carbossilici sono definiti in base alle caratteristiche
del nucleofilo entrante
I derivati degli acidi carbossilici sono definiti in base alle caratteristiche
del nucleofilo entrante

derivati degli acidi carbossilicisostituzione nucleofila
derivati degli acidi carbossilicisostituzione nucleofila
RX
OC+
-
Nu..
X- NH2 ⇒ammide OR’ ⇒ estere OCOR” ⇒ anidrideF,Cl,.. ⇒ alogenuro acilico
Nu: H2O, OH-, NH3, R-OHNu: H2O, OH-, NH3, R-OH
RNu
OC+
-
+ ..

Reattività Relativa dei Derivati degli Acidi nelle Sostituzioni Nucleofile Aciliche
C
O
R NH2
C
O
R OR'C
O
R OC
O
RC
O
R Cl
Ammide Estere Anidride Cloruri acilici
REATTIVITÀ

Nomenclatura degli alogenuri acilici

OR’
OCR
NH2 (NHR,NR2)
O
CR
esteriesteri
ammidiammidi
Se il nucleofilo è un gruppo -OR si forma un estereSe il nucleofilo è un gruppo -OR si forma un estere
SR’
OCR tioesteritioesteri
Si ottengono dalla reazione, a caldo, di un acido carbossilico con un alcol in ambiente acido
Se il nucleofilo è un gruppo -SR si forma un tioestereSe il nucleofilo è un gruppo -SR si forma un tioestere
Se il nucleofilo è un gruppo -NH2 si forma un’ammide
Se il nucleofilo è un gruppo -NH2 si forma un’ammide

OCR
O
CR
Cl (Br)
O
CR
O
alogenuri acilicialogenuri acilici
anidridianidridi
Se il nucleofilo è un gruppo -OCOR si forma un’anidrideSe il nucleofilo è un gruppo -OCOR si forma un’anidride
Se il nucleofilo è un alogeno si forma un alogenuro acilico
Se il nucleofilo è un alogeno si forma un alogenuro acilico

H3C CO
OH H O CH3
H3C CO
OCH3
H2O
OR’
OCR esteriesteri
Gli esteri sono il prodotto di condensazione di una molecola di acido con una molecola di alcol
Gli esteri sono il prodotto di condensazione di una molecola di acido con una molecola di alcol
Derivano dagli acidi per sostituzione del gruppo OH con il gruppo OR’
Quindi la nomenclatura è analoga a quella dei sali

CH3CH2 C O
O
CH
propanoato di 2-butilepropanoato di 2-butile
CH3
CH2
CH3
nomenclatura degli esterinomenclatura degli esteri

CH3 C O
O
CH2CH3
etanoato di etile
nomenclatura degli esterinomenclatura degli esteri
(acetato di etile)

CH3 C O
O
CH2
acetato di benzileacetato di benzile
C O
O
CH2CH3
benzencarbossilato di etile(benzoato di etile)
benzencarbossilato di etile(benzoato di etile)
nomenclatura degli esteri
nomenclatura degli esteri

CO O
CH2
C
CH2
CH2CH3
CH3
CH3Cl
-3-metil-3-cloropentanoato -3-metil-3-cloropentanoato di etiledi etile-3-metil-3-cloropentanoato -3-metil-3-cloropentanoato di etiledi etile
nomenclatura degli esterinomenclatura degli esteri

nomenclatura degli esterinomenclatura degli esteri

Conversione ad Esteri:
CO- Na+
O
R
Carbossilato di Sodio
H3C ISn2
COCH3
O
R
Carbossilato di Metile(un estere)
Esterificazione di Fischer:
COH
O
R + R' OH COR'
O
R + H2OH2SO4
Acido carbossilico Alcol Estere

H3C CO
OH H O CH3
H3C CO
OCH3
H2O
Nucleofilo uscente
Nucleofilo entrante
Esterificazione di FischerEsterificazione di Fischermeccanismo della reazione di sostituzione nucleofila acilica meccanismo della reazione di sostituzione nucleofila acilica
In due stadi:1. addizione del nucleofilo entrante
2. eliminazione del nucleofilo uscente
H+

Nella prima tappa del processo l’acido viene protonato H2SO4 o HCl forniscono i protoni.
Nella prima tappa del processo l’acido viene protonato H2SO4 o HCl forniscono i protoni.
H+
H3C CO
OH
H3C COH
OH
OH+
H3C COH
OH
OH+ H3C C
OH
OH
OH
+
L’acido protonato è stabilizzato per risonanza

Nella seconda tappa del processo l’acido protonato viene attaccato dall’alcol (nucleofilo entrante).
Nella seconda tappa del processo l’acido protonato viene attaccato dall’alcol (nucleofilo entrante).
H
O CH3+ C
OH
HO
CH3
H3C
OH
+H3C COH
OH
OH+
C
OH
O CH3H3C
OH
La trasposizione di un protone“prepara” il nucleofilo uscente H2O
La trasposizione di un protone“prepara” il nucleofilo uscente H2O
C
OH
H
O CH3H3C
OH+
sp3

nell’ultima tappa si elimina una molecola di acqua (nucleofilo uscente) ...
nell’ultima tappa si elimina una molecola di acqua (nucleofilo uscente) ...
C
OH
H
O CH3H3C
OH+ HOH
C
O
O CH3H3C
H+
C
OH
O CH3H3C+
... ed il protone catalitico, con formazione dell’estere. ... ed il protone catalitico,
con formazione dell’estere.
C
O
O CH3H3C
+ H

• 1° tappa?Formazione e stabilizzazione per risonanza
dell’acido protonato come?
• 2° tappa? Attacco dell’alcool nucleofilo entrante
trasposizione di un protone • 3° 4° tappa?
eliminazione di una moecola d’acqua
eliminazione del protone catalitico
• 5° tappa?
• 6° tappa?

H3C CO
OH H O CH3
H3C CO
OCH3
H2O
Eccesso di alcol e ambiente anidro Estere
Eccesso di acqua Idrolisi dell’estere
L’esterificazione è una reazione di equilibrio L’esterificazione è una reazione di equilibrio

compiti
• Pag. 265 n.10.13
• Pag. 26 n. 10.14, 10.15
• Pag.267 n. 10.16
• Pag.269 n. 10.17

C
OH
O
OH
O
O
H2O
C
OH
O
O
HO
O H2O
-idrossiacido(valerianico)-idrossiacido(valerianico)
-lattone-lattone
-idrossiacido-idrossiacido -lattone-lattone
per esterificazione interna dei - e dei -ossiacidi si formano i lattoni (esteri ciclici)
per esterificazione interna dei - e dei -ossiacidi si formano i lattoni (esteri ciclici)

H3C C
O
O HOHH3C CO
O CH3
O CH3
H3C CO
O
CH3OH
idrolisi basica degli esteri:saponificazione
idrolisi basica degli esteri:saponificazione
nucleofiloentrante
nucleofiloentrante
nucleofilouscente
nucleofilouscente
reazioneacido/basereazione
acido/basel’idrolisi basica degli esterinon è una reazione di equilibrio
l’idrolisi basica degli esterinon è una reazione di equilibrio
anione dell’acidoanione dell’acido alcoolalcool

H3C C
O
O HOHH3C CO
O CH3
O CH3
NucleofiloNucleofiloentranteentrante
NucleofiloNucleofiloentranteentrante
Reazione di saponificazione
K+ o Na+
(ambiente basico)
estere
H3C CO
O
CH3OH
K+ o Na+ alcolcarbossilato (sapone)
Il nucleofilo
uscito
funge ora
da base
prendendo il protone ceduto
dall’acido
carbossilico
1
23
4 O CH3
NucleofiloNucleofilouscenteuscente
NucleofiloNucleofilouscenteuscente

saponificazione
• La saponificazione è l'idrolisi di un estere in condizioni basiche e provoca la formazione di un alcool e del sale dell'acido corrispondente.
• I saponi sono di solito sali di sodio di acidi carbossilici a lunga catena.
• Al termine della reazione viene aggiunto cloruro di sodio per facilitare la precipitazione del sapone.
3

• Saponi R - C – O gruppo carbossilato
O
R1COO Na HO CH2
CHHO
-
CH2HOR3 C
O
O CH2
R2 C
O
O CH
CH2O
O
CR1
+
+-R2COO Na
+-R3COO Na
+
CH2OH
O
OHCR3 R3 C
O
O CH2
R2 C
O
O CH
CH2O
O
CR1R1 C OH
O
H O CH2
CHOH
O
OHCR2

Azione detergente del sapone
Estremità idrofobica
testa idrofilica o polare
coda idrofobica o apolare
micella

• sono composti fondamentali nella preparazione
dei detergenti
• sono sostanze che diminuiscono la “tensione
superficiale” dell’acqua
I tensioattivi

Categorie Gruppi chimici Proprietà
Tensioattivi anionici:•Saponi
•Tensioattivi anionici sintetici
Gruppo carbossilato
Gruppo solfato
Gruppo solfonato
Biodegradabili, poco costosi, basso potere detergente in acqua dura, possono aggregare sostanze per addolcire l’acqua, imprimono pH alcalino alle soluzioni acquose
Elevato potere detergente; economici, poco sensibili alla durezza, molto aggressivi verso pelle e capelli
Tensioattivi cationici
Sali di ammonio Non sono buoni agenti lavanti, sono presenti nei cosmetici, hanno un elevato potere antimicrobico, si usano nelle soluzioni disinfettanti.
Tensioattivi anfoteri
Betaine
Solfobetaine
Sono poco costosi, hanno maggiore affinità con la pelle, un moderato effetto detergente, sono usati per l’igiene delle pelli delicate, dei capelli sottili ed infantili e per l’igiene intima.
Tensioattivi non ionici
Gruppo con funzione non idrolizzabile ma con caratteristiche polari
Hanno buon potere detergente, producono poca schiuma, sono utilizzabili nelle lavatrici, sono poco influenzati dalla durezza dell’acqua.

Il tensioattivo è un composto organico caratterizzato da una parte lipofila e una parte idrofila.
Parte lipofila: è generalmente costituita da una catena idrocarburica lunga da 10 a 20 atomi di carbonio, insolubile in acqua.
Parte lipofila Parte idrofila
I tensioattivi si dividono:
Tensioattivi anionici se la parte idrofila è formata da un anione;
Tensioattivi cationici se la parte idrofila è formata da un catione;
Tensioattivi anfoteri se la parte idrofila è formata da un gruppo con doppia carica, positiva e negativa;
Tensioattivi non ionici se la parte idrofila è priva di carica, ma contiene legami polari.
Classificazione dei tensioattivi
Parte idrofila: può essere di vari tipi ma sempre solubile in acqua.

I saponi promuovono la formazione della schiuma (emulsione di aria in acqua)
Introducendo un tensioattivo in acqua, questo si dispone con la parte idrofila nell’acqua.
A causa delle forze esercitate dall’acqua la superficie si incurva sino a formare delle bolle, ovvero micelle contenenti aria

sostituzione nucleofila negli esteri sostituzione nucleofila negli esteri
C
O
OR’R
H2OH+
C
O
OHR
R’’OHH+
C
O
OR’’R
NH3 C
O
NH2R
OH- C
O
O-R
+ R’OH
idrolisi acida
alcolisitransesterificazione
ammonolisi
idrolisi basica

Le Reazioni degli Esteri
C
O
R OR
Estere
H2O
(H+ o OH-)
C
O
R OH
AcidoNH3
C
O
R NH2
Ammide
LiAlH4
CR OH
H H
Alcol 1o
R'MgX
CR OH
Alcol 3o
R' R'

R CO
S CH3
R CO
OH HS CH3
H2O
tioesteritioesteri

HSCoA
CH3 C
O
SCoA
acetilcoenzima Aacetilcoenzima A
Coenzima A Coenzima Aacido aceticoacido acetico
O
CH3 C OH

NH
CO
CH2 CH2 S CO
CH3
CH2 CH2
NH C O
C OHH
C CH3H3C
CH2
O
P OO
O
P O
O
OO
OPO3H2
H H
OH
H
N
NN
N
NH2
acetilcoenzima Aacetilcoenzima A
CH2

H3C CO
OH H N RH3C C
O
N R
H2O
N
OCR ammidiammidi
Le ammidi sono il prodotto di condensazione di una molecola di acido con una molecola di ammina
Le ammidi sono il prodotto di condensazione di una molecola di acido con una molecola di ammina
+

NH2
OCR
Ammidi primarie legano 1 solo acileAmmidi primarie legano 1 solo acile
N
OCR R
H
OCR
NR
R
ammide primariaammide primaria
ammide primariamono alchil sostituita
ammide primariamono alchil sostituita
ammide primariadi alchil sostituitaammide primariadi alchil sostituita

nomenclatura delle ammidinomenclatura delle ammidi
CH3 C
O
NH2 CH3 C
O
NH
CH3
CH3 C
O
N
CH3
CH2CH3
N-metil-etanammideN-metil-acetammide
N-metil-etanammideN-metil-acetammide
etanammideacetammide
etanammideacetammide
N-metil, N-etil-etanammideN-metil, N-etil-etanammide

C
O
N C
O
H
H3C C
O
N C
O
C O
CH3
trietanammide(triacetammide)trietanammide
(triacetammide)
dietanammide(diacetammide)dietanammide
(diacetammide)
benzenammide(benzammide)benzenammide(benzammide)
CH3
CH3H3C
ammide primariaammide primaria
ammide secondaria (2 acili)ammide secondaria (2 acili)
ammide terziaria (3 acili)ammide terziaria (3 acili)
CO NH2

C
O
N
H
.. R’R
mesomeria delle ammidimesomeria delle ammidi
C
O
N
H
R’R
C
O
N
H
R’R+
-

le ammidi sono meno basiche delle ammine
le ammidi sono meno basiche delle ammine
basicità delle ammidibasicità delle ammidi
il lone pairè meno disponibile
il lone pairè meno disponibile
C
O
N
H
.. R’R
C
O
N
H
R’R+
-

C C
O
CN
H
-
+
planarietà delle ammidiplanarietà delle ammidi
sp2sp2 6 atomi giaccionosullo stesso piano6 atomi giaccionosullo stesso piano

tautomeria delle ammiditautomeria delle ammidi
C
O
N
H
.. R’R
C
O
N
H
R’R+
-
C
O
N
H
R’R+
-
..

H3C CO
N H
H
H3C CN H
H
O
H3C CN H
H
OH3C C
N
H
O H
risonanzarisonanza
tautomeriatautomeria

acido carbonicoacido carbonico
ureaurea
CONH2
NH2
acido carbammicoacido carbammico
COOH
NH2
COOH
OH
carbammil fosfatocarbammil fosfato
COOPO3H2
NH2
CHNNH2
NH2
guanidinaguanidina
L’acido carbammico e l’urea sono la monoammide e la diammide dell’acido carbonico
L’acido carbammico e l’urea sono la monoammide e la diammide dell’acido carbonico

Alogenuri Acilicie
Anidridi

H3C CO
Cl
CO
Cl
C
CH3
CH3
H3C CO
Br
cloruro di benzoilecloruro di benzoile
cloruro di etanoilecloruro di etanoile
bromuro di dimetilpropanoilebromuro di dimetilpropanoile
Tra i derivati degli acidi
carbossilici sono i più reattivi
I cloruri sono meno
costosi

H3C CO
ClHCl O
C
C
O
O
CH3
H3C CO
OH
300°C
anidride etanoica(anidride acetica)anidride etanoica(anidride acetica)
acido cis-butendioico(acido maleico)
anidride butendioica(anidride maleica)
anidride butendioica(anidride maleica)
H2O O
O
O
H
H
O
OHC
COH
O
H
H
CH3

Nomenclatura delle Anidridi
CH3(CH2)5C C(CH2)5CH3
O O
O
Anidride eptanoica
O OO
Anidride succinica
CH3(CH2)2C CCH3
O O
O
Anidride aceticobutirrica

L’idrolisi di tutti i derivati degli acidi
carbossilici è una reazione di
Sostituzione Nucleofila

R CO
XO
H
HR C
O
OHH+ X-
nucleofiloentrante
nucleofilouscente
Reattività dei derivati degli acidi carbossiliciReattività dei derivati degli acidi carbossilici
R CO
Cl
R CO
OC
OR
R CO
O R'R C
O
NH
R'

Idrolisi di una ammide in ambiente acido

H3C C
OH
H3C CO
NH2
H3C C
OH
O
H
H
H+OH2
H3C C
OH
O
NH2
H
H
NH3COH
OH
nucleofiloentrante
nucleofiloentrante
nucleofilouscente
nucleofilouscente
H3C
CO
OHH3C
NH4
NH2 NH2

Idrolisi di una ammide in ambiente basico

H3C C
O
O H
NH
R'
OHH3C CO
NH
R'
H3C C
O
O
NH
R'
H
H3C C
O
O NH
R'
H
nucleofiloentrante
nucleofiloentrante
nucleofilouscente
nucleofilouscentel’idrolisi basica delle ammidi
non è una reazione di equilibriol’idrolisi basica delle ammidi
non è una reazione di equilibrio

Alcolisi di un alogenuro acilico

H3C CO
ClO
H
CH3 H3C C
O
O
H
CH3
Cl
H3C C
O
O CH3H3C C
O
OCH3
HCl
nucleofiloentrante
nucleofiloentrante
nucleofilouscente
nucleofilouscente
estereestere

Alcolisi di una anidride

H3C CO
OC
OH3C
O
H
CH3 H3C C
O
O
H
CH3
OC
OH3C
H3C C
O
O CH3H3C C
O
OCH3
CH3COOH
nucleofiloentrante
nucleofiloentrante
nucleofilouscente
nucleofilouscente
estereestere

sostituzione nucleofila nelle ammidi sostituzione nucleofila nelle ammidi
C
O
NH2R
H2OH+
C
O
OHR
R’OHH+
C
O
OR’R
OH- C
O
O-R
+ NH3
idrolisi acida
alcolisi
idrolisi basica

Condensazione di Claisen

CO
O-C2H5
C
H
H
H
H+C
O
O-C2H5
CH
H
Acidità degli idrogeni in al gruppo carbossilicoAcidità degli idrogeni in al gruppo carbossilico
L’anione è stabilizzato per risonanza
L’anione è stabilizzato per risonanza
EsteriEsteri
CO
CH
H
O-C2H5

C
H
H
HO
O-C2H5
C
La Condensazione di Claisen avviene in ambiente basicoLa Condensazione di Claisen avviene in ambiente basico
E’ data da Esteri che possiedono H sul CE’ data da Esteri che possiedono H sul C
anione stabilizzato per risonanza
anione stabilizzato per risonanza
attacco nucleofiloattacco nucleofilo
cheto esterecheto estere
C2H5O-
C2H5OH
C
H
H
HO
CO-C2H5
C
H
H OC
O-C2H5
H C
H
H
C
O
C
H
H
CO
O-C2H5
C2H5O-
SostituzioneNucleofila
SostituzioneNucleofila

C
H
H
HO
O-C2H5
C
C2H5O-
C2H5OH
C
H
H OC
O-C2H5
Alcune considerazioni sulla Sintesi di ClaisenAlcune considerazioni sulla Sintesi di Claisen
C
H
H
HO
O-C2H5
COH-
C
H
H OC
OHH
C2H5O-
Perchè non usare la base OH- ?Perchè non usare la base OH- ?
Perchè ciò provocherebbe l’idrolisi dell’esterePerchè ciò provocherebbe l’idrolisi dell’estere

Le Reazioni degli Acidi Carbossilici
Riduzione ad Alcoli:
COH
O
R1) LiAlH4
2) H3O+CH2OHR
Conversione a Cloruri acilici:
COH
O
R SOCl2
CHCl3
CCl
O
R + HCl + SO2
Conversione ad Anidridi:
COH
O
H3C2Calore
C
O
H3C C
O
CH3
O+ H2O