5 C 2007 Aprile Chimica Nucleare
-
Upload
leodolcevita -
Category
Business
-
view
804 -
download
1
Transcript of 5 C 2007 Aprile Chimica Nucleare

La scoperta della radioattività naturale
Henri Becquerel, scopritore della radiazione emessa dall’uranio (1896) e delle sue proprietà di “impressionare” lastre fotografiche. Per la sua scoperta fu insignito del premio Nobel per la Fisica.
Marie Curie, studentessa all’epoca della scoperta di Becquerel, decise di occuparsi dello studio dell’uranio mentre il resto della comunità scientifica era concentrato sulla produzione e applicazioni dei raggi X. Ella realizzò che la radioattività era una proprietà dell’atomo di uranio. Scoprì, anche, il plutonio e divenne una pioniera nell’utilizzazione in medicina dei raggi X. Fu insignita di due premi Nobel per la Fisica e la Chimica.
Il termine “radioattività fu coniato da Marie Curie per descrivere gli effetti dell’uranio, all’epoca misteriosi, e della sua produzione di “raggi invisibili”. Il termine si riferisce alla particolare “attività” del radio, minerale anch’esso studiato dalla Curie.

-1896 H.Becquerel, possedeva pietrefluorescenti e alla scoperta dei raggi X (allora rivelati con lastre fotografiche) volle provare se questi venivano emessi dalle sue pietre. Espose al sole un solfato doppio di U e K (uranile), e notò che il minerale impressionava una lastra fotografica. In un periodo senza sole mise in un cassettoun pezzo di uranile sopra una chiave ed una lastra fotografica incartata
Il sole non tornò, ma H.B. decise di sviluppare comunque la lastra; con grande stupore la trovò impressionata dal minerale con dentro la forma della chiave. Comprese che il minerale da solo emanava una radiazione nuova che nulla aveva a che fare con la luminescenza, era la Radioattività.

Un nucleo atomico è caratterizzato da:
•numero atomico (Z) che indica il numero di protoni
•numero di massa (A) che rappresenta il numero totale di nucleoni presenti nel nucleo atomico.
Se indichiamo con N il numero di neutroni, possiamo scrivere: A=N+Z.
NAZ X

• ISOBARI Nuclidi con eguale numero di massa A
• ISOTOPI Nuclidi con eguale numero atomico Z
• ISOTONI Nuclidi con eguale numero di neutroni N

Isotopi Stabili
protoni
neutroni

Per nuclei leggeri la configurazione nucleare risulta stabile quando Z = N.
Al crescere di Z il numero di neutroni necessari a garantire la stabilità aumenta.
Per Z > 20 N deve essere > Z
Tale andamento è ben descritto dalla così detta curva di stabilità

Il fenomeno della radioattività
.
.
..
. .
.
..
.
..............

Radiazioni alfa, beta e gamma
Le radiazioni sono poco penetranti e possono essere completamente bloccate da un semplice foglio di carta o dalla pelle
•Le radiazioni beta sono più penetranti di quelle a, ma sono bloccate da piccoli spessori di materiali metallici
sono molto penetranti, e per bloccarle occorrono materiali ad elevata densità come il piombo

2 PROTONI2 NEUTRONI
Particella Particella
....

Particella
.1 ELETTRONE

La radiazione radiazione è un'ondaonda elettromagneticaelettromagnetica:
Ad elevatissima frequenzaelevatissima frequenza originata da 1 nucleo che sta cedendo parte della
sua energia.
RaggioRaggio

numero di neutroni N
num
ero
di pro
toni Z
decadimento +
p n + e+ + AXz Ayz-1 +e++
decadimento -
n p + e- + AXz Ayz+1 +e-+
Decadimento
HeXX 42
4A2Z
AZ
I decadimenti radioattivi
Processi in cui un radionuclideradionuclide si “rompe” emettendo particelle
A=Z+N
Decad.
+
Decad.
-

Molto frequentemente il nucleo “figlio” viene prodotto in un stato eccitato e si diseccita emettendo radiazione gamma
(60Co 60Ni* + e- + )
Emissione
60Ni* 60Ni +
Decadimento 60Ni*
60Ni
La diseccitazione gamma

nuclidi sono tutti gli isotopi conosciuti di
ciascun elemento chimico
• Stabili: 279
• Instabili: ~ 5000

Il primo decadimento radioattivo (da qui il nome alfa) fu scoperto da Rutherford nel 1899. Le particelle α sono nuclei di elio, cioè nuclei particolarmente stabili formati da due protoni e due neutroni (Z=2 ed A=4).
Sono soprattutto i nuclei pesanti (A>200) e deficienti in neutroni ad essere interessati da questo processo nucleare.
HeYX AZ
AZ
42
42
He42
Esempio:
ThU 23490
23892
600.190
90234:
587.192
92238:
23490
23892
p
nTh
p
nU
Decadimento alfa

Fissione dell’uranio 238
prima …………………………….. dopo
92U238 90Th234 +
2He4
92U238
protoni (92)neutroni (146)
nella reazione scompare il nucleo di uranio (U) si trasforma in un nucleo di elio (He) e uno di torio (Th)
2He4
90Th234

Col termine decadimento β intendiamo l’emissione spontanea da parte di un nucleo di
•un elettrone (decadimento β-)•un positrone (decadimento β+)
Oppure la cattura di un elettrone atomico (Cattura Elettronica o E.C.)
aElettronic Cattura
β odecadiment
β odecadiment -
e
e
e
nep
enp
epn
Si tratta di un processo di interazione debole ed è preponderante tra i nuclei instabili.
Se riscriviamo le precedenti in termini di nucleo atomico abbiamo:
aElettronic Cattura
β odecadiment
β odecadiment
1
1
-1
eA
ZAZ
eA
ZAZ
eA
ZAZ
YeX
eYX
eYX
La trasformazione non comporta alcuna variazione del numero di massa A, e per questo motivo le trasformazioni sono dette trasformazioni isobariche.
Decadimento beta

decadimento β-: avviene per quei nuclei in cui vi è un eccesso di neutroni
decadimento β+: avviene per quei nuclei in cui vi è un eccesso di protoni
Decadimento beta

Un nucleo formatosi in seguito ad un decadimento radioattivo può ritrovarsi nel suo stato fondamentale oppure trovarsi in uno dei suoi stati eccitati.
Come avviene per l’atomo, anche il nucleo si porterà nella configurazione più stabile emettendo radiazione elettromagnetica corrispondente al salto energetico dei livelli interessati. A questa radiazione elettromagnetica viene dato il nome di emissione gamma (o raggi γ).
hE
Il passaggio dallo stato eccitato allo stato fondamentale può avvenire in una sola transizione dando in questo modo origine ad un fotone γ di energia Eγ pari al salto energetico tra
il livello eccitato e lo stato fondamentale, o attraverso più transizioni intermedie, dando in questo modo origine a diversi fotoni γ in cascata.
Co
Ni
60
60
0 keV
1333 keV
2159 keV
2506 keV
2626 keV
L’emissione gamma

Schermi protettiviSchermi protettivi


IL DECADIMENTO RADIOATTIVOIL DECADIMENTO RADIOATTIVO
Consideriamo un nucleo instabile in un dato istante; questo si trasformerà in un nucleo stabile (dopo una o più trasformazioni) attraverso un dato processo radioattivo. E’ impossibile prevedere quando un dato nucleo si trasformerà; possiamo solamente definire una certa probabilità di trasformazione in un’unità di tempo data. Questa probabilità è la stessa per tutti i nuclei di un dato nuclide e si mantiene costante nel tempo.
costante radioattiva λ [s-1]( = probabilità nell’unità di tempo)
ESEMPI: Un nucleo di:
60Co probabilità di 1/240 milioni di disintegrarsi in un secondo
238U probabilità di 1/(2·1017)
219Rn probabilità di circa 1/6

Legge del decadimento radioattivoIl decadimento radioattivo avviene con la legge statistica:
N = numero di atomi presenti al tempo t;=costante di decadimento: probabilità che ogni singolo nucleo ha di decadere nell’unità di tempo.
ΔN / Δ t = -N = A
La legge del decadimento radioattivo:
N0 = numero di nuclidi presenti all’istante t=0
N(t) = N0e-t
Nel Sistema Internazionale l'attivitàattività si misura in Bequerel (Bq), 1 Bq = 1 disintegrazione/secondo1 Bq = 1 disintegrazione/secondo.
In passato veniva utilizzato il CurieCurie (CiCi), equivalente a 37 GBq (numero di disintegrazioni/secondo in 1 g di Radio - 226).
attivitàattività

Se il numero di nuclidi all’istante t è
Nt = N0 e -λt
Dato che la massa dipende dal numero di atomi
possiamo anche scrivere che mt = m0 e -λt
• È il tempo dopo il quale il numero iniziale di nuclei radioattivi è diventato la metà, esso si esprime come:
T1/2= ln2/λ T1/2 = 0,693/λ
Tempo di dimezzamento

/00
tt eAeAtA
La legge del decadimento radioattivo
1/2 , o tempo di dimezzamento, è anche quello in cui l’ “attività” si dimezza, cioè A(1/2) = 0.5 A0
Perciò
1/2 = 0.693
è la “vita media”.

parametriparametri
• N(t)N(t) = numero di nuclidi all’istante t• NN00 = numero di nuclidi all’istante iniziale• e e = numero di Nepero, base dei logaritmi
naturali (e = 2.718) costante di decadimento, equivalente a
0.693/ 1/2 , cioè probabilità di decadimento per unità di tempo, riferita ad un singolo nuclide
= 1/vita media del radioisotopo. (Tempo che mediamente trascorre tra l'istante in cui esso viene prodotto e quello in cui decade)

Radiazione cosmica:Raggi cosmici primariRaggi cosmici secondari
Radioattività naturale:Radionuclidi isolatiFamiglie radioattive naturali
Radioattività artificiale.
L’origine della radiazione

La fisica delle particelle elementari
Un viaggio dentro la materia

Ma i protoni e i neutroni sono fondamentali?
il nucleo è fatto di protoni (p), carichi positivamente,
e neutroni (n), privi di carica

Dopo molti esperimenti gli scienziati ora credono che
i quark e gli elettroni (e qualche altra particelle che tra
poco vedremo) siano fondamentali
I fisici hanno scoperto che i protoni e i neutroni sono composti di
particelle ancora più piccole, chiamate quark
Per quanto ne sappiamo fino ad ora, i quark non sono
fatti di nient’altro: sono FONDAMENTALI

Questa è la catena che ha portato i
fisici del secolo scorso alla
scoperta dell’infinitamente
piccolo: ma le particelle sono
molte!

I fisici hanno sviluppato una teoria chiamata Modello Standard
che spiega di cosa il mondo è fatto e cosa lo tiene assieme Il Modello Standard spiega tutte le centinaia di particelle e le
complesse interazioni che le legano con una semplice ricetta:
6 quark (che formano le particelle più pesanti, tra cui protone e neutrone)
6 leptoni (particelle più leggere, tra cui l’elettrone)
Particelle che trasportano le forze ( fotoni, bosoni nucleoni )
+
+

Ci sono sei quarksei quark, raggruppati in tre coppie: up/downup/down (su/giù), charm/strangecharm/strange
(incanto/strano) e top/bottomtop/bottom (cima/fondo)
QuarkLa maggior parte della materia che ci circonda è fatta
di protoni e neutroni, che sono composti di quark
Il quark più misterioso, il quark topquark top, fu scoperto nel 1995, mentre la sua esistenza
era stata teorizzata venti anni primaventi anni prima!
I quark hanno carica elettrica frazionaria

…che sono fatti di tre quark…che sono fatti di un quark
e di un antiquark
i quark si combinanoin modo da formare particelle (chiamate adroniadroni) con
carica elettrica intera
Ci sono due tipi di adroni:
Barioni (dal greco=pesanti) Mesoni (dal greco=in mezzo)

Leptoni
Sono un altra famiglia di particelle di materia, che a differenza dei quark non stanno uniti ma preferiscono vivere da soli…
Ci sono sei leptoni, tre con carica elettrica e tre neutri
Il leptone carico più famoso e’ l’elettrone.l’elettrone.Poi ci sono due elettroni più pesanti, il muonemuone e il tautau

Gli altri tre leptoni sono i tre tipi di neutrinoneutrino. Essi non hanno carica elettrica, sono leggerissimi e difficilissimi da “vedere”
I neutrini sono stati previsti come spiegazione alla massa mancante nel decadimento del neutrone (E. Fermi)

Per ogni tipo di particella di materia che abbiamo incontrato finora esiste anche una particella di antimateria, chiamata
antiparticella
Le antiparticelle sono uguali alle corrispondenti particelle di materia, ma hanno carica elettrica
oppostaQuando una particella e la corrispondente
antiparticella si scontrano, si annichiliscono in pura energia!

Finora sono state scoperte circa 200 particelle, che sono composte dai mattoncini che abbiamo visto in
precedenza: troppe?
Enrico Fermi una volta disse ad un suo studente:
““Giovanotto, se fossi in grado di ricordarmi i nomi Giovanotto, se fossi in grado di ricordarmi i nomi di tutte queste particelle sarei stato un botanico!”di tutte queste particelle sarei stato un botanico!”

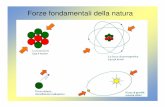
Ci sono quattro interazioni fondamentali tra le particelle, e tutte le forze possono essere attribuite a queste quattro interazioni.
Qualunque forza si consideri - l’attrito, il magnetismo, la gravità, le reazioni nucleari
e così via – è causata da una di queste quattro interazioni fondamentali:
Abbiamo visto quali sono le particelle fondamentali che compongono l’universo: ma come interagiscono tra loro?

Nel mondo delle particelle la forza di gravità ha un ruolo trascurabile
Ma cosa vuol dire che due particelle interagiscono?
Se due pattinatori sul ghiaccio si scambiano una palla, l’effetto di azione e reazione li farà spostare entrambi dall’equilibrio:
Allo stesso modo due particelle interagiscono scambiandosi una particella che trasporta la forza, spostandosi dall’equilibrio…

La forza elettromagnetica fa si che oggetti con la stessa carica si respingano e che oggetti con carica opposta si attraggano
Ad esempio la forza che tiene uniti gli atomi e che rende la materia “solida” e impenetrabile è di natura elettromagnetica!

La forza nucleare “forte” tiene assieme i protoni e i neutroni nei nuclei degli atomi, e lega i quark che
formano i protoni e i neutroni.
Poichè tiene assieme particelle con la stessa carica elettrica, che tendono a respingersi, deve essere una forza,
appunto, “forte”“forte”
Le particelle che mediano la forza “forte” tra i
quark sono chiamati “gluoni”“gluoni”, perchè tengono incollati
tra loro i quark (in Inglese glue=colla)

La forza nucleare “debole” è responsabile del decadimento di
quark e leptoni pesanti in quark e leptoni più leggeri
Quando una particella decade scompare, e viene rimpiazzata da due o più particelle diverse.
Ad esempio nel decadimento del neutrone:
Le tre particelle che mediano la forza “debole”, sono chiamate bosoni W+, W-, Z0
(scoperti da C. Rubbia nel 1983)
neutroneprotone

Reazioni nucleari
• Un nuclide, colpito da particelle con opportuna energia, si trasforma in un nuclide differente
• Nel 1919 Rutherford bombardò 14 N con particelle alfa e ottenendone 17O e un protone.

Lo strumento della prima trasmutazione nucleare
Rutherford Rutherford (1919)(1919)
Ancora non si conosceva l’esistenza del neutrone

Nel 1932 Chadwick scoprì il neutrone
Vai a: www-outreach.phy.cam.ac.uk beryllim radiation per vedere uscire i protoni


La radioattività artificiale(gennaio 1934)
produzione in laboratorio di sostanze radioattive artificiali a scopo di ricerca o per applicazioni mediche
I. Curie e F. Joliot
Bombardando 27Al con particelle alfa ottengono 30 P +n

Grazie ad una reazione nucleare sono stati ottenuti il Promezio e il Tecnezio
• 133Cs + 4 x 2H = 141Pr + 50.5 MeV

Il difetto di massa. L’energia di legame nucleare
• La massa di un nucleo è sempre inferiore alla somma delle masse dei singoli nucleoni
• La massa di un nucleo è data dalla somma della massa di ogni nucleone meno l'energia di legame, ovvero l'energia necessaria a riportare i nucleoni che compongono il nucleo al loro stato libero.

Per le reazioni nucleari l’energia si esprime in elettronvolt
• Simbolo eV
• Corrisponde all’energia acquisita da un
elettrone che passi tra due punti con differenza di potenziale di 1 volt.

L’energia di legame nucleare
È dovuta alle forze nucleari, che tengono legati fra di loro protoni e
neutroni dentro il nucleo
Quando il nucleo diventa troppo grosso, l’energia di legame diminuisce, perché diventa grande la forza di repulsione elettrica fra i protoni
Nei nuclei piccoli, aggiungendo un protone o un neutrone, l’energia di legame aumenta, perché si formano nuovi legami
I nuclei più stabili hanno una massa intorno a quella del ferro




I ragazzi di via Panisperna
Ettore MajoranaEttore Majorana
Emilio SegrèEmilio Segrè
Edoardo AmaldiEdoardo Amaldi
Enrico FermiEnrico Fermi

Enrico Fermi ed Emilio Segrè entrarono a far parte del progetto Manhattan chiamati dal coordinatore del progetto, Robert Oppenheimer.assieme ad un’ équipe di scienziati famosi in tutto il mondo (Bohr, Weisskopf, Wigner, von Neumann, Frisch, Teller, Chadwick, Fuchs e altri ancora) alla ricerca sperimentale per la costruzione della bomba atomica.
Le prime ricerche condotte da Fermi e il suo gruppo, mirarono soprattutto ad assicurare le condizioni necessarie per la produzione di energia dal processo di fissione nucleare.


CHERNOBYLIsotopo T1/2 Isotopo T1/2
99Mo 66 ore 134Cs 2.06 anni
103Ru 39.4 giorni
136Cs 13 giorni
106Ru 1 anno 137Cs 30.2 anni
131I 8.02 giorni
140Ba 12.8 giorni
132I 2.28 ore 140La 40.3 anni
132Te 3.3 giorni
90Sr 29.12 anni
I radioisotopi I radioisotopi
rilasciati rilasciati
nell’incidente di nell’incidente di
ChernobylChernobyl



• Conferenza di Potsdam è il nome dato all'ultimo dei vertici interalleati tenutosi dal 17 luglio al 2 agosto 1945.
• Nel corso dell'incontro i leader delle potenze vincitrici della seconda guerra mondiale (Stati Uniti, Inghilterra e Unione Sovietica) discussero e raggiunsero accordi sulla gestione dell'immediato dopoguerra.
Attlee, Truman, e Stalin a Potsdam
•Il 16 luglio si sperimenta la bomba atomica nel deserto del New Messico Truman si trova in Europa, alla Conferenza di Potsdam. Lo raggiunge un messaggio strano: «I bambini sono nati felicemente ». Significa che la bomba ha funzionato. Il Presidente si confida con Churchill, il quale lascerà scritto: «Resta il fatto storico, e sarà giudicato nei tempi venturi, che la scelta dell'uso o del non-uso della bomba atomica per costringere il Giappone alla resa non fu posta nemmeno. Attorno al nostro tavolo l'accordo fu unanime, automatico, né mai sentii soltanto accennare che si sarebbe potuto agire in modo diverso »

Il giorno della bomba
• Il 6 agosto 1945 alle 8,15 "la bomba" esplode a poco meno di seicento metri d'altezza, polverizzando all'istante ogni cosa su un'area di tre chilometri quadrati e soffiando un alito rovente (dai trecento ai novecentomila gradi) su una superficie assai più vasta.
• Gli abitanti di Hiroshima, dissolti, lasciano la loro ombra sulle pietre vetrificate.
• L'onda d'urto preme con la forza inconcepibile di settemila tonnellate per centimetro quadrato. Dura un attimo, ma tutto spazza e incendia. E' sceso l'inferno sulla terra


Nagasaki 9 Agosto, 1945
• Truman "Con questa bomba noi abbiamo ora raggiunto una gigantesca forza di distruzione, che servirà ad aumentare la crescente potenza delle forze armate. Stiamo ora producendo bombe di questo tipo, e produrremo in seguito bombe anche più potenti"

Le Radiazioni Ionizzanti rappresentano una causa molto importante di insorgenza di neoplasie. Possono indurre tumori praticamente in ogni organo in funzione della dose e delle modalità di esposizione. Le radiazioni ionizzanti esistono da sempre in natura. Sostanze radioattive sono naturalmente presenti in alcuni tipi di rocce, alcune sostanze volatili come il Radon sono radioattive, le radiazioni cosmiche vengono efficacemente filtrate dall'atmosfera ma una piccolissima frazione raggiunge comunque gli strati inferiori. Esiste cioè un "fondo" di radioattività naturale a cui non possiamo sottrarci e che sicuramente ha un suo ruolo nel meccanismo della cancerogenesi ma anche in quello dell'evoluzione.

Radiazione di origine naturale Le sorgenti di radiazioni in natura sono diverse. Oltre alla radiazione cosmica e a quella terrestre, anche i materiali da costruzione (specialmente cementi pozzolanici, tufi, graniti, basalti, porfidi) con cui sono fabbricate le nostre abitazioni contengono atomi radioattivi, come pure gli alimenti con cui ci nutriamo. Un importante contributo alla radioattività a cui siamo giornalmente esposti viene però dato dal Radon, un gas naturale che proviene dal terreno e che si accumula nei piani bassi degli edifici. Di qui il Radon sale trascinato dalle correnti d'aria contaminando anche i piani superiori dove finisce per essere respirato insieme all’aria. La quantità di Radon esalata dal sottosuolo varia moltissimo da una zona all’altra e da un edificio all’altro, spesso anche se distanti solo poche decine di metri. Tuttavia, da uno studio condotto negli USA, è stato stimato che il contributo più rilevante alla radioattività assorbita da un individuo adulto, in un anno, è da imputare prevalentemente all’inalazione del gas Radon (40-80% del totale).

In Italia il gas Radon è presente in molte regioni anche se in differenti quantità. Esso è prodotto dai minerali di Uranio-238 presenti nel suolo. In alcune regioni, come ad esempio, la Campania ed il Lazio ad elevata presenza vulcanica esso può essere presente in abbondanze tali da costituire un problema per la salute pubblica da non sottovalutare visto che l’OMS lo classifica come la seconda causa, dopo il fumo, di tumore ai polmoni. Esso può introdursi nelle abitazioni attraverso le fondamenta e può essere inalato con l’aria che si respira. Un altro gas pure presente nel suolo è il Torio-232. Sia l’Uranio che il Torio decadono in numerosi altri radioisotopi prima di trasformarsi in un nuclide stabile come il Piombo.
Radiazione di origine naturale

Il problema Radon in ItaliaBq/m 3 – 20 40
Piemonte
Valle d’Aosta
Liguria
Toscana
Lombardia
Friuli- Venezia
Giulia
Alto Adige
Trentino
Veneto
Emilia-Romagna
Marche
Abruzzo Lazio
Sardegna Campania
Molise
Puglia
Basilicata
Calabria
Sicilia
Umbria
40 60– Bq/m 3
60 80– Bq/m 3
80 100 – Bq/m 3
100 120 – Bq/m 3