2 Lipidi e membrane BUSB - e... · Se R è l’idrogeno (H) il composto si chiama ceramide....
Transcript of 2 Lipidi e membrane BUSB - e... · Se R è l’idrogeno (H) il composto si chiama ceramide....
14/03/2013
1
Lipidi & Membrane
Biotec_BUSB
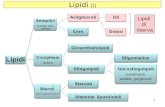
LIPIDI (1)
Miscellanea di molecole biologiche che condividono la proprietà di non essere solubili in acqua.Molecole idrofobiche. Es:
GrassiOli (grasso liquido a temperatura ambiente)ColesteroloMolecole derivate dalle precedenti
LIPIDI (2)
I loro legami chimici covalenti, quasi esclusivamente legami carbono – idrogeno o carbono – carbono, contengono molta energia:
Tipo di legame Energia (kcal/mole)
C-H 99
C-C 83
LIPIDI (3)I lipidi sono perciò una efficiente forma di immagazzinare molta energia in poco spazio.Gli animali usano l’energia in eccesso per sintetizzare lipidi che immagazzinano finchè l’energia non é necessaria.Anche alcune piante immagazzinano energia sotto forma di lipidi, di solito nei semi per fornire energia alla nuova piantina (ad es. semi di girasole, nocciole, mandorle, tutti molti oleosi)Se un animale o una pianta in sviluppo ha bisogno di energia può degradare i lipidi e rilasciare l’energia immagazzinata nei suoi legami chimici.Lipidi modificati mediante collegamento ad un gruppo chimico idrofilico, che quindi sono molecole bipolari , giocano un ruolo fondamentale in quanto si associano spontaneamente in membrane.
Lipidi: Funzioni
Immagazzinamento di energia (grassi e oli)Membrane cellulari (fosfolipidi)Cattura di energia luminosa (carotenoidi)Ormoni e vitamine (steroidei e acidi grassimodificati)Isolamento termicoIsolamento elettrico dei nerviRepulsione di acqua (cere e oli)
Gli acidi grassi sono lunghe catene idrocarburiche che hannoall’estremità un gruppo acido (‐ COOH)
Gli acidi grassi possono essere saturi o insaturi.
14/03/2013
2
Lipidi: Molecola insolubili in acqua
I grassi (animali) e gli oli (vegetali) immagazzinano energia.I grassi e gli oli sono trigliceridi, composti da tre molecole di acidi grassi esterificate con una molecola di glicerolo. Il Glicerolo è una molecola con tre atomi di carbono e tregruppi idrossilici (—OH), uno per ogni atomo di carbono.Gli acidi grassi sono lunghe catene idrocarburiche con un gruppo carbossilico (—COOH) ad una estremità.
Lipidi: Acidi Grassi Saturi
Gli acidi grassi saturihanno soltanto legami carbono‐carbono singoli (sono saturi di idrogeni).Sono rigidi e dritti a temperatura ambiente.I grassi animali sono saturi.
Lipidi: Molecole insolubili in acquaGli acidi grassi insaturi hannoalmeno un carbono coinvolto in un legame doppio nella catena –la catena non è totalmente saturadi atomi di idrogeno.I doppi legami provocano “gomiti” che impediscono un facile impacchettamento. Sono liquidi a temperaturaambiente. Le piante di solito hanno acidigrassi insaturi.
Acidi grassi saturi e insaturi
Most animal fats, solid Most vegetable oils, one @ RT one or more double bonds
liquid @ RT
Ac. Grassi saturi
Ac. Grassi insaturi
I termini saturi e insaturi si riferiscono al numero di legami che può fare ogni atomo di carbono della coda di acido grasso.Lipidi saturi: hanno legami singoli fra tutti gli atomi di carbono e quindi tutti gli atomi di carbono sono collegati al massimo numero di idrogeni possibile.
Queste catene sono abbastanza lineari e possono impacchettarsi strettamente, rendendo questi grassi solidi a temperatura ambiente.
Altri grassi hanno alcuni legami doppi fra taluni atomi di carbono della coda, e ciò provoca un ripiegamento della coda.
Poichè gli atomi di carbono coinvolti nei legami doppi non sono in grado di legarsi al maggiore numero di idrogeni possibile, vengono chiamati grassi insaturi.
I ripiegamenti delle code impediscono ai grassi insaturi di impacchettarsi strettamente come i grassi insaturi, e ciò li rende liquidi a temperatura ambiente.
Lipidi saturi e insaturi
14/03/2013
3
Acidi grassi polinsaturi
Contengono più di un legame doppio nella loroimpalcatura.Includono molti composti importanti quali gli acidigrassi essenziali.I più noti sono polieni interrotti da gruppi metilenici:
‐C‐C=C‐C‐C=C‐Gli acidi grassi essenziali sono tutti omega‐3 e omega‐6 acidi grassi con interruzione di gruppimetilenici
http://www.revisionworld.co.uk/node/5587
saturo
polinsaturo
Acidi grassi monoinsaturi e polinsaturi
I grassi sono designati come “monoinsaturi” si vi è soltanto un doppio legame e “”polinsaturi” si ci sono due o più legamidoppi.Gli acidi grassi omega‐3 e omega‐6 sono acidi grassipolinsaturi, la differenza sta nella localizzazione del legamedoppio:
Negli omega‐3 il primo legame doppio si trova nell 3°atomo di carbonioNegli omega‐6 il primo legame doppio si trova nel 6° stomodi carbono a contare dall’estremità metilenica (nota come omega).
http://www.eufic.org/article/en/artid/The‐importance‐of‐omega‐3‐and‐omega‐6‐fatty‐acids/
Trigliceridi
14/03/2013
4
Struttura dei trigliceridi
http://proteome.biochem.mpg.de/adipo/
Tessuto adiposoe adipociti
http://www.udel.edu/biology/Wags/histopage/colorpage/ca/watmv.GIF
3 Lipidi: Molecole Insolubili in acquaI fosfolipidi hanno due codi di acidi grassi idrofobici e un gruppo idrofilico legato al glicerolo.
Come conseguenza, in ambiente acquoso i fosfolipidi si orientano in modo tale che i gruppi fosfato (e i gruppi polari ad esso legati) si affacciano all’acqua e le code si rivolgono dal lato opposto.
In ambiente acquoso questi lipidi foermano doppi starti (“bilayers”) con le teste rivolte all’esterno e lo code rivolte verso l’interno.
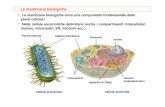
Le membrane cellulari sono così strutturate
Glicerolipidi
Carattere anfipatico o anfifilico dei fosfolipidi
Sn1: Saturo, 16-18 atomi di Carbono
Sn2: Sempre insaturo, + lungo: almeno 18 atomi di Carbono:
GLICEROFOSFOLIPIDI
14/03/2013
5
Fosfolipidi con acidi grassi saturi
Fosfolipidi con acidi grassi insaturi
Influenza dei legami doppi in posizione cisdelle catene idrocarburiche
I legami doppi rendono più difficile il compattamento reciproco delle catene, così rendendo più difficile il congelamento del ”bilayer” lipidico.
Inoltre, dato che le catene degli acidi grassi dei lipidi insaturi sono più sparpagliate, i bilayers lipidici che contengono lipidi insaturi sono più sottili dei “bilayers” formati esclusivemente dai lipidi saturi.
Quattro fosfolipidi importanti nelle membrane plasmatiche dei mammiferi. Tutti i lipidi rappresentati derivano dal glicerolo ad eccezione della sfingomielina, che deriva dalla sfingosina (a sua volta un derivato dalla serina).
e ioni2.7 Structure of phospholipids (Part 1)
14/03/2013
6
2.7 Structure of phospholipids (Part 2) 2.7 Structure of phospholipids (Part 3)
van Meer G. Cellular lipidomics. EMBO J. 24:3159-3165, 2005.
Oltre ai fosfolipidi le membrane contengono anche colesterolo
Ormoni steroidei
Colesterolo
Becker, Il mondo della cellula
14/03/2013
7
SFINGOLIPIDI
Sfingolipidi (1)
Lipidi derivati dall’amminoalcool sfingosina.Un acido grasso è legato al gruppo amminico della sfingosina.I diversi gruppi polari (R) legati al gruppo‐OH conferiscono proprietà molto diverse.Se R è l’idrogeno (H) il composto si chiama ceramide.
GlicosfingolipidiNella classe dei glicolipidi la testa polare é legata alla sfingosinamediante legame glicosidico di una molecola di zucchero, piuttosto che mediante un legame fosfoesterico, come nel caso dei fosfolipidi.
CeramidiI ceramidi sono una famiglia di molecole lipidiche.Un ceramide è composto da sfingosina e di un acido grassoSi trovano in elevata concentrazione nella membrana plasmatica come uno dei componenti della sfingomielina, che è uno dei principali lipidi del doppio strato lipidico.Per anni si è presunto che i ceramidi e altri sfingolipidi fossero soltanto elementi strutturali ma oggi si sa che sono molto di più.Forse uno degli aspetti più affascinanti del ceramide è che esso può agire da molecola di segnalamento.Le funzioni più note dei ceramidi come segnalatori cellulari includono la regolazione del differenziamento, proliferazione e morte cellulare programmata (Programmed cell Death, http://en.wikipedia.org/wiki/Apoptosis)
Glicosfingolipidi, GSLs
Composti anfipatici che comprendono subunità glucidiche legate ad un ceramide.Sono costituenti ubiquitari della membrana plasmatica di tutte le cellule dei Vertebrati.Si ritiene che gli GSLs siano recettori per microorganismi e le loro tossine, modulatori della crescita cellulare e del differenziamento e organizzatori dell’adesione delle cellule alle matrici. Si conoscono più di 400 tipi di GSLs anche se nei Vertebrati si trovano soltanto 7 tipi di monosaccaridi negli GSLs.
14/03/2013
8
R: fosforilcolina→ sfingomielinaR: Zuchero/i→ glicosfingolipidi
Sphingolipids-Sphingomyelin (NO sugar residue)
Major Glycosphingolipids are:
-Cerebrosides:(single sugar)
-Globosides (oligosaccharides
-Sulfatides (acid single sugar)
-Gangliosides (acid multiple sugar)
http://www.elmhurst.edu/~chm/vchembook/556sphingo.html
Il cervello umano e il midollo spinale consistono in regioni grigie e bianche:La regione bianca è fatta da assoni delle cellule nervose avvolti in un rivestimento lipidico bianco, la guaina mielinica, che fornisce isolamento elettrico e permette una conduzione rapida dei segnali elettrici.
La sclerosi multipla è provocata dalla degradazione graduale della guaina mielinicaLe sfingomieline sono presenti in tutto il corpo come componente delle membrane di cellule del sistema nervoso. Cosituiscono circa il 25% dei lipidi della guaina mielinica che circonda ed isola le cellule del Sistema Nervoso Centrale.La malattia di Niemann‐Pick è provocata da un deficit dell’enzima che degrada una quantità eccessiva di sfingolmielina, che quindi si accumula nel fegato, cervello e midollo osseo. Un bambino affetto di questa malattia di solito muore nell’infanzia.
http://www.healthcentral.com/common/images/9/9682_9613_5.jpg
http://upload.wikimedia.org/wikipedia/commons/thumb/c/c1/Myelinated_neuron.jpg/220px‐Myelinated_neuron.jpg
Glycolipids and Cerebrosides:
Glycolipids are complex lipids that contain carbohydrates. Cerebrosides are an example which contain the sphingosine backbone attached to a fatty acid and a carbohydrate. The carbohydrates are most often glucose or galactose. Those that contain several carbohydrates are called gangliosides. The example on the left is shown with glucose. Glucocerebroside has the specific function to be in the cell membranes of macrophages, (cells that protect the body by destroying foreign microorganisms. Galactocerebroside is found almost exclusively in the membranes of brain cells.
There are several genetic diseases resulting from the absence of specific enzymes which breakdown the glycolipids. Tay‐Sachs, which mainly effects Jewish children, results in a build up of gangliosides and result in death in several years. Gaucher's disease results in the excessive build up of glucocerebroside resulting in severe anemia and enlarged liver and spleen.
14/03/2013
9
Principali classi di glicosfingolipidi (1)
Cerebrosidi: hanno un unico zucchero (di solito il galattosio) legato al ceramide. I cerebrosidi aumentano nella malattia di Krabbe a causa della mancanza dell’enzima lisosomiale galattosidasi. Sulfatidi: sono esteri solforici dei galattocerebrosidi. Costituiscono fino al 15% della ‘materia bianca’ del cervello. I solfatidi si accumulano nel cervello nel corso della leucodistrofia metacromatica a causa di mancanza dell’enzima degradativo solfatasi.
Principali classi di glicosfingolipidi (2)
Globosidi: sono ceramide oligosaccaridi neutri, in cui gli zuccheri sono di solito galattosio, glucosio o N‐acetilgalattosamina. Un globoside importante é il ceramide triesosido che si accumula nel rene di pazienti con la malattia di Fabry a causa di mancanza dell’enzima lisosomiale galattosidasi A.Gangliosidi: sono glicosfingolipidi acidi e contengono acido N‐acetilneuramico (noto anche come acido sialico o NANA). Sono concentrati nelle estremità nervose e costituiscono fino a 5‐10% della massa lipidica totale delle cellule nervose. I gangliosidi più comuni sono GM1, GD1a, GD1b, GT1b. Il GM1 è un componente delle cellule della mucosa intestinale e si può legare alla subunità ß della tossina del colera, provocando un aumento dell cAMP, del trasporto degli ioni cloro, e una grave diarrea. Il GM2 aumenta nella malattia di Tay Sachs a causa di una carenza della ß‐hexosaminidase A.
Ruolo degli sfingolipidi
Prottetivo: ad es. sulla superficie apicale delle cellule epiteliali per proteggerle dal basso pH o dalla digestione enzimatica.Trasmissione elettrica: in particolare i gangliosidi che acquisiscono cariche elettriche dopo una campo elettrico nella cellula nervosa.Isolanti elettriciRiconoscimento cellula‐cellula: ad es. recettori di tipo sfingolipidi sui neutrofili si legano alla P‐selettina sulle cellule endoteliali.
http://alexandria.healthlibrary.ca/documents/notes/bom/unit_1/L-31%20Complex%20Lipids.xml
van Meer, G. et al. J Cell Sci 2011;124:5-8
Struttura delle membrane
http://en.wikibooks.org/wiki/Biochemistry/Lipids_And_The_Plasma_Membrane
14/03/2013
10
Doppio strato lipidico («bilayer»)
http://www.ncbi.nlm.nih.gov/books/NBK21583/figure/A1152/
Giunzione fra due cellule
Struttura “trilaminare” delle due membrane cellulari.Gartner, Istologia
Nell’ambito di ogni foglietto, i (fosfo)lipidi hanno libertà di movimento
14/03/2013
11
Il movimento da un foglietto all’altro («flip‐flop») è difficoltato dal carattere anfipatico del lipide e ha bassa probabilità di avvenire.Può essere facilitato da appositi enzimi «flippasi»)
Nella membrana plasmatica la distribuzione dei (fosfo)lipidi è assimmetica
Assimmetria della membrana
IMPORTANZA BIOLOGICA DELL’ASSIMMETRIADEI LIPIDI DELLE MEMBRANE (1)
Le composizioni dei due monostrati del bilayer lipidico sono marcatamente diverse.
Es: nella membrana degli eritrociti umani, quasi tutte le molecole lipidiche che hanno la colina (CH3)3N+CH2CH2OH nel loro gruppo di testa (fosfatidilcolina e sfingomielina) si trovano nel foglietto esterno, mentre quasi tutte le molecole di fosfolipidi che contengono un aminogruppo terminale primario (fosfatidiletanolamina e fosfatidilserina) si trovano nel monostrato interno. Poichè la fosfatidilserina carica negativamente è localizzata nel monostrato interno, vi è una significativa differenza di cariche fra le due metà del doppio strato:
Importanza dell’assimmetria (2)
L’assimmetria dei lipidi è funzionalmente importante.
Molte proteine del citosol si legano a specifici gruppi di testa di lipidi presenti sul monostrato citosolico del bilayer lipidico. Ad es., l’enzima proteina chinasi C (PKC) viene attivata in risposta a diversi segnali extracellulari. La PKC si lega alla faccia citosolica della membrana plasmatica, dove è concentrata la fosfatidilserina, e richiede questo fosfolipide carico negativamente per la sua attività.
14/03/2013
12
Importanza dell’assimmetria (3)In altri casi, il gruppo di testa dei lipidi deve essere prima modificato in modo da creare siti di aggancio per le proteine in un posto e momento determinati.
Ad esempio, il fosfatidilinositolo, che è un fosfolipide poco rappresentato, concentrato nel monostrato citosolico delle membrane cellulari. Diverse chinasi dei lipidi possono legare gruppi fosfato in posizioni distinte dell’anello di inositolo. Gli inositolo‐fosfolipidi fosforilati a questo punto fungono come siti di legame che reclutano proteine specifiche dal citosol fino alla membrana.
Importanza dell’assimmetria (4)
Un importante esempio di chinasi dei lipidi è la fosfatidilinositolo chinasi (PI3‐chinasi), che è attivata in risposta a segnali extracellulari ed aiuta a reclutare specifiche proteine di segnalamento fino alla faccia citosolica della membrana plasmatica. Proteina chinasi simili fosforilano gli inositolfosfolipidi delle membrane intracellulari e quindi aiutano a reclutare proteine che guidano il trasporto di membrana. I fosfolipidi della membrana plasmatica sono usati anche in un altro modo nella risposta ai senali extracellulari. La membrana plasmatica contiene diverse fosfolipasi che sono attivate da segnali extracellulari per scindere molecole di fosfolipidi specifiche, generando frammenti di queste molecole che fungono da mediatori intracellulari a corta vita. Ad esempio, la fosfolipasi C, scinde un inositolo fosfolipide del monostrato citosolico della membrana plasmatica per generare due frammenti, uno dei quali rimane nella membrana ed aiuta ad attivare la proteina chinasi C, mentre l’altro è rilasciato nel citosol dove stimola il rilascio di Ca2+dal reticolo endoplasmatico.
Importanza dell’assimmetria (5)
Gli animali sfruttano l’assimmetria dei fosfolipidi delle membrane plasmatiche per distinguere fra cellule vive e cellule morte. Quando una cellula animale subisce la morte cellulare programmata, o apoptosi, la fosfatidilserina, che normalmente è confinata nel monostrato citosolico della membrana plasmatica, viene rapidamente traslocata al monostrato extracellulare. La fosfatidilserina esposta sulla superficie cellulare serve di segnale per indurre le cellule vicine, come ad esempio i macrofagi, a fagocitare la cellula morta e a digerirla. La traslocazione della fosfatidilserina nelle cellule apoptotiche ha luogo mediante due meccanismi:
Il traslocatore di fosfolipidi che normalamente trasporta i lipidi dal monostrato non citosolico al monostrato citosolico viene inattivato.
Una “scramblase” che trasferisce i fosfolipidi non specificamente in entrambe le direzioni fra i due monostrati viene attivata.
http://www.roche‐applied‐science.com/sis/apoptosis/images/products/annexin01.gif
La cellula come condensatore elettrico
Il doppio strato fosfolipidico è un isolante quasi perfettoEsso può separare le cariche elettriche fra l’interno e l’esterno della cellula: la membrana funziona come un condensatore elettricoLe proprietà capacitive della membrana creano una differenza di distribuzione di cariche che porta allo stabilimento di un potenziale di membrana:
Il numero di cariche negative è maggiore all’interno della cellulaLa membrana plasmatica è polarizzata: ha una distribuzione di ioni e di molecole con carica elettrica diversa nei due lati.Le cellule eccitabili possono scaricarsi in quanto hanno pori attraverso i quali gli ioni possono passare: canali ionici “gated”
14/03/2013
13
Membrana plasmaticomodello del mosaico fluido
Spessore membrana: 5‐8 nm (50‐80 Å)
Modello del mosaico fluido
Le molecole biologiche consistono di proteine inserite in un doppio strato lipidico. Le proteine integrali di membrana sono inserite nella membrana, di solito tramite regioni ad α‐elica con 20‐25 aminoacidi idrofobici. Alcune proteine transmembrana attraversano la membrana solo una volta, altre hanno diverse regioni che attraversano la membrana. Altre proteine sono ancorate alla membrana mediante lipidi che sono legati covalentemente alla catena polipeptidica.
Queste proteine possono essere ancorate alla faccia extracellulare della membrana plasmatica mediante glicolipidi e alla faccia citosolica mediante acidi grassi o gruppi prenilici.
Le proteine periferiche non sono inserite nella membrana ma sono attaccate mediante interazioni con proteine integrali di membrana.
PROTEINE DI MEMBRANAMembrane
CATEGORIEAmminoacidi
14/03/2013
14
Ionizzazione degli AA polari previsti di carica
A pH fisiologico praticamente tutti i residui di ac. glutammico sono carichi negativamente
A pH fisiologico praticamente tutti i residui di lisina sono carichi positivamente
Ac. glutammico
Lisina
Polari carichi (1)
Aminoacidi polari carichi basici Aminoacidi polari carichi acidi
Polari ma privi di carica Polari privi di carica (2)
14/03/2013
15
Non Polari (Idrofobici) (1) Non Polari (Idrofobici) (2)
Catene laterali con proprietà particolari
GLICINA: la catena laterale è formata solo da un atomo di H e può adattarsi sia ad un ambiente idrofilo che idrofobico. Spesso si trova in siti dove due polipeptidi sono a stretto contatto
CISTEINA: Sebbene la catena laterale abbia un carattere polare non carico, ha la particolarità di costitutire un legame covalente con un’altra cisteina, per formare ponti disolfuro (S‐S), che irrigidiscono la catena.
PROLINA. Sebbene la catena laterale abbia carattere polare non carico, ha la particolarità di creare snodi nelle catene polipeptidiche ed interrompere la struttura secondaria ordinata
Ponti disulfuro (S-S) tra residui di cisteina
Questi legami incrociati possono collegare sia due parti della stessa catena polipeptidica che due catene polipeptidiche diverse. Poiché l’energia necessaria per rompere un legame covalente è molto superiore all’energia necessaria per rompere persino un intero insieme di legami non‐covalenti, un legame disulfuro può avere un effetto stabilizzante notevole in una proteina.
FORMAZIONE DI PONTI S-SNELLE PROTEINE
Tipica proteina con diversi legami S‐S (1)
Tipica proteina transmembrana a passaggio singolo “single-pass”.Si noti che la catena lipidica attraversa il doppio strato lipidico come α-elica destrogira e che le catene oligosaccaridiche e i legami disolfuro sono tutti sulla superficie non citosolica della membrana. I legami disolfuro non si formano fra i gruppi sulfidrilici nel dominio citoplasmatico della proteina, perchè l’ambiente riducente del citosol mantiene questi gruppi nella loro forma ridotta (-SH).
14/03/2013
16
Tipica proteina con diversi legami S‐S (2)
Una molecola di anticorpo. (A) Una tipica molecola di anticorpo ha la forma a Y e ha due siti di legame identici per il suo antigene, uno in ciascuna delle braccia della Y. La proteina è composta da quattro catene polipeptidiche (due catene pesanti identiche e due catene leggere identiche e più piccole) tenute insieme da legami disulfuro. Ogni catena è fatta da diversi domini di tipo immunoglobulina, qui ombreggiati sia in azzurro che in grigio. Il sito di legame con l’antigene si forma laddove un dominio variabile della catena pesante (VH) e un dominio variabile della catena leggera (VL) vengono a contatto. Questi sono i domini che differiscono di più in sequenza e struttura nei diversi anticorpi.
LEGAME PEPTIDICOAmminoacidi
Formazione del legame peptidico (1) Formazione del legame peptidico (2)
(A)I legami peptidici si formano fra il gruppo NH2 di un aminoacido e il gruppo COOH di un altro, con la formazione e perdita di una molecola di acqua. Rn, catena laterale dell’aminoacido.
(B) Una proteina ha un’impalcatura polipeptidica con diversi gruppi laterali degli aminoacidi
H. Kreuzer & A. Massey: Biology and Biotechnology: Science, Applications and Issues ASM Press, Washington, D.C., 2005.
14/03/2013
17
Proteine di membrana
Proteine di membrana
http://www.nfsdsystems.com/w3bio315/; http://www.ncbi.nlm.nih.gov/books/NBK28193/figure/A105/?report=objectonly
IMPORTANZA DEI PONTI DI IDROGENO PER LA FORMAZIONE DI UN’ELICA E DI ALTRE
STRUTTURE ORDINATE
Una elica si forma quando una serie di subunità si legano una all’altra in modo regolare
α‐elica (1)
α‐elica (2)
14/03/2013
18
α‐elica (3) β‐foglietto (1)
β‐foglietto (2) β‐foglietto (3)
Note sul ripiegamento delle proteine (1)
L’acqua contiene due legami polari ossigeno‐idrogeno ed è una molecola estremamente polare.Perciò si associa “confortevolmente” con altre molecole polari o cariche elettricamente.Per questa ragione, le molecole che sono elettrostaticamente cariche o polari sono IDROFILICHE.Poichè le molecole non polari non si associano “confortevolmente” con l’acqua, esse sono IDROFOBICHE.Le catene laterali idrofobiche (non polari) degli amminoacidi non si associano stabilmente con il fluido intracellulare (o extracellulare).
Note sul ripiegamento delle proteine (2)
Viceversa, le catene laterali idrofiliche degli amminoacidi (cariche o polari) si possono associare stabilmente con il fluido perchè le loro cariche, o cariche parziali possono essere neutralizzate dalle cariche parziali complementari delle molecole polari dell’acqua.Una regola basilare che determina la struttura delle proteine in ambiente acquoso è, per quanto possibile, il ripiegamento dei gruppi laterali idrofobici concentrandoli all’interno della proteina, così creando un ambiente idrofobico privo di acqua.Le catene laterali idrofiliche sono invece stabili quando esposte al citoplasma sulla superficie della proteina.
14/03/2013
19
Note sul ripiegamento delle proteine (3)
Si dice perciò che una proteina in un ambiente acquoso contiene una zona centrale (“core”; nocciolo) idrofobica e stabile.La struttura tridimensionale di ogni singola proteina (STRUTTURA TERZIARIA) può essere vista come la migliore soluzione al problema di creare la zona centrale idrofobica per ogni struttura primaria.Questo presenta un ulteriore problema: l’impalcatura/asse comune (sequenza di legami peptidici) contiene un gran numero di legami NH e CO, che sono altamente polari.
Note sul ripiegamento delle proteine (4)
Alla superficie della proteina questi legami parzialmente carichi possono essere prontamente neutralizzati mediante legami di idrogeno con l’acqua.Tuttavia, perchè una struttura proteica sia stabile le cariche parziali dell’impalcatura polipeptidica debbono essere neutralizzate anche all’interno della proteina, dove l’acqua non è presente.
Struttura terziaria
Struttura terziaria
Struttura terziaria
14/03/2013
20
http://www.ncbi.nlm.nih.gov/books/NBK28193/figure/A103/?report=objectonly
Questa struttura induce le catene laterali degli aminoacidi a proiettarsi radialmente.
Quando diverse eliche α sono impacchettate strettamente le loro catene laterali possono essere interconnette oppure costrizioni stereochimiche possono provocare la formazione di canali all’interno delle catene.
I residui che si proiettano all’esterno devono essere predominantemente idrofobici per interagire con le catene di acidi grassi dei bilayers lipidici.
Il bilayer ha uno spessore di circa 3 nm. Ogni residuo peptidico si stnede all’interno dell’ α elica per 1.5 Å. Perciò, nonostante modificazioni locali del bilayer o interazioni con altri polipeptidi di membrana possano alterare questo requisito, i segmenti transmembrana di solito richiedono circa 20 residui aminoacidici per attraversare totalmente il bilayer.Le proteine integrali di membrana sono caratterizzate
dalla presenza di segmenti idrofobici con spprossimativamente questa lunghezza.
I domini transmembrana delle proteine integrali di membrane sono predominantemente delle eliche α
Nella maggior parte delle proteine transmembrana la catena polipeptidica attraversa il doppio strato lipidico
in conformazione ad α‐elica (1)
Una proteina transmembrana ha sempre un orientamento caratteristico nella membrana.Questo riflette il modo asimmetrico con cui è sintetizzato ed inserito nel doppio strato nel Reticolo Endoplasmatico ruvido e le diverse funzioni dei suoi domini citosolici e non‐citosolici.Questi domini sono separati da segmenti della catena polipeptidica che attraversano la membrana e che sono in contatto con l’ambiente idrofobico del doppio strato lipidico e sono composti in gran parte di reisdui di aminoacidi con catene laterali non polari.
Proteine transmembrana (2)
Poichè i legami peptidici stessi sono polari e dato che l’acqua è assente, tutti i legami peptidici nell’ambito del doppio strato sono portati a formare legami di idrogeno gli uni con gli altri.Il legame di idrogeno fra i legami peptidici viene massimizzato se la catena polipeptidica forma una α‐elica regolarenell’attraversamento; si ritiene che sia in questo modo che la grande maggioranza dei segmenti che attraversano la membrana delle catene polipeptidiche attraversino il doppio strato.
14/03/2013
21
α‐eliche transmembrana
… ma anche i β‐foglietti si adattano all’attraversamento della membrana
Proteine ancorate alla membrana da lipidi
http://www.ncbi.nlm.nih.gov/books/NBK9898/figure/A1979/?report=objectonly
Associazione proteine con lipidi di membrana
Alcune proteine citosoliche hanno domini che si legano alle teste polari di lipidi che occorrono transientemente nella membrana.Gli enzimi che creano o degradano questi lipidi sono soggetti a regolazione mediata da segnali, fornendo un meccanismo per modulare l’affinità di una proteina verso la superficie di una membrana:
Ad es. i domini “pleckstrin homology”, (PH)” sono in grado di legare il fosfatidilinosiltolo.Alcuni domini PH si legano al PIP2 (PI‐4,5‐P2).Altri domini PH riconoscono e si legano a derivati del foafatidilinositolo con gruppi Pi esterificati con il gruppo 3’‐OH dell’inositolo.
ES: PI‐3‐P, PI‐3,4‐P2, e PI‐3,4,5‐P3.
http://www.rpi.edu/dept/bcbp/molbiochem/MBWeb/mb1/part2/lipid.htm#animat1
Le associazioni alla membranapossono aver luogo mediante legame selettivo
delle proteine a gruppi polari della testa dei lipidi
Un esempio è la spettrina, che si lega al fosfatidilinositolo‐4,5‐bisfosfato rivolto verso il citoplasma mediante un dominio “pleckstrin homology”, (PH)” .Diversi enzimi e proteine strutturali si legano alla membrana in seguito ad attivazione da Ca2+. Es: proteina chinasi C (PKC), fosfolipasi A2 e sinaptotagmina.Una regolazione allosterica dell’idrofobicità delle superficie di legame delle proteine ha spesso luogo. Uno dei casi meglio noti è il legame Ca2+‐dipendente della calmodulina ad altre proteine.
Le annessine sono una famiglia di proteine che formano associazioni Ca2+‐dipendenti con la membrana cellularemediante interazione diretta con fosfolipidi; vice‐versa, le interazioni con i fosfolipidi aumentano la loro affinità verso il Ca2+.
http://www.ncbi.nlm.nih.gov/books/NBK28193/
http://www.geneticaebiologia.unito.it/membrana/globulo_rosso.jpg
spettrina
http://www.ncbi.nlm.nih.gov/books/NBK28193/table/A109/?report=objectonly
14/03/2013
22
Glicosilfosfatidil inositolo (GPI)
Catene idrocarburiche legate covalentemente ancorano alcune proteine alla membrana
http://www.ncbi.nlm.nih.gov/books/NBK21570/#A611
Ancore lipidiche (a)Alcune proteine si legano alla membrana mediante un’ancora lipidica legata covalentemente, che si inserisce nel bilayer.Una proteina può legarsi al versante citosolico della membrana plasmatica mediante un acido grasso legato covalentemente (ad es. palmitato o miristato) oppure un gruppo isoprenoide. Il palmitato di solito si collega mediante un legame tioestere al gruppo –SH di un residuo di cisteina. Una proteine potrebbe essere rilasciat dalla membrana mediante idrolisi del legame esterico – depalmitoilazione.Un gruppo isoprenoide come un residuo farnesilico, è legato ad alcune proteine mediante un legame tioesterico ad un gruppo tiolico di una cisteina.
Ancore lipidiche (b)Il miristato può essere aggiunto cotraduzionalmente alla glicina N‐terminale di un gran numero di proteine periferiche, participando perciò al loro legame con la superficie citoplasmatica della membrane.La subunità catalitica della protein chinasi c‐AMP dipendente, la calcineurina B la NADH‐citocromo b5 reduttasi sono proteine miristoilate.Gli acidi grassi, soprattutto il palmitato, possono legarsi sotto forma di tioesteri ad un residuo di cisteina che di solito è localizzato vicino ad un dominio di legame con la membrana.
Sia proteine integrali di membrana (es. rodopsina o recettore per la transferrina) e proteine associate alla membrana (es. anchirina e vinculina) possono essere acilate.
Un gran numero di proteine può essere prenilata post‐traduzionalmente.Una via biosintetica per le proteine prenilate coinvolge proteine precursore con una sequenza C‐terminale CXXX (C: cisteina). Un gruppo C20 di un geranilgeranil pirofosfato viene aggiunto al gruppo sulfidrilico della cisteina. I tre AA terminali vengono ins eguito rescissi e infine un gruppo metilico viene aggiunto al gruppo cisteina‐α‐carbossile esposto. Le proteine prenilate includono diversi trasduttori di segnale della classe delle piccole proteine G e subunità γ di proteine G trimeriche.
http://www.ncbi.nlm.nih.gov/books/NBK28193/
14/03/2013
23
Ancore lipidiche (c)
I glicosilfosfatidil inositoli (GPI) sono glicolipidi complessi che si legano ad alcune proteine presenti sulla superficie esterna della membrana plasmatica. Il loro legame è simile a quello indicato sotto, nonostante la composizione dell’oligosaccaride possa variare:
Proteina (C‐terminale) ‐ fosfoetanolamina – mannosio ‐mannosio ‐mannosio ‐ N‐acetilglucosamina ‐ inositolo (di fosfatidilinositolo inserito nella membrana)
La proteina è ancorata ad una certa distanza all’esterno della membrana dalla lunga catena oligosaccaridica.
Le proteine legate a GPI possono essere rilasciate dalla superficie esterna delle cellula dalle fosfolipasi.
Ancore lipidiche (d)
Le proteine possono essere ancorate al foglietto esterno mediante legame covalente con fosfoinositidi glicosilati complessi.
Le proteine ancorate a glicosilfosfatidilinositolo (GPI) includono la fosfatasi alcalina, la 5’-nucleotidasi, un’isoforma dell’acetilcolinesterasi e un’isoforma della N-CAM.