Metabolismo composti azotati
-
Upload
stefano-nogas -
Category
Documents
-
view
186 -
download
0
description
Transcript of Metabolismo composti azotati

METABOLISMO DEI COMPOSTI AZOTATI
(lezione di biochimica - classi quinte)
Parole chiave: transamminazione, deamminazione, ciclo dell'urea, acido urico, acido glutammico, glutammina, chetoacidi
Prerequisiti: ciclo di Krebs, amminoacidi, ammoniaca, basi azotate, corpi chetonici, AcetilCoA.
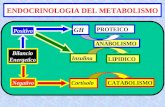
L'azoto in forma organica è contenuto nelle proteine e nelle basi azotate.L'azoto può essere interscambiato. Ad esempio, l'azoto degli amminoacidi può essere utilizzato per sintetizzare altri amminoacidi (transamminazione) o basi azotate.
Il catabolismo degli amminoacidi ricopre il 15% circa del fabbisogno energetico giornaliero di un adulto; la catena carboniosa degli amminoacidi, previa eliminazione del gruppo amminico (v. deamminazione ossidativa) entra nel ciclo di Krebs confluendo in acetil-CoA;ogni amminoacido possiede una propria via metabolica a riguardo.
Le basi azotate dei nucleotidi, invece, non producono significative quantità di energia e sono eliminate come acido urico.
Altre forme di eliminazione dei gruppi amminici provenienti dalla degradazione degli amminoacidi sono: urea (molecola principale prodotta dai reni umani) e ammoniaca (prodotta in gran quantità dai pesci e in piccola quantità dall'uomo).
Quando gli amminoacidi non sono diretti alla biosintesi delle proteine (via anabolica), vengono destinati alla costruzione di importanti molecole, ad esempio: istamina, adrenalina, tiroxina, purine e pirimidine.
Infine, possono essere prodotti alcuni intermedi di vie metaboliche (ac. piruvico, acido, ossalacetico ecc.) che portano al glucosio (gluconeogenesi) o partecipano al ciclo di Krebs. (v. schema a pag. 263 e fig. 5 di pag.271 Ricciotti)
Gli amminoacidi che con la loro conversione entrano nella gluconeogenesi si dicono gluconeogenetici: glicina, serina, alanina, acido glutammico, acido aspartico, istidina, arginina e prolina, ecc.).
Altri amminoacidi, detti chetogenetici, portano alla produzione di acido acetico quando c'è un eccesso di acetil-CoA (ad es. in seguito ad una dieta molto ricca di proteine), l'acido acetico si converte in corpi chetonici (acetoacetato, β-idrossibutirrato e acetone). I corpi chetonici vengono prontamente inviati nel sangue e diventano fonte di energia per il muscolo scheletrico, il muscolo cardiaco e lo stesso cervello (v. anche Corpi chetonici - met. dei lipidi). Normalmente la concentrazione dei corpi chetonici è bassa; in caso di diabete le cellule non avendo a disposizione glucosio, "bruciano" grandi quantità di acidi grassi con aumento dei corpi chetonici che vengono smaltiti con le urine (chetonuria).
Uno svariato numero di amminoacidi può comportarsi da chetogenetico e glucogenetico, ad es.: isoleucina, lisina, fenilalanina e tirosina.

L'acetil-CoA può essere destinato anche alla produzione di acidi grassi o molecole complesse come il colesterolo, precursore:1- degli ormoni steroidei2- acidi biliari3- della vitamina D3o costituente delle membrane cellulari e della sostanza bianca del tessuto nervoso (mielina).
Otto amminoacidi sono essenziali data l'impossibilità per l'organismo di produrli da altri amminoacidi con la transamminazione (v. oltre); gli altri sono detti non essenziali.Essenziali sono: leucina, isoleucina, valina, fenilalanina, triptofano, treonina, lisina e metionina.
Transamminazione ad α-chetoacidi
L'esigenza di poter disporre di amminoacidi da parte dell'organismo implica una conversione reversibile fra un ammioacido e un α-chetoacido. La richiesta di amminoacidi non essenziali viene così soddisfatta quando gli stessi temporaneamente non sono disponibili.La transamminazione (o transaminazione) comporta lo scambio del gruppo amminico -NH2 (o NH3+) con l'ossigeno legato in modo chetonico all'α-chetoacido.Gli enzimi che guidano queste trasformazioni sono detti transamminasi e prevedono la presenza del coenzima piridossale - 5' - fosfato o PLP (un derivato della vitamina B6).Il PLP assume il gruppo amminico e diventa piridossammina fosfato (PMP), poi cede il gruppo amminico all'α-chetoacido: questo comportamento, che coinvolge alternativamente due substrati, chiamato "ping pong". (formula di PLP e PMP a pag. 264 R.).
Le transamminazioni più frequenti sono fra:
acido piruvico < > alaninaacido ossalacetico < > acido asparticoα-chetoglutarico < > acido glutammico
La transamminazione avviene nelle cellule epatiche sia nel citoplasma che nei mitocondri.Le analisi chimico-cliniche sulle transamminasi accertano la funzionalità delle cellule epatiche sulla base delle concentrazioni di questi importantissimi enzimi.
La deamminazione ossidativa e l'azione della glutammico deidrogenasi (p. 265 R.)
L'acido α-chetoglutarico deriva frequnetemente da acido glutammico con formazione di ammoniaca grazie all’azione dell’enzima glutammato deidrogenasi.Questo enzima agisce a livello dei mitocondri. La conversione acido glutammico > acido α-chetoglutarico è una reazione di deamminazione ossidativa in cui una molecola d’acqua cede il proprio ossigeno e lo sostituisce al gruppo amminico di un amminoacido trasformandolo in chetoacido (spesso l’acido glutammico in acido alfa-chetoglutarico), La reazione avviene con l'aiuto del coenzima NAD+ o NADP+ e formazione delle rispettive molecole ridotte (NADH e NADPH).
Reazione complessiva

acido glutammico + H2O + NAD+ > acido α-chetoglutarico + NH4+ + NADH + H+ (p. 266 Ricciotti)
L'azione della glutammato deidrogenasi è attivata da elevate concentrazioni di ADP. La stessa glutammato deidrogenasi, ovviamente, è inibita da alte concentrazioni di GTP (ATP). Nel primo caso si avrà un afflusso di acido α-chetoglutarico verso il ciclo di Krebs per transamminazione dell'acido glutammico, nel secondo caso l'inibizione della glutammato deidrogenasi avviene quando si trasforma succinilCoA in acido succinico con produzione di GTP (ATP) - fase 7 ciclo di Krebs.Il GTP inibisce l’enzima e si blocca la produzione di nuovo alfa-chetoglutarato.
nota:La deamminazione ossidativa può essere regolata da enzimi appartenenti al gruppo delle ossidasi (la glutammato deidrogenasi non ne fa parte) che utilizzano come coenzimi il FAD e FMN. Attraverso questi coenzimi trasferiscono gli idrogeni del gruppo amminico direttamente all'ossigeno con formazione di acqua ossigenata. (p. 300 Stefani).
Ammoniaca e glutammina
L'ammoniaca (o ione ammonio) che si forma lontano dal fegato (es. reni e cervello) viene trasportata nel sangue come glutammina (p. 268 R.); una volta nel fegato la glutammina si ritrasforma in acido glutammico grazie alla glutamminasi. L'ammoniaca liberata viene prontamente inviata al ciclo dell'urea per la sua eliminazione sotto forma di urea (inviata a sua volta ai reni).La glutammina è un amminoacido polare che possiede, rispetto all'acido glutammico, un azoto in più.
Il ciclo dell'urea
L'ammoniaca accumulata nel fegato, per processi di deamminazione e per la presenza di glutammina, viene prontamente convertita in urea con grande dispendio energetico. Per una molecola di ammoniaca si consumano 4 ATP. Il ciclo dell'urea o dell'ornitina fu descritto da Krebs (1932). Il ciclo parte e arriva alla molecola dell'ornitina e prevede una serie di reazioni che avvengono nel mitocondrio e nel citoplasma (v. p. 311 S.).
Fasi
1) Nel mitocondrio giunge CO2 che entra nel ciclo formando carbamilfosfato con il gruppo NH4+ proveniente dalla deamminazione dell'acido glutammico (v. prima) operata dalla glutammico deidrogenasi mitocondriale. La formazione del carbamilfosfato comporta la formazione di 2 ADP.La reazione è irreversibile.
2) L'unione dell'ornitina con il carbamilfosfato porta all'amminoacido citrullina (questi due amminoacidi non fanno parte degli amminoacidi proteici).
3) La citrullina esce nel citoplasma e si unisce ad un secondo azoto proveniente dal gruppo amminico dell'acido aspartico. L'acido aspartico si è formato per transamminazione dal glutammato (o altro amminoacido); l'enzima che regola la formazione della molecola finale, arginosuccinato, è l'arginosuccinato sintetasi.

La reazione è endoergonica e prevede il consumo di 1 ATP con formazione di AMP + 2 PP (il che equivale alla liberazione energetica di 2 ATP).
4) Grazie all'enzima argininosuccinato liasi, l'argininasuccinato si scinde in arginina e fumarato (v. nota) che viene inviato al ciclo di Krebs.
notaL'acido fumarico è un chetoacido del ciclo di Krebs e rappresenta una molecola "ponte" fra i due cicli.
5) L'arginina subisce una idrolisi con la presenza di arginasi permettendo la formazione di 1 molecola di urea (NH2-CO-NH2).
Il residuo di arginina non è altro che ornitina, pronta a riprendere il ciclo dell'urea.La membrana cellulare è permeabile all'urea che viene inviata ai reni dal torrente circolatorio; l'urea rappresenta in percentuale l'80% - 90% dell'intero azoto urinario.La restante parte deriva dal catabolismo delle basi azotate sotto forma di acido urico o dalla creatina.
Nei reni è presente l'enzima glutamminasi che idrolizza la glutammina in acido glutammico liberando piccole concentrazioni ammoniaca; dall'ammoniaca si formano sali d'ammonio che vengono prodotti per tamponare l'acidità del rene (acidosi).
Decarbossilazione degli amminoacidi (p. 275 R.)
Il coenzima piridossal 5' fosfato, già incontrato nella transamminazione, aiuta gli enzimi del gruppo ammnioacido decarbossilasi nel distacco del gruppo carbossilico degli amminoacidi.La decarbossilazione degli amminoacidi genera importanti molecole (ammine biogene) aventi effetti fisiologici.L'istamina, ad esempio, è un potente dilatatore dei vasi capillari che può provocare la contrazione spasmodica della muscolatura liscia (bronchioli, cistifellea e utero).La sua produzione anormale è dovuta alle crisi allergiche ed è collegata ai mastociti (v. il sistema immunitario).L'istamina si genera dall'istidina.Dalla fenilalanina o dalla tirosina si generano due ormoni prodotti dalle ghiandole surrenali midollari: adrenalina e noradrenalina.Questo ormoni fanno parte dei neurotrasmettitori nervosi catacolamminici e nella loro molecola è presente un raggruppamento catecolico (il catecolo è l' o-diidrossibenzene).I neurotrasmettitori agiscono a livello degli impulsi nervosi.
La reazione generale della decarbossilazione è la seguente, con formazione di un gruppo amminico: Istidina (amminoacido) > Istamina (produzione di CO2)

Biosintesi dei nucleotidi pirimidinici e purinici (p. 282 R. e p. 306 S.)
Per costruire nucleotidi (essenziali nel DNA- RNA e nei coenzimi trasportatori come NAD+, FAD) sono necessari: il gruppo fosfato (recuperabile con l'alimentazione), ribosio e basi azotate (scarse nei cibi).Le vie per giungere alle basi azotate sono complesse.La via per giungere al ribosio è essenzialmente quella dello shunt dell'esosomonofosfato (o via dei pentosofosfati).
Sintesi delle basi pirimidinicheL'unione di acido aspartico e carbammilfosfato (v. ciclo dell'urea) porta alla formazione di acido orotico e quindi, grazie all'unione con il ribosio 5-P (dalla via dello shunt) all'uridina monofosfato (URP) (reazione p. 281 R.).
Sintesi delle basi purinicheL'anello delle purine viene assemblato con il concorso di numerose molecole che cedono alcuni loro atomi: glicina, formiato, gruppo ammidico della glutammina, aspartato (gruppo amminico) e anidride carbonica (fig. 10 p. 282 R.).
Degradazione delle basi azotate (p.279 R.)Il destino della catalisi delle pirimidine (citosina, timina , uracile) è diverso dal destino delle purine (adenina e guanina).
Degradazione delle pirimidineLe pirimidine possono essere:
- riutilizzate per la sintesi di nuovi nucleotidi;- demolite direttamente in ammoniaca e urea.
Altri utilizzi sono:
-citosina e uracile vengono demolite per produrre β-alanina, un amminoacido inserito nella struttura del coenzima A-la timina, oltre a produrre ammoniaca, dà origine al succinilCoA che si inserisce nel ciclo di Krebs.
La degradazione delle purine adenina e guaninaLa guanina e l'adenina producono acido urico.Un'alimentazione ricca di purine (es. carne di selvaggina) determina un'alta concentrazione di purine nel sangue (iperuricemia) da cui la gotta.
L'acido urico determina un deposito di sali dell'acido nelle cartilaggini provocando dolori molto acuti e lesioni artritiche.La gotta può accompagnarsi anche a gravi disfunzioni renali.