La stabilità dei composti aromaticidownload.kataweb.it/mediaweb/pdf/espresso/scienze/1992... ·...
Transcript of La stabilità dei composti aromaticidownload.kataweb.it/mediaweb/pdf/espresso/scienze/1992... ·...
La stabilitàdei composti aromatici
Grazie a modelli matematici si è potuto stabilire quali meccanismi dianoa queste sostanze, capaci di conservarsi per milioni di anni e di esisterenell'ambiente ostile dello spazio esterno, la loro stabilità straordinaria
produce una notevole varietà di compo-sti aromatici. Da un punto di vista idea-le, quando si brucia un idrocarburo sidovrebbero ottenere solo anidride carbo-nica e acqua; in realtà una combustionecompleta avviene raramente e si ha sem-pre la formazione di fumo e residui car-boniosi. I prodotti incombusti contengo-no diversi composti aromatici policicli-ci, alcuni dei quali altamente tossici,identificabili mediante le tecniche cro-matografiche, che separano i diversicomponenti di una miscela da analizza-re. John C. Fetzer e Wilt R. Biggs del-la Chevron Research and Technology
di Richmond, in California, e Kiyoka-tsu Jinno della Toyohashi University ofTechnology hanno scoperto che le pol-veri emesse dallo scarico di un motorediesel contengono non solo piccole mo-lecole aromatiche come benzene, nafta-lene (C 10H8 ) e fenantrene (C14/-110), maanche composti più grandi quali il coro-nene (C241-1 12) e l'ovalene (C32H 14 ). Ineffetti, si ritiene che queste polveri sianoessenzialmente aggregati di grandi mo-lecole policicliche aromatiche.
Gli anelli benzenici si formano facil-mente anche nello spazio, oltre che sullaTerra. Si sa che le meteoriti denominate
condriti carbonacee, che sono tra i corpipiù antichi del sistema solare, contengo-no molti tipi di composti aromatici po-liciclici, formatisi presumibilmente perreazione dell'idrogeno con monossido dicarbonio su un substrato adatto. È anchepossibile che i composti aromatici pre-senti nelle meteoriti si siano formati nel-lo spazio interstellare e siano poi stati in-globati nel sistema solare in via di con-densazione. Nelle ultime fasi della loroesistenza le stelle sintetizzano elementipesanti, compreso il carbonio, e li espel-lono nello spazio; è qui che il carboniopotrebbe reagire con l'idrogeno. Nel
N
el 1825 un giovane scienziatodella Royal Institution di Lon-dra fu incaricato di analizzare
il residuo liquido che si formava durantela produzione del gas illuminante. Con-siderato uno dei migliori chimici del suotempo, il trentatreenne Michael Faradayfece una scoperta che avrebbe avutoconseguenze rivoluzionarie: isolò dalcampione un nuovo idrocarburo, ossiauna molecola costituita solo da atomi diidrogeno e di carbonio. Conosciuta oggicon il nome di benzene, questa sostanzacomprende sei atomi di idrogeno legatia sei atomi di carbonio ed è il prototipodella classe dei composti aromatici.
Tutti gli idrocarburi arbmatici hannoin comune una proprietà notevole: unastabilità davvero straordinaria. Sono ca-ratterizzati da una forte tendenza a con-servare la propria struttura e sono quindiassai meno reattivi di molti altri tipi dimolecole. La stabilità è uno dei princi-pali motivi per cui le molecole aromati-che trovano tante applicazioni. Nellabenzina la loro presenza fa aumentare ilnumero di ottano e composti aromaticisono i principali costituenti di prodottidi tutti i giorni come solventi per vernicie palline di naftalina. I composti aroma-tici sono essenziali anche nell'industria,come reagenti e solventi per la produ-zione di fibre sintetiche, resine e colo-ranti. Nonostante la loro amplissima dif-fusione, però, i meccanismi fondamen-tali che spiegano la loro stabilità sonostati chiariti solo recentemente da me eda altri ricercatori.
Il problema che ci trovavamo a fron-teggiare derivava dal fatto che i calcoliquantomeccanici di per sé non fornisco-no una base sufficiente per prevedere odeterminare accuratamente la stabilitàdelle molecole aromatiche. Per far que-sto è necessario affidarsi a diversi postu-lati che, per quanto ragionevoli, non de-rivano naturalmente dalla teoria, ma de-
di Jun-ichi Aihara
vono essere assunti ad hoc. Era difficileanche spiegare certe caratteristiche co-muni ai composti aromatici, quali le loroinsolite proprietà diamagnetiche. Ma ilproblema principale nasceva dal fattoche erano stati sintetizzati in laboratoriodiversi tipi di molecole aromatiche le cuiproprietà non potevano essere spiegatedalle teorie esistenti.
Per rimediare a questo stato di cose,io e altri studiosi abbiamo messo a puntola teoria dell'energia di risonanza topo-logica, che unisce concetti topologici aconcetti quantistici, come gli orbitalielettronici e i livelli di energia, e con-sente di esprimere la stabilità in terminisia numerici sia geometrici. Questo ap-proccio si è dimostrato valido per quasitutti i tipi di molecole aromatiche com-presi i fullereni, i composti sferoidali delcarbonio che attualmente sono al centrodell'attenzione di molti studiosi.
Janostra teoria si basa su conoscenze
che sono state acquisite lo scorso se-colo, quando si cominciò a comprenderein che modo gli elementi reagiscano e sileghino l'uno con l'altro. La stabilitàdelle molecole aromatiche implica cheesse non tendano a reagire e quindi chela loro struttura sia particolarmente fa-vorita. Una fra le prime caratteristichericonosciute dei composti aromatici è ladisposizione degli atomi di carbonio informa di esagono. Fu il chimico tedescoAugust Kekulé a proporre per primoquesta configurazione, nel 1865, e se-condo un famoso aneddoto essa gli fusuggerita da un sogno nel quale egli videun serpente che si mordeva la coda.
É la struttura ad anello a costituire iltratto distintivo dei composti aromatici enon, come si potrebbe equivocamentearguire dal nome, il loro odore; di fatto,anzi, molte di queste sostanze sono ino-dori. Il termine «aromatico» venne in-trodotto quando si scoprì che alcune mo-
lecole odorose contengono anelli benze-nici; in seguito tutti i composti chimicia esse simili vennero attribuiti a questafamiglia e l'impiego del termine finì perdiventare tradizionale. Per complicareulteriormente le cose, vengono oggiclassificati come aromatici anche com-posti organici in cui alcuni degli atomidi carbonio dell'anello sono sostituiti daatomi di azoto, ossigeno o zolfo.
Più che una fonte di stabilità chimica,l'anello benzenico sembra essere unaforma preferita dalla natura. Attualmen-te si sa che gli idrocarburi aromatici so-no estremamente diffusi e si trovano insostanze comunissime, come il carbonee il nerofumo. In effetti, il risultato fina-le di molte reazioni chimiche tende a es-sere la formazione di un anello benzeni-Co. Per fare un esempio, si consideri il5-metilen-1,3-cicloesadiene (C7H8), uncomposto abbastanza semplice a ontadel suo nome complesso (i numeri indi-cano gli specifici atomi di carbonio co-involti nei legami). Questa molecola ap-partiene alla famiglia degli alcheni e,sebbene per la sua forma generale asso-migli al benzene, è altamente reattiva. Insoluzione leggermente acida si riarran-gia e si trasforma in un composto aro-matico, il toluene (C 7H8 ), che è essen-zialmente un anello benzenico in cui auno degli atomi di carbonio è legato ungruppo metile (CH3).
Il comune processo di combustione
Il benzene, il prototipo degli idrocarbu-ri aromatici, rivela la sua struttura adanello in una immagine al microscopioa scansione a effetto tunnel. Ciascunamolecola appare come un rigonfiamentocon una leggera depressione nel centro.I contorni poco definiti sono dovuti al-le «nubi» degli elettroni n delocalizzati.
66 LE SCIENZE n. 285, maggio 1992 LE SCIENZE n. 285, maggio 1992 67
La struttura molecolare del benzene alterna legami semplici e doppi. Ci sono duemodi in cui i legami possono alternarsi (in alto), ma il benzene è in realtà una formaintermedia: è cioè un ibrido di risonanza. Questo fenomeno è dovuto al fatto che gliorbitali atomici p, associati agli elettroni n, si sovrappongono ai propri vicini; la re-gione di sovrapposizione è indicata dalle linee tratteggiate (in basso a sinistra). Glielettroni n sono delocalizzati, ossia sono liberi di muoversi su tutto l'anello forman-do due «nubi re» a forma di ciambella sopra e sotto il piano degli atomi di carbonio.
*LIR & D
FELLOWSHIPSTwo principal
characteristics of Japan's
present day policy for
science and technology
are the promotion of basic science and its
internationalisation. As a result, it is
becoming easier and more attractive for
young European Scientists and engineers to
participate in full to research projects taking
place in Japanese lahoratories.
An European Community programme of
Fellowships (or young European researchers
going to _lapan is now in its seventh year. Its
aim is t() contribute tu the training of young
specialists in their field and to give them the
opportunity of having an inside view into
the workings of Japanese R & D. In the long
run this will strengthen the "human
network" between Europe and Japan and
will play an , important part in increasing S &
T co-operation.
In recent years, through the efforts of
various Ministries and Agencies, the
Japanese government has recognised the
importance of developing a global
dímension to its R & D activities.
,In 1988 the Science and Technology
Agency (STA) launched an important
fellowship programme for foreign scientists,
and in order to promote it and to organize
the selection of potential
candidates, established
contacts with severa]agencies in industrialized
countries, belonging among others to five
Member States of the European
Community, and with the Commission of
the European Communities itself.
The Commission of the European
Communities is at present inviting
applications from candidates wishing to take
up long-term research projects in Japan.
Candidates should not be over 35 years of
age, be nationals of a member State of the
European Community and have completed
their doctorate degree in a scientific or
engineering field, alternatively they must
have an equivalent qualification or research
experience.
Further information on R & D Fellowships in
Japan can be obtained from)
Commission of the European Communities
(DGXII-C-3),
rue de la Loi 200, B-1049 Brussels.
Tel.: (32) (2) 235.3-9.90 or 235.65.09.
Fax: (32) (2) 236.33.08.
•
IN JAPAN
1985 Louis J. Allamandola e colleghidell'Ames Research Center della Natio-nal Aeronautics and Space Administra-tion hanno scoperto che lo spettro dellenebulose presenta notevoli somiglianzecon quello delle polveri emesse dalloscarico di un'automobile.
Ma perché gli anelli aromatici sonotanto stabili? In generale la stabili-
tà di una molecola è legata al fatto chegli atomi costituenti abbiano un certonumero di elettroni di valenza, ossia dielettroni che partecipano a un legamechimico. Essi si trovano nel «guscio»più esterno, detto di valenza, che deveessere riempito con un numero, appro-priato di elettroni per garantire la stabi-lità. (Per la grande maggioranza deglielementi del sistema periodico vale la«regola dell'ottetto», secondo cui il nu-mero di elettroni nel guscio di valenzadeve essere otto.)
Un modo per completare l'ottetto è diappropriarsi di elettroni di altri atomi. Ilcloro, che ha sette elettroni di valenza,può riempire il guscio più esterno sot-traendo un elettrone a un atomo donato-re; questo trasferimento dà origine a unoione cloruro carico negativamente che silega all'atomo donatore carico positiva-mente con un legame denominato ionico(se il donatore è un atomo di sodio, siforma cloruro di sodio, il comune saleda cucina).
Tuttavia il carbonio, che ha quattroelettroni di valenza e ne richiede altri
quattro per riempire il proprio guscioesterno, preferisce condividere gli elet-troni anziché appropriarsene. In uno de-gli idrocarburi più semplici, il metano(CH4), ciascuno degli idrogeni mette incomune il proprio unico elettrone di va-lenza con il carbonio, il quale completacosì l'ottetto. A sua volta il carboniocondivide un elettrone di valenza conciascun idrogeno, che ha bisogno di duesoli elettroni per riempire il proprio gu-scio di valenza. I legami che così si for-mano sono detti covalenti.
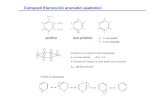
I composti aromatici non seguonoesattamente questa regola. Dato che nelbenzene vi sono solo sei atomi di idro-geno e sei di carbonio, sembra che questiultimi non abbiano modo di completarel'ottetto; e tuttavia la straordinaria stabi-lità del benzene porta a concludere chetutti gli atomi di carbonio abbiano ottoelettroni nel guscio di valenza. Pertantoun atomo di carbonio deve condividerepiù di due elettroni di valenza con i pro-pri vicini, ovvero alcuni dei legami car-bonio-carbonio devono essere multipli.Specificamente, nella struttura ad anellotre legami semplici, indicati con C — C,devono alternarsi a tre legami doppi,rappresentati con C = C. (Le molecolecicliche che hanno questa alternanza dilegami semplici e doppi prendono il no-me di anuleni.) Il doppio legame carbo-nio-carbonio è più forte e più corto di unlegame semplice; è formato da un lega-me a e da un più debole legame n chenasce dalla sovrapposizione di orbitali p.
Sebbene spesso ci si riferisca a un da-to legame come formato da elettronispecifici, lo si fa solo a scopo di «con-tabilità»: in realtà gli elettroni lt del ben-zene possono spostarsi liberamente sututti gli atomi di carbonio, come dimo-stra il fatto che tutti i legami dell'anellohanno forza e lunghezza identiche. Que-sto significa che la struttura del benzeneè un ibrido delle due possibili configu-razioni di legami semplici e doppi alter-nati: è cioè un ibrido di risonanza.
Tuttavia la delocalizzazione degli e-lettroni n non può spiegare da sola l'ec-cezionale stabilità dei composti aroma-tici. Anche nel ciclobutadiene (C4114),un anello di quattro atomi di carboniocon due doppi legami, gli elettroni IC so-no delocalizzati su tutta la struttura, maal contrario del benzene questo compo-sto è notoriamente reattivo e difficile dapreparare. Il ciclobutadiene può esseresintetizzato solo a temperature inferioria circa 20 kelvin e si decompone rapi-damente quando viene riscaldato. Per-ché dunque un anello di sei atomi di car-bonio deve avere una stabilità tanto su-periore a uno di quattro atomi con strut-tura simile?
Una parziale spiegazione fu fornita nel1931 dal chimico tedesco Erich
Htickel, il quale scoprì una regola chepermetteva di determinare se una certaconfigurazione di elettroni n in una mo-lecola conferisse una elevata stabilità.Gli elettroni n di una molecola occupanoorbitali molecolari che sono del tuttoanaloghi agli orbitali atomici; e, comeper questi ultimi, esistono «numeri ma-gici» che corrispondono al numero dielettroni n necessari per riempire i varigusci molecolari. Questi numeri magicisono 2, 6, 10, 14 e così via; ogni altronumero di elettroni n dà origine a uncomposto instabile.
Questa regola può essere espressa intermini generali. Le molecole e gli ioniad anello singolo che contengono 4n(dove n è un qualsiasi intero positivo)elettroni n sono estremamente instabili,mentre quelli che hanno un numero ma-gico di elettroni (vale a dire 4n + 2) sonostabili. La regola di Htickel permise perla prima volta di spiegare perché il ben-zene, che ha sei elettroni n (n = 1), siastabile mentre il ciclobutadiene, che neha quattro, non lo sia.
Il metodo degli orbitali molecolari diHiickel ebbe notevole successo nellospiegare la stabilità dei composti aroma-tici, ma si applicava solo a molecole adanello singolo. Gli eccezionali progressiregistrati nel campo della chimica orga-nica dopo la seconda guerra mondialecondussero alla sintesi di grandi mole-cole aromatiche, molte delle quali costi-tuite da diversi anelli condensati. La re-gola di Htickel non sembrava in gradodi prevedere la stabilità di queste nuovemolecole policicliche.
Per ulteriori progressi si dovette atten-dere fino al 1964 quando Michael J. S.
68 LE SCIENZE n. 285, maggio 1992
5 10 15 20
TEMPO DALLA SEPARAZIONE DEL CAMPIONE (MINUTI)
Lo spettro ultravioletto dei residui di combustione di un motore diesel rivela lapresenza di molti composti aromatici policiclici (gruppi di esagoni). I vari composti,separati con solventi organici, formano intensi picchi di assorbimento; il gruppo dipicchi all'estrema sinistra corrisponde a molecole aromatiche relativamente piccole.
Dewar, ora all'Università della Florida aGainesville, e altri svilupparono il loroconcetto di energia di risonanza. Mentrestudiavano gli stati quantici degli elet-troni n nelle molecole, essi scoprironoche i singoli legami delle molecole adanello sono differenti da quelli delle mo-lecole a catena aperta. In particolare, inqueste ultime i legami dello stesso tipohanno sempre approssimativamente lastessa energia: l'energia del legame dop-pio carbonio-carbonio è di 5,5378 elet-tronvolt (eV) e quella del legame sem-plice è di 4,3499 eV. Il legame car-bonio-idrogeno ha un'energia di circa4,4375 eV.
E facile calcolare la quantità di ener-gia necessaria per spezzare una moleco-la a catena aperta nei suoi atomi costi-tuenti (la cosiddetta energia di atomiz-zazione): essa è uguale alla somma del-le energie di tutti i legami della catena.Per esempio, il butadiene ha due lega-mi doppi e un legame semplice carbo-nio-carbonio e sei legami carbonio-idro-geno; la somma delle energie di legameè quindi 42,051 eV. L'energia di atomiz-zazione del butadiene calcolata a partireda raffinati modelli degli orbitali mole-colari è di 42,054 eV, in accordo quasiperfetto con il valore ottenuto dalla som-ma delle energie di legame.
Questo semplice metodo non è peròapplicabile alle strutture ad anello. Nelbenzene, per esempio, la somma delleenergie di legame (tre legami doppi, tresemplici e sei legami carbonio-idroge-no) è di 56,288 eV. Questo valore do-vrebbe essere uguale all'energia di ato-mizzazione, che invece risulta pari a57,157 eV. La differenza di 0,869 eVcorrisponde a un'energia di stabilizza-
zione di 20 kcal/mol. Poiché si ritieneche l'energia dei legami carbonio-idro-geno sia essenzialmente la stessa in unamolecola ad anello e in una a catenaaperta, l'effetto di stabilizzazione deveessere provocato dalla struttura dei lega-mi carbonio-carbonio, vale a dire dallapresenza dell'anello. Dewar e colleghidiedero a questa energia di stabilizzazio-ne il nome di energia di risonanza, doveil termine «risonanza» si riferisce al fat-to che gli elettroni n sono delocalizzatie stabilizzati energeticamente. (In moltitesti di chimica l'energia di risonanzadel benzene è valutata in 36 kcal/mol;tuttavia questo valore si basa su una dif-ferente definizione di energia di riso-nanza, che include altri fattori oltre al-l'aromaticità.)
Il benzene non è un caso isolato: altremolecole cicliche hanno energie di ato-mizzazione diverse da quelle che si ot-tengono dalla somma delle energie di le-game. La loro energia di risonanza puòessere sia positiva sia negativa; Dewardefinì aromatici quei composti che han-no energia di risonanza positiva e oggila sua definizione è la più accettata.
In realtà, però, l'energia di risonanzaper elettrone n è un indicatore della sta-bilità migliore che non l'energia di riso-nanza dell'intera molecola. Se l'energiaper elettrone n è grande, questo significache i legami n, di solito deboli, risultanorafforzati. Il benzene ha uno dei valoripiù elevati, mentre molecole come il ci-clobutadiene hanno energia di risonanzaper elettrone n negativa; questi compo-sti sono difficili da sintetizzare e si de-compongono rapidamente. L'energia dirisonanza spiega quindi perché i compo-sti aromatici si formino così facilmente
e siano dotati di una struttura ad anel-lo tanto stabile.
Ati 44i!
Vito enché il concetto di energia di riso-nanza proposto da Dewar abbia ap-
profondito le nostre conoscenze sullastabilità dei composti aromatici, vi è unadomanda che rimane in sospeso: nellemolecole a catena aperta legami dellostesso tipo devono avere sempre e ne-cessariamente uguale energia? Finoranon si è trovata alcuna risposta. Lo stes-so Dewar riteneva che l'assegnazione dienergie uguali ai legami fosse solo uncomodo espediente e non riusciva aspiegare perché una struttura ad anel-lo dovesse influenzare la stabilità. Seb-bene sia utile, il concetto di energia dirisonanza è fondato su relazioni empiri-che e non può quindi chiarire da solo lavera natura della stabilità dei compostiaromatici.
Cosa ancora più importante, la defini-zione di Dewar non si applica a tutte lemolecole ad anello, soprattutto a quelledotate di carica. In ioni come l'anioneciclopentadienilico (C 5H5-) e il cationecicloeptatrienilico (C 7H7+, detto ancheione tropilio) sei elettroni n circolanonell'anello, proprio come accade nelbenzene neutro, ma la definizione di De-war non riesce a spiegare perché questicomposti siano stabili.
Nel 1975 io e, indipendentemente,Ivan Gutman, Milorad Milun e NenadTrinajstie dell'Istituto Rugjer Bakoviedi Zagabria abbiamo formulato un me-todo capace di superare gran parte delledifficoltà in cui incappava il metodo diDewar applicando i concetti della topo-logia alla teoria degli orbitali molecolaridi Hiickel. Al contrario del metodo diDewar, la nostra descrizione non ri-chiede il calcolo dell'energia dei singo-li legami, ma ci consente di ricavarel'energia di risonanza (di stabilizzazio-ne) di un certo composto reinterpretandoin termini matematici l'intera strutturamolecolare. Essenzialmente, con questaprocedura si riconfigurano matematica-mente le strutture ad anello in molecole(ipotetiche) a catena aperta.
Come si può facilmente immaginare,i calcoli che entrano in gioco sono note-volmente complessi, ma per fortuna nonè indispensabile comprendere tutti i det-tagli per avere un'idea del metodo. Ilprimo passo è quello di definire un'e-quazione, chiamata polinomio caratteri-stico, specifica per il composto in esamee ricavabile dalla teoria degli orbitalimolecolari di Hiickel. Le radici del po-linomio rappresentano i livelli energeticipermessi per gli elettroni n.
Ma non sono questi livelli energeticiin sé a fornire l'energia di risonanza; do-po tutto, occorre fare una distinzione fral'energia dei legami e l'energia dellastruttura ad anello vera e propria. Pertrovare la differenza, si genera una strut-tura ipotetica supponendo che gli elet-troni n non circolino in un anello, ossiache si comportino come se si trovassero
70 LE SCIENZE n. 285, maggio 1992
NEBULOSA DI ORIONE
— RESIDUIDI COMBUSTIONE
FREQUENZA DELLA LUCE OSSERVATA
La nebulosa di Orione contiene probabilmente vari composti aromatici. Lo spettroinfrarosso della sua regione centrale è molto simile allo spettro Raman nel visibiledei residui di combustione di un motore di automobile, che contengono molecolearomatiche. Si ritiene che i composti di questa classe siano diffusi in tutto l'universo.
Stabilità di alcuni composti ciclici del carbonio
L'energia di risonanza topologica per elettrone Tc (in pa-rentesi), espressa in termini del valore assoluto di 13, èmisura della stabilità. I composti aromatici stabili hannoenergia positiva; i valori negativi indicano specie antia-
romatiche. Le strutture mostrate includono solo i legamicarbonio-carbonio dell'anello, mentre quelli carbonio-i-drogeno sono ignorati; il benzene appare così come unsemplice esagono. I tratti rossi rappresentano legami it.
BENZENE
NAFTALENE
ANTRACENE(0,0454)
(0,0389)
(0,0339)MOLTO STABILE
STABILE
STABILE
FENANTRENE
PIRENE
CORONENE(0,0390)
(0,0374)
(0,0395)STABILE
STABILE
MOLTO STABILE
CIRCUMANTRACENE(0,0369)
MOLTO STABILE, POTREBBEESISTERE NELLE NEBULOSE
DODECABENZOCORONENE(0,0388)
NON ANCORA SINTETIZZATO,MA SI RITIENE CHE SIA STABILE
ED ESISTA NELLE NEBULOSE
BUCKMINSTERFULLERENE (C60)(0,0274)
GRANDE MOLECOLA CAVA STABILE.LA TERZA FORMA DEL CARBONIO PURO,
HA PROPRIETÀ DIFFERENZIATESE COMBINATA CON ALTRI ELEMENTI
CICLOBUTADIENE(- 0,3066)
ESTREMAMENTE INSTABILE;ANCHE SE FOSSE SINTETIZZATO
NON POTREBBE ESSERE ISOLATO
ANIONE CICLOPENTADIENILICO(0,0528)
REAGISCE CON L'OSSIGENO,MA È UNO DEGLI IONINEGATIVI PIÙ STABILI
CICLOOTTATETRAENE(- 0.0744)
MOLTO REATTIVO:LA STRUTTURA NON PLANAREIMPEDISCE AGLI ELETTRONI n
DI MUOVERSI NELL'ANELLO
PENTALENE(- 0,0269)
ESTREMAMENTE REATTIVO;ANCHE SE FOSSE SINTETIZZATO
NON POTREBBE ESSERE ISOLATO
IONE TROPILIO(0,0376)
UNO DEGLI IONIPOSITIVI PIÙ STABILI
AZULENE
EPTALENE
s-INDACENE(0,0151)
(-0,0118)
(0,0046)ABBASTANZA STABILE
NON PLANARE, REAGISCE CON L'OSSIGENO
TERMICAMENTE INSTABILE;E POLIMERIZZA SE RISCALDATO
SI OSSIDA FACILMENTE
OVALENE(0,0382)STABILE
in una catena aperta (alla quale abbiamodato il nome di «quasicatena»). Si puòcosì ottenere quello che chiamo polino-mio di riferimento. (Trinajstié e colleghipreferiscono il termine di «polinomioacilico».)
La risoluzione del polinomio di rife-rimento dà i livelli energetici degli elet-troni n degli atomi in questione organiz-zati in una quasicatena. La differenza trai livelli energetici della struttura reale(l'anello) e quelli della struttura ipoteti-ca (la quasicatena) è l'energia di stabi-lizzazione associata all'anello. Questaenergia in più è una chiara indicazionedel ruolo attivo svolto dalla struttura ci-clica. L'energia di risonanza è espressamediante il valore assoluto di 13 (scrittoI p I); questa grandezza, che si basa sullateoria degli orbitali molecolari di Htickele ha valore negativo, rappresenta il gra-do di interazione dei gusci di valenza diatomi adiacenti.
Il metodo dell'energia di risonanza to-pologica chiarisce da un punto di vistanumerico perché i composti aromaticisiano stabili. La circolazione degli elet-troni n in una struttura ad anello è taleda stabilizzare l'intera molecola; questielettroni esistono anche in molte mole-cole a catena aperta, ma in esse non pos-sono seguire un percorso ad anello equindi la loro energia di risonanza ènulla.
Pertanto la nostra definizione di ener-gia di risonanza è l'unica descrizioneteorica unificata dell'aromaticità e in-corpora tutti i tentativi precedenti dispiegare questo fenomeno. Come nelmetodo di Dewar, un'energia di risonan-za positiva indica che la molecola è sta-bilizzata dagli elettroni n che si muovo-no nell'anello e che quindi è aromatica.(L'energia di risonanza topologica cor-risponde quasi esattamente all'energia dirisonanza di Dewar se si assegna a 13 il
valore — 3,562 eV.) Ma la nostra teoriaelude quello che nell'ipotesi di Dewar èun ostacolo inevitabile: la supposizioneche legami dello stesso tipo in molecolea catena aperta abbiano energie uguali.Forse ancora più importante è il fattoche il nostro metodo è applicabile ancheagli ioni e consente di ricavare l'energiadi risonanza di anelli dotati di carica conuna precisione identica a quella raggiun-gibile per anelli neutri.
Il metodo dell'energia di risonanza to-pologica conferma anche la regola diHtickel. Hiroshi Ichikawa dello HoshiCollege of Pharmacy di Tokyo e io ab-biamo dimostrato che le molecole e gliioni monociclici che possiedono un nu-mero magico (4n + 2) di elettroni n han-no sempre energie di stabilizzazione po-sitive e quindi sono composti aromatici.Tutte le altre molecole monociclicheneutre o cariche hanno energie negativee sono instabili, proprio come afferma laregola di Htickel.
Haruo Hosoya e Kikuko Hosoi del-l'Università Ochanomizu di Tokyo eGutman, che attualmente lavora all'Uni-versità Kragujevac in Serbia, hanno uti-lizzato un metodo analogo alla teoriadell'energia di risonanza topologica perdimostrare che la regola di Htickel è va-lida anche per grandi molecole policicli-che; in precedenza questa estensionedella regola era ritenuta impossibile. Itre ricercatori hanno postulato che unamolecola neutra è energeticamente sta-bile se gli elettroni n possono seguiremolte traiettorie di forma esagonale. Seperò esistono traiettorie quadrangolari oettagonali, le molecole tendono a dive-nire instabili. Questo ragionamento aiutaa spiegare perché gli idrocarburi aroma-tici policiclici abbiano energie di riso-nanza elevate. Dato che queste molecolesono costituite da molti anelli benzenicicondensati, gli elettroni 1C hanno a dispo-sizione un gran numero di traiettorieesagonali da seguire, il che rende lastruttura altamente stabile. Con metodimatematici ho dimostrato che la regoladi Hosoya-Hosoi-Gutman è valida per lamaggior parte delle molecole neutre.
T a nostra teoria ha cominciato a dareprova della sua potenza e utilità. Nel
1984 Alain Léger e Jean-Loup Pugetdell'Université de Paris VII ipotizzaronoche nelle nebulose esista una varietà digrandi molecole aromatiche; tre anni do-po riuscii a stabilire di che tipo debbanoessere questi composti. Non può trattarsidi molecole piccole perché il calcolodell'energia topologica di risonanza e irisultati delle osservazioni astronomicheindicano che la radiazione ultraviolettadi elevata intensità emessa dalle stellevicine ecciterebbe e poi distruggerebbequeste molecole; i grandi, compatti idro-carburi aromatici policiclici dovrebberoinvece riuscire a sopravvivere nelle ne-bulose. I calcoli indicano che queste mo-lecole hanno stati eccitati con energie dirisonanza molto elevate e quindi posso-
72 LE SCIENZE n. 285, maggio 1992 LE SCIENZE n. 285, maggio 1992 73
L'energia di risonanza topologica del naftalene
NAFTALENE C1OH8
Si può determinare la stabilità di questa molecola risolvendone il polinomiocaratteristico P(x) (a sinistra). Le radici dell'equazione corrispondono alleenergie dei 10 elettroni rr del naftalene (pallini), che occupano a due a due ilivelli energetici a partire dal più basso. (Cinque livelli di energia più elevatarimangono vuoti.) Queste energie (espresse in termini di f3) sono confrontatecon quelle ottenute dal polinomio di riferimento R(x) (a destra) che interpretamatematicamente il naftalene come una “quasicatena". La differenza fra lesomme delle energie è l'energia di risonanza topologica, pari a 0,3886 ps I .
P(x) = R(x) =
= x10 - 11x8 + 41x6 - 65x4 + 43x 2 - 9 = = x l ° - 11x8 + 41x6 - 61 x4 31 x 2 - 3 = O
0 0• • 0,3536
0.8654
1 46391,7321
0,6180
1,00001,30281,6180
2,3028
SOMMA DELLE ENERGIE = 13,6832
22323
SOMMA DELLE ENERGIE = 13,2946
ENERGIA DI RISONANZA TOPOLOGICA = 13,6832 - 13,2946 = 0.3886
no essere stabili anche in un ambientetanto ostile. Le più recenti osservazioniastronomiche concordano con questeprevisioni.
Uno dei composti del quale è più pro-babile la presenza nelle nebulose è il do-decabenzocoronene, la cui molecola,non ancora sintetizzata, è costituita da19 anelli benzenici disposti a formare unesagono; un'altra possibilità è rappre-sentata dal circumantracene. Ho calcola-to la stabilità di questi composti nel1987, e nel 1991 Richard D. Broene eFrancois N. Diederich dell'Universitàdella California a Los Angeles sono ri-usciti a sintetizzare il circumantracene.Come previsto, si tratta di una molecolamolto stabile.
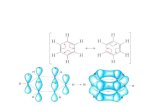
La teoria dell'energia di risonanza to-pologica si applica anche ai fullereni,che sono grandi strutture cave, tridimen-sionali, di atomi di carbonio. Il più facileda sintetizzare è il buckminsterfullerene(C60), prodotto per vaporizzazione dellagrafite con il laser, che ha la forma diun pallone da calcio. La versatilità e lesvariate proprietà di queste molecolestanno suscitando grande interesse, so-prattutto da quando nel 1990 si è trovatocome produrle in quantità (si veda l'ar-ticolo I fullereni di Robert F. Curi eRichard E. Smalley in «Le Scienze»n. 280, dicembre 1991).
La struttura dei fullereni pone qualcheproblema alle teorie tradizionali dell'a-romaticità. La regola di Hiickel non èapplicabile al buckminsterfullerene, datoche questo ha una struttura policiclicatridimensionale. Anche il metodo di De-war fallisce perché le energie di legamedi un sistema siffatto sono sconosciute.Nel 1988 Hosoya e io abbiamo previsto
che C60, che è costituito da 20 esagonidi tipo benzenico e da 12 pentagoni, do-vrebbe essere moderatamente aromaticoe abbiamo calcolato che l'energia di ri-sonanza per elettrone n dovrebbe essereuguale a 0,0274 I [31. (L'energia di riso-nanza del benzene, che è fortemente a-romatico, è 0,04541131.) Gli ioni negati-vi del buckminsterfullerene sono aro-matici come la molecola neutra; l'anio-ne C603-, che a temperature molto bas-se diventa superconduttore, ha un'ener-gia di risonanza per elettrone n ugualea 0,02411131. Sembra invece che l'a-romaticità degli ioni positivi sia moltoinferiore.
Il metodo dell'energia di risonanza to-pologica è anche l'unico che spieghi ildiamagnetismo in termini di aromaticità.Le molecole diamagnetiche sono debol-mente respinte dai campi magnetici, unfenomeno questo dovuto ai moti deglielettroni nella molecola. Il campo ma-gnetico esterno che agisce sugli elettroniin movimento modifica gli stati quanticidi tutti gli elettroni e questa modifica-zione genera un momento magnetico diorientazione opposta al campo applicato.
Sebbene tutti i composti organici pos-siedano in una certa misura questa pro-prietà, le molecole aromatiche hannoun diamagnetismo particolarmente ac-centuato e l'effetto repulsivo diventapiù forte all'aumentare dell'intensità delcampo magnetico. Nel 1981 sono riusci-to a correlare le proprietà diamagnetichedovute al moto degli elettroni dell'anelloall'energia di risonanza topologica. Nonsi tratta di una relazione semplice. Es-senzialmente, se gli elettroni n si muo-vono su una traiettoria ad anello che sta-bilizza la molecola, il diamagnetismo è
più accentuato, mentre si riduce nel casodi traiettorie ad anello che destabilizza-no la struttura. L'aumento del diama-gnetismo è una manifestazione della for-te tendenza della molecola a rimanerestabile, in quanto esso tende a neutra-lizzare l'effetto del campo magneticoesterno.
Vi sono due potenziali inconvenienti
nell'uso dell'energia di risonanzatopologica come indice di stabilità. Inprimo luogo il polinomio caratteristicodipende dalla teoria degli orbitali mole-colari di Hiickel, che non è esente da ap-prossimazioni, e quindi potrebbe conte-nere errori; tuttavia essa è pur semprel'unico quadro teorico disponibile peruno studio analitico dell'aromaticità.
Inoltre l'energia di risonanza topolo-gica rappresenta in effetti la stabilitàenergetica (termodinamica). E però pos-sibile che alcuni composti siano energe-ticamente instabili, ma chimicamenteinerti, ossia che la molecola abbia un'e-nergia di risonanza negativa, ma che perqualche ragione non sia molto reattiva.In questi casi l'energia di risonanza to-pologica non rappresenterebbe la stabi-lità osservata della molecola.
Per fortuna la maggior parte delle mo-lecole energeticamente stabili è anchechimicamente stabile; questo fa sì che lecapacità di previsione del metodo dell'e-nergia di risonanza topologica non ven-gano compromesse, tranne che in pochicasi eccezionali. Sembra proprio di poteraffermare che, dopo oltre un secolo ditentativi teorici, è stata finalmente trova-ta una spiegazione della stabilità deicomposti aromatici, che promette di di-venire uno strumento utile e potente perl'esplorazione del mondo della chimicaorganica.
BIBLIOGRAFIA
AIHARA J., A New Definition of De-war-Type Resonance Energies in «Jour-nal of the American Chemical Society»,98, n. 10, 12 maggio 1976.
GUTMAN I., MILUN M. e TRINAJSTIC N.,Graph Theory and Molecular Orbitals,Part 19: Nonparametric Resonance E-nergies of Arbitrary Conjugated Systemsin «Journal of the American ChemicalSociety», 99, n. 6, 16 marzo 1977.
AIHARA J., Unified Theory of Aroma-ticity and London Diamagnetism in«Journal of the American Chemical So-ciety», 103, n. 19, 23 settembre 1981.
AIHARA L, Aromaticity and Diatropi-city in «Pure and Applied Chemistry»,54, n. 5, maggio 1982.
TRINAJSTIC N., Chemical Graph Theo-ry, Vol. 2, CRC Press, 1983.
AIHARA J. e HOSOYA H., Spherical A-romaticity of Buckminsterfullerene in«Bulletin of the Chemical Society of Ja-pan», 61, n. 7, luglio 1988.
74 LE SCIENZE n. 285, maggio 1992