Il rachitismo carenziale · CONCETTI CHIAVE 1 La vitamina D svolge un ruolo fondamentale nel...
-
Upload
duongkhuong -
Category
Documents
-
view
214 -
download
0
Transcript of Il rachitismo carenziale · CONCETTI CHIAVE 1 La vitamina D svolge un ruolo fondamentale nel...
D o s s i e r e n D o c r i n o l o g i AACon test di autovalutazione
Il rachitismo carenzialeGiuseppe Saggese, Francesco Vierucci
UO Pediatria II, Azienda Ospedaliero-Universitaria Pisana, Ospedale Santa Chiara, Pisa
ABSTRACTIl metabolismo fosfo-calcico è regolato essenzialmente dal paratormone e dalla vitamina D. Il paratormone agisce a livello osseo stimolando il riassorbimento di calcio e a livello renale pro-muovendo il riassorbimento di calcio, l’escrezione di fosfato e la conversione della vitamina Dnella sua forma ormonale attiva, la 1,25-diidrossivitamina D (1,25-OH2D). Parallelamente all’azio-ne del paratormone, la 1,25-OH2D stimola, con un meccanismo di tipo ormonale, l’assorbimen-to di calcio e fosforo a livello intestinale. L’azione combinata di paratormone e vitamina D de-termina quindi un aumento del prodotto calcio-fosforo necessario per un corretto processo dimineralizzazione ossea.Conoscenze recenti hanno dimostrato che la vitamina D svolge anche importanti funzioni ex-tra-scheletriche, come la promozione dell’immunità innata e la regolazione della crescita cellu-lare; il recettore della vitamina D viene infatti espresso in diversi organi e apparati. Queste nuo-ve acquisizioni sottolineano come uno stato vitaminico D insufficiente possa avere varie riper-cussioni sulla salute dell’uomo sino alla conseguenza estrema della deficienza di vitamina D, il ra-chitismo carenziale.Il rachitismo carenziale, caratterizzato da una ridotta mineralizzazione della cartilagine di ac-crescimento con conseguente accumulo di matrice ossea non mineralizzata (tessuto osteoi-de), è presente ancora oggi nei paesi in via di sviluppo ed è in aumento nei paesi industrializ-zati. Soggetti a rischio sono i bambini di colore, quelli che vivono ad alte latitudini, quelli ali-mentati con allattamento al seno esclusivo e prolungato non supplementati con vitamina D,i nati da madri affette da deficienza di vitamina D, gli immigrati e i bambini adottati.La diagnosi di rachitismo si basa sull’interpretazione dei segni clinici e radiologici, dovuti al-l’accumulo di tessuto osteoide non mineralizzato, e dei parametri biochimici. I bambini nati damadri con grave deficienza di vitamina D possono avere un esordio precoce di rachitismo,anche con ipocalcemia sintomatica, quando le tipiche alterazioni scheletriche non sono an-cora comparse.La terapia del rachitismo si basa sulla somministrazione di vitamina D per via orale: sono gene-ralmente efficaci dosi giornaliere di 1.000-10.000 UI in base all’età, da continuare dopo la nor-malizzazione dei parametri radiologici e biochimici con dosi profilattiche di 400 UI/die. Nei casi discarsa compliance si può somministrare una dose semi-urto (100.000-200.000 UI per os o im), ri-petibile dopo tre mesi fino alla guarigione radiologica delle lesioni. In presenza di ipocalcemiaasintomatica o tetania latente è necessario somministrare anche calcio per via orale, mentre incaso di tetania o convulsioni il calcio va somministrato per via endovenosa. Gli apporti di vitamina D attualmente raccomandati dalla American Academy of Pediatrics so-no di 400 UI/die durante tutta l’età evolutiva. La profilassi del rachitismo carenziale si effettua som-ministrando 400 UI/die di vitamina D fin dai primi giorni di vita a ogni bambino alimentato con al-lattamento al seno esclusivo o parziale che non assuma almeno un litro/die di latte formulatocontenente 400 UI/l di vitamina D. Anche i bambini più grandi e gli adolescenti sono a rischio dideficienza di vitamina D e possono richiedere supplementazione con 400 UI/die di vitamina D incaso di insufficiente esposizione solare o scarso apporto dietetico. Un’attenzione particolare va ri-volta ai nati pretermine, che possono richiedere dosi maggiori (800-1.000 UI/die) di vitamina finoal raggiungimento di un’età pari a 40 settimane post-concezionali. Uno stato vitaminico D ade-guato deve essere assicurato anche durante la gravidanza, per l’importante ruolo della vitami-na D sulla programmazione della futura acquisizione della massa ossea del bambino.
D o s s i e r e n D o c r i n o l o g i A
PREREQUISITI1 Conoscenza dell’anatomia macro e microscopica del tessuto osseo.
2 Nozioni fondamentali sulla fisiologia della mineralizzazione del tessuto osseo.
OBIETTIVI DEL DOSSIER1 Indicare le principali azioni della vitamina D a livello osseo ed extra-scheletrico.
2 Descrivere i criteri per la valutazione dello stato vitaminico D durante l’età evolutiva.
3 Sottolineare l’importanza di una corretta esposizione dei bambini alla luce solare.
4 Illustrare l’epidemiologia attuale del rachitismo carenziale.
5 Promuovere il riconoscimento precoce dei soggetti a rischio di sviluppare rachitismo carenziale.
6 Descrivere gli elementi essenziali per la diagnosi di rachitismo carenziale (segni clinici, radiologici, biochimici).
7 Fornire le nozioni di base della terapia e della profilassi del rachitismo carenziale.
CONCETTI CHIAVE1 La vitamina D svolge un ruolo fondamentale nel regolare l’omeostasi fosfo-calcica e il processo di mineralizza-
zione ossea.
2 La 25-idrossivitamina D (25-OHD) è il maggior metabolita circolante della vitamina D e rappresenta l'indice
più accurato per valutare lo stato vitaminico D di un soggetto.
3 Il rachitismo carenziale non è che la punta dell’iceberg della deficienza di vitamina D. Date le numerose azioni
extra-scheletriche della vitamina, la sua insufficienza (valori di 25-OHD compresi tra 15 e 20 ng/ml), e non
solo la deficienza (valori di 25-OHD inferiori a 15 ng/ml), può avere risvolti considerevoli per la salute.
4 Dato che il 90% dell’approvvigionamento di vitamina D deriva dalla sintesi cutanea in seguito a esposizione
solare, è necessario rivalutare una corretta esposizione dei bambini al sole, senza tuttavia incrementare il ri-
schio di sviluppare neoplasie cutanee.
5 Il rachitismo carenziale non è scomparso.
6 Un’accurata anamnesi e l’esame obiettivo del bambino sono fondamentali per porre il sospetto di rachitismo.
7 Il tipico varismo degli arti inferiori è solo uno dei tanti segni clinici di rachitismo.
8 Il rachitismo può esordire acutamente con convulsioni da ipocalcemia.
9 La diagnosi di rachitismo si basa su segni clinici, biochimici e radiologici.
10 Il paratormone (PTH), la fosfatasi alcalina e la 25-OHD sono i parametri biochimici diagnostici essenziali.
11 La terapia del rachitismo carenziale si basa sulla somministrazione di vitamina D, con l’aggiunta di calcio se
presente ipocalcemia.
12 Gli apporti di vitamina D attualmente raccomandati dalla American Academy of Pediatrics sono
di 400 UI/die durante tutta l’età evolutiva.
13 La profilassi con 400 UI/die di vitamina D dovrebbe essere attuata fin dai primi giorni di vita in ogni bambi-
no alimentato con allattamento al seno esclusivo o parziale che non assuma almeno un litro/die di latte for-
mulato contenente 400 UI/l di vitamina D.
14 Anche l’adolescenza è un periodo della vita a rischio di deficienza di vitamina D soprattutto in presenza di in-
sufficiente esposizione solare o scarso apporto dietetico.
15 La gravidanza e l’allattamento sono periodi della vita particolari, in cui è opportuno assicurare nella madre e
nel bambino uno stato vitaminico D sufficiente.
II n. 3 - Maggio/Giugno 2010Ap
✂
pA n. 3 - Maggio/Giugno 2010
D o s s i e r e n D o c r i n o l o g i A
Il rachitismo carenzialeGiuseppe Saggese,Francesco VierucciUO Pediatria II,Azienda Ospedaliero-Universitaria Pisana,Ospedale Santa Chiara, Pisa
OBIETTIVOAccennare allo sviluppodelle conoscenze edelle ipotesi scientifichesulle cause delrachitismo carenziale
BIBLIOGRAFIA
1 Thacher TD, Fischer PR, Strand
MA, et al. Nutritional rickets around
the world: causes and future
directions. Ann Trop Paediatr
2006;26:1-16.
2 O'Riordan JL. Rickets in the 17th
century. J Bone Miner Res
2006;21:1506-10.
LLa scoperta della vitamina D ha se-
gnato una tappa fondamentale per
la medicina moderna in quanto ha per-
messo di iniziare a comprendere i comples-
si meccanismi che regolano l’omeostasi fo-
sfo-calcica e i processi di mineralizzazione
ossea e, soprattutto, ha permesso di curare
una malattia dell’età evolutiva insidiosa e
importante come il rachitismo carenziale.
La vitamina D ha assunto progressivamen-
te un ruolo sempre più centrale nella pro-
mozione della salute e recenti scoperte
stanno dimostrando come essa svolga an-
che importanti funzioni extra-scheletriche.
Questo dossier focalizzerà inizialmente l’at-
tenzione sulla fisiologia e sulle recenti ac-
quisizioni relative al sistema endocrino della
vitamina D, per poi svolgere una trattazio-
ne approfondita del rachitismo carenziale,
nonché della profilassi della deficienza di
vitamina D.
nCENNI STORICI
Il rachitismo carenziale è una patologia an-
tica che, dopo essere stata ritenuta per
molto tempo quasi scomparsa, attualmen-
te sta avendo nuova e importante diffusio-
ne in tutto il mondo (1).La descrizione di condizioni patologiche
associate a deformità scheletriche è già
presente nei trattati medici di autori greci e
romani, ma solo verso la metà del XIX seco-
lo compaiono le prime segnalazioni di casi
di rachitismo: il termine inglese rickets ap-
pare la prima volta nel 1634 nel registro del-
le cause di mortalità della città di Londra
(14 casi). Undici anni dopo, nel 1645, Daniel
Whistler pubblica la prima descrizione det-
tagliata dei segni clinici del rachitismo. Nel-
la Londra della rivoluzione industriale era
presente un forte inquinamento atmosferi-
co: le particelle generate dalla combustio-
ne industriale creavano una cappa sopra
la città che ostacolava il normale passag-
gio dei raggi solari, molte persone vivevano
in condizioni disagiate e con scarsa igiene
e le abitazioni erano separate solo da vico-
li stretti con ulteriore riduzione dell’esposi-
zione alla luce solare (2).I due secoli successivi non videro ulteriori
conquiste nello studio e nel trattamento
del rachitismo, tanto che all’inizio del XIX
secolo questa patologia era ormai molto
diffusa tra i bambini appartenenti alle clas-
si meno agiate che abitavano nelle città
industrializzate del nord degli Stati Uniti e
dell’Europa, zone caratterizzate da un in-
tenso inquinamento atmosferico.
Nel 1919 Edward Mellanby intuì il ruolo
chiave di una dieta non corretta nell’ezio-
patogenesi del rachitismo. Egli vide che ali-
menti ricchi di vitamina A, come l’olio di fe-
gato di merluzzo, il burro e il latte intero, po-
tevano prevenire l’insorgenza del rachiti-
smo, probabilmente perché contenevano
un “fattore antirachitico”. Successivamente
Elmer McCollum dimostrò come la sostan-
za capace di regolare il metabolismo os-
seo fosse, in realtà, diversa dalla vitamina A:
questa sostanza divenne la quarta vitami-
na liposolubile scoperta, per cui, seguendo
l’ordine delle lettere dell’alfabeto, fu chia-
mata vitamina D.
Comunque, la terapia del rachitismo era
già stata intuita precedentemente alla
scoperta della vitamina D: secondo il folk-
lore popolare, l’assunzione di olio di fegato
di merluzzo aveva un’ottima ripercussione
sulla salute e già nel 1824 la letteratura te-
desca riporta la prescrizione di tale olio co-
me terapia delle deformità rachitiche.
Trousseau nel 1861 e Palm nel 1890 com-
presero empiricamente che una scarsa
esposizione solare poteva causare lo svi-
luppo del rachitismo: Palm, infatti, racco-
mandava bagni di sole come misura pre-
ventiva e terapeutica. Infine Huldschinky
nel 1919 dimostrò che l’esposizione alla lu-
ce artificiale (elioterapia con lampade a
vapore di mercurio) poteva prevenire e
III
✂
n. 3 - Maggio/Giugno 2010ApIV
✂
curare i segni clinici del rachitismo (3). Tutte queste scoperte hanno portato, nel
XX secolo, a un’evidente riduzione della
frequenza dei casi di rachitismo: gli Stati
Uniti negli anni Trenta e il Regno Unito dopo
la seconda guerra mondiale hanno infatti
promosso la supplementazione con vitami-
na D del latte e di alcuni suoi derivati (per
esempio la margarina) e di altri alimenti,
come i succhi di frutta e alcuni prodotti a
base di cereali. In altri paesi, come la Fran-
cia e l’Italia, il declino dei casi di rachitismo
è da ricondurre invece a un’estensiva
campagna di profilassi con vitamina D.
n IL SISTEMA ENDOCRINO DELLA VITAMINA DRuolo nel metabolismo osseoLa vitamina D svolge un ruolo fondamenta-
le nel regolare l’omeostasi fosfo-calcica e in
particolare il processo di mineralizzazione
ossea. Con il termine vitamina D si com-
prendono due diverse forme della vitamina
presenti in natura: la vitamina D3 (colecal-
ciferolo), di origine animale, e la vitamina D2
(ergocalciferolo), di origine vegetale.
L’uomo è in grado si sintetizzare vitamina
D3 a livello cutaneo in seguito all’esposizio-
ne alla luce solare e può introdurre con la
dieta vitamina D3 e vitamina D2, presenti in
quantità significative solo in alcuni cibi (per
esempio salmone, sardina, olio di fegato di
merluzzo, ecc.). Un’altra fonte dietetica im-
portante di vitamina D è rappresentata
dagli alimenti supplementati, come latte,
cereali e succhi di frutta. Nella tabella I è ri-portato il contenuto di vitamina D dei prin-
cipali alimenti. Comunque, il 90% della vita-
mina D deriva dall’esposizione solare (4).La figura 1 mostra il processo di fotosintesidella vitamina D3. A livello cutaneo, in se-
guito a irraggiamento ultravioletto B (UVB,
lunghezza d’onda compresa fra 290 e 315
nm) del 7-deidrocolesterolo (7-DHC) pre-
sente negli strati basale e spinoso dell’epi-
dermide, si produce pre-vitamina D3, una
molecola instabile che viene trasformata in
vitamina D3 tramite un processo di termo-
conversione.
Una proteina di trasporto, la vitamin D bin-
ding protein (DBP), veicola la vitamina D al
fegato dove viene idrossilata in posizione
25 dalla 25-idrossilasi a formare la 25-idrossi-
vitamina D (25-OHD o calcidiolo) che è il
maggior metabolita circolante della vita-
mina D e che rappresenta dunque l’indice
più accurato per valutare lo stato vitamini-
co D di un individuo (5). La 25-OHD giungepoi al rene, dove subisce una seconda
idrossilazione da parte dell’1-alfaidrossilasi
formando così la 1,25-diidrossivitamina D
(1,25-OH2D o calcitriolo), la forma ormona-
le attiva della vitamina D.
La 1,25-OH2D si lega al recettore per la vi-
tamina D (VDR) espresso a livello nucleare
dalle cellule del piccolo intestino; il recetto-
re attivato forma quindi un complesso con
il recettore X dell’acido retinoico (RXR) che
va a legarsi agli elementi di risposta alla vi-
tamina D (VDRE, vitamin D-responsive ele-
ment).
Tutto ciò comporta la trascrizione di geni
che fanno esprimere canali per il calcio da
parte degli enterociti con conseguente
aumento dell’assorbimento intestinale del
calcio. La 1,25-OH2D promuove, inoltre, l’as-
sorbimento intestinale di fosforo (5).
BIBLIOGRAFIA
3 Rajakumar K. Vitamin D, cod-liver
oil, sunlight, and rickets: a historical
perspective. Pediatrics 2003;11:132-5.
4 Holick MF. Vitamin D: importance
in the prevention of cancers, type 1
diabetes, heart disease, and
osteoporosis. Am J Clin Nutr
2004;79:362-71.
5 Holick MF. High prevalence of
vitamin D inadequacy and
implications for health. Mayo Clin
Proc 2006;81:353-73.
OBIETTIVODescrivere i processicoinvolti nella sintesidella vitamina D,il suo ruolo nelmetabolismo osseo e le sue azioniextra-scheletriche
Tabella I Contenuto medio di vitamina D negli alimenti più comunemente assunti
zx Latte vaccino intero 5-40 UI/litro
zxYogurt 2,4 UI/100 g
zx Panna 30 UI/100 g
zx Formaggi 12-15 UI/100 g
zx Burro 30 UI/100 g
zx Uovo (intero crudo) 50 UI/100 g
zx Fegato di manzo 40-70 UI/100 g
zxCarne di maiale 40-50 UI/100 g
zx Pesce (dentice, merluzzo, orata, palombo, 300-1.500 UI/100 gsogliola, trota, salmone, aringhe)
pA n. 3 - Maggio/Giugno 2010 V
D o s s i e r e n D o c r i n o l o g i A
BIBLIOGRAFIA
6 Holick MF. Resurrection of vitamin
D deficiency and rickets. J Clin Invest
2006;116:2062-72.
7 Misra M, Pacaud D, Petryk A, et al.
(Drug and Therapeutics Committee
of the Lawson Wilkins Pediatric
Endocrine Society). Vitamin D
deficiency in children and its
management: review of current
knowledge and recommendations.
Pediatrics 2008;122:398-417.
8 Cranney A, Weiler HA, O'Donnell
S, et al. Summary of evidence-based
review on vitamin D efficacy and
safety in relation to bone health. Am J
Clin Nutr 2008;88:S513-9.
✂
Come si vedrà meglio successivamente, il
calcitriolo non agisce soltanto sugli entero-
citi, poiché è in grado di regolare l’omeo-
stasi fosfo-calcica a vari livelli. È stato recen-
temente dimostrato che quando le quan-
tià di calcio assunte con la dieta sono ina-
deguate, il calcitriolo interagisce con il VDR
espresso dagli osteoblasti facendo loro
esprimere la citochina RANKL. Questa cito-
china lega il recettore RANK espresso sulla
membrana plasmatica dei preosteoclasti,
portando questi ultimi a maturazione e fa-
vorendo il riassorbimento di calcio e fosforo
dall’osso. L’azione del calcitriolo è dunque
sinergica a quella del paratormone (PTH),
l’ormone ipercalcemizzante prodotto dal-
le paratiroidi. Il PTH agisce a livello osseo,
dove stimola il riassorbimento di calcio da
parte degli osteoclasti, e a livello renale,
dove promuove il riassorbimento tubulare
di calcio, l’escrezione di fosfato e la con-
versione della vitamina D nella sua forma
ormonale attiva (1,25-OH2D) per azione
dell’1-alfaidrossilasi (6).La vitamina D gioca un ruolo importante
nella regolazione del metabolismo in diversi
periodi della vita, in particolare durante
l’età evolutiva. Nella vita uterina e nell’infan-
zia l’instaurasi di una deficienza di vitamina
D può causare ritardo di crescita, deformità
scheletriche e un aumento del rischio di frat-
ture nelle fasi successive della vita (7).Lo stato vitaminico D regola, infatti, il proces-
so di acquisizione della massa ossea e il rag-
giungimento del picco di massa ossea, cioè
il livello più alto di massa ossea raggiungibile
durante la vita come risultato di una cresci-
ta normale. Negli adulti una carenza di vita-
mina D può esacerbare lo sviluppo di osteo-
penia e di osteoporosi, causare osteomala-
cia e debolezza muscolare, oltre che au-
mentare il rischio di fratture (8).
Azioni extra-scheletricheIl rachitismo carenziale è solo la punta di un
iceberg della deficienza di vitamina D in
quanto ne rappresenta la conseguenza
estrema. La vitamina D svolge importanti
azioni a livello di diversi organi e apparati,
quindi anche l’insufficienza, e non solo la
deficienza, di vitamina D può avere risvolti
considerevoli per la salute dell’uomo (4,9). La vitamina D regola la crescita cellulare:
la 1,25-OH2D controlla diversi geni respon-
sabili della proliferazione e della differenzia-
zione cellulare (per esempio p21 e p27),
dell’apoptosi e dell’angiogenesi; essa può
diminuire la proliferazione sia delle cellule
normali che delle cellule cancerose e di
queste ultime può indurre la differenziazio-
ne terminale.
Figura 1 - Fotosintesi della vitamina D3 e regolazione dell’omeostasi fosfo-calcica.Legenda: 7-DHC= 7-deidrocolesterolo; UVB= raggi ultravioletti di tipo B dello spettrodella radiazione solare; Pre-D3= previtamina D3; DBP= vitamin D-binding protein(proteina di trasporto della vitamina D); 25-OH-D= 25-idrossivitamina D;1,25(OH)2D= 1,25-diidrossivitamina D; PTH= ormone paratiroideo; Ca= calcio; P=fosforo.Modificata con autorizzazione da: Bernasconi S, Iughetti L, Ghizzoni L.Endocrinologia pediatrica. Milano: McGraw Hill, 2000.
n. 3 - Maggio/Giugno 2010ApVI
✂
La vitamina D svolge anche un’azione im-
munomodulante e di promozione dell’im-
munità innata che potrebbe prevenire l’in-
staurarsi di infezioni ricorrenti e lo sviluppo di
alcune malattie autoimmuni come il dia-
bete di tipo 1, l’artrite reumatoide e la scle-
rosi multipla (4). La deficienza di vitamina Dè stata inoltre associata a un aumento del
rischio di sviluppare diabete di tipo 2, schi-
zofrenia, depressione e malattie cardiova-
scolari (4,9).Molti organi come l’encefalo, la prostata, il
seno, il colon e le cellule dell’immunità in-
nata (macrofagi e monociti) esprimono il
recettore della vitamina D e l’1-alfaidrossi-
lasi. Il calcitriolo comunque esercita le azio-
ni extra-scheletriche della vitamina D solo
a livello locale, senza influenzare l’omeo-
stasi fosfo-calcica, dal momento che viene
degradato a livello tissutale dall’enzima 24-
idrossilasi senza entrare in circolo. Appare
chiaro, pertanto, come la deficienza di vi-
tamina D possa essere insidiosa e possa
comportare conseguenze a lungo termine
per l’organismo (9).
nDEFINIZIONE DELLOSTATO VITAMINICO DIN ADULTI E BAMBINI
Il parametro che riflette con maggior ac-
curatezza lo stato vitaminico D di un indivi-
duo è rappresentato dai valori di 25-OHD.
Nel soggetto adulto Holick suggerisce didefinire come deficienza di vitamina D
quella condizione caratterizzata da valori
di 25-OHD inferiori a 20 ng/ml, mentre valo-
ri compresi tra 20 e 30 ng/ml indicherebbe-
ro uno stato di insufficienza (9). Livelli di 25-OHD superiori a 30-40 ng/ml sarebbero in-
vece sufficienti per un ottimale assorbimen-
to intestinale di calcio, una normale secre-
zione di PTH e l’acquisizione di forza musco-
lare e massa ossea adeguate.
In letteratura non vi è accordo unanime su
tale presa di posizione, in quanto considera-
re sufficienti valori di 25-OHD superiori a 30
ng/ml porrebbe l’80% della popolazione eu-
ropea e circa la metà di quella mondiale a
rischio di deficienza di vitamina D (9).Un altro studio recente conferma questi dati
definendo indice di uno stato vitaminico D
sufficiente per l’adulto il riscontro di valori di
25-OHD superiori a 32 ng/ml (10).Pochi studi hanno cercato di definire i valori
normali di 25-OHD nel bambino e nell’adolescente: vi è consenso nel ritenere fran-camente patologici valori di 25-OHD inferio-
ri a 11 ng/ml (11), ma non vi è accordo suquali siano i valori di 25-OHD che esprimono
un’omeostasi fosfo-calcica ottimale.
Una review recente (7) propone di parlare dideficienza di vitamina D in presenza di valo-
ri di 25-OHD inferiori a 15 ng/ml, come sug-
gerito dal riscontro di casi di rachitismo con
valori di 25-OHD inferiori a 15 ng/ml (6), e diparlare di insufficienza vitaminica D di fronte
a valori di 25-OHD compresi tra 15 e 20
ng/ml, in quanto in questa fascia è stato de-
scritto un iniziale aumento dei valori di fosfa-
tasi alcalina (12). Nella tabella II sono con-frontati i valori di 25-OHD suggeriti in lettera-
tura per l’interpretazione dello stato vitamini-
co D durante la vita adulta e l’età evolutiva.
Come vedremo in seguito, la difficoltà nel
BIBLIOGRAFIA
9 Holick MF. Vitamin D deficiency. N
Engl J Med 2007;357:266-81.
10 Hollis BW. Circulating 25-
hydroxyvitamin D levels indicative of
vitamin D sufficiency: implications for
establishing a new effective dietary
intake recommendation for vitamin D.
J Nutr 2005;135:317-22.
11 Greer FR. Issues in establishing
vitamin D recommendations for
infants and children. Am J Clin Nutr
2004;80:S1759-62.
12 Jones G, Dwyer T, Hynes KL, et
al. Vitamin D insufficiency in
adolescent males in Southern
Tasmania: prevalence, determinants,
and relationship to bone turnover
markers. Osteoporos Int 2005;16:636-
41.
OBIETTIVOIllustrare i parametriutilizzati per definire lo stato vitaminico D nelle varie fasce di età
PUNTO CHIAVEI valori di 25-OHD che definisconouno stato vitaminicosufficiente nel bambinoe nell’adolescente sono tuttora in discussione
Tabella II Valutazione dello statovitaminico D in adulti e in bambini e adolescenti in base all'analisi dei valori plasmatici di 25-OHD
Valori di 25-OHD (ng/ml)
Adulti1 Bambini eadolescenti
zxDeficienza <20 <152
zx Insufficienza 20-30 15-202
zx Sufficienza >30 >202,3
1 Holick et al, 2007 (9).2 Gordon et al, 2008 (37).3 Wagner et al, 2008 (31).
pA n. 3 - Maggio/Giugno 2010 VII
D o s s i e r e n D o c r i n o l o g i A
OBIETTIVOSottolineare il ruolo dell’irradiazione solarenel mantenimentodello stato vitaminico De definire le correttemodalità di esposizione
BIBLIOGRAFIA
13 Holick MF. Sunlight and vitamin
D for bone health and prevention of
autoimmune diseases, cancers, and
cardiovascular disease. Am J Clin
Nutr 2004;80:S1678-88.
14 Munns C, Zacharin MR, Rodda
CP, et al. Prevention and treatment of
infant and childhood vitamin D
deficiency in Australia and New
Zealand: a consensus statement. Med
J Aust 2006;185:268-72.
15 Specker BL, Valanis B, Hertzberg
V, et al. Sunshine exposure and serum
25-hydroxyvitamin D concentrations
in exclusively breast-fed infants. J
Pediatr 1985;107:372-6.
16 Bishop N. Don’t ignore vitamin D.
Arch Dis Child 2006;91:549-50.
17 Saggese G, Baroncelli GI,
Bertelloni S, et al. Effetto delle stagioni
sulla sintesi della vitamina D3 a 43°
latitudine nord. Riv Ital Pediatr
1992;18:30-6.
18 American Academy of Pediatrics,
Committee on Environmental Health.
Ultraviolet light: a hazard to children.
Pediatrics 1999;104:328-33.
19 Gilchrest BA. Sun exposure and
vitamin D sufficiency. Am J Clin Nutr
2008;88:S570-7.
definire la normalità dello stato vitaminico
D nel bambino è aumentata anche dal
fatto che, per la diagnosi di rachitismo, i va-
lori di 25-OHD non sempre sono dirimenti,
soprattutto nelle fasi iniziali della malattia, al
contrario dei valori di PTH e di fosfatasi al-
calina, che risultano sempre aumentati.
n L’ESPOSIZIONE SOLARE
La radiazione solare UVB è fondamentale
per la sintesi di vitamina D. L’esposizione cu-
tanea agli UVB viene misurata in dosi mini-
me eritematose (MED): una MED corrispon-
de alla quantità di UVB necessaria a cau-
sare un minimo eritema cutaneo. Negli
adulti l’esposizione dell’intera superficie
corporea a una MED permette il rilascio in
circolo di 10.000-20.000 UI di vitamina D nel-
le 24 ore, mentre l’esposizione del 40% del
corpo a un quarto di MED può generare
1.000 UI/die, la quantità minima di vitamina
D necessaria (13). I bambini necessitano, ri-spetto agli adulti, di una minore esposizione
alla luce solare per produrre sufficienti
quantità di vitamina D, sia per la loro super-
ficie corporea più estesa in rapporto al vo-
lume sia per la loro maggiore capacità di
produrre vitamina D (14).Nel 1985 Specker ha dimostrato, nella città di
Cincinnati nell’Ohio, che un lattante può ot-
tenere valori di 25-OHD superiori a 11 ng/ml
esponendo al sole durante il periodo estivo il
volto e le mani due ore alla settimana, men-
tre sono sufficienti 30 minuti di esposizione se
il bambino indossa soltanto il pannolino (15).Comunque, la durata dell’esposizione solare
capace di mantenere i valori di 25-OHD su-
periori a 20 ng/ml, il valore proposto attual-
mente come indice di uno stato di sufficien-
za di vitamina D nei bambini, deve ancora
essere determinata, in particolare a secon-
da del momento della giornata, della sta-
gione e del colorito della pelle (7).L’efficacia della radiazione solare è influen-
zata infatti da molti parametri: pigmentazio-
ne cutanea, massa corporea, latitudine, sta-
gione, inquinamento atmosferico, percen-
tuale di cute esposta, tipo di vestiario e utiliz-
zo di filtri solari. Nei paesi del Medio Oriente e
nei paesi arabi, nonostante una situazione
climatica con alta irradiazione solare, la de-
ficienza di vitamina D può essere frequente,
soprattutto nelle donne a causa di motivi
culturali e religiosi che vietano loro di stare
all’aperto o di esporre al sole una superficie
sufficiente del proprio corpo (16). Il nostro gruppo ho dimostrato che alla lati-
tudine di Pisa (43°, 40.9’ N), la sintesi cutanea
di vitamina D avviene soltanto in alcuni me-
si dell’anno, in rapporto alla quantità di rag-
gi UVB (290-315 nm) che raggiungono la su-
perficie terrestre. In autunno inoltrato, nei
mesi invernali e all’inizio della primavera, il
bambino, anche se esposto al sole, non è in
grado di produrre vitamina D (17). Durante imesi invernali, quindi, l’esposizione ai raggi
solari è inefficace nel produrre un’adegua-
ta sintesi di pre-vitamina D3: in questo perio-
do dell’anno uno stato vitaminico D suffi-
ciente può essere garantito solo dalle riserve
endogene di vitamina D accumulate du-
rante il periodo estivo o da una supplemen-
tazione esogena. D’altra parte, un’esposizio-
ne prolungata alla luce solare nei mesi estivi,
oltre a essere pericolosa, non può incre-
mentare in maniera proporzionale la produ-
zione di vitamina D poiché la pre-vitamina
D3, raggiunto un livello soglia, viene degra-
data in prodotti inerti come il lumisterolo e il
tachisterolo (13). L’esposizione ai raggi UVB durante l’infanzia
è stata messa in relazione con l’insorgenza,
negli anni successivi, di tumori cutanei.
La American Academy of Pediatrics ha
raccomandato che i lattanti al di sotto dei
sei mesi di vita non vengano esposti diret-
tamente alla luce solare e ha suggerito l’u-
so di abiti protettivi e creme solari per i
bambini più grandi (18,19). A questo pro-posito, l’esposizione prolungata agli UVB è✂
n. 3 - Maggio/Giugno 2010ApVIII
✂
stata associata al rischio di sviluppare che-
ratosi attinica e carcinoma cutaneo a cel-
lule squamose, mentre altri tumori cutenaei,
come il melanoma e il carcinoma cutaneo
a cellule basali, sono da mettere maggior-
mente in relazione con l’esposizione a un ti-
po diverso di raggi ultravioletti contenuti
nella luce solare, gli UVA (7,20). L’esposizioneagli UVA, espressa come rapporto tra UVA e
UVB presenti nella luce solare, aumenta
con la latitudine ed è massima nelle prime
ore e nelle ore tarde del giorno; pertanto, i
comportamenti messi comunemente in at-
to per prevenire gli effetti dannosi dell’espo-
sizione solare, come evitarla durante le ore
centrali della giornata, espongono in realtà
a una maggior percentuale di raggi UVA.
Inoltre, i filtri solari offrono scarsa protezione
contro gli UVA, e sono pertanto incapaci di
prevenire completamente lo sviluppo di
melanoma (7,21).In risposta a quanti sconsigliano di esporre i
bambini alla luce solare, Holick fa notare
che evitare l’esposizione diretta alla luce
solare aumenta pericolosamente il rischio
di deficienza di vitamina D e sottolinea co-
me sia sufficiente esporre per 5-30 minuti le
braccia e le gambe (in base a tutti i para-
metri che influenzano l’efficacia della ra-
diazione solare, precedentemente ricor-
dati) due volte alla settimana nell’orario
compreso tra le ore 10 e le ore 15, in prima-
vera, estate e autunno, periodo in cui mag-
giormente gli UVB raggiungono la superfi-
cie terrestre (9). Ovviamente i bambini dal-la carnagione scura necessitano di tempi
di esposizione alla luce solare maggiori.
Per tempi di esposizione maggiori l’uso di fil-
tri con fattore di protezione solare (sun pro-
tector factor, SPF) di 15 o superiore è rac-
comandato per prevenire gli effetti danno-
si dell’esposizione cronica ed eccessiva. I fil-
tri solari riducono drasticamente la produ-
zione di vitamina D: un SPF di 8 la riduce del
95%, un SPF di 15 di più del 98% (9,13).Più del 90% delle richieste di vitamina D vie-
ne soddisfatto dalla casuale esposizione al-
la luce solare, per cui è opportuno rivaluta-
re gli effetti benefici del sole, promuovendo
un corretto equilibrio tra la prevenzione del
rischio di cancro cutaneo e l’esposizione a
una radiazione UVB sufficiente per mante-
nere adeguati livelli di vitamina D (4,9).
n IL RACHITISMO CARENZIALE OGGIDefinizione e classificazioneIl rachitismo è una patologia caratterizzata
da una ridotta mineralizzazione della carti-
lagine di accrescimento, con conseguente
accumulo di matrice ossea non mineraliz-
zata detta tessuto osteoide. Il rachitismo è ti-
pico dell’età evolutiva in quanto si presen-
ta, per definizione, prima della saldatura
delle epifisi delle ossa lunghe e colpisce so-
prattutto le ossa in più rapido accrescimen-
to come il cranio, le coste, il polso, le ginoc-
chia e le caviglie. Il fenomeno analogo che
colpisce il tessuto osseo maturo porta inve-
ce allo sviluppo dell’osteomalacia (22).Nella tabella III sono elencate le principalicause di rachitismo. Il dossier focalizza l’at-
tenzione sul rachitismo carenziale, che è si-
curamente la forma più frequente.
BIBLIOGRAFIA
20 Armstrong BK, Krincker A. The
epidemiology of UV induced skin
cancer. J Photochem Photobiol B
Biol 2001;63:8-18.
21 Lund LP, Timmins GS.
Melanoma, long wavelenght
ultraviolet and sunscreens:
controversies and potential resolutions.
Pharmacol Ther 2007;114:198-207.
22 Wharton B, Bishop N. Rickets.
Lancet 2003;362:1389-400.
OBIETTIVOFornire uninquadramentodelle diverse formedi rachitismo
Tabella III Classificazione eziologica dei rachitismi
Rachitismi da alterato apporto di vitamina DzxCarenziale (o nutrizionale o comune)zxMalassorbimento intestinale cronico
Rachitismi da alterato metabolismo epatico della vitamina DzxMalattie epato-biliari zx Trattamento cronico con anticonvulsivanti
Rachitismi da alterato metabolismo renale della vitamina Dzx Ipofosfatemico familiarezxVitamina D-dipendente tipo IzxOsteodistrofia renalezx TubulopatiezxOncogenetico
Rachitismi da ridotta azione della vitamina DzxVitamina D-dipendente tipo II
pA n. 3 - Maggio/Giugno 2010 IX
D o s s i e r e n D o c r i n o l o g i A
BIBLIOGRAFIA
23 Ward LM, Gaboury I, Ladhani M,
et al. Vitamin D-deficiency rickets
among children in Canada.
CMAJ;2007;177:161-6.
24 Beck-Nielsen SS, Brock-Jacobsen
B, Gram J, et al. Incidence and
prevalence of nutritional and
hereditary rickets in southern
Denmark. Eur J Endocrinol
2009;160:491-7.
25 Guala A, Guarino R, Ghiotti P, et
al. Il rachitismo in Piemonte. Una
sorveglianza negli ospedali. Medico e
Bambino pagine elettroniche 2006
Febbraio; vol.25. n.2.
26 Saggese G, Baroncelli GI,
Bertelloni S. Profilassi con vitamina D
in età pediatrica. Minerva Pediatr
1992;44:533-49.
✂
EpidemiologiaNuovi casi di rachitismo vengono attual-
mente segnalati in tutto il mondo, sia nei
paesi in via di sviluppo che nei paesi indu-
strializzati, tanto che alcuni autori hanno
definito il rachitismo come la più comune
malattia non trasmissibile dell’infanzia nel
mondo (16).Pur non disponendo di dati precisi inerenti la
prevalenza e l’incidenza attuale del rachiti-
smo carenziale, da un’analisi attenta delle
segnalazioni riportate in letteratura emerge
una netta tendenza all’incremento dei casi
di malattia. Uno studio canadese del 2007 ri-
porta un’incidenza di rachitismo carenziale
tra 0 e 18 anni di vita pari a 2,9:100.000 (23) euna recente indagine fatta in Danimarca
segnala, nel periodo tra il 1995 e il 2005, la
medesima incidenza tra 0 e 14,9 anni (24).Alcuni dei dati italiani disponibili riguarda-
no la regione Piemonte, dove Guala ha se-
gnalato, mediante un esame retrospettivo
di schede di dimissione ospedaliera nel
triennio 2000-2002, 99 casi di rachitismo ca-
renziale, di cui solo 5 riguardavano bambi-
ni italiani (25). Un’indagine condotta dalnostro gruppo alla fine degli anni Novanta
ha rilevato la presenza di segni di rachiti-
smo carenziale nel 4,3% dei bambini di età
compresa tra i 4 e i 31 mesi; il 50% di questi
bambini erano allattati al seno senza profi-
lassi con vitamina D, oppure venivano co-
perti eccessivamente anche quando
esposti alla luce solare (26). Il rachitismo ca-renziale continua a essere descritto non so-
lo nelle zone temperate, come il Canada,
la Nuova Zelanda, la Danimarca, la Fran-
cia, il Regno Unito, ma anche in paesi nei
quali l’irraggiamento solare è maggiore,
come l’Australia e gli Stati Uniti (1). Nonostante un buon irraggiamento solare
per diversi mesi dell’anno, la frequenza del
rachitismo carenziale è alta anche nei
paesi in via di sviluppo, come l’Algeria, l’E-
tiopia, l’Arabia Saudita, l’Egitto, la Nigeria, la
Turchia (1).
Un’attenta analisi dei fattori di rischio per lo
sviluppo di una deficienza di vitamina D è
fondamentale per comprendere questa
nuova recrudescenza. Nella tabella IV so-no riassunti i principali fattori di rischio per il
rachitismo carenziale.
Nei paesi sviluppati le popolazioni mag-giormente a rischio sono i figli di immigrati e
i bambini adottati (soprattutto se allattati al
seno, di colore o non profilassati con vita-
mina D). I primi sono a rischio per le parti-
colari abitudini dietetiche e culturali, la
mancata profilassi con vitamina D, la scar-
sa esposizione solare e probabilmente un
alterato metabolismo della vitamina D (au-
mentato catabolismo, con conseguente ri-
duzione dei livelli circolanti di 25-OHD). Nei
bambini adottati i principali fattori di rischio
sono rappresentati dalla scarsa esposizio-
ne solare per una prolungata istituzionaliz-
zazione, dalla presenza di uno stato di de-
nutrizione e dalla mancata profilassi con vi-
tamina D (16). Anche i dati italiani disponi-bili confermano che il rachitismo carenzia-
le colpisce soprattutto bambini immigrati o
Tabella IV Principali fattori di rischio di sviluppare rachitismo carenziale
Paesi sviluppatiBambini immigratizxAbitudini dietetiche e culturali con conseguente scarsa esposizionesolarezxMancata profilassi con vitamina DzxAlterato metabolismo della vitamina D*Bambini adottatizx Scarsa esposizione solare per prolungata istituzionalizzazionezxDenutrizione zxMancata profilassi con vitamina D
Paesi in via di sviluppozx Ridotta sintesi di vitamina D per scarsa esposizione solare, pigmenta-zione melanica ed eccessiva copertura della cutezxDeficienza materna di vitamina Dzx Prolungato allattamento al seno senza profilassi con vitamina DzxAlterato metabolismo della vitamina D*zx Ridotto assorbimento intestinale di calcio per eccessivo consumo dialimenti ad elevato contenuto di fitati
* aumentato catabolismo di 25-OHD per ridotto apporto dietetico di calcio e
predisposizione genetica.
n. 3 - Maggio/Giugno 2010ApX
✂
adottati (25,27). Il 74% dei bambini dellostudio danese precedentemente citato
erano figli di immigrati, per cui gli autori
hanno calcolato un’incidenza di rachiti-
smo in questa popolazione pari a
100:100.000 tra 0 e 2,9 anni e pari a
60:100.000 tra 0 e 14,9 anni (24).Non è stata ancora completamente chiari-
ta, invece, la ragione dell’alta frequenza
del rachitismo nei paesi in via di sviluppo.Fra le possibili cause sono state considerate:
una ridotta sintesi di vitamina D per scarsa
esposizione solare, la presenza di abbon-
dante pigmentazione melanica della cute,
l’eccessiva copertura con indumenti, la de-
ficienza materna di vitamina D, il prolunga-
to allattamento al seno senza profilassi con
vitamina D, l’aumentato catabolismo delle
scorte di vitamina D dovuto a un ridotto ap-
porto dietetico di calcio o a predisposizione
genetica, un ridotto assorbimento intestina-
le di calcio per eccessivo consumo di ali-
menti contenenti fitati (1,16).Uno studio recente ha sottolineato come
nel Medio Oriente il rachitismo si sviluppi in
seguito alla combinazione di alterazioni nu-
trizionali (i bambini turchi presentano per lo
più deficienza isolata di vitamina D, mentre
i bambini egiziani associano a quest’ultima
una scarsa assunzione di calcio con la die-
ta), condizioni ambientali sfavorevoli e una
predisposizione genetica associata a parti-
colari polimorfismi del recettore della vita-
mina D (l’allele F è associato a un aumento
della frequenza di rachitismo, l’allele B a un
aumento della gravità della malattia) (28).
nASPETTI CLINICI E DIAGNOSI Basi fisiopatologicheIl rachitismo è una condizione caratterizza-
ta da un’inadeguata mineralizzazione del-
le ossa in accrescimento. In presenza di de-
ficienza di vitamina D l’assorbimento intesti-
nale di calcio si riduce dai valori normali
del 30-80% (nei periodi di intenso accresci-
mento) a valori del 10-15%, con associata
riduzione del riassorbimento del fosforo
(6,7). Per mantenere livelli adeguati di cal-cemia si instaura un iperparatiroidismo se-
condario: il PTH stimola il riassorbimento di
calcio e fosforo dal tessuto osseo, aumenta
il riassorbimento renale di calcio e la perdi-
ta renale di fosforo e stimola l’attività dell’1-
alfaidrossilasi renale. Le modificazioni della
calcemia e della fosforemia alterano i nor-
mali processi di mineralizzazione della carti-
lagine di crescita con conseguente accu-
mulo di tessuto osteoide che porta all’am-
pliamento e alla deformazione delle regio-
ni metafisarie delle ossa lunghe. I bassi livel-
li di fosforemia impediscono la normale
apoptosi dei condrociti ipertrofici della car-
tilagine di accrescimento, con conseguen-
te rigonfiamento cellulare e disorganizza-
zione del piatto di crescita (7).Anche la deficienza di calcio riveste un
ruolo importante nello sviluppo delle alte-
razioni del rachitismo, in particolare nei
paesi in via di sviluppo. Alla base del rachi-
tismo carenziale, infatti, si può riscontrare
uno spettro di modificazioni fisiopatologi-
che che vanno dalla deficienza isolata di
vitamina D alla deficienza isolata di calcio.
I bambini con scarso apporto dietetico di
calcio sono suscettibili anche a modesti
deficit di vitamina D dal momento che la
deficienza di calcio aumenta le richieste di
vitamina D dell’organismo (29).
Segni cliniciLe manifestazioni cliniche del rachitismo
carenziale si possono suddividere in mani-
festazioni ossee e non ossee (7,16,22).
Alterazioni osseeLe tipiche alterazioni ossee del rachitismo
possono essere riconosciute dopo che la
deficienza di vitamina D si è instaurata da
alcuni mesi: in assenza di profilassi con vita-
PUNTO CHIAVEDai dati epidemiologiciemerge un diffusoaumento di incidenzadel rachitismo carenziale
BIBLIOGRAFIA
27 Cataldo F, Viviano E. Health
problems of internationally adopted
children. Ital J Pediatr 2007;33:92-9.
28 Baroncelli GI, Bereket A, El Kholy
M, et al. Rickets in the Middle East:
role of environment and genetic
predisposition. J Clin Endocrinol
Metab 2008;93:1743-50.
29 Thacher TD, Fischer PR, Isichei
CO, et al. Early response to vitamin
D2 in children with calcium deficiency
rickets. J Pediatr 2006;149:840-4.
OBIETTIVOIllustrare la patogenesi,le caratteristiche clinichee il corretto approcciodiagnostico alla malattia
pA n. 3 - Maggio/Giugno 2010 XI
D o s s i e r e n D o c r i n o l o g i A
✂
mina D le scorte di vitamina D che un bam-
bino accumula durante la gestazione pos-
sono proteggerlo per circa due mesi dalla
nascita. I bambini nati prematuri e i nati da
madri con deficienza severa di vitamina D
possono sviluppare rachitismo carenziale
più precocemente, spesso con esordio ipo-
calcemico; questa condizione viene de-
scritta in letteratura come “rachitismo con-
genito” o “malattia metabolica ossea della
prematurità” ed è caratterizzata da ridotta
mineralizzazione ossea, scarsa crescita li-
neare e aumentato rischio di fratture diafi-
sarie (16).Il rachitismo si manifesta nella sua fase flori-
da tipicamente verso la fine del primo an-
no e durante il secondo anno di vita; nelle
età successive i segni della deficienza di vi-
tamina D sono più rari, anche se ogni pe-
riodo caratterizzato da intensa crescita
scheletrica, come per esempio la pubertà,
può essere considerato a rischio.
Le alterazioni scheletriche possono interes-
sare diversi distretti ossei.
Alcuni tra i segni classici del rachitismo ca-
renziale si possono ricercare a livello delle
ossa del cranio:n il cranio tabe (non patognomonico di ra-
chitismo) caratterizzato dalla consistenza
elastica e cedevole (tipo “pallina da ping-
pong”) delle ossa occipitali o parietali del-
la testa del bambino, avvertibile esercitan-
do una leggera pressione su queste regio-
ni, e dovuto all’assottigliamento del tavola-
to esterno del cranio;
n il caput quadratum, caratterizzato dalla
prominenza delle bozze frontali dovuta al-
l’espansione delle ossa frontali;
n la maggiore ampiezza della fontanella
anteriore dovuta a ritardata chiusura (oltre
il secondo anno di vita).
Anche il torace può avere un aspetto ca-ratteristico: lo sterno può essere infatti
proiettato in avanti, delineando il cosiddet-
to torace a piccione (o pectus carinatum),
mentre lungo il margine inferiore del torace
può comparire il cosiddetto solco di Harri-
son, una depressione orizzontale dovuta al-
la trazione del diaframma sulle coste più
cedevoli (figura 2).A causa dell’accumulo di tessuto osteoide
si può inoltre osservare il “rosario rachitico”,
dovuto all’ampliamento della giunzione
condrocostale (figura 3).Tipiche sono le deformità scheletriche a
carico degli arti inferiori: quando il bambi-no impara a camminare, femore, tibia e
perone possono deformarsi nel classico va-
rismo, così come è possibile l’instaurarsi di
ginocchio valgo o di deformità “a colpo di
vento” (figura 4).Altri segni tipici sono il “braccialetto rachiti-
co” e la “caviglia rachitica”, dovuti all’ac-
cumulo di tessuto osteoide a livello metafi-
sario (figura 5);
Figura 2 - Solco di Harrison.
Figura 3 - Rosario rachitico.
PUNTO CHIAVENei nati da madre condeficienza severa divitamina D il rachitismopuò esordire precocemente, anchecon ipocalcemia acuta
PUNTO CHIAVEIl rachitismo si presentacon maggior frequenzanei primi due anni di vita,ma tutti i periodicaratterizzati da intensacrescita scheletrica sono a rischio
n. 3 - Maggio/Giugno 2010ApXII
✂
Le fratture sono rare, tranne che nei bambi-
ni nati prematuri, e generalmente sono “a
legno verde” e asintomatiche.
È possibile riscontrare anche alterazioni del
tessuto dentale, come una ritardata eruzio-ne dentaria (incisivi decidui non presenti a
9 mesi e primi molari non presenti a 14 me-
si) o un’ipoplasia dello smalto con conse-
guente maggiore suscettibilità alla carie,
anche a carico dei denti permanenti.
A livello del rachide si può avere scoliosi digrado lieve o cifosi dorso-lombare; nei casi
più gravi e inveterati le deformità del rachi-
de, della pelvi e degli arti inferiori sono cau-
sa di bassa statura (“nanismo rachitico”).
Alterazioni extra-scheletricheTra le alterazioni extra-scheletriche, il qua-
dro più importante è rappresentato dalla
ipocalcemia: è possibile infatti che l’esordiodel rachitismo carenziale sia acuto, in parti-
colare in bambini sotto i 6 mesi di vita nati
da madre affetta da carenza di vitamina D.
L’ipocalcemia può presentarsi anche pri-
ma che si instaurino i tipici segni radiologici;
può essere asintomatica, latente (con posi-
tività dei segni di Chvostek e Trousseau) op-
pure clinicamente manifesta con convul-
sioni, tetania e/o laringospasmo.
Bassi livelli di vitamina D e di calcio possono
associarsi anche a cardiomiopatia e a unaipotonia muscolare, con conseguente ag-gravamento della situazione motoria, spesso
già compromessa per i problemi ossei e arti-
colari. I bambini con rachitismo severo impa-
rano tardi a reggersi in piedi e a camminare.
L’ipotonia dei muscoli della parete addomi-
PUNTO CHIAVEL’ipocalcemia, in formaacuta e clinicamentemanifesta oppure informa latente, puòessere il primo segnodello stato carenzialee precedere anchei segni radiologici
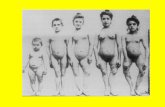
Figura 4 - Varismo degli arti inferiori in pazienteadottato.
Figura 5- Braccialetto rachitico (A) e cavigliarachitica (B).
A
B
pA n. 3 - Maggio/Giugno 2010 XIII
D o s s i e r e n D o c r i n o l o g i A
PUNTO CHIAVEInsieme alla valutazionedella 25-OHD, i dosaggiplasmatici delparatormone e dellafosfatasi alcalinarappresentanoi parametri ematochimicipiù utili per la diagnosidi rachitismo carenziale
BIBLIOGRAFIA
30 Fraser D, Kooh SW, Scriver CR.
Hyperparathyroidism as the cause of
hyperaminoaciduria and phosphaturia
in human vitamin D deficiency.
Pediatr Res 1967;1:425-35.
31 Wagner CL, Greer FR. Prevention
of rickets and vitamin D deficiency in
infants, children and adolescents.
Pediatrics 2008;122:1142-52.
nale spiega la tipica prominenza dell’addo-
me e la maggiore frequenza con cui questi
bambini presentano ernia ombelicale.
Le deformazioni del torace precedente-
mente descritte possono ostacolare la respi-
razione, favorendo l’instaurarsi di bronchiti e
broncopolmoniti ricorrenti che caratterizza-
no il cosiddetto polmone rachitico.
Segni radiologici Le indagini radiologiche permettono di in-
dividuare le alterazioni scheletriche re-
sponsabili di buona parte del quadro clini-
co precedentemente descritto (7,22).A livello delle ossa lunghe è possibile osser-
vare (figure 6 e 7):n osteopenia (questo in genere è il segno
radiologico più precoce);
n slargamento, sfrangiamento e deforma-
zione “a coppa” delle metafisi in seguito al-
la proliferazione della cartilagine non calci-
ficata e del tessuto osteoide;
n assottigliamento degli spessori corticali;
n fratture da stress.
Segni biochimici di laboratorioLa storia naturale del rachitismo carenziale
è stata classicamente suddivisa da Fraser
(30) in tre stadi di malattia:Lo stadio 1 è caratterizzato da ipocalce-mia generalmente subclinica, transitoria e
quindi difficile da documentare, normofo-
sforemia, valori di 25-OHD per lo più ridotti
e da valori aumentati di fosfatasi alcalina
e di PTH. Il passaggio verso lo stadio 2 ècaratterizzato da ulteriore diminuzione dei
livelli di 25-OHD e ulteriore aumento dei
valori di fosfatasi alcalina e di PTH: la pre-
senza, quindi, di un iperparatiroidismo se-
condario franco porta all’instaurarsi di
normocalcemia e ipofosforemia. Nello
stadio 3, infine, si sviluppano deficienza se-vera di 25-OHD, ipocalcemia marcata e
ipofosforemia (a questo punto vi è anche
una chiara evidenza radiologica di demi-
neralizzazione ossea).
L’interpretazione della valutazione biochi-
mica, quindi, dipende dallo stadio in cui si
trova la malattia (7,31).Alla luce di queste considerazioni, per la dia-
gnosi di rachitismo carenziale il dosaggiodella 25-OHD da solo, che come già dettorappresenta il miglior indicatore dello stato
vitaminico D, può non essere sufficiente, in
quanto non sempre chiaramente diminuito,
soprattutto nelle fasi iniziali. Lo stesso si può
Figura 6 - Segni radiologici a carico del carpo edel metacarpo.
Figura 7 - Segni radiologici a carico degli artiinferiori.✂
n. 3 - Maggio/Giugno 2010ApXIV
✂
dire per la calcemia: l’iperparatiroidismo se-condario infatti, determinando un anomalo
riassorbimento osseo di calcio, può mante-
nere, almeno inizialmente, valori di calcemia
e di 25-OHD nella norma. Anche la fosfore-mia inizialmente può essere normale e solonelle fasi successive della malattia diminui-
sce a causa di un’aumentata secrezione
renale di fosforo determinata dal PTH.
Più utili a scopo diagnostico sono, pertanto, i
valori di PTHe di fosfatasi alcalina, che nel ra-chitismo carenziale risultano sempre au-
mentati. Inoltre, il dosaggio dell’isoenzimaosseo della fosfatasi alcalina, che misuraspecificatamente la funzione degli osteo-
blasti, può servire a dirimere (come si vedrà
in seguito) l’effetto confondente di conco-
mitanti malattie epatobiliari o terapie antie-
pilettiche che possono falsamente innalzare
i valori di fosfatasi alcalina totale. Il dosaggio
della 1,25-OH2D e dei markers di formazione
ossea (osteocalcina, propetidi amino e car-
bossi terminali del collagene tipo I) e di rias-
sorbimento osseo (piridolina, desossipiridoli-
na e telo peptidi) non appare, invece, di al-
cuna utilità nella diagnosi e nel trattamento
del rachitismo carenziale (32). In particolare,il dosaggio della 1,25-OH2D può portare a
conclusioni errate, dal momento che negli
stadi iniziali può essere nella norma o addirit-
tura aumentato come conseguenza dell’i-
perparatiroidismo secondario, che costitui-
sce uno stimolo per l’1-alfaidrossilasi renale.
n SCHEMI TERAPEUTICIE LORO MONITORAGGIOLa terapia del rachitismo carenziale si basa
sulla somministrazione di vitamina D. Non tro-vano normalmente indicazione i metaboliti
della vitamina (25-OHD e 1,25-OH2D), per-
ché la somministrazione di calcitriolo sem-
bra aumentare il rischio di sviluppare coleli-
tiasi e ipercalcemia (26); inoltre, il calcitriolostimola l’attività della 24-idrossilasi con con-
seguente aumento della degradazione
della 25-OHD e della 1,25-OH2D (33). Alcuniautori limitano l’utilizzo del calcitriolo alle for-
me di rachitismo secondarie a insufficienza
renale cronica avanzata e alla presenza di
ipocalcemia (9). Non è chiaro se vitaminaD2 e vitamina D3 siano farmacologicamen-
te equivalenti: alcuni studi negli adulti soste-
nevano che l’efficacia della vitamina D2
fosse pari a un terzo di quella della D3, men-
tre recentemente Holick ha dimostrato che
entrambe le formulazioni hanno la medesi-
ma efficacia negli adulti (34).Esistono diversi schemi terapeutici possibili. La vitamina D viene somministrata per via
orale per 2-3 mesi a dosi giornaliere com-
prese tra 1.000 e 10.000 UI a seconda del-
l’età del paziente (7).I dosaggi consigliati sono i seguenti:
n nei bambini di età inferiore a un mese
<1.000 UI/die;
n nei bambini di età compresa tra 1 e 12
mesi 1.000-5.000 UI/die;
n nei bambini di oltre un anno >5.000
UI/die.
Evidenze radiologiche di guarigione si han-
no dopo 8-14 settimane di terapia (32); aguarigione completa si può passare alla
somministrazione di vitamina D in dosi profi-
lattiche di 400 UI/die.
Nei casi di scarsa compliance con la tera-
pia giornaliera è possibile somministrare una
dose semi-urto di vitamina D, pari a 100.000-
200.000 UI, in dose unica per via orale o in-
tramuscolare, seguita da somministrazioni di
mantenimento di 400 UI/die. Qualora fosse
dimostrata scarsa compliance anche nella
terapia di mantenimento è possibile ripete-
re la dose semi-urto ogni tre mesi, fino a con-
ferma della guarigione radiologica delle le-
sioni (35). In letteratura è descritta la cosid-detta stoss therapydegli autori tedeschi ba-
sata sulla somministrazione di dosi urto di
600.000 UI di vitamina D, in dose unica o fra-
zionata in sei dosi da 100.000 UI da sommini-
strare a intervalli di due ore (36). Questa pro-
BIBLIOGRAFIA
32 Baroncelli GI, Bertelloni S,
Ceccarelli C, et al. Bone turnover in
children with vitamin D deficiency
rickets before and during treatment.
Acta Paediatr 2000;89:513-8.
33 Holick MF, Lim R, Dighe AS.
Case records of the Massachusetts
General Hospital. Case 3-2009. A 9-
month-old boy with seizures. N Engl J
Med 2009;360:398-407.
34 Holick MF, Biancuzzo RM, Chen
TC, et al. Vitamin D2 is as effective as
vitamin D3 in maintaining circulating
concentrations of 25-hydroxyvitamin
D. J Clin Endocrin Metab
2008;93:677-81.
35 Shah BR, Finberg L. Single-day
therapy for nutritional vitamin D-
deficiency rickets: a preferred method.
J Pediatr 1994;125:487-90.
OBIETTIVOFornire le indicazioniessenziali per un correttoapproccio terapeuticoal rachitismo carenziale
pA n. 3 - Maggio/Giugno 2010 XV
D o s s i e r e n D o c r i n o l o g i A
BIBLIOGRAFIA
36 Cesur Y, Caksen H, Gündem A, et
al. Comparison of low and high dose
of vitamin D treatment in nutritional
vitamin D deficiency rickets. J Pediatr
Endocrinol Metab 2003;16:1105-9.
37 Gordon CM, Williams AL,
Feldman HA, et al. Treatment of
hypovitaminosis D in infants and
toddlers. J Clin Endocrinol Metab
2008;93:2716-21
✂
cedura non è più consigliabile, da una par-
te per il rischio di ipocalcemia da rapido
passaggio del calcio plasmatico nell’osso,
dall’altra per il rischio di ipercalcemia.
Uno studio recente (37) ha paragonato trepossibili regimi terapeutici, caratterizzati da
vari dosaggi e formulazioni di vitamina D, ri-
spettivamente 2.000 UI/die di vitamina D2,
50.000 UI/settimana di vitamina D2 e 2.000
UI/die di vitamina D3, tutti della durata di
sei settimane e associati a somministrazio-
ne di calcio elemento (35-75 mg/kg/die).
Gli autori hanno concluso che i vari schemi
terapeutici hanno la stessa efficacia e sicu-
rezza e che è quindi opportuno individua-
re, in base alle caratteristiche del paziente,
il regime che meglio si adatta alla sua
compliance.
Il rischio di intossicazione da vitamina D è
modesto: nei bambini ipercalcemia è sta-
ta riportata in seguito a somministrazione di
300.000 UI o di 600.000 UI (36) o dopo dosigiornaliere superiori alle 10.000 UI (7).Anche il calcio ha un ruolo importante nel-la terapia del rachitismo carenziale: il ri-
scontro di ipocalcemia richiede infatti, oltre
alla somministrazione di vitamina D, anche
una terapia con calcio.
Qualora siano presenti tetania o convulsio-
ni, il calcio va somministrato per via endo-
venosa. Se si utilizza calcio gluconato al
10%, è necessario infondere 10-20 mg di
calcio elemento/kg (1-2 ml/kg) per via pa-
renterale lentamente, in almeno 5-10 minu-
ti; se necessario, l’infusione può essere ripe-
tuta ogni 4-6 ore. La calcemia va successi-
vamente mantenuta entro il range di nor-
malità mediante somministrazione di cal-
cio per via orale (35-75 mg/kg/die) (7).Se alla deficienza di vitamina D si associa
ipocalcemia senza manifestazioni tetani-
che è opportuno somministrare calcio per
via orale (35-75 mg/kg/die) (7,16).La supplementazione orale con calcio può
essere utile anche nei bambini che non so-
no francamente ipocalcemici, al fine di
evitare la cosiddetta hungry bone syndro-
me (sindrome dell’osso affamato). Infatti,
durante il trattamento con vitamina D, e in
particolare con dosi semi-urto, si assiste a
un aumento brusco dei processi di minera-
lizzazione ossea che consumano il calcio
plasmatico con conseguente rischio di ipo-
calcemia. Si raccomandano quindi dosi di
30-75 mg/kg/die di calcio elemento per os,
da dividere in 2-3 somministrazioni, sino alla
normalizzazione dei valori di PTH (7).La tabella V riassume i possibili approcci te-rapeutici al rachitismo carenziale.
Il parametro biochimico migliore per valu-
tare la guarigione è la fosfatasi alcalina: i
valori di tale parametro, infatti, diminuisco-
no progressivamente durante la terapia
per rientrare nella norma contemporanea-
mente alla guarigione delle lesioni schele-
triche, cosa che avviene generalmente
dopo 8-14 settimane di terapia.
Per il monitoraggio della terapia alcuni au-tori propongono (7):n dopo un mese il dosaggio di fosfatasi al-
Tabella V Terapia del rachitismo carenziale
Vitamina Dzx Somministrazione giornaliera di 1.000-10.000 UI per 2-3 mesi:- <1.000 UI/die UI per bambini <1 mese di vita- 1.000-5.000 UI/die per bambini di età compresa tra 1 e 12 mesi - >5.000 UI/die per bambini sopra l’anno di vitaDopo la guarigione radiologica delle lesioni continuare a dosi profilattiche (400 UI/die).
zxDosi semi-urto di 100.000-200.000 UI, in dose unica per os o im seguita da un regime di mantenimento a dosi profilattiche (400 UI/die).Nei casi di scarsa compliance la dose semi-urto è ripetibile ogni 3 mesi fino alla guarigione radiologica delle lesioni.
Calciozx In caso di ipocalcemia asintomatica o latente: somministrare calcio peros (35-75 mg/kg/die in 2-3 somministrazioni)zx In caso di ipocalcemia sintomatica: infondere 10-20 mg di calcio elemen-to/kg (1-2 ml/kg se si usa calcio gluconato 10%) ev in almeno 5-10 minuti (ri-petibile se necessario ogni 4-6 ore)zxDopo normalizzazione della calcemia somministrare calcio per os (35-75mg/kg/die in 2-3 somministrazioni)La supplementazione con calcio per os (30-75 mg/kg/die in 2-3 sommini-strazioni) può essere utile anche nei bambini non francamente ipocalcemi-ci al fine di evitare la hungry bone syndrome fino alla normalizzazione deivalori di PTH.
n. 3 - Maggio/Giugno 2010ApXVI
✂
calina, calcio e fosforo;
n dopo tre mesi il dosaggio di fosfatasi al-
calina, calcio, fosforo, magnesio, PTH, 25-
OHD e la ripetizione delle indagini radio-
grafiche per confermare la guarigione del-
le lesioni ossee;
n dopo un anno e poi annualmente: do-
saggio della 25-OHD.
nPROFILASSI DELLA DEFICIENZA DI VITAMINA DUno strumento importante per contrastare
la diffusione del rachitismo carenziale è rap-
presentato dalla profilassi con vitamina D
dei bambini e degli adolescenti.
La profilassi deve essere effettuata sommini-
strando vitamina D e non i suoi metaboliti in
quanto questi ultimi non sono in grado di
mantenere e/o di restaurare le scorte di vi-
tamina D, e inoltre espongono a un rischio
importante di ipercalcemia. È preferibile la
somministrazione quotidiana di preparati in
gocce, in quanto sono di semplice impiego
e la dose da somministrare è ben controlla-
bile (26).Nella tabella VI sono riportati alcuni dei pro-dotti in gocce disponibili per la profilassi del
rachitismo carenziale.
Una recente metanalisi sottolinea come la
mancata effettuazione della profilassi con
vitamina D possa favorire lo sviluppo del ra-
chitismo carenziale, in particolare nei bam-
bini allattati esclusivamente al seno o non
adeguatamente esposti alla luce solare, nei
bambini che vivono in Asia, in Africa o nel
Medio Oriente e nei bambini immigrati da
queste regioni in paesi dove la prevalenza di
rachitismo è minore (38). Nella tabella VII si può notare come neglianni si siano modificate le raccomandazioni
sull’apporto giornaliero di vitamina D.
Gli apporti indicati dall’Istituto di Nutrizione,
(LARN) sono espressi come range per le di-
verse fasce di età e suggeriscono dosi più
alte per i soggetti di carnagione scura o con
limitata esposizione solare (39).Nel 2003 la American Academy of Pedia-
tricsaveva suggerito un apporto di vitamina
D pari a 200 UI/die in tutti gli allattati al seno
e negli allattati con formula, supplementata
con almeno 400 UI/l, che ricevevano una
quantità giornaliera di latte inferiore ai 500
ml, e nei bambini e negli adolescenti non
adeguatamente esposti al sole o con un
apporto giornaliero di vitamina D, tramite
alimenti supplementati o prodotti multivita-
minici, inferiore alle 200 UI/die (40).Successivamente, diversi autori hanno soste-
nuto che un apporto di 200 UI/die di vitami-
na D non è in grado di assicurare una piena
sufficienza dei livelli vitamina D: Holick (9),autori canadesi (23), australiani e neozelan-desi (11) hanno suggerito quindi l’impiegoprofilattico di almeno 400 UI/die di vitamina.
Un dosaggio superiore a 400 UI/die, invece,
non aumenterebbe la capacità di preveni-
re l’insorgenza del rachitismo in assenza di
particolari fattori di rischio (6). La American Academy of Pediatrics ha di
recente pubblicato nuove raccomandazio-
ni, indicando per tutti i neonati, i bambini e
gli adolescenti un apporto giornaliero rac-comandato di 400 UI/die. Tale dosaggio cor-risponde alla quantità di vitamina D presen-
te in un cucchiaio di olio di fegato di merluz-
zo, la cui somministrazione si è dimostrata
storicamente sicura e capace di prevenire il
rachitismo carenziale in assenza di effetti
collaterali da sovradosaggio (31).La modifica delle raccomandazioni del
2003 si è basata sulle seguenti evidenze (31):n la deficienza di vitamina D può instaurarsi
nei neonati sin dai primi giorni di vita, specie
le se madri sono carenti;
n i valori di 25-OHD sono molto bassi nei neo-
nati con allattamento esclusivo al seno non
supplementati, particolarmente in inverno;
n non è noto quanto si debba esporre un
bambino alla luce solare per mantenere
adeguati livelli circolanti di 25-OHD;
OBIETTIVODefinire gli schemidi somministrazionedi una corretta profilassicon vitamina D,anche in base alleraccomandazionidelle società pediatricheinternazionali
BIBLIOGRAFIA
38 Lerch C, Meissner T. Interventions
for the prevention of nutritional
rickets in term born children.
Cochrane Database Syst Rev
2007;17:CD006164.
39 Società Italiana di Nutrizione
Umana (SINU). Livelli di assunzione
raccomandati di energia e nutrienti
per la popolazione italiana (LARN).
Revisione 1996. Roma: Litotipografia
Zesi srl, 1996.
40 Gartner LM, Greer FR (American
Academy of Pediatrics, Section on
Breastfeeding and Committee on
Nutrition). Prevention of rickets and
vitamin D deficiency: new guidelines
for vitamin D intake. Pediatrics
2003;111:908-10.
pA n. 3 - Maggio/Giugno 2010 XVII
D o s s i e r e n D o c r i n o l o g i A
PUNTO CHIAVELa supplementazionecon 400 UI/diegarantisce livelli di25-OHD >20 ng/mlin lattanti sottopostiad allattamento al senoesclusivo
PUNTO CHIAVETutti i bambini sottopostiad allattamento al senoesclusivo oppureche non assumonomediante latte formulato400 UI/die di vitamina Ddevono esseresottoposti a profilassicon vitamina D
✂
n la somministrazione di 400 UI/die di vitami-
na D mantiene livelli di 25-OHD superiori a 20
ng/ml nei bambini sottoposti ad allattamen-
to al seno esclusivo.
Quindi la American Academy of Pediatrics
raccomanda che la supplementazione
con 400 UI/die di vitamina D inizi già nei pri-
mi giorni di vita e continui nell'infanzia, non
ponendo un limite preciso alla durata della
profilassi. La supplementazione dovrebbe
essere effettuata almeno nei primi 18-24
mesi di vita, periodo caratterizzato da inten-
sa crescita scheletrica e quindi ad alto ri-
schio di sviluppare rachitismo, sospenden-
Tabella VI Alcuni prodotti in gocce per la profilassi del rachitismo carenziale
Prodotto Contenuto di vitamina D (UI/gtt)* Fascia Presenza di altre vitaminezxAbidec 54 C PolivitaminicozxAD Pabyrn 100 C Vit AzxAdisterolo 250 C Vit AzxDIBASE 250 A -zxDicovit D 400 (1 perla spremibile) Integratore -zxDicovit DK 400 (1 perla spremibile) Integratore Vit KzxDitrevit 400 (1 ml) Integratore Vit A, Vit E, DHAa
zxDitrevit K50 400 (1 ml) Integratore Vit A, Vit E, Vit K, DHAa
zxHaliborange 40 Integratore Vit A, Vit Czx Idroplurivit 41,5 C Polivitaminicozx Idroplurivit Baby 13,3 Integratore PolivitaminicozxNeoDì 200 (0,5 ml) Integratore -zxNeoKD 200 (0,5 ml) Integratore Vit Kzx PediaCal 300 (1 ml) Integratore Vit A, omega 3, omega 6zx PediaKD 100 Integratore Vit Kzx PediaTre 100 Integratore -zx Proton 50 Integratore -zx Proton Infant DK 67 Integratore Vit Kzx Protovit 42 C Polivitaminicozx Sanivit AD 20 Integratore Vit Azx Sanivit DK 40 Integratore Vit K
*oppure come altrimenti specificato, a acido docosaesaenoicoModificata da: Baroncelli GI, Bertelloni S, Vierucci F, Galli L, Nicolosi A. La profilassi del rachitismo: chi, come e perché. IlPediatra 2008;4:56-61.
Tabella VII Apporti raccomandati di vitamina D durante l’età evolutiva
Età LARN* 1996 (UI/die) AAP** 2003 (UI/die) AAP** 2008 (UI/die)zx Lattanti0-6 mesi 400-1.000 200° 400°°6-12 mesi 400-1.000 200° 400°°
zx Bambini1-3 anni 400 200^ 400^^4-10 anni 0-400 200^ 400^^
zx Adolescenti11-18 anni 0-600 200^ 400^^
*Livelli di assunzione raccomandati in nutrienti per la popolazione italiana** American Academy of Pediatrics (Accademia Americana di Pediatria) ° tutti gli allattati al seno o lattanti che assumono < 500 ml/die di una formula supplementata con 400 UI/l.^ dose da somministrare nei soggetti non adeguatamente esposti al sole che non assumono almeno 500 ml dilatte/die supplementato con 400 UI/l o che non assumono multivitaminici con apporto di vitamina D di almeno200 UI/die.°° ogni bambino alimentato con allattamento al seno esclusivo o parziale che non assuma almeno 400 UI/die divitamina D mediante latte formulato^^ dose da somministrare nei soggetti non adeguatamente esposti al sole che non assumono almeno 400 UI/die divitamina D con la dieta (compreso latte ed altri alimenti fortificati con vitamina D) o mediante multivitaminici.
n. 3 - Maggio/Giugno 2010ApXVIII
✂
dola eventualmente durante l’estate se il
bambino viene esposto regolarmente al so-
le. Deve essere supplementato ogni bambi-
no alimentato con allattamento al seno
esclusivo o parziale che non assuma alme-
no 400 UI/die di vitamina D mediante latte
formulato. La American Academy of Pedia-
trics prende poi in considerazione la neces-
sità di supplementare i bambini più grandi e
gli adolescenti in caso di scarso apporto
dietetico o scarsa esposizione solare.
Diversi studi, infatti, riportano alte percentua-
li (dal 16% al 54%) di adolescenti con livelli di
25-OHD inferiori a 20 ng/ml (41). Uno studiorecente condotto negli Stati Uniti ha rilevato
nel 14% di circa 3.000 adolescenti uno stato
vitaminico D insufficiente (<20 ng/ml), con
un rischio maggiore per gli adolescenti di
sesso femminile, di colore, in sovrappeso (in
particolare un aumento dell’indice di mas-
sa corporea dell’1% si associava a una ridu-
zione del 5% dei valori di 25-OHD) e di basso
livello socio-economico (42).La validazione dei nuovi cut off proposti per
la valutazione dello stato vitaminico D è im-
portante, in quanto rivoluziona l’epidemiolo-
gia della deficienza di vitamina D: nello stu-
dio citato la percentuale di adolescenti con
deficit di vitamina D aumenta dal 2% al 14%
e al 48% considerando come limite di nor-
malità valori di 25-OHD pari rispettivamente
a 11 ng/ml, 20 ng/ml e 30 ng/ml (42).Negli adolescenti i livelli di 25-OHD sono in-
versamente proporzionali ai valori di PTH e
dipendono dalla stagione, dalla razza, dal
consumo di latte, dall’indice di massa cor-
porea e dall’esercizio fisico. L’instaurarsi del-
l’iperparatiroidismo secondario porta a de-
mineralizzazione del tessuto osseo, soprattut-
to in un periodo critico come la pubertà, ca-
ratterizzato da un rapido accrescimento.
Importante è, pertanto, il rapporto tra stato
vitaminico D e acquisizione della massa os-
sea durante l’età evolutiva.
Una recente metanalisi sottolinea come nei
bambini più grandi e negli adolescenti i va-
lori di 25-OHD correlino con i valori di densità
minerale ossea (8), e un altro studio ha di-mostrato in bambine prepuberi allattate al
seno e supplementate con vitamina D alla
dose di 400 UI/die durante il primo anno di
vita valori di densità minerale ossea a livello
del collo femorale e della metafisi radiale si-
gnificativamente maggiori di quelli riscon-
trati in coetanee non supplementate.
Tali dati, pur con tutte le limitazioni che deri-
vano dalla difficoltà di soppesare il ruolo
della vitamina D separatamente da quello
di altri fattori nutrizionali che potrebbero in-
fluire sull’accumulo della massa ossea, sem-
brano suggerire che l’apporto di vitamina D
nel primo anno di vita possa influenzare il
processo di acquisizione della massa ossea
durante l’età evolutiva (43). Ulteriori studi so-no comunque necessari per identificare i
valori di 25-OHD capaci di promuovere l’ot-
timale acquisizione della massa ossea e di
prevenire l’insorgenza di osteoporosi nella vi-
ta adulta. Dal momento che pochi adole-
scenti assumono con la dieta 400 UI/die di
vitamina D, la American Academy of Pedia-
trics raccomanda in questi casi di sommini-
strare 400 UI/die di vitamina D mediante un
multivitaminico o preparati contenenti
esclusivamente vitamina D (31). Quando ipazienti mostrano una scarsa compliance,
un’alternativa alla supplementazione gior-
naliera è data dalla possibilità di sommini-
strare 100.000 UI di vitamina D per via orale,
ogni tre mesi, durante il periodo invernale in
bambini e in adolescenti (44). Infine, la American Academy of Pediatrics
sottolinea come i bambini con aumentato
rischio di deficienza di vitamina D (malassor-
bimento cronico dei grassi, in terapia con
anticonvulsivanti) possono richiedere sup-
plementazioni maggiori di vitamina D. In
questo caso i livelli di 25-OHD devono essere
controllati a intervalli di tre mesi finché non si
raggiungono valori normali (31).Alcuni anticonvulsivanti (fenobarbital, difeni-
lidantoina, carbamazepina) sono induttori
PUNTO CHIAVEL’insufficienteesposizione al sole e l’inadeguato apportoalimentare pongonol’indicazione alla supplementazionecon vitamina Dnei bambinie negli adolescenti
BIBLIOGRAFIA
41 Lanou AJ, Berkow SE, Barnard
ND. Calcium, dairy products, and
bone health in children and young
adults: a reevaluation of the evidence.
Pediatrics 2005;115:736-43.
42 Saintonge S, Bang H, Gerber LM.
Implications of a new definition of
vitamin D deficiency in a multiracial
us adolescent population: the National
Health and Nutrition Examination
Survey III. Pediatrics 2009;123:797-
803.
43 Zamora SA, Rizzoli R, Belli DC,
et al. Vitamin D supplementation
during infancy is associated with
higher bone mineral mass in
prepubertal girls. J Clin Endocrinol
Metab 1999;84:4541-4.
44 Tau C, Ciriani V, Scaiola E, et al.
Twice single doses of 100.000 IU of
vitamin D in winter is adequate and
safe for prevention of vitamin D
deficiencyin healthy children from
Ushuaia, Tierra Del Fuego,
Argentina. J Steroid Biochem Mol
Biol 2007;103:651-4.
pA n. 3 - Maggio/Giugno 2010 XIX
D o s s i e r e n D o c r i n o l o g i A
BIBLIOGRAFIA
45 Saggese G, Baroncelli GI. Disturbi
del metabolismo fosfo-calcico.
Endocrinologia pediatrica. Milano:
McGraw Hill, 2001.
46 Hollis BW, Wagner CL.
Nutritional vitamin D status during
pregnancy: reasons for concern.
CMAJ 2006;174:1287-90.
47 Delvin EE, Salle BL, Glorieux FH,
et al. Vitamin D supplementation
during pregnancy: effect on neonatal
calcium homeostasis. J Pediatr
1986;109:328-34.
48 Cooper C, Westlake S, Harvey N,
et al. Review: developmental origins of
osteoporotic fracture. Osteoporos Int
2006;17:337-47.
49 Sayers A, Tobias JH. Estimated
maternal ultraviolet B exposure levels
in pregnancy influence skeletal
development of the child. J Clin
Endocrinol Metab 2009;94:765-71.
50 Canadian Paediatric Society.
Vitamin D supplementation:
Recommendations for Canadian
mothers and infants. Paediatr Child
Health 2007;12:583-98.
✂
microsomiali della 25-idrossilasi epatica con
conseguente ridotta sintesi di 25-OHD, poi-
ché la vitamina D viene trasformata in pro-
dotti più polari e inattivi escreti con le feci e
le urine. Inoltre, questi farmaci inibiscono l’as-
sorbimento intestinale e il riassorbimento os-
seo di calcio. Il valproato di sodio invece au-
menta l’escrezione renale di calcio e fosfato
per una riduzione del riassorbimento tubula-
re. Particolarmente a rischio di sviluppare le-
sioni ossee sono i pazienti in politerapia con
antiepilettici e i bambini istituzionalizzati, nei
quali l’esposizione solare è scarsa; la profilas-
si di questi bambini deve quindi essere effet-
tuata somministrando vitamina D a dosi più
alte (800-1200 UI/die) o i suoi metaboliti (25-
OHD alla dose di 10-15 mcg/die) (45).Gravidanza e allattamento sono periodi
della vita durante i quali lo stato vitaminico
D riveste una grande importanza.
Non è raro che una deficienza di vitamina D
si determini già durante la vita intrauterina,
come effetto di uno stato carenziale mater-
no che perdura nel corso della gravidanza.I bambini nati da madri con buone riserve di
vitamina D sviluppano, se non correttamen-
te profilassati, una deficienza di vitamina D
generalmente dopo i due mesi di vita; men-
tre i bambini nati da madri con carenza di
vitamina D rischiano di sviluppare tale defi-
cienza in tempi più rapidi. Inoltre, la deficien-
za di vitamina D durante la gestazione è sta-
ta correlata a parto prematuro, un maggior
rischio di ritardo intrauterino di crescita del
feto e a basso peso alla nascita (46). Unadeguato stato vitaminico materno duran-
te la gravidanza è quindi importante per il
corretto sviluppo del feto e in particolare
per la mineralizzazione dello scheletro e per
la formazione dello smalto dentario (31).Nelle gestanti con deficienza di vitamina D,
minori quantità di 25-OHD sono in grado di
passare la placenta e di andare a costituire
le scorte del bambino. I valori di 25-OHD del
bambino correlano, infatti, con quelli della
madre, mentre la 1,25-OH2D non è in grado
di attraversare la placenta (15). Alcuni studihanno dimostrato che la supplementazione
con vitamina D durante la gravidanza ridu-
ce l’incidenza di ipocalcemia nei neonati
(47). Secondo alcuni autori, inoltre, esistereb-be una relazione tra lo stato vitaminico D
della madre e la programmazione del rag-
giungimento dei futuri valori di picco di mas-
sa ossea del bambino (48). Uno studio re-cente ha sottolineato anche l’importanza
dell’esposizione alla luce solare durante la
gravidanza: l’analisi ha raggruppato circa
7.000 bambini e ha dimostrato che l’esposi-
zione della gestante agli UVB durante il terzo
trimestre di gestazione correla con la den-
sità minerale ossea del bambino a dieci an-
ni. In particolare, è stato calcolato che un
aumento di esposizione agli UVB di 0,1 DS
(deviazioni standard) corrisponde a un au-
mento di contenuto minerale osseo di 0,05
DS nel bambino, con una conseguente ri-
duzione del rischio di frattura nella vita adul-
ta del 5% (49).Poiché adeguati valori di vitamina D mater-
ni sono essenziali anche per la salute del fe-
to, sarebbe opportuno verificare sempre
che durante la gestazione i valori di 25-OHD
materni siano superiori a 30 ng/ml (il livello di
vitamina D-sufficienza suggerito per gli adul-
ti) (31); qualora non lo siano alcuni autoriconsigliano la somministrazione di 1.000-
2.000 UI/die di vitamina D alla madre, in par-
ticolare durante l’inverno (50).Al pari della gravidanza, anche il periodo
dell’allattamento al seno è estremamentedelicato per il bambino, poiché il latte ma-
terno, da solo, è capace di assicurare al lat-
tante solo 11-38 UI/die di vitamina D e la
supplementazione delle madri con 400
UI/die di vitamina D non è in grado di au-
mentare in maniera significativa tale appor-
to (25-78 UI/die) (31). L’attività antirachiticadel latte umano è scarsa, in quanto è attri-
buibile unicamente al suo contenuto di vita-
mina D liposolubile, pari a 15-50 UI/l; anche il
latte vaccino intero contiene scarse quan-
n. 3 - Maggio/Giugno 2010ApXX
✂
tità di vitamina D (circa 40 UI/l) (26). Per que-sti motivi i bambini allattati esclusivamente
al seno, in particolare se da madri di colore,
hanno bisogno di ricevere vitamina D da
una fonte addizionale come l’esposizione
solare o la supplementazione esogena (40). Durante l’allattamento la supplementazio-
ne esclusiva della madre con 2.000 UI/die di
vitamina D2 si è dimostrata capace di au-
mentare le proprietà antirachitiche del latte
umano e di assicurare al lattante valori di 25-
OHD superiori a 25 ng/ml, mentre la supple-
mentazione con 4.000 UI/die assicura al lat-
tante concentrazioni di 25-OHD superiori a
30 ng/ml, in assenza di effetti collaterali (51).Al momento attuale, comunque, non esisto-
no evidenze sufficienti per raccomandare
la supplementazione delle madri che allat-
tano con dosi elevate di vitamina D. Ulteriori
studi sono necessari per verificare la sicurez-
za di tale intervento, ma appare più ragio-
nevole e pratico, dopo aver assicurato nella
madre che allatta uno stato vitaminico D
sufficiente, sottoporre tutti i bambini allattati
al seno a profilassi con 400 UI/die vitamina D
fin dai primi giorni di vita (31).Particolare attenzione, infine, va riservata al
neonato pretermine. I processi di mineraliz-zazione ossea iniziano, infatti, durante la vita
intrauterina, e si esprimono in particolare du-
rante l’ultimo trimestre di gestazione. Dopo il
parto il bambino subisce una fisiologica di-
minuzione dei valori di densità minerale os-
sea, dal momento che i processi di minera-
lizzazione ossea post-natali sono inferiori a
quelli presenti durante la vita intrauterina.
Nei nati pretermine, questi processi di adat-
tamento avvengono precocemente e a
partire da valori di densità minerale ossea in-
feriori rispetto al neonato a termine, con il ri-
schio che si determini una condizione di
osteopenia (detta “osteopenia del preter-
mine”), un evento piuttosto comune nei na-
ti prematuri, che può associarsi a un aumen-
to della fragilità ossea e del rischio di frattura
(52) .Questa condizione insorge, in genere,
da 6 a 12 settimane dopo la nascita, ed è
conseguenza delle ridotte scorte di calcio e
fosforo dei pretermine; in questi casi la vita-
mina D svolge comunque un ruolo impor-
tante, per esempio favorendo il passaggio
transplacentare del fosforo e l’assorbimento
intestinale di calcio e fosforo dopo la nasci-
ta. Del resto, i processi di idrossilazione, e
quindi di attivazione, della vitamina D, sono
già pienamente funzionanti a partire dalla
24a settimana di gestazione (52).Non vi è accordo in letteratura su quale sia la
quantità di vitamina D da somministrate a un
bambino nato pretermine: la European So-
ciety for Paediatric Gastroenterology, Hepa-
tology and Nutrition (ESPGHAN) nel 1987
consigliò di somministrare 800-1.600 UI/die
(53), mentre la American Academy of Pe-diatrics nel 1985 raccomandò 400 UI/die
(54). Studi recenti hanno valutato l’effetto didifferenti dosi di vitamina D nei pretermine,
sottolineando che, come nei nati a termine,
400 UI/die sono in grado di mantenere uno
stato vitaminico D normale; questi lavori
sconsigliano di somministrare dosi eccessive
di vitamina D, per non correre il rischio di in-
crementare eccessivamente i processi di tur-
nover osseo, in particolare quelli di riassorbi-
mento (55,56).Questi studi, sicuramente inte-ressanti, sono condotti su popolazioni picco-
le, pertanto per formulare raccomandazioni
certe sono necessarie casistiche più ampie.
Per tali motivi, altri autori preferiscono conti-
nuare a seguire le raccomandazioni dell’E-
SPGHAN, consigliando per il nato pretermine
la somministrazione di 800-1.000 UI/die di vi-
tamina D da protrarre finché il bambino non
raggiunge un’età pari a un’età post conce-
zionale di 40 settimane (52).
n IN SINTESI
Le nuove acquisizioni sul metabolismo, le
funzioni scheletriche ed extra-scheletriche
della vitamina D dimostrano che essa ha un
BIBLIOGRAFIA
51 Hollis BW, Wagner CL. Vitamin D
requirements during lactation: high-
dose maternal supplementation as
therapy to prevent hypovitaminosis D
for both the mother and the nursing
infant. Am J Clin Nutr
2004;80:S1752-8.
52 Rigo J, Pieltain C, Salle B, et al.
Enteral calcium, phosphate and
vitamin D requirements and bone
mineralization in preterm infants.
Acta Paediatr 2007;96:969-74.
53 ESPGAN Committee on nutrition
of the preterm infant. Nutrition and
feeding of preterm infants. Acta
Pediatr Scand 1987;336:1-14.
54 American Academy of Pediatrics,
Committee on Nutrition. Nutritional
needs of low-birthweight infants.
Pediatrics 1985;75:976-86.
55 Backström MC, Mäki R, Kuusela
AL, Sievänen H, et al. Randomised
controlled trial of vitamin D
supplementation on bone density and
biochemical indices in preterm infants.
Arch Dis Child Fetal Neonatal Ed
1999;80:161-6.
56 Kislal FM, Dilmen U. Effect of
different doses of vitamin D on
osteocalcin and deoxypyridinoline in
preterm infants. Pediatr Int
2008;50:204-7.
PUNTO CHIAVEA causa di ridotte scortedi calcio e fosforoil neonato pretermineè a rischio di svilupparela cosiddetta osteopeniadella prematurità
pA n. 3 - Maggio/Giugno 2010 XXI
D o s s i e r e n D o c r i n o l o g i A
PUNTO CHIAVEGli attuali datiepidemiologici sul rachitismoe le conoscenze sulruolo della vitamina Dnel metabolismo osseo ea livello extrascheletricoprovano l’estremaimportanzadi un’individuazioneprecoce degli staticarenziali
✂
ruolo sempre più importante nella promo-
zione della salute del bambino.
Lo stato vitaminico D può essere valutato in
base ai valori plasmatici di 25-OHD. Nel
bambino e nell’adolescente si ritiene che
valori di 25-OHD superiori a 20 ng/ml possa-
no indicare uno stato vitaminico D ottimale,
anche se ulteriori studi sono necessari per
valutare se sia opportuno adottare, anche
nell’età evolutiva, un cut-off di 32 ng/ml, co-
me nella popolazione adulta.
Ulteriori studi sono necessari inoltre per co-
noscere il rapporto rischio-beneficio tra una
corretta esposizione solare e la possibilità di
sviluppare neoplasie cutanee. In particola-
re, le nuove raccomandazioni dovranno
confermarsi efficaci nel garantire un’ade-
guata sintesi cutanea di vitamina D nei
bambini di colore, specie in inverno e alle
alte latitudini.
Il rachitismo carenziale, la conseguenza
estrema della deficienza di vitamina D, è
una patologia presente ancora oggi nei
paesi in via di sviluppo e in aumento nei
paesi industrializzati. L’insorgenza della defi-
cienza di vitamina D si associa a diversi fat-
tori di rischio, in particolare la mancata ef-
fettuazione della profilassi con vitamina D e
l’allattamento esclusivo al seno. Nei paesi
sviluppati i bambini adottati o figli di immi-
grati sono maggiormente a rischio.
La diagnosi di rachitismo si basa sull’interpre-
tazione dei segni clinici e radiologici dovuti
all’accumulo di tessuto osteoide non mine-
ralizzato e dei parametri biochimici. I bambi-
ni nati da madri con grave deficienza di vi-
tamina D possono avere un esordio preco-
ce della malattia, anche con ipocalcemia
sintomatica, quando le tipiche alterazioni
scheletriche non sono ancora comparse.
La terapia del rachitismo carenziale si basa
sulla somministrazione di vitamina D: dosi
giornaliere (1.000-10.000 UI/die per os a se-
conda dell’età) di vitamina D sono capaci
di portare a guarigione le lesioni ossee con-
seguenza della deficienza di vitamina D;
dopo la normalizzazione dei parametri bio-
chimici e radiologici la somministrazione di
vitamina D può continuare a dosi profilatti-
che (400 UI/die). Nei casi di scarsa com-
pliance si possono somministrare dosi d’urto
(100.000-200.000 UI per os o im) ripetibili
eventualmente ogni tre mesi fino alla guari-
gione radiologica delle lesioni. Se si docu-
menta ipocalcemia asintomatica o tetania
latente, è necessario somministrare anche
calcio per via orale e in caso di tetania o
convulsioni il calcio deve essere sommini-
strato per via endovenosa.
Per quanto riguarda la prevenzione del ra-
chitismo carenziale, la AAP ha recente-
mente modificato le raccomandazioni re-
lative al fabbisogno giornaliero di vitamina
D durante l’età evolutiva, passando da 200
UI/die a 400 UI/die senza alcun rischio di
ipervitaminosi. L’esposizione solare è piena-
mente capace di assicurare un’adeguata
sintesi di vitamina D, ma la sua efficacia ri-
sente dei limiti dovuti alla latitudine, alla sta-
gione dell’anno e all’ora del giorno; inoltre
non è noto con precisione quanto tempo
sia necessario esporre un bambino alla lu-
ce solare per mantenere uno stato vitami-
nico D ottimale. Appare pertanto più ragio-
nevole e pratico sottoporre tutti i bambini
allattati al seno a profilassi con 400 UI/die vi-
tamina D fin dai primi giorni di vita, tenendo
sempre presente che tutti i periodi caratte-
rizzati da rapido accrescimento staturo-
ponderale sono a rischio di deficienza di vi-
tamina D in caso di scarso apporto dieteti-
co o scarsa esposizione solare. I nati preter-
mine, che possono richiedere la sommini-
strazione profilattica di dosi maggiori di vi-
tamina D (800-1.000 UI/die) fino al raggiun-
gimento di un’età pari a 40 settimane post
concezionali. Anche durante la gravidan-
za deve essere assicurato uno stato vitami-
nico D adeguato, per l’importante ruolo
della vitamina D sulla programmazione
della futura acquisizione della massa ossea
del bambino.
1
L’esposizione solare contribuisce alle scorte di vi-tamina D del bambino per il:❑ a 10%❑ b 35%❑ c 50%❑ d 75%❑ e 90%
2
L’indice più accurato dello stato vitaminico D è:❑ a colecalciferolo❑ b 25-idrossivitamina D❑ c 1,25-diidrossivitamina D❑ d paratormone❑ e fosfatasi alcalina
3
Tra le seguenti non è un’azione extrascheletri-ca della vitamina D:❑ a il controllo della proliferazione cellulare❑ b l'azione immunomodulante❑ c il controllo della differenziazione cellulare❑ d la promozione del riassorbimento di sodio a livello re-
nale❑ e la prevenzione del rischio di sviluppare malattie car-
diovascolari
4
I valori di 25-OH D recentemente proposti co-me indice di insufficienza di vitamina D sono:❑ a <5 ng/ml❑ b <8 ng/ml❑ c <20 ng/ml❑ d <25 ng/ml❑ e <30 ng/ml
5
Tra i seguenti parametri quello che non in-fluenza la capacità della radiazione solare diprodurre vitamina D a livello cutaneo è:❑ a la pigmentazione melanica❑ b l'inquinamento atmosferico❑ c la latitudine❑ d la stagione❑ e il sesso
6
Tra i seguenti non è un segno suggestivo di ra-chitismo carenziale:❑ a il solco di Harrison❑ b il cranio tabe❑ c il varismo degli arti inferiori❑ d l'alopecia❑ e l’ipotonia
7
Secondo le nuove raccomandazioni dellaAmerican Academy of Pediatrics il fabbisognodi vitamina D durante l’età evolutiva è pari a:❑ a 400 UI/die❑ b 200 UI/die❑ c 800 UI/die❑ d 100 UI/die❑ e 1.000 UI/die
8
Tra le seguenti condizioni patologiche quellache richiede profilassi con vitamina D a dosimaggiori è:❑ a il deficit di ormone della crescita❑ b l'epilessia in terapia con anticonvulsivanti❑ c l'ipotiroidismo❑ d il ritardo puberale costituzionale❑ e l'ipertensione
9
Il contenuto di vitamina D del latte materno èpari a:❑ a 40 UI/l❑ b 400 UI/l❑ c 200 UI/l❑ d zero❑ e 800 UI/l
10
Nel rachitismo carenziale la terapia con vita-mina D porta alla risoluzione delle lesioni ra-diologiche dopo:❑ a 1 settimana❑ b 2 settimane❑ c 8-14 settimane❑ d 6 mesi❑ e 1 anno
Test di autovalutazioneIl test consente di verificare l’apprendimento dei nuclei di aggiornamento presentati nel Dossier: è preparato in modo da va-lutare in prima persona una metodologia di formazione per obiettivi piuttosto che specifiche nozioni di carattere mnemonico.
ATTENZIONE: OGNI QUESITO PUÒ AVERE UNA SOLA RISPOSTA CORRETTA
Giuseppe Saggese, Francesco VierucciUO Pediatria II, Azienda Ospedaliero-Universitaria Pisana, Ospedale Santa Chiara, Pisa
n. 3 - Maggio/Giugno 2010ApXXII
11
Il dosaggio dell’isoenzima osseo della fosfa-tasi alcalina viene raccomandato in presen-za di:❑ a rachitismo carenziale in bambini in terapia con fe-
nobarbital❑ b rachitismo carenziale in bambini in terapia con val-
proato di sodio❑ c rachitismo vitamina D dipendente tipo I❑ d rachitismo vitamina D dipendente tipo II❑ e obesità
12
In presenza di ipocalcemia sintomatica la te-rapia prevede:❑ a somministrazione di calcio ev in push❑ b somministrazione di calcio ev in tempo superiore a
5 minuti❑ c somministrazione di dosi d’urto di vitamina D❑ d somministrazione dei metaboliti della vitamina D❑ e somministrazione di calcio per os
13
In presenza di rachitismo carenziale il para-metro biochimico che risulta sempre altera-to è:❑ a il fosforo❑ b il magnesio❑ c il calcio❑ d la fosfatasi alcalina❑ e l'osteocalcina
14
La vitamina D promuove:❑ a l’assorbimento renale di calcio❑ b l’assorbimento renale di fosforo❑ c l’assorbimento intestinale di calcio❑ d l’assorbimento intestinale di fosforo❑ e l’assorbimento intestinale di calcio e fosforo
15
Alla nostra latitudine l’esposizione alla lucesolare fa produrre la massima quantità di vi-tamina D:❑ a durante tutto l’anno senza differenze stagionali❑ b durante i mesi invernali❑ c durante i mesi estivi❑ d durante i mesi autunnali❑ e durante i mesi primaverili
16
Tra i seguenti bambini non sono particolar-mente a rischio di sviluppare rachitismo ca-renziale quelli:❑ a adottati❑ b immigrati❑ c non profilassati con vitamina D❑ d istituzionalizzati❑ e nati in inverno profilassati con vitamina D
17
I primi casi di rachitismo carenziale sono sta-ti descritti:❑ a in Inghilterra❑ b in Italia❑ c negli Stati Uniti❑ d nel Medio Oriente❑ e in Canada
18
Secondo un recente studio canadese, l’inci-denza attuale del rachitismo carenziale è pa-ri a:❑ a 20:10.000❑ b 2,9:100.000❑ c 5:1.000.000❑ d 10:1.000❑ e 1:100
19
Le dosi semi-urto per la terapia del rachiti-smo carenziale sono pari a:❑ a 100.000 UI/die❑ b 4.000 UI/die❑ c 600.000 UI/die❑ d 10.000 UI/die❑ e 1.000.000 UI/die
20
Il rischio di ipercalcemia si ha per dosi gior-naliere di vitamina D superiori alle:❑ a 400 UI❑ b 4.000 UI❑ c 10.000 UI❑ d 50.000 UI❑ e 100.000 UI
Risposte al test di autovalutazione di Ap N.2 marzo/aprile 2010
1a, 2d, 3b, 4c, 5d, 6e, 7b, 8a, 9d, 10e, 11e, 12b, 13e, 14b, 15c, 16a, 17b, 18b, 19a, 20b
D o s s i e r e n D o c r i n o l o g i A
pA n. 3 - Maggio/Giugno 2010 XXIII