Il legame peptidico - Libero.it ForumFree/biochimica … · completo attorno ad un’alfa-elica. Ci...
Transcript of Il legame peptidico - Libero.it ForumFree/biochimica … · completo attorno ad un’alfa-elica. Ci...

Il legame peptidico

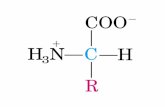
•La polimerizzazione di AA viene raggiunta per eliminazione di una molecola d’acqua tra il gruppo carbossilico di un AA e il gruppo amminico del successivo.
•Il legame che ne risulta è il legame peptidico.
Il legame peptidico
Nelle cellule il legame viene creato nei ribosomi, catalizzato da enzimi.

Il legame peptidico
La catena ha una direzione!!
Leu-encefalina
Ex. La Leu-encefalina, un oppiode che regola la percezione del dolore. Il peptide inverso non riesce a svolgere la stessa funzione

L’ IDROLISI E’ RAPIDA SOLO IN PRESENZA DI CATALIZZATORI
acidi forti HCl 6M enzimi proteolitici o proteasi
transpeptidazione Il legame peptidicosi forma mediantespostamento nucleofilicodel tRNA del sito n da parte del gruppo amminiconel sito successivo. ∆G0 < 0
L’idrolisi del legame peptidico è termodinamicamente favorita rispetto alla formazione del legame (condensazione ∆G0=+10kJmol-1)
I POLIPEPTIDI SONO MOLECOLE METASTABILI

Chimica del legame peptidico
La linea rossa formata da -Cα-C-N- Cα-
costituisce il backbone della catena peptidica
•legame peptidico 40% di doppio legame•config. Planare: massima sovrapposizione orbitali π

Introduction to Molecular Biophysics
µ= Z*d Z= carica in eccesso d= separazione tra cariche in eccesso
1 Debye = 10-18 esu.cm
Momento di dipolo
O
C
Cα
N
Cα
H
O
C
Cα
N
Cα
Hδ+
δ-
µ= 3.5 Debye

La conformazione trans è la conformazione preferita
Pro:cis e trans equivalenti

Una catena polipetidica è costituita da una catena principale con struttura ripetitivae da catene laterali variabili Ri,
Lo scheletro di una proteina è una sequenza di gruppi peptidici planari e rigidi legati
Cα, C, O, N, H, Cα: individuano un piano

Le proteine sono polipeptidi (lunghi) a sequenza aminoacidica definita:struttura primaria
La struttura primaria è il livello strutturale fondamentale su cui sonobasati i livelli superiori di organizzazione
La struttura primaria delle La struttura primaria delle proteineproteine

Struttura primaria dell’insulina bovina: la prima proteina ad essere sequenziata (1953)
struttura primaria residuo
51 residui
Nella sequenza l’estremità N-terminale è scritta a sinistra, la C-terminale a destra

Ogni proteina è unica in una data specie di organismo. Similitudininella struttura primaria sono presentievoluzione molecolare (proteine omologhe)Le proteine “evolvono” per modifiche della sequenza primaria:
Numero delle differenze in amminoacidi tra le sequenze di Citocromo C

Albero filogenetico che decrive le relazioni evoluzionistiche tra alcuni organismi come derivate dall’analisi di sequenza del citocromo c

Strutture tridimensionali delle proteineStrutture tridimensionali delle proteine
La struttura tridimensionale permette alla proteina di svolgereil proprio ruolo biologico
Livelli di struttura:
• struttura primaria
• struttura secondaria
•struttura terziaria
•struttura quaternaria

Primary structure Secondary structure
Tertiary structure Quaternary structure

Le conformazioni dello scheletro polipeptidico possono essere descritti dai loro angoli di torsione (rotazione) ϕ e ψ
ϕ angolo intorno al legame N - Cα
ψ angolo intorno al legame Cα- C
• non tutti i valori sono permessi• alcune coppie di valori sono più probabili

I residui di Gly hanno una elevata libertà conformazionale
diagramma di Ramachandran per i residui di Gly
Distribuzione degli angoli per circa 1000 residui in 8 proteine


conformazioni impossibili: quelle in cui le distanze interatomichetra atomi non legati è inferiore ai raggi di van der Waals
diagramma di Ramachandranmappa delle conformazioni permesse

Le combinazioni di angoli accettabili rappresentano
sottoclassi di strutture

α-elicaα-elica
Elica destrorsa: φ= -57o ψ =-47o
legami a H 2.8Å N-H--O=Cp = 5.4Ån = 3.6
• ha gli angoli permessi nella mappa di Ramachandran• ha una disposizione di legami a H favorevole
Le catene lateralipuntano verso l’esterno

Le eliche sono la forma più abbondante di struttura secondaria riscontrata nelle proteine globulari: 32-38% dei residui
C-terminale

Nell’ α-elica il legame a H chiude un’ansa formata da 13 atomi: α-elica (3.613)
L’ α-elica è un elemento strutturale di moltissime proteine, sia globulari che fibrose
In media circa 12 residui, > 3 giri

n X 3.5 Debye (n= numero di residui)
This is equivalent to 0.5 – 0.7 unit charge at the end of the helix.
Dipolo dell’elica
Momenti di dipolo orientati tutti paralleli
momento di dipolo netto risultante

Introduction to Molecular BiophysicsSide chains point out towards solution althoughthey are tilted towards the amino terminus of the alpha helix.
Side chains with branched amino acids (Val, Ile, Thr) are restricted in their conformations.
Polar side chains (Ser, Asp, Asn) can hydrogen bond to the backbone peptide groups and interfere with hydrogen bonding of the alpha helix.
Interactions with side chains in α-helices

Introduction to Molecular BiophysicsInteractions with side chains in α-helices
Proline residue is not compatible with the alpha helix conformation
Since there is no backbone –NH group for hydrogen bonding, Pro interfereswith hydrogen bonding pattern of the alpha helix (break 2 H bonds).
Also causes packing constraints because of cyclic side chain.
In long helices, proline residues can be accommodated by local distortions in the helical geometry.
Proline residues induce distortions of around 20 degrees in the direction of the helix axis.

Altri tipi di eliche nei polipeptidiAltri tipi di eliche nei polipeptidi
4.416
p =6.0 Å
L’elica 310 e π (4,416) sono osservate in brevi tratti in prossimità di α-elica interferenze steriche

Helical distortions: left handed alpha helixLeft handed alpha helices: theoretically possible by steric considerations and the backbone torsion angles would have the same magnitude (but opposite sign) of right-handed helices.
However, the side chains of a left-handed alpha helix would be too close to the backbone so the right-handed conformation is more favored energetically.
Comparison between thethree theoretically possiblehelical geometries.

L’elica 310 e π (4,416) sono osservate in brevi tratti in prossimità di α-elica: interferenze steriche

Strutture Beta
L’unità di base del foglietto beta è il filamento beta(beta strand), che consiste di un polipeptide completamente esteso.

Legami a H tra filamenti beta adiacenti stabilizzano la struttura
I momenti di dipolo solo allineati
Il foglietto beta (Beta Sheet)
Anti parallelo Parallelo

Strutture βStrutture β
Ripiegamentodel fogliettoche ottimizzai legami a H
Minimo di 2 catene (antiparallelo!),minimo 5 catene (parallelo!)massimo di 15, valore medio 6lunghezza media 6 residui, max. 15

Le catene laterali stanno alternativamente sopra e sotto il piano della catena beta
Nel foglietto β-parallelo ogni residuo è in legame a H con altri due

I residui distano 7.0 Å lungo il filamento ma solo 4.5 Å tra filamenti adiacenti
Beta Sheet

Le catene dei foglietti β β si indicano con frecce orientateverso l’estremità C-terminale
Le catene dei foglietti β tendono ad avvolgersi β tendono ad avvolgersi

β- barrelTrioso fosfato isomerasi
Carbossipeptidasi A
Curvatura destorsa
Curvature destrorse delle StruttureStrutture β β
Il beta sheet Ideale è planare. Nelle proteine i beta sheets hanno una curvatura destrorsa probabilmente a causa della interazione tra backbone e le catene laterali

Impacchettamento di Beta Sheets
A causa della corta distanza tra filamenti (4.5 Å), non è possibile creare patterns di intercalazione (eccetto per casi come la seta).
Coppie di beta sheets possono esssere circa allineati o ortogonali

The Greek Key Motif
Quattro β-strands antiparalleli adiacenti sono arrangiati frequentemente achiave Greca
La connessione tra beta strands con loops corti è semplice

Come sono connessi i β strands paralleli?
La connessione è spesso
effettuata da tratti di alfa elica
(motivo beta- alfa-beta)
Le due estremità connesse sono da parti opposte del beta-sheet cioè
la catena deve attraversare il foglietto per connetterle

Struttura Beta Alfa Beta
Uno strato esterno di alfa eliche che si impaccano contro uno strato (core) di beta sheets paralleli
la subunità beta-alfa-beta-alfa-beta spesso presenti in proteine che legano nucleotidi è detta Rossman Fold

Il barile Alfa Beta
Una sequenza di otto beta-alfa
Il primo beta strand si lega in legami a H con l’ultimo chiudendo la struttura a barile. Osservato per la prima volta nella TIM (TIM fold)
I residui del beta barrel sono idrofobici. Quelli in un lato si impaccano contro l’alfa elica, quelli dal lato opposto costituiscono il cuore centrale del barile.

Struttura Super-secondaria - Arrangiamento di unità di struttura secondaria
•Rossman fold struttura alpha/beta (nucleotide binding).
•Alpha/Beta barrel (o TIM barrel).

Ripiegamenti e gomitiRipiegamenti e gomiti
Spesso Gly
Spesso Pro

Strutture non ripetitiveStrutture non ripetitive
• le strutture regolari α-elica e ββ -sheet rappresentano in media la metà di una struttura proteica
• le rimanenti zone possono assumere forme a coil , loop etc..
• alcuni tratti possono di fatto essere disordinati (random coil)
Ω-loop nel Cyt c AA:40-54
Ruolo dei loop nel riconoscimentobiologico

Introduction to Molecular BiophysicsThe helical wheel
L’amfipaticità di un’alfa elica può essere rappresentata mediante una rappresentazione a ruota
Rappresentazione utile per vedere le interazioni TRA alfa eliche
Ci vogliono 3,5 residui per fare un giro completo attorno ad un’alfa-elica. Ci sono quindi 7 diverse posizioni nella ruota (coperte in due giri)

Introduction to Molecular BiophysicsAssociazione di α eliche: coiled coils
Una ripetizione di 7 residui (eptade abcdefg) con residui non polari alle posizioni a e d
Il coiled coil è uno schema usato spesso per controllare le oligomerizzazioni
Ex. Leucine Zipper Coiled Coil

Introduction to Molecular Biophysics
La ripetizione dell’eptade porta a supercoil
la ripetizione porta a una riga idrofobica lungo l’elica (linea verde, a e d in rosso).
Il twisting permette di massimizzare l’interazione nell’avvolgimento con una seconda elica
Ci sono in realtà più di 3.5 residui per giro (3.6) questo porta a una inclinazione della striscia idrofobica dei residui a,d. per questo le eliche si incrociano a circa 30°.


Introduction to Molecular BiophysicsAssociazioni di α eliche: coiled coils

Alfa-elica Beta-sheet Coiled-coil Leucine-zipper