Ematossilina e eritrosina - sbt.ti.ch · PDF file5 MATERIALI E METODI COLORANTI E...
Transcript of Ematossilina e eritrosina - sbt.ti.ch · PDF file5 MATERIALI E METODI COLORANTI E...
1
EMATOSSILINA & ERITROSINA
PROGETTO DI STANDARDIZZAZIONE IN
ISTOLOGIA
Natalja Zutter
Scuola Superiore Medico-Tecnica, Locarno
Giugno 2007
Lavoro svolto presso l’Istituto di Patologia di Locarno
Responsabile Prof. Dr. Med. Luca Mazzucchelli
2
INDICE
RIASSUNTO/ABSTRACT ......................................................................................... 3
INTRODUZIONE..................................................................................................... 4
MATERIALI E METODI ......................................................................................................... 5
Coloranti e differenziatori ............................................................................................... 5
Coloranti nucleari: ematossilina ................................................................................. 5 Differenziatori ............................................................................................................. 5 Coloranti citoplasmatici: eritrosina/eosina ................................................................. 6
Materiale biologico........................................................................................................... 6
Fissazione .......................................................................................................................... 6
Processazione .................................................................................................................... 7
Inclusione in paraffina..................................................................................................... 8
Taglio al microtomo ....................................................................................................... 10
Colorazione ..................................................................................................................... 11
Valutazione della colorazione........................................................................................ 14
Analisi dei costi ............................................................................................................... 16
RISULTATI ........................................................................................................... 18
Risultati delle colorazioni manuali ............................................................................... 19
Risultati delle colorazioni automatiche ........................................................................ 28
Risultati della valutazione secondo ogni criterio....................................................... 33 Risultati della valutazione: punteggio totale ............................................................. 34
DISCUSSIONE ...................................................................................................... 35
CONCLUSIONI ..................................................................................................... 36
RINGRAZIAMENTI ............................................................................................... 37
BIBLIOGRAFIA…………………………………………………………………38
3
RIASSUNTOIntroduzione: La colorazione ematossilina-eritrosina (H&E) rappresenta la tecnica di colorazione più
frequentemente utilizzata in istologia per l’esame microscopico ed è eseguita per ogni campione tessutale; la sua qualità determina in modo importante l’esecuzione della diagnosi. Lo scopo del lavoro di diploma è quello di
individuare dei coloranti pronti all’uso che potrebbero sostituire i coloranti attualmente ricostituiti manualmente utilizzati all’Istituto cantonale di Patologia di Locarno. La conseguente standardizzazione di questa colorazione
permetterebbe ai tecnici di laboratorio di accorciare i tempi di preparazione dei coloranti e di evitare le imprecisioni dovute alla soggettività manuale della ricostituzione. La qualità della colorazione H&E con i coloranti pronti all’uso
individuati dovrà essere comparabile con quella dei coloranti ricostituiti e il rapporto costi/vantaggi dovrà essere mantenuto.
Materiali e metodi: Inizialmente sono stati individuati sul mercato differenti coloranti nucleari, citoplasmatici e differenziatori pronti all’uso pertinenti con la colorazione sotto esame e sono state effettuate settanta diverse possibili
combinazioni per sequenze e tempi di incubazione con l’obiettivo di individuare dei risultati soddisfacenti. I tessuti campione utilizzati per queste prove sono stati scelti tra i preparati della routine giornaliera indipendentemente dalla
patologia che presentavano; si differenziavano per la loro struttura, dimensione e tipo di processo di disidratazione. Le colorazioni sono state valutate dai medici patologi secondo dei criteri chiaramente stabiliti; in un primo tempo
sono state selezionate le cinque combinazioni che presentavano alla valutazione i risultati più interessanti, mentre in un secondo tempo è stata individuata combinazione di coloranti e di tempi di incubazione ideali che ha portato al risultato ritenuto il migliore in assoluto.
La fase finale ha permesso, procedendo in modo automatico (Tissue Stainer TST 44, Medite) secondo la nuova metodica di colorazione H&E individuata, di colorare tutte le sezioni della routine di un’intera giornata in modo da confrontare
una vasta serie di tessuti che presentavano differenti proprietà. La valutazione di questo cambiamento e dei suoi effetti sulle sezioni ha portato alla conclusione che la qualità della colorazione delle sezioni per l’esame microscopico
permetteva efficacemente la diagnosi da parte del medico patologo.
Risultati: La valutazione positiva da parte dei medici
patologi di più combinazioni della colorazione H&E con coloranti pronti all’uso sui tessuti campione, ha confermato la riuscita della ricerca; la qualità delle colorazioni è comparabile con quella tuttora ottenuta con coloranti
ricostituiti e i costi risultano ragionevoli. Tuttavia al momento dell’introduzione nella routine automatizzata della colorazione sono stati evidenziati alcuni tipi di problematiche per particolari tessuti che richiederanno
un’ulteriore aggiustamento della metodica mirato a migliorare queste imperfezioni.
Conclusione: la colorazione H&E con coloranti pronti all’uso individuata durante questa ricerca, rappresenta una valida alternativa alla colorazione attualmente utilizzata all’ICP. Tuttavia, prima della sua introduzione nella routine
giornaliera, saranno necessari alcuni aggiustamenti mirati a risolvere i problemi relativi all’applicazione automatica del differenziatore.
ABSTRACTIntroduction: Hematoxylin-eosin (H&E) is the staining technique most commonly used in histology for microscopic
analysis and is applicable to every tissue specimen. Consequently the quality of the H&E stain is an important determinant factor in establishing accurate diagnoses. The aim of my diploma work was to identify ready-prepared
H&E stains which could substitute the reconstituted stains currently used at the Institute of Pathology. Subsequent standardization of H&E with the introduction of ready-prepared stains would shorten the time required by
biomedical scientists for stain preparation and avoid imprecision caused by manual subjectivity. The quality of H&E staining with the identified ready-prepared stains had to be comparable with that of reconstituted stains and the
cost/benefits ratio had to be maintained.
Materials and Methods: Firstly, ready-prepared nuclear, plasma and differentiator stains were identified on the market and seventy different possible combinations were effected, by sequence and incubation time, with the aim of
identifying those which gave satisfactory results. The tissue samples used for this work were selected from the daily routine samples, independently of pathology, and were distinguished by different structure, dimensions and
processing programming. The results of staining were evaluated by the participating pathologists on the basis of clearly-established criteria; first the five combinations which had been judged to have produced the most satisfactory
results were selected, while subsequently the combination of stains and incubation times was identified which had lead to the result considered to be the best overall. During the final phase, automatic staining of all the routine staining for an entire day was carried out with the newly-
identified H&E using Tissue Stainer TST 44 apparatus programmed to the new method. This was in order to compare results over a wide range of routine tissues with different properties. In this way it was possible to evaluate
this modification and the effect it had on tissue sections, and to conclude that the quality of staining was such as to allow pathologists to make accurate diagnoses.�
Results: The positive evaluation on the part of pathologists
of the results of more then one combination of ready-prepared nuclear and plasma stains on tissue samples confirmed the success of the research. The quality of these stains was judged to be comparable with that of the
reconstituted stains which have been used until now. However when the newly –identified staining was introduced into the automated routine, certain problems were noted in particular types of tissues, indicating that
there is a need for some adjustment aimed at correcting the imperfections identified.
Conclusion: H&E staining with ready-prepared stains
identified in this study represents a viable alternative to currently applied H&E which uses stains in the form of powder. However, before introduction of the newly-identified H&E into routine, further study is necessary, in
order to resolve problems connected with the automatic application of differentiating solution.
4
INTRODUZIONE
Un aspetto molto importante della patologia clinica risiede nella standardizzazione delle procedure svolte in laboratorio. La standardizzazione assicura la validità dei metodi utilizzati, l’affidabilità e la riproducibilità dei risultati. Questo lavoro nell’ambito istopatologico, tratta del processo di standardizzazione della colorazione fondamentale Ematossilina-Eritosina (H&E) all’Istituto cantonale di Patologia di Locarno (ICP). La colorazione H&E rappresenta la tecnica di colorazione più frequentemente utilizzata in istologia. Essendo una colorazione topografica, permette di osservare a livello generale i differenti costituenti tessutali. Viene utilizzata nella routine istologica come una colorazione generale. Durante la prima fase, i nuclei sono colorati con una soluzione di ematossilina e sviluppano una colorazione blu che può variare dal violetto scuro al nero. La seconda fase è data dalla controcolorazione con eosina oppure eritrosina: il citoplasma con i suoi costituenti, il collagene, la cheratina e gli eritrociti si colorano di rosso. Per l’esecuzione di una corretta diagnosi è indispensabile avere i preparati ben osservabili sia nel nucleo che nel citoplasma. La qualità della colorazione dipende dalla serie di trattamenti che il tessuto subisce prima di poter essere colorato (fattori preanalitici) e dal processo della colorazione stessa. Attualmente all’ICP sono utilizzati dei coloranti ricostituiti da polveri e/o soluzioni liquide. Le soluzioni di ematossilina ed eritrosina sono ricostituite miscelando diversi componenti secondo le ricette del produttore. L’ematossilina non è di per sé un colorante: per colorare deve essere ossidata tramite un processo di maturazione che dura alcune settimane. La fase di preparazione risulta abbastanza lunga e può essere soggetta a imprecisioni dovute alla soggettività manuale, alla non corretta interpretazione delle ricette, alla tecnica di pesatura o alla vetreria utilizzata. Una volta pronta, la soluzione viene filtrata prima dell’uso. La buona qualità della colorazione può dipendere da casuali combinazioni di fattori positivi o dalla buona esecuzione da parte dell’operatore. L’uso dei prodotti certificati garantisce maggiormente la qualità dovuta non al caso, bensì all’esistenza di un insieme di regole che permettono il raggiungimento in ogni momento di tale risultato. Allo scopo di accorciare i tempi di preparazione e ridurre la possibilità di errori causati da fattori soggettivi, è stata decisa l’introduzione dei coloranti pronti all’uso. L’obiettivo di questo lavoro è quello di individuare fra i numerosi coloranti pronti all’uso disponibili sul mercato, quelli che potrebbero prestarsi per la sostituzione dei coloranti attualmente in uso, garantendo la riproducibilità e mantenendo un costo proporzionale ai vantaggi. La colorazione H&E dovrà mantenere la stessa qualità di quella attuale, che permette ai patologi di valutare correttamente i tessuti e che soddisfa da anni i criteri di valutazione imposti dalle associazioni di controllo esterne.
Dato che ogni laboratorio effettua la scelta delle colorazioni basandosi sulle proprie esperienze e abitudini (la colorazione H&E può presentare delle lieve differenze di tonalità che soggettivamente possono essere preferite), non è stato fatto il paragone con esperimenti simili di altri laboratori istopatologici. In questo lavoro sono indicati i coloranti testati nella ricerca, sono descritte le varie procedure che subiscono i campioni tessutali prima di poter essere colorati ed è spiegato il processo della colorazione stessa. Inoltre sono esplicitati i criteri sui quali ci si è fatto riferimento per valutare i risultati ottenuti. Sono mostrate le foto delle colorazioni ottenute nella ricerca, accompagnate dai commenti. Nella fase finale sono discussi i risultati e sono riportate le conclusioni.
5
MATERIALI E METODI
COLORANTI E DIFFERENZIATORI I coloranti e i differenziatori pronti all’uso sono stati forniti dalle ditte Microm (Volketswil, CH)e Medite (Nunningen, CH). Nella ricerca sono stati provati seguenti i prodotti:
Coloranti nucleari: ematossilinaL’ematossilina è un comune colorante nucleare, che viene isolato da un estratto di legno azzurro (Haemotoxylon campechianum) (1, 2)Ematossilina colora in eccesso i nuclei ed i substrati basofili, cioè a carica negativa, producendo la colorazione blu. Allo stato puro non ha proprietà coloranti, ma viene facilmente ossidata ad emateina tramite maturazione; ciò può avvenire tramite un processo naturale di esposizione all’aria ed alla luce per un periodo di 1-2 mesi, oppure con l’aggiunta di agenti ossidanti. L’emateina è anionica e non ha particolari affinità con gli acidi nucleici dei nuclei cellulari. Per conferire al composto una carica positiva è necessario aggiungere un mordente che andrà a costituire, con l’emateina, una lacca relativamente insolubile (legame del mordente al colorante ed al tessuto). Le sostanze mordenzanti generalmente usate sono acidi o sali metallici, oppure sostanze ossidanti (1, 2, 7, 10). Nel corso del lavoro sono state testate le seguenti ematossiline che si differenziano per la diversa concentrazione e il tipo di mordente:
Ematossilina Gill 2 (Microm, lotto: 64895) Ematossilina Gill 3 (Microm, lotto: 64245) Ematossilina di Harris (Microm, lotto: 59922)Ematossilina 1 (Microm, lotto: 71159)
DifferenziatoriI differenziatori sono delle soluzioni tampone e vengono usati allo scopo di togliere l’eccesso di ematossilina e rinforzare la tinta blu. Si tratta di modificare la carica dei componenti tessutali; con l’aumento dell’acidità delle strutture tessutali (quindi la diminuzione del pH), cresce l’affinità per il colorante basico. Le variazioni del pH sono assicurate dagli acidi, se vogliamo ottenere una diminuzione di pH e quindi favorire il legame del tessuto con il colorante rinforzando così il colore, rispettivamente dalle basi per aumentare il pH accrescendo la tendenza del colorante a lasciare il tessuto, diminuendo così l’intensità della colorazione (2). I differenziatori pronti all’uso utilizzati nel corso del lavoro sono i seguenti:
Bluing reagent (Microm, lotto: 63449) Differentiating solution (Microm, lotto: 55422)
Gli innumerevoli vantaggi dell’acqua secondo Scott (6), differenziatore ricostituito tuttora utilizzato all’ICP, hanno inoltre portato alla decisione di includerlo nella lista unitamente a quelli pronti all’uso appena elencati. Questo differenziatore è ricostituito miscelando in uguali proporzioni la soluzione di carbonato di sodio 0.2% con la soluzione di solfato di magnesio 2%. Essendo un tampone, diminuisce il pH dei componenti tessutali favorendo così il legame con il colorante basico. Esso è inoltre utilizzato all’Istituto da tanti anni e possiede numerosi vantaggi: facilità di preparazione, alta/conosciuta stabilità e costi bassissimi. Sulla scorta di esperienze precedentemente testate, interne al nostro laboratorio, abbiamo deciso di includere nello studio anche un altro tipo di differenziatore a base di alcol acidificato; tale differenziatore si è dimostrato negli anni molto valido per i risultati eccellenti e a basso costo che
6
ha prodotto. Il differenziatore a base di alcol acidificato è ricostituito miscelando 10 ml di acido cloridrico 25% in 1000 ml di alcool etilico 95%.
Coloranti citoplasmatici: Eritrosina/EosinaL’eritrosina e l’eosina sono i coloranti citoplasmatici più comunemente usati in istologia. Le loro proprietà acide permettono l’interazione con le proteine cellulari ricche di aminoacidi basici; il risultato è una colorazione citoplasmatica di colore rosso (2). I coloranti utilizzati durante la ricerca sono stati:
Eosina-Y saturata (Microm, lotto: 64341) Eosina-Y (Microm, lotto: 62761) Eosina acquosa 2 % (Medite, lotto: 84-0023-00) Eritrosina B acquosa 1 % (Medite, lotto: 6P7739)
MATERIALE BIOLOGICO Il materiale biologico umano (tessuti campione) utilizzato nel corso della ricerca è stato scelto dai preparati della routine senza tenere conto della patologia che presentava; i criteri di selezione sono stati la dimensione, i tipi di tessuto che lo componevano e i tipi di processo di disidratazione che aveva subito. Inizialmente, per motivi pratici, sono stati selezionati solo quattro tipi di tessuti che potevano rappresentare la maggior parte delle tipologie normalmente presenti tra i preparati giornalieri; i campioni che soddisfacevano queste esigenze corrispondevano a un campione di utero, uno di intestino tenue, uno di cute e una biopsia gastrica. Secondariamente sono stati utilizzati altri tipi di tessuto per simulare ulteriormente la varietà delle situazioni che si presentano nella realtà quotidiana. La selezione dei primi quattro tessuti campione è avvenuta direttamente in macroscopia con la collaborazione del medico patologo, mentre i tessuti utilizzati in un secondo tempo sono stati scelti dall’archivio dei blocchi di alcuni giorni precedenti con l’aiuto dei dati clinici forniti dal programma di gestione dei pazienti dell’ICP. La provenienza dei preparati è stata ristretta alle sale operatorie degli ospedali e delle cliniche, nonché agli studi medici del territorio del cantone Ticino.
FISSAZIONE Il materiale biologico, dopo il prelievo dal paziente, va incontro ai processi degenerativi chiamati autolisi; la rottura delle membrane lisosomiali dopo la morte, dovuta al mancato apporto di ossigeno e sostanze nutritive, determina il rilascio di enzimi autolitici, che in pratica digeriscono la cellula provocandone la distruzione. Per inattivare questi enzimi conservando così l’integrità morfologica del tessuto bisogna intervenire con il processo di fissazione. I fissatori, soluzioni che bloccano il processo di autolisi, agiscono sui tessuti modificando le catene molecolari così da ottenere una struttura stabile e rigida irreversibile. I preparati che giungono all’ICP dalle differenti strutture sanitarie sono fissati con la formalina tamponata al 4%, che è uno dei fissativi più utilizzati in istologia per le sue proprietà di alta penetrazione, basso costo e compatibilità con tutte le analisi nell’ambito di una diagnosi istologica. La fissazione avviene immergendo il preparato nel liquido fissatore, a temperatura ambiente; il fissativo deve avere un volume superiore di circa 20-30 volte rispetto al preparato e la durata ottimale è di 24-48 ore a dipendenza della dimensione; dopo il campionamento delle parti che saranno utilizzate per la diagnosi, i tessuti sezionati sono ulteriormente fissati a 60°C con lo stesso tipo di fissativo (2, 3, 4, 5, 6).
7
PROCESSAZIONE I campioni tessutali fissati sono sciacquati dalla formalina e disidratati attraverso una scala di alcol etilici (in seguito alcol) a concentrazione progressivamente crescente. Questo percorso è chiamato in istologia “processazione” e serve a raggiungere alcuni scopi come la disidratazione totale del tessuto, che diviene più duro e si presta meglio al taglio, nonché una maggiore affinità con il mezzo includente (paraffina) (6, 13). Inoltre il tessuto incluso in paraffina, se privato completamente dell’acqua, si mantiene in ottimo stato anche per decenni. All’ICP di Locarno, dove sono stati processati i tessuti campione della ricerca, la processazione è eseguita dall’apparecchio TPC 15 Tissue Processing Center della Medite (figura1). L’apparecchio è completamente automatico e contiene 15 bagni di 2,5 litri ognuno. I contenuti dei bagni, i tempi di incubazione, le sequenze e le temperature sono gestiti da un programma informatico che è manipolato dall’operatore a seconda delle proprie esigenze. Le capsule contenenti il materiale da processare sono contenute in un cestino di metallo che è spostato da un braccio meccanico; durante le incubazioni l’apparecchio crea un vacuum così da favorire la penetrazione dei liquidi all’interno dei tessuti. La scala di alcol consiste progressivamente nel 70%, 80%, 95% e 100%, in modo da permettere ai tessuti una disidratazione graduale e dolce che non danneggi la morfologia. Alla completa disidratazione seguono dei bagni di chiarificazione tramite xilolo, che è una soluzione che assorbe l’alcool ed è compatibile con la paraffina (contrariamente all’alcol). Nel periodo di permanenza nello xilolo, i tessuti assumano un aspetto traslucido; questa fase aiuta a migliorare l’indice di rifrazione favorendo così la visione al microscopio. Come ultima fase, i tessuti passano nella paraffina liquida a 60° (impregnazione) che penetra completamente all’interno del tessuto sostituendo in modo permanente tutti gli spazi che prima erano occupati dallo xilolo (2, 6, 13).
Figura 1. Processatore TCP 15 (Medite) (11).
I tempi di processazione variano a seconda della dimensione e del tipo di struttura dei tessuti istologici. La dimensione dei tessuti e la durata della processazione sono direttamente proporzionali; inoltre tessuti di tipo adiposo o ghiandolare richiedono processazioni più lunghe rispetto ad altri tipi di tessuto. Le tabelle 1, 2, 3 mostrano le tre differenti programmazioni di processazione che si utilizzano all’ICP a dipendenza del tipo di materiale.
8
Tabella 1. Programma della processazione delle biopsie piccole (programma “strati”, durata 47 min.): biopsie gastriche, biopsie del cuore, biopsie polmonari, biopsie epatiche bagno tempo temperatura
1. alcol 70 % 30 secondi 40 °C
2. alcol 80 % 4 minuti 40 °C
3. alcol 96 % 5 minuti 40 °C
4. alcol 100 % 6 minuti 40 °C
5. alcol 100 % 6 minuti 40 °C
6. xilolo 6 minuti 40 °C
7. xilolo 6 minuti 40 °C
8. paraffina 6 minuti 59 °C
9. paraffina 7 minuti 59 °C
Tabella 2. Programma della processazione delle biopsie medie ( programma “pelli”, durata 4h 22min): biopsie della cute, biopsie della prostata filiformi, biopsie dell’arteria temporale, biopsie ginecologiche. bagno tempo temperatura
1. alcol 70 % 10 minuti 40 °C
2. alcol 80 % 10 minuti 40 °C
3. alcol 95 % 10 minuti 40 °C
4. alcol 95 % 10 minuti 40 °C
5. alcol 100 % 10 minuti 40 °C
6. alcol 100 % 15 minuti 40 °C
7. alcol 100 % 30 minuti 40 °C
8. xilolo 30 minuti 40 °C
9. xilolo 30 minuti 40 °C
10. paraffina 15 minuti 59 °C
11. paraffina 30 minuti 59 °C
12. paraffina 30 minuti 59 °C
Tabella 3. Programma della processazione delle biopsie grandi (programma “grandi”, durata 11 h 36 min.): tutto il resto del materiale istologico.
bagno tempo temperatura
1. alcol 70 % 30 minuti 40 °C
2. alcol 80 % 45 minuti 40 °C
3. alcol 95 % 30 minuti 40 °C
4. alcol 95 % 45 minuti 40 °C
5. alcol 100 % 45 minuti 40 °C
6. alcol 100 % 60 minuti 40 °C
7. alcol 100 % 60 minuti 40 °C
8. xilolo 45 minuti 40 °C
9. xilolo 60 minuti 40 °C
10. xilolo 60 minuti 59 °C
11. paraffina 45 minuti 59 °C
12. paraffina 60 minuti 59 °C
13. paraffina 60 minuti 59 °C
INCLUSIONE IN PARAFFINA Dopo la processazione, il tessuto è incluso in paraffina dapprima liquida e poi indurita; in questa fase è importante orientare la biopsia secondo la superficie di taglio che si intende ottenere. La paraffina divenuta solida fungerà da supporto per il tessuto nella fase di taglio, conferendo all’intero blocco (paraffina/parti costituenti del tessuto) una consistenza adeguatamente
9
omogenea (6, 13). L’inclusione dei tessuti è eseguita tramite il sistema di inclusione TES 99, Medite ( figura 2).
Figura 2. Il sistema d’inclusione TES 99 (Medite) utilizzato nel nostro laboratorio. È composto di una termostazione che mantiene la temperatura della paraffina nei limiti prescritti, da una stazione di lavoro predisposta per le pinze riscaldate e da un’unità raffreddante per i tessuti già inclusi nelle capsule (11).
A B C
D E F
G H I
Figura 3. Il processo d’inclusione dei tessuti nella paraffina tramite un sistema di inclusione TES 99 (Medite): A) le capsule con i campioni processati vengono posizionate nel termostato; B) la capsula è spostata sulla piastra di lavoro e viene aperta; C) il campione tessutale viene trasferito e orientato all’interno della capsula d’inclusione; D) la capsula d’inclusione viene riempita con la paraffina fusa; E) e F) il coperchio contenente il numero del paziente viene staccato e posizionato sopra; G) e H) la capsula viene trasferita sull’unità raffreddante; I) una volta raffreddati e induriti i blocchi di paraffina contenenti il tessuto vengono tolti dalla capsula d’inclusione. Le immagini sono state realizzate da Natalja Zutter.
10
TAGLIO AL MICROTOMO Il successivo passo verso l’allestimento di un preparato istologico è il taglio dei preparati con speciali apparecchiature, i microtomi, che consentono di ottenere sottilissime sezioni dello spessore di 2-3 µm. All’ICP vengono utilizzati i microtomi a slitta, HM 440E, Microm (figura 4).
Figura 4. Microtomo a slitta HM 440E, Microm. L’immagine è stata realizzata da Natalja Zutter
Il microtomo è formato da un supporto al quale è fissato il blocco contenente il tessuto e da una slitta alla quale è fissata la lama. Il movimento del supporto è assicurato da una manopola micrometrica regolata manualmente o manovrata automaticamente (12). Lo spessore del taglio influisce notevolmente sulla qualità della colorazione. Le sezioni spesse contengono più strati di cellule e rendono la stessa colorazione più intensa rispetto a quelle più fini: per la nostra ricerca è molto importante la valutazione obiettiva della colorazione e quindi si è cercato di riprodurre tagli il più simili possibile. Tutte le sezioni utilizzate nella ricerca hanno uno spessore di 2 µm, che corrisponde a uno strato di cellule, e permettono il confronto tra le differenti colorazioni ottenute. La figura 5 mostra i passaggi dell’esecuzione del taglio del tessuto incluso nella paraffina.
11
A B C
D E F
G Figura 5. L’esecuzione del taglio del tessuto tramite microtomo incluso in paraffina: A) il blocco contenente il tessuto viene fissato sul supporto; B) il blocco è tagliato da una lama fissata sulla slitta; C) la sezione ottenuta viene levata dalla lama con l’aiuto di un pennello; D) le sezioni sono messe nel bagnomaria con acqua a una temperatura di 40°-45°C. Questa procedura favorisce la distensione delle eventuali pieghe che renderebbero difficile la lettura al microscopio. E) e F) il taglio viene adagiato su un vetrino con l’aiuto di un pennello; G) il vetrino è posizionato nell’apposito cestello portavetrini. Le immagini sono state realizzate da Natalja Zutter.
Il cestello portavetrini è messo nella stufa a 60°C per trenta minuti per permettere in una prima fase la completa distensione delle sezioni, oltre a favorire l’adesione al vetrino; successivamente la paraffina tornata alla forma liquida viene eliminata (altrimenti la sezione non sarebbe predisposta alla colorazione).
COLORAZIONE Lo scopo della colorazione istologica è di facilitare l’osservazione dei preparati introducendo dei contrasti tra le diverse strutture. La capacità dei coloranti di legarsi a una o più sostanze è determinata dal fatto che essi posseggono dei gruppi molecolari del colore (gruppi cromofori) e altri gruppi, definiti auxofori, che si legano al substrato da colorare. I coloranti si classificano in acidi e basici, non per loro concentrazione degli ioni di idrogeno, bensì per le proprietà anioniche o cationiche della parte significativa del colorante, cioè, in genere, l’auxocromo (1, 2, 7). Durante le differenti colorazioni bisogna tenere conto dei fattori che influiscono sull’azione dei coloranti:
12
� pH: influenza le cariche degli elementi tessutali e delle molecole del colorante stesso determinando così la forza del legame (2).
� Temperatura: determina la velocità di diffusione delle molecole del colorante; l’aumento della temperatura, e quindi di energia, amplifica la forza di penetrazione delle molecole del colorante nel tessuto (2).
� Concentrazione: più un colorante è concentrato, più aumenta la possibilità di formare dei legami tra esso e gli elementi tessutali (2).
� Struttura e permeabilità del tessuto (2).
Le colorazioni sono dette progressive quando si lascia agire il colorante sulla sezione fino al momento in cui l’azione selettiva del o dei coloranti in questione permette di ben distinguere i costituenti cercati. Questa colorazione è seguita da un lavaggio destinato a togliere l’eccesso di colorante. Nelle colorazioni dette regressive si colorano tutti gli elementi che hanno affinità con il colorante per poi decolorare il taglio finché restano colorate sole le strutture che hanno una forte affinità. Le colorazioni si chiamano semplici quando si usa un solo tipo di colorante. Due o più coloranti possono essere usati contemporaneamente in miscele ben bilanciate (colorazione simultanea) oppure impiegati successivamente (6, 7).
La ricerca ha sottoposto a scrupoloso esame la colorazione ematossilina-eosina (Hematoxylin-Eosin o H&E ) utilizzata nella routine istologica all’ICP di Locarno per tutti i tipi di tessuti come una colorazione generale, nell’ottica di un cambiamento della stessa che soddisfi criteri di scelta oramai evoluti rispetto a quelli presi in considerazione nel passato. La Tabella 4 descrive i reagenti, le sequenze ed i tempi d’incubazione dei differenti passaggi di questa colorazione nella forma utilizzata attualmente; è inoltre riportata la frequenza dei cambi dei reagenti secondo le attuali regole vigenti.
Tabella 4. I tempi di programmazione utilizzati attualmente nella colorazione H&E e le frequenze dei cambi dei reagenti. La durata della colorazione è 34 minuti e 53 secondi.
bagno Tempo cambio
1. xilolo 1 minuto giornaliero
2. alcol 100 % 1 minuto settimanale
3. alcol 95 % 1 minuto settimanale
4. alcol 75 % 1 minuto settimanale
5. acqua corrente 1 minuto 6. ematossilina 6 minuti settimanale
7. acqua corrente 1 minuto
8. acqua di Scott 1 minuto giornaliero
9. acqua corrente 1 minuto
10. eritrosina 10 minuti settimanale
11. acqua corrente 1 minuto
12. alcol 70% 30 secondi giornaliero
13. alcol 95 % 45 secondi giornaliero
14. alcol 100 % 2 minuti giornaliero
15. xilolo 30 minuto giornaliero
La colorazione è effettuata in modo automatico utilizzando il Tissue Stainer TST 44 della Medite, rappresentato nella figura 6. Questo apparecchio è completamente automatico e permette il completamento della sparaffinatura, l’idratazione, la colorazione e la disidratazione delle sezioni in previsione di una montatura definitiva con colla non acquosa (risultato stabile per decenni). È composto di 45 vaschette, ognuna delle quali contiene 400 ml di soluzione (coloranti, xiloli per la sparaffinatura ottimale e per le otto postazioni di partenza/arrivo, scale di alcol per l’idratazione/disidratazione, acqua direttamente collegata con il rubinetto dell’acqua
13
corrente per le sei stazioni di lavaggio/risciacquo). Il contenuto dei bagni e la loro disposizione sono a scelta dell’operatore attraverso un programma informatico che gestisce le differenti funzioni dell’apparecchio; lo stesso permette la scelta della sequenza e dei tempi d’incubazione nelle differenti soluzioni in funzione del tipo di colorazione che si vuole ottenere. I vetrini con le sezioni da colorare sono inseriti in cestini di metallo che possono contenere al massimo trenta vetrini; i cestini sono spostati da una vaschetta all’altra tramite un braccio di metallo meccanico che segue le indicazioni riguardanti tempi e sequenza dei bagni introdotte nel software. A dipendenza del tipo di colorazione, quindi dell’utilizzo o meno di bagni in comune e della durata dei tempi di incubazione, il programma informatico ci permette di introdurre contemporaneamente fino a dodici cestini (360 vetrini).
Figura 6. Tissue Stainer TST 44 utilizzato all’ ICP per le colorazione automatiche (11)
L’apparecchio può tuttavia commettere degli errori nella durata dei tempi di incubazione rispetto ai tempi stabiliti (fino a due minuti) in quanto, lavorando con molti cestini contemporaneamente, penalizza qualche incubazione per coordinare più colorazioni simultaneamente (8).
Figura 7. Esecuzione contemporanea di tre colorazioni diverse tramite Tissue Stainer TST 44, Medite. L’immagine è stata realizzata da Natalja Zutter.
La strategia per la selezione delle diverse varianti di H&E provate durante la ricerca ha comunque imposto, per motivi economici, di effettuare le differenti colorazioni dapprima manualmente, in quanto era possibile ridurre il quantitativo di coloranti e di alcool (per standardizzare le prove gli alcol sono stati cambiati per ogni colorazione di prova) da 400 ml a 100 ml. Inoltre, dal punto di vista pratico non era possibile modificare le programmazioni delle colorazioni durante il funzionamento dell’apparecchio; poiché questo era in funzione la maggior parte della giornata, tale procedura avrebbe comportato un significativo rallentamento del numero di prove effettuabili giornalmente. Dopo la selezione delle cinque varianti migliori di H&E, si è passati all’automatizzazione delle colorazioni per misurare gli effetti dei limiti dell’apparecchio durante le differenti fasi (alcune
14
soluzioni modificano completamente il loro effetto se i tempi di incubazione non sono più che precisi, altre sono molto più stabili). A questo scopo sono stati scelti casualmente 30 campioni di tessuto, ognuno dei quali tagliato in 6 copie identiche per ogni variante di H&E (totale 6 vetrini per ogni campione di tessuto). Ogni variante ha così potuto essere testata con una quantità di 6 cestini in simultanea, che corrisponde alla quantità max. media giornaliera per apparecchio all’ICP, in modo da simulare una situazione di routine giornaliera. La valutazione delle variazioni dovute all’automatizzazione è così stata facilitata dal fatto che i tessuti erano sempre gli stessi. Le variazioni di intensità delle colorazioni all’interno della stessa variante tra il primo cestino e il sesto, hanno dato un importante segnale della stabilità dei differenziatori o degli alcol della scala di disidratazione, che in alcuni casi diminuiscono la loro azione con l’aumentare del numero dei vetrini (differente effetto sul primo cestino rispetto al sesto!). Si ottengono così le informazioni sulla frequenza dei cambi di alcune soluzioni sull’arco della giornata.
Dopo la scelta della migliore delle cinque varianti di H&E, tenendo conto degli effetti dell’automatizzazione si è passati a colorare tutti i casi della routine reale di un’intera giornata con questa nuova variante identificata, per evidenziare eventuali problematiche.
VALUTAZIONE DELLA COLORAZIONE Le valutazioni dei risultati delle colorazioni sia manuali che automatizzate sono state effettuate dal Prof. Dr. med. Luca Mazzucchelli e da suoi collaboratori (medici patologi) che lavorano all’ICP seguendo la scheda di valutazione concepita appositamente per questa ricerca. Gli esperti hanno ricevuto le sezioni colorate senza accompagnamento di informazioni concernenti le modalità o di segnalazioni sui tipi di coloranti utilizzati, per rendere il più possibile oggettive le valutazioni. I criteri di valutazione sono stati selezionati con l’aiuto del Prof. Dr. med. Luca Mazzucchelli e prendendo esempio da alcune schede di valutazione utilizzate da organizzazioni per i controlli di qualità che si occupano di colorazioni istologiche alle quali abbiamo fatto riferimento:
eosinofilia- la capacità delle strutture basiche, colorate con coloranti acidi, di assumere la tonalità rosastra che può variare dal rosa al rosa-arancione (2). Questa tonalità troppo pallida o troppo forte può essere un fattore di disturbo nell’esecuzione delle diagnosi.
basofilia- la capacità delle strutture acide, colorate con coloranti basici, di assumere la tonalità bluastra che può variare dal blu di varia tonalità al nero (2). Questa tonalità troppo pallida o troppo scura (soprattutto dei nuclei) può disturbare notevolmente l’esecuzione delle diagnosi.
contrasto- la distinzione netta tra i singoli componenti tessutali. Per eseguire la diagnosi il patologo deve poter osservare con chiarezza ogni singola struttura (2).
artefatti- non sono naturali; sono causati da problemi legati alle tecniche istologiche. Possono essere di natura diversa a dipendenza delle loro cause: disomogeneità della colorazione (più intensa ai margini o al centro), assenza/presenza esagerata dell’affinità per un tipo di colorante, sporcizie varie, colorazione di fondo, precipitati di colorante (2), ritrazioni del tessuto, spazi “vuoti” del tessuto. Gli artefatti possono disturbare l’esecuzione delle diagnosi fino a renderle addirittura impossibili.
Valutazione globale- è un criterio molto soggettivo e dipende dall’abitudine dell’esperto di osservare la microscopia con un certo tipo di risultato. Il risultato della valutazione della stessa colorazione può differire molto da un esperto all’altro.
15
La valutazione è esprimibile in valori numerici che corrispondono a un valore espresso in parole sulla qualità della colorazione; i valori numerici permettono di ottenere un punteggio che facilita la selezione delle colorazioni ritenute migliori per la maggior parte dei criteri di valutazione. La tabella 5 qui di seguito mostra la scheda di valutazione usata nella ricerca.
Tabella 5. Scheda di valutazione della colorazione H&E usata nella ricerca
CRITERI DI VALUTAZIONE ottimo buono discreto sufficiente insufficiente
5 pti 4 pti 3 pti 2 pti 1 pto
1. Basofilia
2. Eosinofilia
3. Contrasto
4. Artefatti
5. Valutazione globale
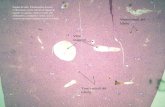
La figura che segue mostra un’immagine della colorazione H&E dove sono ben evidenziate le strutture tessutali valutate durante la ricerca secondo la scheda di valutazione.
Figura 8. Colorazione H&E eseguita sul tessuto polmonare. Le frecce indicano le strutture che sono state valutate secondo la scheda di valutazione: A) strutture eosinofile; B) strutture basofile; C) contrasto: nucleo ben distinguibile dal citoplasma ; D) artefatto: precipitato di colorante (14)
La colorazione rappresentata nella figura 9 possiede tutte le caratteristiche che permettono l’esecuzione ottimale della diagnosi; risulta limpida ed omogenea e i nuclei sono di una tonalità blu né troppo scura né troppo chiara, dove è visibile la cromatina trasparente che lascia intravedere i nucleoli. I citoplasmi sono ben contrastati rispetto ai nuclei e sono distinguibili gli organelli presenti. I substrati eosinofili si colorano di rosso e hanno la tonalità lucida. Tutte le
D
B
A
C
16
singole strutture tessutali sono ben distinguibili. Questa immagine rappresenta l’attuale H&E utilizzata all’ICP per la routine.
Figura 9. L’immagine, eseguita dal Dr. Mazzucchelli, mostra la colorazione H&E attualmente applicata all’ICP.
ANALISI DEI COSTI La logica ci aveva preparato a un rialzo dei costi relativo all’acquisto dei coloranti pronti all’uso certificati rispetto alle polveri per ricostituirli. Tuttavia bisogna tener conto del risparmio economico dovuto al minor impiego di risorse umane che normalmente sono investite nella ricostituzione manuale dei coloranti. Inoltre i coloranti ricostituiti devono essere filtrati prima dell’uso, e questa fase che richiede alcune ore. Per il confronto delle spese limitato al costo dei coloranti pronti all’uso rispetto a quelli correnti, si è calcolato un volume di 400 ml di riferimento, pari al contenuto di un bagno dell’apparecchio Tissue Stainer TST 44. Le figure 10, 11 e 12 che seguono, mostrano i prezzi dei coloranti nucleari, citoplasmatici e dei differenziatori presi in considerazione durante la ricerca e di quelli attualmente utilizzati; le bande rosse rappresentano i prodotti pronti.
PREZZI DEI COLORANTI NUCLEARI
17.7917.54
13.4711.7510.94
8.46
0
5
10
15
20
25
Em
ato
ssili
na
di M
ayer
Em
ato
ssili
na
Gill
2
Em
ato
ssili
na
in p
olv
ere
Em
ato
ssili
na
Gill
3
Em
ato
ssili
na
1
Em
ato
ssili
na
di H
arr
is
CHF
Figura 10. Il grafico rappresenta i prezzi dei coloranti nucleari.
L’ematossilina attualmente utilizzata risulta addirittura più cara rispetto ad altre due pronte all’uso: l’ematossilina di Mayer e l’ematossilina di Gill 2. Altri coloranti pronti all’uso hanno invece prezzi più elevati.
17
PREZZI DEI COLORANTI CITOPLASMATICI
2.30
12.4714.80
21.5623.60
0
5
10
15
20
25
30
Erito
sin
a
in
polv
ere
Eosin
a-Y
Eosin
a
acquosa
2 %
Eosin
a -
Y
satu
rata
Erito
sin
a
B 1
%
acquosa
CHF
�
Figura 11. Il grafico rappresenta i prezzi dei coloranti citoplasmatici.
I prezzi di tutti i coloranti citoplasmatici pronti all’uso sono molto più elevati rispetto al prezzo del colorante in polvere utilizzato attualmente
PREZZI DEI DIFFERENZIATORI
0.351.43
2.21
10.37
0
2
4
6
8
10
12
14
Acqua d
i
Scott
Alc
ol
acid
ific
ato
Blu
ing
reagent
Diffe
rentiating
solu
tion
CHF
�
Figura 12. Il grafico rappresenta i prezzi dei differenziatori.
Dalla figura 12 si nota che i differenziatori pronti hanno prezzi più elevati. Differentiating solution risulta addirittura trenta volte più caro rispetto all’acqua di Scott applicata attualmente. Poiché la soluzione differenziatrice viene cambiata ogni giorno, l’introduzione di Differentiating solution aumenterebbe la spesa in modo molto significativo.
Riassumendo, i prezzi dei prodotti pronti, ad eccezione di alcuni tipi di ematossilina, sono effettivamente più elevati rispetto a quelli dei prodotti impiegati attualmente.
18
RISULTATI
I principali risultati ottenuti sono riportati qui di seguito e possono essere suddivisi in due categorie: 1) risultati riferiti alle colorazione manuali con utilizzo di tutti i coloranti e differenziatori combinati diversamente. 2) risultati riferiti alle colorazioni manuali migliori, riprodotte con procedure automatiche.
Tra i settanta tentativi di colorazione eseguiti manualmente sono stati ottenuti risultati molto dissimili. Esula dal nostro lavoro presentare i risultati di ciascun tentativo; ci limitiamo a presentare quelli riferiti ai nove più significativi, denominati come TEST con il numero corrispondente, illustrandoli e commentandoli. Le tabelle 6-14 mostrano i protocolli seguiti per le colorazioni manuali. Nei protocolli sono evidenziati i coloranti e i differenziatori utilizzati. Le foto della colorazione di cute e intestino rappresentano i risultati ottenuti e sono poste subito sotto il proprio protocollo accompagnate dai commenti. Tutte le immagini mostrate in questo capitolo sono state realizzate dall’autore con l’aiuto di Prof. Dr. med. Luca Mazzucchelli.
19
RISULTATI DELLE COLORAZIONI MANUALI
TEST 1
Tabella 6: Protocollo della colorazione manuale H&E del TEST 1.postazione tempi
1. xilolo 1 minuto
2. alcol 100% 1 minuto
3. alcol 95% 1 minuto
4. alcol 70 % 1 minuto
5. acqua corrente 1 minuto
6. ematossilina Gill 2 6 minuti
7. acqua corrente 5 minuti
8. acqua di Scott 1 minuto
9. acqua corrente 1 minuto
10. eritrosina B 1 % 10 minuti
11. acqua corrente 1 minuto
12. alcol 70 % 30 secondi
13. alcol 95 % 45 secondi
14. alcol 100 % 2 minuti
15. xilolo 30 secondi
Figura 13 La foto mostra i risultati della colorazione H&E della cute (destra) e dell’intestino (sinistra) eseguita manualmente seguendo il protocollo della colorazione del TEST 1. Sono stati utilizzati il colorante nucleare Ematossilina Gill 2 (Microm), il colorante citoplasmatico Eritrosina B 1 % (Medite) e il differenziatore acqua di Scott.
Commenti ai risultatiI nuclei risultano troppo scuri e conseguentemente non è possibile valutare la struttura della cromatina. La diffusione di ematossilina nei citoplasmi e nel tessuto connettivo causa la presenza di una tonalità blu di fondo molto forte; ciò rende indistinguibili i nuclei dai citoplasmi e i singoli componenti tissutali. La colorazione eseguita secondo il protocollo del TEST 1 non può essere introdotta nella routine istologica poiché non appare adeguata all’effettuazione di una corretta diagnosi.
20
TEST 2
Tabella 7. Protocollo della colorazione manuale H&E del TEST 2.Postazione tempi
1. xilolo 1 minuto
2. alcol 100% 1 minuto
3. alcol 95% 1 minuto
4. alcol 70 % 1 minuto
5. acqua corrente 1 minuto
6. ematossilina Gill 3 6 minuti
7. acqua corrente 5 minuti
8. bluing reagent 1 minuto
9. acqua corrente 1 minuto
10. eritrosina B 1 % 10 minuti
11. acqua corrente 1 minuto
12. alcol 70 % 30 secondi
13. alcol 95 % 45 secondi
14. alcol 100 % 2 minuti
15. xilolo 30 secondi
Figura 14. La foto mostra i risultati della colorazione H&E della cute (destra) e dell’intestino (sinistra) eseguita manualmente seguendo il protocollo della colorazione del TEST 2. Sono stati utilizzati il colorante nucleare Ematossilina Gill 3 (Microm), il colorante citoplasmatico Eritrosina B 1 % (Medite), il differenziatore Bluing Reagent.
Commenti ai risultatiLa tonalità scura dei nuclei e la disomogeneità della cromatina rendono impossibile la loro osservazione. La diffusione considerevole dell‘ematossilina nei citoplasmi e nel tessuto connettivo causa una forte tonalità bluastra, rendendo indistinguibili i nuclei dai citoplasmi. Le singole strutture del tessuto connettivo sono difficilmente distinguibili. Inoltre è presente una tonalità bluastra di fondo causata, in tutti i vetrini dove è stato utilizzato il differenziatore Bluing Reagent, dall’affinità dell’ematossilina per il trattamento dei vetrini utilizzati (SuperFrost Plus, Medite). È stato deciso di non utilizzare Bluing Reagent nelle ulteriori prove della ricerca. La colorazione non può essere introdotta nella routine poiché compromette l’esecuzione della corretta diagnosi.
21
TEST 21
Tabella 8. Protocollo della colorazione manuale H&E del TEST 21
postazione tempi
1. xilolo 1 minuto
2. alcol 100% 1 minuto
3. alcol 95% 1 minuto
4. alcol 70 % 1 minuto
5. acqua corrente 1 minuto
6. ematossilina Gill 2 6 minuti
7. acqua corrente 5 minuti
8. differentiating solution 1 minuto
9. acqua corrente 1 minuto
10. eritrosina B 1 % 10 minuti
11. acqua corrente 1 minuto
12. alcol 70 % 30 secondi
13. alcol 95 % 45 secondi
14. alcol 100 % 2 minuti
15. xilolo 30 secondi
Figura 15. La foto mostra i risultati della colorazione H&E della cute (destra) e dell’intestino (sinistra) eseguita manualmente seguendo il protocollo della colorazione del TEST 21. Sono stati utilizzati il colorante nucleare Ematossilina Gill 2 (Microm), il colorante citoplasmatico Eritrosina B 1 % (Medite), Differentiating Solution (Microm).
Commenti ai risultatiSi osserva la mancanza di tonalità blu dei substrati basofili. La deviazione della tonalità dei nuclei verso rosa non ha influenzato la trasparenza della cromatina. Il tessuto connettivo appare delicatamente rosa. Presente il contrasto tra i singoli componenti tissutali. La colorazione dei citoplasmi e del muco delle ghiandole intestinale risulta troppo rosa rispetto a quello che si vorrebbe. Si è deciso di eliminare questa colorazione dalla ricerca a causa della scarsa qualità e dei costi elevati.
22
TEST 40
Tabella 9. Protocollo della colorazione manuale H&E del TEST 40.Postazione tempi
1. xilolo 1 minuto
2. alcol 100% 1 minuto
3. alcol 95% 1 minuto
4. alcol 70 % 1 minuto
5. acqua corrente 1 minuto
6. ematossilina Gill 2 6 minuti
7. acqua corrente 5 minuti
8. differentiating solution 1 minuto
9. acqua corrente 1 minuto
10. eosina acquosa 2 % 10 minuti
11. acqua corrente 1 minuto
12. alcol 70 % 30 secondi
13. alcol 95 % 45 secondi
14. alcol 100 % 2 minuti
15. xilolo 30 secondi
Figura 16. La foto mostra i risultati della colorazione H&E della cute (destra) e dell’intestino (sinistra) eseguita manualmente seguendo il protocollo della colorazione del TEST 40. Sono stati utilizzati il colorante nucleare Ematossilina Gill 2 (Microm), il colorante citoplasmatico Eosina acquosa 2 % (Medite), Differentiating Solution (Microm).
Commenti ai risultatiIn generale si osserva assenza del contrasto. I nuclei risultano troppo pallidi rendendo la valutazione della cromatina difficile. La colorazione dei citoplasmi e del tessuto connettivo è troppo debole; la loro tonalità bluastra può causare difficoltà nell’osservazione e nell’interpretazione. Il muco delle ghiandole intestinali non è distinguibile dal resto della cellula.I difetti sopradescritti non permettono l’esecuzione di una corretta diagnosi. Si è notato che le colorazioni dove è stato utilizzato il colorante citoplasmatico Eosina acquosa 2 % in combinazione con altri coloranti da testare non hanno fornito risultati soddisfacenti per mancanza della tonalità rosa dei substrati eosinofili. Si è deciso di non continuare i test con Eosina acquosa 2 %.
23
TEST 45
Tabella 14. Protocollo della colorazione manuale H&E del TEST 45.postazione tempi
1. xilolo 1 minuto
2. alcol 100% 1 minuto
3. alcol 95% 1 minuto
4. alcol 70 % 1 minuto
5. acqua corrente 1 minuto
6. ematossilina 1 6 minuti
7. acqua corrente 5 minuti
8. alcol 95% acidificato 10 secondi
9. acqua corrente 1 minuto
10. eosina -Y 10 minuti
11. acqua corrente 1 minuto
12. alcol 70 % 30 secondi
13. alcol 95 % 45 secondi
14. alcol 100 % 2 minuti
15. xilolo 30 secondi
Figura 17. La foto mostra i risultati della colorazione H&E della cute (destra) e dell’intestino (sinistra) eseguita manualmente seguendo il protocollo della colorazione del TEST 45. Sono stati utilizzati il colorante nucleare Ematossilina 1 (Microm), il colorante citoplasmatico Eosina-Y (Microm), alcol 95% acidificato.
Commenti ai risultatiColorazione omogenea. I nuclei sono ben evidenziati. Ottima trasparenza della cromatina. Le membrane nucleari sono ben definite. Buona distensione tra le singole strutture tessutali. Ottima tonalità dei substrati eosinofili. La colorazione del muco delle ghiandole intestinali è leggermente tendente al blu. La colorazione permette l’esecuzione di una corretta diagnosi ed è stato deciso di testarla automaticamente.
24
TEST 47
Tabella 10. Protocollo della colorazione manuale H&E del TEST 47.postazione tempi
1. xilolo 1 minuto
2. alcol 100% 1 minuto
3. alcol 95% 1 minuto
4. alcol 70 % 1 minuto
5. acqua corrente 1 minuto
6. ematossilina di Mayer 6 minuti
7. acqua corrente 5 minuti
8. differentiating Solution 1 minuto
9. acqua corrente 1 minuto
10. eritrosina B 1 % 10 minuti
11. acqua corrente 1 minuto
12. alcol 70 % 30 secondi
13. alcol 95 % 45 secondi
14. alcol 100 % 2 minuti
15. xilolo 30 secondi
Figura 18. La foto mostra i risultati della colorazione H&E della cute (destra) e dell’intestino (sinistra) eseguita manualmente seguendo il protocollo della colorazione del TEST 47. Sono stati utilizzati il colorante nucleare Ematossilina di Mayer (Medite), il colorante citoplasmatico Eritrosina B 1 % (Medite), Differentiating Solution (Microm).
Commenti ai risultatiSi osserva la mancanza della tonalità blu dei substrati basofili. I nuclei risultano di tonalità tendente al rosa. La cromatina rimane abbastanza trasparente e lascia intravedere i nucleoli. La colorazione dei citoplasmi è soddisfacente. Il muco delle ghiandole intestinali è distinguibile dal resto della cellula anche se possiede una tonalità piuttosto rosastra. I criteri minimi per definire una buona colorazione sono tuttavia soddisfatti nella sufficienza. Dopo queste osservazioni si è deciso di eliminare questa variante della colorazione in quanto la qualità non raggiunge i livelli della colorazione attualmente utilizzata e, addizionatamene, il costo del differenziatore Differentiating solution è molto elevato.
25
TEST 63
Tabella 11. Protocollo della colorazione manuale H&E del TEST 63.Postazione tempi
1. xilolo 1 minuto
2. alcol 100% 1 minuto
3. alcol 95% 1 minuto
4. alcol 70 % 1 minuto
5. acqua corrente 1 minuto
6. ematossilina Gill 2 6 minuti
7. acqua corrente 5 minuti
8. alcol 95% acidificato 10 secondi
9. acqua corrente 1 minuto
10. eosina acquosa 2 % 10 minuti
11. acqua corrente 1 minuto
12. alcol 70 % 30 secondi
13. alcol 95 % 45 secondi
14. alcol 100 % 2 minuti
15. xilolo 30 secondi
Figura 19. La foto mostra i risultati della colorazione H&E della cute (destra) e dell’intestino (sinistra) eseguita manualmente seguendo il protocollo della colorazione del TEST 63. Sono stati utilizzati il colorante nucleare Ematossilina Gill 2 (Microm), il colorante citoplasmatico Eosina acquosa 2 %B (Medite), alcol 95% acidificato.
Commenti ai risultatiI substrati basofili risultano fortemente blu. La colorazione dei nuclei è troppo scura. La presenza di disomogeneità della cromatina non permette di valutarne la struttura. La colorazione dei citoplasmi e del tessuto connettivo è troppo debole e tendente al bluastro. Le singole strutture tessutali sono difficilmente distinguibili. La colorazione non può essere introdotta nella routine istologica per la presenza di molteplici fattori che disturbano l’esecuzione della diagnosi
26
TEST 65
Tabella 12. Protocollo della colorazione manuale H&E del TEST 65.
Figura 20. La foto mostra i risultati della colorazione H&E della cute (destra) e dell’intestino (sinistra) eseguita manualmente seguendo il protocollo della colorazione del TEST 65. Sono stati utilizzati il colorante nucleare Ematossilina di Mayer (Medite), il colorante citoplasmatico Eosina-Y (Microm), alcol 95% acidificato.
Commenti ai risultatiI nuclei appaiono troppo scuri e ciò condiziona l’osservazione della cromatina. La colorazione dei substrati eosinofili è abbastanza soddisfacente. Il contrasto tra le singole strutture tessutali è abbastanza buono. La colorazione del tessuto connettivo non è sempre omogenea. Per l’esecuzione di una corretta diagnosi è indispensabile ottenere una colorazione omogenea del nucleo e un’ottima trasparenza della cromatina in modo tale che questa possa essere valutata. Tale colorazione non corrisponde a queste esigenze e non può essere introdotta nella routine istologica.
postazione tempi
1. xilolo 1 minuto
2. alcol 100% 1 minuto
3. alcol 95% 1 minuto
4. alcol 70 % 1 minuto
5. acqua corrente 1 minuto
6. ematossilina di Mayer 6 minuti
7. acqua corrente 5 minuti
8. alcol 95% acidificato 10 secondi
9. acqua corrente 1 minuto
10. eosina -Y 10 minuti
11. acqua corrente 1 minuto
12. alcol 70 % 30 secondi
13. alcol 95 % 45 secondi
14. alcol 100 % 2 minuti
15. xilolo 30 secondi
27
TEST 67
Tabella 13. Protocollo della colorazione manuale H&E del TEST 67postazione tempi
1. xilolo 1 minuto
2. alcol 100% 1 minuto
3. alcol 95% 1 minuto
4. alcol 70 % 1 minuto
5. acqua corrente 1 minuto
6. ematossilina Gill 2 6 minuti
7. acqua corrente 5 minuti
8. alcol 95% acidificato 10 secondi
9. acqua corrente 1 minuto
10. eosina -Y 10 minuti
11. acqua corrente 1 minuti
12. alcol 70 % 30 secondi
13. alcol 95 % 45 secondi
14. alcol 100 % 2 minuti
15. xilolo 30 secondi
Figura 21. La foto mostra i risultati della colorazione H&E della cute (destra) e dell’intestino (sinistra) eseguita manualmente seguendo il protocollo della colorazione del TEST 67. Sono stati utilizzati il colorante nucleare Ematossilina Gill 2 (Microm), il colorante citoplasmatico Eosina-Y (Microm), alcol 95% acidificato.
Commenti ai risultatiLa colorazione dei nuclei è omogenea. La cromatina è trasparente e lascia intravedere i nucleoli. La colorazione dei citoplasmi e delle altre strutture eosinofile è soddisfacente. Ottimo contrasto tra le singole strutture tessutali. La colorazione del tessuto connettivo non è sempre omogenea ed in alcuni punti tende al bluastro. In generale la colorazione non compromette l’esecuzione della diagnosi, pertanto è stato deciso di testarla automaticamente.
28
RISULTATI DELLE COLORAZIONI AUTOMATICHE Qui di seguito vengono presentati i risultati di cinque colorazioni che sono state testate automaticamente. Si noti che tutte le colorazioni scelte presentono un identico colorante citoplasmatico. Le colorazioni sono denominate TEST con il numero corrispondente. Le tabelle 14-18 mostrano i protocolli della programmazione del Tissue Stainer TST 44 relativi alle colorazioni; in particolare vengono evidenziati i coloranti e i differenziatori utilizzati. I risultati ottenuti derivano dalla colorazione di intestino e tuba uterina e vengono presentati ciascuno immediatamente di seguito al rispettivo protocollo di effettuazione. Le colorazioni automatiche sono state valutate secondo singoli criteri; i giudizi finali vengono rappresentati nelle figure 27 e 28 alla fine del capitolo.
TEST 12
Tabella 14. Protocollo della colorazione automatica H&E del TEST 12postazione Tempi
1. xilolo 1 minuto
2. alcol 100% 1 minuto
3. alcol 95% 1 minuto
4. alcol 70 % 1 minuto
5. acqua corrente 1 minuto
6. ematossilina 1 6 minuti
7. acqua corrente 5 minuti
8. acqua di Scott 1 minuto
9. acqua corrente 1 minuto
10. eosina -Y 10 minuti
11. acqua corrente 1 minuto
12. alcol 70 % 30 secondi
13. alcol 95 % 45 secondi
14. alcol 100 % 2 minuti
15. xilolo 30 secondi
Figura 22. La foto mostra i risultati della colorazione automatica H&E dell’intestino (destra) e della tuba uterina (sinistra) eseguita seguendo il protocollo della colorazione del TEST 12. Sono stati utilizzati il colorante nucleare Ematossilina 1 (Microm), il colorante citoplasmatico Eosina-Y (Microm), acqua di Scott
29
TEST 34
Tabella 15. Protocollo della colorazione automatica H&E del TEST 34.Postazione tempi
1. xilolo 1 minuto
2. alcol 100% 1 minuto
3. alcol 95% 1 minuto
4. alcol 70 % 1 minuto
5. acqua corrente 1 minuto
6. ematossilina Gill 2 6 minuti
7. acqua corrente 5 minuti
8. acqua di Scott 1 minuto
9. acqua corrente 1 minuto
10. eosina -Y 10 minuti
11. acqua corrente 1 minuto
12. alcol 70 % 30 secondi
13. alcol 95 % 45 secondi
14. alcol 100 % 2 minuti
15. xilolo 30 secondi
Figura 23. La foto mostra i risultati della colorazione automatica H&E dell’intestino (destra) e della tuba uterina (sinistra) eseguita seguendo il protocollo della colorazione del TEST 34. Sono stati utilizzati il colorante nucleare Ematossilina Gill 2 (Microm), il colorante citoplasmatico Eosina-Y (Microm), acqua di Scott.
30
TEST 45
Tabella 16. Protocollo della colorazione automatica H&E del TEST 45.Postazione tempi
1. xilolo 1 minuto
2. alcol 100% 1 minuto
3. alcol 95% 1 minuto
4. alcol 70 % 1 minuto
5. acqua corrente 1 minuto
6. ematossilina 1 6 minuti
7. acqua corrente 5 minuti
8. alcol 95 % acidificato 10 secondi
9. acqua corrente 1 minuto
10. eosina -Y 10 minuti
11. acqua corrente 1 minuto
12. alcol 70 % 30 secondi
13. alcol 95 % 45 secondi
14. alcol 100 % 2 minuti
15. xilolo 30 secondi
Figura 24. La foto mostra i risultati della colorazione automatica H&E dell’intestino (destra) e della tuba uterina (sinistra) eseguita seguendo il protocollo della colorazione del TEST 45. Sono stati utilizzati il colorante nucleare Ematossilina 1 (Microm), il colorante citoplasmatico Eosina-Y (Microm), alcol 95% acidificato.
31
TEST 55
Tabella 17. Protocollo della colorazione automatica H&E del TEST 55.Postazione tempi
1. xilolo 1 minuto
2. alcol 100% 1 minuto
3. alcol 95% 1 minuto
4. alcol 70 % 1 minuto
5. acqua corrente 1 minuto
6. ematossilina Gill 3 6 minuti
7. acqua corrente 5 minuti
8. alcol 95% acidificato 10 secondi
9. acqua corrente 1 minuto
10. eosina -Y 10 minuti
11. acqua corrente 1 minuto
12. alcol 70 % 30 secondi
13. alcol 95 % 45 secondi
14. alcol 100 % 2 minuti
15. xilolo 30 secondi
Figura 25. La foto mostra i risultati della colorazione automatica H&E dell’intestino (destra) e della tuba uterina (sinistra) eseguita seguendo il protocollo della colorazione del TEST 55. Sono stati utilizzati il colorante nucleare Ematossilina Gill 3 (Microm), il colorante citoplasmatico Eosina-Y (Microm), alcol 95% acidificato.
32
TEST 67
Tabella 18. Protocollo della colorazione automatica H&E del TEST 67Postazione tempi
1. xilolo 1 minuto
2. alcol 100% 1 minuto
3. alcol 95% 1 minuto
4. alcol 70 % 1 minuto
5. acqua corrente 1 minuto
6. ematossilina Gill 2 6 minuti
7. acqua corrente 5 minuti
8. alcol 95 % acidificato 10 secondi
9. acqua corrente 1 minuto
10. eosina -Y 10 minuti
11. acqua corrente 1 minuto
12. alcol 70 % 30 secondi
13. alcol 95 % 45 secondi
14. alcol 100 % 2 minuti
15. xilolo 30 secondi
Figura 26. La foto mostra i risultati della colorazione automatica H&E dell’intestino (destra) e della tuba uterina (sinistra) eseguita seguendo il protocollo della colorazione del TEST 67. Sono stati utilizzati il colorante nucleare Ematossilina Gill 2 (Microm), il colorante citoplasmatico Eosina-Y (Microm), alcol 95 % acidificato.
33
Risultati della valutazione secondo ogni criterio stabilito
VALUTAZIONE DI H&E
0
1
2
3
4
5
basofilia eosinofilia contrasto artefatti valutazione
globale
punteggio
TEST 12
TEST 34
TEST 45
TEST 55
TEST 67
Figura 27. Il grafico rappresenta la valutazione secondo ogni criterio dei TEST eseguiti automaticamente.
La basofilia di tutti i TEST è stata valutata tra discreto e buono. Il TEST 55 mostra la migliore eosinofilia, definita tra buono e ottimo. Il TEST 34 e il TEST 67 mostrano il miglior contrasto, apprezzato tra buono e ottimo. Il TEST 45 possiede i minori artefatti. La valutazione globale è stata migliore per il TEST 45 e il TEST 67 che hanno ottenuto pari punteggio.
Sommando i punti ottenuti per ogni criterio è stato calcolato il punteggio totale relativo a ciascuna colorazione; tale punteggio viene presentato nella figura sottostante.
34
Risultati della valutazione : punteggio totale (totale dei criteri della valutazione)
VALUTAZIONE DI H&E
16.417.5
19.9 19.6 19.6
0
5
10
15
20
25
punteggio
MEDIA 16.4 17.5 19.9 19.6 19.6
TEST 12 TEST 34 TEST 45 TEST 55 TEST 67
Figura 28. Il grafico rappresenta il punteggio totale dei criteri della valutazione.
Dalla figura 28 si osserva che la variante della colorazione 45 (TEST 45) ha ottenuto il miglior punteggio totale con la media di 19.9 superando la variante 67 (TEST 67) e la variante 55 (TEST 55) soltanto di 0,3 punti.
35
DISCUSSIONE
L’obiettivo di questo lavoro consisteva nell’individuare, tra i numerosi coloranti pronti disponibili sul mercato, quelli che mantengono una buona qualità e riproducibilità per tutti i campioni tessutali. Poiché la colorazione H&E viene eseguita di base per tutti i campioni tessutali, ne consegue che la sua qualità è estremamente importante e non deve compromettere l’effettuazione della diagnosi. L’introduzione dei coloranti pronti individuati nella ricerca comporta almeno due vantaggi :
1) permette ai tecnici di laboratorio di evitare la fase di preparazione dei coloranti, e quindi consente di guadagnare tempo. 2) contribuisce al processo di standardizzazione tramite l’impiego di coloranti certificati che mantengano una qualità costante indipendentemente dall’intervento umano.
Il lavoro realizzato ha fornito una panoramica generale sui prodotti pronti disponibili sul mercato; in particolare ha permesso di conoscere alcuni coloranti e differenziatori, definendone vantaggi e svantaggi nelle varie combinazione adottate.
Il giudizio positivo da parte dei patologi dell’ICP ha confermato l’individuazione di coloranti nucleari e citoplasmatici che permettessero di valutare nel modo migliore i tessuti.
È da sottolineare il problema incontrato nel lavoro, nato dalla difficoltà di riprodurre automaticamente la qualità di colorazioni manuali eseguite secondo specifici protocolli. Questi ultimi infatti prevedono tempi precisi nelle diverse fasi di colorazione, i quali, com’è intuibile, possono essere rispettati agevolmente nella colorazione manuale. Nella colorazione automatica invece si pone la difficoltà di far rispettare questi tempi, data dal fatto che l’apparecchiatura, effettuando diverse colorazioni contemporaneamente, può commettere un errore nella durata di un passaggio. Tale differenza temporale può arrivare a due minuti: se ciò non rappresenta generalmente un problema per i passaggi a tempi lunghi in cui la reazione avviene lentamente, può invece inficiare il risultato finale nei passaggi piuttosto brevi in cui la reazione avviene velocemente. Nel caso del passaggio nel differenziatore, abbiamo rincontrato tale problematica in quanto la durata è solitamente di 10 secondi. Dal processo di differenziazione dipende l’intensità della colorazione. Dopo il trattamento prolungato alcuni tipi di tessuti non hanno fornito risultati molto soddisfacenti. Introducendo la colorazione secondo il protocollo del TEST 45 per un giorno nella routine si è visto che soprattutto i tessuti ghiandolari come stomaco e intestino hanno presentato una tonalità blu troppo intensa.
Infine osserviamo che l’introduzione di una nuova colorazione implica la necessità da parte dei patologi di prendere confidenza con le nuove caratteristiche cromatiche dei tessuti, e ciò richiede del tempo. Per questo motivo è stato importante coinvolgere tutti i patologi dell’ICP nella formulazione di un giudizio sulle colorazioni eseguite nella ricerca.
36
CONCLUSIONI
È possibile affermare che esistono più combinazioni di coloranti pronti all’uso che permettono l’esecuzione di una corretta diagnosi mantenendo una buona qualità e a costi moderati.
Dopo questa ricerca possiamo affermare con sicurezza che nei processi di cambiamento delle metodiche di colorazione è bene valutare separatamente i risultati ottenuti con l’esecuzione manuale da quelli ricavati a posteriori con l’esecuzione automatica, in quanto non sempre sono concordanti. La scelta dei tessuti campione che sono utilizzati nei processi di cambiamento delle metodiche delle colorazioni dovrebbe avvenire in collaborazione con un medico patologo. Nella fase finale delle valutazioni, infatti, alcuni patologi hanno sottolineato la precarietà dei tipi di tessuti selezionati per evidenziare particolari problematiche (la selezione è stata fatta solo sulla base della diversità dei tessuti e del differente processo di disidratazione).
Il processo di cambiamento di una metodica di colorazione deve prevedere lunghi tempi per includere differenti situazioni preanalitiche che si presentano irregolarmente, ma che dovranno ugualmente essere compatibili; dal momento dell’introduzione nella routine di questi cambiamenti bisogna prevedere una fase di aggiustamento che dipende da questo tipo di situazioni.
L’archiviazione del lavoro di ricerca effettuato consentirà, nel futuro, di usufruire delle informazioni inerenti all’introduzione della colorazione H&E con i coloranti pronti all’uso. Questo permetterà, nell’ottica di altri cambiamenti, di risparmiare tempo, evitando di ripetere le stesse operazioni di selezione e valutazione, con un conseguente risparmio economico.
Le risorse impiegate nella scelta dei criteri di valutazione utilizzati per giudicare le varianti della colorazione H&E hanno permesso di identificare un linguaggio comune oggettivo per tutti i patologi che hanno partecipato alle valutazioni.
37
RINGRAZIAMENTI
Prima di tutto desidero rivolgere i miei ringraziamenti all’Istituto Cantonale di Patologia per avermi dato la opportunità di effettuare il mio periodo di stage pratico e la possibilità di realizzare il mio lavoro di diploma. I miei ringraziamenti vanno in particolare al direttore dell’ICP, Prof. Dr. med. Luca Mazzucchelli, per la sua disponibilità, il suo sostegno e i suoi preziosi consigli durante il svolgimento del mio lavoro. Ringrazio tutti i patologi dell’istituto che hanno partecipato alla realizzazione del mio lavoro di diploma: Stefano Crippa, Davide Soldini, Tiziana Rusca, Eliana Passega-Sidler, Ulrike Perriard, Sandra Leoni e Gabriele Bernasconi. I miei sentili ringraziamenti vanno inoltre alla capolaboratorio, Lara Lunghi-Etienne, per avermi seguita durante tutto questo periodo, per il suo insegnamento e aiuto. Ringrazio tutto il personale del laboratorio, Danela Tavian, Silvia Giudici, Ursula Terribilini, Michela Pelloni, Tripun Stjanov, Stephan Zemp, Paolo Mazzatorta, Daniele Cavalli, per loro disponibilità e comprensione. Inoltre ringrazio il direttore della SSMT di Locarno Andrea Boffini e il docente di chimica clinica Giovanni Togni per il supporto metodologico durante tutto il periodo scolastico. Ringrazio le mie docenti Daniela Marcacci e Sonja Marci per la loro disponibilità e il loro sostegno anche oltre il periodo dello svolgimento del lavoro di diploma. Per finire, voglio ringraziare la mia famiglia per l’aiuto e la comprensione durante tutto il periodo scolastico.
38
BIBLIOGRAFIA
1. Lilie, R. D. Conn’s biological stains. Williams and Wilkens Co, 468-472, 1977
2. Carson, F. L. Histotechnology: a self-instructional text. Dallas: Department of Pathology Baylor University, II edition, 87-109, 1996
3. Bancorft, J. D., Cook, H. C. Manual of histological techniques and their diagnostic application. New York: Churchill Livingstone, 17-39, 1994
4. Bucher, O. Trattato di istologia e citologia. Padova: editore Piccin, 3-7, 1977
5. Prophet, E. B., Mills, B., Arrington, J. B., Sobin, L. H. Laboratory methods in histotechnology. Washington: American registry of pathology. 25-58, 1994
6. Mazzi, V. Manuale di tecniche istologiche e istochimiche. Padova: editore Piccin, 18-91, 1977
7. Marcacci, D. Dispense del corso blocco d’istologia pratica. Scuola superiore medica tecnica, Locarno, Dispense, 2005
8. Medite Medizintechnik. Tissue stainer TST 44. Burgdorf, Bedienungsanleitung, 2002
9. Medite Medizintechnik. Tissue processing center TPC 15. Burgdorf, Bedienungsanleitung, 1999
10. <http://www.sigmaaldrich.com/sigma/general%20information/insert_it_hhs.pdf>. Consultato il 14. 04. 2007
11. <http://www.medite.ch/html/farbemittel__eindeckmittel__fi.html>. Consultato il 14. 04. 2007
12. <http://www.microm.de/microm%20homepage/microm_deutsch/html/haematoxylin_1_.html>. Consultato il 14. 04 2007
13. <http://w3.uniroma1.it/anat3b/didatticanew/Tecniche>.
Consultato il 10. 04. 2007
14. <http://www.afip.org/vetpath/WSC/wsc98/98l/8w073a40.jpg>. Consultato il 15. 04. 2007