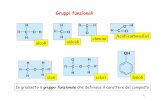
ACIDI CARBOSSILICI
description
Transcript of ACIDI CARBOSSILICI

1
ACIDI CARBOSSILICI
COH
O
Gli acidi contengono il gruppo carbossile:
La nomenclatura degli acidi carbossilici prevede la sostituzione della -o finale del corrispondente alcano con il suffisso –oico.
– CO
OH═H metanoico o
acido formico
– CO
OH═CH3
etanoico o acido acetico
– CO
OH═CH3 – CH2
propanoico o acido propionico
Gli acidi carbossilici a catena lunga sono noti come “Acidi grassi”

2
In genere questi composti sono acidi in soluzione acquosa:
+ H+
Gli acidi carbossilici sono ancora più acidi perché la base coniugata è un ibrido di risonanza tra due strutture limite equivalenti e perciò con uguale energia:
LA RISONANZA NEGLI ACIDI CARBOSSILICI
Come mai gli acidi carbossilici tendono a cedere più facilmente un protone H+ rispetto, per es., agli alcoli?La risposta sta nella forte stabilzzazione del suo anione dovuta alla risonanza:

3
Consideriamo un acido carbossilico generico:
– CO
OH═R
Possiamo scrivere delle strutture di risonanza:
– CO
O – H ═R – C
O
OH═R
E’ sempre lo stesso ac. carbossilico, ma è avvenuto che l’atomo di H è passato da un atomo di O all’altro. Queste due strutture hanno una costante di interconvertibilità altissima, è preferibile pertanto scrivere:
R – C HOO
R – C═O
O – H
─

4
L’acidità di un acido carbossilico è di media forza, circa 10 volte > rispetto a quella dell’H2O:
– CO
OH═R + H2O
10-5
– CO
O─
═R + H3O+
A pH fisiologico, cioè neutro (intorno a 6) l’acido carbossilico si troverà sotto forma di sale, in quanto si comporta da acido. Se il pH è < 5-6 l’acido carbossilico si troverà nella forma indissociata.
Nel caso dell’anione carbossilato analogamente la carica negativa può saltare da un atomo di O all’altro, per cui scriveremo:
R – C ─OO E’ come se l’atomo di C e quello di O
fossero uniti da un legame e mezzo:

5
La formula tipica di un acido carbossilico è: CH3 – (CH2)n - COOH
Molto importanti sono gli acidi carbossilici a numero pari di atomi di C, da 12 in su (acidi grassi):
CH3 – (CH2)10 – COOH Acido laurico o dodecanoico
CH3 – (CH2)12 – COOH Acido miristico o tetradecanoico
CH3 – (CH2)14 – COOH Acido palmitico o esadecanoico
CH3 – (CH2)16 – COOH Acido stearico o octadecanoico
CH3 – (CH2)18 – COOH Acido arachico o ecasanoico
Questi acidi sono contenuti in tutti i tipi di olio, in vari rapporti. Gli acidi grassi a numero dispari di atomi di C non sono naturali.Gli acidi grassi sono detti “SATURI” quando presentano solo legami semplici, sono detti “INSATURI” quando nella molecola sono presenti 1 o più doppi legami.

6
L’acido grasso insaturo più importante è l’acido oleico con 18 atomi di C:
CH3 – (CH2)7 – C10H = C9H – (CH2)7 – COOH
Il doppio legame si trova tra il C9 ed il C10. La catena di atomi di C si conta partendo dal gruppo COOH.
Poichè vi è un doppio legame, vi sarà isomeria geometrica. In natura tutti gli acidi grassi sono presenti in forma “cis”. Nel caso dell’acido oleico, il suo isomero trans è l’acido elaidinico.
CH3 – (CH2)4 – C13H = C12H – CH2 – C10H = C9H – (CH2)7 – COOH
L’acido grasso a 18 atomi di C che contiene 2 doppi legami (diene) entrambi cis, è l’acido linoleico, particolarmente abbondante nell’olio di lino:
Nell’olio di lino è presente anche un acido grasso a 18 atomi di C che contiene 3 doppi legami (triene) tutti cis, l’acido linolenico: :
CH3 – (CH2)4 – C13H = C12H – CH2 – C10H = C9H – CH2 – C7H = C6H – (CH2)4 – COOH
NOTA: i doppi legami sono intervallati da atomi di C ibridizzati sp3

7
NOMENCLATURA DEGLI ACIDI GRASSI
Z isomero cis E isomero trans
Acido oleico: 9 octa - decenoico cis(Z,9) 9 octa-decenoico
Acido elaidinico: 9 octa - decenoico trans(E,9) 9 octa-decenoico
Acido linoleico: 9,12 octa - decadienoico cis(Z,9; Z,12) 9,12 octa-diecadienoico
Acido linolenico: 6,9,12 octa - decatrienoico cis(Z,6; Z,9; Z,12) 6,9,12 octa-decatrienoico
Man mano che aumenta il n° dei doppi legami, la molecola dell’acido carbossilico tende a ripiegarsi su se stessa, importante caratteristica che troviamo, ad es., nei lipidi di membrana e che facilita il passaggio dei metaboliti attraverso la membrana stessa.

8
CARATTERISTICHE FISICHE DEGLI ACIDI GRASSI
Lo stato fisico degli acidi grassi è in relazione al n° di atomi di C che sono presenti nella catena: fino a circa 8 atomi sono allo stato liquido.
Inoltre, gli acidi grassi hanno un elevato punto di ebollizione per la presenza di legami idrogeno:
– CO
OH═ R
– CO
OH═ R C –O
OH═ R
Il legame idrogeno si forma tra l’O-H di una molecola ed il C=O dell’altra, in modo reciproco
Legame H

9
Gli acidi carbossilici fino ad un certo n° di atomi di C sono solubili in H2O. Infatti, in un acido grasso abbiamo due effetti opposti: COOH effetto idrofilo Catena carboniosa effetto idrofobo
L’uno o l’altro effetto prevalgono a seconda della lunghezza della catena :
Fino a 10-12 atomi di C: solubili Tra 12 e 20 atomi di C: equilibrio dei due effetti, formazione di micelle Oltre i 20 atomi di C: insolubili

10
REAZIONI DEGLI AC. CARBOSSILICI CON LE BASI
– CO
O-H═R – C
O
O─
═RNa+
+ H2O+ NaOH
L’NaOH è una base molto forte, per cui strappa il protone, e si forma il corrispondente sale (carbossilato di Na)
Una reazione analoga si ha trattando l’ac. carbossilico con NH3:
– CO
O-H═R – C
O
O─
═RNH4
++ NH3
Tutti in nucleofili che sono anche basi con gli ac. carbossilici si comportano da basi.

11
REAZIONI DEGLI AC. CARBOSSILICI CON NUCLEOFILO: SOSTITUZIONE NUCLEOFILA
– CO
OH═R + N ─
Per un nucleofilo che attacca un acido carbossilico l’attacco sul C è più lento e difficile rispetto all’attacco sul protone. In teoria abbiamo due possibilità:
1) + N ─ – CO
O – H ═R + H – N – C
O
O═R ─
V1 >>
2) + N ─ – CO
O – H ═R R – C – OH
O ─
N
V2 >
Con i nucleofili si verifica sempre la reazione 1) ossia l’acido carbossilico si comporta quasi sempre da acido, per cui la reazione è di tipo acido-base

12
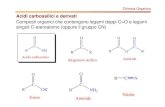
DERIVATI FUNZIONALI DEGLI AC. CARBOSSILICI
Sotto il nome di “derivati funzionali degli ac. Carbossilici” sono racchiuse diverse famiglie di composti. Tutte sono caratterizzate dalla presenza del gruppo acilico:
– CO
═R
– CO
═RCl
cloruro acilico
– CO
═RO
– CR ═
O
anidride
– CO
═RNH2
ammide
– CO
═RO – R’
estere
gruppo acilico o acile:è il nome generico del gruppo funzionale corrispondente ad un acido carbossilico privo del suo gruppo OH.

13
REAZIONI DEGLI AC. CARBOSSILICI CON ALCOL:
ESTERIFICAZIONE
L’unica reazione possibile tra un acido carbossilico ed un alcol è quella acido-base:
– CO
O – H ═R + R’ – O – H ─ – C
O
O═R + R’ – O – H
H
anione carbossilato alcol protonato
L’equilibrio di questa reazione è notevolmente spostato a sinistra, poiché l’alcol protonato è un acido ben più forte dell’acido carbossilico.
Se nella reazione aggiungiamo anche solo una goccia di un acido forte, ad es., H2SO4, avremo invece una reazione molto spedita, detta “Esterificazione”.

14
La stechiometria totale della reazione è:
– CO
O – H ═R + R’ – O – H
H+ R – C
R’ – O
═O
+ H2O
Se lo scopo della reazione è ottenere solo estere si sottrae acqua.
ESTERE
Esempio:
– CO
OH═CH3
acido acetico(acido etanoico)
+ CH3 – CH2 – OH
etanolo
H+
– CO
O – CH2 – CH3 ═CH3 + H2O
estere etilico dell’acido acetico oacetato di etile
Nomenclatura IUPAC: estere dell’etanolo con acido etanoico
Gli esteri sono derivati dagli acidi carbossilici nei quali il carbonile è legato ad un gruppo alcossilico

15
ALTRE REAZIONI DEGLI ACIDI CARBOSSILICI
Abbiamo visto che le reazioni degli acidi carbossilici con nucleofili sono in fondo delle reazioni acido-base, a causa della presenza del protone. Infatti il C risente dell’effetto elettron-attrattore di un O ed elettron-donatore dell’altro O:
– CO
O – H ═R + SOCl2 – C
O═R
Cl+ SO2 + HCl
cloruro di tionile
cloruro acilico
Se il protone non ci fosse, potrebbero avvenire altri tipi di reazione. Per togliere il protone trasformo l’acido carbossilico nel corrispondente “cloruro acilico”:
– CO
O – H ═R

16
R – CO
O – R’ ═ + HCl
Se il nucleofilo è un alcol, si otterrà un estere (non c’è bisogno dell’ambiente acido):
R – CO
Cl═ +
R’ – O – H R – C – Cl
O ─
R’ – O – H
R – C – Cl
O─
R’ – O – HR – C – Cl
O – H
R’ – O
Infine:
R – C – Cl
O – H
R’ – O
R – C
O – H
R’ – O
+ Cl-
- H+
estere

17
Se il nucleofilo è un’ammina, si otterrà un’ammide:
ammide IIaria
L’N è instabile, per cui espelle un H+:
R – CO
Cl═ +
R’ – NH2 R – C
R’ – N – H
H
═O
+ Cl-
R – C
R’ – N – H
H
═O
R – CO
N – R’ ═
H
+ HCl
Se il nucleofilo è un’ammina IIaria si formerà un’ammide IIIaria.