A seguito dello SCAMBIO di ENERGIA o MATERIA sistema ... · SISTEMI ISOLATI: nessuno scambio, né...
Transcript of A seguito dello SCAMBIO di ENERGIA o MATERIA sistema ... · SISTEMI ISOLATI: nessuno scambio, né...

TERMODINAMICA
Acqua riceve energia dalla fiamma
Acqua cede materia (gas) all’ambiente
Acqua riceve materia dal ghiaccio
❑ Definiamo SISTEMA MACROSCOPICO o TERMODINAMICO un generico aggregato di atomi e molecole (per esempio l’acqua nella pentola, il corpo umano, una pianta, una città, il pianeta Terra). ❑ A seguito dello SCAMBIO di ENERGIA o MATERIA con altri sistemi o con l’ambiente, il sistema subisce delle trasformazioni;la termodinamica è lo studio di queste trasformazioni❑ La TERMODINAMICA studia l’evoluzione del sistema quando questo interagisce con un altro sistema o con l’ambiente circostante, con cui può scambiare energia e/o materia❑ Esempi di trasformazioni termodinamiche sono l’acqua nella pentola o l’acqua del mare che evaporano nell’aria circostante

TERMODINAMICA
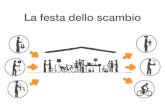
Possiamo distinguere 3 diversi tipi di sistemi termodinamici:❑ SISTEMI APERTI: quando si verificano scambi di materia ed energia con l’ambiente circostante❑ SISTEMI CHIUSI: scambi di sola energia❑ SISTEMI ISOLATI: nessuno scambio, né di materia né di energia
L’acqua nella pentola aperta è un sistema
APERTO: può scambiare energia con la fiamma o con l’aria circostante, e cedere materia sotto
forma di gas
L’acqua nella pentola a pressione è un
sistema CHIUSO: può scambiare energia sotto forma di calore ma non
materia
Il thermos è un sistema (quasi) ISOLATO: non
scambia né materia né calore

Descrizione microscopica e macroscopica
La termodinamica fornisce una descrizione MACROSCOPICA delle trasformazioni che si verificano nei sistemi fisici
H
O
H
Esistono due modi differenti per descrivere un sistema fisico:
❑ La descrizione MICROSCOPICA: considera le singole particelle che compongono il sistema nella loro individualità; ad esempio, una molecola H2O può essere descritta applicando l’equazione di Newton F=Ma a ciascuno degli atomi, e calcolando l’energia degli stati quantici di ciascun elettrone
❑ La descrizione MACROSCOPICA: considera i valori MEDI delle grandezze fisiche (ad esempio velocità, energia) che definiscono lo stato di ogni particella; consideriamo ad esempio l’acqua contenuta in un bicchiere: in una mole d’acqua (equivalente a pochi grammi) vi è un numero di molecole uguale a NA=6×1023 (detto numero di Avogadro). Dovessimo applicare l’equazione di Newton per descrivere individualmente il moto di ciascuna molecola non finiremmo mai…

TEMPERATURA: definizione empirica❑ Ben prima che si conoscesse la struttura della materia e le sue proprietà, i
concetti di temperatura e calore erano interpretati su base puramente empirica: tutti i corpi si consideravano permeati da un misterioso fluido, il calore, il quale poteva scorrere dal corpo più caldo a quello più freddo quando i due corpi venivano posti a contatto; la temperatura esprimeva la sensazione tattile di caldo o freddo provata al contatto con un corpo; un corpo caldo era indice di elevata temperatura, un corpo freddo di bassa temperatura
❑ Anche oggi resta valida la seguente definizione empirica: la temperatura esprime lo STATO TERMICO di un sistema, ovvero ci fornisce la misura di quanto un corpo è caldo o è freddo
❑ La temperatura descrive inoltre l’attitudine di un sistema a scambiare calore con l’ambiente o con altri sistemi
Corpocaldo
Corpofreddo
calore

Temperatura: definizione fondamentale❑ La TEMPERATURA MISURA L’ENERGIA CINETICA MEDIA degli atomi
o delle molecole che compongono un sistema. Per un gas di N particelle (atomi o molecole), l’energia cinetica media di una singola particella Kp è data dalla media delle energie cinetiche di ciascuna particella:
❑ k è la costante di Boltzmann, già incontrata nell’equazione dei gas perfetti❑ La temperatura è proporzionale all’energia cinetica media delle particelle del sistema, dunque misura il grado di agitazione termica ❑ Lo zero assoluto della temperatura corrisponde ad una situazione in cui tutte le particelle del gas sono ferme❑ T è una grandezza INTENSIVA, ovvero non dipende dalla quantità di materia o dal volume del sistema; ad esempio, le temperature del Sole e della lampadina non ci dice se il Sole è più o meno grande della lampadina
1 2 3 ... Np
K K K KK
N
+ + + +=
3
2pK k T=
Si dimostra che l’energia cinetica media di una singola particella è:

ENERGIA TERMICAMoltiplicando l’energia cinetica media di singola particella per il numero N di particelle del sistema otteniamo l’ENERGIA TERMICA del sistema, ovvero l’ energia cinetica totale del gas:
❑ Dunque l’equazione dei gas perfetti dice che il prodotto della pressione interna per volume è proporzionale all’energia cinetica del gas
❑ L’energia termica è una grandezza ESTENSIVA, poiché dipende da N, dunque dalle dimensioni del sistema.
❑ L’energia termica non corrisponde a tutta l’energia interna di un corpo, ma solo alla sua parte cinetica; le particelle infatti posseggono anche un’energia potenziale, dovuta ai campi elettrici e nucleari esercitati su ciascuna particella dalle particelle ad essa circostanti
3
2K PV=
3
2pK N K N k T= =
Ricordiamo l’equazione dei gas perfetti: PV = NkTdunque, l’energia cinetica del gas perfetto è:

TEMPERATURA e STATI della MATERIA
✓ a bassa T la sostanza è allo STATO SOLIDO: gli atomi sono posizionati
in reticoli ordinati e vibrano rapidamente attorno alle posizioni di equilibrio✓ fornendo calore, T aumenta e la sostanza passa allo STATO LIQUIDO: gli atomi abbandonano le posizioni di equilibrio e l’ordine reticolare si perde ✓ aumentando ancora T si raggiunge lo STATO GASSOSO: l’agitazione termica è così grande che gli atomi fuggono in tutte le direzioni; la densità del gas si riduce fino alla totale dispersione se il gas non è costretto in un
volume chiuso.
Un aggregato di atomi ha tre possibili stati di aggregazione:
SOLIDO LIQUIDO GASSOSO

La temperatura: unità di misuraPer la temperatura abbiamo 2 unità di misura principali:
❑ In ambito scientifico si usano i GRADI KELVIN (K): questa scala prende il nome dal barone Kelvin (1824-1907), fisico e ingegnere scozzese.❑ In ambito comune nella maggioranza dei paesi si usano i GRADI CENTIGRADI o CELSIUS (C)
Gradi Kelvin e Celsius in pratica sono uguali, cambia soltanto lo ZERO della scala:
❑ in Kelvin lo ZERO è uguale allo ZERO ASSOLUTO, ovvero ENERGIA CINETICA NULLA❑ in Celsius lo ZERO è 273.15 K e lo ZERO ASSOLUTO è -273.15 C
KCo 15.2730 = KCo 015.273 =−
( ) ( ) 15.273+= CTKT o

Temperatura dell’Universo✓ Nel primo istante del BIG BANG, avvenuto circa 13.7 miliardi di anni fa, la
temperatura era di alcuni miliardi di gradi !✓ Espandendosi (secondo il modello detto inflazionario) l’Universo si è
progressivamente raffreddato: a 300 mila anni dal Big Bang, quando i primi atomi si sono formati, la temperatura era di 3000 gradi; dopo 300 milioni di anni si sono formate le prime stelle, e la temperatura è calata a circa 100 gradi
✓ Oggi l’Universo è un posto molto freddo: le stelle, pur essendo miliardi di miliardi, sono troppo poche rispetto al suo spazio immenso; l’unica fonte di calore è una debole radiazione elettromagnetica detta radiazione elettromagnetica di fondo, emessa al momento del BIG BANG, la quale permea lo spazio vuoto, e se assorbita da un corpo, lo “scalda” a T=2.7 K, ovvero circa - 270 oC
T= 100 K
BIG BANG
T= 2.7 K
13.7 miliardi di anni300 milioni di anni300 mila anni
T= 3000 KT= 109 K

Misura della temperatura
✓ Il riscaldamento o il raffreddamento dei corpi induce variazioni nelle loro caratteristiche fisiche (volume, pressione, resistenza elettrica).
✓ Le sostanze tendono ad ESPANDERSI con la temperatura. L’espansione dovuta ad un aumento di calore può quindi essere utilizzata per misurare la temperatura
✓ Un termometro è costituito da un tubo capillare di vetro con un bulbo, all’interno del quale è posto il liquido termometrico (tipicamente mercurio o alcol). Lungo il tubo c’è una scala graduata che è ottenuta considerando due punti di riferimento: la FUSIONE del GHIACCIO (0 C) e l’EBOLLIZIONE dell’ACQUA (100 C)

IL CALOREIl CALORE è in pratica ENERGIA TERMICA; vi è però una sottile distinzione tra i due concetti:❑ L’energia termica è l’energia cinetica totale posseduta dal sistema❑ Il calore è energia termica trasferita (‘in transito’), ovvero ceduta o
acquistata dal sistema a causa della differenza di temperatura fra questo e l’ambiente circostante o un altro sistema con cui è in contatto
❑ In quanto energia, il calore si misura in Joule
❑ Il calore può compiere lavoro: la somministrazione di calore aumenta l’energia cinetica interna del corpo. Dunque oltre al lavoro meccanico dovuto ad una forza applicata, esiste anche il lavoro termico compiuto dal calore❑ Il calore è una grandezza fisica ESTENSIVA, ovvero dipende dall’estensione e dalla quantità di materia del sistema
AMBIENTE
SISTEMA SISTEMA
AMBIENTE

Differenza tra TEMPERATURA e CALORE
Esempio #1: 1) se una pentola di acqua bollente ci si rovescia sulle mani ci
ustioniamo e dobbiamo correre al pronto soccorso2) Se uno schizzo d’acqua bollente ci colpisce, brucia un po’ ma non
è nulla di grave
Nei due casi la temperatura è la stessa (100 oC) , ma nel primo caso la quantità di calore (ovvero di energia termica) rovesciata sulla pelle è enormemente maggiore, e dunque maggiore il LAVORO (ustione) fatto dall’acqua bollente sulle mani. Al contrario, una singola goccia d’acqua contiene poca energia termica e quindi poco calore

Differenza tra TEMPERATURA e CALORE
Esempio #2: Mettiamo due pentole, una con MOLTA ACQUA e una con POCA ACQUA, su due FORNELLI IDENTICI; dopo 5 minuti misuriamo la temperatura: sarà molto maggiore la temperatura della pentola con poca acqua
I fornelli hanno fornito la STESSA QUANTITA’ di CALORE ai due recipienti. Il calore ha determinato un aumento dell’AGITAZIONE TERMICA delle molecole dell'acqua. Ma nella pentola con meno acqua le molecole avevano maggiore energia a disposizione per molecola, per cui ognuna di esse ha assorbito maggior energia. La temperatura misura l’agitazione termica media delle molecole.

PROPAGAZIONE DEL CALORE
Il calore ha la capacità di propagarsi perché l'energia termica può essere trasmessa da un corpo che ne possiede di più a un altro che ne possiede in minore quantità. Questa trasmissione può avvenire per:✓ CONDUZIONE: il trasporto avviene per contatto, a causa
degli urti fra le particelle dei corpi, senza trasporto di materia (es.: una sbarra di ferro posta su una fiamma); è il meccanismo tipico di trasporto di calore nei corpi solidi
✓ CONVEZIONE: il trasporto avviene per spostamento su distanze macroscopiche di materia riscaldata, sostituita da materia più fredda; è il meccanismo di trasporto principale nei liquidi e nei gas
✓ IRRAGGIAMENTO: il trasporto avviene, senza che sia coinvolta materia, tramite radiazione elettromagnetica (ad esempio il calore che ci arriva dal sole, da un camino acceso, o da una qualunque sorgente luminosa)

CONDUZIONE DEL CALORE
✓ Se abbiamo le mani fredde e le immergiamo nell’acqua calda, in breve si riscaldano: il calore si è trasmesso dall’acqua alle mani. Quando un corpo si riscalda per essere stato messo a contatto con uno più caldo si ha CONDUZIONE di calore
✓ Cosa succede a livello microscopico? Le particelle (atomi o molecole) del corpo più freddo assorbono calore da quelle del corpo più caldo
✓ Dunque, le particelle del corpo più freddo aumentano la loro agitazione termica media, mentre quelle del corpo più caldo riducono l’agitazione termica
✓ Il processo procede fino a quando le particelle di entrambi i corpi hanno tutte la stessa agitazione: si è raggiunto l'equilibrio termico

CONDUZIONE DEL CALORE
✓ Se mettiamo una bacchetta di ferro sulla fiamma, gli atomi di ferro a contatto con la fiamma acquistano energia termica, e, vibrando, trasmettono questa agitazione agli atomi vicini
✓ Gli atomi non si spostano dalle loro posizioni di equilibrio, ma vibrando trasferiscono la loro agitazione agli atomi vicini per contatto diretto, realizzando così la propagazione del calore per conduzione.
✓ Se ripetiamo l’esperimento con una bacchetta di vetro o di legno, vediamo che occorre molto più tempo prima che il calore giunga alla nostra mano
✓ La capacità di un corpo di trasmettere calore si definisce CONDUCIBILITA’ TERMICA. Questa dipende dalla natura del corpo, ossia dalla sostanza di cui è costituito.

Conducibilità termica✓ Le sostanze che si lasciano facilmente attraversare dal calore sono dette
conduttori termici, mentre quelle in cui il calore passa con difficoltà sono dette isolanti termici
✓ Sono buoni conduttori i metalli in genere✓ Sono cattivi conduttori vetro, carta, legno, plastica e in genere
liquidi e gas✓ La capacità di un corpo di trasmettere calore è misurata dalla
conducibilità termica l (“lambda”), una grandezza intensiva che dipende soltanto dalla sostanza
✓ Consideriamo un filo di lunghezza l e spessore S; ai capi del filo applichiamo una differenza di temperatura DT=T2-T1; la quantità di calore Q trasmessa attraverso il filo nel tempo Dt è data da:
ST1 T2l
Q ST
t ll= D
D
✓ Dunque il calore trasmesso attraverso il filo nel tempo Dt è proporzionale alla conducibilità termica, allo spessore e alla differenza di temperatura, ed inversamente proporzionale alla lunghezza del filo

Conducibilità termica✓ Per ottenere l’unità di misura della conducibilità termica conviene
invertire la formula precedente:
Q l
t S Tl =
D D 2
Joule m Watt
s m K m Kl = =
diamante 1600
argento 460
rame 390
oro 320
alluminio 290
ottone 111
platino 70
acciaio 52
piombo 35
ghiaccio ( 0°) 2,20
vetro 1
mattoni 0,90
neve 0,70
acqua distillata 0,60
polipropilene 0,22
cartongesso 0,21
plexiglas 0,19
carta/cartone 0,18
legno di quercia 0,18
idrogeno 0,172
olio minerale 0,15
legno di abete e pino 0,10
sughero 0,052
granuli di sughero 0,050
lana di pecora 0,040
polistirolo espanso 0,035
poliuretano espanso 0,034
aria secca 0,026
aerogel di silice 0.013
✓ La conducibilità termica rappresenta il calore trasmesso nel tempo unitario attraverso un filo di sezione e lunghezza unitari quando ai capi del filo applichiamo una differenza di temperatura di un grado
✓ nella tabella riportiamo i valori di conducibilità di alcune sostanze in W/mK

ISOLANTI e CONDUTTORI✓ Dalla tabella della conducibilità termica vediamo che quasi tutti i buoni
conduttori di calore sono METALLI (ovvero solidi aggregati mediante legame metallico)
✓ Di contro, gli ISOLANTI (solidi aggregati mediante legame covalente o ionico) hanno bassa conducibilità termica (ad eccezione del diamante)
ATOMI ELETTRONI diconduzione
ISOLANTI
CONDUTTORI
✓ In tutti i solidi (metalli o isolanti) il calore si propaga poiché le vibrazioni atomiche dal lato riscaldato si trasmettono da un atomo all’altro verso il lato freddo; le vibrazioni atomiche si propagano lentamente, per cui la propagazione del calore dovuta alle vibrazioni atomiche è in genere lenta
✓ Nei metalli, oltre alle vibrazioni atomiche, abbiamo una marcia in più: gli elettroni di conduzione, liberi di muoversi nel materiale; se riscaldati, essi fuggono verso le zone fredde del cristallo, trasportando calore attraverso il materiale con una rapidità ben maggiore rispetto a quella delle vibrazioni atomiche; ne deriva che nei metalli la conduzione termica è più elevata

PROPAGAZIONE per CONVEZIONE✓ A differenza dei solidi, in liquidi e gas atomi e molecole
possono muoversi e trasportare calore✓ Quando una porzione di liquido o di gas viene riscaldata,
l’aumento di agitazione termica ne riduce la densità rispetto alla massa di fluido più fredda
✓ Per il principio di Archimede, la massa calda più leggera tenderà a salire verso l’alto, e quella più fredda a scendere in basso
✓ Si genera quindi un rimescolamento circolare delle particelle del fluido, detto moto convettivo e il meccanismo è detto convezione
✓ Consideriamo ad esempio, l’acqua nella pentola sul fuoco: gli strati di acqua vicini al fondo della pentola, riscaldandosi, diventano più leggeri e le molecole salgono verso l’alto, sostituite dall’acqua più fredda che precipita verso il fondo
✓ Si genera un moto convettivo continuo che trasporta calore dal basso verso l’alto, distribuendolo a tutto il volume d’acqua

Riscaldamento dell’aria per convezione✓ Il riscaldamento all’interno degli edifici si realizza mediante
convezione dell’aria✓ Ad esempio, in una stanza con i termosifoni (detti anche
caloriferi o radiatori) l’acqua calda (riscaldata dalla caldaia) entra nella parte superiore del termosifone e si raffredda trasferendo calore alla superficie metallica del termosifone, che a sua volta per contatto (conduzione) lo trasferisce all’aria
✓ l’aria riscaldata per convezione sale verso il soffitto e lascia il posto all’aria fredda che scende e si riscalda nuovamente a contatto coi termosifoni, innescando il moto convettivo

✓ la convezione è alla base di tutti i fenomeni atmosferici in natura, come venti, nuvole, tempeste
✓ La differenza di temperatura tra masse d’aria è la causa della circolazione atmosferica. Ad esempio uragani e cicloni sono generati dalle masse d’aria calda che dal suolo salgono verso l’alto e condensano al contatto dell’aria più fredda, generando forti depressioni ed afflusso di venti dalle regioni circostanti
✓ la brezza di mare che dà sollievo durante l’estate è anch’essa dovuta alla convezione
✓ di giorno il suolo si riscalda più rapidamente dell’acqua, per cui l’aria calda sale dalla terra e viene sostituita da aria fresca proveniente dal mare
✓ di notte il suolo si raffredda più rapidamente dell’acqua, per cui l’aria calda sale dal mare e viene sostituita da aria fresca proveniente da terra
CONVEZIONE nei fenomeni atmosferici

PROPAGAZIONE per IRRAGGIAMENTO✓ Qualsiasi corpo caldo emette radiazione elettromagnetica la quale, se
assorbita da un corpo può riscaldarlo; questo meccanismo di propagazione del calore è chiamato IRRAGGIAMENTO
✓ La fonte primaria di riscaldamento per la Terra è la radiazione solare, la quale viaggia nel vuoto attraverso i 150 milioni di Km che ci separano dal Sole alla velocità di 300 mila Km/s, e giunge sulla Terra in circa 8 min
✓ Si noti che conduzione e convezione sono meccanismi di propagazione di calore che richiedono necessariamente la presenza di materia; di contro, l’irraggiamento è l’unico meccanismo di propagazione che può avvenire nel vuoto

PROPAGAZIONE per IRRAGGIAMENTO✓ L’irraggiamento si verifica non solo nel vuoto, ma anche nell’aria,
dove si somma alla convezione✓ Qualunque corpo caldo emette radiazioni infrarosse (ovvero
di frequenza inferiore a quella visibile) nell’ambiente circostante; la radiazione trasporta energia che viene assorbita come energia termica dai corpi investiti dalla radiazione
✓ Il termosifone emette nell’ambiente molta radiazione infrarossa (infatti è anche detto radiatore)
✓ Il corpo umano emette ed assorbe continuamente radiazione infrarossa. Se siamo in un ambiente più freddo sono di più le radiazioni emesse dal corpo, che di conseguenza si raffredda; se i corpi che ci circondano sono più caldi , riceviamo più radiazioni e dunque ci riscaldiamo
✓ Le lampadine di vecchio tipo producono molto calore emettendo radiazione infrarossa non visibile, per cui sono poco energeticamente efficienti; le moderne lampadine al LED invece emettono solo radiazione visibile, per cui l’energia elettrica che alimenta la lampadina è tutta utilizzata per l’illuminazione

PROPAGAZIONE DEL CALORE
In pratica nella maggior parte dei casi i vari meccanismi di trasmissione del calore si verificano simultaneamente. Per esempio: ✓ l’acqua nella pentola riceve calore dalla fiamma sia per conduzione
(attraverso le pareti della pentola) che per irraggiamento, e poi si ridistribuisce nel volume d’acqua per convezione;
✓ il calorifero si dice anche radiatore poiché oltre a scaldare l’aria circostante per contatto emette anche calore per irraggiamento
✓ in spiaggia siamo scaldati direttamente dalla radiazione solare e indirettamente dall’aria calda che dalla sabbia si solleva per convezione

Legge fondamentale della calorimetria✓ La legge della calorimetria esprime la relazione tra la quantità di
calore assorbito o ceduto da un corpo e la corrispondente variazione di temperatura. Essa ci dice che la quantità di calore Q necessaria per far variare di DT la temperatura di un corpo di massa M è data da:
TMcQ D=
✓ Dunque Q è proporzionale alla massa del corpo, alla variazione di temperatura DT, e ad una costante di proporzionalità c
✓ c ed M sono grandezze sempre positive, mentre DT è positiva se la temperatura della sostanza cresce, negativa se la temperatura decresce Dunque, nel caso in cui Q è FORNITO al corpo, si ha Q > 0 e DT >0; se invece il calore è SOTTRATTO al corpo, si ha Q < 0 e DT < 0
✓ La costante di proporzionalità c è una proprietà della specifica sostanza considerata, detta CALORE SPECIFICO.
✓ Il calore specifico è una grandezza intensiva; l’unità di misura di c è:
CKg
Joulec
0=

Significato del calore specifico✓ La legge della calorimetria ci dice che, se forniamo ad un corpo di massa M
e calore specifico c una quantità di calore Q, il corpo aumenta la sua temperatura di una quantità:
✓ Dunque la variazione di temperatura è inversamente proporzionale al calore specifico: per una data quantità di calore Q assorbito o ceduto, maggiore è il calore specifico, minore è la variazione di temperatura
✓ Se Q è sottratto al corpo, Q e DT sono entrambe negativi, ma la formula è la stessa, la relazione tra calore e variazione di temperatura non cambia
✓ Dunque il calore specifico quantifica la resistenza di un corpo al cambiamento della propria temperatura:
✓ Sostanze con grande calore specifico necessitano di scambiare grandi quantità di calore con l’ambiente esterno per variare di pochi gradi la propria temperatura, per cui tendono ad accumulare e disperdere calore molto lentamente
✓ Sostanze con piccolo calore specifico possono variare di molto la propria temperatura scambiando piccole quantità di calore con l’esterno, per cui tendono ad accumulare e disperdere calore molto rapidamente
cM
QT =D

Sabbia e mareConsideriamo un caso emblematico: la sabbia e l’acqua✓ La sabbia ha un calore specifico molto più piccole rispetto
all’acqua; sappiamo bene che poche ore di sole al mattino sono sufficienti a portare la sabbia fredda della notte ad una temperatura molto alta; ugualmente rapida è la discesa della temperatura quando il sole tramonta
✓ Al contrario l’acqua ha calore specifico molto grande, per cui per aumentare o diminuire la temperatura di pochi gradi ha bisogno di guadagnare o perdere grandi quantità di calore: durante i mesi primaverili ed estivi il mare immagazzina una grande quantità di calore, necessario ad aumentare di pochi gradi la temperatura; durante l’autunno e l’inverno il mare restituisce lentamente all’ambiente questa grande quantità di calore accumulata in precedenza
acquasabbia cc
✓ Ne segue che il mare è un forte regolatore termico: esso si oppone alle forti escursioni termiche, favorendo inverni miti ed estati fresche. Di contro i climi continentali (lontani dalle coste) sono caratterizzati da forti escursioni termiche durante l’anno, con estati torride e inverni rigidi

Calore specifico di alcune sostanze✓ Il calore specifico è
proprietà della sostanza e della specifica fase considerata; per esempio è diverso per acqua e ghiaccio
✓ In genere i liquidi hanno calore specifico maggiore dei solidi

Temperatura di equilibrio
✓ il trasferimento di calore cessa quando si raggiunge l’equilibrio termico, ovvero quando i corpi raggiungono la stessa temperatura finale di equilibrio, Tf che è un valore intermedio tra le due temperature iniziali
✓ Possiamo dimostrare, utilizzando la legge della calorimetria, che la temperatura di equilibrio è: (diamo il risultato senza dimostrazione)
M1, T1 M2, T2
calore
✓ Consideriamo due corpi di uguale calore specifico c, di masse M1 e M2, e temperature T1 e T2 differenti; sia T1 > T2
✓ Se messi a contatto, si verifica un passaggio di calore dal corpo più caldo al più freddo; durante questa fase la temperatura del corpo più caldo scende, e quella del più freddo sale
1 21 2f
M MT T T
M M= +
1 2M M M= +
M è la somma delle 2 masse
✓ M1/M si dice massa relativa del corpo 1; M2/M è la massa relativa del 2✓ Dunque la temperatura di equilibrio tra due corpi a contatto di
uguale calore specifico corrisponde alla media delle temperature iniziali dei due corpi pesata sulle masse relative

Esempi
0 0 0100 0.166 5 0.83 20.8c Lf c L
M MT T T C C C
M M= + = + =
Il cappuccino: mescoliamo 20 ml di caffè bollente alla temperatura Tc = 100 oC con 100 ml di latte dal frigo alla temperatura TL = 5 oC; calcoliamo la Tf del cappuccino; per semplicità supponiamo che caffè e latte abbiano stessa densità e calore specifico dell’acqua, dunque la massa del caffè è Mc = 20 gr, e la massa del latte ML = 100 gr
Il bicchiere d’acqua fredda abbassa di poco la T iniziale dell’acqua bollente
Tf è più vicina alla T iniziale del latte, essendo il latte in quantità maggiore
Acqua nella pentola: Abbiamo un litro d’acqua bollente (M1 = 1 Kg) in una pentola alla temperatura T1 = 100 oC; aggiungiamo un bicchiere con 100 ml di acqua fredda (M2 = 0.1 Kg) alla temperatura T2 = 5 oC; calcoliamo la Tf dopo l’aggiunta di acqua fredda
0 0 01 21 2 100 0.91 5 0.09 91.5f
M MT T T C C C
M M= + = + =

Passaggi di stato
✓ Abbiamo visto che un corpo varia la temperatura cedendo o acquisendo calore; durante un passaggio di stato (o transizione di fase) si verifica un diverso fenomeno:
✓ la temperatura non varia, resta fissata ad un valore di riferimento detto temperatura di transizione
✓ il calore fornito alla sostanza viene interamente utilizzato non per aumentare l’agitazione termica, ovvero l’energia cinetica delle particelle (atomi o molecole), ma per indebolire o rompere i loro legami, generando così il cambiamento di stato; rompere i legami significa aumentare l’energia potenziale delle particelle, rendendo il sistema meno stabile; esempio:
o durante la fusione del ghiaccio, la temperatura è fissata a T=0 oC; tutto il calore fornito al ghiaccio è utilizzato per disordinare le molecole del reticolo cristallino e trasformare il ghiaccio in liquido
o durante l’ebollizione dell’acqua la temperatura è fissata a T=100 oC; tutto il calore fornito all’acqua è utilizzato per rompere il legame tra le molecole e trasformare il liquido in vapore

Il calore latente✓ Durante il passaggio di stato la legge della calorimetria cambia: essa
mette in relazione la quantità di calore Q fornito al corpo e la massa M che a causa del calore Q fornito, ha cambiato il proprio stato:
lMQ =
✓ la legge della calorimetria per i passaggi di stato dice che la quantità di calore Q necessaria a trasformare di stato una massa M di sostanza, è proporzionale alla massa M e ad un coefficiente l (lettera greca ‘lambda’) detto calore latente che dipende esclusivamente dalla sostanza
✓ Il calore latente è uguale al calore necessario a trasformare di stato una massa unitaria, ovvero 1 Kg di materia; esso si definisce ‘latente’, ovvero nascosto, per indicare il fatto che non si manifesta attraverso un aumento di temperatura
✓ Per una massa M data, maggiore è il calore latente, maggiore la quantità di calore necessario a produrre la trasformazione di fase di quella massa; dunque il calore latente quantifica la resistenza di una sostanza al passaggio di stato
Kg
J
M
Q== ll

Il calore latente✓ l è una grandezza intensiva; esso dipende non soltanto dal tipo di
sostanza, ma anche dal tipo di trasformazione; ad esempio il calore latente della trasformazione acqua-ghiaccio è diverso da quello acqua-vapore
✓ l e Q hanno sempre lo stesso segno: l e Q sono positivi per le trasformazioni in cui la sostanza riceve calore, negativi quando la sostanza cede calore
✓ Per ogni sostanza abbiamo al massimo 3 valori di calore latente:
o solido –> liquido: calore latente di fusione lF
o liquido –> gas: calore latente di ebollizione lE
o solido –> gas: calore latente di sublimazione lS
✓ Per le 3 trasformazioni inverse, il calore latente è ovviamente lo stesso ma cambiato di segno:
o liquido –> solido: calore latente di solidificazione -lF
o gas –> liquido: calore latente di liquefazione -lE
o gas –> solido: calore latente di brinazione –lS

Valori di calore latente
In generale le sostanze hanno un calore latente di ebollizione MOLTO MAGGIORE del calore latente di fusione; ad esempio, il calore necessario a far bollire 1 Kg d’acqua è uguale a 2272 KJ, mentre il calore necessario a fondere 1 Kg di ghiaccio è 333 KJ

Calore latente dell’acqua✓ Per quasi tutte le sostanze, il calore latente di ebollizione, ovvero il
calore richiesto per trasformare 1 Kg di materia da liquido a vapore è molto maggiore del calore latente di fusione, ovvero il calore necessario a trasformare la stessa massa da solido a liquido
✓ Ciò perché il passaggio da liquido a vapore richiede la completa rottura dei legami tra gli atomi o le molecole, mentre nella fusione le particelle si disordinano, ma i legami non sono completamente distrutti
3333 10F
J
Kgl =
32272 10E
J
Kgl =
✓ Per sciogliere 1 Kg di ghiaccio occorre una quantità di calore lF= 333×103 J✓ Per vaporizzare 1 Kg (1 litro) d’acqua occorre un calore lE= 2272×103 J

Evaporazione ed ebollizioneNon dobbiamo confondere evaporazione con ebollizione:
✓ L’evaporazione è un processo lento e graduale che riguarda soltanto le molecole in superficie, ed avviene a qualsiasi temperatura; ad esempio l’acqua (può essere l’acqua del mare, l’acqua in un recipiente, l’acqua piovana) evapora poiché le molecole d’acqua che si trovano sulla superficie del liquido sono meno legate di quelle all’interno del liquido, per cui a contatto con l’aria più calda o ricevendo calore per irraggiamento possono rompere i loro legami e staccarsi dal liquido, trasformandosi in vapore
✓ L’ebollizione è un processo rapido e violento, che avviene simultaneamente in tutto il liquido ad una temperatura specifica (per l’acqua 100 oC); a questa temperatura le molecole sono talmente agitate da separarsi e creare nella massa liquida bolle d’aria; per il principio di Archimede le bolle così formate salgono in superficie ed esplodono, liberando in aria il vapore

Ebollizione e tensione di vapore✓ Il processo di ebollizione è legato ad una quantità detta
tensione di vapore (o pressione di vapore); essa rappresenta il valore della pressione del gas all’interno delle bolle
✓ Affinché le bolle possano formarsi e l’ebollizione possa avere luogo, è necessario che la pressione di vapore interna alla bolla sia uguale o maggiore della pressione che agisce dall’esterno sulla bolla
✓ Per la legge di Stevino la pressione esterna alla bolla è data dalla Patm più quella del liquido, che però possiamo trascurare supponendo che si tratti ad esempio di una piccola quantità d’acqua (pentola sul fuoco); dunque l’ebollizione ha luogo quando la pressione di vapore è uguale o maggiore di quella atmosferica
✓ Applicando alla bolla la legge dei gas perfetti, vediamo che la pressione del gas P è proporzionale alla temperatura: PV=NkT ; quando T raggiunge un valore tale per cui la pressione nella bolla è uguale a Patm il processo di ebollizione può iniziare
✓ In montagna l’acqua bolle a T più basse (ad esempio sull’Everest bolle a 73 oC) poiché la pressione atmosferica è molto minore che a livello del mare; conseguentemente la pressione interna necessaria alla formazione delle bolle è anch’essa più bassa

Sublimazione✓ In alcuni solidi molecolari (solidi formati dall’aggregato di molecole) le
molecole sono legate da legami dipolari molto deboli ✓ In questi casi può accadere, anche a temperatura ambiente, che le
molecole che si trovano in superficie si stacchino dal reticolo cristallino e passino direttamente allo stato aeriforme; questo fenomeno si dice sublimazione
Esempio: la molecola della naftalinaC10H8 è fatta da atomi di carbonio legati a formare un doppio esagono; ciascun carbonio si lega mediante legame covalente ad altri due atomi di carbonio e ad un idrogeno
✓ La sublimazione è quindi un fenomeno superficiale,dunque analogo all’evaporazione nei liquidi
✓ Esempi sono la naftalina, la canfora, lo iodio; per questo motivo percepiamo l’odore della naftalina e della canfora, e vediamo vapori violetti intorno ai cristalli di iodio

Diagramma di fase (Q,T) dell’acqua✓ Chiamiamo diagramma di fase un grafico (x,y) in cui sull’asse x poniamo
i valori del calore Q fornito al sistema, e sull’asse y la T corrispondente✓ In base alle formule della calorimetria che ci forniscono le relazioni tra Q e
T, disegniamo il diagramma (Q,T) per una massa unitaria d’acqua (M=1 Kg); partendo da una temperatura bassa (T=-40 oC), aggiungiamo progressivamente calore al sistema e riportiamo lungo l’asse y la corrispondente variazione di temperatura (nella slide successiva la spiegazione del grafico)
Calore fornito →
acqua
QT
cD = EQ l=
FQ l=
ghiaccio
QT
cD =

Diagramma di fase (Q, T) dell’acqua❑ Se non c’è passaggio di stato, T cresce proporzionalmente al calore fornito: DT=Q/c; la pendenza della retta è data dall’inverso del calore specifico, ovvero maggiore è c, minore è la crescita di T col calore❑ Quando si raggiunge la temperatura relativa ad un passaggio di stato, T si blocca, e tutto l’incremento di Q è speso per la transizione di fase, ovvero è speso in calore latente: lF = Q. ❑ Partiamo dal ghiaccio a T=-40 oC: ✓ area grigia: fornendo calore, T aumenta secondo la legge DT=Q/c fino a 0 oC,
temperatura di fusione; c è il calore specifico del ghiaccio.✓ area blu: il ghiaccio si trasforma in acqua, T resta fissa a 0 oC finché tutto
il ghiaccio non è sciolto. Il calore Q fornito in questo intervallo necessario a trasformare 1 Kg di ghiaccio in acqua è Q = lF (calore latente di fusione)
✓ area verde: il ghiaccio è ora completamente trasformato in acqua; aggiungendo calore la temperatura dell’acqua torna a salire secondo la leggeDT=Q/c fino a T=100 oC, temperatura di ebollizione; c è il calore specifico dell’acqua liquida
✓ area rossa: la temperatura si blocca a 100 oC; tutto il calore aggiuntivo è utilizzato per trasformare l’acqua in vapore; quando il calore fornito in questa fase raggiunge il valore Q= lE (calore latente di ebollizione) tutta l’acqua sarà stata trasformata in vapore acqueo
✓ area gialla: c’é solo vapore, la temperatura riprende a salire indefinitamente con DT=Q/c, ove c è il calore specifico del vapore acqueo; se racchiuso in un volume il vapore segue la legge dei gas perfetti, dunque la pressione aumenterà proporzionalmente a T

Esercizio: ebollizione dell’acqua
Consideriamo una pentola con 1 litro d’acqua, inizialmente a T=30 oC; mettiamo l’acqua sul fuoco; calcoliamo il calore che deve fornire la fiamma affinché l’acqua, bollendo, disperda metà del suo volume in vapore
6
1 4186 1 70 0.29 10o
o
JQ c M T Kg C J
Kg C= D = =
✓ Calcoliamo innanzitutto il calore Q1 necessario per portare un litro d’acqua a bollire, ovvero per innalzare la temperatura dell’acqua di DT=70 oC; dalla prima formula della calorimetria si ha:
✓ Arrivata ad ebollizione, calcoliamo dalla seconda formula della calorimetria il calore Q2 necessario per vaporizzare mezzo litro d’acqua:
3 6
2 2272 10 0.5 1.135 10E
JQ M Kg J
Kg= = =
✓ Il calore totale fornito dalla fiamma è quindi:
6
1 2 1.425 10Q Q Q J= + =

Equivalenza tra calore e lavoro✓ Fino all’800 il fatto che il calore fosse una forma di energia non
era affatto ovvia: si parlava di un misterioso fluido calorico che passava dai corpi caldi a quelli freddi
✓ Il calore era misurato mediante un’unità di misura operativa detta CALORIA: una caloria equivale al calore necessario a riscaldare un grammo d’acqua da 14.5 °C and 15.5 °C
✓ Nel 1840 il fisico inglese James Prescott Joule inventa uno strumento chiamato mulinello di Joule, mediante il quale dimostra per la prima volta che calore e lavoro meccanico sono due forme di energia trasferita, le quali possono essere trasformate direttamente l'una nell'altra
✓ Il mulinello di Joule è essenzialmente una macchina termica che trasforma il lavoro meccanico del mulinello in calore dell’acqua; il lavoro compiuto dal campo di gravità che agisce sui pesi (Mgh) è esattamente determinato, e posto in relazione con l’aumento di temperatura registrato dal termometro

Joule e caloria✓ Nel 1840, utilizzando il suo celebre mulinello, Joule dimostra che
calore e lavoro sono due forme di energia, e determina la relazione:
Jcal 186.41 =✓ Al giorno d’oggi Joule e calorie sono utilizzate entrambe come unità di
misura dell’energia; il Joule è più usato in ambito scientifico, mentre la caloria è più usata nel settore medico e alimentare
✓ Ricordiamo che 1 J è il lavoro necessario a sollevare di un metro un oggetto di 100 grammi. Dunque 1 cal equivale all’incirca al lavoro necessario per sollevare di un metro una massa di 420 grammi
✓ Attenzione: l’apporto calorico dei cibi riportato sulle confezioni degli alimenti è in kilocalorie, indicate con Kcal, anche dette grandi calorie e indicate con Cal
31 1 10 4186Kcal Cal cal J= = =✓ Dunque, 1 Cal = 1 Kcal equivale al lavoro speso per sollevare MILLE
VOLTE di un metro una massa di 420 grammi✓ Per esempio, 100 g di pane bianco contengono circa 270 Kcal; dunque per
smaltire 100 g di pane bianco occorre sollevare di un metro un peso di 420 grammi per ben 270 mila volte, oppure sollevare un peso di 4.2 Kg per ben 27 mila volte !! Chiaramente il sollevamento pesi non è l’esercizio ideale per consumare calorie…

Joule e caloria✓ Nel 1840, utilizzando il suo celebre mulinello, Joule dimostra che
calore e lavoro sono due forme di energia, e determina la relazione:
Jcal 186.41 =✓ Al giorno d’oggi Joule e calorie sono utilizzate entrambe come unità di
misura dell’energia; il Joule è più usato in ambito scientifico, mentre la caloria è più usata nel settore medico e alimentare
✓ Ricordiamo che 1 J è il lavoro necessario a sollevare di un metro un oggetto di 100 grammi. Dunque 1 cal equivale all’incirca al lavoro necessario per sollevare di un metro una massa di 420 grammi
✓ Attenzione: l’apporto calorico dei cibi riportato sulle confezioni degli alimenti è in kilocalorie, indicate con Kcal, anche dette grandi calorie e indicate con Cal
31 1 10 4186Kcal Cal cal J= = =
✓ Dunque, 1 Cal = 1 Kcal equivale al lavoro speso per sollevare MILLE VOLTE di un metro una massa di 420 g
✓ Per esempio, 100 g di pane bianco contengono circa 270 Kcal; dunque per smaltire 100 g di pane bianco occorre sollevare di un metro un peso di 420 grammi per ben 270 mila volte, oppure sollevare un peso di 4.2 Kg per ben 27 mila volte !! Chiaramente il sollevamento pesi non è l’esercizio ideale per consumare calorie…

Macchine termiche✓ Le macchine termiche trasformano il calore generato da una
caldaia in lavoro meccanico; esse compiono cicli di lavoro ripetuti detti cicli termici o cicli di Carnot
✓ In figura vediamo la rappresentazione schematica di una macchina termica: essa è costituita da un fluido (ad esempio acqua-vapore) che scorre in un percorso chiuso (ciclo)
✓ Il fluido è in contatto con due recipienti: una caldaia a temperatura molto alta TC, ed un recipiente freddo (camera di condensazione) a temperatura fredda TF (in pratica la temperatura ambiente)
✓ Il fluido assorbe calore Qc dalla caldaia, e lo spende per compiere lavoro L lungo il ciclo
✓ Purtroppo, non tutto il calore assorbito dalla caldaia è effettivamente utilizzato come lavoro: vi è sempre una porzione di calore QF ceduta al recipiente freddo, e dunque ‘sprecata’ dal ciclo.
✓ Il recipiente freddo raccoglie il fluido esausto, ovvero il fluido che ha esaurito la sua capacità di lavoro; il fluido viene quindi riportato nella caldaia (tipicamente mediante pompaggio elettrico) per ripetere un nuovo ciclo di lavoro
recipiente freddo
caldaia
fT
cT
cQ
fQ
L

Principi della Termodinamica✓ I Principi della Termodinamica determinano i principi generali di
funzionamento delle macchine termiche cicliche✓ Il 1° Principio esprime essenzialmente la conservazione dell’energia;
esso dice che in un ciclo termico la quantità di calore Q scambiato con l’esterno è uguale al lavoro L compiuto dalla macchina:
✓ In una macchina termica IDEALE il calore QF perso nel vano freddo è nullo ed il calore Qc assorbito dalla caldaia è trasformato interamente in lavoro; nella macchine termiche REALI vi è sempre una porzione di calore QF
perso; si definisce rendimento o efficienza il rapporto tra lavoro compiuto e calore assorbito h (dalla lettera greca “eta”) : fT
cT
cQ
fQ
L
C FQ Q Q L= − =
✓ In una macchina termica ideale QF =0 ed h =1, ovvero il rendimento è il 100%; il 2° Principio della Termodinamica dice che in una trasformazione ciclica reale è impossibile trasformare tutto il calore assorbito in lavoro, ovvero, è impossibile realizzare una macchina termica il cui rendimento sia il 100%
C F
C C
Q QL
Q Qh
−= =

La macchina a vapore
✓ Il sistema acqua-vapore assorbe una quantità di calore Qc dalla caldaia, a temperatura TC
✓ Il vapore ad alta pressione arriva nel cilindro e si espande, spingendo il pistone in avanti, e trasformando così una parte del calore Qc in lavoro meccanico L
✓ Dopo l’espansione il gas raffreddato scende attraverso la valvola di scarico nel recipiente di condensazione a temperatura TF, dove si condensa tornando acqua
✓ Il gas raffreddato porta con sé una quantità di calore QF non trasformato in lavoro, dunque trasmesso al recipiente di condensazione
✓ Infine la pompa riporta l’acqua nella caldaia da cui si riparte per un nuovo ciclo termico

La centrale termoelettrica
✓ Il flusso di vapore riscaldato nella caldaia fluisce nella turbina; la pressione del vapore compie lavoro facendo girare una schiera di pale rotanti
✓ Il movimento rotatorio è trasformato dall’alternatore in energia elettrica, poi trasferita alla rete elettrica.
✓ Il gas raffreddato scende nel condensatore e si ritrasforma in acqua; dal condensatore una pompa elettrica riporta l’acqua nella caldaia
✓ Si dimostra che l’efficienza del ciclo termico è tanto migliore quanto maggiore è la differenza tra Tc e TF; poiché TF è in pratica la temperatura ambiente, ne segue che Tc deve essere molto più alta, tipicamente Tc=540 oC
CQ
FQ
CT
FT
L
CONDENSATOREALTERNATORE
✓ per raggiungere queste alte temperature, il bruciatore della caldaia è alimentato da combustibili fossili (petrolio, carbone, gas naturale), i cui prodotti di combustione sono forti inquinanti ambientali

La centrale termonucleare✓ La centrale termonucleare funziona con lo stesso principio della centrale
termoelettrica; la differenza è che il calore nella caldaia è generatodall’energia termica liberata da reazioni nucleari a catena (in genere la scissione dei nuclei dell’uranio)
✓ L’uranio, contenuto in barre di acciaio, produce la reazione nucleare che riscalda l’acqua in circolo nell’impianto primario (circuito rosso); l’acqua da una parte mantiene sotto controllo la temperatura del reattore, e dall’altra cede calore all’acqua del circuito secondario (circuito blu) dove si produce il vapore che aziona la turbina
✓ Nel reattore vi sono barre di controllo che assorbono parte dei neutroni liberati dalla reazione ed impediscono losviluppo incontrollato di enormi quantità di energia che porterebbe all’effetto bomba
✓ dopo un centro tempo, l’uranio esaurisce la capacità di produrre energia, ma resta radioattivo, pertanto le scorie nucleari non devono entrare in contatto con l’ambiente

Il motore a scoppio✓ Il motore a scoppio delle moderne automobili è anch’esso una macchina
termica; il calore in questo caso è generato dallo scoppio di una miscela formata dalla benzina e dall’ossigeno dell’aria
✓ In figura è mostrato lo schema del motore a 4 tempi: mentre il pistone scende aria e benzina entrano nella camera a scoppio attraverso la valvola di aspirazione (aspirazione); la miscela è altamente instabile, e quando viene compressa dal ritorno del pistone (compressione) essa si incendia ed esplode (scoppio), spingendo nuovamente il pistone verso il basso; infine il pistone torna in alto e spinge i gas combusti attraverso la valvola di scarico (scarico)

Il Frigorifero✓ Il frigorifero/condizionatore è una macchina termica che estrae
calore da un vano freddo e lo trasferisce al vano più caldo✓ Il calore si trasferisce spontaneamente dal vano caldo al vano quello
freddo; dunque affinché avvenga il trasferimento inverso, è necessario compiere lavoro dall’esterno sul sistema
✓ In un frigo ideale tutto il calore QF estratto dal vano freddo è trasferito all’esterno nel vano caldo (QF = QC), ma nessuna macchina è efficiente al 100%, il calore QF estratto dal vano freddo è sempre inferiore al calore QC
ceduto all’esterno; ciò significa che una porzione di lavoro viene sprecata per riscaldare l’esterno
FQCOP
L=
✓ Si definisce coefficiente di prestazione COP (anche detto indice di efficienza energetica) il rapporto tra calore estratto QF e lavoro effettuato (in modulo):
✓ In pratica, L è l’energia spesa dall’esterno per estrarre il calore dal frigo; il COP è tanto maggiore quanto minore è la differenza tra calore estratto dal frigo QF e calore trasferito all’esterno QC
fT
cT
cQ
fQ
L
esterno
interno frigo

Il Frigorifero
✓ Attraversando la valvola di decompressione il liquido subisce una forte decompressione e riduzione di temperatura, la quale si abbassa al di sotto di quella interna del frigo TF
✓ passando attraverso la serpentina interna, il liquido assorbe calore QF
dal vano interno del frigo; essendo il liquido a bassissima pressione, l’assorbimento di calore lo ritrasforma rapidamente in gas
✓ Infine il gas torna nel compressore dove ricomincia il ciclo
✓ La sostanza che compie il ciclo termico è un fluido refrigerante, il FREON (CFCl3), un clorofluorocarburo con caratteristiche ottimali per l’efficienza del ciclo
✓ Il lavoro esterno viene compiuto dal compressore e dalla valvola di decompressione
✓ Attraversando il compressore il gas viene compresso violentemente e portato ad una temperatura maggiore della TC ambiente
✓ Attraversando la serpentina esterna al frigo, esso cede calore QC all’ambiente esterno e si trasforma in liquido ad alta pressione
QC
QF
gas a T > TC
liquido a T < TF
gas
liquido
compressore
valvola