Terapie a base di cellule incapsulate -...
Transcript of Terapie a base di cellule incapsulate -...
2
o
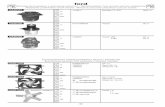
La sezione ingrandita diun impianto tubolarevuoto mostra lastruttura «schiumosa»della membrana.
Terapie a base di cellule incapsulate
IMPIANTO
Un metodo radicalmente nuovo per il trattamentodi molte malattie associa cellule vive a membrane
sintetiche che le difendono dagli attacchi immunitari
di Michael J. Lysaghte Patrick Aebischer
WL.
MEMBRANA SINTETICA
MATRICE DI SUPPORTO
CELLULA DI VITELLO
li •
SIGILLO
PORI
SECREZIONEANALGESICI
SOSTANZE
.•-----NUTRITIVEE OSSIGENO
MOLECOLA
b. IMMUNITARIA
IMMUNITARIAN
ITARIA
• • •
LIQUIDOCEREBROSPINALE
MIDOLLOSPINALE
IMPIANTO
FILOPERL'ESTRAZIONE
N
el 1994 un uomo affetto da dolori incoer-cibili divenne uno dei primi volontariche si sottoposero a un tipo di trattamen-
to completamente nuovo: l'inserimento, tramite in-tervento chirurgico, di un tubicino di plastica nel-la colonna vertebrale. Il tubicino sigillato, lungocinque centimetri e sottile come il filo di una nor-male graffetta fermacarte, incapsulava cellule di vi-tello in grado di liberare un cocktail di sostanzeantidolorifiche.
Se tutto avesse funzionato come previsto, gli an-tidolorifici avrebbero dovuto fuoriuscire dal tubici-no attraverso minuti pori e diffondersi nel midollospinale. Allo stesso tempo dal liquido cerebrospina-le circostante sarebbero penetrate nella capsula so-stanze nutritive e ossigeno per mantenere in vita lecellule; l'involucro esterno della capsula avrebbetuttavia impedito l'ingresso a cellule e molecole digrandi dimensioni, come gli anticorpi del sistemaimmunitario, che dunque non avrebbero potuto at-taccare e distruggere le cellule bovine.
Scopo ultimo di questa procedura era quello dialleviare il dolore, interrompendo il flusso di segna-li che dal midollo spinale raggiungono i centri deldolore localizzati ai livelli superiori dell'encefalo.Lo studio del 1994 aveva lo scopo di stabilire se lecellule impiantate potessero sopravvivere e rilascia-re per mesi le sostanze ad attività analgesica. Cosìfu. Successi analoghi ottenuti in seguito in diversipazienti hanno giustificato una importante speri-mentazione clinica, tuttora in corso, per valutare lapossibilità di un controllo diretto del dolore.
Ma i risultati hanno avuto implicazioni più am-pie, alimentando un crescente ottimismo nei con-fronti di questo nuovo intervento terapeutico che,con l'impiego di cellule vive protette da membranesintetiche, potrebbe migliorare il trattamento ditutta una serie di patologie. A cinque anni di di-
stanza, l'entusiasmo sollevato da questa strategia(chiamata terapia con cellule incapsulate, terapia diimmunoisolamento o terapia bioibrida) sembra in-teramente giustificato. Oggi è in fase di sperimenta-zione controllata sull'uomo, coinvolgendo un grannunero di pazienti e di centri sanitari, anche un si-stema bioibrido di supporto per il fegato. Terapiedi immunoisolamento per varie altre patologie - frale quali vi sono malattie neurodegenerative (come ilmorbo di Parkinson e la corea di Huntington),nonché emofilia, anemia e ritardo nella crescita -stanno per essere sperimentate su piccoli gruppi dipazienti o su animali. Trattamenti per la degenera-zione maculare - una comune causa di cecità - e peraltre malattie degli occhi hanno cominciato a esse-re applicati nei roditori.
La maggior parte delle applicazioni proposteprevede l'impianto di cellule incapsulate in specificisiti dell'organismo. Alcune, come il sistema di sup-porto per il fegato, incorporerebbero invece cellulee membrane in apparecchiature esterne, come acca-de con i sistemi per la dialisi renale.
La terapia di immunoisolamento è interessantein quanto non presenta i considerevoli svantaggidell'impianto di cellule libere. Come queste ultime,le cellule incapsulate in membrane possono teorica-mente svolgere funzioni divenute deficitarie in se-guito a processi patologici che hanno leso o distrut-to cellule dell'organismo. Le cellule incapsulatepossono inoltre svolgere funzioni «in più», comenel caso del controllo del dolore. Si possono persi-no ipotizzare terapie geniche con cellule genetica-mente modificate in modo da secernere proteinecodificate da geni appositamente introdotti.
Le cellule libere sono un facile bersaglio per il si-stema immunitario, a meno che non siano state pre-levate dallo stesso ricevente o da un gemello identi-co. Per questo i pazienti devono essere trattati confarmaci immunosoppressori. Viceversa, bloccandomeccanicamente l'attacco immunitario, le cellule in-capsulate in membrane plastiche potrebbero evitareil ricorso a questi trattamenti, che predispongono ainfezioni e a insufficienza renale e aumentano il ri-schio per certi tipi di cancro (linfoma).
La protezione dagli attacchi immunitari fornitadalle membrane sintetiche dovrebbe anche consen-tire il trapianto nell'uomo di cellule prelevate daanimali (xenotrapianto); se non incapsulate, essesono inutilizza bili perché gli immunosoppressoriesistenti non ne evitano efficacemente il rigetto.D'altra parte, l'uso di cellule animali potrebbe alle-viare la carenza di donatori umani di tessuti. Infine,a differenza delle cellule libere, le cellule impiantateentro una capsula in plastica possono essere recu-perate facilmente, in caso di necessità.
Una intuizione fortunataGli attuali tentativi di incapsulare cellule a scopo
terapeutico devono la loro esistenza a idee propo-
ste a metà degli anni settanta da William L. Chick.Questi, allora al Joslin Research Laboratory di Bo-ston, si dedicava alla ricerca di una cura per il dia-bete insulino-dipendente (di tipo I), che general-mente colpisce i giovani. Questa malattia insorgequando il pancreas cessa di produrre insulina, unormone che normalmente viene rilasciato in quan-tità bilanciata per regolare la concentrazione di glu-cosio nel sangue. Iniezioni quotidiane di insulinamantengono in vita i pazienti, ma la modalità disomministrazione non somiglia molto alla secrezio-ne naturale di insulina. Pertanto, i tessuti possonoessere danneggiati dall'eccesso di glucosio: col tra-scorrere degli anni, questo eccesso può portare acomplicanze quali cecità e insufficienza renale.
Chick ipotizzò che l'impianto di capsule sinteti-che contenenti isole pancreatiche - i grappoli di cel-lule che secernono l'insulina - potesse fornire l'or-mone in maniera corretta, senza richiedere la som-ministrazione di immunosoppressori. L'uso di isolepancreatiche di suino (allora la principale fonte diinsulina) avrebbe garantito, inoltre, una grande di-sponibilità di cellule.
Studi sui roditori condotti a metà degli anni set-tanta e in seguito indicarono che l'intuizione eracorretta. Sfortunatamente alcuni ostacoli tecnicihanno finora impedito alla terapia di immunoisola-mento di concretizzare le proprie potenzialità nellacura del diabete. Chick è morto nel 1998 senza ve-dere la realizzazione di ciò che aveva proposto; lesue idee pionieristiche hanno però portato a grandiprogressi su altri fronti.
Configurazioni creativeOggi esiste una varietà di sistemi con cellule in-
capsulate. Tutti, comunque, includono gli stessielementi base: cellule (di norma quelle che secerno-no sostanze utili), una matrice che fa da scudo allecellule e nel contempo ne assicura la sopravviven-za, e una membrana porosa. Oggi si sa che le cellu-le di un impianto funzionerebbero male o morireb-bero se fossero lontane più di 500 micrometri (0,5millimetri) da un vaso sanguigno o da un'altra fon-te di nutrimento. I sistemi vascolari, che deviano lacircolazione del sangue dal paziente in un tubicinodi plastica e poi la riportano al sistema circolato-rio, sono stati i primi a essere sperimentati (per lacorrezione del diabete nei roditori).
Le cellule secretorie sono poste in una camerachiusa che circonda un segmento leggermente po-roso del tubo; circolando nel dispositivo, il sanguepuò assorbire sostanze terapeutiche secrete dallecellule, fornendo al contempo ossigeno e sostanzenutritive. Se nella camera vi sono isole pancreati-che, esse cederanno insulina in rapporto alla con-centrazione di glucosio nel sangue. Per altre appli-cazioni, si possono scegliere cellule che secernonoun prodotto a livelli costanti.
Questo tipo di congegni potrà essere realizzato
Per dare sollievo a chi soffre di dolore cronico si sta studiando un impianto dicellule all'interno del canale vertebrale. Un sottile tubo di plastica, lungo alcunicentimetri, contiene cellule di vitello in grado di produrre analgesici naturali.Idealmente, queste sostanze filtreranno dall'impianto attraverso minuscoli poridella plastica, diffondendo alle cellule nervose del midollo spinale e bloccando isegnali dolorosi diretti al cervello. I pori permetteranno anche a sostanze nutritivedi piccole dimensioni e all'ossigeno di entrare nell'impianto, ma non consentirannol'accesso alle componenti del sistema immunitario che normalmente distruggonole cellule estranee. Un filo esterno consente di rimuovere l'impianto.
92 LE SCIENZE 371/ luglio 1999 LE SCIENZE 371/ luglio 1999 93
Un promettente metodo di supporto al fegato
Non tutti i sistemi con cellule incapsulate
sono impianti. I sistemi di supporto alfegato che si stanno attualmente studiandofunzionano al di fuori dell'organismo. Il loroscopo è di permettere la sopravvivenza deipazienti colpiti da insufficienza epatica fino aquando non si renda disponibile un organocompatibile per il trapianto. L'apparecchiofotografato a destra e disegnato qui sotto èstato messo a punto da un gruppo diretto daClaudy J. P. Mullon del Circe Biomedical diLexington (Massachusetts) e da Achilles A.Demetriou del Cedars-Sinai Medical Centerdi Los Angeles.
L'apparecchio estrae il sangue dal pazientee pompa il componente fluido (il plasma) at-traverso una colonna di carbone vegetale(che serve a rimuovere alcune tossine) e un'u-nità che lo arricchisce di ossigeno, prima difarlo arrivare in una camera contenente epa-tociti sani prelevati da maiali. In questa came-ra (nel dettaglio) il plasma scorre attraversotubi leggermente porosi, circondati da epato-citi. Le tossine presenti nel plasma diffondo-no alle cellule, che le convertono in sostanzenon nocive. Una volta purificato, il plasma la-scia la camera e viene ricombinato con le cel-lule ematiche; il sangue torna poi al paziente.
t
CSCEPAR
LASMAmostrata)
PRODOTTI DIDEGRADAZIONE
CELLULE(EPATOCITIDI SUINO)
• -
..• • -
CAMERACON CELLULE
OSSIGENATORE
in forma impiantabile, ma troverà probabilmen-te il maggior numero di applicazioni in apparec-chiature extracorporee, da ambulatorio, perché gliimpianti interni richiedono un intervento chirur-gico invasivo e la somministrazione protratta dianticoagulanti per prevenire la formazione di coa-guli nel tubo. Inoltre, l'eventuale rottura del tu-bo impiantato potrebbe essere causa di emorragieinterne.
Cercando metodi meno invasivi, alla fine deglianni settanta, alcuni ricercatori hanno introdottola «microincapsulazione». Per formare microca-psule si pone una singola isola pancreatica o alcunemigliaia di cellule in una goccia di soluzione ac-quosa contenente polimeri dotati di una leggera ca-rica elettrica; si bagna poi la goccia in una soluzio-ne di polimeri di carica opposta. Reagendo, i poli-meri rivestono con una pellicola la goccia di cellu-le e liquido, del diametro di 500 micrometri circa.
Le microcapsule, facili da produrre e prezioseper il lavoro sperimentale, sono tuttavia inadatteall'impiego nell'uomo. Intanto, sono molto fragili:una volta poste in sito, difficilmente possono essererecuperate e rimosse, un grave problema nel casovi siano effetti indesiderati. Per di più, il volume dimicrocapsule necessario per trattare una patologiapotrebbe essere troppo grande per adattarsi conve-nientemente al sito prescelto per l'impianto.
La forma più adatta all'impiego nell'uomo sem-bra essere quella delle macrocapsule preformate:unità inizialmente vuote che vengono caricate conuna matrice e con tutte le cellule necessarie al trat-tamento. Alcune macrocapsule sono dischi dellagrandezza di una monetina; altre sono piatte estrette, come il bastoncino che mantiene rigido ilcollo di una camicia. Normalmente, comunque, lemacrocapsule destinate all'uomo prendono la for-ma di un tubo sigillato, o capillare, lungo diversicentimetri e di diametro fra 0,5 e 1 millimetri.
Le macrocapsule sono di gran lunga più durevo-li e resistenti delle microcapsule a goccia; se ne puòverificare la tenuta prima dell'impianto e si puòprogrammarne la ricarica in loco, nell'organismo.Sono anche relativamente facili da recuperare. Illoro principale limite è il numero di cellule che pos-sono ospitare: fino a circa 5 milioni per il tubicinoe fino a 50 o 100 milioni per il disco o la laminapiatta. Quantità adeguate a molte applicazioni, manon a tutte. Se venissero ingrandite, le capsule cor-rerebbero il rischio di piegarsi e di rompersi. Inol-tre, ai margini delle regioni che si piegano si agevo-la la formazione di zone fibrotiche che possonoostacolare il flusso da e verso le cellule incapsulate.
I produttori di shunt, microcapsule e macro-capsule mirano a ottenere membrane con pori checonsentano la diffusione di molecole di peso mole-colare fino ai 50 000 dalton. Pori di queste dimen-sioni sono abbastanza piccoli per bloccare il pas-saggio delle cellule immunitarie e della maggiorparte delle molecole immunitarie, ma sono suffi-cientemente ampi per consentire l'afflusso di so-stanze nutritive e di ossigeno e l'efflusso delle pro-teine secrete dalle cellule impiantate. Nella realtà,però, le membrane presentano inevitabilmente unaserie di pori di diverse dimensioni: in questo modoalcune molecole del sistema immunitario riesconoa passare attraverso la membrana e a raggiungere
le cellule. Fortunatamente, il fenomeno non pregiu-dica la maggior parte degli impianti.
Cellule «su misura»Fino ai tardi anni ottanta, la maggior parte dei
dispositivi bioibridi si basava su cellule primarie:ossia prelevate direttamente dal tessuto del donato-re. Le cellule primarie sono utili per studi su piccolianimali, ma può essere problematico ottenerne lequantità necessarie per animali di grande taglia (in-cluso l'uomo) o per numerosi riceventi. E poichéogni donatore ha la sua storia, garantire la sicurez-za delle cellule primarie può essere un compito dienorme difficoltà. All'inizio degli anni novanta,dunque, alcuni gruppi di sperimentatori comincia-rono a lavorare su particolari linee cellulari.
Queste linee sono composte da cellule «immor-tali», capaci cioè di replicarsi indefinitamente: essesi moltiplicano rapidamente in coltura senza perde-re la capacità di svolgere funzioni specializzate, co-me la secrezione di sostanze utili. Molte cellule pri-marie proliferano difficilmente in coltura o presen-tano altri svantaggi; pertanto, per produrre una li-nea cellulare, è spesso necessario modificare le ver-sioni di partenza. Tuttavia, una volta stabilite, le li-nee cellulari possono costituire una risorsa inesau-ribile di cellule tutte uguali per il trapianto.
La potenziale utilità delle linee cellulari per le te-rapie con cellule incapsulate divenne chiara nei testsu animali che noi e altri colleghi abbiamo eseguitoa partire dal 1991. La nota linea PC-12, ricavatadal feocromocitoma (un tumore del surrene) di unroditore, aveva la capacità di secernere alti livelli didopammina, molecola carente nel cervello di pa-zienti con morbo di Parkinson. Per saggiare le pos-sibilità terapeutiche di impianti contenenti questecellule, impiantammo alcuni tubuli nel cervello didiversi animali nei quali erano state chimicamentedanneggiate le cellule che producono dopammina,così da indurre i sintomi del Parkinson. In moltisoggetti, compresi primati non umani, la proceduraha alleviato i sintomi in maniera evidentissima.
È da notare che le cellule non hanno proliferatoincontrollatamente fino a forare le capsule: hannorimpiazzato le cellule morte, ma senza permetterealla popolazione cellulare di eccedere la capacitàdell'impianto. Gli studi hanno anche attenuato il ti-more che, qualora fossero sfuggite, le cellule reseimmortali avrebbero inevitabilmente generato nu-clei cancerosi. L'immortalità non è che un passosulla strada verso il cancro; per essere veramentemaligne, le cellule devono acquisire la capacità diinvadere i tessuti circostanti, di formare un sistemadi vasi che le riforniscano di sangue e di migrare insiti lontani. La formazione di tumori è un possibilerischio nel caso di trapianti di cellule rese immorta-li fra individui della stessa specie, ma i trapianti fraspecie diverse danno meno preoccupazioni: cellulePC-12 di ratto non incapsulate non hanno genera-to tumori nel cervello di primati. Di fatto, essespesso non sopravvivono; il sistema immunitariodel ricevente le distrugge rapidamente.
Il lavoro sulle cellule PC-12 non venne prosegui-to su pazienti umani di Parkinson, forse perché fudata la precedenza ad altre promettenti terapie; tut-tavia gli studi mostrarono l'utilizzabilità di queste
linee cellulari nelle terapie di immunoisolamento.I successi ottenuti aprirono anche la via all'uso
di cellule geneticamente modificate, in quanto lecellule capaci di proliferare incorporano facilmentealtri geni e producono le proteine da essi codificate.In altre parole, si vide che la tecnologia dell'immu-noisolamento offriva anche una nuova via alla te-rapia genica. A questo scopo si dovrebbero intro-durre geni per proteine utili in linee cellulari in gra-do di sintetizzare le molecole stesse, e le cellule do-vrebbero poi essere incapsulate in impianti.
Frequentemente, i protocolli delle terapie geni-che prevedono il prelievo di cellule dal paziente,l'introduzione in esse dei geni desiderati, la molti-plicazione in coltura delle cellule così modificate eil loro reinserimento nell'organismo del paziente
con la speranza che le proteine codificate venganoprodotte nelle quantità necessarie. La produzionedelle sostanze volute da parte delle cellule ingegne-rizzate e incapsulate può essere misurata prima del-l'impianto nel paziente; inoltre le capsule potrannoessere rimosse facilmente, in caso di necessità.
Un problema irrisolto è se le linee cellulari da in-capsulare debbano essere tratte dall'uomo o daanimali. Le cellule primarie, prelevate da donatori,quasi sempre sono di origine animale, perché i tes-suti umani donati scarseggiano. Alcuni ricercatoripreferiscono anzi le linee cellulari di origine anima-li perché, se accidentalmente tali cellule fuoriuscis-sero dalle capsule, essendo totalmente estranee ver-rebbero subito distrutte dal sistema immunitario.
Per ottenere le proteine umane desiderate, si p0-
94
LE SCIENZE 371/ luglio 1999 LE SCIENZE 371/ luglio 1999
95
Questo tubicinocontenente cellule dicriceto è stato rimossodalla colonna vertebraledi un soggetto umanodopo 17 settimane. Almomentodell'estrazione, le cellulesecernevano ancora unaproteina ad azioneterapeutica e lamembrana incapsulantenon presentava alcundanno. Questi risultatifanno sperare cheimpianti contenenticellule prelevate daspecie non umanepossano funzionare perlunghi periodi.
trebbero ovviamente inserire in cellule animali gliopportuni geni umani. Altri preferiscono linee cel-lulari di origine umana sia perché le cellule umaneincapsulate tendono a conservarsi meglio, sia per-ché non si rischia che agenti patogeni animali ven-gano trasferiti all'uomo. Per aumentare la sicurez-za, le linee cellulari umane potrebbero essere modi-ficate in modo da indurre un rapido riconoscimen-to immunitario in caso di rottura delle capsule.
Le cellule incapsulate, geneticamente modificateo no, spesso servono essenzialmente come stru-menti per somministrare proteine terapeutiche. Maqueste si possono anche somministrare per iniezio-ne. Perché, allora, ricorrere all'impianto di cellule?
La terapia con cellule incapsulate può esseremolto vantaggiosa quando l'inoculazione direttanon permette di raggiungere la concentrazione ne-cessaria nel sito bersaglio, come avviene nel caso diun tumore o qualora occorra superare la barrieraematoencefalica (un filtro naturale che blocca mol-te sostanze trasportate dal sangue, impedendo lorodi pervenire al cervello e al midollo spinale). Le cel-lule incapsulate potrebbero anche essere utili quan-do la proteina voluta è troppo instabile per esserepreparata come farmaco, ovvero quando è impor-tante riprodurre un andamento naturale della sin-tesi di proteina (come nel caso del diabete).
Studi sull'uomoLe linee cellulari geneticamente modificate pro-
babilmente predomineranno nei congegni bioibrididel futuro. Ma alcune applicazioni che coinvolgonocellule primarie, essendo state studiate più a lungo,hanno già raggiunto le fasi più avanzate della speri-mentazione clinica. Un esempio, messo a punto danoi e dai nostri collaboratori, è il trattamento per ildolore cronico già descritto. Otteniamo le celluleper gli impianti dalle ghiandole surrenali di vitelliallevati in condizioni estremamente controllate.Certi componenti di queste ghiandole - le cellulecromaffini — sono in grado di sintetizzare e liberarecatecolammine e altre sostanze di effetto analgesi-co. Dopo la purificazione accurata di circa tre mi-lioni di queste cellule, le inseriamo in fibre cave, si-gillate alle estremità, legate a un filo (per poterle re-cuperare) e le impiantiamo, con una procedura mi-nimamente invasiva, nella colonna vertebrale.
Quando, a metà degli anni novanta, i chirurghiche collaboravano con noi videro che tali impiantipotevano funzionare per mesi nei pazienti, si reseroconto che questa metodologia consentiva un buoncontrollo del dolore. Molti pazienti riportarono unmiglioramento significativo della qualità della vitae una riduzione nell'uso della morfina. Ma questiesperimenti non includevano un gruppo di con-fronto che ricevesse un placebo (per esempio, unacapsula vuota), sicché non potevamo essere certiche il trattamento fosse veramente affidabile. Lasperimentazione clinica allargata ora in corso coin-volge più di 100 pazienti ed è progettata in modospecifico a valutare il sollievo dal dolore. Respon-sabile dell'esperimento è Moses B. Goddard dellaCytoTherapeutics di Lincoln (nel Rhode Island).
A prescindere dal risultato finale, i dati che pos-sediamo già dimostrano che le cellule immunoiso-late di origine animale possono sopravvivere per
mesi nel sistema nervoso centrale di soggetti chenon assumono alcun farmaco immunosoppressore.Viceversa, nessun organo animale trapiantato nel-l'uomo senza previo incapsulamento è sopravvissu-to, anche quando il trapianto si accompagnava aun'aggressiva terapia con immunosoppressori.
Anche il dispositivo che integra il funzionamentodel fegato fa affidamento su cellule prelevate diret-tamente da animali. In un fegato sano, gli epatocitiassorbono le tossine e le demoliscono riducendolea forme innocue. Quando il fegato non svolge piùquesta funzione, le tossine possono accumularsi fi-no a livelli letali. Il trapianto di fegato può salvare ipazienti, ma purtroppo molti muoiono prima chesi trovi un donatore compatibile. I sistemi epaticibioibridi allo studio mirano a tenere in vita i pa-zienti fino al reperimento di un donatore adatto.
Questa terapia di «ponte verso il trapianto» ri-chiede un dispositivo per la circolazione extracor-porea. Essenzialmente, il sangue del paziente èpompato in una camera chiusa nella quale un seg-mento semiporoso del tubo che trasporta il sangueè circondato da una sospensione di epatociti dimaiale. Gli epatociti assorbono le tossine dal tor-rente sanguigno e le degradano, in modo che ilsangue purificato torni all'organismo e riprenda lasua circolazione. Contrariamente all'impianto an-tidolorifico, in cui si somministrano alcuni mil-ligrammi di cellule destinate a funzionare conti-nuativamente per mesi o anni, l'apparecchiaturaper il sostegno epatico può ospitare dai 20 ai 200grammi di epatociti purificati utilizzati per 6-24ore per volta.
In uno studio iniziale ristretto a 40 pazienti coninsufficienza epatica allo stadio terminale, l'appa-recchiatura funzionò come si era sperato. Quel ri-sultato, riportato nel 1998, ha aperto la strada auna sperimentazione controllata più estesa in pre-parazione negli Stati Uniti e in Europa. Le aspetta-tive ci sono e si hanno ragioni per credere che inparticolari circostanze, come nell'insufficienza epa-tica acuta da eccessiva assunzione di acetaminofe-ne, il fegato possa rigenerarsi senza dover ricorrereal trapianto. Tuttavia l'ottimismo deve essere tem-perato dall'esperienza: precedenti tentativi di met-tere a punto sistemi di supporto per il fegato chehanno avuto successo nei test iniziali, si sono poi ri-velati deludenti in esperimenti allargati.
Per tutte le applicazioni finora discusse, è neces-sario tenere presente la possibilità che geni prove-nienti da virus animali non ancora noti possanonascondersi nelle cellule prelevate e causare perico-lose infezioni nel ricevente. (Rigorosi metodi discreening assicurano che non possa venire trasmes-so alcun agente patogeno già conosciuto.) Fortuna-tamente le capsule sintetiche dovrebbero costituireuna formidabile barriera alla trasmissione di virusanimali e, finora, nessun paziente ha acquisitoun'infezione, anche benigna, dalle cellule impianta-te. Nonostante ciò, i ricercatori sono guardinghi enon trascurano la possibilità, per quanto poco rea-listica, di una diffusione di virus sconosciuti.
Benché meno avanzati, sono cominciati ancheesperimenti di terapia genica nell'uomo. Due picco-li studi si concentrano su patologie del sistema ner-voso centrale. La prima prova clinica con cellule in-capsulate modificate geneticamente riguardava la
sclerosi laterale amiotrofica (SLA), una malattianeurodegenerativa che si manifesta con la distru-zione dei nervi spinali che controllano i muscoli.Nel 1996 sei pazienti hanno ricevuto impianti con-tenenti una linea cellulare - ricavata da cellule delrene di neonato di criceto - nella quale era stato in-serito il gene per una proteina chiamata fattoreneurotrofico di derivazione ciliare (Ciliary-DerivedNeurotrophic Factor o CNTF). Questo gene erastato scelto in quanto precedenti studi avevano in-dicato che il fattore era in grado di ritardare il dete-rioramento dei neuroni che normalmente risultanodistrutti nei pazienti di SLA. Il protocollo era moltosimile a quello usato contro il dolore cronico: unpiccolo impianto a tubicino riempito di cellule fuimpiantato nella colonna vertebrale.
Lo studio verificò che le cellule riuscivano a so-pravvivere e a liberare quantità potenzialmente te-rapeutiche di CNTF per i tre mesi dell'esperimento.Il trattamento però non sembrò ritardare la pro-gressione della malattia; va tuttavia ricordato che iltest era eseguito su un numero troppo ristretto disoggetti e per una durata troppo breve per essereparticolarmente significativo a questo riguardo.L'esperimento ha indicato comunque che, identifi-cati il gene o la miscela di geni adatta al trattamen-to della SLA, le cellule incapsulate potrebbero esse-re un buon mezzo per far pervenire le sostanze daessi specificate al sistema nervoso centrale.
Impianti contenenti la stessa linea cellulare stan-no ora per essere valutati in pazienti con corea diHuntington, una malattia degenerativa che pro-gressivamente uccide certi neuroni cerebrali. Que-sta volta, comunque, le capsule sono state posizio-nate nel cervello, e precisamente nelle cavità pienedi liquido cerebrospinale che prendono il nome diventricoli cerebrali. Questo protocollo di terapiagenica è condotto a Parigi e la sua applicazione èappena cominciata. È iniziato anche un buon nu-mero di esperimenti su animali allo scopo di valu-tare tecniche di immunoisolamento per la sommi-nistrazione di terapia genica; parecchi di essi sonoelencati nella tabella a pagina 98.
La particolare sfida del diabeteSe la ricerca sull'immunoisolamento sta svilup-
pandosi bene in molte aree, come mai nessuno, do-po oltre 20 anni di tentativi, è ancora riuscito aperfezionare un procedimento di incapsulamentodi isole pancreatiche per curare il diabete?
Dal 1977, quando Chick e colleghi trattaronocon successo il diabete nei roditori, almeno una de-cina di gruppi di ricerca in tutto il mondo ha ripe-tuto quell'esperimento, utilizzando un'ampia seriedi tipi di impianti in vari modelli animali della ma-lattia. Ma la terapia di immunoisolamento basatasulle isole pancreatiche non funzionò altrettantobene nella maggior parte delle specie più grandi,come cani e scimmie, e nell'uomo. I risultati positi-vi sono sempre casi singoli. Inoltre, a un più atten-to esame, molti dei successi riportati sono stati rag-giunti solo con l'aiuto di immunosoppressori o diiniezioni di insulina.
Gran parte delle difficoltà deriva dal puro e sem-plice numero di isole pancreatiche richieste per glianimali più grandi e per l'uomo: circa 700 000,
MICROCAPSULECapacità: da 1000 a 5000 cellule
MACROCAPSULECapacità: da 1 000 000a 100 000 000 di cellule
DIMENSIONI REALI5 cmx 1 cmx 500 pm
DISPOSITIVI A FLUSSO TER
Capacità: oltre1 000 000 000 di cell e
DIMENSIONI REALI
Alloggiamento:circa 7 cm di diametro
Tubicino:circa 6 mm di diametro
I sistemi a celluleincapsulate varianoper dimensioni eforma. Lemicrocapsule sonominute bolle diplastica contenenticellule e liquido. Lemacrocapsule, dellalunghezza di alcunicentimetri, sonoprestampate e poiriempite con cellule e unamatrice di supporto. Il
«picciuolo» all'estremitàdell'impianto è un'apertura per ilriempimento, che viene rimossaprima dell'inserimento. La «coda» blusul dispositivo in basso fa parte del filo per l'estrazione. Nei dispositivi più grandiil sangue passa attraverso un tubo di plastica, un segmento del quale è circondatodalla camera che contiene le cellule (in forma di anello); il modello qui mostratoè impianta bile. I disegni sulla destra mostrano le dimensioni reali.
DIMENSIONI REALI500 micrometri (gin)
di diametro
DIMENSIONI REALI5-7 cm x 800 lin
96 LE SCIENZE 371/ luglio 1999LE SCIENZE 371/luglio 1999 97
Patologia
Sclerosi lateraleamiotrofica (SLA)
Corea di Huntington
Morbo di Parkinson
Anemia
Emofilia
Nanismo
Diabete di tipo II (noninsulino-dipendente)
Degenerazionemaculare
Prodotto genico
Fattore neurotrofico di derivazione ciliare (CNTF), unaproteina che impedisce la degenerazione dei neuroni
CNTF
Fattore neurotrofico di derivazione gliale (GDNF), unaproteina che protegge i neuroni secretori di dopammina
Eritropoietina (EPO), una proteina che stimola laproduzione di globuli rossi
Fattore VIII o fattore IX, proteine importanti per lacoagulazione del sangue
Ormone della crescita (HGH), una proteina che stimola losviluppo corporeo
Peptide-1 glucagone-simile (GLP-1), una proteina chestimola la secrezione di insulina
CNTF
Situazione
L'impianto nella colonna vertebrale ha superato lasperimentazione di fase I nell'uomo (in cui si valuta lasicurezza in un piccolo numero di soggetti)
L'impianto in un ventricolo cerebrale è nella fase I dellasperimentazione sull'uomo
L'impianto in un ventricolo cerebrale è allo studio neiprimati non umani
L'impianto sottocutaneo è allo studio in primati nonumani e in roditori
L'impianto sottocutaneo è allo studio in cani e roditori
L'impianto sottocutaneo è allo studio in maiali e roditori
L'impianto sottocutaneo è allo studio in roditori
L'impianto oculare è allo studio in roditori
Applicazioni di terapia genica in corso di studio Cute artificiale:il primo prodottodell'ingegneria dei tessutiLo scorso anno è stato immesso sul mercato il primo sostituto sinteticodella cute umana; a mesi sarà disponibile un secondo prodotto analogo.I ricercatori delle società produttrici spiegano come sono arrivati al risultato
La storia di Organogenesis
MICHAEL J. LYSAGHT e PATRICK AEBISCHER collabo-rano da tempo allo sviluppo di organi bioibridi. Lysaght è inge-gnere biomedico e ha dato molti contributi all'applicazione del-le membrane sintetiche in medicina; è docente alla Brown Uni;versity e presidente del Rhode Island Center for Cellular Medi-cine. Aebischer, medico e neurologo, si concentra ora sullo svi-luppo di applicazioni terapeutiche della medicina molecolare.Dirige la Divisione di ricerche in chirurgia e il Centro per la te-rapia genica dell'Università di Losanna; fa anche parte del cor-po docente del Politecnico federale di Losanna.
AEBISCHER P. e LYSAGHT M. J., Immunoisolation and CellularXenotransplantation in «Xeno», 3 n. 3, giugno 1995.
LANZA ROBERT P., COOPER DAVID K. e CHICK WILLIAM L., Gli xeno-trapianti in «Le Scienze» n. 351, novembre 1997.
LANZA ROBERT P., LANGER ROBERT e CHICK WILLIAM L., Princi-ples of Tissue Engineering, R. G. Landes Company, 1997.
EMERICH D. F. e altri, Treatment of Central Nervous SystemDiseases with Polymer-Encapsulated Xenogeneic Cells in CeliTransplantation (or Neurological Disorders, a cura di ThomasB. Freeman e Hakan Widner, Humana Press, 1998.
" n7.
o
o
Le patologie elencatesono alcune fra quelleche potrebbero esseretrattate con impianti dicellule incapsulatemodificategeneticamente. Lecellule impiantate,dotate del gene checodifica per unaproteina ad azioneterapeutica, possonopotenzialmentesintetizzare la sostanzautile a tempo indefinitoe, spesso, proprio nelsito dell'organismodove è più necessaria.
contenenti quasi due miliardi di cellule «beta» cheproducono insulina, un quantitativo 1000 voltesuperiore, per volume, a quello degli impianti clini-ci finora eseguiti con successo. Nei ratti il diabetepuò essere trattato con circa 500 isole pancreati-che, che generalmente i tecnici estraggono manual-mente dal pancreas di donatori. Prelevare a mano700 000 isole pancreatiche è impossibile, e le tecni-che semiautomatiche non sono ancora in grado diisolare in modo accettabile i quantitativi richiesti.Inoltre, nel pancreas ciascuna isola pancreatica haun rifornimento sanguigno suo proprio; le iso-le pancreatiche soffrono nell'ambiente «asfittico»delle capsule, dove l'irrorazione è scarsa. Per que-ste e altre ragioni siamo d'accordo con coloro chehanno concluso che un pancreas semiartificiale im-piantato, basato su isole pancreatiche incapsulate,rimarrà molto probabilmente un obiettivo difficil-mente raggiungibile per l'immediato futuro.
Una nuova proposta, però, potrebbe consentiredi superare l'impasse. Usando sofisticati metodi,tre gruppi di ricerca stanno sviluppando linee cel-lulari che secernono insulina in risposta agli stessicomplessi segnali che inducono la secrezione di in-sulina nel pancreas sano. L'obiettivo è quello di
creare cellule che producano più insulina delle cel-lule beta naturali (così che ne servano di meno) eche siano adatte a sopravvivere nell'ambiente «po-vero» di un impianto. Cinque anni fa l'ottenimen-to di cellule di questo tipo sarebbe stato considera-to impossibile, ma i recenti progressi della biologiamolecolare e cellulare sono stati straordinari.
Ci aspettiamo di veder sperimentare in grandianimali linee cellulari insulino-secretrici sensibili alglucosio entro cinque anni al massimo. E siamocerti che alcune di quelle linee arriveranno rapida-mente alla sperimentazione clinica. Alcuni espertiritengono che questa previsione sia troppo cauta,mentre altri pensano che l'obiettivo richiederàmolto più tempo. Ma tutti concordano che unpancreas artificiale o una sua versione bioibridadebba continuare a essere una priorità per la medi-cina del XXI secolo. Con il progredire delle ricer-che, dovrebbero manifestarsi nuove opportunitàper l'applicazione della terapia di immunoisola-mento. Prevediamo anzi che nei prossimi 20 annila terapia con cellule incapsulate emergerà dallostadio sperimentale per assumere un ruolo chiavenel trattamento di alcune delle malattie più ostina-te e debilitanti.
ha Organogenesis abbiamo realizzato una cu-te artificiale, Apligraf, che ha la particola-rità di essere composta da entrambi gli stra-
ti che costituiscono la cute umana, il derma (stratointerno) e l'epidermide (strato esterno). Nel maggio1998 Apligraf è stata approvata come presidio bio-medico dalla Food and Drug Administration degliStati Uniti, diventando il primo prodotto contenen-te cellule umane viventi a ottenere tale valutazione.
A un certo punto della progettazione di Apligraf,abbiamo dovuto decidere se tentare di ottenere su-bito l'approvazione per prodotti che erano, in effet-ti, i precursori di Apligraf - derma ed epidermideseparati - oppure se continuare la ricerca per svi-luppare un prodotto completo, confidando di riu-scirci prima dei nostri concorrenti. Abbiamo pun-tato su una cute sintetica a due strati in quanto èmolto simile alla cute naturale, e si sa da tempo chegli innesti effettuati con quest'ultima funzionanobene. Inoltre il substrato costituito dal dermaavrebbe potuto facilitare l'attecchimento dello stra-to di epidermide. L'obiettivo è stato pienamenteraggiunto. L'idea di Apligraf risale ad almeno duedecenni fa. Quando lavorava al Massachusetts In-stitute of Technology, Eugene Bell notò che i fibro-blasti - le cellule che formano il derma - possono in-filtrarsi in un gel di collagene e trasformarlo in unamatrice fibrosa vivente. Il collagene è una compo-nente fondamentale della matrice extracellulare, la«colla» biologica che tiene insieme le cellule. Nel1981 egli scoprì che i cheratinociti - le cellule dellostrato epidermico - crescevano sul substrato delderma e formavano un rudimentale equivalentedella cute. Trovò anche che il tessuto così costruitopoteva essere innestato su ratti. Organogenesis fufondata nel 1985 per sfruttare commercialmente la
di Nancy Parenteau
tecnologia ideata da Bel!. Io ho dato il contributodelle mie conoscenze sulla biologia dei cheratinoci-ti dal 1986, quando sono entrata nella società.
Eravamo certi che una cute artificiale a due stra-ti avrebbe avuto successo dal punto di vista clinico.Un sostituto temporaneo della pelle, composto dacollagene e un altro costituente della matrice extra-cellulare, era stato creato da John F. Burke, alloraallo Shriners' Hospital di Boston, e da loannis V.Yannas del MIT ed era risultato efficace, in speri-mentazioni cliniche su vittime di ustioni, nel preve-nire la deidratazione e nel favo-rire la guarigione del derma.Inoltre Howard Green dellaHarvard Medical School avevaescogitato un modo per coltiva-re foglietti di cellule di epider-mide da applicare sulle ustioni.
Un ostacolo iniziale fu otte-nere collagene adatto alla cre-scita delle cellule. I fornitorinon potevano garantirci unaforma di collagene abbastanzapura e con le proprietà richie-ste. Paul Kemp, della nostra società, e colleghi mi-sero a punto un metodo per ricavare collagene datendini di bovini; inoltre, idearono una tecnica disterilizzazione chimica a freddo che elimina ognicontaminazione senza danneggiare il collagene.
Poi i miei colleghi e io cercammo di trovare lecondizioni di coltura tali da fornire un numero otti-male di cheratinociti umani viventi. All'epoca,però, i metodi per la coltura di cheratinociti eranocoperti da brevetti detenuti da altre società; e, co-munque, alcuni aspetti di quelle tecniche non eranoadattabili ai nostri scopi. Cercammo dunque di svi-
Apligraf assume laforma della piastra in cuiè stato coltivato. Leprove cliniche hannodimostrato che puòfavorire la guarigionedei pazienti che soffronodi ulcere venose, le qualisono causate da difettidella circolazionesanguigna negli artiinferiori.
98 LE SCIENZE 371/ luglio 1999 LE SCIENZE 371/luglio 1999 99