Retrovirus e HIV
-
Upload
pattada3333 -
Category
Documents
-
view
229 -
download
0
Transcript of Retrovirus e HIV
-
7/22/2019 Retrovirus e HIV
1/96
Retrovirus Classificazione:La famigliaRetroviridaeviene tradizionalmente suddivisa in 3 sottofamiglieBasandosi sulla patogenicit:Oncovirusche causano trasformazione cellulare in vitro e in vivo Spumavirus che causano effetti citopatici in vitro ma non ancora associati adalcuna patologia
Lentivirus che inducono lentamente progressive compromissioni del sistemaimmunitario e neurologiche
Recentemente sottodivisi in 7 generi, molto diffusi nel regno animale, con tropismo
per diversi tessuti e associati a patologie talvolta molto diverseIsolati e caratterizzati due retrovirus patogeni per luomo:HIV human immunodeficiency virus(un lentivirus): due sierotipi HIV-1 e HIV-2 HTLV human T Lymphotropic virus(un oncovirus): due sierotipi HTLV-1 e HTLV-2
-
7/22/2019 Retrovirus e HIV
2/96
Ultima classificazione taxonomica della famiglia dei Retrovirus
-
7/22/2019 Retrovirus e HIV
3/96
Genus Example isolates Comments
Avian-leukosis-sarcoma (s) Rous sarcoma virus (RSV) exogenous, oncogene-containing
Rous associated virus 0 endogenous, benign
Rous associated virus 1 to 50 exogenous, cause B-lymphoma, and
other diseases
Mammalian C-type (s) Feline leukemia virus exogenous, causes T-cell lymphoma,
immunodeficiency and other
diseases
Simian sarcoma virus exogenous, oncogene-containing
B-Type viruses (s) Mouse mammary tumor virus endogenous and exogenous, causes
mostly mammary carcinoma
D -Type viruses (s) Mason-Pfizer monkey virus exogenous, unknown pathogenicity
HTLV-BLV viruses (c) Human T-cell leukemia virus exogenous, causes T-cell lymphoma
(HTLV)-1 and -2 and neurological disorders
L entiviruses (c) Equine infectious virus (EIAV) exogenous, causes autoimmune
hemolytic anemia
Visna/maedi virus causes encephalopathy and lung
disease in sheep
Caprine arthritis-encephalitis virus causes encephalopathy and
(CAEV) immune deficiency
Bovine immunodeficiency virus (BIV) causes lymphadenopathy and
neurological disorders
Feline immunodeficiency virus (FIV) causes immune deficiency
Simian immunodeficiency virus (SIV) causes immune deficiency
and encephalopathyHuman immunodeficiency virus causes immune deficiency
(HIV)-1 and -2 and encephalopathy
Spumaviruses (c) Simian foamy virus (SFV) exogenous, apparently benign
Human foamy virus exogenous, apparently benign
Table 1.1 Retroviruses Genera. (s) Indicate simple and (c) complex retroviruses.
-
7/22/2019 Retrovirus e HIV
4/96
Retrovirus
Caratteristica:Il virione, grossolanamente sferico, con diametro di 100-120 nm,
contiene due catene identiche di RNA genomico ss a polarit
positiva, un enzima DNA polimerasi RNA dipendente, la trascrittasi
inversa, che retrotrascive lRNA virale in DNA, che viene poi
integrato nel genoma della cellula ospite a opera dellintegrasi
virale.
Tutti presentano 3 geni: gag, pol, env
-
7/22/2019 Retrovirus e HIV
5/96
Around 8% of the human genome is derived from sequences withsimilarity to infectious retroviruses, which can be easily recognized
because all infectious retroviruses contain at least all three genes,
including gag,poland envas well as long terminal repeats (LTRs). These sequences, human endogenous retroviruses (HERVs),represent the remnants of ancestral retroviral infections that became
fixed in the germline DNA.
Subsequent retrotransposition events amplified these elements to ahigh load within genome, during early Old World primate radiation.
Human endogenous retroviruses (I)
-
7/22/2019 Retrovirus e HIV
6/96
STRUTTURA DEI RETROVIRUS
- Membrana lipidica
- Involucro (ENVELOPE) glicoproteico
- CORE virale interno costituito da diverse proteine
- RNA virale a singola elica (circa 10 kb) in due copie identiche tr
- Trascrittasi inversa
- Altre proteine funzionali e regolatorie virali.
-
7/22/2019 Retrovirus e HIV
7/96
TRASCRITTASI INVERSA (RT/RNAseH)
Enzima virale essenziale per la replicazione con 3 funzioni:
-DNA-Polimerasi RNA-Dipendente
-DNA-Polimerasi DNA-Dipendente (simile alle DNA-Polimerasi cellulari).
-RNAsi H (simile alle RNAsi cellulari).
Circa 30 molecole per virione.
DNA-polimerasi ad alta percentuale di errore (1000/10000 volte superiore alla
DNA-Polimerasi cellulari). Ci spiega, almeno in parte, la frequente insorgenzadi mutanti.
Leggendo il filamento di RNA-transfer (primer) costruisce un filamento di DNA
virale (Minus Strand analogo allRNA virale) utilizzando le basi puriniche e
pirimidiniche trifosforilate dagli enzimi cellulari.
Per la sua peculiarit il principale bersaglio dei farmaci anti-HIV.
Lalta percentuale di errori rende le particelle virali antigenicamente
disomogenee, e ci rende conto della difficolt di identificare vaccini efficaci
contro i diversi ceppi virali.
-
7/22/2019 Retrovirus e HIV
8/96
CICLO REPLICATIVO DEI RETROVIRUS
- Adesione e penetrazione nella cellula
- UNCOATINGe liberazione del genoma virale nel citoplasma.
- Retrotrascrizione (via RT) del genoma a RNA singola elica in DNA a
doppia elica.
- Digestione (via RNAsi H) dellRNA genomico-virale.
- Circolarizzazione del DNA virale e penetrazione nel nucleo.
- Integrazione (via integrasi) nel DNA cellulare random.
- Stato di quiescienza (durata variabile).
- Trascrizione di RNA messaggero dal DNA virale.
-Scissione enzimatica (via proteasi virali) delle poliproteine in proteinemature.
- Glicosilazione delle proteine.-Assemblaggio delle proteine con lRNA virale genomico neoformato.-Formazione di particelle virali complete.-Fuoriuscita della cellula con meccanismo di BUDDING.
-
7/22/2019 Retrovirus e HIV
9/96
Schema del ciclo replicativo dei retrovirus
-
7/22/2019 Retrovirus e HIV
10/96
Relazioni filogenetiche allinterno della famiglia dei Retrovirus
-
7/22/2019 Retrovirus e HIV
11/96
Electron micrographs of representative virion particles. The diameters
of all the particles are approximately 100 nm.Panel A: Type A particles. Intracisternal A particles in theendoplasmic reticulum.Panel B: Betaretrovirus. Mouse mammary tumor
virus (MMTV), type B morphology (top, intracytoplasmic particles;middle, budding particles; bottom, mature extracellular particles).
Panel C: Gammaretrovirus. Murine leukemia virus (MLV) type Cmorphology (top, budding; bottom, mature extracellular particles).Panel D: Alpharetrovirus. Avian leukosis virus, type C morphology
(top, budding; bottom, mature extracellular particles). Panel E:Betaretrovirus. Mason Pfizer monkey virus (MPMV), type D
morphology (top, intracytoplasmic A-type particles; middle, budding;
bottom, mature extracellular particles). Panel F: Deltaretrovirus.Bovine leukemia virus (BLV) (top, budding; bottom, mature
extracellular particles). Panel G: Lentivirus. Bovineimmunodeficiency virus (top, budding; bottom, mature extracellularparticles).
Panel H: Spumavirus. Bovine syncytial virus (top, intracytoplasmicparticles; middle, budding; bottom, mature extracellular particles).
Panel I: Betaretrovirus. Mouse mammary tumor virus, type Bmorphology, visualized by negative staining with phosphotungsticacid.
Panel J: Gammaretrovirus, visualized as pseudoreplica stained withuranyl acetate. Panel K: Lentivirus. Purified cone-shaped cores
of equine infectious anemia virus (top, cores visualized by shadowcasting technique; bottom, cores visualized by negative stainingwith phosphotungstic acid). Panel L: Budding retroviral particles
visualized by scanning electron microscopy. (Micrographs arecourtesy of Dr. Matthew Gonda and reproduced from ref. 708, with
permission.)
-
7/22/2019 Retrovirus e HIV
12/96
-
7/22/2019 Retrovirus e HIV
13/96
Strutture schematiche di RNA e DNA dei retrovirus
durante il ciclo replicativo
Reverse transcription of the RNA soon after infection involves the duplication and translocation of u5 and u3sequence blocks, and it results in the formation of a double-stranded DNA molecule containing two terminal LTRs.The integration of the DNA genome occurs at the terminal sequences, establishing a provirus that is collinear withthe preintegrative DNA.
The forward transcription of the provirus is initiated at the U3/R border in the provirus; the resulting RNAs arecleaved and polyadenylated at the r/u5 border, recreating a viral RNA genome (bottom) identical to the infecting
RNA.
-
7/22/2019 Retrovirus e HIV
14/96
Modello di retrotrascrizione ad opera della RT
PBSPrimer binding siteInnesco per la RT e 3del tRNA lisinaPer la sintesi di DNA -
PPTPoypurine tractInnesco per la RT per la sintesi del DNA +
DNA -DNA +
-
7/22/2019 Retrovirus e HIV
15/96
Integrazione del DNA virale nel DNA della cellula ospite
con formazione del provirus integrato
Sequenza arbitraria nel DNA cellulare
The precursor for the formation of the provirus is a linear double-stranded DNA containing two
LTRs (boxes) and with inverted repeat sequences at the termini.
-
7/22/2019 Retrovirus e HIV
16/96
Integrazione del DNA virale nel DNA della cellula ospite
The full-length linear DNA (top) is processed by the viral integrase by the endonucleolytic removal of
dinucleotides at the 3 termini. The resulting DNA is then used in a strand transfer reaction in which the 3 OH
ends make staggered breaks in the two strands of the target site DNA. The resulting gapped intermediate is
presumably repaired by host enzymes.
-
7/22/2019 Retrovirus e HIV
17/96
Esempi di cleavaggio dei polipeptidi Gag-Pol
nei diversi retrovirus
Proteine mature funzionali
presenti nel virione
-
7/22/2019 Retrovirus e HIV
18/96
HIVAgente eziologico della sindrome da immunodeficienza acquisita (AIDS)
1981- Descrizione della sindrome in uomini omosessualicaratterizzata da
infezioni opportunisticheSarcoma di KaposiLinfomi e altri tumori 1983- Isolamento dellHIV-1
1985- Sequenziamento del genoma
1987- Isolamento dellHIV-2
-
7/22/2019 Retrovirus e HIV
19/96
HUMAN IMMUNODEFICIENCY VIRUS (HIV):
The causative agent of
acquired immunodeficiency syndrome (AIDS)
?
28 years
10 years
2009
-
7/22/2019 Retrovirus e HIV
20/96
SIVcpz (Simian Immunodeficiency Virus of chimpazees) immediate precursor of HIV-1The circumstances leading to the cross-species transfer cpz-human are still unknown
-
7/22/2019 Retrovirus e HIV
21/96
HIV-1
*M(major ) with 9 pure subtypes: A, B, C, D, F, G, H, J, K
> 40 major circolating recombinant forms (CRFs) *O(outlier)*N(non M-non O)
Variation between clades 20-30%
Variation intra-clade 10-15%
Wainberg M.A
3 Groups
-
7/22/2019 Retrovirus e HIV
22/96
HIV-1
*M(major ) with 9 pure subtypes: A, B, C, D, F, G, H, J, K
> 40 major circolating recombinant forms (CRFs) *O(outlier)*N(non M-non O) & *P (from gorillas)
Wainberg M.A
4 Groups
Plantier et al, Nature Medicine, 2009
-
7/22/2019 Retrovirus e HIV
23/96
Non-B subtypes accountfor 88% of HIV infections
Osmanov et al., 2002
-
7/22/2019 Retrovirus e HIV
24/96
-
7/22/2019 Retrovirus e HIV
25/96
Phylogenetic relationship between HIV subtypes
-
7/22/2019 Retrovirus e HIV
26/96
HIV-1 subtypes differ in disease progression
Kanki et al., 1999. J Infect Dis
-
7/22/2019 Retrovirus e HIV
27/96
HIV-1 retrovirus caratterizzato da un genoma alquanto complesso
se paragonato a quello degli altri retrovirus: 9 geni
diversi.- ciclo replicativo erelativamente complesso.
- Ha effetto citopatico, ossia uccide, di norma, le cellule
che infetta. Leffetto citopatico, tuttavia, richiede alcuni
giorni prima di manifestarsi (alcuni virus, es. a RNA,
richiedono solo poche ore). - Il suo ciclo replicativo nei linfociti CD4 infettati etanto
piurapido quanto piui linfociti sono attivati.
-
7/22/2019 Retrovirus e HIV
28/96
GAG
POL
ENV
-
7/22/2019 Retrovirus e HIV
29/96
ssRNA
gp120 SU gp41 TM
p17 MA p24 CA p7 NC
p66 51 RT p32 INp10 PR
vpr p15 Vpr
Fig. 1.2 HIV-1 mature virion structure. Modified fromWebPath resource collection(Klatt,
2000). Typical lentivirus particles are spherical, about 80-110 nm in diameter, and consist of a
lipid bilayer membrane surrounding a conical core. The two identical single-stranded RNA(ssRNA) molecules, of about 9.2kB each, are associated with the nucleocapsid proteins p7gag
(NC). They are packed into the core along with virally encoded enzymes: reverse transcriptase
(RT), integrase (IN), and protease (PR). P24gag comprises the inner part of the core, the capsid(CA). The p17gag protein constitutes the matrix (MA) which is located between the
nucleocapsid and the virion envelope. The viral envelope is produced by the cellular plasma
membrane and contains the protruding viral Env glycoproteins: gp120 surface glycoprotein (SU)
and gp41 transmembrane protein (TM). A mong the accessory proteins encoded by HIV-1,
certainly Vpr and perhaps Nef and Vif are packaged into virions, although the precise location
have not yet been e lucidated. Neither the other accessory protein Vpu nor the regulatory proteins
Tat and Rev have been detected in virion particles.
-
7/22/2019 Retrovirus e HIV
30/96
LTR(long terminal repeat): Sequenze laterali del genoma di HIV che controllano e attivano la
replicazione virale, attraverso una fine regolazione dellespressione dei geni dell'HIV, e una
interazione con i geni e le proteine della cellula ospite. Geni codificanti per proteine strutturaliGAG= Gene codificante per le proteine di struttura:p17matrice, p24capside, p7
nucleocapsidePOL= Gene codificante per gli enzimi:- Transcrittasi inversa: DNA polimerasi RNA dipendente, sintetizza DNA da RNA e DNA
(genera errori:priva di attivit di correzione di bozze)-Ribonucleasi H:degrada RNA diibridi RNA/DNA
- Integrasi : integra il DNA virale nel genoma della cellula ospite (provirus)- Proteasi: scinde in modo specifico le poliproteine virali Gag/Gag-Pol in proteine mature
e funzionali del virus ENV= Gene codificante per le proteine dellenvelope:
- gp 120: Glicoproteina che lega il recettore CD4 sulla superficie cellulare, e
permette linizio del ciclo replicativo. Tramite il legame gp120-CD4 si formano
sincizi cellula-cellula- gp 41 : Glicoproteina che regola lancoraggio e la fusione del virus con la
membrana cellulare
-
7/22/2019 Retrovirus e HIV
31/96
Geni codificanti per proteine regolatriciTAT: Proteina essenziale RNA-binding che incrementa la trascrizione e la produzione di
mRNA virale e quindi la sintesi delle proteine virali.
REV: Proteina essenziale RNA-binding che incrementa la stabilit e la fuoriuscita
nucleare dell'RNA virale contenente introni, favorendo la produzione delle proteine virali
tardive.Geni codificanti per proteine accessorieNEF: Proteina che regola linfettivitavirale. Ceppi virali privi di nef non sono
infettanti.Aumenta la replicazione virale; coinvolta nella diminuzione di espressione di CD4 e
MHC I sulla superficie delle cellule infette. Ruolo nella patogenesi.VIF : Proteina che incrementa l'infettivit virale (APOBEC).VPR: Proteina che incrementa linfezione virale e/o la replicazione (import nucleare del
PIC, attivazione della trascrizione virale, blocco ciclo cellulare G2, induzione di apoptosi)
ruolo nellinfezione dei macrofagi.VPU: Proteina che incrementa la produzione di particelle virali e degradazione del CD4.
-
7/22/2019 Retrovirus e HIV
32/96
HIV
-
7/22/2019 Retrovirus e HIV
33/96
HIV - Life History Entry into the cell
T4 (CD4+) cells are major target
Human HeLaCell
Human HeLa Celltransfected with CD4
antigen
NOT INFECTED INFECTED
-
7/22/2019 Retrovirus e HIV
34/96
HIV - Life History
CD4
CD4CD4
HIV
CCR5
CCR5
chemokine
MutantCCR5
macrophage
-
7/22/2019 Retrovirus e HIV
35/96
HIV
INGRESSO VIRALE
-
7/22/2019 Retrovirus e HIV
36/96
Viral ssRNA
Provirus
TatRev
Nef
Viral dsDNA
Unspliced mRNA (9kb)Singly spliced mRNA (4kb)
Fully splicedmRNA (2kb)
Cell membrane
Nucleus
Recognition and binding:Env
Fusion and entry:Envchemokine receptor
UncoatingReverse transcription:
RTNuclear translocation of PIC:Vpr, MA
Integration:IN
GagPol
Env
VifVprVpu
Transcriptional
activation:TatRev
Capsid assembly:Vif, Vpu
Budding:Vpu
Maturation:PR
Translation Genomic RNA
mRNA ExportmRNA Export:Late Phase:
Early Phase:
Main steps of virus replication
-
7/22/2019 Retrovirus e HIV
37/96
Ciclo di replicazionesulla superficie cellulare
- Legamedi gp120con il recettore cellulare CD4in congiunzione con un recettore per le
chemochine: CXCR4(virus linfocitotropi), CCR5 (virus monocitotropi)- Fusionedell'envelope virale (gp41) con la membrana cellulare.- Entratadel virus nella cellula.
nel citoplasma-Uncoating(scapsidamento) dell'RNA virale (tramite la fusione con i lisosomi).-Costituzione del Provirus, DNA bicatenario del corredo genetico virale, da partedella trascrittasi inversa virale-retrotrascizione di DNA con formazione di un ibrido RNA-DNA,-degradazione dell'RNA da Rnasi H,-sintesi di un secondo filamento di DNA.
- Entrata del DNA virale nel nucleo.nel nucleo
integrazione(pi o meno abbondante) nel DNA cellulare durante la duplicazione della
cellula mediata dall'integrasi virale- (LATENZA).
-
7/22/2019 Retrovirus e HIV
38/96
nel nucleo- Attivazione con trascrizione del provirus in RNAm virale da parte di RNA polimerasi
cellulare.
Fase precoce: espressione di Tat, Rev e Nef (nel citoplasma)Tat e Rev entrano nel nucleo Tat trans-attiva la trascrizione viraleRev media la fuoriuscita di RNAm virale contenente introni (RNA genomico e RNA
codificante proteine strutturali)
nel citoplasmaFase tardiva: espressione di Gag, Pol, Env,Vif, Vpr, Vpu (Rev-dipendente) - Traslazione (sintesi proteica) nei ribosomi e sintesi di poliproteine virali immature.- Modificazione delle proteine (glicosilazione, miristilazione).- Assemblamento delle componenti virali sotto la membrana citoplasmatica.- Fuoriuscita della particella virale dalla cellula tramite gemmazione ("budding")- Maturazionedelle proteine virali tramite la proteasidi HIV- Reinfezione di nuove cellule tramite contatto cellula-cellula (durante il budding) o
contatto cellula-virus libero.
-
7/22/2019 Retrovirus e HIV
39/96
Ciclo di replicazione di HIV e target
farmacologici
8Nucleoside reversetranscriptase inhibitors (NRTIs)
AZT, ddI, ddC, d4T,
3TC, ABC, TDF, FTC
9Protease
inhibitors
(PIs)
SQV,IDV,
RTV,NFV,
APV,LPV,
ATV,TPV,
DRV
4Non-nucleoside reverse
transcriptase inhibitors
(NNRTIs)
EFV, NVP, DLV, ETV
1. Binding&fusion
2. Entry3. Uncoating4. Reverse
transcription5. Integration6. Transcription7. Translation8. Assembly &
budding9. Maturation
1Fusion inhibitor
(FIs)T20
3Integrase
inhibitors (INIs)RAL,EVG,GSK572
2Entry inhibitorsMaraviroc
Vicriviroc
-
7/22/2019 Retrovirus e HIV
40/96
-
7/22/2019 Retrovirus e HIV
41/96
HIV and AIDS
-
7/22/2019 Retrovirus e HIV
42/96
Inexorable decline of CD4+ T4 cells
Of great importance to therapeutic strategy
Why do all ofthe T4 cells
disappear?
At early stagesof infection
only 1 in 10,000
cells is infected
Late 1 in 40
-
7/22/2019 Retrovirus e HIV
43/96
HIV
LISI CELLULARE
-
7/22/2019 Retrovirus e HIV
44/96
HIV
SYNCYTIA
-
7/22/2019 Retrovirus e HIV
45/96
HIV
LISI MEDIATA DAI CTL
-
7/22/2019 Retrovirus e HIV
46/96
Why do all CD8+ killer cells disappear?At a late stage of HIV infection, the cytotoxic T
cells disappear very rapidly
These cells do not have CD4 antigen
They are not infected by HIV
There is a correlation of control of virus and
presence of CD8+ cells
HIV subtypes present in late infection cause mass
apoptosis of CD8+ cells
Cytotoxic T cells do have CXCR4 co-receptor. HIV
binds but does not enter cells
Signal from binding prompts mass suicide ofCD8+/CXCR4+ cells
-
7/22/2019 Retrovirus e HIV
47/96
Binding to
CXCR4 results in
expression of
TNF-alpha on the
cell surface
G protein
signal
Binding to CXCR4
results in
expression of TNF-
alpha receptor II
CD8 cell(no CD4 antigen)
Macrophage
CXCR4
HIVgp120
chemokine
Apoptosis of T cells
-
7/22/2019 Retrovirus e HIV
48/96
CD8 cell Macrophage
CXCR4
Death
CD8 T cell
apoptotic
bodies
Macrophage ingests CD8 cell
apoptotic bodies
-
7/22/2019 Retrovirus e HIV
49/96
Immune responses against HIV
-
7/22/2019 Retrovirus e HIV
50/96
Macrophages may be infected
by two routes CD4
Fc receptor
HIV gp120 binds tomacrophage CD4 antigen
Virus is opsonized by antigp120 antibodies which
bind to macrophage Fc
receptors - an enhancing
antibody
HIV gp120
HIV
Anti-gp120
-
7/22/2019 Retrovirus e HIV
51/96
Cytokine networks that regulate
human immunodeficiency virus
(HIV) replication.
-
7/22/2019 Retrovirus e HIV
52/96
3 Typical cytopathic effect of human immunodeficiency virus
(HIV)-1 in cell culture; syncytium
formation with multinucleated giant cells is shown in a
culture of CD4+ T cells.
-
7/22/2019 Retrovirus e HIV
53/96
Chemochine e recettori specifci per lentrata e linibizione
dellentrata di HIV
Dal 2007 un farmaco inibitore di CCR5 entrato in uso nella pratica clinica
-
7/22/2019 Retrovirus e HIV
54/96
Stato di latenza di HIV in cellule T prima dellintegrazione e
dopo lintegrazione genomica
-
7/22/2019 Retrovirus e HIV
55/96
CARATTERISTICHE DI HIV
- E un virus scarsamente resistente allambiente
esterno (in paragone ad altri virus, come il virus
dellepatite B).
- Sopravvive per poco tempo (ore o giorni, a
seconda della temperatura, umidita, ecc) in
ambiente esterno.
- E inattivato rapidamente da:
- Calore (56C per 10 minuti)
- Perossido di idrogeno
- Ipoclorito di sodio al 10%
- Alcool etilico 40%- Paraformaldeide
- Raggi ultravioletti
-
7/22/2019 Retrovirus e HIV
56/96
EPIDEMIOLOGIA DI HIVTempo di latenza per la sieroconversione (dal
momento del contatto con il virus): 6 settimane
(media)
Tempo di latenza dalla sieroconversione alla malattia
(senza terapia):2 mesi!15 e piuanni.La sieroconversione definitiva, con leccezione di
alcuni bambini di madre sieropositiva
umero di sieropositivi che andranno incontro alla
malattia (in assenza di terapia) = >80 %
Tutti i siero positivi, anche se asintomatici, sono
portatori del virus , e quindi potenzialmente
infettanti.
-
7/22/2019 Retrovirus e HIV
57/96
VIE DI TRASMISSIONE DELLA MALATTIA - Antigeni di HIV, o anche particelle virali complete, sono riscontrabili praticamente in tutti i
fluidi e secrezioni dellorganismo. Tuttavia, HIV einfettante solo in alcuni di essi: Infettivita
- Sangue ++++ - Liquido seminale ++++ - Secrezione vaginale +++- Latte materno +- Saliva ? (probabilmente -)- Lacrime ? (probabilmente -)- Sudore -- Urine ? (probabilmente -)- Liquor cerebrospinale ?- Fluido alveoli polmonari ?
- Derivati del sangueche:Trasmettono il virus Non trasmettonoil virus (in linea di massima)- Sangue intero - Immunoglobuline- Cellule ematiche - Albumina- Plasma - Alcune frazioni plasmatiche- Fattori della coagulazione - Fattori della coagulazione di sintesi
Non stato segnalato nessun caso di infezione tramite punture di insetti, o legata alla
condivisione di o etti otenzialmente infetti ( osate, bicchieri, lenzuola, ecc.)
-
7/22/2019 Retrovirus e HIV
58/96
TRASMISSIONE EMATICA E PARENTERALE DI HIV - Circa l80% degli emofiliaci trattati con fattori della coagulazione estratti dal sangue
sono sieropositivi per HIV. - La percentuale di tossicodipendenti sieropositivi non enota con sicurezza, ma si ritiene
che superi il 50%. - Politrasfusi hanno un rischio attuale di infezione molto modesto (inferiore a 1 sacca su
100.000 trasfuse).- Linfezione del ricevente epiuprobabile se il donatore di sangue infetto eanche
sintomatico.- Rischio di trasmissione da organo da sieropositivo (circa il 100%)- In nessun caso il donatore di sangue puoinfettarsi.- Dose minima infettante di virus: non nota.- In caso di contaminazione parenterale (puntura accidentale), il rischio di infezione
(sieroconversione) elargamente inferiore all1%, confrontato con quello da virus
dellepatite B (superiore al 12%). La possibilitadi acquisire il virus per puntura
accidentale ecomunque maggiore se la quantitadi sangue inoculato era notevole, e se la
ferita era profonda
-
7/22/2019 Retrovirus e HIV
59/96
TRASMISSIONE PERINATALE DI HIV - Rischio globale di infezione del bambino da madre sieropositiva (portatrice del virus):
circa il 30-40% (in assenza di terapia)
- Vie di infezione del bambino : - Intrauterina (intorno alla 12-16 settimana, tramite la placenta)- Durante il parto (contatto sangue materno-sangue fetale, ingestione di fluidi infetti)- Allattamento
- Tutti i bambini di madri sieropositive sono a loro volta sieropositivi, in quanto hanno nel
sangue gli anticorpi anti-HIV materni. - Falsi sieropositivi: Il titolo anticorpale cala con il tempo, per scomparire tra il secondo e il
diciottesimo mese dopo la nascita. Sono tutte IgG. Eimpossibile isolare il virus dal sangue.
Bambini non infettati - Veri sieropositivi: Il titolo anticorpale resta invariato o addirittura aumenta. Sono presenti,
nelle prime settimane, IgM. Epossibile isolare il virus dal sangue. Bambini infettati- Il decorso della malattia nei bambini portatori del virus esolitamente pi rapido che
nell'adulto. In alcuni casi, fortunatamente, epossibile arrivare alla pubert ancora in fase
asintomatica.
-
7/22/2019 Retrovirus e HIV
60/96
I soggetti infettati perdono progressivamente negli anni
gran parte del loro patrimonio di Linfociti helper ediventano suscettibili a numerose infezioni
"opportunistiche",
specialmente fungine (candidosi, aspergillosi,
criptococcosi), protozoarie (toxoplasmosi, pneumocistosi)
e virali (infezione da Herpes e Cytomegalovirus);
anche la suscettibilit a particolari tipi di tumori (sarcoma
di Kaposi, linfoma non-Hodgkin) notevolmenteaumentata.
-
7/22/2019 Retrovirus e HIV
61/96
With giemsa stain intracystic
bodies of Pneumocystiscariniiin lungare seen in this
cytologic preparation from a
bronchoalveolar lavage
dissemination to extrapulmonary
sites, Pneumocystis carinii tends to
produce foci with prominent
calcification, as seen in the kidney
here grossly.
HIV, AIDS andPneumocystis carinii
-
7/22/2019 Retrovirus e HIV
62/96
HIV and AIDSan infectious agent Kaposis Sarcoma
-
7/22/2019 Retrovirus e HIV
63/96
Candida infectionsare common with AIDS,but most often appear as oral thrush, which i
a nuisance but not life-threatening.
Disseminated infections are uncommon, buthere is a rare Candida pneumonia, which
resembles a bacterial bronchopneumonia.
HIV and AIDS
AIDS St ti ti
-
7/22/2019 Retrovirus e HIV
64/96
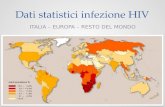
Approximately 8500 new HIV infections occur dailyaround the world
Over 90% of these are in developing countries
1000 are in children less than 15 yearsof age.
Worldwide
Current estimates are that in 2007, 33.2 million peoplehave HIV infectionUSA
As of June 2000, 753,907Americans reported with AIDS. At least 438,795 of them have died.
Sub-Saharan AfricaAbout 1 million new cases of AIDS per year22.5 millionpeople with HIV infectionSeveral countries in sub-Saharan Africa report infection rates of 20-25%
AIDS Statistics
South and East Asia
In south and east Asia there are more than 200,000 new cases per yearand 7.3millionpeople with HIV
The cellular and immunological picture - The course of the disease
-
7/22/2019 Retrovirus e HIV
65/96
Perdita di CD4+T4 cellule helper
Malattiacon CD4+< 250 cells/
mm3
Malattia avanzataPerdita di CD4+T4
e
CD8+cellule killer
The cellular and immunological picture - The course of the disease
-
7/22/2019 Retrovirus e HIV
66/96
Natural history of human
immunodeficiency virus (HIV)
infection.
-
7/22/2019 Retrovirus e HIV
67/96
HUMAN IMMUNODEFICIENCY VIRUS
PATOGENESI
Perdita T cellule CD4+ sviluppo di disfunzione immunitaria e infezioni opportunistiche
Corso: 8-10 anniCorso pi lungo per lHIV-2
Infezione primaria
107particelle virali/ml
sintomi di tipo inluenzale
risoluzione in poche settimane
controllo attraverso immunit umorale e cellulare
plateau: 103-105copie RNA/ml>10
5copie RNA/ml !progressone rapida
-
7/22/2019 Retrovirus e HIV
68/96
PRIMA FASE- Vie di entrata di HIV nellorganismo:
- Sangue (tossicodipendenti, trasfusi, ecc)- Organi genitali (contatti omo- eterosessuali)
- Retto (contatti omosessuali)
- Cute (punture accidentali, ferite, ecc)
- Mucose (contaminazioni, ecc)
- Organi (trapianti)
- Infezione delle cellule locoregionali
-Macrofagi-Cellule dendritiche-Linfociti CD4 helperFase clinicamente latente: puo durare da un minimo di 4-6 settimane a
solitamente non piu di 6 mesi.
- Rapida e abbondante replicazione virale
produzione anticorpale contro HIV assente : soggetto infettato ma sieronegativo
(periodo finestra).
Prima fase
-
7/22/2019 Retrovirus e HIV
69/96
Fase acuta o infezione primariaSintomi aspecifici (simil mononucleosici o similinfluenzali)Comparsa di anticorpi anti HIV (sieropositivit)Carica virale elevatissima (oltre un milione di copie di RNA virale/ml)Deplezione abbondante di CD4Risoluzione in poche settimane Controllo attraverso immunit cellulare e umorale Plateau: 10
3
-105
copie RNA/mlse > 105copie RNA/ml -> progressione rapida
Seconda fase
-
7/22/2019 Retrovirus e HIV
70/96
Terza fase
Periodo asintomatico
Latenza clinica. Da pochi mesi a 15 anni
Assenza di segni clinici della malattia.
Replicazione virale continua e abbondante : circa 10 miliardi di
particelle/die prodotte ed eliminate ogni giorno
Carica virale: 10.000-100.000 copie RNA/ml
Deplezione linfocitaria: Un miliardo di linfociti CD4 uccisi ogni
giorno, controbilanciati dalla neoproduzione di linfociti da parte
del timo
Alterazione dei linfonodit 1/2 virioni = 6 oret 1/2 cellule = 2 giorni
Quarta fase
-
7/22/2019 Retrovirus e HIV
71/96
Quarta fase
Fase sintomatica
Carica virale ancor pi elevata: oltre 100.000 copie RNA/ml50% dei casi varianti virali pi citopatiche
Fino a 1 milione di diverse varianti virali genetiche
- Linfociti CD4 < 300/mmc
Comparsa dei primi sintomi: candida, herpes, deperimentoorganico, primi segni di alterazioni neurologiche.
-Linfociti CD4 < 200/mmcComparsa di infezioni da germi opportunisti (pneumocystis
carinii, cytomegalovirus, micobatteri atipici, toxoplasma, ecc)- tumori rapidamente letali (linfomi, carcinomi)
- sarcoma di Kaposi
- AIDS-dementia complex
-
7/22/2019 Retrovirus e HIV
72/96
Fattori che possono influenzare l'evoluzione della malattia(accelerandone il decorso):
- Defedamento
- Immunocompromissione
- Inoculo ripetuto nel tempo di HIV- Inoculo massivo (anche se unico) di HIV
- Attivazione linfocitaria:
- Da antigeni
- Da patogeni opportunisti o meno : CMV, HBV, HCV, HSV
- Allogenica : Liquido seminale, sangue
-
7/22/2019 Retrovirus e HIV
73/96
HIV and AIDS
Good correlation betweennumber of HIV particles
measured by PCR and
progression to disease
-
7/22/2019 Retrovirus e HIV
74/96
Viral load predictssurvival time
CD4 cell count is notagood predictor of
progression to disease
-
7/22/2019 Retrovirus e HIV
75/96
NEW guidelines
On December 1, the U.S. Department of Health and
Human Services (DHHS) updated its guidelines for
antiretroviral therapy (ART) for HIV positive adults and
adolescents.
In keeping with recent research, the revision calls for earliertreatment: ART is now recommended for people with
350-500 cells/mm3, and half the expert panel favored
treatment even for those with more than 500 cells/mm3.
-
7/22/2019 Retrovirus e HIV
76/96
RT has a high error rate 1:2,000-10,000 HIV genome 9749 nucleotides
Therefore EVERY new virus has at least one mutation! Every possible single mutation arises daily
The viral population in an infected person is highly heterogeneous
Polymorphism population
vaccine problem
-
7/22/2019 Retrovirus e HIV
77/96
Population PolymorphismInitial infecting virus is macrophage-tropic(has CCR5 as co-
receptor)
These are non-syncytium-inducing strains(Note: most vaccines have been made against syncytium-
inducing T4 cell tropic strains)
As virus mutates, it changes subtypes of cells that it infectsas the ability to bind different co-receptors changes
-
7/22/2019 Retrovirus e HIV
78/96
Population PolymorphismEarly in infection:
Macrophage-tropicNon-syncytium-inducing
Slowly replicatingLate in infection
T4 cell tropicSyncytium-inducingHigh titer virus
-
7/22/2019 Retrovirus e HIV
79/96
What is Tropism? ! Tropism refers to the affinity of a virus, or the preferred
pathway a virus uses to enter a certain cell type.
!Specifically for the HIV-1 virus, the type of tropism refers towhich co-receptor the patients virus uses to enter the cells.
-
7/22/2019 Retrovirus e HIV
80/96
HIV entry
1) HIV near to target cell
2) Binding between CD4 receptor
and viral gp120
3) Conformational change
gp120-co-receptor binding
4) membrane fusion
-
7/22/2019 Retrovirus e HIV
81/96
!The tropism is based upon the presence of selected
-
7/22/2019 Retrovirus e HIV
82/96
16 V3 loop residues
are associated
with co-receptor usage
CXCR4 usage is strongly associated
with the presence of mutations
S11R and H13Y
Residues in red are determinant for the
co-receptor choice. Sing et al., 2006
!The tropism is based upon the presence of selectedaminoacids in gp120(within V3 loop, but not only). They
can confer greater affinity to CCR5 or CXCR4.
-
7/22/2019 Retrovirus e HIV
83/96
Chemochine e recettori specifci per lentrata e linibizione
dellentrata di HIV
Dal 2007 maraviroc (inibitore CCR5) entrato in uso nella pratica clinica
HIV co-receptor usage
-
7/22/2019 Retrovirus e HIV
84/96
R5 VirusThey use only CCR5 co-receptorThey are predominant at trasmissionand in early stages of infection
X4 VirusThey use only CXCR4 co-receptor
They emerge in late stages of infectionThey are associated with a morerapid decline of CD4+ T cell anddisease progression
Dual tropic VirusThey use either CCR5 or CXCR4
Viral mixedtropic
population
HIV co receptor usage
Which is the prevalence of co receptor usage?
-
7/22/2019 Retrovirus e HIV
85/96
Which is the prevalence of co-receptor usage?
-
7/22/2019 Retrovirus e HIV
86/96
CELLULE BERSAGLIO DI HIV
HIV infetta soprattutto cellule del sistema immunitario (cellule dendritiche,
macrofagi, linfociti T) e cellule endoteliali.
Causa effetti citopatici nelle cellule permissive: come sincizi, morte cellulare per
apoptosi o necrosi.
-Macrofagi(incluse le cellule microgliali del sistema nervoso centrale) elinfocitiCD4sono il principale bersaglio di HIV in vivo. La loro infezione e
in grado di spiegare praticamente tutte le alterazioni causate dal virus nei
pazienti.
-Altre cellule potenzialmente infettabili da HIV :-Tutte le cellule umane aventi il recettore virale (CD4) sulla membrana
Ma anche cellule CD4-come cellule del SNC (astrociti, oligodendrociti)
-
7/22/2019 Retrovirus e HIV
87/96
Alterazioni immunologiche indotte da HIV:- Deplezione lenta e progressiva di linfociti CD4 (cellule chiave per lattivazionedi corrette risposte immuni dellorganismo) per uccisione diretta, formazione di
sincizi, mediata da cellule killer, da morte programmata, ecc- Produzione elevata di immunoglobuline non specifiche per nessun agente
patogeno (risposta immune non efficace)
- Alterazione della funzione dei linfociti killer (mancata risposta a infezionivirali e a tumori)
-Disfunzione dei macrofagi, con mancato inizio della risposta immune peralterata presentazione dellantigene, ridotta fagocitosi dei microorganismi(p.es. a livello polmonare)
Alterazioni neurologiche indotte da HIV-Disfunzione e morte neuronale per produzione e rilascio, da parte dei
macrofagi cerebrali infettati, di sostanze tossiche cellulari e virali.
-
7/22/2019 Retrovirus e HIV
88/96
Anti-HIV StrategiesEducation
Sexually transmitted
Not highly infectious
ChemotherapyMutation selection Resistance
but
Suppress replication No capacity for mutation
HUMAN IMMUNODEFICIENCY VIRUS
-
7/22/2019 Retrovirus e HIV
89/96
HUMAN IMMUNODEFICIENCY VIRUS
DIAGNOSI
Test sierologici antigeni o anticorpi
Ricerca diretta virus o sequenze genomiche
virali
Test sierologici
Anticorpi rilevabili dalle 6-12 settimane dallinfezione
e presenti in tutti i pazienti entro i 6 mesi
Campioni positivi sono rivalutati con test di conferma
Anticorpi contro p17, p24, p55 precoci ediminuiscono
Anticorpi contro gp160 e gp120 pi tardivi epersistenti
Positivit di un numero variabile di bande- ELISA e Western blot specificit intorno al 100%
Test per la rilevazione di antigeni
-
7/22/2019 Retrovirus e HIV
90/96
Test per la rilevazione di antigeni
ELISA per p24Infezione primaria prima sieroconversione, neonati
Screening trasfusioni
Coltura virale in vitro
Plasma o PBMC
- Sensibilit : 95%
Ricerca sequenze nucleotidiche
DNA provirale nei PBMC
RNA virale nel siero o plasma
Gene gag o pol
- Sensibilit del 99% solo se almeno 10 copiegenomiche virali presenti
-
7/22/2019 Retrovirus e HIV
91/96
HIV Infection:
Critical points in a Diagnostic Laboratory Early infection diagnosis (adults and children) Confirmation of seropositivity HIV-RNA & HIV-DNA quantification and monitoring Variability of HIV Drug-resistance and tropism
-
7/22/2019 Retrovirus e HIV
92/96
Marcatore Tempo medio per la rilevabilit Intervallo di confidenza (95%)
PROFILO CLASSICO DI SIEROCONVERSIONE
RNA virale 11 gg. 1-25 gg.Antigene p24 16 gg. 3-30 gg.
DNA provirale 16 gg. 3-30 gg.Anticorpi 21 gg. 9-34 gg
Tempi per la rilevazione dei marcatori diagnostici
Fasi finestranellinfezione da HIV
Finestraper Ab = 21 giorni
-
7/22/2019 Retrovirus e HIV
93/96
Prima generazione(marzo 1985, Abbott HTLV-IIIEIA):formato indiretto, lisato virale
Seconda generazione(1987): formato indiretto, Agricombinanti/peptidi aumento sensibilit e specificit
Terza generazione(1994): formato diretto (sandwich),Fase solida rivestita di Ag ricombinanti/peptidi,
migliore sensibilit in sieroconversione (IgM, IgA, IgG)
Quarta generazione(1999): rilevazionesimultanea di anticorpi e antigene gagp24,ulteriore riduzione della fase finestra
Le generazionidei test anti-HIV
Infezione da HIV: chiusura del periodo finestra con i
-
7/22/2019 Retrovirus e HIV
94/96
Infezione da HIV: chiusura del periodo finestra con i
diversi test sierologici e molecolari
three assays: VIDAS Ultra, VIDAS Quick, and ARCHITECT)
detected infection before the p24 specific assay (Coulter)
and less than 3 days afterNAT
da: B. Weber, Expert Rev Mol Diagn 2006; 63 (3): 399-411
0 10 20 30 40 50 60 70 80
Giorni dopo l'esposizione
EIA 1 generazione
EIA 2 generazione
EIA 3 generazione
EIA 4 generazione
Ag p24
HIV-RNA (plasma)
La conferma : Western blot
-
7/22/2019 Retrovirus e HIV
95/96
Camp. Ente
gp41
1 FDA p24, p32 e gp41 e/o gp120/160
2 CDC p24 e gp41 e/o gp120/160
3 WHO gp41 e gp120/160
4 Infezione recente?
4
CAMP. 1 2 3
gp160
gp120
p65
p32
p18
p24
p55
CRITERIO
Caratterizzazione con saggio di conferma Western Blot
La conferma: Western blotCriteri di positivit
1) CDC: 2 bande tra p24,gp41, gp120/160
2) WHO: almeno 2 bande env
3) ARC: 1 gag, 1pol, 1 env
4) Mah (Africa): gp160, p31
-
7/22/2019 Retrovirus e HIV
96/96
Negative/Indeterminate + Detectable RNAHIV antibody test
If diagnosis is made by HIV RNA testing, confirmatory serologic
Diagnosis of Acute HIV infection