Regolazione di canali ionici da parte di recettori legati a proteine G Gli agonisti per questi...
-
Upload
ulderico-durante -
Category
Documents
-
view
226 -
download
0
Transcript of Regolazione di canali ionici da parte di recettori legati a proteine G Gli agonisti per questi...

Regolazione di canali ionici da parte di recettori legati a proteine G
• Gli agonisti per questi recettori possono regolare l’attività dei canali ionici:
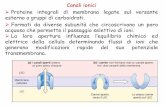
1. Direttamente, senza la mediazione di secondi messaggeri (cAMP, InsP3, DAG): la subunità o quella di una proteina G regolano la funzionalità del canale (aumento o diminuzione dell’apertura). Es.: il recettore colinergico muscarinico cardiaco aumenta la permeabilità al potassio iperpolarizzazione inibizione dell’attività elettrica bradicardia.

2. Indirettamente, con la mediazione di secondi messaggeri. La stimolazione recettoriale porta alla formazione di un secondo messaggero (cAMP); il secondo messaggero può modulare l’attività dei canali direttamente oppure attivando le chinasi fosforilazione del canale ionico cambiamento delle caratteristiche funzionali del canale.
Es.: il recettore ß-adrenergico cardiaco stimola la formazione di cAMP fosforilazione del canale al Ca++ aumento della probabilità di apertura maggiore influsso di Ca++ effetto cronotropo e inotropo positivo.

Amplificazione del segnale

Amplificazione del segnale

Integrazione delle risposte cellulari.Sinergismo delle azioni di un secondo messaggero per
ottenere la massima risposta cellulare. Es. degradazione del glicogeno da parte dell’adrenalina

Integrazione e regolazione delle risposte cellulari seguenti all’attivazione di recettori accoppiati a
Proteine G.
• La stimolazione di un tipo di recettore (es. ß-adrenergico) porta alla formazione di due prime effettori cellulari: la subunità -GTP e la subunità .
• Sia la subunità -GTP che quella possono regolare l’attività di più effettori (canali ionici, adenilato ciclasi ecc.)
• I secondi messaggeri (cAMP) possono attivare più effettori ‘finali’ (chinasi, canali ionici)
• Gli effettori finali possono regolare l’attività di molte proteine funzionali

L’attivazione di un tipo recettoriale determina quindi una “rete” di eventi cellulari.
Questi eventi cellulari sono tra loro ‘integrati’ per dare una risposta cellulare ottimale. Es.: sinergismo (degradazione del glicogeno); ‘automodulazione’.
Gli eventi cellulari determinano risposte cellulari con cinetiche temporali diverse (risposte immediate, a medio e a lungo termine)
L’attivazione di recettori diversi può portare a complessi fenomeni di integrazione dei singoli segnali (es. attivazione-inibizione dell’adenilato ciclasi).
La risposta cellulare ad un trasmettitore dipende dal tipo cellulare, dallo ‘stato’ della cellula (sana-malata, immatura-matura), dalla stimolazione da parte di altri trasmettitori.

Sovrapposizione degli effetti delle subunità e in seguito ad attivazione di un recettore accoppiato a
proteine G

RECETTORI CON ATTIVITA’ TIROSIN-CHINASICA (RECETTORI PER I FATTORI DI
CRESCITA)
• Sono recettori fattori di crescita. Anche il recettore dell’insulina appartiene a questa famiglia
• I fattori di crescita sono proteine che stimolano la proliferazione e/o la differenziazione cellulare.
• I fattori di crescita possono agire a distanza, viaggiando nel sangue, o essere prodotti localmente, nel tessuto (agenti paracrini).
• Sono essenziali per il corretto sviluppo di diversi tessuti• I fattori di crescita, i loro recettori e i trasduttori del
segnale sono prodotti di oncogeni o protooncogeni, geni deputati al controllo della proliferazione cellulare.

Organizzazione molecolare dei recettori per i fattori di crescita
• La porzione intracellulare di questi recettori ha un dominio catalitico, che funziona come un enzima; questo dominio è capace di legare il substrato (una porzione di proteina contenente residui di tirosina) e l’ATP e catalizzare quindi la fosforilazione del substrato.
• In assenza di ligando, questa attività enzimatica è inibita.
• Il sito di legame con il ligando è nel dominio extracellulare del recettore. Il legame recettore-ligando è caratterizzato da un’affinità molto alta.

Il legame con il ligando agonista induce la dimerizzazione di 2 molecole di recettore; il dominio catalitico di ciascuna molecola catalizza la fosforilazione di residui di tirosina dell’altra molecola (auto/transfosforilazione). I residui di tirosina sono presenti nella porzione intracellulare del recettore.
La fosforilazione dei residui di tirosina conferisce alta affinità per numerose proteine intracellulari (denominate proteine con dominio SH2), che quindi si legano alla porzione del recettore contenente i residui di tirosina fosforilati.

Trasduzione del segnale
• Alcune proteine con dominio SH2 sono enzimi (protein chinasi, fosfolipasi), che vengono attivati dando inizio alla cascata di reazioni intracellulari.
• Altre proteine con dominio SH2 non sono enzimi ma regolano l’attività di enzimi intracellulari.

La via Ras/Raf
• Media l’effetto di molti fattori di crescita.
• Ras è una proteina che funziona come la subunità di una proteina G (legata al GDP è inattiva, viene attivata dal legame con GTP, è dotata di attività GTP-asica).
• Ras viene attivata da una proteina con dominio SH2, denominata Grb.
• Ras attivata attiva a sua volta Raf, che è la prima di una sequenza di chinasi, ognuna delle quali fosforila la seguente, attivandola (cascata delle chinasi),

L’ultima chinasi è la chinasi MAP, che fosforila uno o più fattori di trascrizione, che modulano l’espressione genica.
La modulazione dell’espressione genica porta a varie risposte cellulari, tra le quali la proliferazione e la differenziazione cellulare.
Alcuni composti naturali, come la quercetina, sono inibitori dell’attività tirosin-chinasica, e sono quindi dotati di alta tossicità.

Anche i recettori accoppiati a proteine G possono attivare la ‘cascata della MAP-chinasi’
• Tramite meccanismi complessi e ancora poco conosciuti, la stimolazione dei recettori accoppiati a proteine G può attivare la ‘cascata delle chinasi’, il cui effetto ultimo è la modulazione dell’espressione genica.
• Gli agonisti di questi recettori possono quindi indurre degli effetti a lungo termine (ad es., regolazione dei geni i cui prodotti sono coinvolti nella trasmissione del segnale)

Il recettore per l’insulina
• Appartiene alla famiglia dei recettori con attività tirosin-chinasica, ma è un dimero anche in assenza di ligando (le 2 catene sono legate da un ponte disolfuro).
• Il legame con l’insulina attiva la regione con attività tirosin-chinasica formazione di secondi messaggeri e regolazione dell’espressione genica.
• L’insulina determina effetti cellulari immediate, a medio termine, a lungo termine.

Sovrapposizione delle ‘vie’ cellulari di risposta all’attivazione di recettori diversi.

Interazioni tra le vie cellulari di risposta

‘Vie’ ioniche attraverso la membrana cellulare

Canali ionici, pompe e potenziali transmembrana
• Le membrane cellulari sono impermeabili agli ioni• Proteine di membrana specializzate formano dei canali
permeabili ai singoli ioni (K+, Na+, Ca++, Cl-), che fluiscono attraverso i canali seguendo il loro gradiente elettrochimico. Tuttavia, la permeabilità per i cationi non è altamente selettiva: canali per il K+ lasciano passare anche Na+ e viceversa. C’è invece selettività assoluta tra cationi e anioni (Cl-).
• Le pompe ioniche sono proteine che trasportano ioni da un lato all’altra della membrana consumando energia, fornita dall’idrolisi dell’ATP, sono quindi delle ATPasi.

Potenziali transmembrana
• I vari ioni hanno concentrazioni molto diverse all’interno ed all’esterno della cellula

• Il libero flusso (attraverso un canale) di uno ione secondo il suo gradiente di concentrazione crea una differenza di potenziale transmembrana, perché porta ad una separazione di cariche sui due lati della membrana. Ad es., il flusso di ioni K+ dall’interno all’esterno della cellula porta rapidamente ad un accumulo di cariche negative all’esterno e di cariche negative (dovute ai controioni negativi) all’interno.
• Questa differenza di potenziale (differenza di distribuzione di cariche elettriche) blocca l’ulteriore flusso dello ione attraverso la membrana. Si crea quindi uno stato di equilibrio in cui la ‘spinta’ del gradiente di concentrazione è controbilanciata dalla ‘controspinta’ della differenza di potenziale.

La differente concentrazione ai due lati della membrana, e la presenza di canali permeabili, crea quindi una differenza di potenziale transmembrana.
La differenza di potenziale è legata alla differenza di concentrazione dall’equazione di Nernst:
(f.e.m.) = ± 61 log Conc. Interna/Conc. Esterna
Il segno del potenziale è per convenzione negativo se lo ione è positivo, positivo se lo ione è negativo.

Potenziale di riposo
• Le membrane cellulari contengono canali ionici sempre aperti permeabili principalmente al K+. Data anche la grande differenza di concentrazione interno-esterno del K+
(K+interno/K+
esterno= 35; Na+interno/Na+
esterno: 0,1), la differenza di potenziale a riposo è determinata principalmente (ma non solo) dalla differenza di concentrazione del K+. Il potenziale di transmembrana a riposo è quindi negativo ed il suo valore è compreso tra –40 e –90 mV (a secondo del tipo cellulare). L’interno della cellula è carico negativamente, l’esterno positivamente.

Flussi ionici, depolarizzazione, iperpolarizzazione
• Lo spostamento del potenziale di membrana verso valori meno negativi (o persino positivi) viene definito depolarizzazione.
• Lo spostamento verso valori più negativi viene definito iperpolarizzazione.

•Il flusso di ioni Na+ dall’esterno all’interno (secondo il gradiente di concentrazione di Na+) causa depolarizzazione (diminuisce la differenza di distribuzione di cariche tra interno ed esterno). •Il flusso di ioni Ca++ dall’esterno all’interno causa depolarizzazione (come per Na+). •Il flusso di ioni K+ dall’interno all’esterno (secondo il gradiente di concentrazione di K+) causa iperpolarizzazione (aumento della differenza di distribuzione di cariche).•Il flusso di ioni Cl- dall’esterno all’interno causa anch’esso un aumento della differenza di distribuzione di cariche e quindi iperpolarizzazione.

Il valore del potenziale di riposo di una cellula eccitabile determina la sua sensibilità a stimoli depolarizzanti, in grado di innescare un potenziale d’azione.
Tanto più la membrana cellulare è depolarizzata (potenziale di riposo meno negativo) tanto più è eccitabile.
Tanto più è iperpolarizzata, tanto meno è eccitabile.

Flussi ionici ed eccitabilità
• Il flusso di ioni Na+ (e Ca++) attraverso la membrana determina quindi un aumento dell’eccitabilità
• Il flusso di ioni K+ (interno esterno) e Cl- (esterno interno) determina diminuzione dell’eccitabilità.

Tipi di canali ionici
• I flussi ionici sono controllati da canali, la cui apertura è controllata da:
1. Differenza di potenziale (canali voltaggio-dipendenti)
2. Segnali intracellulari (cAMP, Ca++, ATP)
3. Neurotrasmettitori (recettori-canale)
• Esistono anche canali controllati da altri stimoli (es. stimoli meccanici ). Come già detto, esistono sempre aperti (canali leaky) permeabili soprattutto a K+.


Canali ionici, eccitabilità, potenziale d’azione, risposta cellulare
• L’apertura dei canali, consentendo l’entrata o l’uscita di ioni secondo il loro gradiente, permette di far variare rapidamente il potenziale transmembranario. I canali controllano quindi l’eccitabilità cellulare (sensibilità ad uno stimolo depolarizzante) e sono essi stessi responsabili del potenziale d’azione.
• I flussi di Na+, K+, Cl- controllano il potenziale transmembrana. Questi ioni non determinano essi stessi, direttamente, risposte cellulari.
• I flussi di Ca++ contribuiscono a determinare il potenziale transmembrana. L’aumento della concentrazione di ioni Ca++ è l’evento finale che determina la risposta cellulare.

Canali ionici, malattie, farmaci
• Diverse malattie congenite sono dovute a mutazioni geniche il cui prodotto sono canali ionici la cui funzionalità è alterata (canalopatie; es. alcune forme di epilessia, ipertermia maligna).
• Condizioni patologiche acquisite determinano alterazioni dell’eccitabilità cellulare (ischemia, epilessia ecc.)
• Molti farmaci agiscono a livello dei canali, facilitando o diminuendo la loro apertura.

Organizzazione funzionale dei canali ionici
• I canali ionici ‘regolati’ possono assumere una conformazione (stato) ‘aperta’ e uno stato ‘chiuso’, in risposta agli stimoli modulatori. Gli ioni possono passare attraverso il canale solo quando questo è nello stato aperto.
• Alcuni canali possono anche assumere uno stato ‘inattivato’.
• I canali sono (relativamente) selettivi ad uno ione.

Possiamo quindi distinguere diversi domini proteici:
Domini formanti il ‘poro’ (canale vero e proprio); Domini responsabili della selettività ionica;Domini responsabili della risposta agli stimoli modulatori.

Struttura dei canali ionici
• I canali cationici sono monomeri, dimeri o tetrameri.
• I monomeri assumono una conformazione ‘pseudo tetramerica’.
• Ciascun (pseudo)-monomero è formato da 6 segmenti trans-membrana

• I segmenti 5 e 6 di ciascun dominio concorrono a formare il poro e determinano la selettività al catione.
• Il segmento 4 è responsabile della sensibilità al voltaggio (apertura o chiusura del canale in funzione del potenziale transmembrana).
• I canali anionici (Cl-) sono strutturalmente diversi
• La presenza di cariche positive o negative agli ‘ingressi dei pori determina la selettività per la carica dello ione

Canale chiuso
Canale aperto
Canale inattivato

Struttura del sensore del voltaggio (‘cancello’)
• Il domino 4 possiede residui di aminoacidi carichi positivamente. In condizioni di riposo queste cariche positive sono attirate verso l’interno della membrana, carico negativamente.
• La depolarizzazione della membrana (diminuzione della carica negativa interna) determina una diminuzione di questa forza di attrazione e uno slittamento del dominio 4 verso l’esterno.
Il cambiamento conformazionale del dominio 4 si trasmette agli altri domini, causando l’apertura del poro

Canali ionici voltaggio-dipendenti
• La loro apertura/chiusura è regolata dal potenziale transmembrana (voltaggio).
• Canali al Na+, Ca++, K+. Esistono canali permeabili a questi ioni attivati da meccanismi diversi.
• I canali a Cl- hanno sono regolati sia dal potenziale transmembrana sia da fattori intracellulari (cAMP, Ca++)

Canali al sodio voltaggio-dipendenti
• Esistono in tre stati: a riposo (chiusi), attivati (aperti), inattivi.
• Al valore di potenziale di riposo (- 90 mV) sono nello stato chiuso.
• La stimolazione chimica (es. Ach), elettrica o meccanica determina l’apertura di un certo numero di canali Na+. Questa apertura causa una parziale depolarizzazione della membrana che causa l’apertura di altri canali Na+ (si aprono a potenziali –70 –50 mV) che causa ulteriore depolarizzazione e ulteriore apertura di canali Na+ (processo cooperativo) inizio del potenziale d’azione.

• Allo stesso valore di potenziale di membrana a cui avviene l’apertura, si ha anche il passaggio allo stato inattivato.
• Il passaggio allo stato inattivato avviene però più lentamente del processo di apertura. I canali rimangono quindi aperti per un breve periodo (alcuni decimillesimi di secondo) e poi passano allo stato inattivato.
• I canali rimangono nello stato inattivato finché il potenziale di membrana ritorna ai valori di riposo (apertura dei canali al K+); a questo punto ritornano nello stato di riposo (chiusi).

• I processi di apertura/chiusura possono essere modulati da fosforilazioni indotte sia direttamente dalle proteine G sia da secondi messaggeri (cAMP, DAG).

Farmaci che agiscono modulando i canali al Na +
• Anestetici locali (lidocaina, benzocaina ecc.): bloccano i canali Na+ dei nervi periferici (sensitivi), bloccando quindi l’insorgenza del potenziale d’azione e la propagazione dell’impulso nervoso.
• Antiaritmici di classe I (chinidina, procainamide ecc.): bloccano i canali Na+ cardiaci.
• Alcuni antiepilettici (fenitoina, carbamazepina): bloccano i canali Na+ dei neuroni centrali

Il sito di legame di questi farmaci è all’interno del poro (canale). Il legame farmaco-canale favorisce lo stato inattivato del canale.
Per raggiungere il loro sito di legame ed esercitare il loro effetto, è necessario che il canale sia nello stato aperto interazione (ed effetto) uso-dipendente e voltaggio-dipendente. L’effetto aumenta all’aumentare della frequenza di apertura del canale.
Queste caratteristiche fanno sì che questi farmaci agiscano preferenzialmente su cellule danneggiate, che sono parzialmente depolarizzate.
• Diverse tossine naturali sono dei potenti bloccanti dei canali Na+ (es. tetrodotossina).

Canali al Na+ voltaggio-indipendenti
• Questi canali sono presenti negli epiteli, e soprattutto nel tubulo distale e nel dotto collettore del nefrone.
• Le dinamiche di apertura/chiusura sono modulate, tra l’altro, da vasopressina (ormone antidiuretico) e aldosterone.
• Sono bloccati da alcuni farmaci, definiti diuretici risparmiatori di potassio (es. amiloride).

Canali al K+
• Tutti i canali al K+, indipendentemente dal meccanismo di attivazione, spostano il potenziale di membrana verso i valori di riposo, allontanandolo dai valori soglia per l’inizio del potenziale d’azione riduzione dell’eccitabilità.
• Essenziali nella fase di ripolarizzazione del P.A.• Determinano la durata degli intervalli tra
potenziali d’azione successivi

Canali al K+ voltaggio-dipendenti
• Esistono diversi tipi di canali al K+ voltaggio-dipendenti (delayed rectifier, transient outward ecc.), che hanno proprietà biofisiche diverse tra loro, anche perché sono espressi in cellule di tessuti molto diversi.
• Svolgono un ruolo fondamentale nella fase di ripolarizzazione del potenziale d’azione e nel diminuire l’eccitabilità di cellule a riposo.
• Alcuni farmaci antiaritmici bloccano alcuni canali K+ voltaggio-dipendenti cardiaci prolungamento del potenziale d’azione prolungamento del periodo refrattario.

Canali al K+ voltaggio-indipendenti
1. Canali regolati da ATP. Regolano la secrezione di insulina da parte delle cellule del pancreas, ma sono presenti anche in altri tessuti (muscolatura liscia).
• Sono chiusi dall’ATP (che si lega a subunità ‘accessorie’ del canale). La chiusura provoca depolarizzazione della membrana fino ad un potenziale al quale si aprono i canali voltaggio-dipendenti al Ca++ ingresso di ioni Ca+
+ secrezione di insulina.
• La concentrazione di ATP aumenta quando aumenta il glucosio intracellulare. L’insulina viene quindi secreta quando c’è un aumento della concentrazione di glucosio.

• Gli ipoglicemizzanti orali agiscono ‘mimando’ l’effetto dell’ATP (chiudono quindi i canali).
• Altri farmaci (Potassium Channel Openers, KCO) determinano invece l’apertura di questi canali iperpolarizzazione diminuzione dell’ingresso di Ca++ attraverso i canali Ca++ voltaggio-dipendenti rilasciamento della muscolatura liscia.
• Alcuni di questi farmaci sono dei potenti ipotensivi (minoxidil, causa vasodilatazione), altri dei broncodilatatori (cromakalin). La relativa selettività d’azione di questi farmaci è dovuta al fatto che le subunità accessorie cui si legano i farmaci sono diverse da tessuto a tessuto.

2. Canali al K+ attivati da recettori accoppiati a proteine G.
• Sono attivati dalle subunità .
• Sono presenti soprattutto nel sistema nervoso e nel cuore e determinano inibizione dell’eccitabilità e del rilascio di neurotrasmettitori; sono accoppiati ai recettori di molti trasmettitori (es. oppioidi, adenosina ecc.)
3. Canali al K+ attivati dal Ca++ (intracellulare).

Controllo del Ca++ intracellulare
Processi Ca++-dipendenti:
• Secrezione di neurotrasmettitori
• Secrezione di ormoni
• Contrazione muscolare
• Controllo attività enzimatiche (chinasi, fosfolipasi, proteasi ecc.)
• Modulazioni attività di recettori, canali, trasportatori
• Trascrizione e duplicazione DNA
• Citotossicità (necrosi e apoptosi)

Ca++ libero e legato
• Il Ca++ si può legare reversibilmente a molte proteine
• Nel liquido extracellulare la concentrazione di Ca++ libero è circa 1 mM (50% del Ca++ totale)
• Nel citosol, la concentrazione di Ca++ libero è molto bassa (circa 100 nM, 1/10.000 del Ca++ totale)
• Nei depositi intracellulari (RE) il Ca++ libero è 0,1 – 1 mM (ca++ totale 50-100 mM)

• L’enorme differenza di concentrazione di Ca++ libero tra il liquido extracellulare e il citosol e tra i depositi cellulari e il citosol consente di accumulare molto rapidamente Ca++ nel citosol e di regolare quindi velocemente le funzioni Ca++-dipendenti.
• Le variazioni di Ca++ citosolico possono avvenire: Per apertura dei canali al Ca++ della membrana cellulare Per svuotamento dei depositi intracellulari Con entrambi i meccanismi

Apertura dei canali Ca++ della membrana cellulare
• Recettori-canale (es. recettore NMDA)• Canali voltaggio-dipendenti• Canali attivati da proteine G o da secondi
messaggeri• Canali attivati dallo svuotamento dei depositi
di Ca++ intracellulari

Svuotamento dei depositi intracellulari
• Apertura dei canali attivati da IP3 (II messaggero)• Apertura dei canali attivati dal Ca++ (calcium-
induced calcium release, canali sensibili alla rianodina): questi canali possono essere attivati dal flusso di ioni Ca++ provenienti dai canali di membrana o da quelli provenienti dai canali attivati da IP3.

• I canali attivati da IP3 sono modulati dal Ca++ stesso: a basse concentrazioni Ca++ è un modulatore positivo, ad alte concentrazioni è un modulatore negativo.
• Questa doppia modulazione consente di potenziare inizialmente l’efflusso di ioni Ca++ dal deposito; quando la concentrazione citosolica raggiunge un valore sufficientemente elevato, l’efflusso viene inibito cosicché i depositi possono ricaricarsi di Ca++ anche in presenza di IP3.

Eterogeneità spaziale della concentrazione di Ca++
• Le proteine citosoliche leganti il Ca++ non sono saturate in condizioni normali
• Ca++ diffonde quindi lentamente nel citosol perché si lega alle proteine
• Data la lentezza della diffusione, Ca++ può saturare rapidamente le proteine leganti nello spazio circondante il canale (di membrana o di un deposito celllulare)
• Si creano quindi zone ad alta concentrazione di Ca++ libero (10-100 M), mentre la concentrazione nell’intero citosol rimane molto più bassa (1 M). Questa eterogeneità serve ad attivare selettivamente alcune funzioni cellulari (es. fusione di vescicole sinaptiche)

Funzione dei depositi intracellulari
• La presenza di depositi cellulari, che possono essere attivati rapidamente da IP3, permette di aumentare rapidamente la concentrazione di Ca++ libero anche in zone della cellula distanti dalla membrana cellulare
• Se non esistessero questi depositi e il Ca++ provenisse solo dai canali della membrana cellulare, in queste zone ‘profonde’ la concentrazione di Ca++ libero aumenterebbe molto lentamente, per i processi descritti.

Proteine citosoliche leganti il Ca++
• Le proteine citosoliche leganti il Ca++ non sono saturate
• Per aumentare la concentrazione di Ca++ libero di 5 volte (da 100 a 500 nM) è necessario il passaggio nel citosol di circa 400 x 100 nmoli/l di Ca++
• Variazioni efficaci di Ca++ libero possono essere determinate solo dall’apertura di canali ad alta capacità (canali voltaggio-dipendenti ad alta soglia, canali dei siti di deposito)
• La proteina legante il Ca++ più diffusa è la calmodulina, che agisce anche da modulatore di molti enzimi

Pompe e trasportatori rimuovono il Ca++ dal citosol
Membrana cellulare:• Pompa al Ca++ (Ca++-ATPasi). Trasporta uno
ione Ca++ all’esterno della cellula consumando una molecola di ATP. La sua attività è stimolata dal complesso Ca++-calmodulina: aumento del Ca++ citosolico aumento della concentrazione di Ca++-calmodulina aumento dell’attività della pompa riduzione del Ca++ citosolico. La Ca++ATPasi è in grado di riportare alla normalità aumenti moderati di Ca++ libero citosolico.

• Quando gli aumenti di Ca++ libero sono maggiori, entra in azione lo scambiatore (antiporto) Ca++/Na+, che ha un’affinità minore rispetto alla pompa ma una maggiore capacità di trasporto.
• Lo scambiatore è ‘azionato’ dal gradiente di concentrazione del Na+, che è mantenuto dalla Na+/K+-ATPasi. Tanto maggiore è il gradiente tanto maggiore è l’estrusione di Ca++.
• Agenti che inibiscono la Na+/K+-ATPasi (digitalici) diminuiscono il gradiente Na+ persistenza dell’aumento di Ca++ intracellulare aumento della contrazione muscolare (azione inotropa positiva)

• Pompe al Ca++ (Ca++-ATPasi) sono presenti anche nel reticolo endoplasmatico

Canali al Ca++
• Canali voltaggio-dipendenti• Canali attivati da segnali intracellulari (proteine G,
IP3, Ca++)• Recettori-canale (es. recettore NMDA)

Canali al Ca++ voltaggio-dipendenti
• Funzionalmente e strutturalmente simili a quelli al Na+
• Ne esistono 2 classi, in base al potenziale di attivazione:1. Canali a bassa soglia (canali T): si attivano in seguito a
piccole depolarizzazioni e si inattivano molto rapidamente importanti nel controllo dell’eccitabilità.
2. Canali ad alta soglia: si attivano in seguito a forti depolarizzazioni e rimangono aperti più a lungo responsabili dei grandi aumenti di Ca++ intracellulare necessari per l’azione di secondo messaggero del Ca++. Ne esistono diversi sottotipi (L, N, P/Q, R), che differiscono per la sensibilità farmacologica.

I diversi tipi di canale differiscono per la composizione in subunità.
Farmaci che ‘bloccano’ i canali ad alta soglia di tipo L sono utilizzati come antiipertensivi, antiaritmici, nell’angina (i canali di tipo L sono presenti soprattutto nel sistema cardiovascolare).
Questi farmaci si legano preferenzialmente ai canali nello stato ‘inattivato’ e ‘stabilizzano’ i canali in questo stato.
L’effetto è una diminuzione delle correnti di calcio transmembrana in risposta ad uno stimolo depolarizzante.

Nel cuore, la diminuzione della corrente del calcio determina:
riduzione della forza di contrazione del miocardio;
diminuzione della frequenza del pacemaker del nodo del seno;
diminuzione della velocità di conduzione del nodo atrioventricolare.

Nella muscolatura liscia dei vasi, la diminuzione della corrente del calcio determina rilasciamento riduzione delle resistenze vascolari periferiche (arteriole) diminuzione della pressione arteriosa.
Gli effetti totali sono:
Diminuzione della pressione arteriosa;
Diminuzione del lavoro cardiaco e quindi del fabbisogno di ossigeno da parte del cuore;
Diminuzione del plateau del PA e diminuzione della velocità di conduzione AV