MAPPA CONCETTUALE - itiscalfaro-cz.it 8.i legami... · Per determinare la geometria molecolare è...
-
Upload
truongkhue -
Category
Documents
-
view
236 -
download
0
Transcript of MAPPA CONCETTUALE - itiscalfaro-cz.it 8.i legami... · Per determinare la geometria molecolare è...
Gli atomi ,ad eccezione dei gas nobili, si legano tra di loro a formare molecole o aggregati di ioni.
• Teoria di Lewis: – Gli elettroni esterni, di valenza, sono implicati nel legame chimico. – Se gli elettroni vengono trasferiti si ha legame
ionico. – Se gli elettroni sono in compartecipazione si ha
legame covalente – Gli atomi tendono ad assumere la configurazione elettronica dei gas nobili, regola dell’ottetto.
L’elettronegatività è la capacità di un atomo,che ha già formato un legame , di attrarre verso di sé gli elettroni del legame.
Importante: il tipo di legame che si forma tra gli atomi di due elementi dipende dalla loro differenza di elettronegatività. Se Δe ˃ 1,9 LEGAME IONICO Se Δe < 1,9 LEGAME COVALENTE
Il legame ionico è l'attrazione che si stabilisce tra le cariche opposte di cationi ed anioni : questi si formano grazie al trasferimento di elettroni dal metallo al non metallo.
• un atomo di K e un atomo di Cl si avvicinano, il K perde
un elettrone e diventa K+, mentre Cl acquista un elettrone diventando Cl- .
• Poi gli ioni si uniscono a formare un solido ionico che risulta stabile perché l'attrazione che nel solido ogni catione ha per ogni anione supera la repulsione tra ioni dello stesso segno.
Il legame ionico si forma tra un metallo e un non metallo con differenza di elettronegatività ≥ 1,9;
Il Metallo cede i suoi elettroni , trasformandosi in catione, al nonMetallo che si trasforma in anione;
I cationi e gli anioni si attraggono e formano un SOLIDO IONICO
Nel legame covalente gli elettroni responsabili del legame sono condivisi tra i due atomi legati.
Il legame chimico singolo(o semplice) coinvolge due elettroni che possono provenire da ciascuno dei due atomi legati ,oppure da uno solo dei due (legame covalente dativo).
Tra due atomi può instaurarsi più di un singolo legame. Si parla di legame multiplo: doppio ,se nel legame complessivo tra i due atomi sono coinvolte due coppie di elettroni; triplo, se sono coinvolte tre coppie di elettroni.
Il composto che si ottiene è di tipo molecolare
La condivisione di elettroni è equamente ripartita tra i due atomi solo quando questi sono identici es. H2, N2, O3, P4 (legame covalente omopolare).
In caso contrario gli elettroni di legame passano più tempo intorno all’atomo che ha maggiore capacità di attrarli verso di sé (cioè è più elettronegativo). In questi casi la molecola risultante presenta un eccesso di carica negativa localizzata su un atomo: si genera quindi un dipolo elettrico. Queste molecole sono dette dipolari(o semplicemente polari) e il legame si chiama legame covalente polare.
N.B: Δe < 0,4 Legame covalente apolare 0,4<Δe < 1,9 Legame covalente polare
Nel 1957 Gillespie elaborò una teoria che permette di ricavare le strutture molecolari delle Formule di Lewis.
Questa teoria è indicata con la sigla VSEPR: teoria della repulsione delle coppie di elettroni del guscio di valenza.
La teoria si basa sul concetto che ,siccome le nubi elettroniche si respingono, le coppie di elettroni esterni si dispongono il più lontano possibile l’una dall’altra. Non solo, ma i doppietti di non legame si respingono di più delle coppie di legame.
I legami covalenti semplici, doppi e tripli ,ai fini della geometria molecolare valgono come i legami covalenti singoli.
In linea di massima la forza repulsiva tra coppie di elettroni varia nel seguente modo: repulsione tra doppietti solitari > repulsione tra doppietti
solitari e doppietti condivisi > repulsione tra doppietti condivisi
Per determinare la geometria molecolare è necessario
calcolare il valore del numero sterico NS sommando il numero di atomi (X), legati all'atomo centrale (A), e il numero di coppie di elettroni libere presenti sull'atomo centrale. In base a questo valore è possibile prevedere la geometria della molecola.
Ogni molecola potrà essere rappresentata con la formula generica AX n Em
in cui A rappresenta l'atomo centrale, X il numero di atomi legati all'atomo centrale ed E le coppie di elettroni di non legame presenti sull' atomo centrale.
NS = 2; geometria lineare Per molecole con struttura AX2 La geometria lineare è assunta da quelle molecole il
cui atomo centrale presenta due legami chimici e nessun doppietto solitario e che quindi hanno formula generica AX2. (A = atomo centrale; X = atomi legati all'atomo centrale).
Queste molecole risultano lineari X—A—X
e i due legami si dispongono a 180° l'uno dall'altro. Es: BeH2
NS = 3 ; geometria trigonale planare Per molecole con struttura AX3, AX2E. Molecole ,con tre legami e nessun doppietto
solitario sull'atomo centrale (molecole con formula generica AX3), assumono geometria trigonale planare con i legami disposti su un unico piano a 120° l'uno dall'altro.
Presentano questa geometria il tricloruro di boro (BCl3)
Molecole ,con due legami e una coppia di elettroni solitaria sull'atomo centrale (molecole con formula generica AX2E), assumono geometria angolata (derivata dalla geometria trigonale planare). A causa della maggior repulsione della coppia solitaria sulle coppie di legame, l'angolo di legame risulta inferiore a 120°.
Presenta questa geometria l'anidride solforosa SO2
NS = 4 ; geometria tetraedrica Per molecole con struttura AX4, AX3E, AX2E2. Molecole, con quattro legami e nessun doppietto solitario
sull'atomo centrale (molecole con formula generica AX4), assumono geometria tetraedrica con i legami disposti a 109,5° l'uno dall'altro.
Presenta questa geometria il metano (CH4). Molecole ,con tre legami e una coppia di elettroni solitaria
sull'atomo centrale (molecole con formula generica AX3E), assumono geometria piramidale (derivata dalla geometria tetraedrica). A causa della maggior repulsione della coppia solitaria sulle coppie di legame, l'angolo di legame risulta essere inferiore a 109,5°.
Presenta questa geometria la molecola dell'ammoniaca NH3 nella quale gli angoli di legame sono di 107,3°.
Molecole, con due legami e due coppie di elettroni solitarie sull'atomo centrale (molecole con formula generica AX2E2), assumono geometria angolata (derivata dalla geometria tetraedrica). Le due coppie solitarie occupano due vertici del tetraedro ed esercitando una forte repulsione nei confronti degli elettroni di legame, comprimono l'angolo di legame a valori inferiori rispetto a quelli caratteristici della geometria piramidale.
Presenta questa geometria la molecola dell'acqua H2O nella quale gli angoli di legame sono di 104,5°.
Perché una molecola sia polare, cioè abbia una parte parzialmente carica positivamente e una parte parzialmente carica negativamente a causa di uno squilibrio di elettroni verso gli atomi più elettronegativi, occorre:
La presenza di uno o più legami covalenti polari
La giusta geometria molecolare Entrambi questi fattori infatti portano la
molecola a comportarsi come un dipolo elettrico.
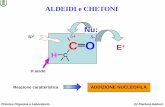
LEGAMI DIPOLO-DIPOLO : si formano tra le parti di polarità opposta di molecole polari con dipoli elettrici permanenti. (Fig 1) es: acetone
FORZE DI LONDON: si formano tra le polarità opposte di dipoli elettrici temporanei che si vengono a formare in molecole apolari.(Fig2) es: esano
LEGAME IDROGENO: si forma tra l’idrogeno parzialmente positivo, perché legato ad un atomo molto elettronegativo di una molecola, e l’atomo parzialmente negativo di una seconda molecola. Es acqua, etanolo… (può essere anche intramolecolare es proteine, DNA).(Fig 3 )
Solidi ionici (KCl) Solidi covalenti (diamante,grafite) Solidi molecolari (ghiaccio) Solidi metallici (metalli e leghe)