L'interleuchina -...
-
Upload
nguyenkien -
Category
Documents
-
view
217 -
download
3
Transcript of L'interleuchina -...

L'interIeuchina 2 (IL 2) si lega con un recettore situato sulla mem-brana esterna dei linfociti T del sistema immunitario, stimolati daun antigene. Il recettore è costituito da una catena proteica di gran-di dimensioni (75 chilodalton) e da una più piccola (55 chilodalton),
ciascuna delle quali si lega separatamente alla molecola di interleu-china 2. L'interazione tra questa molecola e la catena più lunga se-gnala al linfocita T che deve proliferare, potenziando così l'attac-co specifico del sistema immunitario a un microrganismo invasore.
INTERLEUCHINA 2
CATENADA 75 CHILODALTON
CATENADA 55 CHILODALTON
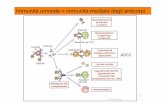
L'interleuchina 2Primo ormone riconosciuto del sistema immunitario, contribuisce aerigere una difesa contro i microrganismi innescando la moltiplicazionedi quelle cellule che sono in grado di contrattaccare gli invasori
su basi cellulari del sistema immunitarioe si scoprì che i linfociti appartengono adue tipi principali: i linfociti B e i linfo-citi T. I linfociti B. che derivano dal mi-dollo osseo, espongono le molecole dianticorpo sulla propria superficie, comeaveva immaginato Burnet. Esperimenticompiuti da Gustav Nossal dello Hall In-stitute e da Jerne e Albert A. Nordindell'Università di Pittsburgh hanno di-mostrato che ogni linfocita B diventauna plasmacellula che secerne anticorpidotati di specificità quando viene stimo-lato da un antigene specifico.
I linfociti T, che maturano nel timo,non producono anticorpi, ma portanosulla membrana esterna recettori speci-fici per l'antigene, che somigliano in mo-do sorprendente alle molecole di anti-corpo e si legano selettivamente all'anti-gene. Come i linfociti B. essi reagisconoallo stimolo antigenico secernendo mo-lecole che mediano la loro funzione im-munitaria. In base alla natura di questemolecole, i linfociti T si dividono ulte-riormente in linfociti Tcoadiuvanti (hel-per) e linfociti T citotossici (killer). Oggisi sa che i primi hanno il compito di se-
cernere interleuchine. Per contro, i lin-fociti T citotossici stabiliscono un con-tatto diretto con le cellule infettate e,secernendo molecole tossiche, uccidonole cellule e gli agenti patogeni in essecontenuti.
I linfociti T, in particolare, si sono di-mostrati un buon modello sperimentaleper lo studio della risposta immunitaria.Quando un antigene è iniettato in un or-ganismo, l'unica risposta immunitaria ri-levabile è proprio la reazione specificacontro quell'antigene. Anche in colturala proliferazione dei linfociti T è antige-
di Kendall A. Smith
D
a quando, nel 1797, Edward Jen-ner introdusse la vaccinazionecome mezzo per prevenire il
vaiolo, i ricercatori sono sempre rimastiaffascinati e sconcertati dal sistema im-munitario. Negli ultimi due secoli si èappreso gradualmente che il funziona-mento di questo sistema dipende dall'a-zione concertata di vari tipi cellulari delsangue e dei tessuti, che sono estrema-mente specializzati e svolgono ciascunouna funzione esclusiva. Eppure, mentresi allungava l'elenco delle cellule immu-nitarie, rimaneva oscuro il modo in cuiquesta moltitudine di cellule separate ri-uscisse a coordinare le proprie attività inuna difesa selettiva dalle malattie. Diconseguenza, ancora in tempi recentil'immunità era un fenomeno misteriosoe l'immunologia appariva anche ai bio-logi esperti in altre discipline come unascienza terribilmente complessa e riser-vata a pochi eletti.
Negli ultimi 10 anni, tuttavia, l'immu-nologia è stata rivoluzionata dalla dimo-strazione che il sistema immunitario èregolato da specifici ormoni proprio co-me lo sono quasi tutti gli altri sistemidell'organismo. Oggi l'immunologia nonè più una scienza che si distingue per unaterminologia e una serie di meccanismialtamente specializzati. Al contrario, lascoperta e la caratterizzazione delle in-terleuchine, cioè degli ormoni del siste-ma immunitario, hanno chiarito che larisposta immunitaria opera secondo glistessi principi che regolano gli ormoniclassici e i loro recettori.
L'interleuchina 2 (IL 2) è stato il pri-mo ormone del sistema immunitario aessere scoperto e caratterizzato. Benchégli immunologi riconoscano oggi ben ot-to interleuchine, le funzioni di alcune so-no ancora indeterminate o non ricolle-gabili direttamente all'immunità; percontro, l'IL 2 ha un'importanza fonda-mentale per l'elaborazione di una rispo-sta immunitaria efficace. Pertanto la co-noscenza di questo ormone e dei suoirecettori schiude la via allo sviluppo di
terapie indirizzate a una vasta gamma dicondizioni patologiche come neoplasie,malattie autoimmuni, infezioni croni-che, sindrome da immunodeficienza ac-quisita (AIDS) e rigetto dei trapianti.
La comprensione del ruolo della IL 2ha avuto un peso notevole nel chiari-mento delle proprietà specifiche del si-stema immunitario. Proprio come il si-stema nervoso avverte le variazioni deglistimoli luminosi, sonori e di altro genereche provengono dall'ambiente e vi rea-gisce, così il sistema immunitario si met-te in allarme in seguito all'invasione dimolecole estranee (antigeni) che si pre-sentano sotto forma di microrganismi(batteri, virus, funghi e parassiti in gene-re). Per svolgere i propri compiti il siste-ma immunitario combina tre caratteri-stiche del tutto originali. In primo luogo,la risposta immunitaria è nel contempoestremamente specifica ed estremamen-te diversificata: queste proprietà consen-tono all'organismo di riconoscere qual-siasi microrganismo o molecola estraneae di reagire. Il sistema immunitario haanche la straordinaria capacità di distin-guere il «proprio» dal «non proprio» esolo raramente attacca i tessuti dell'or-ganismo a cui appartiene. Infine, il siste-ma immunitario ha una memoria: dopoesposizione a un antigene, subisce mo-difiche misteriose che lo rendono capacedi rispondere con rapidità e intensità no-tevolmente superiori a nuove eventualiesposizioni allo stesso antigene.
Nel 1955, mentre lavorava al Califor-nia Institute of Technology, Niels K. Jer-ne, che nel 1984 ha ottenuto il premioNobel per la fisiologia o la medicina in-sieme a J. F. Kohler e C. Milstein, posele basi per l'attuale conoscenza del siste-ma immunitario, proponendo che la re-attività immunitaria si basasse sul prin-cipio darwiniano della selezione natura-le. Si sapeva già che nel sangue le mole-cole di anticorpo reagiscono in modospecifico con gli antigeni. Jerne ipotizzòche ciascun organismo possedesse ini-zialmente un ristretto numero di anticor-
pi diretti contro ogni possibile antigenee che gli anticorpi subissero una selezio-ne positiva (per usare la terminologia diDarwin) e aumentassero di numero inoccasione del legame con l'antigene.
Quattro anni dopo un altro premioNobel, Sir Macfarlane Burnet del
Walter and Eliza Hall Institute of Medi-cal Research di Melbourne, in Australia,pubblicò un volumetto dal titolo TheClonal Selection Theory of Acquired Im-munity, in cui forniva una base cellularealla teoria di Jerne, basata sulla selezio-ne naturale. Egli propose che ogni mo-lecola di anticorpo fosse il prodotto diuna singola cellula. Secondo Burnet,l'antigene reagisce direttamente con lacellula che genera l'anticorpo per stimo-larne la produzione. (Quest'idea era giàstata suggerita nel 1905 da Paul Ehrlich,pioniere nel campo dell'immunologia eanch'egli premio Nobel.) Nell'ipotesi diBurnet era implicito il fatto che, dopol'attivazione selettiva da parte di un an-tigene, la cellula produttrice dell'anti-corpo proliferase formando un clone,cioè un insieme di cellule aventi un ca-postipite comune.
All'epoca in cui Burnet avanzò la suaproposta, le cellule responsabili della ri-sposta diretta contro gli antigeni nonerano note, anche se si era sufficiente-mente certi che le plasmacellule, un tipodi globuli bianchi del sangue, produces-sero notevoli quantitativi di anticorpi. Ilinfociti, le cellule preponderanti nei lin-fonodi, erano i candidati più ovvi al com-pito di reagire inizialmente con gli anti-geni e quindi fungere da precursori delleplasmacellule. Ma si pensava, in genera-le, che essi fossero incapaci di prolifera-re. Tuttavia solo un anno dopo, nel1960, Peter C. Nowell dell'Universitàdella Pennsylvania scoprì che anche i lin-fociti proliferano, purché ricevano unostimolo chimico appropriato.
Nel decennio che seguì la formulazio-ne dell'ipotesi di Burnet e la scoperta diNowell, si consolidarono le conoscenze
24 LE SCIENZE n. 261, maggio 1990 LE SCIENZE n. 261, maggio 1990 25

MACROFAGO
Le principali cellule del sistema immunitario svolgono vari compiti. I due tipi di linfociti Treagiscono a specifici antigeni (molecole estranee). I linfociti T citotossici (killer) uccidonole cellule infettate e i microrganismi invasori secernendo molecole tossiche. I linfociti T coa-diuvanti (helper) secernono le interleuchine, o fattori di crescita, che potenziano la rispostaimmunitaria. I linfociti B sono simili ai linfociti T, ma non attaccano i microrganismi: sevengono stimolati da un antigene essi si differenziano in plasmacellule che secernono anti-corpi per combattere gli invasori. Le cellule NK (natura! killer) non sono antigene-specifi-che, ma attaccano qualsiasi agente patogeno estraneo. I macrofagi inglobano i microrgani-smi e ne presentano gli antigeni ai linfociti T, per avviare la risposta immunitaria specifica.
• •A A INGLOBA A
ONF TA GGOE N E
AA
•• •
L'ANTIGENE PRESENTATOA UN LINFOCITA T LOATTIVA
•
LINFOCITA TINATTIVATO • I •
••• OCI!
••I LINFOCITI T FIGLI
ASPETTANO DI ESSERE ATTIVATIDALL ANTIGENE
LINFOCITA T ATTIVATOCHE SECERNE LA IL 2
E NE PRODUCE I RECETTORI
LA IL 2 INNESCALA DIVISIONE
DEI LINFOCITI T
• INTERLEUCHINA 2 (IL 2)
A ANTIGENE
La proliferazione dei linfociti T è controllata dalla IL 2 dopo che un antigene, inglobato epresentato da un macrofago, attiva i singoli linfociti T. L'antigene stimola i linfociti T a se-cernere IL 2 e a produrre recettori per questa molecola. Il legame della IL 2 con i recettorisegnala poi ai linfociti T che devono dividersi, formando coppie di linfociti figli che possonoanch'essi essere attivati dall'antigene. Si sviluppa così un clone di linfociti T antigene-spe-cifici identici, che cresce finché il sistema immunitario elimina l'antigene dall'organismo.
LINFOCITA T
PLASMACELLULA
ne-specifica: solo le cellule che reagisco-no con un dato antigene sopravvivono esi moltiplicano. Per questa ragione, nel1965 la coltura a breve termine di linfo-citi T venne adottata come una riprodu-zione in provetta della risposta immuni-taria. Il comportamento dei linfociti Tincoltura aiutava inoltre, a spiegare il fe-nomeno della memoria immunitaria: l'e-sposizione a un antigene fa aumentareselettivamente il numero di linfociti chein futuro potranno reagire con esso.
Gli immunologi avevano sempre datoper scontato che l'antigene fosse
l'unico stimolo per la divisione dei linfo-citi B e T. Questo assunto, che divenneun dogma, dovette essere rovesciatoperché l'immunologia procedesse versouna descrizione più dettagliata e accura-
LINFOCITA B
CELLULA NK
ta di come opera il sistema immunitario.Le origini delle attuali conoscenze sui
meccanismi che stimolano lo sviluppodei linfociti si possono far risalire al1965, quando Shinpei Kasakura e LouisLowenstein e, indipendentemente, J.Gordon e Lloyd D. MacLean, tutti delRoyal Victoria Hospital di Montreal,pubblicarono contemporaneamente leloro scoperte su «Nature». Entrambi igruppi riferivano che i terreni colturali«condizionati» da linfociti in fase di pro-liferazione contenevano una sostanzanon identificata che potenziava lo svilup-po dei linfociti in presenza dell'antigene.
Nel decennio successivo apparveroparecchi lavori su queste misteriose so-stanze che favoriscono la crescita dei lin-fociti, ma la maggior parte degli immu-nologi li ignorò e continuò a sostenere
che gli unici agenti responsabili dellaproliferazione dei linfociti fossero gli an-tigeni. Al massimo, si riteneva che il fat-tore presente nel terreno colturale con-dizionato dai linfociti amplificasse laproliferazione già innescata da un anti-gene. Convinti di questo, agli inizi deglianni settanta vari ricercatori pubblicaro-no articoli che descrivevano metodi percoltivare i linfociti per lunghi periodi ditempo mediante l'aggiunta ripetuta diantigene. Ricorrendo a queste tecniche,si poté stimolare la proliferazione di lin-fociti in coltura anche per quattro mesi,durante i quali i linfociti conservavano laspecificità per l'antigene.
Gli immunologi dubitavano che unfattore liberato dalle cellule potesse sti-molare specificamente la divisione deilinfociti perché esso avrebbe dovuto am-plificare la proliferazione di tutti i linfo-citi, indipendentemente dal fatto che es-si avessero incontrato il loro antigenespecifico. Nel 1976, tuttavia, Doris A.Morgan, che lavorava con Francis W.Ruscetti nel laboratorio di Robert C.Gallo al National Cancer Institute diBethesda, riferì che si potevano coltiva-re senza antigene linfociti T umani nor-mali anche per nove mesi, purché a in-tervalli regolari si aggiungesse alle coltu-re un terreno condizionato dai linfociti.
In realtà, l'osservazione della Morganera stata fortuita. Novizia, per sua stessaammissione, nel campo delle colture dilinfociti, ella era esperta in ematologiaed ematopoiesi (il processo mediante ilquale si sviluppano le cellule del san-gue). Nel cercare di ottenere colture alungo termine di cellule leucemiche, siservì come stimolante di un terreno col-turale condizionato dai linfociti, datoche questi liberano fattori che promuo-vono lo sviluppo dei precursori delle cel-lule ematopoietiche. Con suo iniziale di-spiacere, la Morgan osservò che le cellu-le di pazienti leucemici che venivano fat-te crescere sul terreno di coltura condi-zionato dai linfociti sembravano esserelinfociti T normali anziché cellule leuce-miche. Per gli immunologi, però, i suoirisultati furono importanti in quantosuggerivano l'esistenza nel mezzo condi-zionato di un fattore responsabile dellaproliferazione dei linfociti Tdiverso dal-l'antigene.
Benché l'articolo della Morgan fossestato pubblicato sulla prestigiosa rivista«Science», il suo significato non vennecolto immediatamente da gran parte de-gli immunologi. La ricercatrice e i suoicollaboratori erano ben noti in ambienteematologico e virologico, mentre eranoper lo più estranei a quello immunologi-Co. Il titolo dell'articolo sottolineava chei linfociti T coltivati provenivano dal mi-dollo osseo, il che significava che essipotevano essere immaturi o comunquenon rappresentativi dei linfociti T in ge-nerale. Ma, fatto ancora più importante,non era stato dimostrato che i linfociticoltivati eseguissero funzioni specificheper l'antigene e gli immunologi erano
tradizionalmente indifferenti ai fenome-ni nei quali era assente la specificità perl'antigene.
Come la Morgan, anch'io avevo mag-gior esperienza nel campo dell'ema-
tologia e dell'ematopoiesi che in quellodell'immunologia. Dopo il dottorato,avevo lavorato con Georges Mathé al-l'Institut de Cancérologie et d'Immuno-génétique a Villejuif, in Francia. Mathéera stato uno dei primi ricercatori a cer-care di curare la leucemia con l'immuno-terapia. Nel tentativo di trovare un me-todo per uccidere le cellule leucemiche,ero stato attratto dalla possibilità di sti-molare la crescita dei linfociti citotossici.Nel 1974, in qualità di professore aggiun-to di medicina alla Dartmouth MedicalSchool, avviai perciò un programma diricerca per conoscere i fattori che deter-minano la proliferazione cellulare. Giànel 1976 avevo dimostrato insieme aimiei collaboratori che i linfociti T cito-tossici potevano uccidere in coltura cel-lule leucemiche di topo; tuttavia erava-mo frustrati dalla nostra incapacità dimantenere i linfociti T in coltura per piùdi qualche giorno. Decidemmo, pertan-to, di cercare nuovi metodi per ottenereuna proliferazione antigene-specifica, alungo termine, dei linfociti T.
Non vincolati dai dogmi dell'immuno-logia, combinammo i metodi già speri-mentati da altri ricercatori. In primo luo-go, vaccinammo ripetutamente topi concellule tumorali irradiate per ampliare inquesti animali la popolazione di linfoci-ti T in grado di reagire ai tumori. I lin-fociti T di questi topi furono quindi me-scolati in coltura con cellule tumorali: inquesta coltura a breve termine sarebbe-ro sopravvissuti e avrebbero proliferatosolo quei linfociti che reagivano con l'an-tigene tumorale. Dopo una settimana odue, i linfociti T sopravvissuti furonotrasferiti su un terreno colturale condi-zionato dai linfociti, simile a quello de-scritto dalla Morgan. Steven Gillis, chea quell'epoca era al primo anno del corsodi perfezionamento, fu il primo a otte-nere in laboratorio colture di linfociti Ta lungo termine.
In breve, benché tutti pensassero cheil nostro metodo avrebbe dovuto fallireperché avevamo rimosso l'antigene tu-morale specifico, riuscimmo a osservare,nel terreno colturale condizionato dailinfociti, lo sviluppo a lungo termine dilinfociti T citotossici specifici per Fanti-gene tumorale. Il nostro articolo appar-ve nel luglio 1977 su «Nature» e, contra-riamente a quanto era successo per il la-voro della Morgan, destò l'interesse de-gli immunologi perché poneva l'accentosulla coltivazione di linfociti T funzio-nanti e antigene-specifici.
Il successo ottenuto ci spinse a tentaredi dimostrare direttamente l'ipotesi do-nale di Burnet producendo cloni di lin-fociti antigene-specifici, tutti derivati daun'unica cellula. Anche qui l'opinioneprevalente era che questo compito fosse
quasi impossibile da realizzare perché,in genere, le singole cellule proliferanopoco in coltura (quando lo fanno). Inve-ce, l'aggiunta di terreno di coltura con-dizionato dai linfociti ci permise di otte-nere con sorprendente efficienza cloni dilinfociti T. Ogni clone dimostrava unacitotossicità antigene-specifica che pote-va essere attribuita al fatto che il clonederivava da un'unica cellula. Comuni-cammo di aver ottenuto le prime lineecellulari monoclonali costituite da linfo-citi T citotossici nel 1979, 20 anni dopoche Burnet aveva formulato la teoriadella selezione donale.
Problemi fondamentali che l'immuno-
logia non aveva potuto affrontare conpopolazioni eterogenee di linfociti han-no trovato una soluzione grazie alle lineecellulari donate antigene-specifiche. Peresempio, la capacità di ottenere in col-tura quantità illimitate di linfociti T i-dentici ha portato alla caratterizzazionemolecolare del recettore per l'antigenenel linfocita T. Ha permesso, inoltre, didimostrare in modo inequivocabile cheuna struttura proteica, il maggior com-plesso di istocompatibilità, svolge unruolo essenziale nel riconoscimento del-l'antigene da parte dei linfociti T. Lapossibilità di produrre cloni di linfociti Tcoadiuvanti e citotossici ha contribuito
26 LE SCIENZE n. 261, maggio 1990
LE SCIENZE n. 261, maggio 1990 27

La struttura molecolare della IL 2 è stata rivelata dalla cristallografia a raggi X. 1133amminoacidi che costituiscono lo scheletro della proteina sono avvolti a elica e ripiegati inmodo da fare assumere alla molecola una forma grossolanamente sferica. I cilindri indicaticon le lettere da A a F rappresentano eliche compatte. La IL 2 deve essere strutturalmenteintegra per poter reagire con entrambe le catene proteiche che costituiscono il suo recettore.
,
- PRIMA ESPOSIZIONEALL'ANTIGENE
SECONDA ESPOSIZIONEALL'ANTIGENE
10
20
30
sostanzialmente all'identificazione deimeccanismi molecolari responsabili del-l'attività di queste cellule. In breve, lacapacità di ottenere cloni di linfociti Tincoltura e di manipolarli ha permesso didimostrare a livello molecolare l'ipotesidella selezione clonale di Burnet.
I nostri primi esperimenti hanno chia-rito come la selezione di un clone me-diante un processo antigene-specificopossa avviare una proliferazione cellula-re che dipende solo da un fattore di cre-scita. La spiegazione più logica è che unlinfocita, quando è attivato da un anti-gene, sviluppa una capacità particolaredi reagire al fattore di crescita, mentregran parte dei linfociti (che non reagisco-no a quell'antigene) rimane inattiva.
I miei collaboratori e io abbiamo ef-fettuato una serie di esperimenti per ve-rificare questa teoria e, nel 1978, abbia-mo presentato i nostri risultati a una del-le più prestigiose riviste di immunologia.Tuttavia, con nostro disappunto, l'ideadi un fattore di crescita era ancora con-siderata un'eresia: tutti «erano certi» chel'unica cosa che stimolasse i linfociti T aproliferare era l'antigene. A quanto pa-reva, il comitato di redazione era scetti-co e insisteva per avere dati biochimiciparticolareggiati sul fattore, informazio-ni che noi non avevamo.
Di conseguenza, abbiamo dedicatotutti i nostri sforzi a definire le ca-
ratteristiche sia biologiche sia biochimi-che del fattore di crescita dei linfociti T.
Benché fattori di crescita dei linfocitifossero stati descritti fin dal 1965, nessu-no aveva elaborato un saggio quantitati-vo per misurarne l'attività e pertantonon era possibile, durante i procedimen-ti di purificazione, individuare e con-frontare le quantità relative dei vari fat-tori. Il problema principale che avevaintralciato i primi ricercatori nel caratte-rizzare questi fattori era stato l'uso dicolture eterogenee di cellule. Per questomotivo era impossibile stabilire qualicellule reagissero a ciascuno dei moltifattori presenti nel terreno colturale con-dizionato dai linfociti.
Tuttavia, avendo già prodotto lineemonoclonali di linfociti dipendenti dalfattore di crescita, il problema dell'ete-rogeneità cellulare era risolto. Inoltre,durante il corso di specializzazione, ave-vo messo a punto un saggio quantitativoper l'eritropoietina, il fattore di crescitadei globuli rossi, ed era relativamentesemplice adattarlo alla misurazione delfattore di crescita dei linfociti T.
Avendo a disposizione un metodo dianalisi rapido e quantitativo, abbiamoeseguito una serie di esperimenti, poipubblicati tra il 1978 e il 1983 in diversiarticoli che nel complesso descrivevanoper la prima volta le caratteristiche bio-logiche e biochimiche del fattore di cre-scita dei linfociti T, oggi noto come in-terleuchina 2 (IL 2). Questi studi hannodimostrato che il sistema immunitario,dopo aver avvertito la presenza di unantigene, trasferisce il controllo sulla ri-
sposta immunitaria da un meccanismoregolato dall'antigene a un sistema rego-latore di tipo ormonale.
Il processo si svolge come segue.Quando un antigene viene introdottonell'organismo, è inglobato dai macro-fagi (cellule capaci di fagocitare particel-le estranee) e dai linfociti B, che lo di-geriscono e alla fine presentano cortisegmenti della sua molecola in superfi- •cie. La maggior parte dei linfociti T nonriconosce gli antigeni presentati e conti-nua a spostarsi tranquillamente nel cir-colo sanguigno e nel sistema linfatico.Alcuni linfociti T, invece, possiedonorecettori per gli antigeni che si leganoagli antigeni presentati, stimolando cosìi linfociti stessi. Questi, una volta stimo-lati dall'antigene, diventano «fabbriche»autonome di fattore di crescita, sia se-cernendo la IL 2 sia reagendo a essa conla proliferazione cellulare. Il risultato fi-nale è l'espansione di quei cloni di linfo-citi T che reagiscono allo stimolo pro-dotto dall'antigene.
Pur essendo riusciti a dimostrare chesolo i linfociti T attivati dall'antigene ri-spondono alla IL 2, non sapevamo comequesto fattore interagisse con le celluleper produrre i propri effetti. Avevo ilsospetto che il meccanismo chiamasse incausa i recettori per la IL 2 presenti sullasuperficie cellulare, proprio come i re-cettori per l'insulina mediano l'attività diquesto ormone. Ben presto i nostri espe-rimenti dimostrarono che i linfociti T at-tivati potevano assorbire l'attività dellaIL 2, proprio come se fossero dotati direcettori per questo ormone.
I risultati ottenuti ci spinsero a produr-re e a purificare IL 2 marcata con isotopiradioattivi, il che ci offriva la possibilitàdi osservare direttamente il processo. Irisultati raccolti con i nostri primissimiesperimenti erano chiari: la IL 2 si legaai linfociti T grazie alla presenza sullaloro superficie di un recettore ad affinitàelevata.
L'applicazione dell'abbinamento or-mone-recettore al sistema immunitarioha avuto un impatto straordinario suimodelli della regolazione immunitaria.L'immunologia cellulare aveva sostenu-to in passato che i macrofagi, i linfociti Be i linfociti T comunicavano tra loro soloper stretto contatto. Dopo la scopertadella IL 2 e di altri fattori solubili e l'ac-quisizione del concetto che l'espressionedei recettori per la IL 2 determina qualicellule partecipino alla risposta immuni-taria, le interazioni tra cellule del siste-ma immunitario persero parte del loromistero. Divenne possibile conoscerle inbase a principi tratti dall'endocrinologia,principi che descrivono le interazioni de-gli ormoni e dei loro recettori.
Nel 1982 era ormai evidente che percomprendere i meccanismi moleco-
lari che fanno proliferare i linfociti T sa-rebbe stato necessario conoscere sia lastruttura della IL 2 sia quella del suo re-cettore. La conoscenza strutturale della
molecola avrebbe anche permesso diprogettare agenti in grado di bloccareterapeuticamente o imitare l'interazioneormone-recettore. Il primo passo impor-tante verso questi obiettivi fu l'isolamen-to del gene per la IL 2, compiuto nel1983 da Tadatsugu Taniguchi e collabo-ratori dell'Università di Tokyo.
Una volta isolato un gene, la tecnicadi donazione permette di ottenere laproteina codificata da quel gene in quan-tità praticamente illimitate. In effetti,negli ultimi sei anni, la IL 2 è stata pro-dotta da ditte specializzate nel campodelle biotecnologie e distribuita in tuttoil mondo. La sua disponibilità in grandiquantitativi e in forma pura ha permessonel 1987 a David B. McKay e ai suoicollaboratori dell'Università del Colora-do a Boulder di ottenerla allo stato cri-stallino e di stabilirne la struttura tridi-mensionale mediante cristallografia araggi X.
Nel 1984, Warren J. Leonard e colla-boratori, che lavoravano nel laboratoriodi Thomas A. Waldmann presso il Na-tional Cancer Institute, e Toshio Nikai-do , assieme a Tasuku Honjo, a TakashiUchiyama e ad altri dell'Università diKyoto, hanno dato contemporaneamen-te la notizia dell'isolamento di un gene
A
responsabile della sintesi di un ipoteticorecettore proteico per la IL 2. Questaproteina reagiva con un anticorpo mo-noclonale prodotto da Uchiyama e diret-to contro il recettore della IL 2; tuttavia,la piccola dimensione della catena pro-teica e la sua scarsa affinità per la IL 2facevano pensare che non fosse il recet-tore completo della IL 2. Poi, nel 1986,Keisuke Teshigawara dell'Università diKyoto, che lavorava nel nostro labora-torio a Dartmouth, e Mitsuru Tsudo, an-ch'egli dell'Università di Kyoto ma ospi-te nel laboratorio di Waldmann , hannoscoperto indipendentemente una secon-da e più grossa catena presente nel re-cettore della IL 2.
Si è stabilito così che il recettore dellaIL 2 è formato da due catene: l'una di 55chilodalton e in grado di reagire con l'an-ticorpo ottenuto da Uchiyama, l'altra di75 chilodalton. Michael Sharon del Na-tional Institute of Child Health andHuman Development, lavorando conLeonard, ha raccolto dati che sostengo-no questa interpretazione. Nell'autun-no del 1986 la maggior parte dei ricerca-tori in questo settore aveva già comin-ciato a competere per l'isolamento e lacaratterizzazione della nuova catena da75 chilodalton.
Fu Tsudo, che nel frattempo aveva as-sunto un nuovo incarico al MetropolitanInstitute for Medical Scie nces di Tokyo,a vincere la gara: alla metà del 1988 egliaveva ottenuto anticorpi monoclonaliche reagivano con la catena da 75 chilo-dalton. Successivamente cominciò a col-laborare con Masanori Hatakeyama, ungiovane ematologo che lavorava nel la-boratorio di Taniguchi all'Università diOsaka. Utilizzando gli anticorpi prepa-rati da Tsudo, Hatakeyama riuscì poi aidentificare e a isolare il gene che codi-fica per la catena da 75 chilodalton.
Mentre questi studi procedevano, aDartmouth abbiamo concentrato tutti inostri sforzi nella definizione del ruolodel sistema recettore della IL 2 nella ri-sposta immunitaria. In una serie di espe-rimenti, Doreen A. Cantrell ha determi-nato come operi il meccanismo del re-cettore della IL 2 durante la risposta im-munitaria di un linfocita T modello e hascoperto che vi sono soltanto tre para-metri importanti che regolano la prolife-razione dei linfociti T dopo l'attivazionedell'antigene: la concentrazione dellaIL 2, la densità dei recettori della IL 2alla superficie del linfocita e la duratadell'interazione tra IL 2 e recettore.chiaro che, prima che una cellula comin-
GIORNI
La base cellulare della risposta immunitaria spiega il fenomeno del- risposta immunitaria non è riconoscibile per 10-14 giorni, perchéla memoria immunitaria per cui l'organismo reagisce a un antige- occorre del tempo prima che il clone di linfociti T antigene-specificine più rapidamente e più intensamente dopo successive esposizioni
si sviluppi fino a dimensioni adeguate. Dopo la seconda esposizione
di quanto non faccia dopo la prima esposizione. Nello schema l'in- il tempo di latenza è più breve perché il numero di linfociti T pre-tensità della risposta immunitaria è proporzionale allo spessore senti nel sangue e in grado di reagire con l'antigene è già elevato. Ladella banda in colore. Dopo la prima esposizione a un antigene, la crescita esponenziale del clone intensifica la risposta immunitaria.
28 LE SCIENZE n. 261, maggio 1990 LE SCIENZE n. 261, maggio 1990 29

• • •
•
•
••
2 •
••
••(
-i) nr •
• • •
•
•
•
•
rél
!
3
La soppressione selettiva della risposta immunitaria è auspicabile in pazienti sottoposti atrapianto d'organo o affetti da malattie autoimmunitarie. Si potrebbe interferire con il le-game tra l'IL 2 e i suoi recettori sui linfociti T iniettando nell'organismo anticorpi control'IL 2(1). Anticorpi contro il recettore della IL 2 dovrebbero avere lo stesso effetto perchéle molecole di IL 2 non riuscirebbero a trovare recettori vacanti (2). Un'alternativa è l'ino-culazione di recettori solubili per l'IL 2, i quali competerebbero con i recettori cellulari (3).
ci a dividersi irrevocabilmente, devonoverificarsi molte interazioni tra la IL 2 eil suo recettore nell'arco di alcune ore.
Huey-Mei Wang, che ha da poco ini-ziato la specializzazione nel mio labora-torio, ha esteso questi risultati mostran-do che il recettore della IL 2 funzionacome un interruttore «acceso/spento».La IL 2 si lega rapidamente al recettore,interagendo con il sito di legame localiz-zato sulla catena da 55 chilodalton, e vie-ne tenuta saldamente in questa posizio-ne da una interazione con il sito di lega-me situato sulla catena da 75 chilodal-ton. (Proprio perché deve interagire conentrambe le catene del recettore la mo-lecola di IL 2 deve essere intatta per fun-zionare.) L'interazione tra la IL 2 e lacatena da 75 chilodalton attiva i mecca-nismi intracellulari che segnalano al lin-focita T che deve entrare in azione.Quando la IL 2 si dissocia dal recettore,
RECETTORE DELLA IL 2
• 1L2
‘-"Y ANTICORPO CONTRO LA IL 2
\). ANTICORPO CONTRO IL RECETTOREI DELLA IL 2
• IL 2
IL 2 CONIUGATA CON UNA TOSSINA
il che avviene solo molto lentamente inquanto il legame con la catena più lungaè molto tenace, il segnale cessa.
Via via che la risposta immunitariaprocede, l'antigene scompare gradual-mente dall'organismo e i linfociti T chereagiscono con esso non ricevono più se-gnali dai recettori per l'antigene presentisulla loro superficie. Di conseguenza ilnumero di recettori della IL 2 presentisui linfociti diminuisce a poco a poco e ilgrosso clone di cellule cessa di prolifera-re. La popolazione di linfociti T che siconserva costituisce la «memoria» del si-stema immunitario.
I linfociti T non sono le uniche cellu-le che vengono stimolate dalla IL 2. Findal 1981 Christopher S. Henney e colla-boratori dell'Università di Washingtonhanno riferito che le cosiddette cellulenatura! killer (NK) sono stimolate dallaIL 2. Le cellule NK costituiscono circa il
10 per cento della popolazione totale dilinfociti in circolo e si ritiene che par-tecipino alla sorveglianza immunitariacontro le cellule neoplastiche e alla ri-sposta iniziale dell'organismo a un'inva-sione virale. Possono, infatti, servire co-me prima linea di difesa grazie alla lorocapacità di risposta immediata alla IL 2.Diversamente dai linfociti T, le celluleNK non hanno recettori per gli antigenie sembrano essere sempre in uno statodi attivazione. Alcune ricerche hannodimostrato che esse espongono conti-nuamente la catena da 75 chilodalton delrecettore della IL 2.
I linfociti B, come i linfociti T, riman-gono inattivi fino a quando non entranoin contatto con l'antigene. Subisconoquindi un'espansione clonale, diventan-do plasmacellule che producono grandiquantità di anticorpi. Il ruolo della IL 2in questi cambiamenti cellulari è ancora
alquanto controverso, ma la maggiorparte dei ricercatori concorda nel direche la IL 2 promuove la proliferazionedi doni di linfociti B attivati dall'antige-ne, allo stesso modo in cui stimola laproliferazione dei linfociti T. Inoltre , re-centi esperimenti compiuti da Marian E.Koshland dell'Università della Califor-nia a Berkeley e da Kenji Nakanishi del-lo Hyogo College of Medicine hanno di-mostrato che la IL 2 partecipa al diffe-renziamento dei linfociti B aiutandoli adavviare la produzione di anticorpi.
Tutti questi risultati dimostrano che il-L meccanismo del recettore della IL 2
svolge un ruolo decisivo nel regolare iprimi eventi della risposta immunitaria.Pertanto è stato facile pensare di sfrut-tare questa interazione ormone-recetto-re sia per potenziare sia per sopprimerela risposta immunitaria a scopo terapeu-tico. I due tipi più efficaci di farmaci im-munosoppressori oggi prescritti, la ciclo-sporina e i glicocorticoidi, operano in ef-fetti inibendo la produzione di IL 2.
Il mio collega Thomas L. Ciardelli diDartmouth spera di servirsi del sistemarecettore della IL 2 creando forme mo-dificate di questa molecola che potreb-bero servire o come antagonisti dellaIL 2 stessa (legandosi al recettore sen-za attivarlo) o come «superleuchine»con effetti immunostimolanti più inten-si. Una impostazione altrettanto inge-gnosa nella ricerca dell'immunosoppres-sione è stata escogitata indipendente-mente da John R. Murphy della BostonUniversity e da Ira H. Pastan del Natio-nal Cancer Institute. Con tecniche di in-gegneria genetica questi ricercatori han-no accoppiato tossine batteriche allaIL 2 e hanno constatato che le molecoleibride tossiche così formate si legano ailinfociti T e B attivati dall'antigene e lidistruggono, eliminando così dall'orga-nismo un clone antigene-specifico.
Gli anticorpi monoclonali che reagi-scono con la IL 2 o con il suo recettorepossono anche sopprimere le rispostedei linfociti T attivati dall'antigene. Glianticorpi che bloccano il legame dellaIL 2 con il suo recettore inibiscono com-pletamente la proliferazione antigene--specifica dei linfociti T in coltura; essisi sono anche dimostrati efficaci immu-nosoppressori antigene-specifici in espe-rimenti di trapianto cardiaco. La stessafunzione potrebbe essere svolta da unapreparazione diversa - costituita da quel-la regione del recettore che si lega allaIL 2 - che potrebbe competere con i re-cettori della IL 2 presenti sulla superfi-cie cellulare.
La stessa IL 2 ha parecchie applicazio-ni come immunostimolante. Dato chefavorisce l'espansione clonale dei linfo-citi T e B dopo l'introduzione dell'anti-gene , può essere ovviamente impiegatacome immunopotenziatore , per aumen-tare l'efficacia delle vaccinazioni. La si-curezza e l'attività della IL 2 nell'uomosono già state verificate da Stefan C.
Meuer dell'Università di Heidelberg du-rante prove di immunizzazione condottecon un vaccino per l'epatite B. Via viache si produrranno altri vaccini con letecniche dall'ingegneria genetica, la di-sponibilità di un immunostimolante effi-cace come la IL 2 potrà determinarne ilsuccesso o l'insuccesso finale.
La IL 2 è già stata utilizzata nell'im-munoterapia sperimentale del cancro.Questa strategia, introdotta per la primavolta da Steven A. Rosenberg e collabo-ratori del National Cancer Institute, rap-presenta il punto di arrivo di una ricercache dura da quasi un secolo e ha l'obiet-tivo di utilizzare efficacemente il sistemaimmunitario per distruggere le celluleneoplastiche. Finora alcuni pazienti af-fetti da tre forme di tumore estrema-mente resistenti alle terapie convenzio-nali (melanoma maligno, carcinoma re-nale e carcinoma del colon) hanno rispo-sto positivamente alla somministrazionedi IL 2 combinata con cellule NK stimo-late dalla stessa interleuchina. La per-centuale dei pazienti che hanno reagitoin maniera significativa alla terapia è an-cora bassa, circa il 20 per cento. Tuttaviamolti di essi hanno presentato una remis-sione stabile della malattia senza esseresottoposti a ulteriori terapie.
Uno dei campi più promettenti per laterapia di potenziamento della rispostaimmunitaria è quello del trattamentodelle malattie infettive. Dall'introduzio-ne degli antibiotici, avvenuta tra la finedegli anni quaranta e gli anni cinquanta,la maggior parte dei paesi sviluppati èstata in linea di massima liberata dallepiù comuni malattie batteriche. Non so-no stati prodotti, invece, farmaci altret-tanto efficaci contro i funghi, i parassi-ti e i virus. Le malattie infettive conti-nuano inoltre a costituire un problemasanitario importante nei paesi in via disviluppo.
Molte malattie infettive croniche chenon reagiscono alle cure convenzionali,per esempio la tubercolosi, la lebbra e laleishmaniosi, comportano infezione deimacrofagi. Queste cellule, una volta in-fettate, producono costantemente so-stanze infiammatorie che finiscono perdistruggere i tessuti circostanti. Dai ri-sultati ottenuti da Gilla Kaplan, ZanvilA. Cohn e collaboratori della Rockefel-ler University, sembra oggi che l'attiva-zione e l'espansione dei linfociti T e del-le cellule NK a opera della IL 2 possanospostare l'ago della bilancia in favore delsistema immunitario; i linfociti stimolatidalla IL 2 possono uccidere le cellule in-fettate e gli agenti patogeni in esse con-tenuti. I paesi in via di sviluppo potreb-bero essere i primi a beneficiare di unasimile immunoterapia.
L'AIDS ha molte caratteristiche in co-mune con queste malattie infettive cro-niche. Tuttavia il virus dell'immunodefi-cienza acquisita dell'uomo (HIV) infettaproprio i linfociti T coadiuvanti oltre chei macrofagi, con il risultato che i pazientifiniscono per perdere le cellule più im-
portanti ai fini di una risposta immuni-taria efficace. Di conseguenza, i pazientiaffetti da AIDS diventano suscettibili aqualunque agente patogeno presentenell'ambiente. Si stanno oggi comincian-do a effettuare prove cliniche con la IL 2per il trattamento dell'infezione da HIV,somministrandola prima che si sviluppiuna immunodeficienza conclamata. Sele cellule infettate dall'HIV possono es-sere distrutte dai linfociti T e dalle cel-lule NK attivati dalla IL 2 prima che il -virus si diffonda, ai pazienti può essererisparmiata la devastante perdita dellecellule immunitarie.
Il fine opposto, quello della immuno-soppressione , è importante soprattuttonei paesi sviluppati dove i trapianti diorgani e le malattie autoimmunitarie so-no più diffusi. I farmaci attualmente di-sponibili sono immunosoppressori adampio spettro e devono essere sommini-strati per lunghi periodi di tempo; per-tanto i soggetti che abbiano subito untrapianto d'organo e i pazienti affetti damalattie autoimmunitarie corrono seririschi di essere colpiti da infezioni poten-zialmente fatali durante il trattamento.È necessario trovare un metodo per sop-primere solo quelle cellule del sistemaimmunitario che reagiscono a un organoo a un tessuto trapiantato, risparmiandole altre cellule immunitarie. Qualunquemetodo in grado di utilizzare il bloccodell'interazione tra la IL 2 e il suo recet-tore potrà fornire questa tanto desidera-ta specificità.
Nei 30 anni seguiti all'enunciazione da
parte di Macfarlane Burnet dellateoria della selezione clonale , è statamessa a punto una interpretazione di co-me sia regolato il sistema immunitario alivello cellulare e molecolare. Questoprogresso è stato consentito da un'ade-guata valutazione del ruolo fondamen-tale svolto dalla IL 2 nel mediare l'e-spansione di un clone di cellule-immuni-tane dopo che è stato selezionato da unantigene. Oggi finalmente, questa inter-pretazione razionale dei processi immu-nitari può consentire la messa a punto dinuovi metodi per stimolare o deprimereil sistema immunitario a fini terapeutici.
BIBLIOGRAFIA
BURNET SIR MACFARLANE, Cellu-lar Immunology, Melbourne UniversityPress, 1969.
SMITH KENDALL A. (a cura), Interleu-kin 2, Academic Press, 1988.
SMITH KENDALL A., Interleukin-2:Inception, Impact, and Implications in«Science», 240, n. 4856,27 maggio 1988.
SMITH KENDALL A., The Interleukin 2Receptor in «Annual Review of Cell Bio-logy», a cura di G. E. Palade, vol. 5,pp. 397-425, 1989.
Per sopprimere selettivamente il sistema immunitario si può anche eliminare un clone spe-cifico di linfociti T, somministrando all'organismo IL 2 coniugata con una tossina batteri-ca. Solo i linfociti T attivati da un antigene producono l'IL 2 e i suoi recettori (1). Pertanto,il prodotto di coniugazione tra l'IL 2 e la tossina si legherebbe solo con i linfociti T attivi,uccidendoli (2). I linfociti T inattivi non sarebbero minacciati dalle molecole coniugate (3).
30 LE SCIENZE n. 261, maggio 1990
LE SCIENZE n. 261, maggio 1990 31