Le soluzioni
description
Transcript of Le soluzioni

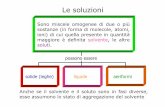
Le soluzioni
Sono miscele omogenee di due o più sostanze (in forma di molecole, atomi, ioni) di cui quella presente in quantità maggiore è definita solvente, le altre soluti.
possono essere
solide (leghe) liquide aeriformi
Anche se il solvente e il soluto sono in fasi diverse, esse assumono lo stato di aggregazione del solvente

La solubilità
E’ la quantità massima di soluto che può sciogliersi, ad una data temperatura, in una
data quantità di solvente: la soluzione in questo caso di dice satura.
Una soluzione è insatura quando il solvente è ancora in grado di sciogliere soluto o soluti.
Una soluzione insatura può essere diluita, se la quantità di soluto disciolta è piccola o
concentrata se invece è grande, relativamente alla quantità di solvente.

Equilibrio dinamico in una soluzione satura
Una soluzione è satura quando il numero delle particelle di soluto che lasciano la loro posizione nel reticolo
cristallino è uguale, nell’unità di tempo, a quello delle particelle che ritornano a
far parte del solido. A questo punto il solido non si scioglie più e rimane del corpo di fondo. La quantità di soluto,
per unità di solvente, necessaria a formare una soluzione satura,
rappresenta la sua solubità. Si è raggiunto uno stato di equilibrio
dinamico: una trasformazione continua ad avvenire, ma contemporaneamente
ha luogo, e con la stessa velocità, la trasformazione in senso contrario.

Il processo di solubilizzazione
I soluti possono essere:
• ionici
• di tipo covalente polare
• di tipo covalente non polare
I solventi possono essere
• di tipo covalente polare
• di tipo covalente non
polare
I soluti ionici sono solubili in solventi covalenti polari.
I soluti covalenti polari sono solubili in solventi covalenti polari.
I soluti non polari (o leggermente polari) sono solubili in solventi non polari (o leggermente polari).

+ - -
ione sodio ione cloruro molecola d’acqua
δ+ δ+
+
Le molecole di H2O si comportano come dipoli e si orientano verso i cristalli di NaCl, in modo tale da orientare i propri poli
positivi e negativi verso gli ioni periferici di carica opposta, vincendo progressivamente le forti attrazioni esistenti.
--
Solido ionico in solvente covalente polare

Solubilità di un solido covalente polare in un solvente polare
glucosio
CH2OH
HOCH
OHOH H
C C
C
H OH
H
OH
C
Il glucosio forma con l’acqua legami ad idrogeno. Da un cristallo si separano molecole idratate.
= =

Soluto apolare in solvente apolare
naftlalene
trielina
Il naftalene è solubile nella trielina perché tra le due sostanze si instaurano le forze di Van der
Waals.

+
+ -
Soluzioni di liquidi in liquidi:miscibilità.Liquidi polari
+ -
- +
- ++ -
+ -
+ -
+ -
+ -
+ -+ -
+ -+ -
+ -+ - + -+ -
++
+
+
+
+
++
+ -
+
+
+ -
Due o più liquidi polari si miscelano tra di loro grazie all’instaurarsi di attrazioni dipolo-dipolo
+Alcol etilico
+ -+ - Acqua

+
Liquidi polari e apolari
+
olio acqua miscela
++
++ + + +
++
++ ++
++ +
+
+
++
+
Un liquido apolare non potrà miscelarsi con uno polare, perché le forze intermolecolari sono diverse
+
++
+
+
++

Liquidi apolari
Due o più liquidi apolari si miscelano tra loro perché tra essi si instaurano le forze di Van der
Waals.
+
Tetracloruro bromo misceladi carbonio

La dissoluzione dell’idrossido di sodio in acqua è un processo esotermico, quella dell’idrossido di
ammonio è endotermico. Il cloruro di sodio si scioglie in acqua senza modificazione della temperatura del
sistema.
Effetti termici nella dissoluzione di un composto ionico
La dissoluzione di un composto ionico avviene in due fasi: 1-demolizione della struttura cristallina del
composto ionico con richiesta di energia e 2-idratazione degli ioni, con liberazione di energia. Il
bilancio energetico di questi due processi può rendere il processo esotermico o endotermico.

Effetti termici nella dissoluzione di un composto ionico
(liberazione di energia)
1-disgregazione del cristallo( assorbimento di energia)
2- idratazione

Le proprietà colligative delle soluzioni
Il solvente, come ogni sostanza pura, possiede delle proprietà fisiche caratteristiche. La
presenza del soluto, nella soluzione, modifica le caratteristiche del solvente. Alcune proprietà
delle soluzioni dipendono esclusivamente dalla concentrazione della soluzione , cioè dal numero
di particelle di soluto presenti, non dalla sua natura. Queste particolari proprietà si definiscono proprietà colligative e sono: l’abbassamento della
tensione di vapore, l’innalzamento del punto di ebollizione, l’abbassamento della temperatura di
solidificazione, la pressione osmotica.

Abbassamento della tensione di vapore
La tensione di vapore di una soluzione contenente un soluto non volatile è minore di quella del solvente puro: infatti alla superficie della soluzione alcune particelle di solvente sono
sostituite da quelle di soluto, che non hanno alcuna tendenza ad evaporare.
molecola del solvente molecola del soluto

tempo
Tem
pera
tura
(°C
)
105-
100-
9 -
inizia l’ebollizione
acqua salata
acqua pura
Innalzamento della temperatura di ebollizione
Innalzamento della temperatura di ebollizione
Le interazioni che si vengono a creare tra soluto e solvente
diminuiscono la tendenza delle molecole del solvente a
liberarsi, per passare allo stato di vapore. E’ necessaria più energia per vincere queste
interazioni, rispetto a quella necessaria al solvente puro. Di conseguenza, si registrerà una temperatura di ebollizione più
elevata.

tempo
Tem
pera
tura
(°C
)
0-
-2-
inizia il congelamento
acqua salata
acqua pura
-1-
2-
1-
Abbassamento della temperatura di solidificazione
Abbassamento della temperatura di solidificazione
L’abbassamento della temperatura di solidificazione
della soluzione, rispetto a quella del solvente puro, è dovuta al
disturbo che le particelle di soluto provocano alle molecole
del solvente, le quali dovendole accoglierle, cambiano il loro
modo di aggregarsi. Le particelle di soluto costituiscono
un ostacolo alla solidificazione del solvente perché si
interpongono tra le sue molecole impedendo loro di
organizzarsi in un reticolo cristallino

Osmosi
L’osmosi è un processo che consiste nel passaggio delle molecole del solvente da una soluzione più diluita ad una più concentrata quando tra esse è posta una particolare membrana, detta membrana semipermeabile, capace di
lasciarsi attraversare solo dalle molecole del sovente e non da quelle del soluto.
molecola del soluto
molecola del solvente

Pressione osmoticasolvente puro soluzione
movimento del solvente
pressione osmotica
pressione necessaria per contrastare l’aumento del volume
Quando solvente e soluto sono separati da una membrana semipermeabile (a) le molecole del solvente tendono a spostarsi verso la
soluzione dove sono meno concentrate (osmosi). Il volume della soluzione aumenta (b) e quindi diminuisce la concentrazione di soluto. La pressione
osmotica è quella che si deve applicare per impedire l’aumento del volume della soluzione.
(a) (b) (c)
Molecola del soluto
Molecola delsolvente

Modi per esprimere la concentrazione
La concentrazione si può esprimere in vari modi:
Molarità: E’ definita dalle moli di soluto disciolte in un litro di soluzione (solvente + soluto) M = moli (soluto) V(L)( soluzione) n° moli = Molarità (mol) x V(L)
L

Percentuale in massa (% m/m): indica la quantità in grammi di soluto
disciolta in 100 g di soluzione.
Percentuale in volume (% V/V): indica il volume in cm3 di soluto disciolto in 100 cm3 di soluzione

Fattori che influiscono sulla solubilitàdi un gas
temperatura
0 10 20 30 40 50 60 70 80 90 100
0,0070
0,0060
0,0050
0,0040
0,0030
0,0020
0,0010
Sol
ubi
lità
in g
per
100
g d
i acq
ua
O2
CH4
N2
La solubilità dei gas nei liquidi è influenzata dalla pressione e dalla temperatura. Essa diminuisce all’aumentare della temperatura e, ad
una determinata temperatura, risulta proporzionale alla pressione del gas sul liquido.
Pressione in atm
1 2 3 4 5
Sol
ubi
lità
in (
g /
100
g di
acq
ua a
25°
C)x
104
200
180
160
140
120
100
80
60
40
20
O2
N2
He

Fattori che influiscono sulla solubilità dei solidi e dei liquidi
La solubilità della maggior parte dei liquidi e dei solidi aumenta al crescere della temperatura
KNO3
KBr
NaCl
Ce2(SO4)3
Li2SO4
NaNO3
Pb(NO3)2
Temperatura °C
0 10 20 30 40 50 60 70 80 90 100
Sol
ubi
lità
in g
per
100
g d
i acq
ua
10
20
30
4
0
50
60
70
8
0 9
0
100
110