Il controllo della concentrazione plasmatica degli ormoni tiroidei: cosa c’è di nuovo per la...
Transcript of Il controllo della concentrazione plasmatica degli ormoni tiroidei: cosa c’è di nuovo per la...

L’Endocrinologo (2014) 15:218–224DOI 10.1007/s40619-014-0067-0
R A S S E G NA
Il controllo della concentrazione plasmatica degli ormoni tiroidei:cosa c’è di nuovo per la clinica
Tommaso Porcelli · Fausta Alfano · Monica Dentice
Pubblicato online: 24 settembre 2014© Springer International Publishing AG 2014
Sommario Il controllo della funzione tiroidea è affidatoprincipalmente a tre sistemi di regolazione: il primo è co-stituito dalla liberazione ipofisaria di TSH (a sua volta con-trollata dalla liberazione ipotalamica di TRH con un mecca-nismo a feedback); il secondo, intratiroideo, consiste nellapossibilità di autoregolazione della liberazione di T3 e T4in funzione dei livelli di iodio organico intracellulare; il ter-zo, periferico, è rappresentato dall’attività delle selenode-siodasi e dalla conseguente trasformazione della T4 in T3,biologicamente più attiva. Mentre i primi due processi so-no altamente regolati al fine di garantire la costanza delleconcentrazioni plasmatiche di ormone, il terzo livello puòsubire notevoli alterazioni che consentono forti fluttuazionidi ormone attivo a livello nucleare. Le conseguenze di talivariazioni sono state oggetto di numerosi studi negli ultimidecenni e le più recenti scoperte sono di seguito descritte.
Parole chiave Ormoni tiroidei · Desiodasi · AsseIpotalamo–Ipofisi–Tiroide
Introduzione
Gli ormoni tiroidei (OT) tiroxina (T4) e triiodotironina (T3)sono prodotti dalla tiroide sotto il controllo dell’ormone ti-
Proposta da D. Salvatore.
Materiale elettronico supplementare La versione elettronicadi questo articolo (DOI:10.1007/s40619-014-0067-0) contienemateriale supplementare, disponibile per gli utenti autorizzati.
T. Porcelli · F. Alfano · M. Dentice (B)Dipartimento di Medicina Clinica e Chirurgia, Università diNapoli “Federico II”, Via S. Pansini 5, 80131 Napoli, Italiae-mail: [email protected]
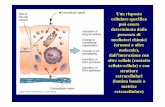
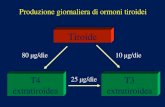
reostimolante (TSH) ipofisario, a sua volta modulato dal-l’ormone di rilascio della tireotropina (TRH) ipotalamico.Gli OT, al contrario, regolano la produzione degli ormoniipotalamo-ipofisari con un meccanismo di retroazione inibi-toria (Fig. 1). La disponibilità plasmatica di iodio ha un ruo-lo critico nel processo di sintesi degli OT. Il fabbisogno iodi-co giornaliero è di 150 mcg e viene concentrato nella tiroidegrazie al cotrasportatore sodio-iodio (NIS), che ne mantie-ne una concentrazione ghiandolare di circa 8000 mcg. La T4costituisce l’80% del prodotto di secrezione della tiroide e laT3 ne rappresenta il restante 20%. L’emivita della tiroxina èdi 6–8 giorni e può subire variazioni in caso di ipertiroidi-smo, dove si riduce fino a 3–4 giorni, e di ipotiroidismo,dove può raggiungere i 9–10 giorni. L’ormone attivo T3 hainvece un’emivita di qualche ora e viene rapidamente inat-tivato dalle selenodesiodasi periferiche in iodotironine nonattive [1].
L’ormone biodisponibile, costituito dalla frazione non le-gata alle proteine di trasporto plasmatico, è in grado di en-trare nella cellula bersaglio attraverso specifici trasportatoridi membrana. Per essere attivata, la T4 deve essere conver-tita nell’ormone effettore T3 dalla desiodasi di tipo 1 (D1)e 2 (D2). La desiodasi di tipo 3 (D3), all’opposto, catalizzal’inattivazione della T4 in reverse T3 (rT3) e dell’ormoneattivo T3 in diiodotironina (T2). D2 e D3 sono i due enzimicritici nella regolazione periferica della concentrazione in-tracellulare di T3, mentre D1 ha nell’uomo un ruolo più mar-ginale. Recentemente, per la D1 è stato proposto un ruolo dienzima scavenger nell’ambito del riutilizzo dello iodio. Leazioni cellulari degli OT sono mediate dai recettori nucleariper la T3 (TRs), i quali riconoscono specifiche sequenze diDNA sui promotori dei geni bersaglio della T3 (thyroid re-sponse element, TRE). Ogni tessuto possiede uno specificopattern di distribuzione delle diverse isoforme dei TRs, che

L’Endocrinologo (2014) 15:218–224 219
Fig. 1 L’asse tiroideo rappresenta un classico esempio di “ansa endo-crina a feedback”: il TRH ipotalamico stimola la produzione ipofisariadi TSH che, a sua volta, stimola la sintesi e secrezione di ormone ti-roideo; gli ormoni tiroidei, con meccanismo a feedback, inibiscono laproduzione di TRH e TSH
suggerisce in parte un loro distinto ruolo funzionale (Fig. 2)[2].
Ruolo del set point ipotalamico nella regolazione deilivelli plasmatici di ormoni tiroidei
I parametri di funzione tiroidea, contrariamente a quanto siverifica nel singolo soggetto, mostrano nell’ambito della po-polazione sana una variabilità considerevole. I livelli di or-moni tiroidei dipendono dal grado di sensibilità del set pointipotalamico dell’asse ipotalamo-ipofisi-tiroide (HPT), diffe-rente in ciascun individuo, che si determina durante la vitaintrauterina in ragione dell’azione di fattori genetici e am-bientali. Tra i primi, sembrano essere candidati locus geni-ci e polimorfismi di numerosi geni della pathway degli OT,tra i quali quelli del recettore del TSH, delle desiodasi, deitrasportatori e del recettore degli ormoni tiroidei e della fo-sfodiesterasi 8B. Tra i fattori ambientali, sembra avere unruolo più definito il corretto apporto iodico e l’esposizionead anomale concentrazioni di OT materni [3].
Modelli animali knock out (KO) per le desiodasi di tipo2 e 3 hanno permesso di evidenziare il ruolo critico svol-to dalle desiodasi nella definizione del set point dell’asseHPT. Infatti, topi D2KO mostrano una profonda deregola-zione dell’asse con valori di TSH fino a 3 volte superioririspetto a topi wild type (WT), valori di T4 aumentati finoal 40% e una quota di T3 nei limiti della norma. In questitopi, i livelli di mRNA ipotalamici di TRH sono normali e lasoppressione del TSH è conservata dopo somministrazione
Fig. 2 Le desiodasi svolgonoun ruolo importante nellaregolazione periferica dellaconcentrazione intracellularedegli ormoni tiroidei. D1 e D2sono i principali attivatoridell’ormone tiroideocatalizzando la conversione delpro-ormone T4 in T3; alcontrario, la D3 medial’inattivazione degli OTattraverso la trasformazione diT4 in rT3 e di T3 in T2

220 L’Endocrinologo (2014) 15:218–224
Tabella 1 Parametri difunzione tiroidea in base all’età(da [6])
Età T3 (nmol/L) T4 (nmol/L) FT4 (pmol/L) TSH (mIU/L)
1–4 giorni 1,5–11,4 142–277 28–68 1–39
1–4 settimane 1,6–5,3 106–221 12–30 1,7–9,1
1–12 mesi 1,6–3,8 76–210 10–23 0,8–8,2
1–5 anni 1,6–4,1 94–193 10–27 0,7–5,7
6–10 anni 1,4–3,7 82–171 13–27 0,7–5,7
11–15 anni 1,3–3,3 71–151 10–26 0,7–5,7
16–20 anni 1,2–3,2 54–152 10–26 0,7–5,7
21–50 anni 1,1–3,1 55–161 12–32 0,4–4,2
51–80 anni 0,6–2,8 55–160 12–32 0,4–4,2
di T3 ma non si verifica in risposta alla T4. Nell’insieme, idati sembrano indicare che il knock out del gene della D2induca una resistenza ipofisaria al feedback inibitorio dellatiroxina [4]. I topi D3KO, invece, presentano un eccesso diT3 circolante e bassi livelli di T4. All’opposto del modelloD2KO, nei topi D3KO l’esposizione fetale a un eccesso diT3 causa un ipotiroidismo centrale che si manifesta dopo 14giorni di vita, a conferma della necessità di un corretto equi-librio tra i processi di attivazione ed inattivazione degli OTper la maturazione centrale dell’asse HPT nel corso dellosviluppo embrionale [5].
La funzione tiroidea subisce notevoli variazioni durantelo sviluppo embrio-fetale e nell’età prepuberale, fino a stabi-lizzarsi definitivamente dopo lo sviluppo sessuale. La produ-zione di OT comincia nei follicoli tiroidei embrionali a par-tire dalla 12a settimana di gestazione e aumenta progressiva-mente fino a raggiungere l’apice durante le prime settimanedi vita. Il tasso di produzione di T4 diminuisce gradualmentedurante il primo anno di vita e continua a decrescere in misu-ra più lieve sino all’età puberale, fino a diventare un parame-tro ematico stabile e costante nell’età giovane-adulta e nellavecchiaia. A partire dai 50 anni di età, una serie di progressi-ve variazioni di funzione dell’asse ipotalamo-ipofisario so-no responsabili di un lento e minimo decremento dei valoridella T3 ematica, senza però modificare i valori di T4 e TSHcircolante. Gli indicatori di funzione tiroidea nei soggetti sa-ni non mostrano differenze clinicamente significative in baseal sesso o alla razza (Tabella 1) [6].
Il TSH è prodotto dall’ipofisi secondo un ritmo circadia-no con zenit nelle ore notturne (2:00 AM) e nadir in quel-le pomeridiane (4:00 PM). Benché la variazione diurna delTSH sia di circa ±50%, questa non è in grado di modificarela concentrazione sierica della T4. Infatti, il tasso di secre-zione oraria della T4 (3–5 tg/h) costituisce solo una minimafrazione del pool extratiroideo della T4 (500–600 pg) [6].
Il fine ultimo di tale complesso processo regolativo è digarantire la stabilità dell’omeostasi plasmatica degli OT. Latiroide ha un tasso di rilascio ormonale invariato al fine dioffrire una concentrazione di ormone costante per il metabo-lismo basale di ogni sistema cellulare. Sorprendentemente,
a fronte di una sostanziale stabilità dei valori di TSH e T4ematici osservabili nella vita adulta, le concentrazioni di OTnei tessuti bersaglio subiscono notevoli variazioni in rispostaalle esigenze metaboliche cellulari contingenti.
Cosa c’è di nuovo per la clinica? Aspetti molecolari
L’espressione tessuto-specifica delle singole desiodasi con-sente ai tessuti periferici di rendersi indipendenti dall’azionetiroidea e di stabilire il proprio footprint tiroideo. Riassumia-mo di seguito alcune delle più recenti scoperte che hannocontribuito ad ampliare la nostra conoscenza sui comples-si meccanismi di attivazione e inattivazione locale degli OTmediante la deiodinazione.
Ruolo della D3 nel rimodellamento cardiacopost-ischemico
La desiodasi di tipo 3 è una oncofetoproteina espressa ad altilivelli durante la vita embrionale e scarsamente rilevabile neitessuti adulti. La sua localizzazione subcellulare, nel con-testo della membrana plasmatica, ne consente un’azione diprincipale protettore cellulare nei confronti di un’eccessiva oinadeguata esposizione alla T3 plasmatica. Nella vita adultala sua espressione è limitata a un ridotto numero di tessuti.Tuttavia, i suoi livelli possono aumentare drasticamente incondizioni fisiopatologiche peculiari quali la tumorigenesi,l’infiammazione, l’ipertrofia cardiaca e vari processi di ripa-razione tissutale. In tali circostanze l’espressione della D3può essere così imponente da abbattere i livelli circolanti diOT, a dimostrazione della rilevanza clinica della D3 comeregolatore sistemico dei livelli di T3 circolante [7].
Uno studio del 2008 di Simonides et al. [8] ha rivelatoche la D3 è un target dell’hypoxia-inducible factor 1a (HIF-1a), fattore chiave nella risposta tissutale allo stato ipossi-co. Nell’ambito dell’ipossia cardiomiocitica presente nelloscompenso cardiaco da ipertrofia ventricolare, la drastica in-duzione di D3 indotta da HIF-1a è sufficiente a inibire il ra-te metabolico indotto da T3 e a ridurre l’azione degli OT

L’Endocrinologo (2014) 15:218–224 221
in maniera tessuto-specifica. L’abilità della D3 nel ridurre ilconsumo di ossigeno durante l’ipossia conferma il concet-to generalmente accettato che la riduzione dell’azione degliOT può rappresentare un adattamento benefico in specifichecircostanze quali la sindrome da bassa T3.
Questo modello di induzione della D3 durante l’ipos-sia fornisce interessanti informazioni cliniche. Il pattern diespressione della D3, alto durante la vita embriofetale e ap-pena individuabile dopo la nascita, coincide con la transi-zione dalla circolazione feto-placentare a quella neonatalee con il rapido aumento della pressione parziale di ossige-no arterioso da 25 mmHg a 74 mmHg. Bambini affetti daipossia cronica, e.g. in presenza di malformazioni cardiachecongenite, presentano all’opposto un pattern di iodotironineche coincide con un’alta attività di inner ring deiodinationpropria dell’azione desiodasica di D3 (alto TSH, bassa T4,alta rT3). Allo stesso modo, in pazienti affetti da malattiacritica e deceduti in Unità di Terapia Intensiva, l’attività spe-cifica della D3 nel fegato e nel muscolo scheletrico apparedirettamente proporzionale alla richiesta di terapia inotropasomministrata. Complessivamente, questi dati suggerisconocon forza che l’ischemia tissutale stimola l’espressione dellaD3 e causa un’importante riduzione della T3 plasmatica [8].
Ruolo della D2 nei meccanismi di miogenesi erigenerazione muscolare
Il muscolo scheletrico è uno dei principali target degli OT,che hanno importanti effetti regolatori nell’ambito della fi-siopatologia del muscolo, tra i quali la determinazione dellaproporzione di fibre lente e veloci, il tasso di sintesi e di ca-tabolismo proteico e la modulazione della termogenesi cor-porea [9]. La relazione fra ormoni tiroidei e muscolo schele-trico è importante per diversi aspetti. Il primo tra questi, evi-dente già sul piano clinico, riguarda le miopatie distiroideeche si verificano in caso di eccesso e di difetto ormonale. Inpresenza di tireotossicosi, il muscolo subisce un danno diret-tamente correlato con gli elevati livelli ormonali che causa-no aumento della catabolisi muscolare e conseguente deficitdi forza, debolezza e dolore diffuso. In caso di ipotiroidi-smo, le alterazioni del metabolismo della fibra muscolare ela riduzione della forza contrattile determinano affaticabili-tà, rallentamento dei movimenti, rigidità e occasionalmentemialgie e crampi. Infine, il sistema muscolo-scheletrico in-cide considerevolmente sulla spesa energetica basale con untasso intorno al 40%, ed è noto che gli OT aumentano il con-sumo metabolico proprio attraverso un aumento della spesaenergetica muscolare.
Un nuovo studio del 2010 ha portato alla luce la capacitàdella modulazione locale degli OT via desiodasi nel con-trollo della fisiologia delle cellule staminali del muscolo, lecellule satelliti [10]. Scoperte da Mauro nel 1981, tali cel-lule, localizzate al di sotto della membrana plasmatica delle
miofibre, sono cellule quiescenti e fuori dal ciclo cellula-re. In seguito a un insulto che danneggi la fibra, tali cellulerientrano nel ciclo cellulare e vanno incontro a un’attiva faseproliferativa e dunque differenziativa, fino a fondersi e a co-stituire nuove fibre mature (Fig. 3). È stato osservato che, nelcorso del processo differenziativo, tali cellule presentano unpattern differenziale di espressione delle desiodasi D2 e D3che consente una fine regolazione della biodisponibilità de-gli OT. In fase proliferativa, le cellule satelliti esprimono altilivelli di D3; al contrario, le cellule avviate al differenzia-mento reprimono la D3 e aumentano drasticamente la sintesidi D2, causando un incremento netto di segnale dell’ormonetiroideo, essenziale per una corretta esecuzione del differen-ziamento terminale (Fig. 3). Gli studi in vivo in modelli mu-rini di rigenerazione muscolare hanno dimostrato che questafine regolazione è componente essenziale, non solo del dif-ferenziamento delle cellule staminali in vitro, ma anche delprogramma rigenerativo successivo a danno muscolare di-retto. Infatti, topi KO per la D2 sono incapaci di completareun ciclo rigenerativo in seguito a danno a causa dell’incapa-cità di differenziamento delle fibre di neoformazione. Nellasuccessione di eventi che caratterizza il processo riparati-vo, è pertanto richiesta un’inattivazione (pro-proliferativa) eun’attivazione (pro-differenziativa) sequenziale degli OT. Lamodulazione differenziale dell’espressione delle desiodasiconsente alle cellule satelliti di adattare l’azione degli OTalle differenti fasi del processo. Questo studio rappresentaun nuovo settore di ricerca che apre interessanti prospettivenello studio e, potenzialmente, nel trattamento di complessemalattie muscolari come la distrofia e la sarcopenia.
Ruolo della D3 nei processi neoplastici
Nel secolo scorso, Beatson descrisse per la prima volta l’im-piego di estratti tiroidei come cura per i tumori mamma-ri [11]. Nei decenni successivi, svariati studi hanno eviden-ziato l’esistenza di una stretta relazione tra effetti tissutalidegli ormoni tiroidei e controllo della proliferazione cellu-lare, dunque anche dei processi neoplastici. Analogamen-te, numerose mutazioni a carico dei recettori degli OT sonostate associate allo sviluppo di tumori nell’uomo. Un casoesemplificativo è rappresentato dalla scoperta che l’oncoge-ne per l’eritroblastosi aviaria, v-erb-a, è l’omologo virale delgene codificante per il gene TR-alfa [12]. Di recente è sta-to dimostrato che anche i meccanismi di modulazione lo-cale degli OT sono essenziali per una corretta attenuazionedel segnale dell’OT durante i processi oncogenici. In parti-colare, è stata riportata una significativa ri-espressione del-la D3 in molti tumori umani ex vivo così come in svaria-te linee cellulari in vitro derivanti da cellule tumorali uma-ne e murine. La teoria più accreditata al momento ritieneche l’alta espressione di D3 sarebbe necessaria alle celluletumorali al fine di silenziare l’azione pro-differenziativa e

222 L’Endocrinologo (2014) 15:218–224
Fig. 3 L’ormone tiroideo è unfattore critico per la correttaesecuzione del processo dimiogenesi. Le desiodasi D2 eD3 sono finemente regolatedurante il differenziamento deiprecursori muscolari. La D3 èespressa nelle cellule staminaliproliferanti, le quali richiedonouno stato di ipotiroidismocellulare. Al contrario, nellecellule avviate aldifferenziamento si rilevano altilivelli di D2 e un conseguenteaumento di T3, essenziale per lacorretta maturazione deimioblasti immaturi in miotubi
anti-proliferativa della T3. I due casi in cui l’azione di ini-bizione della D3 è stata funzionalmente dimostrata favorirela tumorigenesi sono rappresentati dal carcinoma basocellu-lare e dal carcinoma del grosso intestino. In entrambi questimodelli è stato dimostrato che la D3 è iperespressa nel tes-suto tumorale ed è assente nella controparte sana. Inoltre,nel caso dei carcinomi del colon vi è una forte correlazionetra grading del tumore ed espressione della D3, che risul-ta a livelli massimi nelle fasi neoplastiche precoci (G1) esi riduce nei tumori a stadiazione più avanzata (G3). Infi-ne, il silenziamento della D3 nel contesto tumorale ne atte-nua notevolmente la crescita, a dimostrazione del ruolo cri-tico svolto dall’inattivazione degli OT per il progredire dellatumorigenesi.
Cosa c’è di nuovo per la clinica? Aspetti clinici
Ruolo della terapia combinata LT3/LT4
L’ipotirodismo rappresenta la disfunzione tiroidea più fre-quente. La terapia di prima scelta prevede la monoterapia abase di levotiroxina, utilizzando la capacità dei tessuti pe-riferici di convertire la T4 in T3. Negli ultimi anni, tutta-via, è emerso che tale scelta terapeutica non è in grado diricondurre allo stato di eutiroidismo clinico e ormonale tut-ti i pazienti. Infatti, circa un quinto dei pazienti ipotiroideitrattati in monoterapia con L-T4 e con un normale quadroormonale biochimico non raggiunge un completo eutiroidi-smo clinico. Pur ottenendo il target biochimico di eutiroi-dismo, questa minoranza di pazienti riferisce un mancatocompenso clinico, lamentando la persistenza di sintomato-logia da ipotiroidismo e, in alcuni casi, andando incontro a
un peggioramento del profilo di rischio cardiovascolare. Unrecente studio effettuato da Gullo et al. su 1880 pazienti ati-reotici trattati con L-T4 ha documentato alcuni limiti dellaterapia levotiroxinica. A fronte di normali valori di TSH, il15% dei pazienti trattati con L-T4 analizzati in questo stu-dio presentava valori di FT3 al di sotto dei limiti di norma-lità e il 7% valori FT4 superiori alla norma. Il 30% di questipazienti, infine, mostrava un rapporto FT3/FT4 inferiore alnormale [13].
Nei soggetti sani, il 20% di ormone prodotto dalla tiroi-de è costituito da T3. I pazienti atireotici e quelli affetti daipotiroidismo grave non godono di questa quota di T3 e di-pendono interamente dalla conversione periferica della T4.La variabilità interindividuale nella capacità di deiodinazio-ne periferica della T4 è pertanto alla base del razionale del-la terapia combinata T3/T4. I pazienti in terapia con L-T4e con alterato rapporto T3/T4 risentono verosimilmente diun’incapacità a convertire in maniera adeguata la levotiro-xina. Tale deficit ha una genesi complessa ancora non nota.Alcuni studi hanno suggerito, tra le cause possibili, i poli-morfismi delle desiodasi periferiche e, in particolare, il sin-gle nucleotide polymorphism Thr92Ala della desiodasi di ti-po 2. Un deficit nella pathway di D2 rende conto della ridot-ta conversione periferica della L-T4 in T3 e del conseguenteipotiroidismo tissutale in quei pazienti con persistenza sin-tomatologica in monoterapia sostitutiva. Alcuni studi hannodocumentato un deficit di T3 tissutale in presenza del poli-morfismo Thr92Ala. Sul piano clinico, il mutante Thr92Alaè stato associato a numerose condizioni patologiche qualiinsulino-resistenza e alterato metabolismo glicidico, obesi-tà, ipertensione arteriosa, alterato turnover osseo e diverseanomalie dell’asse HPT [14].

L’Endocrinologo (2014) 15:218–224 223
Nell’insieme, queste evidenze suggeriscono la presenzadi una discreta minoranza di pazienti che potrebbe benefi-ciare della terapia combinata di T3 e T4. Sono tuttavia ne-cessari ulteriori studi clinici e di laboratorio per chiarire inmodo più definito i meccanismi alla base delle differenze dirisposta individuale alla monoterapia con levotiroxina e ilreale beneficio clinico della terapia combinata T3/T4.
Sindrome da bassa T3
La sindrome da bassa T3 definisce una condizione di alterataconcentrazione plasmatica degli OT osservabile in moltepli-ci stati patologici acuti e cronici, che, tuttavia, non si cor-rela a disfunzioni ghiandolari tiroidee e che regredisce conla guarigione. In alcuni contesti clinici, in fase acuta di ma-lattia può verificarsi una rimodulazione dell’assetto ormo-nale tiroideo con conseguente riduzione della T3 circolantee concomitante aumento della reverse T3. L’eventuale evo-luzione in patologia cronica può determinare modifiche piùprofonde dell’asse HPT che comprendono una più marcatariduzione del rapporto T3/rT3, una lieve riduzione del TSHe, nei casi di malattia avanzata o terminale, una riduzioneconcomitante dei livelli di T4. La riduzione globale dei pa-rametri di funzione tiroidea non è riferibile al meccanismodi retroazione inibitoria degli OT ma descrive un mutamen-to più profondo nella regolazione del set point ipotalamo-ipofisario. Resta tuttavia oggetto di discussione se tali alte-razioni riflettano una risposta neuroendocrina adattativa del-l’organismo all’insulto patogeno o una condizione dannosalegata alla malattia sottostante [15].
Già a distanza di qualche ora da un intervento di chirur-gia maggiore o dall’instaurarsi di patologie gravi quali sep-si, ustioni severe, infarto del miocardio, scompenso cardiacoacuto, insufficienza renale acuta e politrauma, è osservabileuna riduzione dei livelli circolanti di T3 e un parallelo au-mento dei valori di rT3. È stato riportato che nella fase acutadi una patologia critica tali cambiamenti rapidi dei livelli diOT sono ascrivibili all’attività desiodasica periferica media-ta da D1 e da D3. Nei pazienti critici si verifica un’induzionedi attività di D3 nel fegato e nel muscolo scheletrico che, incondizioni di normalità, non esprimono D3 e una riduzionedell’attività di D1 negli stessi tessuti con conseguente ridottaconversione di T4 in T3 [1].
Nella malattia critica, a fronte di un’importante riduzionedei livelli di T3 e in alcuni casi di una concomitante riduzio-ne di T4, il TSH mostra valori generalmente nei limiti dellanorma benché inappropriatamente bassi rispetto ai livelli diOT. Con la progressione di malattia si determina una gradua-le riduzione dell’ampiezza dei pulse secretori della tropinaipofisaria e la scomparsa del picco notturno. In tali casi, ilTSH può raggiungere livelli francamente inferiori alla nor-ma. Studi condotti con test al TRH in questi pazienti han-no evidenziato un deficit di risposta ipofisaria allo stimolo
ipotalamico, riferibile al riassetto centrale della regolazionedella funzione tiroidea. Pertanto, con il prolungarsi della du-rata di malattia, la sindrome da bassa T3 diventa sostenutaprimariamente da un’alterata funzione ghiandolare media-ta dal cambiamento nella regolazione ipotalamo-ipofisariadell’asse [16].
La determinazione dei livelli di OT è stata investigata innumerosi studi quale parametro prognostico nell’ambito dinumerose patologie di area critica. Le evidenze prodotte mo-strano una correlazione indipendente dei livelli di T3 e T4 edel rapporto T3/rT3 con la sopravvivenza a breve e lungotermine e con la mortalità, in particolare nell’ambito dellepatologie cardiovascolari [17]. In relazione alle controversieintorno alla genesi adattativa o maladattativa della sindromeda bassa T3, gli studi che hanno valutato gli effetti della te-rapia sostitutiva in questo contesto clinico sono di numerolimitato. I risultati ottenuti hanno tuttavia evidenziato che iltrattamento con sola levotiroxina non è in grado di modifi-care i livelli di T3 circolante e che la normalizzazione di talilivelli ottenuta con la somministrazione di T3 esogena nonmigliora la prognosi e la sopravvivenza di pazienti affetti dapatologia critica [16]. Pertanto, la terapia sostitutiva non hamostrato né svantaggi né benefici tali da supportarne l’utiliz-zo, benché gli scarsi dati a riguardo non consentano di porreconclusioni definitive.
Conclusioni
Gli effetti pleiotropici dell’ormone tiroideo richiedono uncontrollo rigoroso delle variazioni di concentrazione dell’or-mone sia a livello plasmatico che a livello periferico. Talecontrollo si realizza con la corretta esecuzione di una seriedi checkpoints che agiscono a livello dell’asse ipotalamo-ipofisi-tiroide e a livello cellulare tramite l’azione coordi-nata di trasportatori, desiodasi e recettori. Questi proces-si costituiscono un esempio di come gli ormoni possanoessere attivati o inattivati nei distretti extra-ghiandolari, inmaniera analoga a quanto accade per la 5α-reduttasi e laP450-aromatasi nel controllo del metabolismo degli ormonisessuali e dell’11β-idrossisteroido-deidrogenasi nel control-lo dell’azione degli ormoni glucocorticoidi. Il duplice con-trollo plasmatico e tissutale rappresenta, dunque, uno stru-mento omeostatico integrato per modificare lo stato tiroi-deo di una singola cellula senza perturbare la concentrazioneplasmatica dell’ormone.
Conflitto di interesse Gli autori Tommaso Porcelli, Fausta Alfano eMonica Dentice dichiarano di non avere conflitti di interesse.
Consenso informato Lo studio presentato in questo articolo non harichiesto sperimentazione umana.
Studi sugli animali Gli autori di questo articolo non hanno eseguitostudi sugli animali.

224 L’Endocrinologo (2014) 15:218–224
Bibliografia
1. Bianco AC, Salvatore D, Gereben B et al (2002) Biochemistry,cellular and molecular biology, and physiological roles of theiodothyronine selenodeiodinases. Endocr Rev 23:38–89
2. Cheng SY, Leonard JL, Davis PJ (2010) Molecular aspects ofthyroid hormone actions. Endocr Rev 31:139–170
3. Hansen PS, Brix TH, Iachine I et al (2007) Genetic and environ-mental interrelations between measurements of thyroid functionin a healthy Danish twin population. Am J Physiol: EndocrinolMetab 292:E765–770
4. Schneider MJ, Fiering SN, Pallud SE et al (2001) Targeted di-sruption of the type 2 selenodeiodinase gene (DIO2) resultsin a phenotype of pituitary resistance to T4. Mol Endocrinol15:2137–2148
5. Hernandez A, Martinez ME, Fiering S et al (2006) Type 3 deiodi-nase is critical for the maturation and function of the thyroid axis.J Clin Invest 116:476–484
6. Fisher DA (1996) Physiological variations in thyroid hormones:physiological and pathophysiological considerations. Clin Chem42:135–139
7. Huang SA, Tu HM, Harney JW et al (2000) Severe hypothy-roidism caused by type 3 iodothyronine deiodinase in infantilehemangiomas. N Engl J Med 343:185–189
8. Simonides WS, Mulcahey MA, Redout EM et al (2008) Hypoxia-inducible factor induces local thyroid hormone inactivation duringhypoxic-ischemic disease in rats. J Clin Invest 118:975–983
9. Salvatore D, Simonides WS, Dentice M et al (2014) Thy-roid hormones and skeletal muscle-new insights and potentialimplications. Nat Rev Endocrinol 10:206–214
10. Dentice M, Marsili A, Ambrosio R et al (2010) The FoxO3/type 2deiodinase pathway is required for normal mouse myogenesis andmuscle regeneration. J Clin Invest 120:4021–4030
11. Dentice M, Marsili A, Zavacki A et al (2013) The deiodinasesand the control of intracellular thyroid hormone signaling duringcellular differentiation. Biochim Biophys Acta 1830:3937–3945
12. Dentice M, Antonini D, Salvatore D (2013) Type 3 deiodinaseand solid tumors: an intriguing pair. Expert Opin Ther Targets17:1369–1379
13. Gullo D, Latina A, Frasca F et al (2011) Levothyroxine mono-therapy cannot guarantee euthyroidism in all athyreotic patients.PLoS ONE 6:e22552
14. Dora JM, Machado WE, Rheinheimer J et al (2010) Associationof the type 2 deiodinase Thr92Ala polymorphism with type 2diabetes: case-control study and meta-analysis. Eur J Endocrinol163:427–434
15. Fliers E, Alkemade A, Wiersinga WM (2001) The hypothalamic-pituitary-thyroid axis in critical illness. Best Pract Res ClinEndocrinol Metabol 15:453–464
16. Wajner SM, Maia AL (2012) New insights toward the acute non-thyroidal illness syndrome. Front Endocrinol 3:8
17. Cerillo AG, Storti S, Kallushi E et al (2014) The low triiodothy-ronine syndrome: a strong predictor of low cardiac output anddeath in patients undergoing coronary artery bypass grafting. AnnThorac Surg 97:2089–2096














![Tiroide.ppt [modalità compatibilità] · Metabolismo degli ormoni tiroideiMetabolismo degli ormoni tiroidei • L’80% i d ll T4 d tt d ll ti idL’80% circa della T4 prodotta dalla](https://static.fdocumenti.com/doc/165x107/5e830597e1eb6f56d7659bfd/modalit-compatibilit-metabolismo-degli-ormoni-tiroideimetabolismo-degli-ormoni.jpg)


