Enzimi: catalizzatori biologici - digilander.libero.itdigilander.libero.it/Daerlic/Chimca...
Transcript of Enzimi: catalizzatori biologici - digilander.libero.itdigilander.libero.it/Daerlic/Chimca...
Enzimi: catalizzatori biologiciEnzimi: catalizzatori biologici
• praticamente tutte le reazioni biochimiche della chimica della vita sono catalizzate da enzimi
• gli enzimi sono proteine
• la velocità di reazioni enzimatiche è aumentata di fattori 106-1012
rispetto alle stesse reazioni non catalizzate
• le condizioni biologiche di reazione sono moderate: T<100 oC, Patm, pH ≅ 7 , soluzioni acquose
• gli enzimi hanno un elevatissimo grado di specificità
• l’attività degli enzimi è regolata
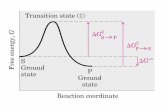
Energia libera di Gibbs
Nei sistemi biologici∆V è molto piccolo
spontaneo
non spontaneo
equilibrio
∆Ssistema+ ∆Suniverso > 0
spontaneo
∆G positivo
∆G negativo
∆G=0
Il ∆G di una reazione dipende solo dalla differenza di energia libera dei prodotti (stato finale) e dei reagenti (stato iniziale)
è lo stesso
La VELOCITA’ della reazione non è prevedibile in base al ∆G
Teoria della velocità di reazione o dello stato di transizione
• i reagenti devono incontrarsi (collidere)• i reagenti devono aver sufficiente energia per raggiungere lo stato di transizione• i reagenti devono essere orientati correttamente• nello stato di transizione normalmente, gli angoli di legame e le lunghezze di legame sono distorti verso quelli caratteristici dei prodotti
Effetto della temperatura e di un catalizzatore sulla velocità di reazione
Equazione di Arrhenius:
k = Aexp(-Ea/RT)ln k = lnA -Ea/RT
la velocità dei reazione è proporzionale: alla frequenza degli urti molecolari • alla probabilità che l’urto avvenga con energia sufficiente a far avvenire la reazione
Ea = energia di attivazione
I catalizzatori riducono l’energia di attivazione
CINETICA CHIMICA
La stechiometria di una reazione chimica non specifica il meccanismo della reazione
A P
una reazione è descritta da reazioni elementari
A I1 I2 Pintermedi
Generalmente una reazione avviene in molte tappe (meccanismo)Spesso uno step è il più lento e determina la velocità della reazione
(rate determining step)
Proprietà di un catalizzatore
• è presente in piccole quantità
• non viene alterato dalla reazione
• fa aumentare la velocità di reazione ma non sposta l’equilibrio
• facilita la reazione in entrambi i sensi
• è specifico per la reazione
non catalizzata
catalizzata
coordinata di reazione
aumento della velocità di reazione
I catalizzatori riducono l’energia di attivazione
Fattori responsabili dell’aumento della velocità nella catalisi enzimaticaFattori responsabili dell’aumento della velocità nella catalisi enzimatica
Le reazioni non catalizzate possono essere lente in quanto:
• coinvolgono la formazione di cariche positive e/o negative nello stato di transizione• richiedono spesso che molecole vengano in stretto contatto con concomitante perdita
di entropia
Queste difficoltà vengono superate con gli enzimi:
• le cariche vengono stabilizzate piazzando acidi, basi, ioni metallici, o dipoli che fanno parte della struttura dell’enzima nel sito attivo
• catalisi covalente viene utilizzata per percorrere cammini di reazione a bassa energia
• le perdite di entropia sono minimizzate in quanto i gruppi catalitici sono parte della struttura dell’enzima
• sito attivo
• substrato
• coenzima o cofattore
• velocità di reazione
• attivatore
• inibitore
Definizioni importanti per l’attività e proprietà degli enzimi
Modello chiave-serratura
Adattamento indottol’enzima forza il substrato ad assumere una conformazione simile
allo stato di transizione
L’enzima lega il substrato nel proprio sito attivo
La distorsione indotta può essere localizzata od estesa a gran parte dell’enzima
esochinasiD-glucosio
Le interazioni Enzima-Substrato
• legami a H• forze di van der Waals
•forze elettrostaticheResidui idrofobici
Legami multi-contatto
E + S ES
N.B gli enzimi non si limitanoa posizionare e/o distorcere isubstrati abbassando l’energiadi attivazione, ma promuovonol’evento catalitico utilizzandoresidui “opportunamente posti”
I siti attivi includono generalmente residui anche lontani nellasequenza primaria
Lisozima:enzima che catalizzala reazione di rottura delle pareti cellulari di alcuni batteri
I siti attivi occupano una parte relativamente piccola del volumetotale dell’enzima, che comprende anche siti regolatori, di interazione, canali etc
POCHI PRINCIPI CATALITICI DI BASE SONO USATI DA MOLTI ENZIMI
• Catalisi acido-base
• Catalisi con ioni metallici (elettrofili)
• Catalisi per prossimità (reazioni a più substrati)
• Catalisi covalente
Lys
HisGlu
Il residuo di acido glutammico Glu 165 è essenziale per la funzione enzimatica
Il sito attivo: legame con DHAP
Ansa protettiva
LysHisGlu
G3P-enzima
Stato di transizione
Intermedio endiolico
Stato di transizione
DHAP-enzima
Reazione
acido-base
catalizzata
concertata
Proteasi serinicheProteasi serinichela reazione consiste nell’idrolisi di legami peptidici dal lato carbossilico di particolari AA
Asp His Ser sono semprepresenti nel sito attivo
chimotripsina
un residuo di serina gioca un ruolo importantenella catalisi di tipo covalente
L’idrolisi del legame peptidico è termodinamicamente favorita rispetto alla formazione del legame (condensazione ∆G0=+10kJmol-1)
I POLIPEPTIDI SONO MOLECOLE METASTABILI
La formazione del legame avviene con l’utilizzo di ATP, per azione di aminoacil-tRNA-sintetasi che attivano gli AA nel legame con tRNA
1. AA+ATP Amminoacil-AMP + PPi
2. Amminoacil-AMP +tRNA
+ AMPAmminoacil-tRNA tRNA
Il legame peptidico a partire dagli amminoacil-tRNA ètermodinamicamente favorito
chimotripsina: residui del sito attivo
La differenza tra gli enzimi riguarda la “tasca” vicina alla Ser (responsabile della specificità delle proteasi)
• chimostripsina idrolizza i legami la cui porzione carbossilica è un residuo idrofobico (Phe, Leu)• tripsina idrolizza i legami la cui porzione carbossilica è un residuo basico (Lys Arg)
Meccanismo catalitico
La Ser attivata è un forte nucleofilo: attacco al carbonile del substrato
Phe buco delloossianione
La stabilizzazione degli stati di transizione (stabilizzazionedell’ossianione tetraedrico) e il corretto posizionamento dei reagenti abbassano l’energia di attivazione
La triade catalitica èconservata in varie famigliedi proteasi, sia battericheche virali, che di animali e piante(evoluzione convergente)
Le tasche di alloggiamento del substratorendono selettivo il taglio proteolitico
Arg,Lys Ala,SerPhe, Leu
PROTEASI NON SERINICHEIl sito attivo presentacaratteristiche per l’attivazione diun nucleofilo per l’attacco al carbonilee una stabilizzazione dell’intermedio tetraedrico