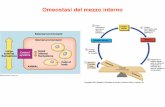
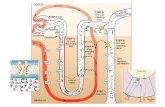
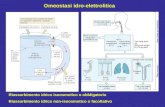
Omeostasi delle proteine (I) (Pancreas esocrino, intensa attività secretoria)
Corso di Laurea in Biotecnologie Offerte di Tirocinio · Omeostasi del ferro intraellulare:...
Transcript of Corso di Laurea in Biotecnologie Offerte di Tirocinio · Omeostasi del ferro intraellulare:...
25 settembre 2017 – Giornata dell’ accoglienza
Università degli Studi dell’Insubria
Corso di Laurea in Biotecnologie
Offerte di Tirocinio
Dipartimento di Biotecnologie e Scienze della Vita
21 dicembre 2017
1
Presentazione Offerte di Tirocinio del DBSV
21 dicembre 20172
I Laboratori di Ricerca del DBSV
1. piano blu
2. piano verde
3. piano giallo
4. piano rosso
Presentazione Offerte di Tirocinio del DBSV
21 dicembre 20173
1. piano bluLaboratorio di biologia degli invertebratiAttività: Processi di morte cellulare nello sviluppo di insetti olometaboli; strategie peril controllo di specie dannose; bioconversione di masse di scarto mediante l'impiego diinsetti.Tecniche utilizzate: microscopia ottica ed elettronica, immunoistochimica, tecniche dibiologia cellulare e molecolare (estrazione di RNA, qPCR, western blot, test diproliferazione e di apoptosi), dosaggi enzimatici.Contatti: Prof. Gianluca Tettamanti
Presentazione Offerte di Tirocinio del DBSV
21 dicembre 20174
1. piano blu
Laboratorio di biologia degli invertebrati
Attività: Studio della risposta immunitaria innata utilizzando come modello animale la sanguisuga Hirudo medicinalis. Identificazione e la caratterizzazione di fattori infiammatori che regolano il reclutamento ed il differenziamento dei macrofagi.Tecniche utilizzate: microscopia ottica, elettronica a trasmissione e a scansione, immunoistochimica, istochimica enzimatica, Western blot, utilizzo di biopolimeri per allestimento di colture cellulari.Contatti: Prof.ssa Annalisa Grimaldi
Attività: L’amiloidogenesi come risposta fisiologica all’aumento di specie reattive dell’ossigeno in differenti tipi cellulari (studi in vivo e in vitro) Tecniche utilizzate: analisi TEM,SEM, Confocale, biologia cellulare e molecolare.Contatti: Prof.ssa Magda de Eguileor
Presentazione Offerte di Tirocinio del DBSV
21 dicembre 20175
1. piano blu
Laboratorio di genetica molecolare
Attività:
1. Regolazione dell’espressione dell’enzima mitocondriale Prolina Deidrogenasi
(PRODH) e caratterizzazione del suo ruolo nei tumori del polmone non a piccole
cellule (NSCLC);
2. Dosaggio di microRNA circolanti come marcatori per la diagnosi precoce del
cancro al polmone;
3. Studio dell’espressione di recettori TRP e NMDA nel dolore lombare cronico.
Tecniche utilizzate: tecniche di immunoistochimica, biologia cellulare e molecolare
(estrazione di DNA ed RNA, qPCR, digital PCR, saggi di luciferasi, Western blot, ELISA);
Clonaggi; Colture di cellule umane, trasfezioni stabili e transienti, saggi fenotipici su
cellule (proliferazione, apoptosi, invasione, ecc.).
Contatti: Dott.ssa Paola Campomenosi
Presentazione Offerte di Tirocinio del DBSV
21 dicembre 20176
Laboratorio di fisiologia cellulare e molecolare
Attività:
Trasportatori di aminoacidi e peptidi: struttura, funzione e regolazione, ruolo
nell’uptake di nutrienti essenziali e negli stati infiammatori. Ruolo delle diverse
isoforme dei trasportatori di nutrienti
Trasporto di D-aminoacidi negli insetti: ruolo e significato
Omeostasi del ferro intracellulare: costruzione di proteine chimeriche per l’analisi
di domini funzionali
Nanoparticelle e membrane – vie di permeazione di membrana
Tecniche utilizzate: Biologia molecolare (estrazioni di DNA/RNA Trascrizione in Vitro,
PCR Mutagenesi, clonaggi, costruzione di vettori di espressione), immunochimica
(immunoistochimica, immunocitochimica, western-blot), elettrofisiologia, microscopia
in fluorescenza, utilizzo di sonde fluorescenti, colture cellulari,
trasfezioni, microiniezione.
Contatti: Prof.ssa Elena Bossi
1. piano blu
Presentazione Offerte di Tirocinio del DBSV
21 dicembre 20177
Laboratorio di immunologia e patologia generale
Attività:
1. Ruolo delle cellule Natural Killer nel processo angiogenetico del tumore prostatico
umano.
2. Caratterizzazione fenotipica e funzionale di cellule innate linfoidi periferiche e
tissutali nel carcinoma colon-retto e identificazione di fattori pro-tumorali e pro-
angiogenetici.
3. Risposta di cellule Natural Killer in vitro a liquidi pleurici infiammatori e tumorali.
4. Ruolo in vitro della citolisi anticorpo dipendente delle cellule Natural Killer nella
terapia di tumori.
Tecniche utilizzate: colture primarie di linfociti umani, test funzionali di citotosscità
verso cellule tumorali, test in vitro di morfogenesi, invasione e migrazione di cellule
endoteliali umane, test di proliferaizone cellulare, citofluorimetria a flusso e cell
sorting, RT-PCR e digital PCR.
Contatti: Prof. Douglas Noonan - Dott. Lorenzo Mortara
1. piano blu
25 settembre 2017 – Giornata dell’ accoglienza
8
2. piano verde
Laboratorio di biologia cellulare
Attività:
1. Studi sulla tossicità di nanoparticelle (nanotossicologia) usando come modello
sperimentale cellule staminali umane.
2. Preparazione di nanosistemi (nanoparticelle@enzimi; nanoparticelle@antibiotici),
caratterizzazione e saggi di attività
3. Studi sul differenziamento delle cellule staminali da tessuto adiposo ed effetto
paracrino delle stesse.
Tecniche utilizzate: estrazione di DNA e RNA, retrotrascrizione. PCR qualitativa, semiquantitativa e real time, trasformazioni, colture cellulari. Metodi di sintesi e coniugazione delle nanoparticelle, saggi enzimatici.Contatti: Prof. Giovanni Bernardini - Prof.ssa Rosalba Gornati
25 settembre 2017 – Giornata dell’ accoglienza
Laboratorio di biotecnologie vegetali
Attività:
1. Risposta delle piante ai cambiamenti climatici. Studi funzionali in piante
transgeniche. Analisi dei cambiamenti proteomici.
2. Caratterizzazione della risposta molecolare e fisiologica del frumento alla
colonizzazione di funghi micorrizici e batteri simbionti benefici
Tecniche utilizzate: tecniche varie di biologia molecolare (estrazione e manipolazione
di DNA, PCR, trasformazione), colture microbiche e di espianti vegetali; estrazione di
proteine e separazione mediante elettroforesi bidimensionale o gel-free,
identificazione mediante spettrometro di massa ed elaborazione bioinformatica dei
dati
Contatti: Prof.ssa Marcella Bracale - Prof.ssa Candida Vannini
9
2. piano verde
25 settembre 2017 – Giornata dell’ accoglienza
Laboratorio di microbiologia ambientale e molecolare (DBSV)
Attività- Terapia fotodinamica antimicrobica: risposta di microrganismi modello allo stress
foto-ossidativo.- Studio di biofilm batterici e di modalità per eradicarli.Tecniche utilizzate: tecniche di base della batteriologia (preparazione terreni, coltivazione batteri, valutazione della concentrazione cellulare e della biomassa, allestimento curve di crescita). Allestimento biofilm batterici e loro visualizzazione mediante microscopia confocale. Tecniche di biologia molecolare (estrazione DNA genomico e plasmidico, clonaggi, PCR, elettroforesi su gel per analisi DNA e proteine, allestimento banche mutanti).Contatti: Prof.ssa Paola Barbieri - Dott.ssa Viviana Orlandi
10
2. piano verde
25 settembre 2017 – Giornata dell’ accoglienza
Laboratorio biotecnologie animali
Attività:
Caratterizzazione del microbioma intestinale in modelli animali aquatici mediante la
tecnologia Next-Generation Sequencing del gene 16S rRNA: influenza di fattori
ambientali e nutrizionali sull’abbondanza di taxa batterici in specie ittiche marine e di
acqua dolce.
Influenza della dieta a base di farina di insetto sulla composizione del microbioma
intestinale e sull’espressione di geni coinvolti nel trasporto intestinale di aminoacidi ed
oligopeptidi, in specie ittiche d’acqua dolce.
Influenza di derivati stabili dell’acido butirrico nella dieta di specie ittiche marine sulla
composizione del microbioma intestinale e sull’espressione di geni coinvolti nella
risposta immunitaria e nel metabolismo proteico.
11
2. piano verde
25 settembre 2017 – Giornata dell’ accoglienza
Risposta trascrizionale di alcuni geni coinvolti nel metabolismo della metionina in
trote allevate con diete a base di farina di insetto (Tenebrio molitor o Hermetia
illucens).
Influenza di alcune diete sperimentali sull’attività trascrittomica dei geni codificanti
per il trasportatore intestinale di oligopeptidi (PepT1) e di aminoacidi neutri, SLC6A19,
in specie ittiche marine.
Tecniche utilizzate: estrazione automatizzata di DNA genomico e RNA da contenuto e
mucosa intestinale e da vari tessuti animali, clonaggio molecolare, PCR, One Step
Taqman real time, elettroforesi su gel per analisi DNA e proteine, Western blot,
elettroforesi capillare, istologia, microscopia.
Tecniche molecolari innovative: sequenziamento mediante tecnologia Next-
Generation Sequencing del gene 16S rRNA.
Contatti: Prof.ssa Genciana Terova - Dott.ssa Micaela Antonini - Dott.ssa Simona
Rimoldi
12
2. piano verde
25 settembre 2017 – Giornata dell’ accoglienza
3. piano giallo
13
Laboratorio di post-genomica funzionale e ingegneria proteica
"The Protein Factory"
Attività:
Studio di proteine umane coinvolte nel metabolismo di neuromodulatori e loro
alterazioni in condizioni patologiche (schizofrenia, SLA, patologia di Alzheimer)
• caratterizzazione biochimica delle proteine prodotte in forma ricombinante;
• studi funzionali in linee cellulari – localizzazione subcellulare, modulazione
dell’attività, stabilità (emivita, vie di degradazione), modificazioni II
Studio e ottimizzazione di enzimi di interesse industriale mediante ingegneria proteica
• ottimizzazione dell’espressione ed evoluzione molecolare;
• caratterizzazione biochimica e biocatalisi su substrati di interesse;
• messa a punto di «tool box enzimatici»
Produzione di proteine di interesse terapeutico in linee cellulari di mammifero
• messa a punto delle condizioni di espressione e purificazione;
• studi strutturali e funzionali
25 settembre 2017 – Giornata dell’ accoglienza
3. piano giallo
14
Tecniche utilizzate: metodi di biologia molecolare (estrazione e manipolazione di DNA,
PCR, trasformazione, trasfezione), colture microbiche e di cellule animali; purificazione
di proteine, detection (Western blot, immunofluorescenza, immunoprecipitazione);
metodi di biochimica (cromatografie, spettrofotometria, fluorimetria, dicroismo
circolare, dosaggi enzimatici, cinetica allo stato stazionario e prestazionario).
Contatti: Prof. Loredano Pollegioni - Prof. Gianluca Molla - Prof. ssa Silvia Sacchi- Dott.
Luciano Piubelli – Dott.ssa Elena Rosini
25 settembre 2017 – Giornata dell’ accoglienza
3. piano giallo
15
Laboratorio di genetica umana
Attività: Caratterizzazione molecolare e funzionale del gene oncosoppressore umano RNASET2.Tecniche utilizzate: clonaggio, PCR standard e real-time, saggi di ibridazione, colture cellulari, trasferimento genico in vitro, test di trasformazione tumorale in vitro, Western blot, saggi di immunofluorescenza su cellule coltivate in vitro.Contatti: Prof. Francesco Acquati
25 settembre 2017 – Giornata dell’ accoglienza
3. piano giallo
16
Laboratorio di biologia vegetale
Attività:
1. Studio dei processi di acclimatazione delle piante a livello morfologico-
architetturale, anatomico e molecolare, in risposta a diversi stress di tipo abiotico
(idrico, da alta temperatura e meccanico), soprattutto a livello di sistema radicale.
2. Analisi della produzione di metaboliti secondari in risposta a stress abiotico e
biotico.
Tecniche utilizzate: analisi morfologica 2D e 3D, indagini anatomiche, scambi gassosi
epi- ed ipo-gei, tecniche varie di biologia molecolare, biochimica, elaborazione
statistica dei dati
Contatti: Prof. Antonino Di Iorio
25 settembre 2017 – Giornata dell’ accoglienza
Biotecnologie microbiche e delle fermentazioniAttività: Studi sulla biosintesi (produzione) e sui meccanismi di azione e resistenza di
antibiotici e studio biochimico di alcuni enzimi coinvolti nelle relative vie metaboliche;
sviluppo (ottimizzazione delle condizioni) di fermentazioni per la produzione di
proteine terapeutiche e enzimi industriali da genomica e metagenomica.
Tecniche utilizzate: metodi di biologia molecolare su microrganismi (trasformazioni,
estrazione e manipolazione di DNA, PCR…), crescite di colture microbiche
(fermentazioni). Purificazione, detection (western blot) e caratterizzazione di proteine
(cromatografie, spettrofotometria…). Analisi di metaboliti secondari da brodi di
fermentazione mediante HPLC.
Contatti: Prof.ssa Flavia Marinelli - Dott.ssa Letizia Marcone
3. piano giallo
17
25 settembre 2017 – Giornata dell’ accoglienza
Laboratorio di chimica organica - Unità di fotobiologia
Attività: Sintesi di nuovi fotosensibilizzanti appartenenti alla famiglia delle porfirine e dei BODIPY e loro applicazione in vitro nella terapia fotodinamica antitumorale (collaborazione con il laboratorio di Farmacologia antineoplastica di Busto Arsizio –Prof.ssa Monti) e antibatterica (collaborazione con il laboratorio di Microbiologia –Prof.ssa Barbieri)Tecniche utilizzate: sintesi chimica, estrazione con solvente, cromatografia su colonna, HPLC, spettroscopia Uv-vis e di fluorescenza, colture cellulari, microscopia fluorescenza e confocale, colture battericheContatti: Prof. Stefano Banfi - Dott. Enrico Caruso
4. piano rosso
18
25 settembre 2017 – Giornata dell’ accoglienza
Laboratorio di farmacologia antineoplastica
Attività:
1. Ruolo del fattore inducibile dall'ipossia nella risposta di cellule tumorali al
trattamento farmacologico
2. Specie reattive dell’ossigeno e transizione epitelio-mesenchimale in cellule
tumorali
3. Modulazione dell’attività delle cellule Natural Killer nella risposta ad anticorpi
terapeutici utilizzati nella terapia dei tumori
4. Ruolo dell'autofagia nella resistenza ai farmaci antitumorali
Tecniche utilizzate: colture in vitro di cellule tumorali, immunofluorescenza, RT-PCR,
metodiche di biochimica e biologia molecolare, citofluorimetria a flusso
Contatti: Prof.ssa Elena Monti - Prof.ssa Marzia Gariboldi
Sede di Busto Arsizio
19
25 settembre 2017 – Giornata dell’ accoglienza
Laboratorio di Archeobiologia e biotecnologie forensi
Attività:
1. Indagini di antropologia fisica su resti ossei antichi
2. Sviluppo di metodiche di antropologia identificativa forense (identificazione
generica sui singoli scheletri) direttamente sui siti di rinvenimento: aree di
necropoli e cimiteriali
3. Indagini di archeobotanica, archeozoologia e metodi di datazione relativa in
ambito di contesti archeologici
4. Indagini antropologiche identificative su reperti ossei provenienti da ossari
comuni: ricognizione di ossa frammentarie e ricostruzione del numero minimo di
individui
Tecniche utilizzate: indagini macroscopiche, morfologiche e morfometriche, sui singoli
reperti ossei, lettura analisi tomografiche
Contatti: Prof. Ilaria Gorini, dott.sa Marta Licata
20
25 settembre 2017 – Giornata dell’ accoglienza
Laboratorio di Biotecnologie Medico-chirurgiche applicate all’ortopedia e
traumatologia
Attività: studio dei canali TRVP e NRMA nel dolore cronico, neurogenico
Tecniche utilizzate: microscopia ottica ed elettronica, immunoistochimica, tecniche dibiologia cellulare e molecolare (estrazione di RNA, qPCR, western blot).
Contatti: Prof. Michele F. Surace
Attività: studio delle necrosi avascolari della testa del femore
Tecniche utilizzate: microscopia ottica, elettronica a trasmissione e a scansione, immunoistochimica.
Contatti: Prof. Michele F. Surace
21
25 settembre 2017 – Giornata dell’ accoglienza
22
Dove trovare le informazioni:
https://www.uninsubria.it/offertaformativa/biotecnologie