Chimica organica - Home - Liceo Scientifico Vercelli 25/10/14 18.47 Chimica parte 5 1/58 Chimica...
Transcript of Chimica organica - Home - Liceo Scientifico Vercelli 25/10/14 18.47 Chimica parte 5 1/58 Chimica...
25/10/14 18.47 Chimica parte 5 1/58
Chimica organica
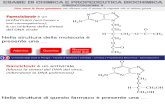
Una volta con questo termine si indicavano i composti sintetizzati da organismi viventi, come ad esempio legno, ossa, vestiti, cibi, medicine, e le sostanze complesse che formano il nostro corpo (in antitesi con la chimica inorganica che era quella basata sui composti sintetizzati artificialmente).
Questa teoria fu abbandonata nel 1828 quando il chimico tedesco Friedrich Wohler preparò l’urea (componente dell’urina quindi materiale chiaramente organico) riscaldando un sale inorganico: il cianato di ammonio.
Fu quindi evidente che una sostanza organica poteva essere sintetizzata anche in laboratorio oltre che da organismi viventi. Nonostante ciò si ritenne opportuno mantenere la vecchia divisione tra materiali organici ed inorganici
NH4OCN H2N C
O
NH2
T
25/10/14 18.47 Chimica parte 5 2/58
Il carbonioLa chimica organica è essenzialmente la chimica del carbonio: il primo elemento del IV gruppo della tavola periodica:
configurazione elettronica esterna s2p2
• possibilità di formare 4 legami covalenti• può dare doppi legami C=C e i tripli legami C≡C, C≡C anch’essi molto diffusi, sono molto stabili
• Quando si lega forma ibridi sp3, sp2 e sp
25/10/14 18.47 Chimica parte 5 3/58
Ibridazione sp3
Consideriamo l'atomo di carbonio la cui configurazione elettronica è 1s2 2s2 2p2. Come si può notare, il carbonio ha solo due orbitali 2p semipieni e, pertanto, dovrebbe dare origine solamente a due legami covalenti.
In realtà il carbonio, come nel metano CH4, è prevalentemente tetravalente, cioè in grado di formare 4 legami con altri atomi. Si suppone la promozione di un elettrone dall'orbitale 2s sull'orbitale 2p vuoto. Tale atomo di carbonio eccitato ha ora quattro orbitali semipieni, e potrebbe formare quattro legami
Tuttavia, siccome l'orbitale atomico 2s sferico ha energia inferiore e forma diversa da quella dei tre orbitali 2px, 2py, 2pz, dovremmo aspettarci tre legami uguali ed uno diverso. Tutto ciò è in contrasto con i fatti sperimentali che accertano la presenza nel metano (CH4) di 4 legami covalenti identici.
25/10/14 18.47 Chimica parte 5 4/58
Ibridazione sp3
● La teoria suggerisce il "mescolamento" dell'orbitale 2s con i tre orbitali 2p. Tale mescolamento è matematico, delle funzioni d'onda dell'orbitale e quindi non è un reale fenomeno fisico. Come risultato si ottengono 4 nuovi orbitali identici tra loro, di forma, energia e disposizione nello spazio del tutto diverse da quelle originarie. Questa operazione matematica prende il nome di ibridazione. I nuovi 4 orbitali ibridi, chiamati sp3, hanno per 1/4 le caratteristiche dell'orbitale s di partenza e per 3/4 le caratteristiche degli orbitali 2p. L'esponente di p indica il numero di orbitali p che partecipano alla formazione dell'ibrido
● Presentano ibridazione sp3 gli atomi di carbonio uniti da un legame covalente singolo (-C-C-), come ad esempio nella molecola dell’etano
25/10/14 18.47 Chimica parte 5 5/58
Formazione dell'ibrido sp3
Uno dei 2 elettroni del sottolivello 2s viene 'promosso' al sottolivello 2p, i 4 orbitali sp3 risultanti hanno la stessa energia, maggiore del sottolivello 2s ma minore del sottolivello 2p. Per mantenersi alla massima distanza reciproca assumono un'angolazione di circa 109 gradi nello spazio. Configurazione tetraedrica
25/10/14 18.47 Chimica parte 5 7/58
Ibridi sp2
● Oltre all'ibridazione sp3 esistono anche altre ibridazioni. Dal mescolamento di un orbitale s con due orbitali di tipo p si ottengono 3 orbitali ibridi detti orbitali sp2 che si dispongono su di un piano formando angoli di 120° l'uno dall'altro (geometria trigonale planare).
● L'orbitale p non coinvolto nell'ibridazione si dispone perpendicolarmente al piano formato dai tre orbitali ibridi sp2
● Presentano ibridazione sp2 gli atomi di carbonio uniti da un legame covalente doppio (>C=C<), come ad esempio nella molecola dell’etene (o etilene) H2C=CH2. Il doppio legame C=C si realizza in seguito alla sovrapposizione frontale tra due orbitali ibridi sp2 e alla sovrapposizione laterale tra i 2 orbitali p non coinvolti nell'ibridazione.
25/10/14 18.47 Chimica parte 5 8/58
Formazione dell'ibrido sp2
Uno dei 2 elettroni del sottolivello 2s viene 'promosso' al sottolivello 2p, si formano 3 orbitali sp2 con energia, maggiore del sottolivello 2s ma minore del sottolivello 2p; rimane un orbitale p occupato da un elettrone. Gli orbitali sp2 assumono un'angolazione reciproca di 120 gradi nel piano, l'orbitale p è perpendicolare ad essi. Configurazione planare
25/10/14 18.47 Chimica parte 5 10/58
Ibridi sp
● La combinazione di un orbitale di tipo s e uno di tipo p dà origine a 2 orbitali ibridi sp. Ogni orbitale ibrido sp ha il 50% di carattere s e il 50% di carattere p
● I due orbitali ibridi sp si dispongono a 180° l’uno rispetto all’altro (geometria lineare)
● Gli orbitali p non coinvolti nell'ibridazione sono disposti perpendicolarmente tra loro e sono perpendicolari ai due orbitali ibridi sp
● Presentano ibridazione sp gli atomi di carbonio uniti da un legame covalente triplo (-C≡C-), come ad esempio nella molecola dell’etino HC≡CH. Il triplo legame -C≡C- si realizza in seguito alla sovrapposizione frontale tra due orbitali ibridi sp e alla sovrapposizione laterale tra le due coppie di orbitali p non coinvolti nell'ibridazione.
25/10/14 18.47 Chimica parte 5 11/58
Formazione dell'ibrido sp
Uno dei 2 elettroni del sottolivello 2s viene 'promosso' al sottolivello 2p, si formano 2 orbitali sp con energia, maggiore del sottolivello 2s ma minore del sottolivello 2p; rimangono 2 orbitali p occupati da un elettrone ciascuno. Gli orbitali sp assumono un'angolazione reciproca di 180 gradi, i due orbitali p sono perpendicolari. Configurazione lineare
25/10/14 18.47 Chimica parte 5 13/58
Formule
● Grezze: es. C6H14, dove si indicano gli atomi e le loro quantità
● Razionali: es.
dove sono evidenziati i legami tra atomi di carbonio
● Di struttura: es.
dove si evidenziano tutti i legami fra gli atomi di una molecola,
25/10/14 18.47 Chimica parte 5 14/58
Formule topologiche
● Rappresentano con segmenti lo scheletro della molecola con la disposizione geometrica degli atomi di carbonio, ai vertici di ogni segmento, se non diversamente indicato, vi è un atomo di carbonio
25/10/14 18.47 Chimica parte 5 15/58
Isomerie● I composti che hanno la stessa formula grezza ma diversa struttura si dicono isomeri
● Esistono diversi tipi di isomeri
25/10/14 18.47 Chimica parte 5 16/58
Isomeri strutturali
Hanno stessa formula bruta, ma i C sono legati tra loro in diversa successione:
Etanolo CH3 CH2 OH e metossimetano CH3 O CH3
Butano CH3 CH2 CH2 CH3 e metilpropano (CH3)2CH CH3
Nell’isomeria è importante la sequenza dei legami. Se gli atomi sono legati in successione differente, i due composti sono isomeri di struttura, se sono legati reciprocamente allo stesso modo, sono stereoisomeri.
25/10/14 18.47 Chimica parte 5 17/58
Isomeri strutturali● di catena, che interessa la struttura dello "scheletro" di carbonio, ossia la presenza e
posizione di ramificazioni od anelli; isomeri di questo tipo hanno proprietà fisiche diverse, ma reattività chimiche spesso abbastanza simili;
● di posizione, che interessa la posizione di legami multipli o di gruppi contenenti atomi diversi da carbonio e idrogeno; isomeri di questi tipo appartengono alla stessa classe di composti, hanno quindi generalmente reattività chimica simile, diverse sono invece le loro proprietà fisiche;
● di gruppo funzionale, isomeri cioè che pur avendo formula bruta uguale, presentano gruppi funzionalmente diversi, ed hanno quindi proprietà chimiche e fisiche molto differenti.
25/10/14 18.47 Chimica parte 5 18/58
Stereoisomeri● Gli atomi sono legati nella stessa sequenza ma la struttura finale è differente
– Enantiomeri (anche chiamati isomeri ottici), sono uno la forma speculare non sovrapponibile dell'altro. Si formano in presenza di elementi stereogenici come un atomo, tipicamente un carbonio portante quattro sostituenti diversi, che viene definito centro chirale.
– Diastereoisomeri (anche chiamati isomeri geometrici) isomeri di cui uno non è l'immagine speculare dell'altro o, in modo equivalente, due stereoisomeri che non sono enantiomeri. Le molecole possiedono quindi la stessa formula molecolare e connettività fra gli atomi ma hanno un orientamento nello spazio diverso. Nonostante nella categoria rientrino anche, ad esempio, gli isomeri geometrici e quelli conformazionali, il termine di diastereoisomeri viene di solito utilizzato per distinguere molecole con più di uno stereocentro
● geometrici, (o cis-trans), nelle molecole in cui la cui struttura (es. doppio legame) impedisce una libera rotazione possono trovarsi gli stessi gruppi in posizioni geometricamente differenti
● conformazionali, è il caso in cui pur non essendoci uno stereocentro, le possibili orientazioni date dalla rotazione di un legame C-C e dalle possibili conformazioni di una molecola (come ad esempio nel caso in cui i sostituenti di un atomo o una catena di atomi si orienti ad elica e anche nelle conformazioni dei cicloalcani) producono molecole con ugual formula bruta, ugual connettività ma non sovrapponibili. Un isomero conformazionale si dice anche conformero o rotamero. È il caso di sottolineare che i conformeri non sono dei veri e propri isomeri, in quanto la barriera energetica tra le varie orientazioni è molto piccola e, a temperatura ambiente, l'una si trasforma nell'altra, pur avendo ciascuna una maggiore o minore probabilità a seconda della stabilità.
25/10/14 18.47 Chimica parte 5 19/58
Enantiomeri
● Nell'acido lattico (CH3-CHOH-COOH) il C in posizione 2 è asimmetrico
(stereogenico) e genera 2 molecole speculari: la forma R o destrogira e la forma S o levogira.
● Il verso della rotazione si ottiene partendo dagli atomi legati al centro stereogenico con numero atomico maggiore spostandosi verso gli atomi con numero atomico minore ponendo il gruppo a priorità minore dietro (sotto) il carbonio asimmetrico
25/10/14 18.47 Chimica parte 5 20/58
Isomeri geometrici
1,2-transdicloroetene 1,2-cisdicloroetene
Non è possibile la rotazione attorno all'asse del doppio legame e le due molecole non si possono trasformare l'una nell'altra
25/10/14 18.47 Chimica parte 5 21/58
Isomeri conformazionali
Per rappresentare la conformazione di queste molecole, si usano le proiezioni di Newman che si costruiscono immaginando di osservare la struttura lungo l'asse che unisce coppie di atomi di carbonio.
La differenza di energia tra le varie conformazioni è solitamente bassa e la molecola può passare facilmente da una forma all'altra
Conformazioni cicloesano
25/10/14 18.47 Chimica parte 5 22/58
Idrocarburi
● contengono solo carbonio ed idrogeno● vengono distinti in tre classi
– alifatici suddivisi in● saturi: solo legami semplici c-c
– alcani con catena lineare o ramificata, cicloalcani se ciclici: ● insaturi: con legami multipli c=c (alcheni), c≡c (alchini)
– aromatici: ciclici ed insaturi - simili al benzene.
25/10/14 18.47 Chimica parte 5 23/58
Alcani e cicloalcani
● alcani (ibridazione sp3)
– formano una serie omologa, in cui ogni termine differisce dal successivo per una quantità costante (-CH2-).
– hanno formula generale CnH2n+2
● cicloalcani (ibridazione sp3)
– sono idrocarburi saturi i cui atomi di carbonio formano almeno un anello.
– Quando sono formati da un anello singolo hanno formula generale CnH2n
25/10/14 18.47 Chimica parte 5 24/58
Alcheni
● Alcheni o idrocarburi etilenici o olefine (ibridazione sp2)– Hanno almeno un doppio legame
– Quando è presente solo un doppio legame hanno formula generale CnH2n
25/10/14 18.47 Chimica parte 5 25/58
Alchini
● ibridazione sp● hanno almeno un triplo legame● Con un solo triplo legame hanno formula
generale CnH2n-2
25/10/14 18.47 Chimica parte 5 27/58
Regole di nomenclatura IUPAC
L’alcano più semplice è il metano CH4. Gli alcani successivi si ricavano allungando la catena carboniosa ed aggiungendo H a completare i legami del C.Gli alcani non ramificati vengono detti normali
Desinenze:Alcani -anoAlcheni -ene (2 doppi legami –diene; 3 doppi legami –triene ecc.)Alchini -ino (due tripli legami –diino; 3 tripli legami triino ecc.)
-enino Composto insaturo con doppi e tripli legami
Sostituenti saturi:Gruppi alchilici –ileEs.: metile: CH3 ; etile CH3 CH2 ; propile CH3 CH2 CH2
Il simbolo R viene usato per indicare un gruppo alchilico generico (R-H), così R-Cl è un generico cloruro alchilico.
25/10/14 18.47 Chimica parte 5 28/58
Regole di nomenclatura IUPAC
● Numerazione:– Per i composti non ramificati il nome è dato dal numero di atomi di C– Nei composti ramificati il nome è dato della catena più lunga di atomi di C – La numerazione è progressiva a partire dal C più vicino al primo sostituente– A parità di atomi di C si sceglie la catena con più ramificazioni– Se due ramificazioni sono equidistanti dalle estremità il C1 è il più vicino alla terza ramificazione– Se manca una terza ramificazione, il numero più basso va alla ramificazione che viene prima alfabeticamente– Ogni sostituente deve avere un nome ed un numero anche se si trovano sullo stesso Carbonio.– I sostituenti vengono indicati in ordine alfabetico, indipendentemente dalla numerazione
● Precedenza per desinenza finale e numerazione– Acidi carbossilici, Anidridi, Esteri, Ammidi, Aldeidi, Chetoni, Alcoli, Ammine, Eteri, Alcheni, Alchini, Alcani
Prefisso Lunghezza catena
met- 1 atomo di carbonio
et- 2 atomi di carbonio
prop- 3 atomi di carbonio
but- 4 atomi di carbonio
pent- 5 atomi di carbonio
es- 6 atomi di carbonio
... (come per i poligoni)
25/10/14 18.47 Chimica parte 5 29/58
Alcani - nomenclatura● individuare la più lunga catena ininterrotta di atomi di carbonio nella struttura;● numerare gli atomi della catena partendo dall'estremità che permette i numeri più bassi possibile
● Individuare e nominare le ramificazioni in modo analogo alla catena principale, sostituendo però il suffisso -ano con il suffisso -il (pertanto 1: metil, 2:etil, 3: propil, etc.)
● il nome è costituito dall'elenco delle ramificazioni precedute dal numero di ogni atomo della catena principale che le ospita, seguito dal nome della catena principale. Il nome va scritto come un'unica parola e si ricordi che i prefissi di-, tri- ecc. non concorrono all'ordine alfabetico dei sostituenti.
● in alcuni rari casi è possibile che un sostituente a sua volta si ramifichi. In questi casi il sostituente va nominato seguendo le regole precedenti considerandolo una catena a parte. Successivamente il gruppo andrà inserito tra parentesi nel nome indicando il numero del carbonio legato
2,2,4-trimetilpentano
25/10/14 18.47 Chimica parte 5 30/58
Cicloalcani - nomenclatura
● Si mette il prefisso ciclo al nome dell’alcano corrispondente per numero di C● Se il composto ha un solo sostituente, questo sta sempre sul C in posizione
1 e nel nome non viene indicata la numerazione.● Se si hanno più sostituenti la numerazione parte dal C con il sostituente che
viene prima alfabeticamente e va in direzione del sostituente più vicino.● Se i sostituenti sono degli alogeni, questi vanno indicati in ordine alfabetico● Es. Ciclopropano, ciclobutano, ciclopentano, cicloesano, ecc..● Possono assumere conformazioni diverse, quella a sedia è più stabile
25/10/14 18.47 Chimica parte 5 31/58
Alcani e cicloalcani - caratteristiche
Principali fonti naturali sono petrolio e gas naturale. Non sono composti polari, quindi non sono solubili in acqua. Sono tra i componenti che formano la pellicola protettiva cerosa all’esterno di frutti quali le mele (C27H56 e C29H60)
I composti con non più di 4 atomi di C sono gassosi. A parità di PM con la maggior parte degli altri composti organici, gli alcani hanno i punti di ebollizione più bassi a causa delle deboli forse attrattive tra molecole non polari. Con il crescere della catena carboniosa, crescono le forze attrattive e crescono, di conseguenza i punti di ebollizione.
Gli alcani non sono molecole solubili perché, a differenza dell’H2O che è una molecola polare, tutti i legami C-C e C-H degli alcani sono covalenti puri e per scioglierli in acqua occorre una energia sufficiente a vincere le forze attrattive tra le molecole di H2O.
25/10/14 18.47 Chimica parte 5 32/58
Alcheni - nomenclatura
● Si sceglie sempre la catena più lunga contenente entrambi i C del legame insaturo● La numerazione parte dal C più vicino al legame insaturo● Se un doppio ed un triplo legame sono equidistanti dai C terminali, il numero più basso va al
C più vicino al doppio legame● Per i sostituenti, la nomenclatura segue le regole degli alcani● La rotazione attorno al doppio legame è impedita. Gli atomi di C del doppio legame e gli H
ad essi legati si trovano sullo stesso piano. L’angolo di legame del C trigonale è di 120°. Negli alcheni è possibile una isomeria cis-trans solo quando i C del doppio legame hanno sostituenti diversi.
● Nei cicloalcheni la numerazione va nella direzione dei C del doppio legame in senso orario, ma se vi sono due legami insaturi, la direzione è quella del secondo legame più vicino.
25/10/14 18.47 Chimica parte 5 33/58
Alcheni - caratteristiche
Proprietà simili a quelle degli alcani. Densità inferiore a quella dell’acqua. I composti con non più di 4 atomi di C sono, analogamente agli alcani, incolori e gassosi, mentre gli omologhi superiori sono liquidi volatili.
25/10/14 18.47 Chimica parte 5 34/58
Alchini - nomenclatura
● Come per gli alcheni ma il doppio legame ha la precedenza sul triplo
● Desinenza -ino● Angolo di legame in presenza di legame triplo =
180°
25/10/14 18.47 Chimica parte 5 35/58
Alchini - caratteristiche
● Come per gli alcheni, anche la maggior parte della reattività degli alchini si esplica attraverso reazioni di addizione al triplo legame. Le reazioni di addizione possono essere lasciate procedere fino all'ottenimento di composti saturi (cioè con atomi legami tra loro solo da legami semplici) oppure essere condotte in condizioni tali da favorire un'addizione parziale, trasformando quindi il triplo legame in un legame doppio.
● Particolarità chimica degli alchini è l'acidità degli idrogeni legati ai carboni coinvolti nel triplo legame. Tale acidità permette la formazione di sali, chiamati "carburi". Il più comune di questi è il carburo di calcio (CaC2), usato dagli speleologi per produrre acetilene (etino in IUPAC) nelle apposite lampade
25/10/14 18.47 Chimica parte 5 36/58
Composti aromatici: benzene
A differenza del cicloesano la struttura del benzene è piana
Kekulè propose una struttura classica con i C ai vertici di un esagono regolare e doppi legami alternati (coniugati), ma per spiegare il fatto che il benzene non dà le stesse reazioni degli alcheni, Kekulè propose uno scambio così rapido tra legami semplici e doppi che le normali reazioni non potevano avvenire.
Oggi sappiamo che le due forme proposte da Kekulè sono due forme limite equivalenti e che gli atomi occupano sempre le stesse posizioni, ma differiscono solo per la disposizione degli elettroni, requisito fondamentale per la risonanza. Di fatto la struttura ibrida è una sola. Non esistono né legami semplici né doppi, ma un tipo intermedio tra i due.
25/10/14 18.47 Chimica parte 5 37/58
Composti aromatici - nomenclatura
● Se è legato un solo gruppo alchilico:– Nome del gruppo alchilico seguito dalla desinenza “benzene”
● Se sono legati più gruppi alchilici o alchenilici:– Come nei cicloalcani, il primo sostituente si trova sul C1– Nome del sostituente con posizione relativa– Quando i sostituenti sono 2 sono possibili 3 isomeri: orto (C2), meta (C3), para (C4)– Quando i sostituenti sono più di 3 la posizione è data numerando i C dell’anello.
● Come classe, gli idrocarburi aromatici prendono il nome di areni. Un generico gruppo aromatico (gruppo arilico) si indica con Ar.
● I gruppi più ricorrenti sono il gruppo fenile ed il gruppo benzile.
25/10/14 18.47 Chimica parte 5 39/58
Gruppi funzionali
● Sono atomi o gruppi di atomi che conferiscono caratteristiche particolari alla molecola di cui fanno parte
25/10/14 18.47 Chimica parte 5 40/58
Alcol
● Formula generale: R-OH● Gruppo funzionale: Ossidrilico (-OH)● Nomenclatura
– Nome del gruppo alchilico legato all’ossidrile con desinenza –olo
– Il C1 è quello che porta l’ossidrile
– Negli alcoli insaturi si hanno 2 desinenze: quella del legame insaturo e quella dell’ossidrile che viene comunque messa per seconda. In questi composti il suffisso -olo, che nella numerazione ha la precedenza, viene messo per secondo.
– Si può anche considerare l'ossidrile come ramificazione indicandolo col prefisso idrossi-
– Negli aromatici si fa risalire la nomenclatura al capostipite fenolo
25/10/14 18.47 Chimica parte 5 41/58
AlcolEsempi
CaratteristicheAlcoli e fenoli possono formare legami idrogeno tra loro e con l’acqua in quanto il legame OH è polarizzato con parziale carica + sull’H e parziale carica – sull’O:
H O·····H O H O·····H O R R R H
Per questo motivo i punti di ebollizione degli alcoli sono molto più elevati di quelli dei corrispondenti idrocarburi con simile peso molecolare. All’aumentare della catena carboniosa, diminuisce la miscibilità in acqua e l’alcol diventa sempre più simile ad un idrocarburo.Alcoli e fenoli sono acidi deboli in quanto l’ossidrile è in grado di cedere il protone. Quando si allunga la catena di atomi di C e negli alcoli soggetti a ingombro sterico come l’alcol t-butilico, diminuisce l’acidità a causa appunto dell’ingombro sterico che rende difficile la solvatazione dei corrispondenti ioni alcossido.
25/10/14 18.47 Chimica parte 5 42/58
Eteri
● Formula generale: R-O-R', R e R' possono essere uguali o diversi● Gruppo funzionale: etere (-O-)● Nomenclatura
– Si assegnano prima i nomi dei gruppi alchilici o arilici messi in ordine alfabetico e si fa seguire la parola "etere"
– Negli eteri a struttura complessa si deve identificare il gruppo alcossile -O-R
– Nella nomenclatura IUPAC l'alcossile quando è di piccole dimensioni deve essere considerato come un sostituente.
– Es: CH3CH2OCH3 = etilmetiletere; CH3OCH3 = Metossimetano;
CH3CH CH2 CH2CH3 = 2-metossipentano;
OCH3
25/10/14 18.47 Chimica parte 5 43/58
Eteri
Proprietà:● Composti incolori, punti di ebollizione inferiori a quelli degli alcoli ad uguale numero di
atomi di C. Non possono associarsi con legami idrogeno, ma possono accettare un legame idrogeno dagli alcoli e dall'acqua.
● Gli eteri sono composti inerti, NON reagiscono con acidi, basi, agenti ossidanti o riducenti ed associano la loro inerzia alla capacità di disciogliere la maggior parte dei composti organici. Sono utili, quindi nelle estrazioni di composti organici, perché il loro basso punto di ebollizione ne rende facile l’allontanamento ed il recupero per distillazione.
Preparazione degli eteri:● Disidratazione di un alcol:
● CH3CH2OH + CH3CH2OH → CH3CH2OCH2CH3 La reazione avviene a 140°C con H2SO4
● In condizioni più energiche (180°C) non si ottiene più un etere, ma un alchene: CH2=CH2
25/10/14 18.47 Chimica parte 5 45/58
Aldeidi e chetoni
● Sono composti caratterizzati dal gruppo "carbonile" che rappresenta, forse, il più importante gruppo funzionale della chimica organica.
● Aldeidi: carbonile in posizione 1● Chetoni: carbonile in posizione intermedia
25/10/14 18.47 Chimica parte 5 46/58
Aldeidi
● Hanno almeno un H legato al carbonio carbonilico, quindi il gruppo aldeidico è CHO e la formula generale è R-CHO
● Nomenclatura:– Desinenza: -ale
– Nel caso di aldeidi sostituite, la numerazione parte dal carbonio aldeidico (CHO) che ha priorità sul doppio legame e sull'ossidrile non solo nella numerazione, ma anche per la desinenza
● HCHO = Metanale o formaldeide; CH3CHO = etanale o acetaldeide;
● CH3CH2 CHO = propanale o aldeide propionica
25/10/14 18.47 Chimica parte 5 47/58
Chetoni
● Il C del carbonile è legato ad altri 2 atomi di Carbonio, quindi il gruppo chetonico è C=O
● Nomenclatura:– Desinenza: -one
– La numerazione parte in modo da assegnare al carbonio carbonilico la numerazione più bassa
– Se sono presenti più gruppi funzionali si deve rispettare l'ordine di precedenza specificato a pag. 30
– Se in presenza di gruppi a priorità maggiore si può indicare come ramificazione usando il prefisso -oxo
25/10/14 18.47 Chimica parte 5 48/58
Aldeidi e chetoni - caratteristiche
● Preparazione: – Aldeidi e chetoni si preparano per ossidazione di alcol: da un alcol primario si
ottengono aldeidi, da un alcol secondario si ottengono chetoni.
● Caratteristiche– Sono composti molto presenti in natura, gran parte di essi ha aromi e profumi
gradevoli che ne hanno consentito l’impiego in cosmetica.
– L'Ossigeno è molto elettronegativo e conferisce una polarità al legame >C=O
– La polarizzazione del carbonile influenza la solubilità di aldeidi e chetoni, ed infatti i composti a basso peso molecolare, pur non potendo fare legami idrogeno tra loro, possono accettare legami idrogeno da altri gruppi contenenti i gruppi OH o NH.
– Il punto di ebollizione è superiore a quello degli alcani, ma inferiore a quello degli alcoli, in quanto le molecole dei composti carbonilici hanno la tendenza ad associarsi da un punto di vista elettrostatico, ma non possono formare tra loro legami idrogeno.
25/10/14 18.47 Chimica parte 5 49/58
Acidi carbossilici
● Caratterizzati dal gruppo carbossilico, ovvero un gruppo carbonilico legato ad un ossidrile● Nomenclatura:
– Desinenza: -oico premettendo la parola "acido" per gli acidi monocarbossilici
– Desinenza: -dioico premettendo la parola "acido" per gli acidi dicarbossilici
– Ai fini della nomenclatura il carbossile ha priorità sui tutti gli altri gruppi
– Sono diversi i nomi comuni degli acidi carbossilici fino a 10 atomi di C e derivano, in genere dalla fonte dalla quale si ottiene l'acido (ad es.: acido butirrico: 4 atomi di C - burro; acido capronico, caprilico e caprinico: rispettivamente 6, 8 e 10 atomi di C – capre)
● Numerazione:– Nella nomenclatura IUPAC il carbonio del carbossile è il C1 e la numerazione avviene come per gli
alcani.
– Nella nomenclatura comune, si assegnano lettere greche progressive al primo C che segue quello carbossilico.
– Il carbossile ha la priorità sugli altri gruppi funzionali, quindi nel caso vi sia un gruppo chetonico, questi viene considerato un sostituente e si usa il prefisso -oxo.
25/10/14 18.47 Chimica parte 5 51/58
Acidi carbossilici - caratteristiche
● Proprietà fisiche e chimiche:– I primi tre della serie sono liquidi incolori dotati di odore pungente e spesso
sgradevole. Sono composti polari e, analogamente agli alcoli, possono formare legami idrogeno tra loro e con l'acqua. I loro punti di ebollizione, quindi, sono elevati e a parità di peso molecolare sono più elevati dei corrispondenti alcoli.
– Gli acidi carbossilici si dissociano in acqua dando luogo ad un anione carbossilato ed uno ione idronio:
CH3COOH + H2O CH3COO- + H3O+
– Analogamente ad alcoli e fenoli, gli acidi carbossilici si ionizzano perdendo un H dall'ossidrile, ma sono molto più acidi. La formazione di legami idrogeno spiega l’elevata solubilità in acqua degli acidi a basso numero di atomi di carbonio.
25/10/14 18.47 Chimica parte 5 52/58
Esteri
● Derivano per sostituzione del gruppo ossidrilico del carbossile con un gruppo O-R.
● Nomenclatura:
– Il nome è quello dell'acido corrispondente (ma con desinenza -ato), seguito da quello del radicale R del gruppo O-R (xxxato di yyyile).
– Esempio: acetato di metile
25/10/14 18.47 Chimica parte 5 53/58
Esteri - caratteristiche
● Sono sostanze dall'odore gradevole, responsabili dell'odore e del sapore di molti frutti (acetato di pentile = banane; acetato di ottile = arance; butirrato di etile = ananas).
25/10/14 18.47 Chimica parte 5 54/58
Ammidi
● Sono estremamente diffuse in natura e sono, tra i derivati degli acidi carbossilici, i composti meno reattivi. Le ammidi più importanti sono le proteine.
R-COOH + NH3 → R-COO-NH4+ → R-CONH2 + H2O
Acido + ammoniaca → sale di ammonio + calore → ammide primaria● Nomenclatura:
– Il nome è quello del composto che contiene il gruppo alchilico con desinenza "ammide"
– Qualora all'N siano legati gruppi alchilici, il nome è preceduto da "N-alchi-
– Le ammidi possono essere primarie, secondarie o terziarie a seconda di quanti gruppi sono legati all'atomo di azoto.
25/10/14 18.47 Chimica parte 5 55/58
Ammidi - caratteristiche
● Sono composti estremamente polari, in grado di formare forti legami idrogeno. I loro punti di ebollizione sono elevati in proporzione al loro peso molecolare.
25/10/14 18.47 Chimica parte 5 56/58
Ammine
● Derivati dell'ammoniaca (NH3) ottenuti per sostituzione di uno, due o tutti gli H della molecola con gruppi organici alchilici o arilici, rappresentano le più importanti basi organiche presenti in natura.
● Le ammine possono essere classificate come primarie, secondarie o terziarie a seconda che abbiano 1, 2 o 3 gruppi organici legati all'N.
● Nomenclatura:– Nomi dei gruppi alchilici o acrilici legati all'azoto, seguiti dal suffisso -ammina
CH3CH2CH2NH2 CH3CH2NH2 (CH3CH2)2NH (CH3CH2)3N
Propilammina etilammina dietilammina trietilammina
(Primaria) (Primaria) (Secondaria) (Terziaria)
– Secondo le regole IUPAC, il gruppo amminico -NH2 è considerato un sostituente e come tale viene trattato.
– Nelle ammine secondarie e terziarie, il prefisso è costituito dal nome dei gruppi alchilici legati all'N seguito dal nome della catena più lunga.
– Le ammine aromatiche vengono considerate derivati dell’anilina
– Se sono presenti altri gruppi funzionali, l’amminogruppo viene considerato sempre un sostituente e la numerazione parte, quindi, dal C più vicino al gruppo funzionale. Prefisso: -ammino-
25/10/14 18.47 Chimica parte 5 57/58
Ammine - caratteristiche
● Proprietà fisiche– Le ammine primarie e secondarie hanno punti di ebollizione
elevati a causa dei legami idrogeno intermolecolari, ma dal momento che il legame idrogeno delle ammine è meno forte di quello degli alcoli, i punti di ebollizione delle ammine sono meno elevati di quelli degli alcoli.
● Esempi