SEZIONE 13 - doctor33.it · hanno la funzione di indurire il capezzolo per facilitare la suzione da...
Transcript of SEZIONE 13 - doctor33.it · hanno la funzione di indurire il capezzolo per facilitare la suzione da...
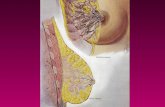
Tavola 13.1 Apparato genitale
284 ATLANTE DI ANATOMIA, FISIOPATOLOGIA E CLINICA
POSIZIONE E STRUTTURA
La tavola illustra la mammella in sezione parziale (nella parte supe-
riore) e in sezione sagittale (nella parte inferiore). La mammella ha
dimensioni variabili, ma nella maggior parte dei casi si estende
dalla 2ª alla 6ª costa e dallo sterno alla linea ascellare anteriore, con
una terminazione ascellare nelle porzioni esterna e superiore, pal-
pabile lungo il margine esterno del muscolo grande pettorale.
Il tessuto mammario è situato direttamente sopra il muscolo grande
pettorale ed è separato dalla fascia esterna di questo muscolo
mediante uno strato di tessuto adiposo che è continuo con lo stroma
adiposo della ghiandola stessa.
Alcuni depositi adiposi circondano gli elementi ghiandolari e sono
frammisti a essi, venendo a formare una parte signifi cativa della
struttura mammaria e contribuendo al volume e alla forma della
mammella. Il rapporto tra tessuto adiposo e tessuto ghiandolare
varia in base al soggetto e al periodo della vita: con la menopausa,
al diminuire del tessuto ghiandolare, la quantità relativa di tessuto
adiposo aumenta. Le mammelle sono irrorate da una fi tta rete va-
scolare e linfatica (trattata in seguito).
L’innervazione sensitiva della mammella segue la normale di-
stribuzione dei dermatomeri e deriva principalmente dai rami antero-
laterale e antero-mediale dei nervi toracici intercostali T 3 -T 5 . Inoltre,
i nervi sopraclavicolari afferenti dalle fi bre inferiori del plesso cer-
vicale innervano le porzioni superiore e laterale della mammella.
L’innervazione sensitiva del capezzolo proviene dal ramo cutaneo
laterale del T 4 .
Nella donna adulta, il centro della mammella completamente
sviluppata, a forma di cupola, è contrassegnato dall’areola mam-
maria, un’area circolare di cute pigmentata con un diametro tra 1,5
e 2,5 cm. La superficie dell’areola ha un aspetto ruvido per la
presenza di grosse ghiandole sebacee, in una certa misura modi-
fi cate, denominate ghiandole di Montgomery, che si trovano diret-
tamente sotto la cute, nel sottile strato di tessuto sottocutaneo. Si
ritiene che la secrezione adiposa di queste ghiandole lubrifi chi il
capezzolo. I fasci di muscolatura liscia presenti nel tessuto areolare
hanno la funzione di indurire il capezzolo per facilitare la suzione da
parte del neonato.
Il capezzolo, o papilla mammaria, si eleva di pochi millimetri sulla
mammella e contiene da 15 a 20 condotti lattiferi circondati da tes-
suto fi bro-muscolare e ricoperti di una cute rugosa. In parte all’interno
di questo compartimento del capezzolo e in parte sotto la sua base,
questi condotti si espandono per formare i brevi seni lattiferi, o ampolle,
dove si può depositare il latte. Queste ampolle sono la continuazione
dei condotti mammari, che si estendono radialmente dal capezzolo in
direzione della parete toracica e dai quali si diparte un numero va-
riabile di tubuli secondari, i quali terminano in masse epiteliali che
formano le strutture acinose o lobuli della ghiandola mammaria. Il
numero di tubuli e le dimensioni delle strutture acinose variano
enormemente in base alla persona e al periodo della vita. In generale,
i tubuli terminali e le strutture acinose sono più numerosi durante
l’età fertile e raggiungono il loro pieno sviluppo fi siologico solo du-
rante la gravidanza e l’allattamento. Nel loro insieme queste strutture
epiteliali costituiscono il parenchima della ghiandola. Lo stroma è
composto da un misto di tessuto adiposo e fi broso le cui quantità
relative, in assenza di gravidanza e lattazione, determinano le dimen-
sioni e la consistenza della mammella.
La fascia che avvolge la mammella si continua con la fascia pet-
torale, suddivide le ghiandole in lobuli e manda nella cute sovrastante
delle espansioni che, nell’emisfero superiore, sono note come i lega-
menti sospensori di Cooper. Poiché non sono tese, queste espansioni
consentono il movimento naturale del seno, ma con l’età determinano
la ptosi mammaria, a causa del rilassamento dovuto all’età.
Sezione antero-laterale
Muscolo grandepettorale(profondamentealla fasciapettorale)
Muscolo obliquo esterno
Fascia pettorale
Muscoli intercostali
Muscolo dentato anteriore
Clavicola
2a costa
Muscolo grande pettorale
Nervo e vasiintercostali
Polmone
6a costa
Lobuli ghiandolari
Seno lattifero
Condotto lattifero
Adipe (strato di tessutosottocutaneo)
Sezione sagittale
Legamenti sospensoridella mammella (di Cooper)
Lobulighiandolari
Adipe
Seno lattifero
Condotti lattiferi
CapezzoloAreola
Legamentisospensoridella mammella(di Cooper)
Ghiandoledell’areola
Coda ascellare(di Spence)
C0065.indd 284C0065.indd 284 2/9/12 6:17:14 PM2/9/12 6:17:14 PM
Tavola 13.2 Mammella
ATLANTE DI ANATOMIA, FISIOPATOLOGIA E CLINICA 285
IRRORAZIONE
L’abbondante apporto sanguigno della ghiandola mammaria deriva
dall’aorta toracica discendente, che emette le arterie intercostali
posteriori; dall’arteria succlavia, dalla quale ha origine l’arteria
mammaria interna; e dall’arteria ascellare, che irrora la ghiandola
mammaria mediante l’arteria toracica laterale e talvolta mediante
un altro ramo, l’arteria mammaria esterna. Un ulteriore apporto
ematico deriva dai rami provenienti dall’arteria toraco-dorsale e
dall’arteria toraco-acromiale, breve tronco che origina dalla parte
anteriore dell’arteria ascellare, con l’origine a cui in genere si so-
vrappone il margine superiore del muscolo piccolo pettorale.
I rami intercostali dell’arteria mammaria interna, la cui porzione
toracica si trova dietro la cartilagine delle prime sei coste, appena
fuori dallo strato parietale della pleura, irrorano la faccia mediale
della ghiandola mammaria. I rami cutanei laterali delle arterie inter-
costali aortiche 3 a , 4 a e 5 a entrano nella ghiandola lateralmente. I
rami cutanei laterali delle arterie intercostali penetrano nei muscoli
laterali del torace e poi si dividono in rami posteriori e anteriori, dei
quali solo i rami anteriori raggiungono la ghiandola mammaria. I
rami dell’arteria toracica laterale, che discendono lungo il margine
inferiore del muscolo piccolo pettorale, si avvicinano alla ghiandola
mammaria da dietro, nella regione del quadrante supero-esterno.
Uno di questi rami (nelle donne più sviluppato rispetto agli altri rami)
è l’arteria mammaria esterna, che gira intorno al margine del mu-
scolo grande pettorale e che potrebbe essere visibile nell’illustra-
zione se la mammella fosse sollevata. Tra l’arteria toracica laterale
e i vasi che derivano dall’arteria mammaria interna esiste una vasta
rete di anastomosi; questi vasi si anastomizzano anche con le arterie
intercostali, così che diverse parti della ghiandola sono irrorate da
due o addirittura tre delle fonti principali. Le ramifi cazioni di tutte e
tre le arterie principali formano un plesso circolare intorno all’areola,
che garantisce l’apporto ematico al capezzolo e all’areola. L’irrora-
zione della cute della mammella dipende dal plesso sottodermico,
che è in comunicazione con i vasi sottostanti più profondi che irro-
rano il parenchima mammario, dove un secondo plesso derivante
dagli stessi vasi principali si forma nelle regioni più profonde della
ghiandola.
Questa distribuzione vascolare si presenta in una serie di varia-
zioni, da tenere presente per evitare il pericolo di necrosi, per
esempio nelle incisioni circolari intorno al capezzolo. La fi tta rete di
vasi sanguigni che irrorano la mammella permette una varietà di
procedure chirurgiche, a scopo sia terapeutico sia estetico, utiliz-
zabili senza danno alla vitalità dei lembi di cute e del parenchima
mammario dopo l’intervento chirurgico. Questo vantaggio può di-
ventare uno svantaggio in quanto questa zona può diventare il punto
di partenza per la diffusione di infezioni o tumori maligni.
Le vene seguono il decorso delle arterie. Il drenaggio venoso
avviene principalmente tramite la vena ascellare, e in parte tramite
la vena toracica interna. La vena ascellare ha un’anatomia irregolare,
che complica gli interventi chirurgici sotto il braccio. Le vene super-
fi ciali circondano il capezzolo e trasportano il sangue nelle vene
intercostale, ascellare e mammaria interna, oltre che ai polmoni.
Queste connessioni possono permettere alle cellule tumorali della
mammella di diffondersi ai polmoni, tramite le vene di superfi cie, e
formare così metastasi tumorali. Le vene intercostali si uniscono a
una rete complessa di vene vertebrali che decorrono dentro e intorno
alla spina, fornendo al tumore un’ulteriore via di diffusione alle
ossa.
Le vene che drenano il parenchima mammario sono soggette,
come in altre aree del corpo, a infiammazione e trombosi, con
conseguente malattia di Mondor e trombofl ebite, rispettivamente.
Arteria succlavia
Arteria toracica internae relativi rami perforanti
Rami mammari mediali
Arteria ascellare
Plesso brachiale
Arteria brachiale
Arteria toracicalaterale e ramimammarilaterali
Coda ascellare(di Spence)
Rami mammarilaterali dei ramicutanei lateralidelle arterieintercostaliposteriori
C0065.indd 285C0065.indd 285 2/9/12 6:17:20 PM2/9/12 6:17:20 PM
Tavola 13.3 Apparato genitale
286 ATLANTE DI ANATOMIA, FISIOPATOLOGIA E CLINICA
DRENAGGIO LINFATICO
La distribuzione linfatica della mammella è complessa. La ghiandola
mammaria possiede una fi ttissima rete di vasi linfatici, suddivisa su
due piani: il plesso linfatico superfi ciale o sottoareolare e il plesso
profondo o fasciale. Entrambi originano negli spazi interlobulari e
nelle pareti dei condotti lattiferi. I linfonodi che drenano la mammella
non hanno andamento lineare retto ma presentano una disposizione
tortuosa, variabile e fi ssa, all’interno di cuscinetti adiposi. Questa
disposizione complica le operazioni di rimozione dei linfonodi durante
gli interventi chirurgici di rimozione del cancro della mammella.
Raccogliendo la linfa dalle parti centrali della ghiandola mam-
maria, dalla cute, dall’areola e dal capezzolo, la maggior parte del
plesso superfi ciale drena lateralmente verso l’ascella, passando
prima nel gruppo dei linfonodi pettorali anteriori, spesso denominati
gruppo dei linfonodi ascellari inferiori. I linfonodi pettorali anteriori,
da 4 a 6, si trovano lungo il margine dei muscoli pettorali adiacenti
all’arteria toracica laterale. Il drenaggio avviene quindi nei linfonodi
ascellari centrali, situati lungo la vena ascellare, o nei linfonodi
medio-ascellari, e da lì va ai linfonodi succlavi, posti all’apice del-
l’ascella, nel punto di giunzione tra la vena ascellare e la vena
succlavia. L’ascella contiene un numero di linfonodi variabile, in
genere tra 30 e 60 e circa il 75% del drenaggio linfatico della
mammella è diretto verso questi linfonodi regionali ascellari.
Il plesso linfatico profondo fasciale si estende, attraverso i mu-
scoli pettorali, verso i linfonodi di Rotter, situati sotto il muscolo
grande pettorale, e quindi ai linfonodi succlavi; questa via è nota
come percorso di Groszman. Il resto del plesso linfatico fasciale si
estende, per la maggior parte, medialmente lungo l’arteria mam-
maria interna, attraverso i linfonodi mammari interni, verso i linfonodi
mediastinici. Altre vie di drenaggio linfatico provengono dalle porzioni
inferiore e mediale della mammella. Una di queste è la via para-
mammaria di Gerota che, attraverso i vasi linfatici addominali, va al
fegato o ai linfonodi sottodiaframmatici. Un’altra è la via mammaria
crociata, che passa attraverso i vasi superfi ciali linfatici e va alla
mammella e all’ascella controlaterali. Talvolta, tramite questa via, si
verifi cano le metastasi da una mammella, attraverso la linea me-
diana, all’altra mammella o alla parete toracica. Dalla porzione
mediale inferiore della mammella drenano alcuni vasi linfatici del
gruppo fasciale, passando sotto lo sterno, in direzione dei linfonodi
mediastinici anteriori situati davanti all’aorta. Può inoltre esserci
il drenaggio linfatico alle ghiandole intercostali, situate posterior-
mente lungo la colonna vertebrale, e alle aree sottopettorale e
sottodiaframmatica.
I linfonodi svolgono un ruolo centrale nella diffusione del cancro
della mammella. I linfonodi ascellari sono particolarmente importanti,
in quanto sono tra i primi siti interessati da metastasi del cancro
della mammella. Spesso questo gruppo di linfonodi è defi nito “lin-
fonodi del livello I” (i linfonodi del livello II sono situati sotto il muscolo
piccolo pettorale e i linfonodi del livello III vicino al punto centrale
della clavicola). Altre vie di diffusione metastatica includono i vasi
linfatici adiacenti ai vasi mammari interni, che permettono la diffu-
sione diretta nel mediastino.
Il drenaggio linfatico in genere è diretto al gruppo di linfonodi più
vicino: questo fenomeno sta alla base del concetto di mappatura
dei linfonodi sentinella nel cancro della mammella. Nella maggior
parte dei casi, il cancro della mammella si diffonde in modo preve-
dibile, all’interno della catena dei linfonodi ascellari, sulla base della
posizione del tumore primario e dei linfonodi sentinella associati.
Tuttavia, le metastasi linfatiche provenienti da un’area specifi ca della
mammella si possono trovare in uno qualsiasi o in tutti i gruppi di
linfonodi regionali. Nonostante questa osservazione, l’idea di utiliz-
zare un linfonodo sentinella per individuare la diffusione del tumore
è comunque utile perché solo nel 3% di queste donne il linfonodo
positivo si verifi ca al di fuori dell’ascella.
Linfonodi parasternali
Linfonodi ascellari apicali (succlavi)
Linfonodi interpettorali (di Rotter)
Linfonodi ascellari centrali
Linfonodi ascellarilaterali (omerali)
Linfonodi ascellariposteriori (sottoscapolari)
Linfonodiascellarianteriori(pettorali)
Via per i linfonodimediastinicianteriori
Vie per la mammella controlaterale
Vie per i linfonodi frenici inferiori (sottodiaframmatici) e il fegato
C0065.indd 286C0065.indd 286 2/9/12 6:18:25 PM2/9/12 6:18:25 PM
Tavola 13.4 Mammella
ATLANTE DI ANATOMIA, FISIOPATOLOGIA E CLINICA 287
STADI DI SVILUPPO
Alla nascita, tutti i neonati, indipendentemente dal sesso, possiedono
ghiandole mammarie suffi cientemente sviluppate da apparire come
rilievi emisferici ben delineati, che al tatto si presentano come
morbide masse mobili. Questi rilievi sono particolarmente pronun-
ciati nei bambini nati post-termine. Dal punto di vista istologico,
sono facilmente riconoscibili diversi canali ramifi cati con strati di
cellule di rivestimento e tappi di cellule basali alle loro estremità,
rispettivamente i futuri condotti lattiferi e i lobuli ghiandolari. In un
gran numero di bambini si osserva un capezzolo sporgente all’ester-
no e in circa il 10% può essere palpata una ghiandola notevolmente
ingrossata, condizione che ha ricevuto l’infelice nome di mastite dei
neonati, nonostante l’assenza di segni di infi ammazione. Queste
prime strutture ghiandolari, a partire da 2 o 3 giorni dopo la nascita,
possono produrre una secrezione simile al latte, il cosiddetto “latte
di strega”. Tutti questi fenomeni neonatali della mammella, che sono
il risultato di processi di sviluppo molto intensi, derivanti dall’azione
degli estrogeni materni negli ultimi stadi della vita intrauterina, si
attenuano entro le prime 2-3 settimane di vita. È in questo periodo
che la mammella subisce marcati cambiamenti involutivi che por-
tano allo stadio quiescente, caratteristico dell’infanzia e della fan-
ciullezza. Durante questi periodi, le ghiandole mammarie maschili
e femminili sono formate da alcuni condotti rudimentali ramifi cati,
rivestiti da un epitelio appiattito circondato da tessuto connettivo
collageno.
Per la maggior parte delle ragazze, il primo segno della pubertà
è lo sviluppo mammario. Negli Stati Uniti, questi cambiamenti iniziali
della mammella iniziano a un’età media di 10,8 (±1,1) anni. Con
l’inizio della pubertà e durante l’adolescenza, la maturazione folli-
colare nelle ovaie, in risposta all’ormone follicolo-stimolante (FSH)
del lobo anteriore dell’ipofi si, è accompagnata da un aumento del
rilascio di estrogeni. In risposta a questo aumento, i condotti mam-
mari si allungano e il loro epitelio di rivestimento si duplica e prolifera
nelle terminazioni dei tubuli mammari, formando le gemme dei futuri
lobuli. Questa crescita dell’epitelio dei condotti è accompagnata
dalla crescita di un tessuto fi broso periduttale, che è in gran parte
responsabile dell’aumento di dimensioni e della saldezza della
ghiandola femminile dell’adolescente. Durante questo periodo,
crescono anche l’areola mammaria e il capezzolo e diventano
pigmentati.
Con la comparsa della maturità, ossia quando si verifi ca l’ovula-
zione e si formano i corpi lutei che secernono progesterone, si
verifi ca il secondo stadio dello sviluppo mammario, che è essen-
zialmente connesso alla formazione dei lobuli e delle strutture
acinose. Benché nella donna adulta il progesterone eserciti sempre
la sua infl uenza quando sono simultaneamente presenti gli estro-
geni, esistono delle prove sperimentali inconfutabili che indicano
che questo dispiegamento iniziale dei lobuli è un effetto specifi co
del progesterone. Ciò conferisce alla ghiandola mammaria la tipica
struttura lobulare riscontrabile durante il periodo della fertilità. Que-
sta differenziazione in ghiandola lobulare termina all’incirca un anno
o un anno e mezzo dopo la prima mestruazione, anche se vi è un
ulteriore sviluppo di acini, che prosegue in proporzione all’intensità
degli stimoli ormonali durante ciascun ciclo mestruale e special-
mente durante le gravidanze. La deposizione di adipe e la formazione
dello stroma fi broso contribuiscono ad aumentare le dimensioni
della ghiandola mammaria nel periodo dell’adolescenza.
La prevedibile sequenza dello sviluppo mammario che avviene
durante l’adolescenza costituisce una parte della scala della matu-
razione sessuale (scala di Tanner), utilizzata per determinare il grado
e la sequenza dello sviluppo puberale. Nel 1969, Marshall e Tanner
hanno defi nito cinque stadi di sviluppo mammario e di sviluppo dei
peli pubici denominati complessivamente stadi (da I a V) di Tanner
o puberali. Per gran parte delle ragazze, lo sviluppo delle mammelle
è il primo segno della pubertà e il menarca l’ultimo.
Infanzia Pubertà Maturità
Estrogeni
Progesterone
C0065.indd 287C0065.indd 287 2/9/12 6:18:31 PM2/9/12 6:18:31 PM
Tavola 13.5 Apparato genitale
288 ATLANTE DI ANATOMIA, FISIOPATOLOGIA E CLINICA
CAMBIAMENTI FUNZIONALI E LATTAZIONE
Le modifi che della secrezione degli ormoni dell’adenoipofi si e delle
ovaie sono fattori importanti nello sviluppo e nel funzionamento della
ghiandola mammaria. Gli ormoni follicolo-stimolante e luteinizzante
sono indispensabili per la produzione degli estrogeni e del proge-
sterone ovarici, che a loro volta controllano lo sviluppo della ghian-
dola mammaria. Questi ormoni sono necessari ma non suffi cienti a
preparare il seno per la lattazione.
La ghiandola mammaria di una donna non gravida non è ade-
guatamente preparata all’attività secretoria. Solo durante la gravi-
danza si verifi cano i cambiamenti che rendono possibile la produ-
zione di latte. Nel 1° trimestre di gravidanza, i tubuli terminali che
originano dai condotti mammari proliferano per fornire un numero
massimo di elementi epiteliali per la futura formazione degli acini.
Nel 2° trimestre, i tubuli terminali duplicati si raggruppano formando
grossi lobuli. I loro lumi cominciano a dilatarsi e le strutture acinose
così formate sono rivestite da un epitelio cubico; alcuni acini con-
tengono piccole quantità di secrezione di colostro. Nell’ultimo trime-
stre della gravidanza, gli acini formati nei primi mesi di gravidanza
si dilatano progressivamente. Gli alti livelli di estrogeni e proge-
sterone in circolo durante la gravidanza sono senza dubbio re-
sponsabili di questi mutamenti del seno.
Durante la gravidanza, con l’aumento dei livelli di estrogeni, si
verifi ca parallelamente un’ipertrofi a e un’iperplasia delle cellule
lattotrope dell’ipofi si. Un aumento della prolattina si verifi ca subito
dopo l’impianto, contemporaneamente all’aumento degli estrogeni
circolanti. I livelli circolanti di prolattina aumentano costantemente
durante tutta la gravidanza, con un picco di circa 200 ng/mL nel 3°
trimestre. Questo innalzamento dei livelli di prolattina avviene pa-
rallelamente all’aumento dei livelli di estrogeni circolanti in questo
periodo. Nonostante livelli di prolattina così elevati, la lattazione non
si verifi ca perché gli estrogeni inibiscono l’azione della prolattina
sulla mammella (probabilmente bloccando l’interazione con il re-
cettore della prolattina).
Dopo il parto inizia un’attiva secrezione nelle strutture acinose,
ora massimamente dilatate, in conseguenza della stimolazione da
parte della prolattina secreta dal lobo anteriore dell’ipofi si e dell’al-
lattamento del neonato. Uno o due giorni dopo l’espulsione della
placenta, i livelli sia di estrogeni sia di prolattina subiscono un rapido
calo e inizia la lattazione. Nelle donne che non allattano, i livelli di
prolattina raggiungono concentrazioni basali dopo 2-3 settimane,
mentre nelle donne che allattano i livelli di prolattina raggiungono i
valori precedenti la gravidanza entro 6 mesi dal parto; ogni volta
che si verifi ca l’atto della suzione, la prolattina subisce un aumento
marcato.
La lattazione, che inizia 3-4 giorni dopo il parto, una volta iniziata
è stimolata e mantenuta attraverso l’atto meccanico della suzione.
Oltre a fornire un impulso alla prolattina, la stimolazione dell’areola
provoca la secrezione dell’ossitocina, responsabile dell’emissione
del latte e della contrazione dei condotti che espellono il latte. È
quindi grazie a questi meccanismi di feedback che la suzione assi-
cura la produzione di latte.
Non è stata dimostrata un’infl uenza della prolattina sui cambia-
menti micro- e macroscopici che si verificano nella ghiandola
mammaria. La sua unica funzione è stimolare la secrezione di latte
dopo che i tessuti sono stati precedentemente preparati adeguata-
mente (dagli estrogeni e dal progesterone). Durante un allattamento
frequente, la maturazione follicolare e l’ovulazione sono inibite per
circa 6 mesi.
La secrezione di latte vero avviene nel rivestimento epiteliale degli
acini dilatati da parte di cellule cubiche o cilindriche, con i nuclei
alla base o all’estremità. Questo epitelio poggia su una sottile striscia
di tessuto connettivo contenente capillari dalle pareti sottili. I globuli
secreti e le cellule epiteliali desquamate distendono gli acini e i loro
canali afferenti. Durante il periodo dell’allattamento, da 1 / 5 a 1 / 3
del volume della mammella è dovuto alla secrezione e all’accumulo
di latte.
Nelle donne non gravide la stimolazione del capezzolo e della
mammella può inoltre aumentare i livelli di prolattina. I livelli di
prolattina normalmente si innalzano in seguito al pranzo e possono
aumentare in risposta all’esercizio fi sico, al sonno e allo stress. Per
questi motivi, i livelli di prolattina in genere subiscono delle fl uttua-
zioni nell’arco della giornata, con livelli massimi durante il riposo
notturno e nel primo pomeriggio.
AllattamentoGravidanza
C0065.indd 288C0065.indd 288 2/9/12 6:18:37 PM2/9/12 6:18:37 PM
Tavola 13.6 Mammella
ATLANTE DI ANATOMIA, FISIOPATOLOGIA E CLINICA 289
POLITELIA, POLIMASTIA, IPERTROFIA
Anomalie congenite della mammella come l’agenesia o l’amastia,
l’aplasia, o l’assenza del capezzolo e/o dell’areola sono estrema-
mente rare (l’atelia, o amastia, è talvolta associata alla sindrome di
Poland, che consiste nell’assenza dei muscoli della parete toracica
e delle coste da 2 a 5 e in malformazioni delle mani o delle vertebre).
Più di frequente si registrano casi di aumento del numero delle
mammelle e dei capezzoli. Entrambe queste condizioni trovano
un’immediata spiegazione nello sviluppo embrionale delle mammelle
stesse. Dalla 6ª alla 12ª settimana di gestazione, le ghiandole
mammarie si sviluppano innanzitutto come un’estrofl essione verso
il basso dell’epidermide che si estende nel mesenchima dall’ascella
alle regioni inguinali, le creste mammarie. In seguito, queste spor-
genze scompaiono, tranne nell’area pettorale in cui si sviluppano le
normali mammelle.
I capezzoli accessori o soprannumerari (politelia) si verifi cano in
circa l’1% degli uomini e il 2% delle donne. Si tratta di casi spora-
dici; anche se vi è una familiarità, condizione questa estremamente
rara. Molti capezzoli soprannumerari assomigliano a un nevo o a
una macchia congenita e sono riconoscibili solo per la loro posizione
anatomica. I capezzoli soprannumerari si trovano più spesso 5 o
6 cm al di sotto dei capezzoli normali e verso la linea mediana; essi
in genere non sono caratterizzati da grandi quantità di parenchima
mammario sottostante. I capezzoli accessori senza parenchima
mammario accessorio si riscontrano in qualsiasi punto lungo le
creste mammarie embrionali, che nell’adulto si estendono dal-
l’ascella alle regioni inguinali. La cresta mammaria (detta anche
linea del latte) decorre medialmente al capezzolo normale nelle
regioni sottostanti alla mammella e lateralmente, in direzione di
ciascuna ascella, sopra la mammella. Le ghiandole mammarie
soprannumerarie (polimastia) situate lateralmente sono più inclini
a essere di grandi dimensioni e a presentare una normale lattazione
rispetto a quelle situate medialmente. Durante la gravidanza pos-
sono svilupparsi mammelle ascellari bilaterali di piccole dimensioni
con produzione di secrezione lattea. Questo fenomeno si verifi ca
all’incirca nell’1-2% delle donne europee e nel 5-6% di quelle
asiatiche. Il parenchima mammario accessorio è stato classifi cato
in otto livelli di completezza, da una semplice chiazza di peli a una
mammella in miniatura con produzione di latte. Questa classifi ca-
zione si basa sulla presenza di tessuto ghiandolare e adiposo, un
capezzolo, un’areola oppure ciuffi di peli.
Un parenchima mammario aberrante nell’ascella, senza forma-
zione di capezzolo, è più incline a una trasformazione maligna ri-
spetto a quello di una mammella in soprannumero, nel quale la
frequenza di episodi tumorali è apparentemente la stessa di quella
di una mammella normale. Sia nel parenchima aberrante sia in
quello soprannumerario possono verifi carsi tumori benigni o maligni.
Un articolo del 2000 dell’ American Journal of Cardiology ha po-
stulato una possibile correlazione con il prolasso della valvola
mitrale.
L’ipertrofi a mammaria è un’anomalia comune della mammella e
colpisce entrambi i sessi. Nelle donne, le forme principali di ipertrofi a
mammaria sono l’ipertrofi a precoce o infantile e l’ipertrofi a verginale
o gravidica, che si verifi cano rispettivamente nell’adolescenza o
durante la gravidanza. L’ipertrofi a mammaria precoce è associata
a disturbi endocrini dell’ovaio; è simmetrica bilateralmente e rara-
mente di grado marcato. L’ipertrofi a verginale e quella gravidica
sono di origine sconosciuta e possono essere bilaterali o unilaterali,
con la mammella interessata che può raggiungere dimensioni
enormi. Le mammelle ingrossate sono composte da grandi quantità
di stroma fi broso con dotti ipertrofi ci, talvolta associati a una for-
mazione lobulare. L’ingrossamento, una volta verifi catosi, permane.
Quando si verifi ca nelle adolescenti, questo tipo di ipertrofi a può
infl uire profondamente sulla percezione della propria immagine e
sullo sviluppo sociale. L’unico trattamento effi cace è la mastoplastica
riduttiva.
Un certo grado di asimmetria nello sviluppo del seno è comune
e interessa circa il 3% delle pazienti, che presenta asimmetrie vo-
lumetriche relative alla mammella controlaterale. Questa asimmetria
rappresenta una variazione normale e benigna, tranne in caso di
presenza di un’anomalia palpabile associata.
PolimastiaLinee del latte
Politelia
Ipertrofia verginale
C0065.indd 289C0065.indd 289 2/9/12 6:18:42 PM2/9/12 6:18:42 PM
Tavola 13.7 Apparato genitale
290 ATLANTE DI ANATOMIA, FISIOPATOLOGIA E CLINICA
GINECOMASTIA
Normalmente, durante l’adolescenza, nelle mammelle maschili si
riscontra un certo grado di ipertrofi a mammaria. Nei 2 / 3 dei ragazzi
tra i 14 e i 17 anni, è palpabile sotto il capezzolo una placca a forma
di bottone di tessuto mammario, noto come nodo della pubertà.
Benché sia in genere bilaterale, la ginecomastia può essere anche
unilaterale e normalmente regredisce prima dei 21 anni. Di rado
questa crescita di parenchima può essere 2-3 volte la sua dimen-
sione normale e perdurare nel tempo. Talvolta tale ingrossamento
è così netto e compatto che è stato classifi cato come fi broadenoma
benigno. La deposizione di tessuto adiposo senza proliferazione
ghiandolare è denominata pseudoginecomastia.
La ginecomastia si verifi ca più di frequente nei neonati, negli
adolescenti e negli anziani di sesso maschile. Alla palpazione, la
ghiandola mammaria ingrossata può apparire come un aumento
sia del parenchima mammario sia del tessuto adiposo e avere
l’aspetto di un normale seno femminile. Spesso si avverte una
massa distinta e compatta, costituita microscopicamente da una
notevole quantità di tessuto connettivo periduttale, che circonda i
condotti mammari contenenti un epitelio iperplastico.
La crescita delle ghiandole mammarie durante l’adolescenza si
spiega con i cambiamenti dell’ambiente endocrino caratteristico di
questa età. La ginecomastia in genere deriva da un’alterazione
dell’equilibrio estrogeni/androgeni, in favore degli estrogeni (stimo-
lazione) sugli androgeni (inibizione), o da un aumento della sensibilità
della mammella al normale livello di estrogeni circolanti. Gli estro-
geni inducono l’iperplasia epiteliale duttale, l’allungamento e la
ramifi cazione dei condotti, la proliferazione dei fi broblasti periduttali
e un aumento della vascolarità, come accade nelle mammelle
femminili: in seguito all’esposizione agli estrogeni, il quadro istolo-
gico è simile nelle donne e negli uomini. Le cellule di Leydig dei
testicoli, a lungo ritenute fonte esclusivamente degli androgeni,
secernono anche estrogeni. Gran parte della produzione di estrogeni
nei maschi proviene dalla conversione periferica di androgeni (testo-
sterone e androstenedione in estradiolo ed estrone, rispettivamente)
attraverso l’azione dell’aromatasi, principalmente nei muscoli, nella
cute e nel tessuto adiposo. Per questo motivo, rispetto agli adole-
scenti normopeso, gli adolescenti in sovrappeso hanno maggiori
probabilità di andare incontro a questi cambiamenti o di subire
cambiamenti più marcati. La prevalenza complessiva della gineco-
mastia adolescenziale varia tra il 4 e il 69%.
La ginecomastia nella tarda adolescenza e nell’adulto è in molti
casi associata a disturbi endocrini che determinano un eccesso di
estrogeni o una riduzione di androgeni. Qualsiasi disturbo endocrino
che abbia come conseguenza l’ipogonadismo, sia esso primario,
come la sindrome di Klinefelter (46, XXY), o secondario, come
l’ipopituitarismo dovuto ad adenoma ipofi sario non secernente, può
causare ginecomastia. Altre cause includono le neoplasie surrenali-
che testicolari e femminilizzanti. Anche l’ipertiroidismo è associato
a ginecomastia, che si ritiene essere correlata a una relativa ridu-
zione del testosterone libero circolante dovuto a un aumento stimo-
lato dalla tiroide della globulina legante gli ormoni sessuali, oltre a
un aumento dell’aromatizzazione periferica. Le cause genetiche di
ginecomastia includono le forme complete e incomplete di insen-
sibilità, oltre ad alcuni tipi di iperplasia surrenalica congenita.
La ginecomastia nei maschi adulti è spesso multifattoriale. Un
aumento dell’aromatizzazione periferica di testosterone a estradiolo
e la diminuzione graduale della produzione di testosterone nei te-
sticoli dell’uomo in età avanzata probabilmente contribuiscono alla
ginecomastia negli anziani. Vi sono diversi farmaci che possono
produrre ginecomastia, tra cui ormoni sintetici ad attività simil-
estrogenica, alcuni antibiotici come il metronidazolo, antipertensivi
come lo spironolattone, farmaci antiulcera come la ranitidina e
psicofarmaci come le fenotiazine. Anche l’alcol specialmente se ha
causato una cirrosi, la marijuana, il metadone e le anfetamine sono
stati associati a ginecomastia.
Piuttosto frequentemente, la ginecomastia si riscontra nei pazienti
con tumori testicolari (specialmente corioepitelioma, ma anche
teratomi e tumori delle cellule interstiziali). L’insuffi cienza testicolare
in tutte le sue forme può essere accompagnata da vari gradi di
ginecomastia. L’ipertrofi a mammaria è stata originariamente de-
scritta come parte integrante della sindrome di Klinefelter. Quando
il processo di ialinizzazione dell’apparato tubolare dei testicoli in
questa condizione inizia nella tarda pubertà, la ginecomastia diviene
un fenomeno frequente ma non obbligatorio.
Una semplice mastectomia eseguita tramite un’incisione
curva, seguendo il margine dell’areola, rimane il trattamento più
soddisfacente.
Fibroadenoma di una mammella
Forma fibroadenomatosa di ginecomastianell’adulto
Epitelio dei condotti iperplastici e stromaperiduttale della ginecomastia prepuberale
Ginecomastia vera (femminilizzazione)
C0065.indd 290C0065.indd 290 2/9/12 6:18:47 PM2/9/12 6:18:47 PM
Tavola 13.8 Mammella
ATLANTE DI ANATOMIA, FISIOPATOLOGIA E CLINICA 291
CONGESTIONE DOLOROSA E MASTITE PUERPERALE
La congestione dolorosa della mammella è causata da una stasi
vascolare e linfatica e generalmente si verifi ca dal 3° al 4° giorno
dopo il parto, prima della comparsa della lattazione; può inoltre
verifi carsi quando l’allattamento, una volta avviato, viene interrotto.
I seni sono pesanti, dolorosi, caldi, duri e dolenti alla palpazione,
con prolungamenti ascellari prominenti (coda di Spence, porzione
della ghiandola mammaria che si estende lungo il margine infero-
laterale del muscolo grande pettorale verso l’ascella). L’innalzamento
della temperatura di rado è superiore a 1 °C. La cute sovrastante
può essere edematosa e il capezzolo è così appiattito da impedire
la suzione da parte del bambino. Il tiraggio del latte o la spremitura
manuale possono aiutare a ridurre la congestione, consentendo al
bambino di afferrare il capezzolo e nutrirsi. Il grado di congestione
generalmente si riduce con ciascun figlio; le primipare spesso
presentano una congestione maggiore rispetto alle donne che al-
lattano il loro secondo fi glio (o i successivi). Nei casi in cui l’allatta-
mento viene interrotto, il seno deve essere strettamente fasciato e
si deve ricorrere a impacchi di ghiaccio e ad analgesici per alleviare
il dolore.
La prevenzione della mastite infettiva consiste nel porre atten-
zione a lavare accuratamente le mani (e qualsiasi altro strumento
utilizzato) prima dell’allattamento o della manipolazione del seno.
Inoltre, anche i capezzoli e il viso del bambino devono essere puliti
prima di procedere con l’allattamento.
La mastite acuta si verifi ca più frequentemente durante i primi
4 mesi di allattamento e negli Stati Uniti essa colpisce circa il 10%
delle madri che allattano; la metà dei casi è costituita da madri che
allattano per la prima volta. La via d’accesso dei microrganismi
infettivi è in genere un capezzolo traumatizzato o con ragadi, che
permettono il passaggio di germi dal naso e dalla bocca del bambino
alla madre. I segni che accompagnano l’insorgenza della mastite
acuta sono febbre, leucocitosi, dolore unilaterale e una zona di in-
durimento. In alcuni casi l’infezione avanza piuttosto rapidamente
e la temperatura corporea può innalzarsi fino a raggiungere i
40,5-41 °C. In questi casi la suppurazione di solito comincia entro
48 ore. La formazione di ascessi può essere in genere evitata se
viene prontamente iniziata una terapia antibiotica. Nella maggior
parte dei casi l’allattamento deve essere interrotto. Una fasciatura
stretta unitamente all’applicazione di impacchi di ghiaccio a scopo
analgesico possono migliorare i sintomi. Nei casi in suppurazione,
una terapia con dicloxacillina bloccherà l’infezione, ma qualsiasi
ascesso formatosi dovrebbe essere svuotato. La scelta dell’antibio-
tico deve essere modifi cata in base all’anamnesi della paziente, alle
allergie (se presenti), e alla prevalenza di Staphylococcus aureus
resistente alla meticillina. Ciprofl oxacina, clindamicina e trimetropi-
ma/sulfametoxazolo sono spesso effi caci contro lo S. aureus resi-
stente alla meticillina. Tuttavia, il trimetropima/sulfametoxazolo deve
essere evitato nei primi due mesi di allattamento.
In base alla sede sono stati distinti tre tipi di mastite: la sottoa-
reolare, la ghiandolare e l’interstiziale. Nel tipo di infezione sottoa-
reolare, l’ascesso, quando si forma, è confi nato all’area appena sotto
il capezzolo. Nella forma ghiandolare vi è il coinvolgimento di uno o
più lobi e l’ascesso può rompersi spontaneamente, dando origine a
un tratto fistoloso. Nel tipo interstiziale sono coinvolti il tessuto
adiposo e quello connettivo, che danno origine a un ascesso re-
tromammario sopra la fascia pettorale, come mostrato nell’illu-
strazione. Una volta che si sono sviluppati i segni di una suppura-
zione, si dovrebbe cercare di localizzare l’ascesso con applicazioni
calde, per poi inciderlo e drenarlo. In certi casi una mastite cronica
segue uno stato acuto. Tutti i sintomi e i segni di mastite acuta pos-
sono proseguire per settimane e mesi, anche se in forma più leggera.
La terapia della forma cronica è la stessa di quella acuta.
Raramente, la mastite si verifi ca nelle donne che non hanno
partorito da poco e nelle donne in menopausa. Poiché il carcinoma
infi ammatorio della mammella presenta sintomi molto simili a quelli
della mastite, si deve considerare la possibilità che dietro a un
ascesso si celi un carcinoma.
Congestione dolorosa
Sottocutanea
Mastite acuta
Sottoareolare
Sedi di ascessi della mammella
Ghiandolare (intramammaria)
Retromammaria
Sottotipi di mastite
C0065.indd 291C0065.indd 291 2/9/12 6:18:54 PM2/9/12 6:18:54 PM
Tavola 13.9 Apparato genitale
292 ATLANTE DI ANATOMIA, FISIOPATOLOGIA E CLINICA
GALATTORREA
La galattorrea è la secrezione mammaria bilaterale spontanea di un
liquido di aspetto simile al latte (molte donne, specialmente quelle
che hanno partorito, possono avere piccole perdite di liquido latti-
ginoso da uno o entrambi i capezzoli, e ciò è considerato normale).
La galattorrea è poco comune ma il numero di casi varia tra l’1 e il
30%, in base alla popolazione studiata. Anche se non è intrinseca-
mente pericolosa, la galattorrea può essere il primo sintomo
precursore di disturbi fi siopatologici sottostanti che, in quanto tali,
meritano un’attenta valutazione.
Poiché la galattorrea rappresenta un sintomo, una stessa pre-
sentazione clinica può avere cause multiple. L’adenoma ipofi sario
o l’ipotiroidismo possono determinare livelli di prolattina elevati, in
grado di stimolare il parenchima mammario, causando la secrezione
di latte. La galattorrea può inoltre essere un effetto collaterale di
agenti farmacologici. Più di frequente si manifesta con i farmaci che
infl uiscono sulla produzione di dopamina o serotonina o sul meta-
bolismo (alcuni alimenti consumati in eccesso possono creare tale
situazione, in particolare la liquirizia). Alcune malattie autoimmuni
(sarcoidosi, lupus) o la sindrome di Cushing possono determinare
questi sintomi. Le irritazioni croniche della parete toracica quali
herpes zoster, la stimolazione mammaria o irritazioni della mammella
possono attivare le vie nervose normalmente associate alla produ-
zione fisiologica di latte. La stimolazione cronica di queste vie
nervose può determinare galattorrea. I mutamenti fi siologici che
avvengono durante la gravidanza o dopo il parto e/o l’allattamento
possono portare a persistente secrezione di latte. Gran parte
dei processi patologici che conducono alla galattorrea determi-
nano un innalzamento dei livelli sierici di prolattina. Ciò può essere
utile nel valutare la fonte dei sintomi e la minaccia che essi
rappresentano.
Alla presentazione, la galattorrea è spesso accompagnata da altri
disturbi o condizioni: 1 / 3 delle pazienti con livelli di prolattina elevati
sperimenta amenorrea e infertilità. Un’amenorrea ipogonadica
prolungata derivante da iperprolattinemia è associata a un aumento
del rischio di osteoporosi, alterazioni atrofi che a carico della vagina
e degli organi genitali, dispareunia e disfunzioni della libido.
La valutazione della paziente con galattorrea è in parte dettata
da qualsiasi sintomo associato indicativo di un processo sottostante.
In assenza di altri sintomi, il processo di valutazione inizia con la
misurazione dei livelli sierici di prolattina (in assenza di mestruazioni
deve sempre essere considerata la possibilità di una gravidanza in
atto). La prolattina deve essere misurata a digiuno e a riposo, perché
il cibo e lo stress possono aumentarne i livelli. Livelli elevati di
prolattina sierica indicano la necessità di una valutazione radiologica
dell’ipofi si. L’approccio preferenziale è la tomografi a computeriz-
zata o la risonanza magnetica della sella turcica. Purtroppo, vi è una
scarsa correlazione tra i livelli sierici di prolattina e le dimensioni
della lesione ipofi saria. Un esame dei campi visivi può essere indi-
cato in presenza di macroadenoma ( ≥ 10 mm).
Quando i livelli di prolattina sono bassi e la diagnostica per im-
magini della sella turcica è normale, può essere suffi ciente la sem-
plice osservazione. Se si decide per l’osservazione, devono essere
eseguite delle valutazioni periodiche per controllare l’eventuale
comparsa di tumori a crescita lenta. Il trattamento con bromocriptina
è raccomandato per le pazienti che desiderano una gravidanza, che
presentano gradi di galattorrea che provocano disturbi, o che hanno
macroadenomi. Purtroppo, la terapia medica può essere associata
a nausea, ipotensione ortostatica, sonnolenza o sincope, iperten-
sione o attacchi epilettici, e la terapia con bromocriptina può inte-
ragire con le fenotiazine o con i butirrofenoni.
La terapia medica è in genere effi cace nelle pazienti con iper-
prolattinemia. I livelli di prolattina devono essere misurati ogni 6-
12 mesi e i campi visivi rivalutati annualmente. L’ipofi si deve essere
riesaminata ogni 2-5 anni, in base alla diagnosi iniziale. Quando la
terapia medica viene sospesa, i sintomi possono ripresentarsi.
I tumori a rapida crescita, i tumori di grosse dimensioni al mo-
mento della diagnosi o i tumori che non rispondono alla terapia con
bromocriptina possono richiedere un intervento chirurgico o la ra-
dioterapia. Spesso l’intervento chirurgico può essere eseguito tra-
mite la via di accesso transfenoidale. Il trattamento chirurgico può
determinare la perdita completa della funzione ipofi saria e richiede
una sostituzione e un monitoraggio attenti di altri sistemi endocrini,
compresi quello tiroideo e quello surrenalico.
Suzione prolungata(o manipolazione)
Malattia fibro-cistica benignadellamammella
Herpes zoster
Interventichirurgicial torace
Somministrazione di tranquillanti (raramente)
FSH = ormone follicolo-stimolante; STH = ormone somatotropo
Psicosi
Acromegalia
Carenzadi FSH
Carenzadi estrogeni
Amenorrea
STHProlattina
Sindromedi Chiari-Frommel;allattamentoprolungatoe amenorreapost-gravidanza
Sindromedi Ahumada-del Castillo;allattamentosenza precedentegravidanzao acromegalia
Influenze endocrinenella lattazione
normale
Nervi afferenti dal capezzolo
Stimolazione ipotalamicaattraverso le vie sensitive
Tumore o disfunzionedell’ipofisi
Disturbo della funzione ipotalamicaDisturbi cortico-surrenalici od ovarici
surrenaliciCorticoidi
Estrogeni
Ossitocina
Progesterone
STH
Prolattina
C0065.indd 292C0065.indd 292 2/9/12 6:19:01 PM2/9/12 6:19:01 PM
Tavola 13.10 Mammella
ATLANTE DI ANATOMIA, FISIOPATOLOGIA E CLINICA 293
MALATTIA DI MONDOR
La malattia di Mondor, o angioite superfi ciale, è una trombofl ebite
superficiale della mammella, che prende il nome dal chirurgo
francese Henri Mondor (1885-1962), che descrisse per primo la
malattia nel 1939. Si tratta di un’entità clinica molto rara, che può
manifestarsi verso la fi ne del periodo riproduttivo o nei primi anni
della menopausa. L’età predominante delle pazienti con la malattia
di Mondor è tra i 30 e i 60 anni. Questa malattia non deve essere
confusa con la sindrome di Paget-Schroetter, che si riferisce a una
trombosi venosa profonda delle vene degli arti superiori, compresa
la vena ascellare o succlavia, che si verifi ca, nella maggior parte dei
casi, in seguito a un’intensa attività fi sica (anche se può manifestarsi
spontaneamente).
Anche se può verifi carsi spontaneamente, la fl ebite della mam-
mella è per lo più correlata a una gravidanza, un trauma o una
procedura operatoria recenti e spesso coinvolge le vene toraco-
epigastriche della mammella e le vene toraciche laterali. Raramente,
la malattia di Mondor si può presentare in seguito a un intervento
di mastoplastica additiva, manifestandosi in forma di cordoncini
temporanei che si estendono dalla regione sotto la mammella in
direzione dell’addome. Tale complicanza si verifi ca in meno del 2%
delle pazienti. In queste pazienti, i cordoncini appaiono a circa 3-6
settimane dall’intervento, durano qualche mese e poi generalmente
scompaiono.
La trombofl ebite delle vene della mammella di solito si presenta
con sintomi di dolore acuto e generalmente localizzato nel quadrante
supero-esterno della mammella. All’esame obiettivo sono osservabili
una fossetta cutanea o una cordicella distinta con margini eritema-
tosi. Inoltre, si può osservare un solco poco profondo che si estende
verso l’alto in direzione dell’ascella quando il braccio è alzato.
Anche se tipici della malattia di Mondor, questi sintomi devono
essere differenziati da quelli dell’ascesso mammario o della mastite,
dell’ectasia duttale, del carcinoma o della steatonecrosi. La malattia
di Mondor può essere distinta dal carcinoma infi ammatorio della
mammella dalla presenza di dolore improvviso, formazione precoce
di aderenze e miglioramento progressivo, caratteristiche non pre-
senti in questo tipo di cancro. Le cicatrici derivanti da interventi
chirurgici precedenti (biopsia, aumento o riduzione del seno) pos-
sono causare un ispessimento o una retrazione della cute sovra-
stante, similmente a quanto si osserva nella malattia di Mondor;
tuttavia, con un’attenta anamnesi, è possibile distinguere precoce-
mente i due quadri.
La malattia di Mondor è in genere diagnosticata tramite l’anam-
nesi e l’esame obiettivo. All’esame obiettivo, sono osservabili
un’accentuazione della fossetta o la formazione di un solco sulla
vena interessata. Spesso ciò si verifi ca quando il braccio omolaterale
viene sollevato durante l’esame obiettivo. La mammografi a può
rendersi necessaria per escludere altri processi, ma generalmente
la diagnosi è posta tramite l’esame obiettivo e l’anamnesi (alla
mammografi a, sono visibili una vena sottocutanea a “corona di
rosario” e una retrazione cutanea; raramente, le vene calcifi cano).
All’ecografi a, è osservabile una struttura tubulare ipoecogena corri-
spondente alla vena interessata dalla trombosi. In casi rari, per porre
la diagnosi può essere necessaria una biopsia.
La malattia di Mondor è benigna e autolimitante. Il trattamento
della trombofl ebite superfi ciale della mammella è generalmente di
supporto: gli analgesici e il calore riducono i sintomi. La condizione
solitamente si risolve da sola nel giro di 2-3 settimane, ma prima
di una risoluzione completa possono trascorrere anche 6 settimane.
Anche se non vi sono restrizioni in termini di attività fi sica, un buon
sostegno meccanico costituito da un reggiseno o una fascia adatti
migliorano il comfort durante un’attività fi sica intensa. Gli antibiotici
e gli anticoagulanti hanno uno scarso effetto sul decorso della
malattia e non sono indicati.
È stata inoltre descritta la trombosi della vena sottocutanea del
pene (malattia di Mondor del pene); essa è caratterizzata da un’in-
sorgenza rapida e si presenta come un indurimento quasi indolore
della superfi cie dorsale del pene. La sua patogenesi è ignota.
La malattia di Mondor derivada una tromboflebite delle venetoraco-epigastriche
I segni tipici includono dolore della venainteressata, eritema e presenzadi una “fossetta”
Alla palpazione la vena può appariresimile a un cordoncino
Il sollevamento del braccio produceuno stiramento che interessale vene, creando un solco
C0065.indd 293C0065.indd 293 2/9/12 6:19:05 PM2/9/12 6:19:05 PM
Tavola 13.11 Apparato genitale
294 ATLANTE DI ANATOMIA, FISIOPATOLOGIA E CLINICA
DIAGNOSTICA PER IMMAGINI DELLA MAMMELLA
Nella pratica medica attuale, la diagnostica per immagini prevede
due modalità di screening e valutazione delle lesioni mammarie
sospette, la mammografi a e l’ecografi a. In alcuni casi, la risonanza
magnetica (RM) si è rivelata utile come esame aggiuntivo ai tradi-
zionali metodi di diagnostica per immagini. Altri metodi diagnostici
come l’imaging termico (termografi a), l’imaging molecolare della
mammella (scintimammografi a), la mammografi a tridimensionale
(tomosintesi), la tomografi a a impedenza elettrica (T-scan) e la
transilluminazione sono sperimentali o non hanno dimostrato di
essere effi caci.
La mammografi a è il metodo di screening migliore attualmente
disponibile per l’individuazione delle lesioni in fase iniziale: essa è
infatti in grado di identifi care lesioni di piccole dimensioni (1-2 mm),
calcifi cazioni, o altri mutamenti che lasciano sospettare un tumore
all’incirca 2 anni prima che la lesione sia clinicamente palpabile.
Oltre 1 / 3 dei tumori asintomatici della mammella presenta calcifi ca-
zioni, che rendono tumori, altrimenti non individuabili, visibili alla
mammografi a.
L’utilizzo diffuso della mammografi a è stato correlato a una ridu-
zione del 30% del tasso di mortalità dovuta al cancro della mam-
mella. Purtroppo, non tutte le donne vengono sottoposte regolar-
mente a uno screening adeguato. Le linee guida più recenti in merito
allo screening per il cancro della mammella raccomandano l’ese-
cuzione della mammografi a ogni 1-2 anni per le donne tra i 40 e i
49 anni e successivamente ogni anno. Gran parte delle linee guida
non suggerisce più di eseguire mammografi e di routine nelle donne
sotto i 40 anni. Perlopiù, si raccomanda una mammografi a e un
esame senologico annuali per le donne a partire dai 50 anni. Tut-
tavia, il dibattito, scientifi co e pubblico, sui potenziali rischi e benefi ci
della mammografi a di screening è tutt’ora aperto.
Nei casi in cui la paziente avesse una parente di primo grado che
ha avuto un carcinoma della mammella in premenopausa, lo scree-
ning dovrebbe iniziare circa 5 anni prima dell’età a cui quel tumore
è stato diagnosticato. Per le pazienti con rischio aumentato di
carcinoma della mammella (forte anamnesi familiare o anomalia
genetica come mutazioni di BRCA1 o di BRCA2), alla mammografi a
dovrebbe essere affi ancata la RM. La RM non dovrebbe essere
utilizzata come unico metodo di screening a causa del tasso troppo
elevato di falsi positivi.
La mammografi a nelle giovani donne è più diffi cile da interpretare
rispetto a quella effettuata nelle donne di età più avanzata a causa
della maggiore densità tissutale durante gli anni riproduttivi e per
questo motivo i carcinomi della mammella nelle giovani passano
spesso inosservati. Nel complesso, la mammografi a ha un’accura-
tezza di circa l’85% nella diagnosi di tumore maligno, con un tasso
di falsi negativi del 10-15%. Per questa ragione, è uno strumento
aggiuntivo alla diagnostica clinica e alla procedura defi nitiva della
biopsia ma non le sostituisce. All’incirca il 10% degli studi mammo-
grafi ci richiede ulteriori elementi. Tra l’1 e il 2% degli studi di scree-
ning per la formulazione della diagnosi necessita di una valutazione
istologica. Nella mammografi a, l’esposizione complessiva alle ra-
diazioni è minima ( < 1 rad).
L’ecografi a è diventata un utile strumento per l’utilizzo insieme
alla mammografi a, in quanto è ampiamente diffusa, non invasiva e
meno costosa delle altre opzioni diagnostiche. In origine, l’ecografi a
è stata utilizzata principalmente come un efficace metodo per
la differenziazione delle masse cistiche da quelle solide presenti
nella mammella, ma fornisce inoltre informazioni utili sulla natura e
la diffusione delle masse solide e di altre lesioni mammarie. Benché
sia meno sensibile della RM (individua un numero minore di tumori),
l’ecografi a ha il vantaggio di essere meno costosa e più diffusa.
L’ecografi a della mammella non è eseguita come esame di scree-
ning di routine, ma piuttosto è utile per la valutazione di masse
palpabili, occulte alla mammografi a, nella valutazione delle lesioni
mammarie clinicamente sospette nelle donne sotto i 30 anni e nel
monitoraggio di anomalie individuate tramite mammografi a. Alcuni
studi hanno suggerito un’utilità nell’esecuzione di routine dell’eco-
grafi a, con una mammografi a nelle donne più giovani o con tessuto
mammario denso. Un ampio studio ha valutato l’utilizzo dell’eco-
grafi a mammaria come metodo di screening e ha scoperto che
veniva individuato un numero maggiore di tumori al seno con la
combinazione dei due metodi piuttosto che con la sola mammo-
grafi a, anche se il tasso di studi e biopsie con falsa positività era
elevato. L’ecografi a è generalmente riconosciuta come un metodo
fortemente dipendente dal medico da cui è eseguita, che deve
essere esperto, e richiede un controllo di alta qualità e una stru-
mentazione molto moderna.
Mammografia
Ecografia
Posizione per la proiezionecranio-caudale
Posizione per laproiezione laterale
Posizione per la proiezionemedio-laterale
Generalmente vengono eseguitedue esposizioni ad angoli retti(cranio-caudale e laterale)per ciascuna mammella
Quando sono necessari ulterioridettagli di coste e mammella,viene eseguita ancheun’esposizione medio-laterale
Dispositivoper la compressionedella mammella
Dispositivoper la compressionedella mammella
Raggi Xa fasci conici
Tessutoadiposotraslucido
Ombredi tessutoconnettivo
Condotti prominentied elementi ghiandolari
Ombre vascolari
Proiezione cranio-caudale di una normalemammella adiposa
Proiezione lateraledi una mammella ghiandolaredi densità normale
Massa cistica visibile
Proiezione medio-lateraledi una mammella normale
Dettaglio della costa mostratoin questa proiezione
Ombre di tessuto connettivo
C0065.indd 294C0065.indd 294 2/9/12 6:19:12 PM2/9/12 6:19:12 PM
Tavola 13.12 Mammella
ATLANTE DI ANATOMIA, FISIOPATOLOGIA E CLINICA 295
MODIFICAZIONI FIBRO-CISTICHE I: MASTODINIA
Quando si parla di modifi cazioni fi bro-cistiche (precedentemente
denominate mastopatia fi bro-cistica) ci si riferisce a un quadro
generico che comprende la mastalgia (mastodinia), le cisti mam-
marie e la nodularità priva di carattere distintivo. Queste modifi ca-
zioni possono essere isolate o verifi carsi contemporaneamente. Le
mammelle in genere sono nodulari, dense e dolenti alla palpazione.
Le modifi cazioni fi bro-cistiche sono responsabili della sintomatologia
mammaria più comunemente riportata.
Mastalgia è il termine non specifi co utilizzato per indicare un
dolore al seno di qualsiasi eziologia. Un dolore mammario può ve-
rifi carsi nelle mammelle obese e pendule durante o dopo la meno-
pausa, quando il peso delle mammelle stesse stira i legamenti
sospensori esercitando una trazione sulle fi bre nervose. In questi
casi non si tratta di reale mastodinia e il dolore è alleviabile con un
buon reggiseno e una riduzione del peso. Un’altra forma di dolore
mammario, che non origina nel parenchima, è dovuta a una ne-
vralgia intercostale, che può essere una complicanza di una spon-
dilite, di affaticabilità e di infezioni respiratorie.
Gran parte delle donne, almeno una volta nella vita, sperimenta
dolore mammario, che in molti casi è transitorio. La causa più co-
mune di mastodinia persistente è una modifi cazione fi bro-cistica. Il
dolore mammario può inoltre manifestarsi in seguito a un rapido
cambiamento ormonale (specialmente quando si verifi ca un innal-
zamento dei livelli di estrogeni, come in caso di inizio di assunzione
della pillola anticoncezionale, terapia sostitutiva o gravidanza). In
assenza di cambiamenti patologici evidenti, la mastalgia è stata
attribuita al consumo di caffeina e a diete ricche di grassi, ma
mancano dati solidi. La cause non ginecologiche includono la radi-
colite dorsale o modifi cazioni infi ammatorie delle articolazioni costo-
condrali (sindrome di Tietze), adenosi sclerosante, spasmi muscolari
della parete toracica, costocondrite e fi bromialgia. Le pazienti di età
più avanzata possono inoltre essere affette da nevralgia posterpetica
o da neurite secondaria a infezioni da herpes zoster. Questo dolore
può essere simile a quello della mastalgia.
Il dolore delle modifi cazioni fi bro-cistiche, inizialmente presente
solo nel premestruo, diventa progressivamente più esteso nel tempo
e più grave, fi no a permanere durante tutto il ciclo. La mammella
interessata è generalmente ben sviluppata. Viene percepita una
zona granulosa di maggiore densità, situata più di frequente nel
quadrante supero-laterale che in altre parti dell’emisfero. La com-
pressione con le dita di quest’area rigonfi a genera dolore. Le mo-
difi cazioni fi bro-cistiche sono spesso bilaterali. Generalmente non
sono percepite masse defi nite. Un dolore monolaterale o localizzato
suggerisce un processo patologico. La mammografi a può essere
indicata per altre ragioni ma raramente è utile nella valutazione della
mastalgia.
Il tessuto mammario dolente sottoposto a biopsia appare più
denso e fibroso del normale. Sul tessuto lobulare si osservano
chiaramente piccole macchie rosa in un denso stroma bianco, che
racchiude alcune piccole formazioni cistiche. L’esame al micro-
scopio rivela lobuli irregolari o che presentano un arresto di crescita,
con minuscole dilatazioni cistiche. Un tessuto connettivo immaturo
e proliferante, scarsamente colorabile, circonda le strutture
epiteliali.
La mastodinia in genere risponde alla terapia medica e alla
rassicurazione nel caso in cui la paziente tema la presenza di un
carcinoma. Le misure generali includono analgesici, un sostegno
meccanico (un buon reggiseno indossato giorno e notte), terapia
termica applicata localmente e rassicurazione della paziente. Spesso
si ottiene un benefi cio riducendo l’assunzione di metilxantine. Per
alcune pazienti si raccomanda di limitare l’assunzione di sale o di
liquidi. Il ruolo delle vitamine A ed E è sconosciuto. L’enotera e
l’agnocasto hanno mostrato un’effi cacia in studi clinici ristretti ma
la non standardizzazione di entrambi i trattamenti e dei principi attivi
in vari preparati limita la capacità di valutare appieno queste opzioni
terapeutiche.
I contraccettivi orali combinati migliorano la sintomatologia nel
70-90% dei pazienti. Nei casi più resistenti, può rendersi necessario
un trattamento con spironolattone, danazolo (iniziato durante le
mestruazioni o una volta che è stata esclusa una gravidanza) o
bromocriptina. In pazienti molto selettive possono essere necessari
gli agonisti del GnRH. I diuretici devono essere utilizzati con atten-
zione per evitare disturbi relativi ai liquidi e agli elettroliti. All’inizio
della terapia e per diversi giorni la bromocriptina può causare ipo-
tensione. In caso di pazienti con compromissione della funzione
epatica o renale occorre procedere con cautela.
Qualsiasi sia la terapia utilizzata, in tutti i casi resta fondamentale
escludere la possibilità di un carcinoma.
Schema della sindrome clinica:rigonfiamento dolente e granulare
Aspetto al microscopio (lobuli con un arrestodi crescita nello stroma fibroso proliferante)
Sezione sagittale
C0065.indd 295C0065.indd 295 2/9/12 6:19:17 PM2/9/12 6:19:17 PM
Tavola 13.13 Apparato genitale
296 ATLANTE DI ANATOMIA, FISIOPATOLOGIA E CLINICA
MODIFICAZIONI FIBRO-CISTICHE II: ADENOSI
La proliferazione stromale e duttale che determina formazione di
cisti, ispessimento diffuso, dolore ciclico e dolorabilità è il tratto
distintivo delle modifi cazioni fi bro-cistiche. Il termine modifi cazione
fi bro-cistica include una moltitudine di processi diversi e di vecchie
espressioni, tra cui mastopatia fi bro-cistica. Si tratta della condizione più
comune tra tutte le condizioni mammarie benigne e ciò spiega il
perché sia stato abbandonato il termine “mastopatia”. Con diversi
gradi di importanza, le modifi cazioni fi bro-cistiche interessano tra
il 60 e il 75% di tutte le donne. Queste modifi cazioni sono più co-
muni tra i 30 e i 50 anni, con solo il 10% dei casi tra le donne sotto
i 21 anni. È stata avanzata l’ipotesi che le metilxantine siano un
agente eziologico, ma mancano dati solidi a supporto di tale tesi.
Non vi sono evidenze a sostegno del fatto che i contraccettivi orali
aumentino il rischio di queste modifi cazioni. Spesso è presente
un’anamnesi familiare di modifi cazioni fi bro-cistiche, ma l’agente
eziologico è diffi cile da individuare.
Le cause delle modifi cazioni fi bro-cistiche sono ignote, ma è stato
postulato che esse derivino da un’eccessiva risposta del parenchima
agli ormoni. È stato suggerito un possibile ruolo del progesterone
per la frequenza con cui si manifestano gonfi ore e dolore mammario
nel periodo premestruale. Altre cause ipotizzate delle modifi cazioni
fi bro-cistiche sono un’alterazione del rapporto tra estrogeni e proge-
sterone e un aumento della velocità di secrezione della prolattina,
ma nessuna di queste è stata confermata.
L’adenosi è caratterizzata dalla presenza di noduli multipli in una
o in entrambe le mammelle, di dimensione variabile tra 1 mm e 1 cm,
in genere distribuiti intorno alla periferia dell’emisfero superiore o
esterno. Le mammelle interessate tendono a essere piccole, com-
patte e con bordi “a piattino”, avvertibili alla palpazione. I reperti
tipici rilevati all’esame obiettivo includono cisti multiple e noduli
frammisti a nodularità bilaterale disseminata, o un ispessimento
nastriforme, specialmente nei quadranti supero-esterni delle mam-
melle. Come nella mastodinia, si verifi cano dolore e dolorabilità (che
varia durante il ciclo mestruale), con un’acutizzazione dei sintomi
appena prima delle mestruazioni (il dolore associato alle modifi ca-
zioni fi bro-cistiche spesso si irradia alle spalle e alla parte superiore
delle braccia). Benché il dolore sia il disturbo più frequente, l’adenosi
fi bro-cistica, nel 50% dei casi, può essere asintomatica.
Le modifi cazioni fi bro-cistiche consistono in tre fasi: (1) prolife-
razione dello stroma, specialmente nei quadranti supero-esterni;
(2) proliferazione dei condotti e delle cellule alveolari, adenosi e
formazione di cisti; (3) presenza di cisti di dimensioni maggiori e
dolore generalmente diminuito. Le modifi cazioni proliferative pos-
sono essere estese (anche se generalmente benigne) in un punto
qualsiasi dei tessuti coinvolti. Nel complesso, il tessuto mammario
interessato contiene un denso tessuto fi broso, numerose cisti di
piccolissime dimensioni e focolai di proliferazione epiteliale. La
struttura lobulare è molto distorta. Alcuni dei tubuli terminali formano
solidi tappi di cellule basali, che in sezione trasversale appaiono
come adenomi dei condotti. Altri tubuli danno luogo a strutture lo-
bulari fortemente ingrossate, penetrate da fasci densi di tessuto
fi broso che conferiscono l’aspetto di un adenoma fi broso. La dia-
gnosi differenziale tra un’adenosi e un adenoma fi broso è talvolta
diffi cile se non impossibile, in particolare se nei casi di adenosi in
fase avanzata si sono sviluppati piccoli papillomi intraduttali. L’età
premenopausale, la molteplicità di noduli situati più perifericamente,
un’escrezione marrone piuttosto che sanguigna dal capezzolo e il
coinvolgimento di entrambe le mammelle fanno propendere per
l’adenosi.
La mammografi a può essere utilizzata per fornire ulteriori ele-
menti per la diagnosi o per ottenere una valutazione basale, ma non
è necessaria per porre la diagnosi. La mammografia comporta
maggiori diffi coltà nelle donne giovani che segnalano prevalente-
mente questo disturbo. Di conseguenza, l’ecografi a può essere di
maggiore aiuto quando la diagnostica per immagini è ritenuta ne-
cessaria. Se la paziente presenta una massa cistica nella mammella,
un’agoaspirazione con ago calibro 22-25 può essere sia diagnostica
sia terapeutica. In caso di sospetto di tumore maligno, può essere
necessaria un’aspirazione con ago sottile o una core biopsy della
mammella. In caso di atipia riscontrata nei condotti iperplastici o
nelle cellule apocrine, il rischio di un futuro sviluppo di carcinoma
aumenta di cinque volte.
Schema della sindrome clinica:simile a un cordoncino e nodularecon bordi “a piattino”
Acini dilatati e proliferazione epiteliale
Aspetto alla sezionetrasversale
C0065.indd 296C0065.indd 296 2/9/12 6:19:19 PM2/9/12 6:19:19 PM
Tavola 13.14 Mammella
ATLANTE DI ANATOMIA, FISIOPATOLOGIA E CLINICA 297
MODIFICAZIONI FIBRO-CISTICHE III: ALTERAZIONE CISTICA
Le masse cistiche nella mammella si rilevano di frequente nella
pratica clinica. La distinzione tra le cisti che rappresentano una
minaccia da quelle che possono essere seguite in modo conserva-
tivo è la sfi da posta dalla presenza di cisti mammarie. Alcuni autori
ritengono che la formazione di cisti mammarie si verifi chi in circa il
50% delle donne in età riproduttiva. All’incirca una donna su quattro
si rivolge a un medico per problemi al seno, che spesso si manife-
stano come masse palpabili. La causa più comune di cisti mammaria
palpabile è una modifi cazione fi bro-cistica (riscontrata nel 60-75%
di tutte le donne). Le cisti possono inoltre essere causate dalla di-
latazione dei condotti e da complicanze dell’allattamento (galattoceli,
ascessi).
La patogenesi delle formazioni cistiche più comuni non è chiara.
I cambiamenti ormonali ciclici inducono modifi cazioni stromali ed
epiteliali che possono causare fi brosi e formazioni cistiche. Le cisti
possono essere isolate o presentarsi in gruppi, con un diametro
che può raggiungere i 4 cm. Le cisti di piccole dimensioni sono
compatte e contengono un liquido chiaro, che conferisce loro un
colore tendente al blu. Le cisti più grosse possono essere di colore
marrone, derivante da un’emorragia al loro interno. Secrezioni dense
o latte possono formare una dilatazione cistica dei condotti (galat-
tocele, ectasia duttale), palpabile come massa cistica. Nello stroma
circostante sono visibili gradi variabili di fi brosi e di infi ammazione
(la perdita di liquido cistico nel tessuto circostante induce una ri-
sposta infi ammatoria in grado di alterare i reperti fi sici e assomi-
gliare a un carcinoma). I reperti microscopici associati alle cisti
mammarie dipendono dai cambiamenti fi siopatologici coinvolti.
La modificazione fibro-cistica si manifesta con la comparsa
improvvisa di una cisti in una mammella precedentemente normale,
nella quale il parenchima è stato per la maggior parte sostituito da
adipe, ed è accompagnata da una sensazione sgradevole o di dolore
pungente. In circa il 6% delle pazienti si verifi ca un’escrezione
sierosa dal capezzolo. Alla palpazione si avverte una massa arro-
tondata e tesa, che si muove liberamente tra la punta delle dita delle
mani, se la massa viene compressa alternativamente con entrambe
le mani. La cisti in genere è situata a metà tra il capezzolo e la
periferia della mammella.
A un esame macroscopico (quando viene esposta nel corso di
un intervento chirurgico), la cisti presenta una caratteristica cupola
blu che preme sull’adipe sottocutaneo. Questa cisti ha una parete
fi brosa e sottile, che può possedere un rivestimento epiteliale di
cellule duttali somigliante all’epitelio delle ghiandole sudoripare.
Aprendo la cisti, fuoriesce un liquido opaco color paglierino. Micro-
scopicamente, la parete cistica è racchiusa in un denso stroma
mammario fi broso. La ghiandola è povera di tessuto acinare.
La diagnosi e il trattamento delle masse cistiche nella mammella
si basano sull’anamnesi, l’esame obiettivo e l’aspirazione, talvolta
unitamente alla mammografi a e all’ecografi a (l’ecografi a è utile per
distinguere le masse solide da quelle cistiche, ma ha una risoluzione
spaziale limitata e non può essere utilizzata per distinguere i tessuti
benigni da quelli maligni). L’agoaspirazione con un ago da 22-
25 gauge può essere sia diagnostica sia terapeutica. Se la cisti
scompare completamente e non si riforma nel giro di un mese, non
si richiedono ulteriori terapie. Il liquido aspirato dalle pazienti con
modifi cazioni fi bro-cistiche è generalmente di colore paglierino. Le
cisti formatesi da lungo tempo possono contenere un liquido di
colore marrone scuro o verde, che tuttavia è innocuo. I liquidi con
tracce ematiche richiedono ulteriori indagini. L’esame citologico del
liquido ottenuto ha scarso valore a causa dell’alto numero di falsi
positivi e falsi negativi. A distanza di 2-4 settimane dall’aspirazione
di una cisti, la paziente deve essere sottoposta a un controllo. In
caso di mancanza di una risoluzione completa al momento dell’aspi-
razione e in presenza di una recidiva o di una massa palpabile si
richiedono ulteriori esami come l’aspirazione con ago sottile (FNA)
o la biopsia a cielo aperto.
estrogenicoEffetto
Follicolo
Follicoloin involuzione
Ef
fetto
ga
latto
poie
tico
do
poca
lo d
i estr
ogen
i Corpus albicans
Cisti multiple
Cisti solitaria cupoliforme di colore blu
C0065.indd 297C0065.indd 297 2/9/12 6:19:25 PM2/9/12 6:19:25 PM
Tavola 13.15 Apparato genitale
298 ATLANTE DI ANATOMIA, FISIOPATOLOGIA E CLINICA
FIBROADENOMA BENIGNO, PAPILLOMA INTRACISTICO
I fi broadenomi sono la seconda forma più comune di patologia
mammaria e la forma più comune di masse nella mammella. Il picco
di incidenza è tra i 20 e i 25 anni e la maggior parte delle pazienti
è al di sotto dei 30 anni. I tumori a crescita più rapida sono riscon-
trabili durante l’adolescenza. I tumori sono due volte più comuni
nelle donne di colore (30% dei disturbi mammari riferiti), nelle pa-
zienti con intensa attività ormonale (adolescenti, donne gravide) e
nelle pazienti sottoposte a terapia a base di soli estrogeni.
I fi broadenomi si presentano generalmente come masse solitarie
compatte, indolori, mobili e gommose all’interno della mammella e
possono crescere rapidamente durante l’adolescenza o in condizioni
di alti livelli di estrogeni come in gravidanza o sotto terapia estro-
genica. Di solito questi tumori vengono individuati casualmente o
durante l’autopalpazione del seno e presentano un diametro di
2-3 cm, anche se possono raggiungere i 6-10 cm. Nel 15-20%
delle pazienti vengono rilevati dei fi broadenomi multipli, che risultano
bilaterali nel 10-20% dei casi.
Il sintomo principale è un ingrossamento graduale della massa
nel corso di mesi o anni e della durata di poco meno di 3 anni. Alla
palpazione, il tumore è duro, incapsulato, nodulare e liberamente
mobile. La mammografi a è generalmente evitata, ma, se necessaria,
può avere valore diagnostico. L’ecografi a della mammella permette
di distinguere tra masse solide e masse cistiche, anche se spesso
questa distinzione non è necessaria.
La struttura del tumore è di tipo lobulare. Questi tumori sono
caratterizzati da un nodulo centrifugo a carattere nettamente circo-
scritto, carnoso e omogeneo, generalmente a forma sferica od ovale.
In sezione, spirali fi brose di colore rosa o bianco-marroncino spor-
gono dalla superfi cie. Gli infarti emorragici sono comuni. Micro-
scopicamente, si osservano condotti ben sviluppati, circondati da
una proliferazione marcata di tessuto connettivo periduttale. Quando
questo tessuto è di colore pallido e lasso e l’epitelio dei condotti è
compresso, il tumore è denominato mixoma intracanalicolare.
Quando la quantità di tessuto fi broso e la crescita dei condotti sono
più equilibrate, il tumore è chiamato fi broadenoma.
All’inizio dell’adolescenza, in gravidanza o verso la menopausa,
quando aumenta la secrezione di estrogeni, la crescita dei fi broa-
denomi è rapida. Questi tumori sono denominati mixomi mammari
giganti. Una trasformazione maligna è estremamente rara e in
genere assume la forma di un fi brosarcoma che si verifi ca nel mi-
xoma gigante. Dopo la menopausa i fi broadenomi tendono a re-
gredire e a diventare ialinizzati, ma con la terapia sostitutiva a base
di estrogeni possono restare invariati o crescere. Il trattamento
consiste in una semplice escissione, che conferma la diagnosi ed
è suffi ciente per la terapia.
I papillomi intracistici benigni sono crescite epiteliali molli che si
verifi cano entro un condotto mammario o in un acino cistico. Essi
hanno una frequenza pari alla metà rispetto ai fi broadenomi e si
riscontrano nella zona centrale della mammella, in prossimità della
menopausa o durante la menopausa stessa. La durata dei sintomi
varia tra 6 mesi e 5 anni. I sintomi consistono in una secrezione
ematica dal capezzolo (nel 50% dei casi) o in una protuberanza
associata a una moderata dolorabilità. Raramente i tumori sono di
grosse dimensioni; vanno da 1 a diversi centimetri di diametro. Quelli
più grossi sono caratterizzati da un liquido ematico contenuto entro
la cisti o da alterazioni maligne che si verifi cano in circa il 10% dei
casi. Nel 14% dei casi si riscontrano papillomi multipli in una o in
entrambe le mammelle. Alla palpazione, il papilloma benigno è li-
beramente mobile, morbido e teso (cistico) o fl uttuante.
Macroscopicamente, i papillomi intracistici sono tumori incapsu-
lati in cui i ciuffi epiteliali si estendono entro la cavità e sono bagnati
da quantità variabili di liquido siero-ematico. Papillomi più piccoli si
possono riscontrare nei condotti vicini o nelle ramifi cazioni di un
gruppo di condotti a una certa distanza dal tumore principale. Micro-
scopicamente, la proliferazione epiteliale arborescente giace su un
peduncolo fi broso con una membrana basale integra. Il trattamento
è una semplice escissione, un esame dei condotti vicini per eventuali
papillomi secondari e un’escissione di questi, se indicata. Per i
tumori ricorrenti nelle pazienti più anziane, è consigliata una sem-
plice mastectomia.
Fibroadenoma
Tumore benigno escissodalla mammella
Sezione istologica di un fibroadenomae papilloma che mostra condottiben sviluppati circondatida tessuto connettivo periduttaleeccessivamente sviluppato
Tumore in sezione trasversale
Peduncolofibroso
Papillomanel tessutomammario
Secrezionedal capezzolo
Papilloma intracistico benigno
C0065.indd 298C0065.indd 298 2/9/12 6:19:36 PM2/9/12 6:19:36 PM
Tavola 13.16 Mammella
ATLANTE DI ANATOMIA, FISIOPATOLOGIA E CLINICA 299
MIXOMA GIGANTE, SARCOMA
Una varietà di fi broadenoma che cresce fi no a raggiungere dimen-
sioni enormi e che si verifi ca in prossimità della menopausa fu
descritto per la prima volta da Johannes Müller, un rinomato fi siologo
di inizio Ottocento, come “cistosarcoma fi lloide”. Si tratta di un tu-
more per lo più benigno che interessa quasi esclusivamente le
mammelle femminili e rappresenta meno dell’1% di tutti i tumori
mammari. Questo tumore si sviluppa per 6 o 7 anni, con una rapida
crescita verso la fi ne di questo periodo, quando i tumori possono
aumentare in modo signifi cativo nel giro di poche settimane. Il ca-
rattere benigno del tumore è indicato dall’assenza di un’invasione
della cute o dei linfonodi regionali. Questi tumori sono pesanti,
massicci, lobulati con aree cistiche, hanno un aspetto liscio
fortemente demarcato e sono di norma liberamente mobili. Il loro
peso medio è di oltre 3 kg. Nonostante le dimensioni, il tumore rimane
mobile e incapsulato e il capezzolo non è retratto. A livello macro-
scopico, il tumore presenta le caratteristiche di un grosso sarcoma
maligno, in sezione assume un aspetto fogliforme e dal punto di vista
istologico mostra spazi cistici epiteliali. Poiché questi tumori sono
perlopiù benigni, la loro denominazione può essere fuorviante, e
perciò si preferisce parlare di tumore fi lloide e mixoma gigante.
Queste proliferazioni originano da un mixoma intracanalicolare
preesistente. Un tessuto fi broso denso in forma di spirali è separato
tramite fessure da masse polipoidi, fi brose ed epiteliali che si pro-
iettano in cavità cistiche. Al microscopio, la componente predomi-
nante è un tessuto connettivo mixomatoso, con tratti densi e fi brosi
interposti. La maggioranza di questi tumori è benigna, ma alcuni
possono essere sede di una trasformazione sarcomatosa. Ciò avvie-
ne, nel 10% dei casi, in particolare quando il tumore è presente da
molti anni. La migliore terapia per questi tumori è la semplice ma-
stectomia con la rimozione della fascia del muscolo grande pettorale.
Benché spesso non metastatizzino, questi tumori benigni sono noti
per crescere in modo aggressivo e per essere localizzati e ricor-
renti. I tumori maligni metastatizzano per via ematogena come gli
altri sarcomi. L’aspetto istologico non sempre predice il comportamento
clinico di questi tumori. Circa il 30% dei pazienti con tumori fi lloidi
maligni va incontro a morte a causa di questa patologia. Per i tumori
fi lloidi non esistono cure diverse dall’intervento chirurgico, in quanto
la chemioterapia e la radioterapia non sono effi caci. Gli studi attuali
non forniscono prove a sostegno dell’uso della radioterapia adiuvante
nei pazienti con tumore escisso in modo adeguato.
Il sarcoma mammario è relativamente raro e rappresenta l’1-2%
dei tumori mammari. Sono state descritte molte varietà di sarcoma,
come il sarcoma osteogenico, il linfosarcoma, il miosarcoma, il li-
posarcoma e il mielosarcoma. In oltre la metà dei casi, tuttavia, i
sarcomi della ghiandola mammaria sono del tipo a cellule fusate e
originano dallo stroma della mammella o dallo stroma di fi broade-
nomi preesistenti. I tumori possono svilupparsi a qualsiasi età ma
il loro picco di incidenza è tra i 45 e i 55 anni e sono caratterizzati
da una rapida crescita, grosse dimensioni e una consistenza rigida.
Può verifi carsi un’ulcerazione della pelle con micosi. Le enormi
dimensioni e l’assenza di un coinvolgimento dei linfonodi ascellari
permettono di distinguere questi tumori dai carcinomi mammari. I
sintomi osservati più comunemente sono dolore e rapida crescita.
Un fi broadenoma preesistente può avere un carattere stazionario e
asintomatico per molti anni e poi improvvisamente diventare dolente,
dando origine a un sarcoma invasivo a rapida crescita.
Le alterazioni sarcomatose sono state riscontrate anche nei
mixomi benigni. Macroscopicamente, i tumori sono proliferazioni
solide e carnose, che possono invadere la fascia del muscolo grande
pettorale. Microscopicamente, essi sono costituiti da cellule fusate
pleomorfe, fi ttamente stipate. Il trattamento consiste in una ma-
stectomia radicale. I polmoni sono la più frequente sede di meta-
stasi, seguiti da ossa, cuore e fegato.
Sarcoma. Visione al microscopio che mostranumerose cellule fusate ammassate con nucleiipercromatici anomali
Tumore ulcerato attraverso la pelle
Sarcoma
Mixoma gigante
Mixoma gigante. Visione al microscopioche mostra un tessuto connettivo mixoideblando contenente cellule fusate uniformi
Presentazione clinica del tumorenella mammella destra
Cisticontenenteuna massamixoide
Sezione di tessuto mammariocontenente un tumore
C0065.indd 299C0065.indd 299 2/9/12 6:19:41 PM2/9/12 6:19:41 PM
Tavola 13.17 Apparato genitale
300 ATLANTE DI ANATOMIA, FISIOPATOLOGIA E CLINICA
CANCRO DELLA MAMMELLA
Le donne statunitensi presentano i più alti tassi di incidenza del
cancro della mammella al mondo. A livello mondiale, il cancro della
mammella è il secondo tipo più comune di tumore dopo il cancro
del polmone (il 10,4% dell’incidenza complessiva relativa ai tumori,
in entrambi i sessi) e la quinta causa più comune di decesso per
cancro. Circa 1 / 3 di tutte le forme di carcinoma femminile ha origine
nella mammella, di cui oltre 3 / 4 sono carcinomi di tipo scirroso infi l-
trante o lobulare. Il carcinoma della mammella è responsabile
di circa il 18% dei decessi dovuti al cancro, totalizzando negli Stati
Uniti un numero di decessi annuo pari a quello degli incidenti
stradali. Il picco di incidenza è dopo i 40 anni: 85% dopo i 40
anni e 75% dopo i 50 anni. Circa il 5-10% dei carcinomi della
mammella ha una correlazione genetica o familiare.
I sintomi che portano la paziente a rivolgersi al medico sono la
scoperta di una massa in continuo aumento (tra il 55 e il 65% dei
casi), episodi occasionali e transitori di dolore o dolorabilità e cam-
biamenti della cute o del capezzolo. Circa il 60% dei tumori palpabili
è localizzato nel quadrante supero-esterno della mammella. Una
mammografi a anomala senza una massa palpabile è la seconda
causa più comune della diagnosi (35%). Un quarto di tutti i carcinomi
della mammella viene scoperto durante l’esame di routine.
I principali reperti clinici sono la presenza, rilavata alla palpazione,
di una singola massa in una mammella per il resto normale in una
paziente sopra i 35 anni di età; la durezza e l’irregolarità del tumore;
la chiara vicinanza del tumore alle dita dell’esaminatore, a causa
dell’atrofi a dell’adipe sovrastante; la scarsa mobilità della massa;
infi ne, l’appiattimento o la retrazione della pelle o del capezzolo dal
lato interessato durante la manipolazione delle braccia o delle
mammelle. La diagnosi defi nitiva può essere posta solo in seguito
a biopsia escissionale con o senza controllo radiografi co.
Macroscopicamente, questo carcinoma mammario si presenta
come una massa densa, bianco-giallastra, stellata e indurita, con
una superfi cie di taglio granulosa e concava, che al tatto assomiglia
a una pera non matura. A meno che non si sia secondariamente
infettato, il tumore in genere non presenta necrosi. Esso infi ltra
l’adipe circostante e lo stroma fi broso della mammella. Microsco-
picamente, le cellule tumorali sono di media grandezza, con grossi
nuclei ipercromatici. Le cellule crescono a piccoli nidi o in cordoni,
con un abbondante tessuto fibroso interposto. Nei carcinomi a
crescita più lenta, le cellule proliferano in masse sparse e tendono
a formare strutture acinose o tubulari, mentre in quelli a crescita
più rapida, le cellule sono sparse singolarmente, senza alcuna somi-
glianza istologica con la struttura normale.
A livello istologico, il tumore mammario più comune è il carcino-
ma duttale infi ltrante, responsabile di circa il 75% dei carcinomi
della mammella. Il sottotipo più comune è il carcinoma scirroso,
caratterizzato da noduli duri e ben defi niti costituiti da cordoni e nidi
di cellule duttali maligne. Sono state individuate anche le forme
midollare e mucinosa.
Un tempo la mastectomia radicale era il trattamento di elezione,
con un tasso di sopravvivenza a cinque anni del 70% in assenza di
coinvolgimento dei linfonodi ascellari. Negli ultimi decenni si è invece
intrapreso un approccio molto meno radicale, attuabile sulla base di
una serie di fattori: le dimensioni del tumore, la sua aggressività in-
trinseca stabilita tramite esame istologico della lesione iniziale, la
presenza di linfonodi positivi e lo stato recettoriale del tumore. Alla base
delle novità, introdotte nel corso degli ultimi due decenni in merito al
trattamento del cancro della mammella vi è principalmente un cambio
di opinione riguardo alla biologia del tumore. È diventato evidente che
molte donne con cancro della mammella al momento della diagnosi
iniziale presentano una malattia sistemica. La storia naturale del car-
cinoma mammario in fase di sviluppo, con un tempo di raddoppiamento
medio di 100 giorni, ha messo in evidenza che il tumore cresce per
anni prima della sua scoperta clinica. Poiché è probabile che prima
della diagnosi si verifi chi una disseminazione vascolare, il trattamento
del cancro della mammella si basa attualmente sulla terapia sia locale
sia sistemica, senza un affi damento completo alla chirurgia radicale.
Retrazione del capezzoloForma a crescita lenta. Proliferazionedelle cellule duttali con nuclei ingranditie struttura ghiandolare irregolare
Forma a crescita rapida. Proliferazionedelle cellule duttali con nuclei ipercromaticiin strati solidi e senza architettura ghiandolare
Carcinoma infiltrante. Osservatoin sezione trasversale della mammella
Massastellatae irregolare
C0065.indd 300C0065.indd 300 2/9/12 6:19:47 PM2/9/12 6:19:47 PM
Tavola 13.18 Mammella
ATLANTE DI ANATOMIA, FISIOPATOLOGIA E CLINICA 301
ADENOCARCINOMA INTRADUTTALE E LOBULARE
I due tipi principali di adenocarcinoma mammario sono i carcinomi
duttali (85%) e i carcinomi lobulari. Sulla base dell’esame istologico,
questi tumori sono talvolta classifi cati come adenocarcinomi papil-
lari, carcinomi con degenerazione mucoide e gelatinosa, o carcinomi
intraduttali che formano ostruzioni nei condotti preesistenti e anelli
circoscritti di cellule carcinomatose. Queste forme di adenocarci-
nomi circoscritti sporgono esternamente dalla parete toracica piutto-
sto che retrarsi all’interno, come nella forma infi ltrante. Un’aderenza
o un’ulcerazione cutanee e un coinvolgimento dei linfonodi ascellari
si verifi cano molto più tardi nel corso della malattia rispetto alla
forma scirrosa comune. I tumori avanzano lentamente fi no a rag-
giungere dimensioni enormi. Il tipo più comune di adenocarcinoma
è il carcinoma duttale, che origina nelle celle dei condotti. Il carci-
noma lobulare ha origine nei lobi o lobuli ed è bilaterale molto più
di frequente rispetto agli altri tipi di cancro della mammella. Il cancro
viene classifi cato in base ai tipi cellulari istologici predominanti;
tuttavia, vi sono diverse strutture cellulari che si possono trovare in
qualsiasi tumore.
Nel carcinoma intraduttale in situ, le anomalie cellulari sono li-
mitate all’epitelio duttale e il tumore non è penetrato nella mem-
brana basale del condotto. Questa condizione si verifi ca più comu-
nemente nelle donne durante il periodo di perimenopausa e di
postmenopausa. Poiché la malattia non produce una massa ben
defi nita, il carcinoma intraduttale in situ generalmente non viene
percepito alla palpazione. La diagnosi istologica di carcinoma in-
traduttale in situ include un gruppo eterogeneo di tumori con po-
tenziale di malignità variabile. Il carcinoma si sviluppa in circa il 35%
delle donne con questa patologia nel giro di 10 anni dalla diagnosi
iniziale e nel 5-10% delle donne, al momento della biopsia, si
manifesta contemporaneamente un carcinoma invasivo nella stessa
mammella.
A differenza del carcinoma intraduttale in situ, il carcinoma lo-
bulare in situ non deve essere trattato come un cancro o un pre-
cursore del cancro, ma piuttosto come marker di un aumento del
rischio di cancro della mammella. Questo carcinoma ha una ten-
denza molto maggiore a essere bilaterale e a presentarsi come
malattia multifocale. Tre pazienti su quattro con carcinoma lobulare
in situ sono in età premenopausale. Il periodo di latenza prima
dello sviluppo di un carcinoma invasivo è maggiore rispetto al
carcinoma intraduttale in situ; spesso, prima dello sviluppo di un
carcinoma infi ltrante passano 20 anni. Circa il 20% delle donne con
questa patologia alla fi ne sviluppa un carcinoma mammario invasivo.
Paradossalmente, questi carcinomi invasivi tardivi sono perlopiù
duttali, non lobulari.
Nei casi di carcinoma duttale infi ltrante, cellule epiteliali maligne
di varie forme e dimensioni infi ltrano il tessuto circostante. Il grado
di risposta fi brosa alle cellule epiteliali invasive determina la durezza
alla palpazione e la consistenza riscontrate durante la biopsia.
Spesso la reazione stromale può essere imponente. Circa il 10%
dei carcinomi duttali infi ltranti presenta un quadro istologico unifor-
me ed è classifi cato come carcinoma midollare, colloide, comedo-
nico, tubulare o papillare. In generale, le forme specializzate sono
più morbide, mobili e ben delineate, e hanno in genere dimensioni
più ridotte e una prognosi più ottimistica della varietà eterogenea
più comune. I carcinomi midollari sono molli, con infiltrazione
stromale estesa tramite linfociti e plasmacellule. I carcinomi colloide
e gelatinoso hanno anch’essi consistenza molle, con un’ampia
deposizione di mucina extracellulare.
I carcinomi lobulari infi ltranti sono rilevanti dal punto di vista
istologico per l’uniformità delle cellule neoplastiche piccole e rotonde.
La suddivisione istologica del carcinoma lobulare infi ltrante include
i carcinomi a piccole cellule, a cellule rotonde e a cellule ad anello
con castone. Spesso le cellule epiteliali maligne infi ltrano lo stroma
con una disposizione a fi la indiana. Questo tipo di cancro tende ad
avere un’origine multicentrica nella stessa mammella e a coinvolgere
entrambe le mammelle più spesso rispetto al carcinoma duttale infi l-
trante. Alla palpazione, queste masse appaiono spugnose e semi-
mobili e sono pendenti e pesanti quando la mammella viene spostata
verso l’alto. I carcinomi papillari possono contenere una cavità cistica
con sangue. I carcinomi intraduttali formano ostruzioni (comedoni)
che possono essere spremuti dai condotti. In sezione macroscopica,
i carcinomi gelatinosi contengono un caratteristico materiale mucoide
grigio e vischioso che fuoriesce dal tumore, il quale ha un aspetto
multiloculare con camere contenenti questa sostanza.
Adenocarcinoma papillare.Strati di cellule tumoralicon nuclei ipercromaticidi un carcinoma di grossedimensioni con proiezionipapillari (si veda la sezionetrasversale sopra riportata)
Carcinoma duttale(comedocarcinoma). Nididi cellule tumorali con focolaicentrali di necrosi (freccia)
Carcinoma gelatinoso. Gruppidi cellule maligne (frecce)racchiusi in un materialedenso e gelatinoso
Massa con presentazione clinicanella mammella sinistra
Massa visibilein sezionetrasversaledella mammella
C0065.indd 301C0065.indd 301 2/9/12 6:19:55 PM2/9/12 6:19:55 PM
Tavola 13.19 Apparato genitale
302 ATLANTE DI ANATOMIA, FISIOPATOLOGIA E CLINICA
CARCINOMA INFIAMMATORIO
Il carcinoma infi ammatorio o acuto, una volta chiamato mastite
carcinomatosa, si osserva più di frequente nelle pazienti con mam-
melle di grandi dimensioni o durante la gravidanza e l’allattamento,
da cui è derivata un’altra denominazione “cancro della lattazione”,
ormai obsoleta. I carcinomi infi ammatori costituiscono l’1-5% di tutti
i carcinomi mammari. Questa forma è riconosciuta clinicamente
come un carcinoma altamente maligno e di rapido sviluppo, con infi l-
trazione di cellule maligne nei vasi linfatici cutanei, che produce un
quadro clinico simile a quello di un’infezione cutanea. Non vi è un
tipo istologico specifi co. Nel sistema di stadiazione TNM per il cancro
della mammella, il carcinoma infi ammatorio ha una sua classifi ca-
zione, T4d, e si colloca allo stadio IIIB o superiore (i carcinomi
mammari allo stadio IIIB sono localmente avanzati; quelli allo stadio
IV sono carcinomi diffusi ad altri organi). A causa della rapida crescita
di questi tumori, l’aspetto fi sico della mammella è spesso diverso
da quello delle pazienti con altri tipi di carcinomi allo stadio III.
Il carcinoma mammario infi ammatorio tende a essere diagno-
sticato nelle donne più giovani rispetto ad altri tipi di carcinomi e si
verifi ca più spesso nelle donne di colore piuttosto che nelle donne
di razza bianca. Come altri tipi di carcinomi mammari, il carcinoma
infi ammatorio della mammella può verifi carsi anche negli uomini,
ma generalmente a un’età più avanzata rispetto alle donne. Vi sono
alcune prove a favore di un legame tra l’anamnesi familiare di
cancro della mammella e i carcinomi infi ammatori, ma sono neces-
sari ulteriori studi.
La comparsa di un’area di cute infi ammata in rapida espansione
si verifi ca generalmente nelle prime fasi della malattia e può pre-
cedere la scoperta di un tumore sottostante. La diffusione cutanea
è causata da un’estensione retrograda delle cellule tumorali at-
traverso le vie linfatiche della pelle. Nella maggioranza dei casi viene
riscontrata una forma primaria: la paziente ha notato un piccolo
nodulo nella mammella o nell’ascella solo alcune settimane prima
della comparsa dei segni infi ammatori. Un tumore in forma secon-
daria anticipa invece di mesi l’infi ammazione cutanea. Il tumore
potrebbe avere già raggiunto grandi dimensioni, oppure i cambia-
menti cutanei possono verifi carsi su una cicatrice di una precedente
mastectomia. I cambiamenti della pelle sono caratterizzati da una
colorazione purpurea o rossastra e da un edema che produce il
caratteristico effetto a buccia d’arancia. Possono inoltre essere
presenti piccoli noduli multipli. L’area dell’infiammazione può
estendersi fi no al collo e lungo il braccio, oppure alla mammella e
alla spalla opposte. L’invasione carcinomatosa della pelle è accom-
pagnata da un lieve rialzo termico, linfonodi ascellari ingrossati e
da un elevato numero di leucociti, che può raggiungere i 15.000.
L’adenopatia può estendersi all’inguine e la pelle sopra l’addome
può essere infi ammata, da cui il termine di carcinoma erisipeloide.
Generalmente i sintomi durano meno di 4 mesi. Il trattamento consi-
ste nella chemioterapia, la chirurgia mirata, la radioterapia e la te-
rapia ormonale, ma la sopravvivenza a 5 anni si colloca tra appena
il 25 e il 50% con frequenti recidive. Si tratta di percentuali più basse
rispetto ad altri tipi di carcinomi mammari. Il primo trattamento è in
genere la chemioterapia, seguita da un intervento chirurgico mirato.
Eventuali ulteriori trattamenti includono la chemioterapia aggiuntiva,
la terapia ormonale o la nuova modalità della terapia mirata (come
quella con trastuzumab) per le pazienti i cui tumori sono caratteriz-
zati da un’iperespressione dell’oncoproteina HER-2.
Le sezioni tissutali di una regione interessata da carcinoma
infi ammatorio mostrano un numero relativamente esiguo di segni
di infi ammazione acuta. La caratteristica predominante è il blocco
dei vasi linfatici e dei vasi sanguigni superfi ciali, con cellule tumorali
invasive. Questo stesso processo metastatico nella zona sottocuta-
nea è osservabile nei preparati ottenuti da carcinoma lenticolare, o
carcinoma a corazza, quando l’invasione procede più lentamente,
più diffusamente e senza edema.
Carcinoma infiammatorio
Carcinoma ricorrente
Invasione dei vasi linfatici dermici
Cuteinfiammata
Carcinoma in formazionelungo la ferita chirurgica
C0065.indd 302C0065.indd 302 2/9/12 6:19:58 PM2/9/12 6:19:58 PM
Tavola 13.20 Mammella
ATLANTE DI ANATOMIA, FISIOPATOLOGIA E CLINICA 303
PATOLOGIA MAMMARIA EREDITARIA
Circa il 5-10% dei carcinomi mammari ha una predisposizione
genetica o familiare. In queste famiglie, il cancro della mammella
tende a manifestarsi in giovane età e vi è un’elevata prevalenza di
malattia bilaterale. L’associazione tra carcinoma mammario eredi-
tario e carcinoma ovarico ereditario ha portato alla denominazione
sindrome del cancro ereditario della mammella e dell’ovaio
(HBOC).
La sindrome del cancro ereditario della mammella e dell’ovaio è
caratterizzata dalla comparsa del tumore mammario in giovane età
(spesso prima dei 50 anni). Nelle famiglie colpite da questo tumore
vi è un’anamnesi familiare positiva per carcinoma sia mammario
sia ovarico e una maggiore possibilità di carcinoma bilaterale con
un familiare affetto da carcinoma sia mammario sia ovarico. L’albero
genealogico mostra un modello di ereditarietà autosomico domi-
nante (trasmissione verticale da parte di madre o di padre). I membri
di queste famiglie presentano inoltre un aumento dell’incidenza di
tumori a carico di altri organi, come le tube di Falloppio o la prostata.
Le famiglie con casi di carcinoma mammario maschile e le famiglie
di origine ebraica-ashkenazita sono a maggior rischio di contrarre
questa sindrome (rischio 10 volte maggiore).
Sono stati individuati almeno due geni le cui mutazioni possono
causare questo modello di ereditarietà per il cancro della mammella
e/o dell’ovaio. Sembra che le mutazioni della germinale del gene
oncosoppressore BRCA1 sul cromosoma 17q siano responsabili,
per una buona parte, di questi carcinomi ereditari. Tuttavia, non in
tutte le famiglie in cui si sospetta un cancro ereditario della mam-
mella o dell’ovaio si sono riscontrate mutazioni di BRCA1 o di
BRCA2 . Una singola mutazione in uno di questi geni non sembra
essere suffi ciente per lo sviluppo del tumore. Si ritiene che per lo
sviluppo del tumore si debbano verifi care mutazioni di entrambi gli
alleli, dovute a esposizioni ambientali chimiche, fi siche o biologiche,
oppure errori casuali nella replicazione cellulare. A oggi, sono state
identifi cate centinaia di mutazioni peculiari nei geni BRCA1 e BRCA2 ,
dovute per lo più a mutazioni sporadiche proprie di un certo individuo
o di una certa famiglia. Specifi che mutazioni ricorrenti sono state
individuate nelle persone di origine ebraica-ashkenazita e in quelle
di origine olandese, islandese e svedese. Le mutazioni della famiglia
dei geni BRCA determinano un rischio di contrarre un cancro della
mammella nel corso della vita che si avvicina all’85%, anche se il
rischio di cancro dell’ovaio varia in base alla sede della mutazione.
Il rischio medio stimato di contrarre il cancro dell’ovaio nel corso
della vita è di circa il 40-50%.
Il gene BRCA2 risiede sul cromosoma 13 e la sequenza del suo
DNA è stata individuata nel 1995. Una donna con una mutazione
del gene BRCA2 presenta un rischio di contrarre un cancro della
mammella nel corso della vita pari all’85% e di contrarre un cancro
dell’ovaio pari al 15-20%. Questa mutazione è associata al carci-
noma mammario maschile, con un 5-10% di rischio per gli uomini
con questa mutazione. Il gene BRCA3 è stato di recente mappato
sul cromosoma 8, ma maggiori dettagli su eventuali sindromi clini-
che associate non sono ancora stati defi niti.
Attualmente, le raccomandazioni per la gestione clinica delle
donne con mutazioni dei geni BRCA variano tra test di screening
precoci e a intervalli aumentati e misure di profi lassi quali chemio-
prevenzione con tamoxifene, mastectomia e ooforectomia. Un
gruppo di esperti ha raccomandato l’autoesame del seno a partire
dai 20 anni, esami clinici una o due volte all’anno a partire dai 25-
35 anni e mammografi e annuali, sempre a partire dai 25-35 anni,
senza dare indicazioni a favore o contro la chirurgia preventiva in
queste pazienti. Nonostante l’esistenza di prove solide a favore di
una riduzione signifi cativa apportata dal tamoxifene del rischio di
contrarre il cancro della mammella nelle donne ad alto rischio, non
vi sono dati defi nitivi sull’impiego del tamoxifene in una popolazione
di pazienti con mutazione dei geni BRCA . Ad oggi, non esistono
tecniche di screening effi caci per l’individuazione precoce del cancro
dell’ovaio. Per questa ragione, alcune donne ad alto rischio scelgono
di sottoporsi a ooforectomia.
I quadrati rappresentano gli uomini e i cerchi le donne, le linee diagonaliindicano una riduzione degli individui affetti, la freccia indica il probando
GenerazioneI
II
III
IV
C0065.indd 303C0065.indd 303 2/9/12 6:20:00 PM2/9/12 6:20:00 PM
Tavola 13.21 Apparato genitale
304 ATLANTE DI ANATOMIA, FISIOPATOLOGIA E CLINICA
MALATTIA DI PAGET DEL CAPEZZOLO
La malattia di Paget della mammella è rara e rappresenta l’1-2%
dei tumori mammari. Si tratta di un processo maligno che interessa
il capezzolo e l’areola e raramente anche la cute della vulva. Le
lesioni hanno un aspetto simile all’eczema o alla dermatite del
capezzolo. Il quadro clinico è prodotto da un carcinoma duttale infi l-
trante che invade l’epidermide. La malattia di Paget ha una prognosi
eccellente.
Il carcinoma di Paget è caratterizzato da un’invasione del capez-
zolo o dell’areola mammaria e degli sbocchi dei condotti più grandi
da parte di grosse cellule maligne, che assomigliano a quelle os-
servabili nel carcinoma a cellule transizionali delle membrane
mucose in altre parti del corpo. Si ritiene che questo carcinoma
abbia origine a livello della giunzione dermo-epidermica grazie a
cellule multipotenti in grado di differenziarsi in cellule ghiandolari o
squamose. L’età media al momento della diagnosi è di 62 anni per
le donne e 69 per gli uomini. Le caratteristiche cliniche della malattia
sono la durata dei sintomi, che è di circa 3 anni, e i sintomi stessi,
riferibili al capezzolo. La malattia di Paget è quasi sempre associata
a un carcinoma infi ltrante o intraduttale nelle zone più profonde
della mammella (95% dei casi). Nella maggior parte dei casi, il
coinvolgimento del capezzolo precede la comparsa di un tumore
visibile della mammella, ma in alcuni casi può essere notato innan-
zitutto un rilievo nel seno. La malattia è bilaterale in meno del 5%
dei casi. La mammografi a è generalmente utilizzata per individuare
lesioni più profonde e lesioni nella mammella controlaterale. Inoltre,
uno striscio ottenuto ammorbidendo la crosta con una soluzione
salina e raschiando delicatamente la superfi cie mostra spesso le
tipiche cellule della malattia di Paget.
Il capezzolo interessato ha un aspetto arrossato e granulomatoso
oppure incrostato ed eczematoso. Dopo un intervallo di qualche
mese, in entrambi i casi nell’area interessata si verifi ca un’ulcera-
zione, con emissione di siero o sangue. Alla manipolazione si può
ottenere una piccola quantità di sangue. Negli stadi iniziali, la zona
immediatamente circostante il capezzolo è indurita, mentre negli
stadi più avanzati, sia la zona centrale sia quella periferica possono
essere caratterizzate dalla presenza di una massa dura.
Macroscopicamente, oltre ai cambiamenti del capezzolo, si ve-
rifi ca una dilatazione dei condotti più grandi, che sono inoltre colmi
di sangue o di una secrezione densa. Microscopicamente, nell’epi-
dermide del capezzolo si riscontrano grandi cellule con nuclei ve-
scicolari o molto colorabili e con citoplasma pallido. Le fi gure mito-
tiche sono frequenti. Gli infi ltrati dermici di grosse cellule neopla-
stiche (cellule di Paget) sono caratteristiche tipiche di questa con-
dizione. Queste cellule hanno un abbondante citoplasma chiaro con
nucleoli prominenti, irregolari e mucoidi. Più spesso, queste cellule
originano da un carcinoma duttale infi ltrante. Nei casi in cui si siano
infi ltrate oltre la membrana basale, le cellule nel capezzolo invadono
sia i condotti più grandi sia il tessuto mammario.
La terapia si focalizza sul trattamento del tumore maligno sotto-
stante e il più delle volte consiste in un intervento chirurgico. Quando
la lesione è circoscritta al capezzolo, è possibile preservare la
mammella. La terapia ormonale aggiuntiva o la chemioterapia è
spesso raccomandata sulla base del tipo cellulare e dello stadio. La
radioterapia è una terapia adiuvante comunemente utilizzata in
seguito alla chirurgia mammaria conservativa.
La diagnosi differenziale da lesioni benigne del capezzolo, come
cheratosi e ulcere, dipende nella maggior parte dei casi dalla sco-
perta, alla palpazione, di una massa nel tessuto sottostante. Sebbene
la biopsia del capezzolo dovrebbe essere evitata qualora sia possibi-
le, in alcuni casi lo studio dei tessuti diventa obbligatorio, per
esempio quando la lesione cutanea non guarisce entro alcuni giorni
con misure igieniche o con l’applicazione di vaselina. Anche se la
ghiandola non sembra essere coinvolta, è importante che i prelievi
bioptici ottenuti da queste pazienti contengano non solo pelle, ma
anche una porzione rappresentativa dei condotti mammari.
Malattia di Paget: manifestazione di tipo eczematoso
Malattia di Paget: manifestazionedi tipo ulcerante
Cellule di Paget nell’epidermide (frecce) Invasione duttale
C0065.indd 304C0065.indd 304 2/9/12 6:20:05 PM2/9/12 6:20:05 PM
Tavola 13.22 Mammella
ATLANTE DI ANATOMIA, FISIOPATOLOGIA E CLINICA 305
TUMORI MALIGNI DELLA MAMMELLA MASCHILE
Il carcinoma della mammella maschile è una malattia rara, in quanto
rappresenta solo lo 0,1% di tutti i tumori maligni, ed è all’incirca
100 volte meno comune del carcinoma mammario femminile, poi-
ché rappresenta circa l’1% di tutti i tumori della mammella. Negli
Stati Uniti, vi sono meno di 2.000 casi all’anno di carcinoma della
mammella maschile e questo tumore è responsabile di meno di
500 morti. L’età media per la diagnosi è tra i 60 e i 70 anni, anche
se questa patologia può colpire gli uomini di qualunque età. La
durata media dei sintomi prima della diagnosi è di circa 2 anni. Un
periodo così lungo è probabilmente conseguenza dello scarso inte-
resse riguardo a questo organo rudimentale da parte del maschio
adulto e da parte del medico esaminante. Si ritiene che tra i fattori
di rischio predisponenti vi sia un’esposizione alle radiazioni, la
somministrazione di estrogeni e la presenza di patologie associate
all’iperestrogenismo, come la cirrosi o la sindrome di Klinefelter.
È stato riscontrato un aumento del rischio di carcinoma mammario
in determinate famiglie, con un aumento dell’incidenza osservabile
negli uomini con un alto numero di consanguinei di sesso femminile
con cancro della mammella e in quelli in cui è presente una muta-
zione di BRCA2 sul cromosoma 13q. In presenza di una mutazione
di questo gene, il rischio di sviluppare un carcinoma della mammella
maschile nel corso della vita si colloca tra il 5 e il 10%.
A causa delle piccole quantità di stroma adiposo e di tessuto
ghiandolare presenti nelle mammelle maschili, i sintomi della
comparsa del tumore sono quasi sempre un’ulcerazione della pelle
o il coinvolgimento del capezzolo. Dolore e trauma sono spesso i
motivi che conducono all’esame medico. Il tumore è duro, irregolare
e saldamente attaccato alle strutture sovrastanti e sottostanti. È
frequente la presenza di ulcerazione e in genere i linfonodi ascellari
sono ingrossati.
Una diagnosi differenziale dalla ginecomastia può essere formu-
lata con discreta certezza sulla base dell’età del paziente. I tumori
nodulari negli uomini di mezza età devono essere escissi ed esa-
minati istologicamente. Anche se un fi broadenoma, un papilloma
intracistico, un lipoma o una cisti epidermoide benigna, al contrario
del carcinoma, in genere lasciano la pelle sopra il nodulo libera-
mente mobile e sebbene questi noduli siano anche più molli rispetto
al carcinoma, non è raccomandabile escludere una neoplasia mali-
gna esclusivamente sulla base di questi segni clinici.
In sezione trasversale, la neoplasia è dura, bianca e infi ltrante.
Una percentuale più alta di queste neoplasie è rappresentata da
adenocarcinomi di basso grado, che si manifestano probabilmente
per anomalie di sviluppo delle ghiandole sudoripare o delle strutture
epiteliali mammarie. Dal punto di vista patologico, molti carcinomi
della mammella maschile assomigliano alla forma infi ltrante riscon-
trabile nella mammella femminile, di cui il carcinoma duttale infi l-
trante è il tipo di tumore più comune. È stato descritto anche il
carcinoma lobulare. Il carcinoma infi ammatorio e la malattia di Paget
del capezzolo sono stati osservati anche nell’uomo, mentre non è
stato riscontrato il carcinoma lobulare in situ. Il coinvolgimento
linfonodale e il carattere ematogeno della diffusione sono simili a
quelli osservati nel carcinoma mammario femminile. Il sistema di
stadiazione TNM per il cancro della mammella maschile è identico
a quello per il cancro della mammella femminile.
La sopravvivenza complessiva è simile a quella delle donne con
carcinomi mammari di stadi simili. L’impressione che il carcinoma
della mammella maschile abbia una prognosi peggiore potrebbe
derivare dalla tendenza di questi tumori a essere diagnosticati a uno
stadio più avanzato. Fattori prognostici come le dimensioni della
lesione e la presenza o l’assenza di coinvolgimento linfonodale sono
fortemente correlati alla prognosi. La tesi secondo cui la ploidia e
una serie di cellule nella fase S abbiano un’infl uenza sulla soprav-
vivenza necessita di ulteriori indagini. Sono attualmente in corso di
esame anche lo stato dei recettori degli estrogeni e dei recettori del
progesterone, e l’amplifi cazione del gene HER2/neu.
Anche se rari, sono stati descritti vari tipi di sarcomi della mam-
mella maschile. Nella maggioranza dei casi si tratta di fi brosarcomi
a cellule fusate o linfosarcomi, tumori altamente maligni a rapida
crescita con attacco precoce alla cute sovrastante. Viene eseguita
una mastectomia semplice. Se l’esame istologico rivela un linfosar-
coma o un liposarcoma, deve essere eseguita una radioterapia
postoperatoria.
Sarcoma
Carcinoma scirroso ulcerante
C0065.indd 305C0065.indd 305 2/9/12 6:20:09 PM2/9/12 6:20:09 PM